Aceon 2mg, 4mg, 8mg Perindopril Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Aceon 4mg und wie wird es angewendet?
Aceon 8 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie) und stabiler koronarer Herzkrankheit (KHK). Aceon kann allein oder mit anderen Medikamenten verwendet werden.
Aceon gehört zu einer Klasse von Arzneimitteln, die als ACE-Hemmer bezeichnet werden.
Es ist nicht bekannt, ob Aceon bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Aceon 4mg haben?
Aceon kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Aceon 2mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Aceon. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
ACEON® (Perindopril Erbumin) Tabletten enthalten das tert-Butylaminsalz von Perindopril, dem Ethylester eines Nicht-Sulfhydrylangiotensin-Converting-Enzym (ACE)-Hemmers. Perindopril-Erbumin wird chemisch als (2S,3DS,7DS)-1-[(S)-N-[(S)-1-Carboxy-butyl]alanyl]hexahydro-2-indolincarbonsäure, 1-ethylester, Verbindung mit beschrieben tert-Butylamin (1:1). Seine Summenformel ist C19H32N2O5C4H11N. Seine Strukturformel lautet:
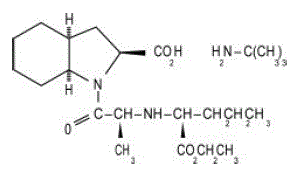
Perindopril Erbumin ist ein weißes, kristallines Pulver mit einem Molekulargewicht von 368,47 (freie Säure) oder 441,61 (Salzform). Es ist frei löslich in Wasser (60 % w/w), Alkohol und Chloroform.
Perindopril ist die freie Säureform von Perindopril-Erbumin, ist ein Prodrug und wird in vivo durch Hydrolyse der Estergruppe zu Perindoprilat, dem biologisch aktiven Metaboliten, metabolisiert.
ACEON ist in Stärken von 2 mg, 4 mg und 8 mg zur oralen Verabreichung erhältlich. Zusätzlich zu Perindopril-Erbumin enthält jede Tablette die folgenden Hilfsstoffe: kolloidales Siliciumdioxid (hydrophob), Lactose, Magnesiumstearat und mikrokristalline Cellulose. Die 4-mg- und 8-mg-Tabletten enthalten außerdem Eisenoxid.
INDIKATIONEN
Hypertonie
ACEON ist angezeigt zur Behandlung von Patienten mit essentieller Hypertonie. ACEON kann allein oder zusammen mit anderen Klassen von Antihypertonika, insbesondere Thiaziddiuretika, angewendet werden.
Stabile koronare Herzkrankheit
ACEON 8 mg ist zur Behandlung von Patienten mit stabiler koronarer Herzkrankheit indiziert, um das Risiko einer kardiovaskulären Mortalität oder eines nicht tödlichen Myokardinfarkts zu verringern. ACEON kann zusammen mit einer konventionellen Behandlung zur Behandlung der koronaren Herzkrankheit, wie z. B. einer gerinnungshemmenden, blutdrucksenkenden oder lipidsenkenden Therapie, angewendet werden.
DOSIERUNG UND ANWENDUNG
Hypertonie
Anwendung bei Patienten mit unkompliziertem Bluthochdruck
Bei Patienten mit essentieller Hypertonie beträgt die empfohlene Anfangsdosis 4 mg einmal täglich. Die Dosis kann nach Bedarf auf maximal 16 mg pro Tag titriert werden. Die übliche Erhaltungsdosis beträgt 4 mg bis 8 mg, verabreicht als einzelne Tagesdosis oder in zwei aufgeteilten Dosen.
Anwendung bei älteren Patienten
Die empfohlene Anfangsdosis von ACEON 4 mg für ältere Menschen beträgt 4 mg täglich, verteilt auf eine oder zwei Einzeldosen. Die Erfahrung mit ACEON bei älteren Patienten mit Dosen über 8 mg ist begrenzt. Dosierungen über 8 mg sollten unter sorgfältiger Überwachung des Blutdrucks und Dosistitration verabreicht werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Verwendung mit Diuretika
Bei Patienten, die derzeit mit einem Diuretikum behandelt werden, kann nach der Anfangsdosis von ACEON eine symptomatische Hypotonie auftreten. Erwägen Sie, die Dosis des Diuretikums zu reduzieren, bevor Sie mit ACEON beginnen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Stabile koronare Herzkrankheit
Bei Patienten mit stabiler koronarer Herzkrankheit sollte ACEON 4 mg in einer Anfangsdosis von 4 mg einmal täglich für 2 Wochen verabreicht und dann je nach Verträglichkeit auf eine Erhaltungsdosis von 8 mg einmal täglich erhöht werden. Bei älteren Patienten (über 70 Jahre) sollte ACEON in der ersten Woche einmal täglich als 2-mg-Dosis gegeben werden, gefolgt von 4 mg einmal täglich in der zweiten Woche und 8 mg einmal täglich als Erhaltungsdosis, sofern sie vertragen werden.
Dosisanpassung bei eingeschränkter Nierenfunktion und Dialyse
Die Elimination von Perindoprilat ist bei Patienten mit eingeschränkter Nierenfunktion verringert. ACEON wird bei Patienten mit einer Kreatinin-Clearance
WIE GELIEFERT
Darreichungsformen und Stärken
Die Tabletten sind länglich mit einer Bruchkerbe auf einer Seite.
Die 2-mg-Tablette ist weiß und auf der Seite ohne Bruchkerbe mit „ACN 2“ geprägt.
Die 4-mg-Tablette ist rosa und auf der Seite ohne Bruchkerbe ist „ACN 4“ eingeprägt.
Die 8-mg-Tablette ist lachsfarben und auf der Seite ohne Bruchkerbe mit „ACN 8“ geprägt.
Lagerung und Handhabung
Die Tabletten sind länglich mit einer Bruchkerbe auf einer Seite.
Von Kindern fern halten.
Bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern [siehe USP]. Vor Feuchtigkeit schützen.
Für weitere Informationen rufen Sie bitte unsere medizinische Kommunikationsabteilung gebührenfrei unter 888-985-7657 an.
Hergestellt von: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Überarbeitet: September 2017
NEBENWIRKUNGEN
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erfahrung mit klinischen Studien
Die folgenden Nebenwirkungen werden an anderer Stelle in der Kennzeichnung diskutiert:
Hypertonie
ACEON 4 mg wurde in klinischen Studien in den USA und im Ausland an ungefähr 3.400 Patienten mit Bluthochdruck auf Sicherheit untersucht. Die hier präsentierten Daten basieren auf den Ergebnissen der 1.417 mit ACEON behandelten Patienten, die an den klinischen Studien in den USA teilgenommen haben. Über 220 dieser Patienten wurden mindestens ein Jahr lang mit ACEON® (Perindopril Erbumin) behandelt.
In placebokontrollierten klinischen Studien in den USA betrug die Inzidenz eines vorzeitigen Therapieabbruchs aufgrund von Nebenwirkungen 6,5 % bei mit ACEON 2 mg behandelten Patienten und 6,7 % bei mit Placebo behandelten Patienten. Die häufigsten Ursachen waren Husten, Kopfschmerzen, Asthenie und Schwindel.
Unter 1.012 Patienten in placebokontrollierten Studien in den USA war die Gesamthäufigkeit der berichteten Nebenwirkungen bei mit ACEON behandelten Patienten und bei denen, die mit Placebo behandelt wurden, ähnlich (ungefähr 75 % in jeder Gruppe). Die einzigen Nebenwirkungen, deren Inzidenz unter ACEON 4 mg mindestens 2 % höher war als unter Placebo, waren Husten (12 % vs. 4,5 %) und Rückenschmerzen (5,8 % vs. 3,1 %).
Schwindel wurde in der Perindopril-Gruppe (8,2 %) nicht häufiger als in der Placebo-Gruppe (8,5 %) berichtet, aber seine Wahrscheinlichkeit stieg mit der Dosis, was auf einen kausalen Zusammenhang mit Perindopril hindeutet.
Stabile koronare Herzkrankheit
Perindopril wurde in EUROPA, einer doppelblinden, placebokontrollierten Studie mit 12.218 Patienten mit stabiler koronarer Herzkrankheit, auf Sicherheit untersucht. Die Gesamtabbruchrate betrug etwa 22 % unter Medikament und Placebo. Die häufigsten medizinischen Gründe für das Absetzen, die unter Perindopril häufiger auftraten als unter Placebo, waren Husten, Arzneimittelunverträglichkeit und Hypotonie.
Postmarketing-Erfahrung
Freiwillige Berichte über Nebenwirkungen bei Patienten, die ACEON eingenommen haben und die seit der Markteinführung aufgetreten sind und in einem unbekannten kausalen Zusammenhang mit ACEON 8 mg stehen, umfassen: Herzstillstand, eosinophile Pneumonitis, Neutropenie/Agranulozytose, Panzytopenie, Anämie (einschließlich hämolytischer und aplastischer), akute Thrombozytopenie Nierenversagen, Nephritis, Leberversagen, Gelbsucht (hepatozellulär oder cholestatisch), symptomatische Hyponatriämie, bullöses Pemphigoid, Pemphigus, akute Pankreatitis, Stürze, Psoriasis, exfoliative Dermatitis und ein Syndrom, das Folgendes umfassen kann: Arthralgie/Arthritis, Vaskulitis, Serositis, Myalgie, Fieber Hautausschlag oder andere dermatologische Manifestationen, ein positiver antinukleärer Antikörper (ANA), Leukozytose, Eosinophilie oder eine erhöhte Erythrozytensedimentationsrate (ESR).
Klinische Labortestergebnisse
Hämatologie
Leichte Abnahmen von Hämoglobin und Hämatokrit treten häufig bei hypertensiven Patienten auf, die mit ACEON 8 mg behandelt werden, sind aber selten von klinischer Bedeutung. In kontrollierten klinischen Studien wurde die Therapie bei keinem Patienten aufgrund der Entwicklung einer Anämie abgebrochen. Leukopenie (einschließlich Neutropenie) wurde in klinischen Studien in den USA bei 0,1 % der Patienten beobachtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Leberfunktionstest
Erhöhungen von ALT (1,6 % ACEON versus 0,9 % Placebo) und AST (0,5 % ACEON 2 mg versus 0,4 % Placebo) wurden in placebokontrollierten klinischen Studien beobachtet. Die Erhöhungen waren im Allgemeinen leicht und vorübergehend und verschwanden nach Absetzen der Therapie.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Diuretika
Bei Patienten, die mit Diuretika behandelt werden, und insbesondere bei Patienten, die kürzlich mit der Behandlung begonnen haben, kann es nach Beginn der Behandlung mit ACEON gelegentlich zu einer übermäßigen Blutdrucksenkung kommen. Die Möglichkeit blutdrucksenkender Wirkungen kann minimiert werden, indem vor Beginn der Behandlung mit Perindopril entweder die Dosis des Diuretikums verringert oder abgesetzt oder die Salzaufnahme erhöht wird. Wenn die diuretische Therapie nicht geändert werden kann, ist bei der ersten Dosis von ACEON eine engmaschige medizinische Überwachung für mindestens zwei Stunden und bis zur Stabilisierung des Blutdrucks für eine weitere Stunde erforderlich [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Geschwindigkeit und das Ausmaß der Resorption und Elimination von Perindopril werden durch die gleichzeitige Anwendung von Diuretika nicht beeinflusst. Die Bioverfügbarkeit von Perindoprilat wurde jedoch durch Diuretika verringert, was mit einer Abnahme der ACE-Hemmung im Plasma einherging.
Kaliumpräparate und kaliumsparende Diuretika
ACEON 8 mg kann das Serumkalium erhöhen, da es die Aldosteronproduktion verringern kann. Die Anwendung von kaliumsparenden Diuretika (Spironolacton, Amilorid, Triamteren und andere), Kaliumpräparaten oder anderen Arzneimitteln, die das Serumkalium erhöhen können (Indomethacin, Heparin, Cyclosporin und andere), kann das Risiko einer Hyperkaliämie erhöhen. Wenn die gleichzeitige Anwendung solcher Mittel indiziert ist, sollte daher das Serumkalium des Patienten häufig überwacht werden.
Lithium
Erhöhtes Serumlithium und Symptome einer Lithiumtoxizität wurden bei Patienten berichtet, die gleichzeitig mit Lithium und ACE-Hemmern behandelt wurden. Eine häufige Überwachung der Lithiumkonzentration im Serum wird empfohlen. Die Anwendung eines Diuretikums kann das Risiko einer Lithiumtoxizität weiter erhöhen.
Gold
Nitritoidreaktionen (Symptome umfassen Gesichtsrötung, Übelkeit, Erbrechen und Hypotonie) wurden selten bei Patienten unter Therapie mit injizierbarem Gold (Natriumaurothiomalat) und gleichzeitiger ACE-Hemmer-Therapie einschließlich ACEON berichtet.
Digoxin
Eine kontrollierte pharmakokinetische Studie hat bei gleichzeitiger Verabreichung mit ACEON keine Wirkung auf die Plasmakonzentration von Digoxin gezeigt, aber eine Wirkung von Digoxin auf die Plasmakonzentration von Perindopril/Perindoprilat wurde nicht ausgeschlossen.
Gentamicin
Tierexperimentelle Daten haben die Möglichkeit einer Wechselwirkung zwischen Perindopril und Gentamicin nahegelegt. Dies wurde jedoch nicht in Studien am Menschen untersucht.
Nicht-steroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretika-Therapie) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit ACE-Hemmern, einschließlich Perindopril, zu einer Verschlechterung der Nierenfunktion führen , einschließlich möglicher akuter Niereninsuffizienz. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Perindopril- und NSAID-Therapie erhalten.
Die blutdrucksenkende Wirkung von ACE-Hemmern, einschließlich Perindopril, kann durch NSAIDs, einschließlich selektiver COX-2-Hemmer, abgeschwächt werden.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden. Die meisten Patienten, die die Kombination von zwei RAS-Hemmern erhalten, erhalten keinen zusätzlichen Nutzen im Vergleich zur Monotherapie. Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Bei Patienten, die mit ACEON 2 mg und anderen Wirkstoffen, die das RAS beeinflussen, behandelt werden, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht gleichzeitig mit ACEON 8 mg bei Patienten mit Diabetes. Vermeiden Sie die Anwendung von Aliskiren zusammen mit ACEON 2 mg bei Patienten mit eingeschränkter Nierenfunktion (GFR
mTOR-Inhibitoren
Bei Patienten, die gleichzeitig mit mTOR (mammalian target of rapamycin)-Inhibitoren behandelt werden, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Neprilysin-Inhibitor
Bei Patienten, die gleichzeitig Neprilysin-Inhibitoren einnehmen, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Anaphylaktoide und möglicherweise verwandte Reaktionen
Vermutlich weil Angiotensin-Converting-Enzym-Hemmer den Metabolismus von Eicosanoiden und Polypeptiden, einschließlich endogenem Bradykinin, beeinflussen, können bei Patienten, die ACE-Hemmer (einschließlich ACEON) erhalten, verschiedene Nebenwirkungen auftreten, von denen einige schwerwiegend sind. Patienten mit schwarzer Hautfarbe, die ACE-Hemmer erhalten, haben im Vergleich zu nicht-schwarzen Patienten eine höhere Inzidenz von Angioödemen.
Kopf-Hals-Angioödem
Angioödeme des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze oder des Kehlkopfs wurden bei Patienten berichtet, die mit ACE-Hemmern, einschließlich ACEON, behandelt wurden (0,1 % der Patienten, die in klinischen Studien in den USA mit ACEON behandelt wurden). Angioödeme in Verbindung mit einer Beteiligung von Zunge, Stimmritze oder Kehlkopf können tödlich sein. Brechen Sie in solchen Fällen die Behandlung mit ACEON sofort ab und beobachten Sie, bis die Schwellung verschwunden ist. Wenn eine Beteiligung der Zunge, Glottis oder des Kehlkopfes wahrscheinlich zu einer Obstruktion der Atemwege führt, ist umgehend eine geeignete Therapie, wie subkutane Epinephrinlösung 1:1000 (0,3 bis 0,5 ml), zu verabreichen.
Patienten, die gleichzeitig eine Therapie mit einem mTOR-Inhibitor (z. B. Temsirolimus) oder einem Neprilysin-Inhibitor erhalten, haben möglicherweise ein erhöhtes Risiko für ein Angioödem [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Darm-Angioödem
Bei Patienten, die mit ACE-Hemmern behandelt wurden, wurde über intestinales Angioödem berichtet. Diese Patienten zeigten Bauchschmerzen (mit oder ohne Übelkeit oder Erbrechen); in manchen Fällen gab es in der Vorgeschichte kein faziales Angioödem und die C-1-Esterasespiegel waren normal. Das Angioödem wurde durch Verfahren wie Bauch-CT oder Ultraschall oder bei einer Operation diagnostiziert, und die Symptome verschwanden nach dem Absetzen des ACE-Hemmers. Intestinale Angioödeme sollten in die Differentialdiagnose von Patienten mit ACE-Hemmern einbezogen werden, die sich mit Bauchschmerzen vorstellen.
Hypotonie
ACEON 4 mg kann eine symptomatische Hypotonie verursachen. In placebokontrollierten Studien in den USA wurde ACEON bei 0,3 % der Patienten mit unkompliziertem Bluthochdruck mit Hypotonie in Verbindung gebracht. Symptome im Zusammenhang mit orthostatischer Hypotonie wurden bei weiteren 0,8 % der Patienten berichtet.
Eine symptomatische Hypotonie tritt am wahrscheinlichsten bei Patienten auf, die infolge einer verlängerten diuretischen Therapie, salzarmer Ernährung, Dialyse, Durchfall oder Erbrechen einen Volumen- oder Salzmangel erlitten haben [siehe DOSIERUNG UND ANWENDUNG ].
ACE-Hemmer können eine übermäßige Hypotonie verursachen und mit Oligurie oder Azotämie und selten mit akutem Nierenversagen und Tod einhergehen. Bei Patienten mit ischämischer Herzkrankheit oder zerebrovaskulärer Erkrankung könnte ein übermäßiger Blutdruckabfall zu einem Myokardinfarkt oder einem Schlaganfall führen.
Bei Patienten, bei denen das Risiko einer übermäßigen Hypotonie besteht, sollte die Behandlung mit ACEON unter sehr engmaschiger ärztlicher Überwachung begonnen werden. Die Patienten sollten während der ersten beiden Behandlungswochen und immer dann, wenn die Dosis von ACEON 2 mg und/oder Diuretikum erhöht wird, engmaschig überwacht werden.
Wenn eine übermäßige Hypotonie auftritt, sollte der Patient sofort in Rückenlage gebracht und, falls erforderlich, mit einer intravenösen Infusion physiologischer Kochsalzlösung behandelt werden. Die Behandlung mit ACEON 4 mg kann in der Regel nach Wiederherstellung des Volumens und des Blutdrucks fortgesetzt werden.

Neutropenie/Agranulozytose
ACE-Hemmer wurden mit Agranulozytose und Knochenmarkdepression in Verbindung gebracht, am häufigsten bei Patienten mit eingeschränkter Nierenfunktion, insbesondere bei Patienten mit einer Kollagenose wie systemischem Lupus erythematodes oder Sklerodermie.
Fötale Toxizität
Schwangerschaftskategorie D
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie ACEON 4 mg so bald wie möglich ab [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Beeinträchtigte Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Aldosteron-Systems sind bei empfindlichen Personen Veränderungen der Nierenfunktion zu erwarten. Die Nierenfunktion sollte bei Patienten, die ACEON erhalten, regelmäßig überwacht werden [siehe DOSIERUNG UND ANWENDUNG ], [sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Bei Patienten mit schwerer dekompensierter Herzinsuffizienz, bei denen die Nierenfunktion von der Aktivität des Renin-Angiotensinaldosteron-Systems abhängen kann, kann die Behandlung mit ACE-Hemmern, einschließlich ACEON, mit Oligurie, fortschreitender Azotämie und selten mit akutem Nierenversagen und Tod einhergehen.
Bei Bluthochdruckpatienten mit einseitiger oder beidseitiger Nierenarterienstenose können Anstiege des Harnstoffstickstoffs im Blut und des Serumkreatinins auftreten; normalerweise reversibel nach Absetzen des ACE-Hemmers. Bei solchen Patienten sollte die Nierenfunktion während der ersten Behandlungswochen überwacht werden.
Bei einigen mit ACEON behandelten Patienten kam es zu geringfügigen und vorübergehenden Anstiegen des Harnstoffstickstoffs im Blut und des Serumkreatinins, insbesondere bei Patienten, die gleichzeitig mit einem Diuretikum behandelt wurden.
Hyperkaliämie
Bei einigen Patienten, die mit ACE-Hemmern, einschließlich ACEON, behandelt wurden, wurden Erhöhungen des Serumkaliumspiegels beobachtet. In den meisten Fällen handelte es sich um isolierte Einzelwerte, die klinisch nicht relevant erschienen und selten Anlass zum Absetzen waren. Risikofaktoren für die Entstehung einer Hyperkaliämie sind Niereninsuffizienz, Diabetes mellitus und die gleichzeitige Anwendung von Mitteln wie kaliumsparenden Diuretika, Kaliumpräparaten und/oder kaliumhaltigen Salzersatzmitteln [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Serumkalium sollte bei Patienten, die ACEON erhalten, regelmäßig überwacht werden.
Husten
Vermutlich aufgrund der Hemmung des Abbaus von endogenem Bradykinin wurde bei allen ACE-Hemmern über anhaltenden unproduktiven Husten berichtet, der im Allgemeinen nach Absetzen der Therapie abklang. Berücksichtigen Sie ACE-Hemmer-induzierten Husten in der Differentialdiagnose von Husten.
Leberversagen
Selten wurden ACE-Hemmer mit einem Syndrom in Verbindung gebracht, das mit cholestatischem Ikterus beginnt und zu einer fulminanten hepatischen Nekrose und manchmal zum Tod fortschreitet. Der Mechanismus dieses Syndroms ist nicht verstanden. Patienten, die ACE-Hemmer erhalten und eine Gelbsucht oder deutliche Erhöhungen der Leberenzymwerte entwickeln, sollten den ACE-Hemmer absetzen und eine angemessene medizinische Nachsorge erhalten.
Chirurgie/Anästhesie
Bei Patienten, die sich einem chirurgischen Eingriff unterziehen oder während einer Anästhesie mit Mitteln, die Hypotonie hervorrufen, kann ACEON die Angiotensin-II-Bildung blockieren, die andernfalls sekundär zur kompensatorischen Reninfreisetzung erfolgen würde. Eine auf diesen Mechanismus zurückzuführende Hypotonie kann durch Volumenexpansion korrigiert werden.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenität
In Studien an Ratten und Mäusen wurden keine Hinweise auf eine karzinogene Wirkung beobachtet, wenn Perindopril in Dosierungen bis zum 20-Fachen (mg/kg) oder 2- bis 4-Fachen (mg/m2) der vorgeschlagenen maximalen klinischen Dosis (16 mg/Tag) verabreicht wurde 104 Wochen.
Mutagenese
Für ACEON, Perindoprilat und andere Metaboliten wurde in verschiedenen In-vitro- und In-vivo-Untersuchungen, einschließlich des Ames-Tests, des Saccharomyces-cerevisiae-D4-Tests, kultivierter menschlicher Lymphozyten, des TK-Maus-Lymphom-Assays, des Maus- und Ratten-Mikrokerntests und des chinesischen Hamsters, kein genotoxisches Potenzial festgestellt Knochenmarkprobe.
Beeinträchtigung der Fruchtbarkeit
Bei Ratten, die bis zum 30-fachen (mg/kg) oder 6-fachen (mg/m2) der vorgeschlagenen maximalen klinischen Dosis von ACEON 2 mg während der Spermatogenese bei männlichen Tieren oder der Oogenese und Trächtigkeit verabreicht wurden, gab es keine nennenswerte Wirkung auf die Reproduktionsleistung oder Fertilität bei Weibchen.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie D [vgl KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie ACEON so schnell wie möglich ab. Diese unerwünschten Wirkungen sind normalerweise mit der Anwendung dieser Arzneimittel im zweiten und dritten Trimenon der Schwangerschaft verbunden. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden.
Eine angemessene Behandlung der mütterlichen Hypertonie während der Schwangerschaft ist wichtig, um die Ergebnisse für Mutter und Fötus zu optimieren.
In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus. Führen Sie serielle Ultraschalluntersuchungen durch, um die intraamniotische Umgebung zu beurteilen. Wenn Oligohydramnion beobachtet wird, ACEON 2 mg absetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat. Beobachten Sie Säuglinge, die in der Vergangenheit ACEON in der Gebärmutter ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie [siehe Pädiatrische Verwendung ].
Nach Verabreichung von 14C-Perindopril an trächtige Ratten war bei Föten Radioaktivität nachweisbar.
Stillende Mutter
Milch säugender Ratten enthielt nach Verabreichung von 14C-Perindopril Radioaktivität. Es ist nicht bekannt, ob Perindopril in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen, ist bei der Verabreichung von ACEON an stillende Mütter Vorsicht geboten.
Pädiatrische Verwendung
Neugeborene mit einer Vorgeschichte von In-utero-Exposition gegenüber ACEON
Wenn Oligurie oder Hypotonie auftritt, lenken Sie die Aufmerksamkeit auf die Unterstützung des Blutdrucks und der Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen. Perindopril, das die Plazenta passiert, kann theoretisch auf diese Weise aus dem neonatalen Kreislauf entfernt werden, begrenzte Erfahrungen haben jedoch nicht gezeigt, dass eine solche Entfernung für die Behandlung dieser Säuglinge von zentraler Bedeutung ist.
Sicherheit und Wirksamkeit von ACEON 8 mg bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Die mittlere Blutdruckwirkung von Perindopril war bei Patienten über 60 etwas geringer als bei jüngeren Patienten, obwohl der Unterschied nicht signifikant war. Die Plasmakonzentrationen von Perindopril und Perindoprilat waren bei älteren Patienten im Vergleich zu den Konzentrationen bei jüngeren Patienten erhöht. Bei älteren Patienten waren mit Ausnahme von Schwindel und möglicherweise Hautausschlag keine Nebenwirkungen deutlich erhöht.
Beginnen Sie mit einer niedrigen Dosis und titrieren Sie langsam nach Bedarf. Wegen möglicher Stürze auf Schwindel achten.
Die Erfahrungen mit ACEON 8 mg bei älteren Patienten in Tagesdosen von mehr als 8 mg sind begrenzt.
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion kann eine Dosisanpassung erforderlich sein [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Die Bioverfügbarkeit von Perindoprilat ist bei Patienten mit eingeschränkter Leberfunktion erhöht [vgl KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Bei Tieren waren Perindopril-Dosen von bis zu 2.500 mg/kg bei Mäusen, 3.000 mg/kg bei Ratten und 1.600 mg/kg bei Hunden nicht tödlich. Frühere Erfahrungen waren spärlich, deuteten jedoch darauf hin, dass eine Überdosierung mit anderen ACE-Hemmern auch von Menschen ziemlich gut vertragen wurde. Die wahrscheinlichste Manifestation ist Hypotonie, und die Behandlung sollte symptomatisch und unterstützend sein. Die Therapie mit dem ACE-Hemmer sollte abgebrochen und der Patient überwacht werden. Dehydration, Elektrolytstörungen und Hypotonie sollten mit etablierten Verfahren behandelt werden.
Unter den gemeldeten Fällen einer Perindopril-Überdosierung benötigten Patienten, von denen bekannt war, dass sie eine Dosis von 80 mg bis 120 mg eingenommen hatten, eine assistierte Beatmung und Kreislaufunterstützung. Ein weiterer Patient entwickelte Hypothermie, Kreislaufstillstand und starb nach Einnahme von bis zu 180 mg Perindopril. Die Intervention bei einer Perindopril-Überdosierung kann eine energische Unterstützung erfordern.
Laborbestimmungen der Serumspiegel von Perindopril und seinen Metaboliten sind nicht allgemein verfügbar, und solche Bestimmungen spielen jedenfalls keine etablierte Rolle bei der Behandlung einer Perindopril-Überdosierung.
Es liegen keine Daten vor, die auf physiologische Manöver hinweisen (z. B. Manöver zur Veränderung des pH-Werts des Urins), die die Elimination von Perindopril und seinen Metaboliten beschleunigen könnten. Perindopril kann durch Hämodialyse entfernt werden, mit einer Clearance von 52 ml/min für Perindopril und 67 ml/min für Perindoprilat.
Angiotensin II könnte vermutlich als spezifisches Antagonist-Antidot bei der Behandlung einer Perindopril-Überdosierung dienen, aber Angiotensin II ist außerhalb verstreuter Forschungseinrichtungen praktisch nicht verfügbar. Da die blutdrucksenkende Wirkung von Perindopril durch Vasodilatation und effektive Hypovolämie erreicht wird, ist es sinnvoll, eine Überdosierung von Perindopril durch Infusion von normaler Kochsalzlösung zu behandeln.
KONTRAINDIKATIONEN
ACEON® (Perindopril-Erbumin) ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit (einschließlich Angioödem) gegenüber diesem Produkt oder einem anderen ACE-Hemmer. ACEON 4 mg ist auch bei Patienten mit hereditärem oder idiopathischem Angioödem kontraindiziert.
Verabreichen Sie Aliskiren nicht gleichzeitig mit ACEON bei Patienten mit Diabetes. [sehen WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
ACEON ist in Kombination mit Neprilysin-Inhibitoren (z. B. Sacubitril) kontraindiziert. Verabreichen Sie ACEON 8 mg nicht innerhalb von 36 Stunden nach der Umstellung auf oder von Sacubitril/Valsartan, einem Neprilysin-Hemmer [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
ACEON® (Perindopril Erbumin) ist ein Prodrug für Perindoprilat, das ACE bei Menschen und Tieren hemmt. Es wird angenommen, dass der Mechanismus, durch den Perindoprilat den Blutdruck senkt, hauptsächlich die Hemmung der ACE-Aktivität ist. ACE ist eine Peptidyldipeptidase, die die Umwandlung des inaktiven Decapeptids Angiotensin I in den Vasokonstriktor Angiotensin II katalysiert. Angiotensin II ist ein starker peripherer Vasokonstriktor, der die Aldosteronsekretion durch die Nebennierenrinde stimuliert und eine negative Rückkopplung auf die Reninsekretion liefert. Die Hemmung von ACE führt zu einem verringerten Plasma-Angiotensin II, was zu einer verringerten Vasokonstriktion, einer erhöhten Plasma-Renin-Aktivität und einer verringerten Aldosteronsekretion führt. Letzteres führt zu Diurese und Natriurese und kann mit einem geringen Anstieg des Serumkaliums einhergehen.
ACE ist identisch mit Kininase II, einem Enzym, das Bradykinin abbaut. Ob erhöhte Spiegel von Bradykinin, einem potenten Vasodepressor-Peptid, eine Rolle bei der therapeutischen Wirkung von ACEON 4 mg spielen, muss noch geklärt werden.
Während angenommen wird, dass der Hauptmechanismus von Perindopril bei der Blutdrucksenkung über das Renin-Angiotensinaldosteron-System erfolgt, haben ACE-Hemmer selbst bei scheinbar niedriger Renin-Hypertonie eine gewisse Wirkung. Perindopril wurde bei relativ wenigen Patienten mit schwarzer Hautfarbe untersucht, normalerweise einer Population mit niedrigem Reninspiegel, und die durchschnittliche Reaktion des diastolischen Blutdrucks auf Perindopril war etwa halb so hoch wie die Reaktion, die bei Patienten mit nicht schwarzer Hautfarbe beobachtet wurde, ein Ergebnis, das mit früheren Erfahrungen mit anderen ACE-Hemmern übereinstimmt.
Pharmakodynamik
Nach Gabe von Perindopril wird ACE dosis- und blutkonzentrationsabhängig gehemmt, wobei die maximale Hemmung von 80 bis 90 % bei 8 mg über 10 bis 12 Stunden anhält. Nach diesen Dosen beträgt die 24-stündige ACE-Hemmung etwa 60 %. Der durch eine gegebene Dosis erreichte Grad der ACE-Hemmung scheint mit der Zeit abzunehmen (der ID50 steigt). Die pressorische Reaktion auf eine Angiotensin-I-Infusion wird durch Perindopril reduziert, aber diese Wirkung ist nicht so anhaltend wie die Wirkung auf ACE; 24 Stunden nach einer 12-mg-Dosis besteht eine Hemmung von etwa 35 %.
Pharmakokinetik
Absorption
Die orale Verabreichung von ACEON führt zu maximalen Plasmakonzentrationen, die nach etwa 1 Stunde auftreten. Die absolute orale Bioverfügbarkeit von Perindopril beträgt etwa 75 %. Nach der Resorption werden etwa 30 bis 50 % des systemisch verfügbaren Perindoprils zu seinem aktiven Metaboliten Perindoprilat hydrolysiert, der eine mittlere Bioverfügbarkeit von etwa 25 % hat. Maximale Plasmakonzentrationen von Perindoprilat werden 3 bis 7 Stunden nach der Verabreichung von Perindopril erreicht. Die orale Verabreichung von ACEON 8 mg mit Nahrung verringert die Geschwindigkeit oder das Ausmaß der Resorption von Perindopril im Vergleich zum nüchternen Zustand nicht signifikant. Das Ausmaß der Biotransformation von Perindopril zum aktiven Metaboliten Perindoprilat ist jedoch um etwa 43 % verringert, was zu einer Verringerung der ACE-Hemmungskurve im Plasma um etwa 20 % führt, was wahrscheinlich klinisch unbedeutend ist. In klinischen Studien wurde Perindopril im Allgemeinen nicht nüchtern verabreicht.
Bei Dosierungen von 4 mg, 8 mg und 16 mg ACEON steigen Cmax und AUC von Perindopril und Perindoprilat dosisproportional sowohl nach oraler Einzeldosis als auch im Steady-State während einer einmal täglichen Mehrfachgabe.
Verteilung
Ungefähr 60 % des zirkulierenden Perindoprils werden an Plasmaproteine gebunden und nur 10 bis 20 % von Perindoprilat werden gebunden. Daher sind Arzneimittelwechselwirkungen, die durch Effekte auf die Proteinbindung vermittelt werden, nicht zu erwarten.
Stoffwechsel und Ausscheidung
Nach oraler Verabreichung zeigt Perindopril eine Multikompartiment-Pharmakokinetik, einschließlich eines tiefen Gewebekompartiments (ACE-Bindungsstellen). Die mittlere Halbwertszeit von Perindopril, die mit dem größten Teil seiner Elimination verbunden ist, beträgt ungefähr 0,8 bis 1 Stunde.
Perindopril wird nach oraler Verabreichung weitgehend metabolisiert, wobei nur 4 bis 12 % der Dosis unverändert im Urin wiedergefunden werden. Es wurden sechs Metaboliten identifiziert, die aus Hydrolyse, Glucuronidierung und Cyclisierung durch Dehydratisierung resultieren. Dazu gehören der aktive ACE-Hemmer Perindoprilat (hydrolysiertes Perindopril), Perindopril und Perindoprilat-Glukuronide, dehydriertes Perindopril und die Diastereoisomere von dehydriertem Perindoprilat. Beim Menschen scheint die hepatische Esterase für die Hydrolyse von Perindopril verantwortlich zu sein.
Der aktive Metabolit Perindoprilat zeigt nach oraler Gabe von ACEON ebenfalls eine Multikompartiment-Pharmakokinetik. Die Bildung von Perindoprilat erfolgt allmählich, wobei maximale Plasmakonzentrationen zwischen 3 und 7 Stunden auftreten. Der anschließende Rückgang der Plasmakonzentration zeigt eine offensichtliche mittlere Halbwertszeit von 3 bis 10 Stunden für den Großteil der Elimination, mit einer verlängerten terminalen Eliminationshalbwertszeit von 30 bis 120 Stunden, die aus der langsamen Dissoziation von Perindoprilat von der Plasma-/Gewebe-ACE-Bindung resultiert Websites. Bei wiederholter oraler einmal täglicher Gabe von Perindopril akkumuliert Perindoprilat etwa das 1,5- bis 2-fache und erreicht innerhalb von 3 bis 6 Tagen Steady-State-Plasmaspiegel. Die Clearance von Perindoprilat und seinen Metaboliten erfolgt fast ausschließlich renal.
Alten
Die Plasmakonzentrationen sowohl von Perindopril als auch von Perindoprilat sind bei älteren Patienten (über 70 Jahre) etwa doppelt so hoch wie bei jüngeren Patienten, was sowohl eine erhöhte Umwandlung von Perindopril in Perindoprilat als auch eine verringerte renale Ausscheidung von Perindoprilat widerspiegelt [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Herzfehler
Die Clearance von Perindoprilat ist bei Patienten mit dekompensierter Herzinsuffizienz verringert, was zu einer um 40 % höheren Dosisintervall-AUC führt.
Nierenfunktionsstörung
Bei Perindopril-Dosen von 2 mg bis 4 mg steigt die AUC von Perindoprilat mit abnehmender Nierenfunktion an. Bei einer Kreatinin-Clearance von 30 bis 80 ml/min ist die AUC etwa doppelt so hoch wie bei 100 ml/min. Wenn die Kreatinin-Clearance unter 30 ml/min fällt, steigt die AUC deutlicher an.
Bei einer begrenzten Anzahl von untersuchten Patienten lag die Clearance von Perindopril durch Dialyse im Bereich von etwa 40 bis 80 ml/min. Die Clearance von Perindoprilat durch Dialyse lag im Bereich von etwa 40 bis 90 ml/min [vgl DOSIERUNG UND ANWENDUNG ].
Leberfunktionsstörung
Die Bioverfügbarkeit von Perindoprilat ist bei Patienten mit eingeschränkter Leberfunktion erhöht. Die Plasmakonzentrationen von Perindoprilat waren bei Patienten mit eingeschränkter Leberfunktion etwa 50 % höher als bei gesunden Probanden oder hypertensiven Patienten mit normaler Leberfunktion.
Klinische Studien
Hypertonie
In placebokontrollierten Studien zur Perindopril-Monotherapie (2 mg bis 16 mg einmal täglich) bei Patienten mit einem mittleren Blutdruck von etwa 150/100 mmHg hatten 2 mg nur geringe Wirkung, aber Dosen von 4 mg bis 16 mg senkten den Blutdruck. Die 8-mg- und 16-mg-Dosen waren nicht zu unterscheiden, und beide hatten eine größere Wirkung als die 4-mg-Dosis. In diesen Studien führten Dosen von 8 mg und 16 mg pro Tag in Rückenlage zu einer Taldrucksenkung von 9 bis 15/5 bis 6 mmHg. Beim Vergleich von einmal täglicher und zweimal täglicher Dosierung war das zweimal tägliche Dosierungsschema im Allgemeinen geringfügig überlegen, jedoch um nicht mehr als etwa 0,5 mm Hg bis 1 mm Hg. Nach Dosen von 2 mg bis 16 mg Perindopril betrugen die mittleren systolischen und diastolischen Blutdruckeffekte etwa 75 bis 100 % der Spitzeneffekte.
Die Wirkungen von Perindopril auf den Blutdruck waren ähnlich, wenn es allein oder vor einer Hintergrundtherapie mit 25 mg Hydrochlorothiazid gegeben wurde. Im Allgemeinen trat die Wirkung von Perindopril sofort ein, wobei die Wirkung über mehrere Wochen leicht zunahm.
Formale Interaktionsstudien von ACEON® (Perindopril-Erbumin) wurden nicht mit anderen Antihypertonika als Thiaziden durchgeführt. Begrenzte Erfahrungen aus kontrollierten und unkontrollierten Studien zur gleichzeitigen Anwendung von ACEON 2 mg mit einem Kalziumkanalblocker, einem Schleifendiuretikum oder einer Dreifachtherapie (Betablocker, Vasodilatator und ein Diuretikum) deuten nicht auf unerwartete Wechselwirkungen hin. Im Allgemeinen haben ACE-Hemmer weniger als additive Wirkungen, wenn sie zusammen mit beta-adrenergen Blockern verabreicht werden, vermutlich weil beide teilweise über das Renin-Angiotensin-System wirken.
In unkontrollierten Studien an Patienten mit insulinabhängigem Diabetes schien Perindopril die glykämische Kontrolle nicht zu beeinflussen. Bei Langzeitanwendung wurde bei diesen Patienten keine Auswirkung auf die Proteinausscheidung im Urin beobachtet.
Die Wirksamkeit von ACEON 4 mg wurde nicht durch das Geschlecht beeinflusst und war bei Patienten mit schwarzer Hautfarbe weniger wirksam als bei Patienten mit nicht schwarzer Hautfarbe. Bei älteren Patienten (über oder gleich 60 Jahre) war der mittlere Blutdruckeffekt etwas geringer als bei jüngeren Patienten, obwohl der Unterschied nicht signifikant war.
Stabile koronare Herzkrankheit
Die EURopean-Studie zur Reduktion kardialer Ereignisse mit Perindopril bei stabiler koronarer Herzkrankheit (EUROPA) war eine multizentrische, randomisierte, doppelblinde und placebokontrollierte Studie, die an 12.218 Patienten durchgeführt wurde, die Anzeichen einer stabilen koronaren Herzkrankheit ohne klinische Herzinsuffizienz aufwiesen. Die Patienten hatten Hinweise auf eine koronare Herzkrankheit, dokumentiert durch einen früheren Myokardinfarkt mehr als 3 Monate vor dem Screening, eine koronare Revaskularisation mehr als 6 Monate vor dem Screening, angiographische Anzeichen einer Stenose (mindestens 70 %ige Verengung einer oder mehrerer großer Koronararterien) oder positiven Stress Test bei Männern mit Brustschmerzen in der Vorgeschichte. Nach einer Anlaufphase von 4 Wochen, in der alle Patienten 2 mg bis 8 mg Perindopril erhielten, wurden die Patienten randomisiert 8 mg Perindopril einmal täglich (n = 6.110) oder entsprechendem Placebo (n = 6.108) zugeteilt. Die mittlere Nachbeobachtungszeit betrug 4,2 Jahre. Die Studie untersuchte die Langzeitwirkung von Perindopril auf die Zeit bis zum ersten Ereignis von kardiovaskulärer Mortalität, nicht tödlichem Myokardinfarkt oder Herzstillstand bei Patienten mit stabiler koronarer Herzkrankheit.
Das Durchschnittsalter der Patienten betrug 60 Jahre; 85 % waren männlich, 92 % nahmen Thrombozytenhemmer ein, 63 % nahmen β-Blocker ein und 56 % nahmen eine lipidsenkende Therapie ein. Die EUROPA-Studie zeigte, dass Perindopril das relative Risiko für die primären Endpunktereignisse signifikant senkte (Tabelle 1). Diese vorteilhafte Wirkung ist größtenteils auf eine Verringerung des Risikos eines nicht tödlichen Myokardinfarkts zurückzuführen. Diese vorteilhafte Wirkung von Perindopril auf das primäre Ergebnis war nach etwa einem Behandlungsjahr offensichtlich (Abbildung 1). Das Ergebnis war in allen vordefinierten Untergruppen nach Alter, Grunderkrankung oder Begleitmedikation ähnlich (Abbildung 2).
Abbildung 1. Zeit bis zum ersten Auftreten des primären Endpunkts 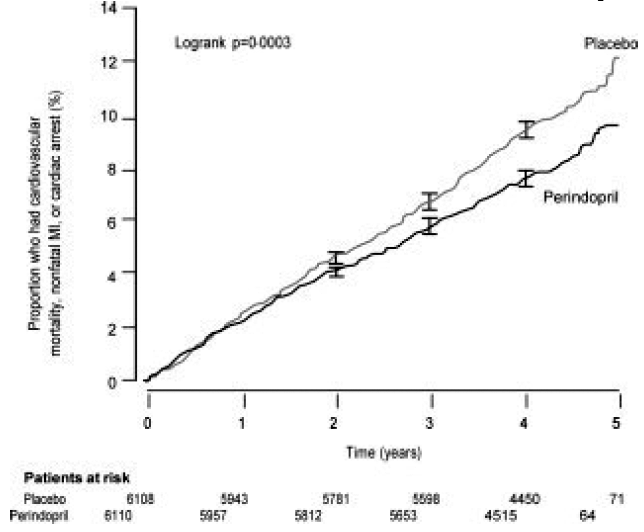
Abbildung 2. Vorteilhafte Wirkung der Behandlung mit Perindopril auf den primären Endpunkt in vordefinierten Untergruppen 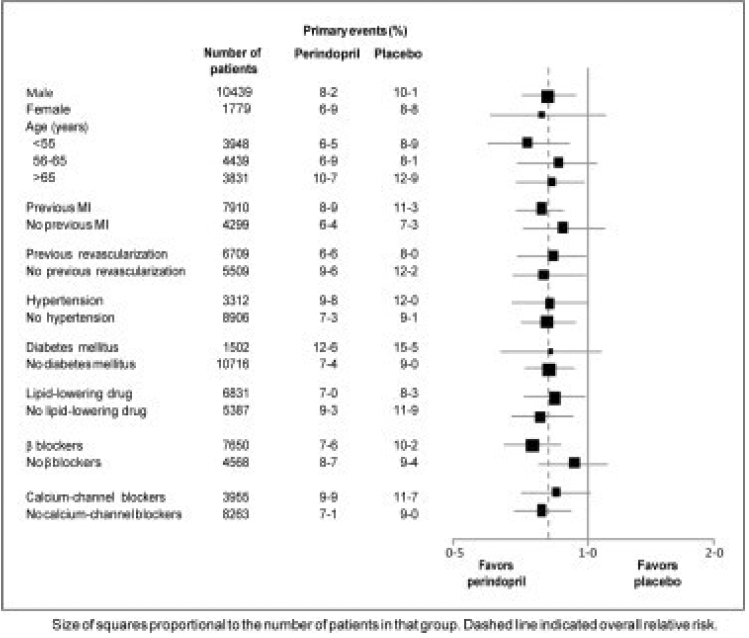
INFORMATIONEN ZUM PATIENTEN
Patientinnen im gebärfähigen Alter sollten über die Folgen einer Exposition gegenüber ACEON 2 mg während der Schwangerschaft aufgeklärt werden. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Patientinnen sollten aufgefordert werden, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden.
Weisen Sie die Patienten an, unverzüglich alle Anzeichen einer Infektion (z. B. Halsschmerzen, Fieber) zu melden, die ein Anzeichen für eine Neutropenie sein könnten.