Haarbehandlung: Avodart 0.5mg Dutasteride Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Avodart 0,5 mg und wie wird es angewendet?
Avodart 0,5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome einer vergrößerten Prostata (benigne Prostatahyperplasie). Avodart kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Avodart 0,5 mg gehört zu einer Klasse von Arzneimitteln, die als 5-Alpha-Reduktase-Hemmer bezeichnet werden.
Es ist nicht bekannt, ob Avodart 0,5 mg bei Kindern sicher und wirksam ist.
Was sind Nebenwirkungen von Avodart?
Zu den Nebenwirkungen von Avodart 0,5 mg gehören:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Avodart 0,5 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Avodart. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
AVODART 0,5 mg ist eine synthetische 4-Azasteroid-Verbindung, die ein selektiver Inhibitor sowohl der Typ-1- als auch der Typ-2-Isoformen der Steroid-5-Alpha-Reduktase ist, einem intrazellulären Enzym, das Testosteron in DHT umwandelt.
Dutasterid wird chemisch als (5α,17β)-N-{2,5-bis(trifluormethyl)phenyl}-3-oxo-4-azaandrost-1-en-17-carboxamid bezeichnet. Die empirische Formel von Dutasterid ist C27H30F6N2O2, was ein Molekulargewicht von 528,5 mit der folgenden Strukturformel darstellt:
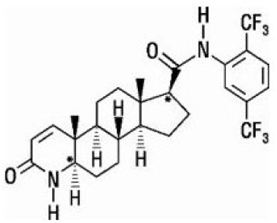
Dutasterid ist ein weißes bis blassgelbes Pulver mit einem Schmelzpunkt von 242 °C bis 250 °C. Es ist löslich in Ethanol (44 mg/ml), Methanol (64 mg/ml) und Polyethylenglycol 400 (3 mg/ml), aber es ist unlöslich in Wasser.
Jede oral verabreichte AVODART 0,5 mg Weichgelatinekapsel enthält 0,5 mg Dutasterid, gelöst in einer Mischung aus Mono-Diglyceriden von Capryl-/Caprinsäure und butyliertem Hydroxytoluol. Die inaktiven Hilfsstoffe in der Kapselhülle sind Eisenoxid (gelb), Gelatine (aus zertifiziert BSE-freien Rinderquellen), Glycerin und Titandioxid. Die Weichgelatinekapseln sind mit essbarer roter Tinte bedruckt.
INDIKATIONEN
Monotherapie
AVODART (Dutasterid) Weichgelatinekapseln sind indiziert zur Behandlung der symptomatischen gutartigen Prostatahyperplasie (BPH) bei Männern mit vergrößerter Prostata bei:
Kombination mit alpha-adrenergen Antagonisten
AVODART in Kombination mit dem alpha-adrenergen Antagonisten Tamsulosin ist angezeigt zur Behandlung der symptomatischen BPH bei Männern mit vergrößerter Prostata.
Nutzungsbeschränkungen
AVODART 0,5 mg ist nicht zur Vorbeugung von Prostatakrebs zugelassen.
DOSIERUNG UND ANWENDUNG
Die Kapseln sollten im Ganzen geschluckt und nicht gekaut oder geöffnet werden, da der Kontakt mit dem Kapselinhalt zu Reizungen der Mund-Rachen-Schleimhaut führen kann. AVODART kann mit oder ohne Nahrung verabreicht werden.
Monotherapie
Die empfohlene Dosis von AVODART beträgt 1 Kapsel (0,5 mg) einmal täglich.
Kombination mit alpha-adrenergen Antagonisten
Die empfohlene Dosis von AVODART 0,5 mg beträgt 1 Kapsel (0,5 mg) einmal täglich und Tamsulosin 0,4 mg einmal täglich.
WIE GELIEFERT
Darreichungsformen und Stärken
0,5 mg, undurchsichtige, mattgelbe Gelatinekapseln mit dem Aufdruck „GX CE2“ in roter Tinte auf einer Seite.
Lagerung und Handhabung
AVODART Weichgelatinekapseln 0,5 mg sind längliche, undurchsichtige, mattgelbe Gelatinekapseln mit dem Aufdruck „GX CE2“ mit roter essbarer Tinte auf einer Seite, verpackt in Flaschen mit 30 ( NDC 0173-0712-15) und 90 ( NDC 0173-0712-04) mit kindergesicherten Verschlüssen.
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15° bis 30°C (59° bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
Dutasterid wird über die Haut aufgenommen. AVODART 0,5 mg Kapseln sollten nicht von Frauen gehandhabt werden, die schwanger sind oder schwanger werden könnten, da die Möglichkeit einer Resorption von Dutasterid und dem daraus resultierenden potenziellen Risiko für einen sich entwickelnden männlichen Fötus besteht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hergestellt für: GlaxoSmithKline Research Triangle Park. Überarbeitet: Januar 2020
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Aus klinischen Studien mit AVODART 0,5 mg als Monotherapie oder in Kombination mit Tamsulosin:
Monotherapie
Mehr als 4.300 männliche Probanden mit BPH erhielten randomisiert Placebo oder 0,5-mg-Tagesdosen von AVODART in 3 identischen 2-jährigen, placebokontrollierten, doppelblinden Phase-3-Behandlungsstudien, denen jeweils eine 2-jährige offene Studie folgte Verlängerung. Während des doppelblinden Behandlungszeitraums wurden 2.167 männliche Probanden mit AVODART 0,5 mg behandelt, darunter 1.772 mit 1-jähriger und 1.510 mit 2-jähriger Exposition. Unter Einbeziehung der offenen Verlängerungen wurden 1.009 männliche Probanden 3 Jahre lang AVODART 0,5 mg und 812 4 Jahre lang AVODART ausgesetzt. Die Bevölkerung war zwischen 47 und 94 Jahre alt (Durchschnittsalter: 66 Jahre) und mehr als 90 % waren weiß. Tabelle 1 fasst klinische Nebenwirkungen zusammen, die bei mindestens 1 % der mit AVODART behandelten Patienten und mit einer höheren Inzidenz als bei Patienten unter Placebo berichtet wurden.
Langzeitbehandlung (bis zu 4 Jahre)
Hochgradiger Prostatakrebs
Die REDUCE-Studie war eine randomisierte, doppelblinde, placebokontrollierte Studie, an der 8.231 Männer im Alter von 50 bis 75 Jahren mit einem Serum-PSA-Wert von 2,5 ng/ml bis 10 ng/ml und einer negativen Prostatabiopsie innerhalb der letzten 6 Monate teilnahmen. Die Patienten wurden randomisiert und erhielten bis zu 4 Jahre lang Placebo (n = 4.126) oder 0,5 mg AVODART (n = 4.105) pro Tag. Das Durchschnittsalter betrug 63 Jahre und 91 % waren Weiße. Die Probanden unterzogen sich nach 2 und 4 Behandlungsjahren protokollpflichtigen geplanten Prostatabiopsien oder hatten „aus gegebenem Anlass“ Biopsien zu außerplanmäßigen Zeiten, wenn dies klinisch indiziert war. Es gab eine höhere Inzidenz von Prostatakrebs mit einem Gleason-Score von 8-10 bei Männern, die AVODART erhielten (1,0 %), verglichen mit Männern unter Placebo (0,5 %) [siehe INDIKATIONEN UND VERWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN ]. In einer 7-jährigen placebokontrollierten klinischen Studie mit einem anderen 5-Alpha-Reduktase-Hemmer (Finasterid 5 mg, PROSCAR) wurden ähnliche Ergebnisse für Prostatakrebs mit Gleason-Score 8-10 beobachtet (Finasterid 1,8 % versus Placebo 1,1 %).
Bei mit AVODART behandelten Patienten mit Prostatakrebs wurde kein klinischer Nutzen nachgewiesen.
Fortpflanzungs- und Brusterkrankungen
In den 3 zulassungsrelevanten placebokontrollierten BPH-Studien mit AVODART 0,5 mg, die jeweils 4 Jahre dauerten, gab es keine Hinweise auf vermehrte sexuelle Nebenwirkungen (Impotenz, verminderte Libido und Ejakulationsstörung) oder Brusterkrankungen mit längerer Behandlungsdauer. Unter diesen 3 Studien gab es 1 Fall von Brustkrebs in der Dutasterid-Gruppe und 1 Fall in der Placebo-Gruppe. In keiner Behandlungsgruppe der 4-jährigen CombAT-Studie oder der 4-jährigen REDUCE-Studie wurden Fälle von Brustkrebs gemeldet.
Der Zusammenhang zwischen der Langzeitanwendung von Dutasterid und Neoplasien der männlichen Brust ist derzeit nicht bekannt.
Kombination mit Alpha-Blocker-Therapie (CombAT)
Mehr als 4.800 männliche Probanden mit BPH erhielten randomisiert einmal täglich 0,5 mg AVODART 0,5 mg, 0,4 mg Tamsulosin oder eine Kombinationstherapie (0,5 mg AVODART plus 0,4 mg Tamsulosin) in einer 4-jährigen Doppelblindstudie. Insgesamt erhielten 1.623 Patienten eine Monotherapie mit AVODART; 1.611 Patienten erhielten eine Monotherapie mit Tamsulosin; und 1.610 Patienten erhielten eine Kombinationstherapie. Die Bevölkerung war 49 bis 88 Jahre alt (Durchschnittsalter: 66 Jahre) und 88 % waren weiß. Tabelle 2 fasst die Nebenwirkungen zusammen, die bei mindestens 1 % der Patienten in der Kombinationsgruppe und mit einer höheren Inzidenz als bei Patienten berichtet wurden, die eine Monotherapie mit AVODART 0,5 mg oder Tamsulosin erhielten.
Herzversagen
In CombAT war nach 4 Behandlungsjahren die Inzidenz des zusammengesetzten Begriffs Herzinsuffizienz in der Kombinationstherapiegruppe (12/1.610; 0,7 %) höher als in beiden Monotherapiegruppen: AVODART 0,5 mg, 2/1.623 (0,1 %) und Tamsulosin, 9/1.611 (0,6 %). Die kombinierte Herzinsuffizienz wurde auch in einer separaten 4-jährigen placebokontrollierten Studie untersucht, in der AVODART bei Männern mit Risiko für die Entwicklung von Prostatakrebs untersucht wurde. Die Inzidenz von Herzinsuffizienz bei Patienten, die AVODART 0,5 mg einnahmen, betrug 0,6 % (26/4.105) im Vergleich zu 0,4 % (15/4.126) bei Patienten unter Placebo. Eine Mehrheit der Patienten mit Herzinsuffizienz hatte in beiden Studien Komorbiditäten, die mit einem erhöhten Risiko für Herzinsuffizienz einhergingen. Daher ist die klinische Bedeutung der numerischen Ungleichgewichte bei Herzinsuffizienz unbekannt. Es wurde kein kausaler Zusammenhang zwischen AVODART allein oder in Kombination mit Tamsulosin und Herzinsuffizienz hergestellt. In beiden Studien wurde kein Ungleichgewicht in der Inzidenz von kardiovaskulären unerwünschten Ereignissen insgesamt beobachtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von AVODART nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Diese Reaktionen wurden aufgrund einer Kombination aus Schweregrad, Meldehäufigkeit oder möglichem kausalen Zusammenhang mit AVODART für die Aufnahme ausgewählt.
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen, einschließlich Hautausschlag, Juckreiz, Urtikaria, lokalisierte Ödeme, schwerwiegende Hautreaktionen und Angioödem.
Neubildungen
Brustkrebs beim Mann.
Psychische Störungen
Depressive Stimmung.
Störungen des Fortpflanzungssystems und der Brust
Hodenschmerzen und Hodenschwellung.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Cytochrom P450 3A-Inhibitoren
Dutasterid wird beim Menschen weitgehend durch die Isoenzyme Cytochrom P450 (CYP)3A4 und CYP3A5 metabolisiert. Die Wirkung starker CYP3A4-Hemmer auf Dutasterid wurde nicht untersucht. Wegen möglicher Arzneimittelwechselwirkungen ist bei der Verschreibung von AVODART an Patienten, die starke, chronische CYP3A4-Enzym-Hemmer (z. B. Ritonavir) einnehmen, Vorsicht geboten [siehe KLINISCHE PHARMAKOLOGIE ].
Alpha-adrenerge Antagonisten
Die Verabreichung von AVODART in Kombination mit Tamsulosin oder Terazosin hat keinen Einfluss auf die Steady-State-Pharmakokinetik eines der alpha-adrenergen Antagonisten. Die Wirkung der Verabreichung von Tamsulosin oder Terazosin auf die pharmakokinetischen Parameter von Dutasterid wurde nicht untersucht.
Calciumkanalantagonisten
Die gleichzeitige Anwendung von Verapamil oder Diltiazem verringert die Dutasterid-Clearance und führt zu einer erhöhten Dutasterid-Exposition. Die Veränderung der Dutasterid-Exposition wird nicht als klinisch signifikant angesehen. Es wird keine Dosisanpassung empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
Cholestyramin
Die Verabreichung einer Einzeldosis von 5 mg AVODART 0,5 mg, gefolgt von 12 g Cholestyramin 1 Stunde später, hat keinen Einfluss auf die relative Bioverfügbarkeit von Dutasterid [siehe KLINISCHE PHARMAKOLOGIE ].
Digoxin
AVODART 0,5 mg verändert die Steady-State-Pharmakokinetik von Digoxin nicht, wenn es gleichzeitig in einer Dosis von 0,5 mg/Tag über 3 Wochen verabreicht wird [siehe KLINISCHE PHARMAKOLOGIE ].
Warfarin
Die gleichzeitige Verabreichung von AVODART 0,5 mg/Tag über 3 Wochen mit Warfarin verändert weder die Steady-State-Pharmakokinetik der S- oder R-Warfarin-Isomere noch die Wirkung von Warfarin auf die Prothrombinzeit [siehe KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Auswirkungen auf das prostataspezifische Antigen (PSA) und die Verwendung von PSA bei der Erkennung von Prostatakrebs
In klinischen Studien senkte AVODART 0,5 mg die Serum-PSA-Konzentration innerhalb von 3 bis 6 Behandlungsmonaten um etwa 50 %. Diese Abnahme war über den gesamten Bereich der PSA-Werte bei Probanden mit symptomatischer BPH vorhersagbar, obwohl sie von Person zu Person unterschiedlich sein kann. AVODART 0,5 mg kann auch bei Vorhandensein von Prostatakrebs zu einer Abnahme des Serum-PSA führen. Zur Interpretation serieller PSA-Werte bei Männern, die AVODART 0,5 mg einnehmen, sollte mindestens 3 Monate nach Beginn der Behandlung ein neuer PSA-Ausgangswert festgelegt und der PSA-Wert danach regelmäßig überwacht werden. Jeder bestätigte Anstieg vom niedrigsten PSA-Wert während der Behandlung mit AVODART kann auf das Vorhandensein von Prostatakrebs hinweisen und sollte untersucht werden, selbst wenn die PSA-Werte bei Männern, die keinen 5-Alpha-Reduktase-Hemmer einnehmen, immer noch im normalen Bereich liegen. Die Nichteinhaltung von AVODART kann auch die PSA-Testergebnisse beeinflussen.
Um einen isolierten PSA-Wert bei einem Mann zu interpretieren, der 3 Monate oder länger mit AVODART 0,5 mg behandelt wurde, sollte der PSA-Wert zum Vergleich mit normalen Werten bei unbehandelten Männern verdoppelt werden. Das Verhältnis von freiem Gesamt-PSA (Prozent freies PSA) bleibt auch unter dem Einfluss von AVODART konstant. Wenn sich Kliniker dafür entscheiden, Prozent freies PSA als Hilfsmittel bei der Erkennung von Prostatakrebs bei Männern zu verwenden, die AVODART erhalten, erscheint keine Anpassung des Werts erforderlich.
Die gleichzeitige Verabreichung von Dutasterid und Tamsulosin führte zu ähnlichen Veränderungen des Serum-PSA wie die Dutasterid-Monotherapie.
Erhöhtes Risiko für hochgradigen Prostatakrebs
Bei Männern im Alter von 50 bis 75 Jahren mit einer vorherigen negativen Biopsie auf Prostatakrebs und einem Ausgangs-PSA-Wert zwischen 2,5 ng/ml und 10,0 ng/ml, die AVODART in der 4-jährigen REDUCE-Studie (Reduction by Dutasteride of Prostate Cancer Events) einnahmen, gab es eine erhöhte Inzidenz von Prostatakrebs nach Gleason-Score 810 im Vergleich zu Männern, die Placebo einnahmen (AVODART 1,0 % versus Placebo 0,5 %) [vgl INDIKATIONEN UND VERWENDUNG , NEBENWIRKUNGEN ]. In einer 7-jährigen placebokontrollierten klinischen Studie mit einem anderen 5-Alpha-Reduktase-Hemmer (Finasterid 5 mg, PROSCAR) wurden ähnliche Ergebnisse für Prostatakrebs mit Gleason-Score 8-10 beobachtet (Finasterid 1,8 % versus Placebo 1,1 %).
5-Alpha-Reduktase-Hemmer können das Risiko für die Entwicklung von hochgradigem Prostatakrebs erhöhen. Ob die Wirkung von 5-Alpha-Reduktase-Hemmern zur Reduzierung des Prostatavolumens oder studienbezogene Faktoren die Ergebnisse dieser Studien beeinflussten, wurde nicht festgestellt.
Bewertung für andere urologische Erkrankungen
Vor Beginn der Behandlung mit AVODART 0,5 mg sollten andere urologische Erkrankungen berücksichtigt werden, die ähnliche Symptome verursachen können. Außerdem können BPH und Prostatakrebs koexistieren.
Transdermale Exposition von AVODART 0,5 mg bei Schwangeren – Risiko für den männlichen Fötus
AVODART-Kapseln sollten nicht von Frauen gehandhabt werden, die schwanger sind oder schwanger sein könnten. Dutasterid kann über die Haut aufgenommen werden und könnte zu einer unbeabsichtigten Exposition des Fötus und einem potenziellen Risiko für einen männlichen Fötus führen. Wenn eine schwangere Frau mit auslaufenden Dutasterid-Kapseln in Kontakt kommt, sollte die Kontaktstelle sofort mit Wasser und Seife gewaschen werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Dutasterid kann basierend auf Tierversuchen über die Haut aufgenommen werden [siehe Nichtklinische Toxikologie ].
Blutspende
Männer, die mit AVODART behandelt werden, sollten kein Blut spenden, bis mindestens 6 Monate nach ihrer letzten Dosis vergangen sind. Der Zweck dieses zurückgestellten Zeitraums besteht darin, die Verabreichung von Dutasterid an eine schwangere Transfusionsempfängerin zu verhindern.
Auswirkung auf die Sameneigenschaften
Die Wirkungen von Dutasterid 0,5 mg/Tag auf die Spermieneigenschaften wurden bei gesunden Männern über einen Zeitraum von 52 Behandlungswochen und 24 Wochen Nachbeobachtung untersucht. Nach 52 Wochen führte die Behandlung mit Dutasterid im Vergleich zu Placebo zu einer mittleren Verringerung der Gesamtzahl der Spermien, des Samenvolumens und der Beweglichkeit der Spermien; die Auswirkungen auf die Gesamtzahl der Spermien waren nach 24-wöchiger Nachbeobachtung nicht reversibel. Spermienkonzentration und Spermienmorphologie blieben unbeeinflusst und die Mittelwerte aller Spermienparameter blieben zu allen Zeitpunkten im Normbereich. Die klinische Bedeutung der Wirkung von Dutasterid auf die Spermieneigenschaften für die Fertilität eines einzelnen Patienten ist nicht bekannt [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
PSA-Überwachung
Informieren Sie die Patienten darüber, dass AVODART den Serum-PSA-Spiegel innerhalb von 3 bis 6 Monaten nach der Therapie um etwa 50 % senkt, obwohl dies individuell unterschiedlich sein kann. Bei Patienten, die sich einem PSA-Screening unterziehen, kann ein Anstieg der PSA-Werte während der Behandlung mit AVODART auf das Vorhandensein von Prostatakrebs hindeuten und sollte von einem Arzt untersucht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Erhöhtes Risiko für hochgradigen Prostatakrebs
Informieren Sie die Patienten darüber, dass es bei Männern, die mit 5-Alpha-Reduktase-Hemmern (die zur BPH-Behandlung indiziert sind), einschließlich AVODART 0,5 mg, behandelt wurden, im Vergleich zu denen, die mit Placebo behandelt wurden, in Studien, die deren Anwendung untersuchten, eine Zunahme von hochgradigem Prostatakrebs gab Medikamente zur Verringerung des Risikos von Prostatakrebs [siehe INDIKATIONEN UND VERWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN ].
Transdermale Exposition von AVODART bei schwangeren oder potenziell schwangeren Frauen – Risiko für den männlichen Fötus
Informieren Sie die Patienten darüber, dass AVODART 0,5 mg Kapseln nicht von Frauen gehandhabt werden sollten, die schwanger sind oder möglicherweise schwanger sind, da Dutasterid möglicherweise resorbiert wird und ein daraus resultierendes potenzielles Risiko für einen sich entwickelnden männlichen Fötus besteht. Dutasterid kann über die Haut aufgenommen werden und könnte zu einer unbeabsichtigten Exposition des Fötus führen. Wenn eine schwangere oder potenziell schwangere Frau mit auslaufenden AVODART 0,5-mg-Kapseln in Kontakt kommt, sollte die Kontaktstelle sofort mit Wasser und Seife gewaschen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen ].
Auswirkungen auf Samenparameter
Weisen Sie Männer darauf hin, dass AVODART 0,5 mg die Eigenschaften der Spermien beeinflussen kann, die Auswirkung auf die Fruchtbarkeit jedoch nicht bekannt ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen ].
Blutspende
Informieren Sie Männer, die mit AVODART 0,5 mg behandelt werden, dass sie bis mindestens 6 Monate nach ihrer letzten Dosis kein Blut spenden sollten, um zu verhindern, dass schwangere Frauen Dutasterid durch Bluttransfusion erhalten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Serumspiegel von Dutasterid sind noch 4 bis 6 Monate nach Behandlungsende nachweisbar [vgl KLINISCHE PHARMAKOLOGIE ].
AVODART ist eine Marke, die der GSK-Unternehmensgruppe gehört oder an diese lizenziert ist.
Die anderen aufgeführten Marken sind Marken, die ihren jeweiligen Eigentümern gehören oder an diese lizenziert sind, und sind nicht Eigentum der GSK-Unternehmensgruppe oder an diese lizenziert. Die Hersteller dieser Marken sind nicht mit der GSK-Unternehmensgruppe oder ihren Produkten verbunden und unterstützen diese nicht.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Eine 2-Jahres-Karzinogenitätsstudie wurde an B6C3F1-Mäusen mit Dosen von 3, 35, 250 und 500 mg/kg/Tag für Männchen und 3, 35 und 250 mg/kg/Tag für Weibchen durchgeführt; eine erhöhte Inzidenz gutartiger hepatozellulärer Adenome wurde bei 250 mg/kg/Tag (das 290-fache der MRHD einer 0,5-mg-Tagesdosis) nur bei weiblichen Mäusen festgestellt. Zwei der drei wichtigsten menschlichen Metaboliten wurden in Mäusen nachgewiesen. Die Exposition gegenüber diesen Metaboliten bei Mäusen ist entweder geringer als beim Menschen oder nicht bekannt.
In einer 2-Jahres-Karzinogenitätsstudie an Han-Wistar-Ratten kam es bei Dosen von 1,5, 7,5 und 53 mg/kg/Tag bei Männchen und 0,8, 6,3 und 15 mg/kg/Tag bei Weibchen zu einem Anstieg der Leydig-Zellen Adenome in den Hoden beim 135-fachen der MRHD (53 mg/kg/Tag und mehr). Eine erhöhte Inzidenz von Leydig-Zell-Hyperplasie war beim 52-fachen der MRHD vorhanden (männliche Ratten-Dosen von 7,5 mg/kg/Tag und höher). Eine positive Korrelation zwischen proliferativen Veränderungen in den Leydig-Zellen und einem Anstieg der zirkulierenden luteinisierenden Hormonspiegel wurde mit 5-Alpha-Reduktase-Hemmern nachgewiesen und steht im Einklang mit einer Wirkung auf die Hypothalamus-Hypophysen-Hoden-Achse nach einer 5-Alpha-Reduktase-Hemmung. Bei tumorerzeugenden Dosen waren die Spiegel des luteinisierenden Hormons bei Ratten um 167 % erhöht. In dieser Studie wurden die wichtigsten menschlichen Metaboliten bei etwa dem 1- bis 3-Fachen der erwarteten klinischen Exposition auf Karzinogenität getestet.
Mutagenese
Dutasterid wurde in einem bakteriellen Mutagenese-Assay (Ames-Test), einem Chromosomenaberrations-Assay in Eierstockzellen des chinesischen Hamsters und einem Mikronukleus-Assay in Ratten auf Genotoxizität getestet. Die Ergebnisse zeigten kein genotoxisches Potenzial des Ausgangsarzneimittels. Zwei wichtige menschliche Metaboliten waren ebenfalls entweder im Ames-Test oder in einem abgekürzten Ames-Test negativ.
Beeinträchtigung der Fruchtbarkeit
Die Behandlung geschlechtsreifer männlicher Ratten mit Dutasterid in der 0,1-fachen MRHD (Tierdosen von 0,05 mg/kg/Tag oder mehr für bis zu 31 Wochen), basierend auf der mittleren Serumkonzentration, führte bei allen Dosen zu einer dosis- und zeitabhängigen Abnahme der Fertilität ; verringerte cauda epididymale (absolute) Spermienzahl, aber nicht Spermienkonzentration (bei 50 und 500 mg/kg/Tag); reduziertes Gewicht der Nebenhoden, Prostata und Samenbläschen; und mikroskopische Veränderungen (zytoplasmatische Vakuolisierung des tubulären Epithels in den Nebenhoden und/oder verringerter zytoplasmatischer Inhalt des Epithels, vereinbar mit verringerter sekretorischer Aktivität in der Prostata und den Samenbläschen) in den Fortpflanzungsorganen bei allen Dosen ohne väterliche Toxizität. Die Auswirkungen auf die Fertilität kehrten sich bis zur Erholungswoche 6 bei allen Dosierungen um, und die Spermienzahl war am Ende einer 14-wöchigen Erholungsphase normal. Die mikroskopischen Veränderungen waren in der 14. Erholungswoche beim 0,1-fachen der MRHD nicht mehr vorhanden und wurden in den verbleibenden Behandlungsgruppen teilweise wiederhergestellt. Im Serum von unbehandelten weiblichen Ratten, die mit behandelten männlichen Tieren verpaart wurden (10 bis 500 mg/kg/Tag für 29 bis 30 Wochen), wurden niedrige Dutasterid-Spiegel (0,6 bis 17 ng/ml) nachgewiesen, die dem 16- bis 110-fachen der MRHD entsprechen mittlere Serumkonzentration. Bei männlichen Nachkommen unbehandelter weiblicher Ratten, die mit behandelten männlichen Ratten gepaart wurden, trat keine Feminisierung auf, obwohl bei den weiblichen Ratten nachweisbare Blutspiegel von Dutasterid beobachtet wurden.
In einer Fertilitätsstudie an weiblichen Ratten mit einer Dosierung 4 Wochen vor der Paarung bis zur frühen Trächtigkeit führte die orale Gabe von Dutasterid in Dosen von 0,05, 2,5, 12,5 und 30 mg/kg/Tag zu einer reduzierten Wurfgröße aufgrund erhöhter Resorptionen und zur Verweiblichung männlicher Föten (verringerter anogenitaler Abstand) mit dem 2- bis 10-fachen der MRHD (Tierdosen von 2,5 mg/kg/Tag oder mehr), basierend auf der mittleren Serumkonzentration, bei Vorliegen maternaler Toxizität (verringerte Körpergewichtszunahme). Das fötale Körpergewicht war ebenfalls um etwa das 0,02-fache der MRHD (Rattendosis von 0,05 mg/kg/Tag oder höher) basierend auf der mittleren Serumkonzentration reduziert, ohne Wirkungsspiegel ohne maternale Toxizität.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
AVODART 0,5 mg ist für die Anwendung in der Schwangerschaft kontraindiziert, da es den männlichen Fötus schädigen kann [siehe KONTRAINDIKATIONEN ]. AVODART ist nicht für die Anwendung bei Frauen indiziert.
AVODART 0,5 mg ist ein 5-Alpha-Reduktase-Hemmer, der die Umwandlung von Testosteron in Dihydrotestosteron (DHT) verhindert, ein Hormon, das für die normale Entwicklung der männlichen Genitalien notwendig ist. Anomalien in den Genitalien männlicher Föten sind eine erwartete physiologische Folge der Hemmung dieser Umwandlung. Diese Ergebnisse ähneln Beobachtungen bei männlichen Säuglingen mit genetischem 5-Alpha-Reduktase-Mangel.
In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
In Reproduktionsstudien an Tieren hemmte Dutasterid die normale Entwicklung der äußeren Genitalien bei männlichen Nachkommen, wenn es Ratten oder Kaninchen während der Organogenese mit weniger als der maximal empfohlenen Humandosis (MRHD) von 0,5 mg täglich verabreicht wurde, ohne maternale Toxizität. Beim 15-Fachen der MRHD wurden bei Ratten verlängerte Trächtigkeit, vermindertes Gewicht der Fortpflanzungsorgane und verzögerte Pubertät bei männlichen Nachkommen beobachtet, wobei die Werte ohne Wirkung unter der MRHD von 0,5 mg täglich lagen. Bei Kaninchen wurde auch ein erhöhtes Plazentagewicht beobachtet, mit No-Effect-Spiegeln von weniger als der MRHD von 0,5 mg täglich (vgl Daten ).
Obwohl Dutasterid in die menschliche Samenflüssigkeit ausgeschieden wird, ist die Wirkstoffkonzentration in der menschlichen weiblichen Partnerin etwa 100-mal geringer als die Konzentrationen, die in Tierstudien Anomalien der männlichen Genitalien hervorrufen (vgl Daten ). Bei Affen, denen während der Organogenese Blutkonzentrationen verabreicht wurden, die vergleichbar oder höher waren als die Konzentrationen, denen eine menschliche Partnerin schätzungsweise ausgesetzt ist, wurden die äußeren Genitalien der männlichen Nachkommen nicht nachteilig beeinflusst. Bei männlichen Nachkommen unbehandelter weiblicher Ratten, die mit behandelten männlichen Ratten gepaart wurden, trat keine Feminisierung auf, obwohl bei den weiblichen Ratten nachweisbare Blutspiegel von Dutasterid beobachtet wurden [vgl Nichtklinische Toxikologie ].
Daten
Menschliche Daten
Die höchste gemessene Konzentration von Dutasterid im Sperma bei behandelten Männern betrug 14 ng/ml. Obwohl Dutasterid im Sperma nachweisbar ist, würde die erwartete Dutasterid-Blutkonzentration der Frau unter der Annahme, dass eine Frau mit 50 kg 5 ml Sperma und 100 % Resorption ausgesetzt wäre, etwa 0,0175 ng/ml betragen. Diese Konzentration ist ungefähr 100-mal geringer als Blutkonzentrationen, die in Tierversuchen Anomalien der männlichen Genitalien hervorrufen. Dutasterid ist in menschlichem Sperma stark proteingebunden (mehr als 96 %), was die für die vaginale Resorption verfügbare Menge an Dutasterid verringern kann.
Tierdaten
In einer Studie zur embryofetalen Entwicklung bei Ratten führte die orale Gabe von Dutasterid in einer 10-mal geringeren Menge als der MRHD von 0,5 mg täglich (basierend auf durchschnittlichen Blutspiegeln bei Männern) zu einer Feminisierung der männlichen Genitalien beim Fötus (verringerter anogenitaler Abstand bei 0,05 mg /kg/Tag, mit fehlendem No-Effect-Level) ohne maternale Toxizität. Darüber hinaus traten bei Föten von Muttertieren, die mit Dosen von 2,5 mg/kg/Tag oder mehr (etwa dem 15-Fachen der MRHD) behandelt wurden, Brustwarzenentwicklung, Hypospadie und ausgedehnte Präputialdrüsen auf. Bei maternaler Toxizität (verringerte Körpergewichtszunahme) wurde bei einer maternalen Exposition von etwa dem 15-fachen der MRHD (Dosis von 2,5 mg/kg/Tag oder mehr) ein reduziertes fötales Körpergewicht und eine damit verbundene verzögerte Ossifikation beobachtet. Bei Muttertieren, die mit 30 mg/kg/Tag (ungefähr das 111-fache der MRHD) behandelt wurden, wurde eine Zunahme totgeborener Jungtiere beobachtet, mit einer Dosis ohne Wirkung von 12,5 mg/kg/Tag.
In einer Studie zur embryofetalen Entwicklung bei Kaninchen wurden an den Trächtigkeitstagen 7 bis 29 (während der Organogenese und der Spätphase) Dosen verabreicht, die dem 28-Fachen der MRHD (Dosen von 30 mg/kg/Tag oder mehr) entsprachen, basierend auf den durchschnittlichen Blutspiegeln bei Männern Entwicklungszeitraum der äußeren Genitalien). Die histologische Untersuchung der Genitalpapille von Föten ergab Hinweise auf eine Feminisierung des männlichen Fötus sowie verschmolzene Schädelknochen und erhöhte Plazentagewichte bei allen Dosen ohne maternale Toxizität. Eine zweite Studie zur embryofetalen Entwicklung bei Kaninchen, denen während der Trächtigkeit (Organogenese und spätere Entwicklung der äußeren Genitalien [Tragzeit 6 bis 29]) das 0,3-fache der MRHD (Dosen von 0,05 mg/kg/Tag oder mehr, ohne keine Wirkungsniveau), ergaben auch Hinweise auf eine Feminisierung der Genitalien bei männlichen Föten und erhöhten Plazentagewichten bei allen Dosen ohne maternale Toxizität.
In einer Studie zur embryofetalen Entwicklung wurden trächtige Rhesusaffen während der Organogenese (20. bis 100. Trächtigkeitstag) intravenös einem Dutasterid-Blutspiegel ausgesetzt, der mit der geschätzten Dutasterid-Exposition einer weiblichen Partnerin vergleichbar oder darüber lag. Dutasterid wurde an den Trächtigkeitstagen 20 bis 100 (während der Organogenese) in Dosen von 400, 780, 1.325 oder 2.010 ng/Tag (12 Affen/Gruppe) verabreicht. Es wurde keine Feminisierung der männlichen äußeren Genitalien von Affennachkommen beobachtet. Bei der höchsten getesteten Dosis wurden eine Verringerung des fötalen Nebennierengewichts, eine Verringerung des fötalen Prostatagewichts und eine Zunahme des fötalen Eierstock- und Hodengewichts beobachtet. Basierend auf der höchsten gemessenen Konzentration von Dutasterid im Sperma bei behandelten Männern (14 ng/ml) stellen diese Dosen beim Affen das bis zu 16-fache der potenziellen maximalen Exposition einer 50 kg schweren Frau gegenüber 5 ml Sperma täglich von einem Dutasterid dar. behandelter Mann, unter der Annahme von 100 % Resorption. Die Dosismengen (auf ng/kg-Basis), die Affen in dieser Studie verabreicht wurden, betragen das 32- bis 186-fache der Nenndosis (ng/kg), der ein Weibchen möglicherweise über die Samenflüssigkeit ausgesetzt wäre. Es ist nicht bekannt, ob Kaninchen oder Rhesusaffen einen der wichtigsten menschlichen Metaboliten produzieren.
In einer oralen prä- und postnatalen Entwicklungsstudie an Ratten wurde eine Feminisierung der männlichen Genitalien beobachtet. Eine verringerte anogenitale Distanz wurde beim 0,05-Fachen der MRHD und darüber (0,05 mg/kg/Tag und darüber) beobachtet, wobei ein Nicht-Effekt-Level fehlte, basierend auf durchschnittlichen Blutspiegeln bei Männern als Schätzung der AUC. Hypospadie und Entwicklung der Brustwarzen wurden ab 2,5 mg/kg/Tag beobachtet (das 14-Fache der MRHD oder höher, mit einem Nicht-Effekt-Level bei 0,05 mg/kg/Tag). Dosen von 2,5 mg/kg/Tag und mehr führten auch zu einer verlängerten Trächtigkeit bei den elterlichen Weibchen, zu einer Verlängerung der Zeit bis zur Balano-Präputial-Trennung bei männlichen Nachkommen, zu einer Verkürzung der Zeit bis zur vaginalen Durchgängigkeit bei weiblichen Nachkommen und zu einer Abnahme der Prostata und Samenbläschengewicht bei männlichen Nachkommen. Bei 30 mg/kg/Tag (das 102-fache der MRHD bei maternaler Toxizität [verringertes Körpergewicht]) wurden vermehrt Totgeburten und eine verringerte Lebensfähigkeit der Neugeborenen bei den Nachkommen festgestellt.
Stillzeit
Zusammenfassung der Risiken
AVODART ist nicht für die Anwendung bei Frauen indiziert. Es liegen keine Informationen über das Vorhandensein von Dutasterid in der Muttermilch, die Auswirkungen auf das gestillte Kind oder die Auswirkungen auf die Milchproduktion vor.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Männchen
Die Wirkungen von Dutasterid 0,5 mg/Tag auf die Spermieneigenschaften wurden bei gesunden Freiwilligen im Alter von 18 bis 52 Jahren (n = 27 Dutasterid, n = 23 Placebo) über 52 Behandlungswochen und 24 Wochen Nachbeobachtung untersucht. Nach 52 Wochen betrug die durchschnittliche prozentuale Reduktion der gesamten Spermienzahl, des Samenvolumens und der Spermienmotilität gegenüber dem Ausgangswert 23 %, 26 % bzw. 18 % in der Dutasterid-Gruppe, wenn die Änderungen gegenüber dem Ausgangswert in der Placebo-Gruppe angepasst wurden. Spermienkonzentration und Spermienmorphologie blieben unbeeinflusst. Nach 24-wöchiger Nachbeobachtung blieb die mittlere prozentuale Veränderung der gesamten Spermienzahl in der Dutasterid-Gruppe 23 % niedriger als der Ausgangswert. Während die Mittelwerte für alle Spermienparameter zu allen Zeitpunkten innerhalb der normalen Bereiche blieben und die vordefinierten Kriterien für eine klinisch signifikante Veränderung (30 %) nicht erfüllten, wiesen 2 Probanden in der Dutasterid-Gruppe eine Abnahme der Spermienzahl von mehr als 90 % gegenüber dem Ausgangswert auf 52 Wochen, mit teilweiser Erholung bei der 24-wöchigen Nachuntersuchung. Die klinische Bedeutung der Wirkung von Dutasterid auf die Spermieneigenschaften für die Fertilität eines einzelnen Patienten ist nicht bekannt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Pädiatrische Verwendung
AVODART 0,5 mg ist nicht für die Anwendung bei pädiatrischen Patienten indiziert. Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Von 2.167 männlichen Probanden, die in 3 klinischen Studien mit AVODART 0,5 mg behandelt wurden, waren 60 % 65 Jahre und älter und 15 % 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist für AVODART 0,5 mg keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Dutasterid wurde nicht untersucht. Da Dutasterid extensiv metabolisiert wird, könnte die Exposition bei Patienten mit eingeschränkter Leberfunktion höher sein. In einer klinischen Studie, in der 60 Probanden 24 Wochen lang täglich 5 mg (das Zehnfache der therapeutischen Dosis) erhielten, wurden jedoch keine zusätzlichen Nebenwirkungen im Vergleich zu denen beobachtet, die bei der therapeutischen Dosis von 0,5 mg beobachtet wurden [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
In Probandenstudien wurden Einzeldosen von Dutasterid bis zu 40 mg (das 80-fache der therapeutischen Dosis) über 7 Tage ohne nennenswerte Sicherheitsbedenken verabreicht. In einer klinischen Studie wurden 60 Probanden 6 Monate lang Tagesdosen von 5 mg (das Zehnfache der therapeutischen Dosis) verabreicht, ohne dass es zu zusätzlichen Nebenwirkungen im Vergleich zu denen kam, die bei therapeutischen Dosen von 0,5 mg beobachtet wurden.
Es gibt kein spezifisches Antidot für Dutasterid. Daher sollte im Falle einer vermuteten Überdosierung unter Berücksichtigung der langen Halbwertszeit von Dutasterid gegebenenfalls eine symptomatische und unterstützende Behandlung erfolgen.
KONTRAINDIKATIONEN
AVODART 0,5 mg ist kontraindiziert zur Anwendung bei:

KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Dutasterid hemmt die Umwandlung von Testosteron in DHT. DHT ist das Androgen, das hauptsächlich für die anfängliche Entwicklung und anschließende Vergrößerung der Prostata verantwortlich ist. Testosteron wird durch das Enzym 5-Alpha-Reduktase in DHT umgewandelt, das in 2 Isoformen, Typ 1 und Typ 2, vorliegt. Das Typ-2-Isoenzym ist hauptsächlich in den reproduktiven Geweben aktiv, während das Typ-1-Isoenzym auch für die Testosteronumwandlung in den reproduktiven Geweben verantwortlich ist Haut und Leber.
Dutasterid ist ein kompetitiver und spezifischer Inhibitor der 5-Alpha-Reduktase-Isoenzyme sowohl vom Typ 1 als auch vom Typ 2, mit denen es einen stabilen Enzymkomplex bildet. Die Dissoziation von diesem Komplex wurde unter In-vitro- und In-vivo-Bedingungen bewertet und ist extrem langsam. Dutasterid bindet nicht an den menschlichen Androgenrezeptor.
Pharmakodynamik
Wirkung auf 5 Alpha-Dihydrotestosteron und Testosteron
Die maximale Wirkung von Dutasterid-Tagesdosen auf die Reduktion von DHT ist dosisabhängig und wird innerhalb von 1 bis 2 Wochen beobachtet. Nach 1 und 2 Wochen täglicher Gabe von Dutasterid 0,5 mg waren die mittleren Serum-DHT-Konzentrationen um 85 % bzw. 90 % reduziert. Bei Patienten mit BPH, die 4 Jahre lang mit Dutasterid 0,5 mg/Tag behandelt wurden, betrug die mediane Abnahme des Serum-DHT 94 % nach 1 Jahr, 93 % nach 2 Jahren und 95 % nach 3 und 4 Jahren. Der mittlere Anstieg des Testosterons im Serum betrug 19 % nach 1 und 2 Jahren, 26 % nach 3 Jahren und 22 % nach 4 Jahren, aber die mittleren und mittleren Werte blieben innerhalb des physiologischen Bereichs.
Bei Patienten mit BPH, die bis zu 12 Wochen vor der transurethralen Resektion der Prostata mit 5 mg/Tag Dutasterid oder Placebo behandelt wurden, waren die mittleren DHT-Konzentrationen im Prostatagewebe in der Dutasterid-Gruppe im Vergleich zu Placebo signifikant niedriger (784 und 5.793 pg/g bzw. P
Erwachsene Männer mit genetisch vererbtem Typ-2-5-Alpha-Reduktase-Mangel haben ebenfalls verringerte DHT-Spiegel. Diese 5 alpha-Reduktase-defizienten Männer haben ihr ganzes Leben lang eine kleine Prostata und entwickeln keine BPH. Abgesehen von den damit verbundenen urogenitalen Defekten, die bei der Geburt vorhanden waren, wurden bei diesen Personen keine anderen klinischen Anomalien im Zusammenhang mit einem 5-Alpha-Reduktase-Mangel beobachtet.
Auswirkungen auf andere Hormone
Bei gesunden Probanden führte eine 52-wöchige Behandlung mit Dutasterid 0,5 mg/Tag (n = 26) im Vergleich zu Placebo (n = 23) zu keiner klinisch signifikanten Veränderung von Sexualhormon-bindendem Globulin, Östradiol, luteinisierendem Hormon, follikelstimulierendem Hormon, Thyroxin (freies T4) und Dehydroepiandrosteron. Statistisch signifikante, zu Studienbeginn angepasste mittlere Anstiege im Vergleich zu Placebo wurden für das Gesamttestosteron nach 8 Wochen (97,1 ng/dl, p
Andere Effekte
Plasma-Lipid-Panel und Knochenmineraldichte wurden nach 52 Wochen Dutasterid 0,5 mg einmal täglich bei gesunden Probanden bewertet. Es gab keine Veränderung der Knochenmineraldichte, gemessen durch Dual-Energy-Röntgenabsorptiometrie, im Vergleich zu Placebo oder Baseline. Außerdem wurde das Plasmalipidprofil (dh Gesamtcholesterin, Lipoproteine niedriger Dichte, Lipoproteine hoher Dichte, Triglyceride) durch Dutasterid nicht beeinflusst. In einer Teilpopulation (n = 13) der 1-jährigen Studie mit gesunden Freiwilligen wurden keine klinisch signifikanten Veränderungen der Reaktion der Nebennierenhormone auf die Stimulation mit adrenocorticotropem Hormon (ACTH) beobachtet.
Pharmakokinetik
Absorption
Nach der Gabe einer Einzeldosis von 0,5 mg einer Weichgelatinekapsel erreicht die maximale Serumkonzentration (Tmax) von Dutasterid innerhalb von 2 bis 3 Stunden. Die absolute Bioverfügbarkeit beträgt bei 5 gesunden Probanden etwa 60 % (Bereich: 40 % bis 94 %). Wenn das Medikament zusammen mit Nahrung verabreicht wird, werden die maximalen Serumkonzentrationen um 10 % bis 15 % reduziert. Diese Reduktion hat keine klinische Bedeutung.
Verteilung
Pharmakokinetische Daten nach einmaliger und wiederholter oraler Gabe zeigen, dass Dutasterid ein großes Verteilungsvolumen hat (300 bis 500 l). Dutasterid wird stark an Plasmaalbumin (99,0 %) und saures Alpha-1-Glykoprotein (96,6 %) gebunden.
In einer Studie mit gesunden Probanden (n = 26), die Dutasterid 0,5 mg/Tag über 12 Monate erhielten, betrugen die Dutasterid-Konzentrationen im Sperma nach 12 Monaten durchschnittlich 3,4 ng/ml (Bereich: 0,4 bis 14 ng/ml) und erreichten, ähnlich wie im Serum, ein stabiles Niveau -Konzentrationen nach 6 Monaten angeben. Im Durchschnitt verteilten sich nach 12 Monaten 11,5 % der Dutasterid-Serumkonzentrationen auf die Samenflüssigkeit.
Stoffwechsel und Ausscheidung
Dutasterid wird beim Menschen extensiv metabolisiert. In-vitro-Studien zeigten, dass Dutasterid durch die Isoenzyme CYP3A4 und CYP3A5 metabolisiert wird. Diese beiden Isoenzyme produzierten die Metaboliten 4'-Hydroxydutasterid, 6-Hydroxydutasterid und 6,4'-Dihydroxydutasterid. Außerdem wurde der 15-Hydroxydutasterid-Metabolit von CYP3A4 gebildet. Dutasterid wird in vitro nicht durch die humanen Cytochrom-P450-Isoenzyme CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 und CYP2E1 metabolisiert. In Humanserum nach Dosierung bis zum Steady State unverändertes Dutasterid, 3 Hauptmetaboliten (4'-Hydroxydutasterid, 1,2-Dihydrodutasterid und 6-Hydroxydutasterid) und 2 Nebenmetaboliten (6,4'-Dihydroxydutasterid und 15 -Hydroxydutasterid), wie anhand der massenspektrometrischen Reaktion bestimmt, wurden nachgewiesen. Die absolute Stereochemie der Hydroxyl-Additionen in den Positionen 6 und 15 ist nicht bekannt. In vitro sind die Metaboliten von 4'-Hydroxydutasterid und 1,2-Dihydrodutasterid gegenüber beiden Isoformen der humanen 5-Alpha-Reduktase viel weniger wirksam als Dutasterid. Die Aktivität von 6β-Hydroxydutasterid ist mit der von Dutasterid vergleichbar.
Dutasterid und seine Metaboliten wurden hauptsächlich mit dem Stuhl ausgeschieden. Als Prozentsatz der Dosis lagen ungefähr 5 % unverändertes Dutasterid (~1 % bis ~15 %) und 40 % als Dutasterid-verwandte Metaboliten (~2 % bis ~90 %) vor. Im Urin wurden nur Spuren von unverändertem Dutasterid gefunden (
Die terminale Eliminationshalbwertszeit von Dutasterid beträgt etwa 5 Wochen im Steady State. Die durchschnittliche Dutasterid-Serumkonzentration im Steady State betrug 40 ng/ml nach 0,5 mg/Tag über 1 Jahr. Nach täglicher Gabe erreichen die Dutasterid-Serumkonzentrationen nach 1 Monat 65 % der Steady-State-Konzentration und nach 3 Monaten etwa 90 %. Aufgrund der langen Halbwertszeit von Dutasterid bleiben Serumkonzentrationen (mehr als 0,1 ng/ml) bis zu 4 bis 6 Monate nach Absetzen der Behandlung nachweisbar.
Spezifische Populationen
Pädiatrische Patienten
Die Pharmakokinetik von Dutasterid wurde bei Personen unter 18 Jahren nicht untersucht.
Geriatrische Patienten
Bei älteren Patienten ist keine Dosisanpassung erforderlich. Die Pharmakokinetik und Pharmakodynamik von Dutasterid wurde bei 36 gesunden männlichen Probanden im Alter zwischen 24 und 87 Jahren nach Verabreichung einer Einzeldosis von 5 mg Dutasterid untersucht. In dieser Einzeldosisstudie verlängerte sich die Halbwertszeit von Dutasterid mit zunehmendem Alter (etwa 170 Stunden bei Männern im Alter von 20 bis 49 Jahren, etwa 260 Stunden bei Männern im Alter von 50 bis 69 Jahren und etwa 300 Stunden bei Männern über 70 Jahren). Von 2.167 Männern, die in den 3 zulassungsrelevanten Studien mit Dutasterid behandelt wurden, waren 60 % 65 Jahre und älter und 15 % 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet.
Männliche und weibliche Patienten
AVODART ist in der Schwangerschaft kontraindiziert und nicht zur Anwendung bei Frauen indiziert [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Die Pharmakokinetik von Dutasterid bei Frauen wurde nicht untersucht.
Rassen- und ethnische Gruppen
Die Auswirkung der ethnischen Zugehörigkeit auf die Pharmakokinetik von Dutasterid wurde nicht untersucht.
Patienten mit eingeschränkter Nierenfunktion
Die Auswirkung einer Nierenfunktionsstörung auf die Pharmakokinetik von Dutasterid wurde nicht untersucht. Allerdings werden weniger als 0,1 % einer Steady-State-Dosis von 0,5 mg Dutasterid im menschlichen Urin wiedergefunden, sodass bei Patienten mit eingeschränkter Nierenfunktion keine Dosisanpassung zu erwarten ist.
Patienten mit eingeschränkter Leberfunktion
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Dutasterid wurde nicht untersucht. Da Dutasterid extensiv metabolisiert wird, könnte die Exposition bei Patienten mit eingeschränkter Leberfunktion höher sein.
Arzneimittelwechselwirkungsstudien
Cytochrom-P450-Inhibitoren
Es wurden keine klinischen Wechselwirkungsstudien durchgeführt, um die Auswirkungen von CYP3A-Enzyminhibitoren auf die Pharmakokinetik von Dutasterid zu untersuchen. Basierend auf In-vitro-Daten können die Blutkonzentrationen von Dutasterid jedoch in Gegenwart von CYP3A4/5-Inhibitoren wie Ritonavir, Ketoconazol, Verapamil, Diltiazem, Cimetidin, Troleandomycin und Ciprofloxacin ansteigen.
Dutasterid hemmt nicht den In-vitro-Metabolismus von Modellsubstraten für die wichtigsten humanen Cytochrom-P450-Isoenzyme (CYP1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A4) in einer Konzentration von 1.000 ng/ml, 25-mal höher als Steady-State-Serumkonzentrationen beim Menschen .
Alpha-adrenerge Antagonisten
In einer Einzelsequenz-Crossover-Studie mit gesunden Probanden hatte die Verabreichung von Tamsulosin oder Terazosin in Kombination mit AVODART keine Wirkung auf die Steady-State-Pharmakokinetik eines der alpha-adrenergen Antagonisten. Obwohl die Wirkung der Verabreichung von Tamsulosin oder Terazosin auf die pharmakokinetischen Parameter von Dutasterid nicht untersucht wurde, war die prozentuale Veränderung der DHT-Konzentration bei AVODART 0,5 mg allein im Vergleich zur Kombinationsbehandlung ähnlich.
Calciumkanalantagonisten
In einer populationspharmakokinetischen Analyse wurde eine Abnahme der Clearance von Dutasterid bei gleichzeitiger Verabreichung mit den CYP3A4-Inhibitoren Verapamil (-37 %, n = 6) und Diltiazem (-44 %, n = 5) festgestellt. Im Gegensatz dazu wurde keine Verringerung der Clearance beobachtet, wenn Amlodipin, ein anderer Calciumkanalantagonist, der kein CYP3A4-Hemmer ist, zusammen mit Dutasterid verabreicht wurde (+7 %, n = 4).
Die Abnahme der Clearance und die anschließende Zunahme der Dutasterid-Exposition in Gegenwart von Verapamil und Diltiazem wird nicht als klinisch signifikant angesehen. Es wird keine Dosisanpassung empfohlen.
Cholestyramin
Die Verabreichung einer Einzeldosis von 5 mg AVODART 0,5 mg gefolgt von 12 g Cholestyramin 1 Stunde später hatte keinen Einfluss auf die relative Bioverfügbarkeit von Dutasterid bei 12 gesunden Probanden.
Digoxin
In einer Studie mit 20 gesunden Freiwilligen veränderte AVODART 0,5 mg die Steady-State-Pharmakokinetik von Digoxin nicht, wenn es gleichzeitig in einer Dosis von 0,5 mg/Tag über 3 Wochen verabreicht wurde.
Warfarin
In einer Studie mit 23 gesunden Freiwilligen veränderte eine 3-wöchige Behandlung mit AVODART 0,5 mg/Tag weder die Steady-State-Pharmakokinetik der S- oder R-Warfarin-Isomere noch die Wirkung von Warfarin auf die Prothrombinzeit, wenn es zusammen mit Warfarin verabreicht wurde.
Andere Begleittherapie
Obwohl keine spezifischen Interaktionsstudien mit anderen Verbindungen durchgeführt wurden, nahmen etwa 90 % der Patienten in den 3 randomisierten, doppelblinden, placebokontrollierten Sicherheits- und Wirksamkeitsstudien, die AVODART erhielten, gleichzeitig andere Medikamente ein. Der Kombination von AVODART und gleichzeitiger Therapie konnten keine klinisch signifikanten unerwünschten Wechselwirkungen zugeschrieben werden, wenn AVODART zusammen mit Antihyperlipidämien, Angiotensin-Converting-Enzym (ACE)-Hemmern, Betarezeptorenblockern, Kalziumkanalblockern, Kortikosteroiden, Diuretika und nichtsteroidalen Antibiotika verabreicht wurde -Entzündungsmedikamente (NSAIDs), Phosphodiesterase-Typ-V-Hemmer und Chinolon-Antibiotika.
Tiertoxikologie und/oder Pharmakologie
Studien zur Toxikologie des zentralen Nervensystems
Bei Ratten und Hunden führte die wiederholte orale Verabreichung von Dutasterid bei einigen Tieren zu Anzeichen einer unspezifischen, reversiblen, zentral vermittelten Toxizität ohne damit verbundene histopathologische Veränderungen bei Expositionen, die dem 425- bzw. 315-Fachen der erwarteten klinischen Exposition (der Ausgangssubstanz) entsprachen .
Dermale Absorption von Kaninchen
In einer dermalen Pharmakokinetikstudie an Kaninchen führte die dermale Resorption von Dutasterid in CAPMUL (Glyceryloleat) bei Kaninchen zu Serumkonzentrationen von 2,7 bis 40,5 µg/h/ml für Dosen von 1 bis 20 mg/ml bzw. 56 % bis 100 % des applizierten Dutasterids, das unter verschlossenen und verlängerten Bedingungen absorbiert werden soll. Oral verabreichte AVODART Weichgelatinekapseln enthalten 0,5 mg Dutasterid, gelöst in einer Mischung aus Mono-Diglyceriden von Capryl-/Caprinsäure und butyliertem Hydroxytoluol. Dutasterid in Wasser wurde von Kaninchen minimal resorbiert (2.000 mg/kg).
Klinische Studien
Monotherapie
AVODART 0,5 mg/Tag (n = 2.167) oder Placebo (n = 2.158) wurde bei männlichen Probanden mit BPH in drei 2-jährigen multizentrischen, placebokontrollierten Doppelblindstudien mit jeweils 2-jähriger unverblindeter Verlängerung untersucht ( n = 2.340). Mehr als 90 % der Studienpopulation waren Weiße. Die Probanden waren mindestens 50 Jahre alt mit einem Serum-PSA-Wert von ≥ 1,5 ng/ml und
Auswirkung auf die Symptomwerte
Die Symptome wurden mit dem AUA-SI quantifiziert, einem Fragebogen, der Harnsymptome (unvollständige Entleerung, Häufigkeit, Unterbrechungen, Harndrang, schwacher Strahl, Pressen und Nykturie) durch Bewertung auf einer Skala von 0 bis 5 für eine mögliche Gesamtpunktzahl von 35 bewertet höhere numerische Gesamtsymptomwerte, die eine größere Schwere der Symptome darstellen. Der Ausgangs-AUA-SI-Score in den 3 Studien betrug ungefähr 17 Einheiten in beiden Behandlungsgruppen.
Probanden, die Dutasterid erhielten, erreichten eine statistisch signifikante Verbesserung der Symptome im Vergleich zu Placebo in Monat 3 in 1 Studie und in Monat 12 in den anderen 2 zulassungsrelevanten Studien. In Monat 12 betrug die mittlere Abnahme der AUA-SI-Gesamtsymptomwerte gegenüber dem Ausgangswert in den 3 gepoolten Studien -3,3 Einheiten für Dutasterid und -2,0 Einheiten für Placebo mit einem mittleren Unterschied zwischen den beiden Behandlungsgruppen von -1,3 (Bereich: -1,1 bis -1,5 Einheiten in jeder der 3 Studien, P
Diese Studien wurden prospektiv entwickelt, um die Auswirkungen auf die Symptome basierend auf der Prostatagröße zu Studienbeginn zu bewerten. Bei Männern mit einem Prostatavolumen von ≥ 40 cc betrug die mittlere Abnahme -3,8 Einheiten für Dutasterid und -1,6 Einheiten für Placebo, mit einem mittleren Unterschied zwischen den beiden Behandlungsgruppen von -2,2 in Monat 24. Bei Männern mit einem Prostatavolumen von
Abbildung 1: Änderung des AUA-SI-Scores gegenüber dem Ausgangswert (gepoolte randomisierte, doppelblinde, Placebo-kontrollierte Studien)
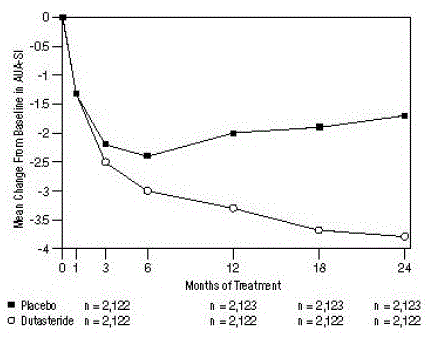
ein AUA-SI-Score reicht von 0 bis 35.
Wirkung auf die akute Harnverhaltung und die Notwendigkeit einer BPH-bedingten Operation
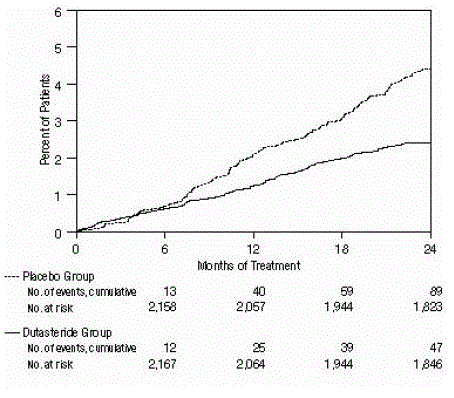
Die Wirksamkeit wurde auch nach 2-jähriger Behandlung anhand der Inzidenz von AUR, die eine Katheterisierung erforderten, und BPH-bedingten urologischen chirurgischen Eingriffen bewertet. Im Vergleich zu Placebo war AVODART mit einer statistisch signifikant geringeren Inzidenz von AUR (1,8 % für AVODART gegenüber 4,2 % für Placebo, P
Abbildung 2: Prozentsatz der Studienteilnehmer, die über einen Zeitraum von 24 Monaten einen akuten Harnverhalt entwickelten (gepoolte randomisierte, doppelblinde, Placebo-kontrollierte Studien)
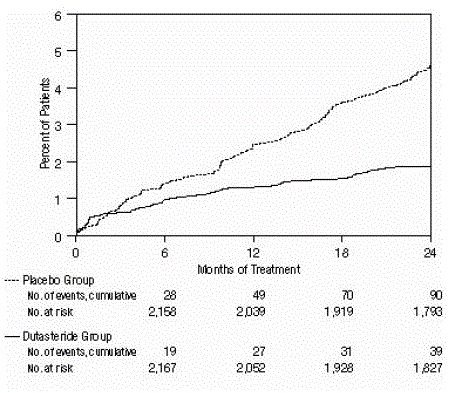
Abbildung 3: Prozentsatz der Probanden, die sich einer Operation wegen benigner Prostatahyperplasie über einen Zeitraum von 24 Monaten unterzogen (randomisierte, doppelblinde, Placebo-kontrollierte Studien gepoolt)
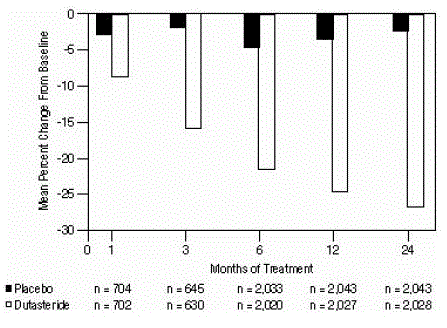
Wirkung auf das Prostatavolumen
Für die Aufnahme in die Studie war ein per transrektalem Ultraschall gemessenes Prostatavolumen von mindestens 30 cc erforderlich. Das durchschnittliche Prostatavolumen bei Studieneintritt betrug ungefähr 54 cm³.
Statistisch signifikante Unterschiede (AVODART 0,5 mg gegenüber Placebo) wurden bei der frühesten Messung des Prostatavolumens nach der Behandlung in jeder Studie (Monat 1, Monat 3 oder Monat 6) festgestellt und hielten bis Monat 24 an das Prostatavolumen in den 3 gepoolten Studien betrug -24,7 % für Dutasterid und -3,4 % für Placebo; die mittlere Differenz (Dutasterid minus Placebo) betrug -21,3 % (Bereich: -21,0 % bis -21,6 % in jeder der 3 Studien, p
Abbildung 4: Prozentuale Veränderung des Prostatavolumens gegenüber dem Ausgangswert (gepoolte randomisierte, doppelblinde, Placebo-kontrollierte Studien)
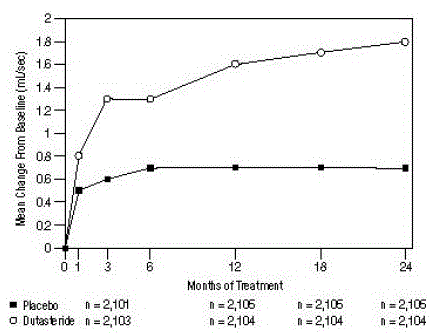
Auswirkung auf die maximale Urinflussrate
Für die Aufnahme in die Studie war eine mittlere maximale Urinflussrate (Qmax) von ≤ 15 ml/s erforderlich. Qmax betrug zu Studienbeginn in den 3 zulassungsrelevanten Studien ungefähr 10 ml/s.
Die Unterschiede zwischen den 2 Gruppen waren gegenüber dem Ausgangswert in Monat 3 in allen 3 Studien statistisch signifikant und blieben bis Monat 12 bestehen. In Monat 12 betrug die mittlere Zunahme von Qmax in den 3 gepoolten Studien 1,6 ml/s für AVODART 0,5 mg und 0,7 ml /sec für Placebo; die mittlere Differenz (Dutasterid minus Placebo) betrug 0,8 ml/s (Bereich: 0,7 bis 1,0 ml/s in jeder der 3 Studien, p
Abbildung 5: Veränderung von Qmax gegenüber dem Ausgangswert (gepoolte randomisierte, doppelblinde, Placebo-kontrollierte Studien)
Zusammenfassung der klinischen Studien
Daten aus 3 großen, gut kontrollierten Wirksamkeitsstudien zeigen, dass die Behandlung mit AVODART (0,5 mg einmal täglich) das Risiko sowohl von AUR- als auch von BPH-bedingten chirurgischen Eingriffen im Vergleich zu Placebo reduziert, BPH-bedingte Symptome verbessert, das Prostatavolumen verringert und das Maximum erhöht Harnflussraten. Diese Daten deuten darauf hin, dass AVODART 0,5 mg den Krankheitsprozess von BPH bei Männern mit einer vergrößerten Prostata aufhält.
Kombination mit Alpha-Blocker-Therapie (CombAT)
Die Wirksamkeit der Kombinationstherapie (AVODART 0,5 mg/Tag plus Tamsulosin 0,4 mg/Tag, n = 1.610) wurde mit AVODART 0,5 mg allein (n = 1.623) oder Tamsulosin allein (n = 1.611) in einem 4-jährigen, multizentrischen, randomisierten Verfahren verglichen , Doppelblindversuch. Die Studieneintrittskriterien waren ähnlich wie bei den in Abschnitt 14.1 beschriebenen doppelblinden, placebokontrollierten Monotherapie-Wirksamkeitsstudien. Achtundachtzig Prozent (88 %) der eingeschriebenen Studienpopulation waren Weiße. Ungefähr 52 % der Studienteilnehmer waren zuvor mit 5-Alpha-Reduktase-Inhibitoren oder Alpha-Adrenergika-Antagonisten behandelt worden. Von den 4.844 Studienteilnehmern, die randomisiert der Behandlung zugeteilt wurden, beendeten 69 % der Studienteilnehmer in der Kombinationsgruppe, 67 % in der Gruppe, die AVODART 0,5 mg erhielt, und 61 % in der Tamsulosin-Gruppe eine 4-jährige doppelblinde Behandlung.
Auswirkung auf den Symptom-Score
Die Quantifizierung der Symptome erfolgte anhand der ersten 7 Fragen des International Prostate Symptom Score (IPSS) (identisch mit dem AUA-SI). Der Ausgangswert betrug ungefähr 16,4 Einheiten für jede Behandlungsgruppe. Die Kombinationstherapie war jeder der Monotherapiebehandlungen hinsichtlich der Verringerung der Symptombewertung in Monat 24, dem primären Zeitpunkt für diesen Endpunkt, statistisch überlegen. In Monat 24 betrugen die mittleren Veränderungen gegenüber dem Ausgangswert (±SD) der IPSS-Gesamtsymptomwerte -6,2 (±7,14) für die Kombination, -4,9 (±6,81) für AVODART und -4,3 (±7,01) für Tamsulosin, mit einer mittleren Differenz zwischen Kombination und AVODART 0,5 mg von -1,3 Einheiten (p
Abbildung 6: Änderung des internationalen Prostatasymptom-Scores gegenüber dem Ausgangswert über einen Zeitraum von 48 Monaten (randomisierte, doppelblinde Parallelgruppenstudie [CombAT-Studie])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/dcd17b45d4691f571773a9a6c14221f2.jpg)
Auswirkungen auf die akute Harnverhaltung oder die Notwendigkeit einer BPH-bedingten Operation
Nach 4 Behandlungsjahren zeigte die Kombinationstherapie mit AVODART 0,5 mg und Tamsulosin keinen Nutzen gegenüber der Monotherapie mit AVODART hinsichtlich der Verringerung der Inzidenz von AUR- oder BPH-bedingten Operationen.
Auswirkung auf die maximale Urinflussrate
Der Ausgangs-Qmax betrug ungefähr 10,7 ml/s für jede Behandlungsgruppe. Die Kombinationstherapie war jeder der Monotherapiebehandlungen bei der Erhöhung von Qmax in Monat 24, dem primären Zeitpunkt für diesen Endpunkt, statistisch überlegen. In Monat 24 betrug der mittlere Anstieg von Qmax gegenüber dem Ausgangswert (±SD) 2,4 (±5,26) ml/s für die Kombination, 1,9 (±5,10) ml/s für AVODART 0,5 mg und 0,9 (±4,57) ml/s für die Kombination Tamsulosin, mit einem mittleren Unterschied zwischen Kombination und AVODART von 0,5 ml/s (p = 0,003; [95 % KI: 0,17; 0,84]) und zwischen Kombination und Tamsulosin von 1,5 ml/s (p
Die zusätzliche Verbesserung von Qmax der Kombinationstherapie gegenüber der Monotherapie mit AVODART 0,5 mg war in Monat 48 nicht mehr statistisch signifikant.
Abbildung 7: Qmax-Änderung gegenüber dem Ausgangswert über einen Zeitraum von 24 Monaten (randomisierte, doppelblinde Parallelgruppen-Studie [CombAT-Studie])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/777d65c94800a9f8f5457909251b890f.jpg)
Wirkung auf das Prostatavolumen
Das mittlere Prostatavolumen bei Studieneintritt betrug etwa 55 cc. In Monat 24, dem primären Zeitpunkt für diesen Endpunkt, betrugen die mittleren prozentualen Veränderungen des Prostatavolumens gegenüber dem Ausgangswert (±SD) -26,9 % (±22,57) für die Kombinationstherapie, -28,0 % (±24,88) für AVODART 0,5 mg und 0 % (±31,14) für Tamsulosin, mit einem mittleren Unterschied zwischen Kombination und AVODART 0,5 mg von 1,1 % (P = NS; [95 % KI: -0,6; 2,8]) und zwischen Kombination und Tamsulosin von -26,9 % (P
INFORMATIONEN ZUM PATIENTEN
AVODART (av o dart) (Dutasterid) Kapseln
AVODART 0,5 mg ist nur für Männer bestimmt.
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von AVODART 0,5 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist AVODART 0,5 mg?
AVODART 0,5 mg ist ein verschreibungspflichtiges Arzneimittel, das Dutasterid enthält. AVODART 0,5 mg wird zur Behandlung der Symptome einer benignen Prostatahyperplasie (BPH) bei Männern mit einer vergrößerten Prostata angewendet, um:
Wer sollte AVODART NICHT einnehmen?
Nehmen Sie AVODART nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von AVODART 0,5 mg mitteilen?
Bevor Sie AVODART 0,5 mg einnehmen, informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. AVODART und andere Arzneimittel können sich gegenseitig beeinflussen und Nebenwirkungen verursachen. AVODART 0,5 mg kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von AVODART 0,5 mg beeinflussen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie soll ich AVODART einnehmen?
Was sollte ich während der Einnahme von AVODART 0,5 mg vermeiden?
Welche Nebenwirkungen kann AVODART haben?
AVODART kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie diese schweren allergischen Reaktionen haben.
Zu den häufigsten Nebenwirkungen von AVODART gehören:
*Einige dieser Ereignisse können auch nach Beendigung der Einnahme von AVODART fortbestehen.
Bei Patienten, die AVODART erhielten, wurde über depressive Verstimmung berichtet.
AVODART 0,5 mg reduziert nachweislich die Spermienzahl, das Samenvolumen und die Spermienbewegung. Die Wirkung von AVODART 0,5 mg auf die männliche Fertilität ist jedoch nicht bekannt.
Prostata-spezifisches Antigen (PSA)-Test: Ihr Arzt kann Sie vor Beginn und während der Einnahme von AVODART auf andere Prostataprobleme, einschließlich Prostatakrebs, untersuchen. Ein Bluttest namens PSA (prostataspezifisches Antigen) wird manchmal verwendet, um festzustellen, ob Sie Prostatakrebs haben könnten. AVODART senkt die in Ihrem Blut gemessene PSA-Menge. Ihr medizinischer Betreuer ist sich dieser Wirkung bewusst und kann PSA dennoch verwenden, um festzustellen, ob Sie möglicherweise Prostatakrebs haben. Anstiege Ihrer PSA-Werte während der Behandlung mit AVODART (selbst wenn die PSA-Werte im normalen Bereich liegen) sollten von Ihrem Arzt beurteilt werden.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von AVODART. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich AVODART 0,5 mg aufbewahren?
Bewahren Sie AVODART 0,5 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie AVODART 0,5 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie AVODART nicht an andere Personen weiter, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu AVODART zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über AVODART 0,5 mg fragen, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen erhalten Sie unter www.AVODART.com oder telefonisch unter 1-888-825-5249.
Welche Inhaltsstoffe enthält AVODART 0,5 mg?
Wirkstoff: Dutasterid.
Inaktive Zutaten : Butylhydroxytoluol, Eisenoxid (gelb), Gelatine (aus zertifiziert BSE-freien Rinderquellen), Glycerin, Mono-Diglyceride von Capryl-/Caprinsäure, Titandioxid und essbare rote Tinte.
Wie wirkt AVODART?
Prostatawachstum wird durch ein Hormon im Blut namens Dihydrotestosteron (DHT) verursacht. AVODART senkt die DHT-Produktion im Körper, was bei den meisten Männern zu einer Schrumpfung der vergrößerten Prostata führt. Während einige Männer nach 3-monatiger Behandlung mit AVODART weniger Probleme und Symptome haben, ist normalerweise eine Behandlungsdauer von mindestens 6 Monaten erforderlich, um zu sehen, ob AVODART 0,5 mg bei Ihnen wirkt.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.