Benicar 10mg, 20mg, 40mg Olmesartan Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Benicar 40 mg und wie wird es angewendet?
Benicar ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie). Benicar 10 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Benicar ist ein Angiotensin-II-Rezeptorblocker oder ARBs.
Es ist nicht bekannt, ob Benicar bei Kindern unter 6 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Benicar 40 mg haben?
Benicar kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Benicar sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Benicar. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
Olmesartanmedoxomil, ein Prodrug, wird während der Resorption aus dem Gastrointestinaltrakt zu Olmesartan hydrolysiert. Olmesartan ist ein selektiver Antagonist des Angiotensin-II-Rezeptors vom AT1-Subtyp.
Olmesartanmedoxomil wird chemisch als 2,3-Dihydroxy-2-butenyl-4-(1-hydroxy-1-methylethyl)-2-propyl-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]imidazol- 5 Carboxylat, zyklisches 2,3-Carbonat.
Seine Summenformel ist C29H30N6O6 und seine Strukturformel ist:
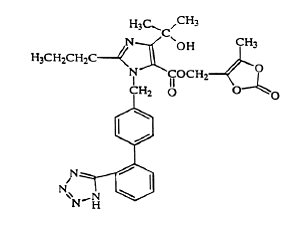
Olmesartanmedoxomil ist ein weißes bis leicht gelblich-weißes Pulver oder kristallines Pulver mit einem Molekulargewicht von 558,59. Es ist praktisch unlöslich in Wasser und schwer löslich in Methanol. Benicar 20 mg ist zur oralen Anwendung als Filmtabletten mit 5 mg, 20 mg oder 40 mg Olmesartanmedoxomil und den folgenden Hilfsstoffen erhältlich: Hydroxypropylcellulose, Hypromellose, Lactose-Monohydrat, niedrig substituierte Hydroxypropylcellulose, Magnesiumstearat, mikrokristalline Cellulose , Talk, Titandioxid und (nur 5 mg) gelbes Eisenoxid.
INDIKATIONEN
Benicar 40 mg ist angezeigt zur Behandlung von Bluthochdruck bei Erwachsenen und Kindern ab sechs Jahren, um den Blutdruck zu senken. Die Senkung des Blutdrucks verringert das Risiko tödlicher und nicht tödlicher kardiovaskulärer Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen, einschließlich der Klasse, zu der dieses Arzneimittel hauptsächlich gehört, beobachtet. Es gibt keine kontrollierten Studien, die eine Risikominderung mit Benicar belegen.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als ein Medikament, um ihre Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt die Medikamente, die größtenteils für diese Vorteile verantwortlich sind. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Mortalität wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass selbst eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Reduktion des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absolutem Risiko ähnlich, sodass der absolute Nutzen bei Patienten größer ist, die unabhängig von ihrer Hypertonie einem höheren Risiko ausgesetzt sind (z. B. Patienten mit Diabetes oder Hyperlipidämie), und solche Patienten wären zu erwarten um von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel zu profitieren.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten.
Es kann allein oder in Kombination mit anderen blutdrucksenkenden Mitteln verwendet werden.
DOSIERUNG UND ANWENDUNG
Bluthochdruck bei Erwachsenen
Die Dosierung muss individuell angepasst werden. Die übliche empfohlene Anfangsdosis von Benicar 20 mg beträgt 20 mg einmal täglich bei Anwendung als Monotherapie bei Patienten ohne Volumenkontraktion. Bei Patienten, die nach 2-wöchiger Therapie eine weitere Senkung des Blutdrucks benötigen, kann die Benicar-Dosis auf 40 mg erhöht werden. Dosen über 40 mg scheinen keine größere Wirkung zu haben. Die zweimal tägliche Gabe bietet keinen Vorteil gegenüber der gleichen Gesamtdosis einmal täglich.
Bei Patienten mit möglicher Erschöpfung des intravaskulären Volumens (z. B. Patienten, die mit Diuretika behandelt werden, insbesondere solche mit eingeschränkter Nierenfunktion), sollte Benicar unter engmaschiger ärztlicher Überwachung eingeleitet und die Anwendung einer niedrigeren Anfangsdosis in Betracht gezogen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypertonie bei Kindern (6 Jahre und älter)
Die Dosierung muss individuell angepasst werden. Bei Kindern, die Tabletten schlucken können, beträgt die übliche empfohlene Anfangsdosis von Benicar 10 mg einmal täglich für Patienten mit einem Gewicht von 20 bis
Die Anwendung von Benicar 10 mg bei Kindern unter 1 Jahr wird nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Kindern, die keine Tabletten schlucken können, kann die gleiche Dosis wie unten beschrieben als unfertige Suspension gegeben werden [siehe KLINISCHE PHARMAKOLOGIE ]. Befolgen Sie die nachstehenden Anweisungen zur Herstellung einer Suspension, um Benicar als Suspension zu verabreichen.
Zubereitung der Suspension (für 200 ml einer 2 mg/ml Suspension)
Geben Sie 50 ml gereinigtes Wasser in eine bernsteinfarbene Flasche aus Polyethylenterephthalat (PET), die zwanzig Benicar 20 mg-Tabletten enthält, und lassen Sie sie mindestens 5 Minuten lang stehen. Schütteln Sie den Behälter mindestens 1 Minute und lassen Sie die Suspension mindestens 1 Minute stehen. Wiederholen Sie 1 Minute Schütteln und 1 Minute Stehen vier weitere Male. 100 ml ORA-Sweet® und 50 ml ORA-Plus®* zur Suspension geben und mindestens 1 Minute gut schütteln. Die Suspension sollte bei 2-8°C (36-46°F) gekühlt werden und kann bis zu 4 Wochen gelagert werden. Schütteln Sie die Suspension vor jedem Gebrauch gut und stellen Sie sie umgehend wieder in den Kühlschrank.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
Benicar ist als gelbe, runde Filmtabletten ohne Bruchkerbe mit 5 mg Olmesartanmedoxomil, als weiße, runde Filmtablette ohne Bruchkerbe mit 20 mg Olmesartanmedoxomil und als weiße, ovale Tablette erhältlich Filmtabletten ohne Bruchkerbe mit 40 mg Olmesartanmedoxomil. Die Tabletten mit 5, 20 bzw. 40 mg Tabletten sind auf einer Seite mit Sankyo und auf der anderen Seite mit C12, C14 oder C15 geprägt.
Tabletten werden wie folgt geliefert:
Lagerung
Bei 20–25 °C (68–77 °F) lagern [siehe USP Controlled Room Temperature].
Hergestellt für Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Überarbeitet: Okt. 2019
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Bluthochdruck bei Erwachsenen
Benicar wurde bei mehr als 3825 Patienten/Probanden auf Sicherheit untersucht, darunter mehr als 3275 Patienten, die in kontrollierten Studien wegen Bluthochdruck behandelt wurden. Diese Erfahrung umfasste etwa 900 Patienten, die mindestens 6 Monate und mehr als 525 mindestens 1 Jahr lang behandelt wurden. Die Ereignisse waren im Allgemeinen leicht, vorübergehend und standen in keinem Zusammenhang mit der Benicar-Dosis.
Die Analyse von Geschlecht, Alter und ethnischer Zugehörigkeit zeigte keine Unterschiede zwischen Benicar 40 mg und den mit Placebo behandelten Patienten. Die Abbruchrate aufgrund von Nebenwirkungen in allen Studien mit Bluthochdruckpatienten betrug 2,4 % (dh 79/3278) der mit Benicar 40 mg behandelten Patienten und 2,7 % (dh 32/1179) der Kontrollpatienten. In Placebo-kontrollierten Studien war Schwindel die einzige Nebenwirkung, die bei mehr als 1 % der mit Benicar 20 mg behandelten Patienten und häufiger als Placebo auftrat (3 % vs. 1 %).
Bei fünf Patienten, die Benicar erhielten, wurde über Gesichtsödeme berichtet. Bei Angiotensin-II-Antagonisten wurde über Angioödeme berichtet.
Pädiatrischer Bluthochdruck
Es wurden keine relevanten Unterschiede zwischen dem Nebenwirkungsprofil für pädiatrische Patienten im Alter von 1 bis 16 Jahren und dem zuvor für erwachsene Patienten berichteten festgestellt.
Post-Marketing-Erfahrung
Die folgenden Nebenwirkungen wurden nach Markteinführung berichtet. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Asthenie, Angioödem, anaphylaktische Reaktionen
Magen-Darm: Erbrechen, angussartige Enteropathie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Stoffwechsel- und Ernährungsstörungen: Hyperkaliämie
Bewegungsapparat: Rhabdomyolyse
Urogenitalsystem: Akute Niereninsuffizienz, erhöhte Kreatininwerte im Blut
Haut und Anhängsel: Alopezie, Juckreiz, Urtikaria
Daten aus einer kontrollierten Studie und einer epidemiologischen Studie deuten darauf hin, dass hochdosiertes Olmesartan das kardiovaskuläre (CV) Risiko bei Diabetikern erhöhen kann, aber die Gesamtdaten sind nicht schlüssig. Die randomisierte, placebokontrollierte, doppelblinde ROADMAP-Studie (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) untersuchte die Anwendung von Olmesartan, 40 mg täglich, vs. Placebo bei Patienten mit Typ-2-Diabetes mellitus, Normoalbuminurie und At mindestens ein zusätzlicher Risikofaktor für kardiovaskuläre Erkrankungen. Die Studie erreichte ihren primären Endpunkt, das verzögerte Einsetzen der Mikroalbuminurie, aber Olmesartan hatte keine positive Wirkung auf die Abnahme der glomerulären Filtrationsrate (GFR). Es wurde eine erhöhte kardiovaskuläre Mortalität (beurteilter plötzlicher Herztod, tödlicher Myokardinfarkt, tödlicher Schlaganfall, Revaskularisierungstod) in der Olmesartan-Gruppe im Vergleich zur Placebo-Gruppe festgestellt (15 Olmesartan vs. 3 Placebo, HR 4,9, 95 % Konfidenzintervall [CI ], 1,4, 17), aber das Risiko eines nicht tödlichen Myokardinfarkts war unter Olmesartan geringer (HR 0,64, 95 %-KI 0,35, 1,18).
Die epidemiologische Studie umfasste Patienten ab 65 Jahren mit einer Gesamtexposition von > 300.000 Patientenjahren. In der Untergruppe der Diabetiker, die hochdosiertes Olmesartan (40 mg/Tag) über > 6 Monate erhielten, schien das Sterberisiko (HR 2,0, 95 % KI 1,1, 3,8) im Vergleich zu ähnlichen Patienten, die andere Arzneimittel einnahmen, erhöht zu sein Angiotensinrezeptorblocker. Im Gegensatz dazu schien die hochdosierte Anwendung von Olmesartan bei nicht-diabetischen Patienten mit einem verringerten Sterberisiko verbunden zu sein (HR 0,46, 95 % KI 0,24, 0,86) im Vergleich zu ähnlichen Patienten, die andere Angiotensin-Rezeptorblocker einnahmen. Es wurden keine Unterschiede zwischen den Gruppen beobachtet, die niedrigere Olmesartan-Dosen im Vergleich zu anderen Angiotensin-Blockern erhielten, oder zwischen den Gruppen, die
Insgesamt geben diese Daten Anlass zu Bedenken hinsichtlich eines möglichen erhöhten kardiovaskulären Risikos im Zusammenhang mit der Anwendung von hochdosiertem Olmesartan bei Diabetikern. Es gibt jedoch Bedenken hinsichtlich der Glaubwürdigkeit des Befunds eines erhöhten kardiovaskulären Risikos, insbesondere der Beobachtung in der großen epidemiologischen Studie für einen Überlebensvorteil bei Nichtdiabetikern in einer Größenordnung, die dem nachteiligen Befund bei Diabetikern ähnlich ist.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mittel zur Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von Olmesartan mit anderen Mitteln, die das Renin-Angiotensin-System blockieren, kaliumsparenden Diuretika (z. B. Spironolacton, Triamteren, Amilorid), Kaliumpräparaten, kaliumhaltigen Salzersatzmitteln oder anderen Arzneimitteln, die den Kaliumspiegel erhöhen können (z. B. Heparin). zu einem Anstieg des Serumkaliums führen. Wenn eine Komedikation als notwendig erachtet wird, ist eine Überwachung des Serumkaliums ratsam.
Nicht-steroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretikatherapie) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit Angiotensin-II-Rezeptorantagonisten, einschließlich Olmesartanmedoxomil, zu einer Verschlechterung führen der Nierenfunktion, einschließlich eines möglichen akuten Nierenversagens. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Therapie mit Olmesartanmedoxomil und NSAR erhalten.
Die blutdrucksenkende Wirkung von Angiotensin-II-Rezeptor-Antagonisten, einschließlich Olmesartanmedoxomil, kann durch NSAIDs, einschließlich selektiver COX-2-Hemmer, abgeschwächt werden.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden. Die meisten Patienten, die die Kombination von zwei RAS-Hemmern erhalten, erhalten keinen zusätzlichen Nutzen im Vergleich zur Monotherapie. Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Bei Patienten, die mit Benicar und anderen Wirkstoffen, die das RAS beeinflussen, behandelt werden, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht gleichzeitig mit Benicar bei Patienten mit Diabetes [siehe KONTRAINDIKATIONEN ]. Vermeiden Sie die Anwendung von Aliskiren zusammen mit Benicar 40 mg bei Patienten mit eingeschränkter Nierenfunktion (GFR
Lithium
Bei gleichzeitiger Gabe von Lithium mit Angiotensin-II-Rezeptor-Antagonisten, einschließlich BENICAR, wurde über einen Anstieg der Lithiumkonzentrationen im Serum und eine Lithiumtoxizität berichtet. Überwachen Sie den Lithiumspiegel im Serum während der gleichzeitigen Anwendung.
Colesevelamhydrochlorid
Die gleichzeitige Gabe des Gallensäure-Sequestriermittels Colesevelamhydrochlorid reduziert die systemische Exposition und die maximale Plasmakonzentration von Olmesartan. Die Gabe von Olmesartan mindestens 4 Stunden vor Colesevelamhydrochlorid verringerte die Arzneimittelwechselwirkung. Erwägen Sie die Verabreichung von Olmesartan mindestens 4 Stunden vor der Colesevelamhydrochlorid-Dosis [siehe KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Fötale Toxizität
Benicar 10 mg kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die auf das Renin-Angiotensin-System (RAS) während des zweiten und dritten Schwangerschaftstrimesters wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie Benicar so bald wie möglich ab [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Morbidität bei Säuglingen
Die Anwendung von Benicar bei Kindern unter 1 Jahr wird nicht empfohlen. Medikamente, die direkt auf das Renin-Angiotensin-Aldosteron-System (RAAS) wirken, können Auswirkungen auf die Entwicklung unreifer Nieren haben [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Hypotonie bei Patienten mit Volumen- oder Salzmangel
Bei Patienten mit einem aktivierten Renin-Angiotensin-Aldosteron-System, wie z. B. Patienten mit Volumen- und/oder Salzmangel (z. B. Patienten, die mit hochdosierten Diuretika behandelt werden), kann nach Beginn der Behandlung mit Benicar mit einer symptomatischen Hypotonie gerechnet werden. Beginnen Sie die Behandlung unter engmaschiger ärztlicher Überwachung und erwägen Sie, mit einer niedrigeren Dosis zu beginnen. Wenn eine Hypotonie auftritt, bringen Sie den Patienten in Rückenlage und geben Sie, falls erforderlich, eine intravenöse Infusion mit normaler Kochsalzlösung [siehe DOSIERUNG UND ANWENDUNG ]. Eine vorübergehende hypotensive Reaktion ist keine Kontraindikation für eine weitere Behandlung, die normalerweise problemlos fortgesetzt werden kann, sobald sich der Blutdruck stabilisiert hat.
Beeinträchtigte Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Aldosteron-Systems können bei empfindlichen Personen, die mit Benicar behandelt werden, Veränderungen der Nierenfunktion erwartet werden. Bei Patienten, deren Nierenfunktion möglicherweise von der Aktivität des Renin-Angiotensinaldosteron-Systems abhängt (z. B. Patienten mit schwerer dekompensierter Herzinsuffizienz), wurde die Behandlung mit Angiotensin-Converting-Enzym (ACE)-Hemmern und Angiotensin-Rezeptor-Antagonisten mit Oligurie und/oder fortschreitender Azotämie in Verbindung gebracht und selten mit akutem Nierenversagen und/oder Tod. Ähnliche Ergebnisse können bei mit Benicar behandelten Patienten erwartet werden [siehe DOSIERUNG UND ANWENDUNG , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
In Studien mit ACE-Hemmern bei Patienten mit einseitiger oder beidseitiger Nierenarterienstenose wurde über Anstiege des Serum-Kreatinins oder des Blut-Harnstoff-Stickstoffs (BUN) berichtet. Bei Patienten mit einseitiger oder beidseitiger Nierenarterienstenose wurde Benicar nicht über einen längeren Zeitraum angewendet, es können jedoch ähnliche Ergebnisse erwartet werden.
Sprue-ähnliche Enteropathie
Schwere, chronische Diarrhoe mit erheblichem Gewichtsverlust wurde bei Patienten berichtet, die Olmesartan Monate bis Jahre nach Beginn der Behandlung mit Olmesartan einnahmen. Darmbiopsien von Patienten zeigten oft Zottenatrophie. Wenn ein Patient diese Symptome während der Behandlung mit Olmesartan entwickelt, schließen Sie andere Ätiologien aus. Erwägen Sie eine alternative antihypertensive Therapie in Fällen, in denen keine andere Ätiologie identifiziert wurde.
Hyperkaliämie
Serumkalium sollte bei Patienten, die Benicar erhalten, überwacht werden. Arzneimittel, die das Renin-Angiotensin-System hemmen, können eine Hyperkaliämie verursachen. Risikofaktoren für die Entwicklung einer Hyperkaliämie sind Niereninsuffizienz, Diabetes mellitus und die gleichzeitige Anwendung von kaliumsparenden Diuretika, Kaliumpräparaten und/oder kaliumhaltigen Salzersatzmitteln [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Olmesartanmedoxomil war nicht karzinogen, wenn es Ratten über einen Zeitraum von bis zu 2 Jahren über die Nahrung verabreicht wurde. Die höchste getestete Dosis (2000 mg/kg/Tag) war, auf mg/m2-Basis, etwa das 480-fache der maximal empfohlenen Humandosis (MRHD) von 40 mg/Tag. Zwei an Mäusen durchgeführte Karzinogenitätsstudien, eine 6-monatige Sondenernährungsstudie an p53-Knockout-Mäusen und eine 6-monatige Studie mit diätetischer Verabreichung an transgenen Hras2-Mäusen mit Dosen von bis zu 1000 mg/kg/Tag (etwa das 120-fache der MRHD) ergaben keine Hinweise auf eine krebserzeugende Wirkung von Olmesartanmedoxomil.
Sowohl Olmesartanmedoxomil als auch Olmesartan wurden im In-vitro-Test zur Transformation von Embryonenzellen des syrischen Hamsters negativ getestet und zeigten im Ames-Test (bakterielle Mutagenität) keine Hinweise auf genetische Toxizität. Es wurde jedoch gezeigt, dass beide Chromosomenaberrationen in kultivierten Zellen in vitro (Chinesische Hamsterlunge) induzieren und im In-vitro-Maus-Lymphom-Assay positiv auf Thymidinkinase-Mutationen getestet wurden. Olmesartanmedoxomil wurde in vivo bei oralen Dosen von bis zu 2000 mg/kg (Olmesartan nicht getestet) negativ auf MutaMouse-Darm und -Niere und auf Klastogenität im Mausknochenmark (Mikrokerntest) getestet.
Die Fertilität von Ratten wurde durch die Verabreichung von Olmesartanmedoxomil in Dosierungen von bis zu 1000 mg/kg/Tag (240-fache der MRHD) in einer Studie, in der mit der Dosierung 2 (Weibchen) oder 9 (Männchen) Wochen vor der Paarung begonnen wurde, nicht beeinflusst.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Benicar 10 mg kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. In Reproduktionsstudien an Tieren führte die Behandlung mit Benicar während der Organogenese zu einer erhöhten embryofetalen Toxizität bei Ratten in Dosen, die niedriger waren als die für das Muttertier toxischen Dosen.
Wenn eine Schwangerschaft festgestellt wird, setzen Sie Benicar so schnell wie möglich ab. Erwägen Sie während der Schwangerschaft eine alternative blutdrucksenkende Therapie.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Bluthochdruck in der Schwangerschaft erhöht das mütterliche Risiko für Präeklampsie, Schwangerschaftsdiabetes, Frühgeburt und Geburtskomplikationen (z. B. Notwendigkeit eines Kaiserschnitts und postpartale Blutungen). Bluthochdruck erhöht das fötale Risiko für eine intrauterine Wachstumsbeschränkung und einen intrauterinen Tod. Schwangere Frauen mit Bluthochdruck sollten sorgfältig überwacht und entsprechend behandelt werden.
Fetale/neonatale Nebenwirkungen
Oligohydramnion bei Schwangeren, die im zweiten und dritten Trimenon Arzneimittel anwenden, die das Renin-Angiotensin-System beeinflussen, kann zu Folgendem führen: reduzierte fetale Nierenfunktion, die zu Anurie und Nierenversagen führt, fetale Lungenhypoplasie, Skelettdeformationen, einschließlich Schädelhypoplasie, Hypotonie und Tod. Führen Sie bei Patientinnen, die Benicar 20 mg während der Schwangerschaft einnehmen, serielle Ultraschalluntersuchungen durch, um das intraamniotische Milieu zu beurteilen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat.
Beobachten Sie Säuglinge, die Benicar 40 mg in der Gebärmutter ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie. Bei Neugeborenen mit einer Vorgeschichte von Benicar-Exposition in utero, wenn Oligurie oder Hypotonie auftritt, ergreifen Sie Maßnahmen, um einen angemessenen Blutdruck und eine ausreichende Nierenperfusion aufrechtzuerhalten. Austauschtransfusionen oder Dialyse können erforderlich sein, um Hypotonie umzukehren und die Nierenfunktion zu unterstützen.
Daten
Tierdaten
Es wurden keine teratogenen Wirkungen beobachtet, wenn Olmesartanmedoxomil trächtigen Ratten in oralen Dosen von bis zu 1000 mg/kg/Tag (das 240-Fache der maximal empfohlenen Humandosis (MRHD) auf mg/m2-Basis) oder trächtigen Kaninchen in oralen Dosen bis zu verabreicht wurde 1 mg/kg/Tag (die Hälfte der MRHD auf mg/m2-Basis; höhere Dosen konnten nicht auf Auswirkungen auf die fötale Entwicklung untersucht werden, da sie für die Weibchen tödlich waren). Bei Ratten wurden bei Dosen von ≥ 1,6 mg/kg/Tag eine signifikante Abnahme des Geburtsgewichts und der Gewichtszunahme der Jungtiere sowie Verzögerungen bei Entwicklungsmeilensteinen (verzögerte Trennung der Ohrmuscheln, Durchbruch der unteren Schneidezähne, Auftreten von Bauchhaaren, Abstieg der Hoden, und Trennung der Augenlider) und eine dosisabhängige Erhöhung der Inzidenz einer Dilatation des Nierenbeckens wurden bei Dosen ≥ 8 mg/kg/Tag beobachtet. Die Dosis ohne beobachtete Wirkung für Entwicklungstoxizität bei Ratten beträgt 0,3 mg/kg/Tag, etwa ein Zehntel der MRHD von 40 mg/Tag.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von Olmesartan in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Olmesartan wird in geringer Konzentration in die Milch säugender Ratten ausgeschieden (vgl Daten ). Wegen möglicher unerwünschter Wirkungen auf den Säugling sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen beendet oder das Medikament abgesetzt werden soll.
Daten
Das Vorhandensein von Olmesartan in der Milch wurde nach einmaliger oraler Verabreichung von 5 mg/kg [14C] Olmesartanmedoxomil an laktierende Ratten beobachtet.
Pädiatrische Verwendung
Die blutdrucksenkende Wirkung von Benicar wurde in einer randomisierten, doppelblinden klinischen Studie bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren untersucht [siehe Klinische Studien ]. Die Pharmakokinetik von Benicar wurde bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren untersucht [siehe KLINISCHE PHARMAKOLOGIE ]. Benicar 10 mg wurde im Allgemeinen von pädiatrischen Patienten gut vertragen, und das Nebenwirkungsprofil war ähnlich wie bei Erwachsenen beschrieben.
Benicar 20 mg hat sich bei Kindern unter 6 Jahren bei Bluthochdruck nicht als wirksam erwiesen.
Die Anwendung von Benicar bei Kindern WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Das Renin-Angiotensin-Aldosteron-System (RAAS) spielt eine entscheidende Rolle bei der Nierenentwicklung. Es wurde gezeigt, dass die RAAS-Blockade bei sehr jungen Mäusen zu einer abnormalen Nierenentwicklung führt. Die Verabreichung von Arzneimitteln, die direkt auf das Renin-Angiotensin-Aldosteron-System (RAAS) wirken, kann die normale Nierenentwicklung verändern.
Geriatrische Verwendung
Von der Gesamtzahl der Bluthochdruckpatienten, die Benicar in klinischen Studien erhielten, waren mehr als 20 % 65 Jahre und älter, während mehr als 5 % 75 Jahre und älter waren. Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen älteren Patienten und jüngeren Patienten beobachtet. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Bei Patienten mit mittelschwerer Leberfunktionsstörung wurden im Vergleich zu entsprechenden Kontrollen Anstiege von AUC0-∞ und Cmax beobachtet, mit einem Anstieg der AUC von etwa 60 %. Bei Patienten mit mäßiger bis ausgeprägter Leberfunktionsstörung wird keine anfängliche Dosisanpassung empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Patienten mit Niereninsuffizienz haben erhöhte Serumkonzentrationen von Olmesartan im Vergleich zu Patienten mit normaler Nierenfunktion. Nach wiederholter Gabe wurde die AUC bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Schwarze Patienten
Die blutdrucksenkende Wirkung von Benicar 10 mg war bei Patienten mit schwarzer Hautfarbe (normalerweise eine Population mit niedrigem Reninspiegel) geringer, wie dies bei ACE-Hemmern, Betablockern und anderen Angiotensinrezeptorblockern beobachtet wurde.
ÜBERDOSIS
Es liegen begrenzte Daten zur Überdosierung beim Menschen vor. Die wahrscheinlichsten Manifestationen einer Überdosierung wären Hypotonie und Tachykardie; Eine Bradykardie kann auftreten, wenn eine parasympathische (vagale) Stimulation auftritt. Wenn eine symptomatische Hypotonie auftritt, ist eine unterstützende Behandlung einzuleiten. Die Dialysierbarkeit von Olmesartan ist nicht bekannt.
KONTRAINDIKATIONEN
Verabreichen Sie Aliskiren nicht gleichzeitig mit Benicar 20 mg bei Patienten mit Diabetes [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Angiotensin II wird aus Angiotensin I in einer durch das Angiotensin-Converting-Enzym (ACE, Kininase II) katalysierten Reaktion gebildet. Angiotensin II ist der wichtigste blutdruckerhöhende Wirkstoff des Renin-Angiotensin-Systems mit Effekten wie Vasokonstriktion, Stimulierung der Synthese und Freisetzung von Aldosteron, Herzstimulation und renale Reabsorption von Natrium. Olmesartan blockiert die vasokonstriktorischen Wirkungen von Angiotensin II, indem es selektiv die Bindung von Angiotensin II an den AT1-Rezeptor in der glatten Gefäßmuskulatur blockiert. Seine Wirkung ist daher unabhängig von den Wegen der Angiotensin-II-Synthese.
Ein AT2-Rezeptor wird auch in vielen Geweben gefunden, aber es ist nicht bekannt, dass dieser Rezeptor mit der kardiovaskulären Homöostase assoziiert ist. Olmesartan hat eine mehr als 12.500-fach höhere Affinität zum AT1-Rezeptor als zum AT2-Rezeptor.
Die Blockade des Renin-Angiotensin-Systems mit ACE-Hemmern, die die Biosynthese von Angiotensin II aus Angiotensin I hemmen, ist ein Mechanismus vieler Arzneimittel, die zur Behandlung von Bluthochdruck eingesetzt werden. ACE-Hemmer hemmen auch den Abbau von Bradykinin, eine Reaktion, die ebenfalls durch ACE katalysiert wird. Da Olmesartanmedoxomil ACE (Kininase II) nicht hemmt, hat es keinen Einfluss auf die Reaktion auf Bradykinin. Ob dieser Unterschied klinische Relevanz hat, ist noch nicht bekannt.
Die Blockade des Angiotensin-II-Rezeptors hemmt die negative regulatorische Rückkopplung von Angiotensin II auf die Reninsekretion, aber die daraus resultierende erhöhte Plasma-Renin-Aktivität und die zirkulierenden Angiotensin-II-Spiegel überwinden nicht die Wirkung von Olmesartan auf den Blutdruck.
Pharmakodynamik
Benicar-Dosen von 2,5 mg bis 40 mg hemmen die pressorische Wirkung einer Angiotensin-I-Infusion. Die Dauer der Hemmwirkung war dosisabhängig, wobei Benicar-Dosen > 40 mg nach 24 Stunden > 90 % Hemmung bewirkten.
Die Plasmakonzentrationen von Angiotensin I und Angiotensin II sowie die Plasma-Renin-Aktivität (PRA) steigen nach einmaliger und wiederholter Verabreichung von Benicar 10 mg an gesunde Probanden und Bluthochdruckpatienten. Die wiederholte Verabreichung von bis zu 80 mg Benicar hatte einen minimalen Einfluss auf die Aldosteronspiegel und keine Auswirkung auf das Serumkalium.
Pharmakokinetik
Absorption
Olmesartanmedoxomil wird während der Resorption aus dem Gastrointestinaltrakt schnell und vollständig durch Esterhydrolyse zu Olmesartan bioaktiviert.
Benicar-Tabletten und die aus Benicar-Tabletten hergestellte Suspensionsformulierung sind bioäquivalent [vgl DOSIERUNG UND ANWENDUNG ].
Die absolute Bioverfügbarkeit von Olmesartan beträgt etwa 26 %. Nach oraler Gabe wird die maximale Plasmakonzentration (Cmax) von Olmesartan nach 1 bis 2 Stunden erreicht. Nahrungsmittel haben keinen Einfluss auf die Bioverfügbarkeit von Olmesartan. Benicar kann mit oder ohne Nahrung verabreicht werden.
Verteilung
Das Verteilungsvolumen von Olmesartan beträgt etwa 17 l. Olmesartan wird stark an Plasmaproteine gebunden (99 %) und dringt nicht in rote Blutkörperchen ein. Die Proteinbindung ist bei Olmesartan-Plasmakonzentrationen, die weit über dem Bereich liegen, der mit empfohlenen Dosen erreicht wird, konstant.
Bei Ratten passierte Olmesartan die Blut-Hirn-Schranke nur schlecht, wenn überhaupt. Olmesartan passierte bei Ratten die Plazentaschranke und wurde auf den Fötus verteilt. Olmesartan wurde bei Ratten in geringen Mengen in die Milch abgegeben.
Stoffwechsel und Ausscheidung
Nach der raschen und vollständigen Umwandlung von Olmesartanmedoxomil in Olmesartan während der Resorption findet praktisch keine weitere Metabolisierung von Olmesartan statt. Die Gesamtplasmaclearance von Olmesartan beträgt 1,3 l/h, die renale Clearance 0,6 l/h. Ungefähr 35 % bis 50 % der absorbierten Dosis werden im Urin wiedergefunden, während der Rest über die Galle mit dem Stuhl ausgeschieden wird.
Olmesartan scheint biphasisch mit einer terminalen Eliminationshalbwertszeit von etwa 13 Stunden ausgeschieden zu werden. Olmesartan zeigt nach oraler Einzelgabe von bis zu 320 mg und nach oraler Mehrfachgabe von bis zu 80 mg eine lineare Pharmakokinetik. Steady-State-Spiegel von Olmesartan werden innerhalb von 3 bis 5 Tagen erreicht und bei einmal täglicher Gabe tritt keine Kumulation im Plasma auf.
Spezifische Populationen
Geriatrische Patienten
Die Pharmakokinetik von Olmesartan wurde bei älteren Patienten (≥65 Jahre) untersucht. Insgesamt waren die maximalen Plasmakonzentrationen von Olmesartan bei jungen Erwachsenen und älteren Menschen ähnlich. Bei älteren Patienten wurde bei wiederholter Gabe eine geringe Akkumulation von Olmesartan beobachtet; AUCss, τ war bei älteren Patienten um 33 % höher, was einer etwa 30 %igen Verringerung der CLR entspricht [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrische Patienten
Die Pharmakokinetik von Olmesartan wurde bei pädiatrischen Patienten mit Hypertonie im Alter von 1 bis 16 Jahren untersucht. Die Clearance von Olmesartan bei pädiatrischen Patienten war bei Anpassung an das Körpergewicht ähnlich wie bei erwachsenen Patienten [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Die Pharmakokinetik von Olmesartan wurde bei pädiatrischen Patienten unter 1 Jahr nicht untersucht [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Männliche und weibliche Patienten
Es wurden geringfügige Unterschiede in der Pharmakokinetik von Olmesartan bei Frauen im Vergleich zu Männern beobachtet. AUC und Cmax waren bei Frauen um 10-15 % höher als bei Männern.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit mittelschwerer Leberfunktionsstörung wurden im Vergleich zu entsprechenden Kontrollen Anstiege von AUC0-∞ und Cmax beobachtet, wobei die AUC um etwa 60 % zunahm [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit Niereninsuffizienz waren die Serumkonzentrationen von Olmesartan im Vergleich zu Patienten mit normaler Nierenfunktion erhöht. Nach wiederholter Gabe wurde die AUC bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Arzneimittelwechselwirkungsstudien
Gallensäure-Sequestriermittel Colesevelam
Die gleichzeitige Anwendung von 40 mg Olmesartanmedoxomil und 3750 mg Colesevelamhydrochlorid führte bei gesunden Probanden zu einer 28 %igen Verringerung der Cmax und einer 39 %igen Verringerung der AUC von Olmesartan. Geringere Wirkungen, 4 % bzw. 15 % Verringerung von Cmax und AUC, wurden beobachtet, wenn Olmesartanmedoxomil 4 Stunden vor Colesevelamhydrochlorid verabreicht wurde [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere Studien
In Studien, in denen Olmesartanmedoxomil zusammen mit Digoxin oder Warfarin an gesunde Probanden verabreicht wurde, wurden keine signifikanten Arzneimittelwechselwirkungen berichtet.
Die Bioverfügbarkeit von Olmesartan wurde durch die gleichzeitige Verabreichung von Antazida [Al(OH)3/Mg(OH)2] nicht signifikant verändert.
Olmesartanmedoxomil wird nicht durch das Cytochrom-P450-System metabolisiert und hat keine Auswirkungen auf P450-Enzyme; daher sind Wechselwirkungen mit Arzneimitteln, die diese Enzyme hemmen, induzieren oder durch diese metabolisiert werden, nicht zu erwarten.
Klinische Studien
Bluthochdruck bei Erwachsenen
Die antihypertensive Wirkung von Benicar 10 mg wurde in sieben Placebo-kontrollierten Studien mit Dosen von 2,5 mg bis 80 mg über 6 bis 12 Wochen nachgewiesen, die jeweils eine statistisch signifikante Senkung des maximalen und minimalen Blutdrucks zeigten. Insgesamt wurden 2693 Patienten (2145 Benicar; 548 Placebo) mit essentieller Hypertonie untersucht. Benicar 40 mg einmal täglich senkte den diastolischen und systolischen Blutdruck. Die Reaktion war dosisabhängig, wie in der folgenden Grafik dargestellt. Eine Benicar-Dosis von 20 mg täglich bewirkt eine Senkung des Blutdrucks (BD) im Sitzen um ca. 10/6 mmHg gegenüber Placebo und eine Dosis von 40 mg täglich eine Senkung des Blutdrucks im Sitzen um ca. 12/7 mmHg gegenüber Placebo. Benicar 10 mg-Dosen von mehr als 40 mg hatten wenig zusätzliche Wirkung. Die antihypertensive Wirkung trat innerhalb von 1 Woche ein und war nach 2 Wochen weitgehend manifest.
Benicar 40 mg Dosis-Wirkungs-Beziehung Placebo-korrigierte Senkung des Blutdrucks (mmHg) 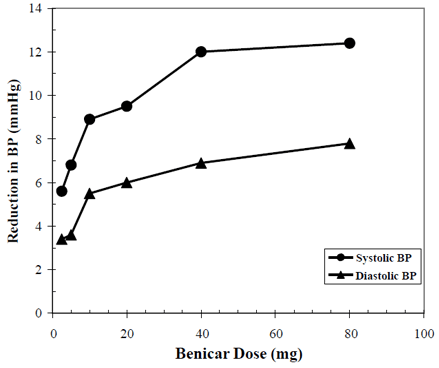
Die obigen Daten stammen aus sieben placebokontrollierten Studien (2145 Benicar-Patienten, 548 Placebo-Patienten). Die blutdrucksenkende Wirkung hielt bei einmal täglicher Gabe von Benicar über den Zeitraum von 24 Stunden an, mit Tal-zu-Spitzen-Verhältnissen für die systolische und diastolische Reaktion zwischen 60 und 80 %.
Die blutdrucksenkende Wirkung von Benicar 40 mg mit und ohne Hydrochlorothiazid hielt bei den behandelten Patienten bis zu 1 Jahr an. Es gab keine Hinweise auf Tachyphylaxie während der Langzeitbehandlung mit Benicar oder Rebound-Effekt nach abruptem Absetzen von Olmesartanmedoxomil nach 1-jähriger Behandlung.
Die blutdrucksenkende Wirkung von Benicar war bei Männern und Frauen und bei Patienten älter und jünger als 65 Jahre ähnlich. Die Wirkung war bei Patienten mit schwarzer Hautfarbe (normalerweise eine Population mit niedrigem Reninspiegel) geringer, wie dies bei ACE-Hemmern, Betablockern und anderen Angiotensinrezeptorblockern beobachtet wurde. Benicar hatte zusätzlich zu Hydrochlorothiazid eine blutdrucksenkende Wirkung.
Es gibt keine Studien mit Benicar, die eine Verringerung des kardiovaskulären Risikos bei Patienten mit Bluthochdruck belegen, aber mindestens ein pharmakologisch ähnliches Medikament hat solche Vorteile gezeigt.
Pädiatrischer Bluthochdruck
Die blutdrucksenkende Wirkung von Benicar 40 mg bei Kindern und Jugendlichen wurde in einer randomisierten Doppelblindstudie mit 302 Bluthochdruckpatienten im Alter von 6 bis 16 Jahren untersucht. Die Studienpopulation bestand aus einer rein schwarzen Kohorte von 112 Patienten und einer gemischtrassigen Kohorte von 190 Patienten, darunter 38 schwarze Patienten. Die Ätiologie der Hypertonie war überwiegend eine essentielle Hypertonie (87 % der schwarzen Kohorte und 67 % der gemischten Kohorte). Patienten mit einem Körpergewicht von 20 bis
In derselben Studie erhielten 59 Patienten im Alter von 1 bis 5 Jahren mit einem Körpergewicht von ≥ 5 kg 0,3 mg/kg Benicar 10 mg einmal täglich für drei Wochen in einer offenen Phase und wurden dann randomisiert einer Doppelblindbehandlung mit Benicar oder Placebo zugeteilt Phase. Am Ende der zweiten Woche des Absetzens war der mittlere systolische/diastolische Blutdruck am Talspiegel in der randomisierten Benicar-Gruppe um 3/3 mmHg niedriger; dieser Blutdruckunterschied war statistisch nicht signifikant (95 % KI -2 bis 7/-1 bis 7).
INFORMATIONEN ZUM PATIENTEN
Schwangerschaft
Informieren Sie Patientinnen im gebärfähigen Alter über die Folgen einer Exposition gegenüber Benicar 20 mg während der Schwangerschaft. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Weisen Sie die Patientinnen an, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Weisen Sie stillende Frauen darauf hin, während der Behandlung mit BENICAR nicht zu stillen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hyperkaliämie
Weisen Sie die Patienten darauf hin, keine kaliumhaltigen Kaliumpräparate oder kaliumhaltigen Salzersatzmittel ohne Rücksprache mit ihrem Arzt zu verwenden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].