Casodex 50mg Bicalutamide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Casodex und wie wird es angewendet?
Casodex ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Prostatakrebs. Casodex 50 mg kann allein oder mit anderen Medikamenten verwendet werden.
Casodex 50 mg gehört zu einer Klasse von Medikamenten namens Antineoplastika, Antiandrogen; CYP3A4-Hemmer, moderat.
Es ist nicht bekannt, ob Casodex bei Kindern sicher und wirksam ist.
Was sind die möglichen Nebenwirkungen von Casodex?
Casodex kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Casodex 50 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Casodex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
CASODEX® (Bicalutamid)-Tabletten enthalten 50 mg Bicalutamid, einen nicht-steroidalen Androgenrezeptor-Inhibitor ohne andere bekannte endokrine Aktivität. Der chemische Name ist Propanamid, N [4 cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methyl-,(+-). Die Struktur- und Summenformeln lauten:
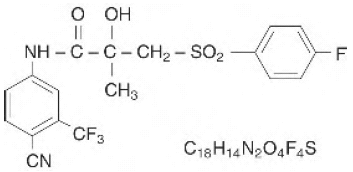
Bicalutamid hat ein Molekulargewicht von 430,37. Die pKa' beträgt etwa 12. Bicalutamid ist ein feines weißes bis cremefarbenes Pulver, das in Wasser bei 37 °C praktisch unlöslich ist (5 mg pro 1000 ml), in Chloroform und absolutem Ethanol schwer löslich, in Methanol schwer löslich und in Aceton löslich ist Tetrahydrofuran.
CASODEX ist ein Racemat, dessen antiandrogene Aktivität fast ausschließlich vom R-Enantiomer von Bicalutamid ausgeübt wird; das S-Enantiomer ist im Wesentlichen inaktiv.
Die inaktiven Bestandteile von CASODEX 50 mg Tabletten sind Lactose, Magnesiumstearat, Hypromellose, Polyethylenglykol, Polyvidon, Natriumstärkeglykolat und Titandioxid.
INDIKATIONEN
CASODEX 50 mg täglich ist angezeigt zur Verwendung in Kombinationstherapie mit einem luteinisierenden Hormon-Releasing-Hormon (LHRH)-Analogon zur Behandlung von metastasierendem Prostatakarzinom im Stadium D2.
CASODEX 150 mg täglich ist nicht zugelassen zur alleinigen Anwendung oder zusammen mit anderen Behandlungen [vgl Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Empfohlene Dosis und Zeitplan
Die empfohlene Dosis für die Therapie mit CASODEX 50 mg in Kombination mit einem LHRH-Analogon ist eine 50-mg-Tablette einmal täglich (morgens oder abends) mit oder ohne Nahrung. Es wird empfohlen, CASODEX 50 mg jeden Tag zur gleichen Zeit einzunehmen. Die Behandlung mit CASODEX sollte gleichzeitig mit der Behandlung mit einem LHRH-Analogon begonnen werden. Wenn eine Dosis CASODEX 50 mg ausgelassen wurde, nehmen Sie die nächste Dosis zum vorgesehenen Zeitpunkt ein. Nehmen Sie die vergessene Dosis nicht ein und verdoppeln Sie die nächste Dosis nicht.
Dosisanpassung bei eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Dosisanpassung bei eingeschränkter Leberfunktion
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung ist keine Dosisanpassung erforderlich. Bei Patienten mit schwerer Leberfunktionsstörung (n = 4) war trotz einer 76 %igen Verlängerung der Halbwertszeit (5,9 bzw. 10,4 Tage für normale und beeinträchtigte Patienten) des aktiven Enantiomers von Bicalutamid keine Dosisanpassung erforderlich [ sehen Verwendung in bestimmten Bevölkerungsgruppen ].
WIE GELIEFERT
Darreichungsformen und Stärke
CASODEX® (Bicalutamid) 50 mg Tabletten zur oralen Verabreichung.
Weiße Filmtabletten (auf einer Seite mit „CDX50“ und auf der Rückseite mit dem „CASODEX-Logo“ gekennzeichnet) werden in Einzeldosisflaschen mit 30 Tabletten geliefert (0310-0705-30).
Lagerung und Handhabung
Bei kontrollierter Raumtemperatur von 20°-25°C (68°-77°F) lagern.
Hergestellt für: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Überarbeitet: März 2017.
NEBENWIRKUNGEN
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Erfahrung mit klinischen Studien
Bei Patienten mit fortgeschrittenem Prostatakrebs, die mit CASODEX 50 mg in Kombination mit einem LHRH-Analogon behandelt wurden, waren Hitzewallungen (53 %) die häufigste Nebenwirkung.
In der multizentrischen, doppelblinden, kontrollierten klinischen Studie zum Vergleich von CASODEX 50 mg einmal täglich mit Flutamid 250 mg dreimal täglich, jeweils in Kombination mit einem LHRH-Analogon, traten die folgenden Nebenwirkungen mit einer Inzidenz von 5 % oder mehr unabhängig auf der Kausalität, wurden berichtet.
Andere Nebenwirkungen (mehr als oder gleich 2 %, aber weniger als 5 %), die in der CASODEX-LHRH-Analoga-Behandlungsgruppe berichtet wurden, sind unten nach Körpersystem aufgelistet und sind innerhalb jedes Körpersystems unabhängig von der Kausalität mit abnehmender Häufigkeit aufgeführt.
Körper als Ganzes: Neubildung; Nackenschmerzen; Fieber; Schüttelfrost; Sepsis; Hernie; Zyste
Herz-Kreislauf: Angina pectoris; Stauungsinsuffizienz; Myokardinfarkt; Herzstillstand; Koronararterienstörung; Synkope
Verdauungs: Melena; rektale Blutung; Trockener Mund; Dysphagie; Magen-Darm-Störung; parodontaler Abszess; Magen-Darm-Karzinom
Stoffwechsel und Ernährung: Ödem; Brötchen erhöht; Kreatinin erhöht; Austrocknung; Gicht; Hypercholesterinämie
Bewegungsapparat: Myalgie; Beinkrämpfe
Nervös: Hypertonie; Verwirrtheit; Schläfrigkeit; Libido verringert; Neuropathie; Nervosität
Atmung: Lungenerkrankung; Asthma; Nasenbluten; Sinusitis
Haut und Anhängsel: Trockene Haut; Alopezie; Juckreiz; Herpes zoster; Hautkarzinom; Hautkrankheit
Besondere Sinne: Katarakt angegeben
Urogenital: Dysurie; Ich muss dringend Urinieren; Hydronephrose; Störung der Harnwege
Abnormale Labortestwerte:
Laboranomalien einschließlich: erhöhte AST, ALT, Bilirubin, BUN und Kreatinin; und verminderte Hämoglobin- und Leukozytenzahl, wurden sowohl bei mit CASODEX-LHRH-Analoga als auch mit Flutamid-LHRH-Analoga behandelten Patienten berichtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CASODEX nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Atemwegserkrankungen: Interstitielle Lungenerkrankung (einige mit tödlichem Ausgang), einschließlich interstitieller Pneumonitis und Lungenfibrose, am häufigsten bei Dosen über 50 mg.
Erkrankungen der Haut und des Unterhautzellgewebes: Lichtempfindlichkeit
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Klinische Studien haben keine Arzneimittelwechselwirkungen zwischen Bicalutamid und LHRH-Analoga (Goserelin oder Leuprolid) gezeigt. Es gibt keine Hinweise darauf, dass Bicalutamid hepatische Enzyme induziert.
In-vitro-Studien haben gezeigt, dass R-Bicalutamid ein Inhibitor von CYP 3A4 mit geringerer inhibitorischer Wirkung auf die Aktivität von CYP 2C9, 2C19 und 2D6 ist. Klinische Studien haben gezeigt, dass bei gleichzeitiger Anwendung von CASODEX die mittleren Midazolam-Spiegel (ein CYP 3A4-Substrat) um das 1,5-Fache (für Cmax) und 1,9-Fache (für AUC) ansteigen können. Daher ist Vorsicht geboten, wenn CASODEX 50 mg zusammen mit CYP 3A4-Substraten verabreicht wird.
In-vitro-Studien zur Proteinbindung haben gezeigt, dass Bicalutamid Cumarin-Antikoagulantien von den Bindungsstellen verdrängen kann. Die Prothrombinzeiten sollten bei Patienten, die bereits Cumarin-Antikoagulanzien erhalten und mit CASODEX 50 mg begonnen werden, engmaschig überwacht werden, und es kann eine Anpassung der Antikoagulans-Dosis erforderlich sein.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Hepatitis
Todesfälle oder Krankenhauseinweisungen aufgrund schwerer Leberschäden (Leberversagen) wurden nach Markteinführung im Zusammenhang mit der Anwendung von CASODEX berichtet. Hepatotoxizität trat in diesen Berichten im Allgemeinen innerhalb der ersten drei bis vier Behandlungsmonate auf. Hepatitis oder deutliche Erhöhungen der Leberenzyme, die zum Absetzen des Arzneimittels führten, traten in kontrollierten klinischen Studien bei etwa 1 % der CASODEX-Patienten auf.
Die Serum-Transaminase-Spiegel sollten vor Beginn der Behandlung mit CASODEX, während der ersten vier Behandlungsmonate in regelmäßigen Abständen und danach regelmäßig gemessen werden. Wenn klinische Symptome oder Anzeichen auftreten, die auf eine Leberfunktionsstörung hindeuten (z. B. Übelkeit, Erbrechen, Bauchschmerzen, Müdigkeit, Anorexie, „grippeähnliche“ Symptome, dunkler Urin, Gelbsucht oder Druckschmerz im rechten oberen Quadranten), werden die Serumtransaminasen, insbesondere die Serum-ALT, sollte sofort gemessen werden. Wenn ein Patient zu irgendeinem Zeitpunkt Gelbsucht hat oder seine ALT über das Zweifache der oberen Normgrenze ansteigt, sollte CASODEX sofort abgesetzt und die Leberfunktion engmaschig überwacht werden.
Gynäkomastie und Brustschmerzen
In klinischen Studien mit CASODEX 150 mg als Monotherapie bei Prostatakrebs, Gynäkomastie und Brustschmerzen wurde bei bis zu 38 % bzw. 39 % der Patientinnen berichtet.
Glukosetoleranz
Bei Männern, die LHRH-Agonisten erhielten, wurde eine Verringerung der Glukosetoleranz beobachtet. Dies kann sich bei Patienten mit vorbestehendem Diabetes als Diabetes oder Verlust der glykämischen Kontrolle manifestieren. Daher sollte bei Patienten, die CASODEX 50 mg in Kombination mit LHRH-Agonisten erhalten, eine Überwachung des Blutzuckers erwogen werden.
Labortests
Regelmäßige Messungen des prostataspezifischen Antigens (PSA) im Serum können bei der Überwachung des Ansprechens des Patienten hilfreich sein. Wenn die PSA-Spiegel während der Therapie mit CASODEX 50 mg ansteigen, sollte der Patient auf klinische Progression untersucht werden. Bei Patienten mit objektiver Krankheitsprogression zusammen mit einem erhöhten PSA-Wert kann eine behandlungsfreie Zeit mit Antiandrogen unter Beibehaltung des LHRH-Analogons in Erwägung gezogen werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Dosis und Zeitplan
Informieren Sie die Patienten darüber, dass die Therapie mit CASODEX 50 mg und dem LHRH-Analogon gleichzeitig begonnen werden sollte und dass sie die Einnahme dieser Medikamente nicht ohne Rücksprache mit ihrem Arzt unterbrechen oder beenden sollten [siehe DOSIERUNG UND ANWENDUNG ].
Hepatitis
Informieren Sie die Patienten darüber, dass CASODEX Hepatitis verursachen kann, die zu Leberversagen und Tod führen kann. Weisen Sie die Patienten darauf hin, dass die Leberfunktionstests während der Behandlung regelmäßig überwacht und Anzeichen und Symptome einer Hepatitis gemeldet werden sollten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Glukosetoleranz
Informieren Sie die Patienten darüber, dass bei Patienten mit vorbestehendem Diabetes während der Behandlung mit LHRH-Agonisten über Diabetes oder Verlust der glykämischen Kontrolle berichtet wurde. Daher sollte bei Patienten, die CASODEX in Kombination mit LHRH-Agonisten erhalten, eine Überwachung des Blutzuckers erwogen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schläfrigkeit
Während der Behandlung mit CASODEX wurde über Somnolenz berichtet. Weisen Sie Patienten, bei denen dieses Symptom auftritt, an, beim Autofahren oder Bedienen von Maschinen vorsichtig zu sein [siehe NEBENWIRKUNGEN ].
Lichtempfindlichkeit
Informieren Sie die Patienten darüber, dass während der Behandlung mit CASODEX Fälle von Lichtempfindlichkeit berichtet wurden und dass sie eine direkte Exposition gegenüber übermäßigem Sonnenlicht oder UV-Licht vermeiden sollten. Die Verwendung von Sonnenschutzmitteln sollte in Betracht gezogen werden [siehe NEBENWIRKUNGEN ].
Empfängnisverhütung und Fruchtbarkeit
Weisen Sie männliche Patienten mit gebärfähigen Partnerinnen an, während der Behandlung und für 130 Tage nach der letzten Dosis von CASODEX 50 mg eine wirksame Verhütungsmethode anzuwenden. Weisen Sie männliche Patienten darauf hin, dass CASODEX die Fruchtbarkeit beeinträchtigen kann [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden zweijährige orale Karzinogenitätsstudien an männlichen und weiblichen Ratten und Mäusen mit Dosen von 5, 15 oder 75 mg/kg/Tag Bicalutamid durchgeführt. Eine Reihe von Wirkungen auf Tumorzielorgane wurden identifiziert und der Antiandrogenität von Bicalutamid zugeschrieben, nämlich testikuläre gutartige interstitielle (Leydig)-Zelltumoren bei männlichen Ratten bei allen Dosierungen (die Steady-State-Plasmakonzentration bei 5 mg/kg/Tag Dosis beträgt etwa das 0,7-fache der Exposition beim Menschen bei der empfohlenen Dosis) und Uterus-Adenokarzinom bei weiblichen Ratten bei 75 mg/kg/Tag (etwa das 1,5-fache der Exposition beim Menschen bei der empfohlenen Dosis). Es gibt keine Hinweise auf eine Leydig-Zell-Hyperplasie bei Patienten; Uterustumoren sind für die angegebene Patientenpopulation nicht relevant.
Eine geringfügige Erhöhung der Inzidenz von hepatozellulären Karzinomen bei männlichen Mäusen, die 75 mg/kg/Tag Bicalutamid erhielten (ungefähr das 4-fache der humanen Exposition bei der empfohlenen Dosis), und eine erhöhte Inzidenz von gutartigen Adenomen der Schilddrüsenfollikelzellen bei Ratten, die 5 mg/kg erhielten /Tag (ungefähr das 0,7-fache der menschlichen Exposition bei der empfohlenen Dosis) und darüber wurden aufgezeichnet. Diese neoplastischen Veränderungen waren Progressionen von nicht-neoplastischen Veränderungen im Zusammenhang mit der hepatischen Enzyminduktion, die in Toxizitätsstudien an Tieren beobachtet wurden. Eine Enzyminduktion wurde nach Verabreichung von Bicalutamid beim Menschen nicht beobachtet. Es gab keine tumorerzeugenden Wirkungen, die auf eine genotoxische Karzinogenese hindeuten.
Eine umfassende Reihe von In-vitro- und In-vivo-Genotoxizitätstests (Hefe-Genumwandlung, Ames, E. coli, CHO/HGPRT, zytogenetische Tests an humanen Lymphozyten, Maus-Mikronukleus und zytogenetische Tests an Rattenknochenmark) hat gezeigt, dass Bicalutamid keine genotoxische Aktivität aufweist .
In toxikologischen Studien mit wiederholter Gabe wurde bei allen untersuchten Spezies eine Atrophie der Samenkanälchen der Hoden beobachtet, was ein vorhergesagter Klasseneffekt bei Antiandrogenen ist. In der 6- und 12-monatigen Studie an Ratten wurde eine Hodenatrophie bei etwa dem 2-Fachen der humantherapeutischen Exposition bei der empfohlenen Dosis beobachtet. In der 12-monatigen Studie mit Hunden wurde die Inzidenz von Hodenatrophie bei etwa dem 7-Fachen der humantherapeutischen Exposition bei der empfohlenen Dosis beobachtet. Bei männlichen Ratten, denen 250 mg/kg/Tag verabreicht wurden (ungefähr das Zweifache der beim Menschen empfohlenen Dosis), waren das präkoitale Intervall und die Zeit bis zur erfolgreichen Paarung bei der ersten Paarung verlängert, aber es wurden keine Auswirkungen auf die Fertilität nach erfolgreicher Paarung beobachtet. Diese Wirkungen waren 7 Wochen nach Ende einer 11-wöchigen Dosierungsperiode rückgängig gemacht.
Weibliche Ratten, die mit 1, 10 und 250 mg/kg/Tag (weniger als das Zweifache der beim Menschen empfohlenen Dosis) dosiert wurden, zeigten eine erhöhte Unregelmäßigkeit des Östruszyklus, aber es gab keine Auswirkung auf die Fertilität.
In einer peri- und postnatalen Entwicklungsstudie wiesen weibliche Nachkommen von Ratten, die Dosen von 10 mg/kg/Tag (ca. Die Verabreichung von Bicalutamid an schwangere Frauen führte bei Dosen von 10 mg/kg/Tag (ungefähr das 0,7-fache der beim Menschen empfohlenen Dosis) und darüber zu einer Verweiblichung der männlichen Nachkommen, was zu Hypospadie führte. Betroffene männliche Nachkommen waren ebenfalls impotent.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
CASODEX ist für die Anwendung bei schwangeren Frauen kontraindiziert, da es den Fötus schädigen kann. CASODEX 50 mg ist nicht für die Anwendung bei Frauen angezeigt. Es liegen keine Humandaten zur Anwendung von CASODEX 50 mg bei Schwangeren vor. In Reproduktionsstudien an Tieren verursachte die orale Verabreichung von Bicalutamid an trächtige Ratten während der Organogenese bei Expositionen, die etwa dem 0,7- bis 2-Fachen der beim Menschen empfohlenen Dosis entsprachen, eine abnormale Entwicklung der Fortpflanzungsorgane bei männlichen Föten (siehe Daten ).
Daten
Tierdaten
In einer Studie zur embryofetalen Entwicklung bei trächtigen Ratten, denen während der Organogenese vom 6. bis 15. Trächtigkeitstag eine Dosis verabreicht wurde, wiesen männliche Föten bei Dosen von 10 mg/kg/Tag und mehr (etwa das 0,7- bis 2-fache der Exposition beim Menschen) eine verringerte anogenitale Distanz auf die empfohlene Dosis).
In einer prä- und postnatalen Entwicklungsstudie wurde weiblichen Ratten vom 7. bis 16. Trächtigkeitstag eine Dosis verabreicht, und man ließ ihre Nachkommen bis zur Entwöhnung werfen und aufziehen . Bei männlichen Nachkommen von Ratten, die Dosen von 10 mg/kg/Tag (etwa das 0,7-fache der beim Menschen empfohlenen Dosis) und darüber erhielten, wurde eine verringerte anogenitale Distanz beobachtet.
In einer peri- und postnatalen Entwicklungsstudie erhielten weibliche Ratten vom 16. Tag der Trächtigkeit bis zum 22. Laktationstag eine Dosis und durften ihre Nachkommen bis zur Entwöhnung werfen und aufziehen. Überleben und Gewicht der Nachkommen während der Laktation waren bei Würfen von mütterlichen Ratten, die Dosen von 250 mg/kg/Tag (ungefähr das Zweifache der beim Menschen empfohlenen Dosis) erhielten, reduziert. Bei männlichen Nachkommen von Ratten, die Dosen von 10 mg/kg/Tag (ungefähr das 0,7-Fache der beim Menschen empfohlenen Dosis) und darüber erhielten, wurde beobachtet, dass sie einen verringerten anogenitalen Abstand, kleinere sekundäre Geschlechtsorgane, Kryptorchismus und Hypospadie aufwiesen, was zu einer Unfähigkeit zur Paarung führte und ihre Partnerinnen schwängern. Weibliche Nachkommen von Ratten, die Dosen von 10 mg/kg/Tag (ungefähr das 0,7-fache der humantherapeutischen Exposition bei der empfohlenen Dosis) und darüber erhielten, zeigten verringerte Trächtigkeitsraten.
Stillzeit
Zusammenfassung der Risiken
CASODEX 50 mg ist nicht für die Anwendung bei schwangeren Frauen angezeigt. Es liegen keine Informationen zum Vorhandensein von Bicalutamid in der Muttermilch oder zu den Auswirkungen auf den gestillten Säugling oder die Milchproduktion vor. Bicalutamid wurde in Rattenmilch nachgewiesen.
Weibchen und Männchen mit reproduktivem Potenzial
Empfängnisverhütung
Männchen
Eine Antiandrogentherapie kann morphologische Veränderungen in Spermien verursachen [siehe Nichtklinische Toxikologie ]. Raten Sie männlichen Patienten mit reproduktionsfähigen Partnerinnen auf der Grundlage von Ergebnissen in Reproduktionsstudien an Tieren und ihres Wirkungsmechanismus, während der Behandlung und für 130 Tage nach der letzten CASODEX-Dosis eine wirksame Empfängnisverhütung anzuwenden [siehe Schwangerschaft und KLINISCHE PHARMAKOLOGIE ].
Unfruchtbarkeit
Männchen

Basierend auf Tierversuchen kann CASODEX 50 mg zu einer Hemmung der Spermatogenese führen und die Fruchtbarkeit bei gebärfähigen Männern beeinträchtigen. Die Langzeitwirkung von CASODEX 50 mg auf die männliche Fertilität wurde nicht untersucht [siehe Nichtklinische Toxikologie ].
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von CASODEX 50 mg bei pädiatrischen Patienten wurde nicht nachgewiesen.
CASODEX (Bicalutamid) Schmelztablette wurde in Kombination mit ARIMIDEX (Anastrozol) Schmelztablette in einer offenen, nicht vergleichenden, multizentrischen Studie untersucht, in der die Wirksamkeit und Sicherheit dieses Kombinationsschemas über 12 Monate bei der Behandlung von Gonadotropin unabhängig untersucht wurde verfrühte Pubertät bei Jungen mit familiär bedingter verfrühter Pubertät, auch bekannt als Testotoxikose. Patienten wurden in die Studie aufgenommen, wenn sie ein Ausgangsalter von ≥ 2 Jahren hatten und eine Testotoxikose-Diagnose basierend auf klinischen Merkmalen wie fortschreitende vorzeitige Pubertät, symmetrische Hodenvergrößerung, fortgeschrittenes Knochenalter, pubertäre Testosteronspiegel im Serum, präpubertäres Muster der Gonadotropinsekretion nach a GnRH-Stimulationstest und Fehlen anderer klinischer und biochemischer Ursachen für Testosteronüberschuss. 13 der 14 eingeschlossenen Patienten schlossen die 12-monatige Kombinationsbehandlung ab (ein Patient ging für die Nachbeobachtung verloren). Wenn sich eine zentrale vorzeitige Pubertät (CPP) entwickelte, sollte ein LHRH-Analogon hinzugefügt werden. Vier Patienten wurden während der 12-monatigen Studie mit CPP diagnostiziert und erhielten eine Behandlung mit LHRH-Analoga, und 2 weitere Patienten wurden am Ende der 12 Monate diagnostiziert und erhielten anschließend eine Behandlung. Die mittleren ± SD-Eigenschaften zu Studienbeginn waren wie folgt: chronologisches Alter: 3,9 ± 1,9 Jahre; Knochenalter 8,8 ± 2,5; Verhältnis Knochenalter/chronologisches Alter: 2,06 ± 0,51; Wachstumsrate (cm/Jahr): 10,81 ± 4,22; Wachstumsraten-Standardabweichungswert (SDS): 0,41 ± 1,36.
Die CASODEX-Anfangsdosis betrug 12,5 mg. CASODEX wurde bei jedem Patienten titriert, bis die Talspiegel von R-Bicalutamid (dem aktiven Isomer von Bicalutamid) im Steady-State 5-15 µg/ml erreichten, was dem Bereich der therapeutischen Konzentrationen entspricht, die bei Erwachsenen mit Prostatakrebs nach der Verabreichung von derzeit erreicht werden zugelassene CASODEX-Dosis von 50 mg. Die tägliche Anfangsdosis von Anastrozol betrug 0,5 mg. Anastrozol wurde bei jedem Patienten unabhängig titriert, bis im Steady-State eine Estradiolkonzentration im Serum von
Die primäre Wirksamkeitsanalyse der Studie bestand darin, die Veränderung der Wachstumsrate nach 12 Behandlungsmonaten im Verhältnis zur Wachstumsrate während der ≥ 6 Monate vor Beginn der Studie zu bewerten. Die Wachstumsraten vor der Studie wurden rückwirkend ermittelt. Es gab keinen statistischen Beweis dafür, dass die Wachstumsrate während der Behandlung reduziert war. Während der Behandlung mit CASODEX/ARIMIDEX verringerte sich die mittlere Wachstumsrate (cm/Jahr) um 1,6 cm/Jahr, 95 % KI (-4,7 bis 1,5) p=0,28; die mittlere Wachstumsrate SDS verringerte sich um 0,1 SD, 95 % KI (–1,2 bis 1,0) p=0,88. Tabelle 2 zeigt beschreibende Daten für Wachstumsraten für die Gesamtpopulation und für Untergruppen, die durch die Vorgeschichte einer früheren Behandlung von Testotoxikose mit Ketoconazol, Spironolacton, Anastrozol oder anderen Aromatasehemmern definiert sind.
Die Testosteron-Gesamtkonzentrationen stiegen im Verlauf der 12-monatigen Behandlung um durchschnittlich 5 mmol/l ausgehend von einem Ausgangsmittelwert von 10 mmol/l. Bei 11 von 12 Patienten nach 12-monatiger Behandlung lagen die Östradiolkonzentrationen auf oder unter der Quantifizierungsgrenze (9,81 pmol/l). Sechs der 12 Patienten begannen die Behandlung mit einer Östradiolkonzentration unterhalb der Quantifizierungsgrenze.
Es gab keine Todesfälle, schwerwiegende unerwünschte Ereignisse oder Studienabbrüche aufgrund unerwünschter Ereignisse während der Studie. Von den 14 Patienten, die der Studienbehandlung unterzogen wurden, trat bei 13 (92,9 %) mindestens ein unerwünschtes Ereignis auf. Die am häufigsten berichteten (> 3 Patienten) Nebenwirkungen waren Gynäkomastie (7/14, 50 %), zentrale verfrühte Pubertät (6/14, 43 %), Erbrechen (5/14, 36 %), Kopfschmerzen (3/14, 21 %), Pyrexie (3/14, 21 %) und Infektionen der oberen Atemwege (3/14, 21 %). Zu den Nebenwirkungen, die von den Prüfärzten als möglicherweise im Zusammenhang mit Bicalutamid angesehen wurden, gehörten Gynäkomastie (6/14, 43 %), zentrale vorzeitige Pubertät (2/14, 14 %), Brustspannen (2/14, 14 %), Brustschmerzen (1/14, 7 %), Asthenie (1/14, 7 %), erhöhte Alanin-Aminotransferase [ALT] (1/14, 7 %), erhöhte Aspartat-Aminotransferase [AST] (1/14, 7 %) und muskuloskelettale Brustschmerzen (1 /14, 7%). Kopfschmerzen waren die einzige Nebenwirkung, die von den Prüfärzten als möglicherweise mit Anastrozol zusammenhängend angesehen wurde. Bei dem Patienten, der erhöhte ALT- und AST-Werte entwickelte, war die Erhöhung
Geriatrische Verwendung
In zwei Studien mit Patienten, die 50 oder 150 mg täglich erhielten, wurde kein signifikanter Zusammenhang zwischen dem Alter und den Steady-State-Spiegeln von Gesamt-Bicalutamid oder dem aktiven R-Enantiomer gezeigt.
Leberfunktionsstörung
CASODEX sollte bei Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung mit Vorsicht angewendet werden. CASODEX wird weitgehend von der Leber metabolisiert. Begrenzte Daten bei Patienten mit schwerer Leberfunktionsstörung deuten darauf hin, dass die Ausscheidung von CASODEX verzögert sein und zu einer weiteren Akkumulation führen könnte. Regelmäßige Leberfunktionstests sollten bei Patienten mit eingeschränkter Leberfunktion unter Langzeittherapie in Betracht gezogen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bei Patienten mit leichter bis mittelschwerer Lebererkrankung wurde kein klinisch signifikanter Unterschied in der Pharmakokinetik der beiden Enantiomere von Bicalutamid im Vergleich zu gesunden Kontrollpersonen festgestellt. Allerdings war die Halbwertszeit des R-Enantiomers bei Patienten mit schwerer Lebererkrankung (n = 4) um etwa 76 % (5,9 bzw. 10,4 Tage für normale und beeinträchtigte Patienten) erhöht.
Nierenfunktionsstörung
Eine eingeschränkte Nierenfunktion (gemessen anhand der Kreatinin-Clearance) hatte keinen signifikanten Einfluss auf die Elimination von Bicalutamid insgesamt oder des aktiven R-Enantiomers.
ÜBERDOSIS
Klinische Langzeitstudien wurden mit Dosierungen von bis zu 200 mg CASODEX 50 mg täglich durchgeführt und diese Dosierungen wurden gut vertragen. Eine Einzeldosis von CASODEX 50 mg, die zu Symptomen einer Überdosierung führt, die als lebensbedrohlich angesehen wird, wurde nicht ermittelt.
Es gibt kein spezifisches Gegenmittel; Die Behandlung einer Überdosierung sollte symptomatisch erfolgen.
Bei der Behandlung einer Überdosierung mit CASODEX 50 mg kann Erbrechen ausgelöst werden, wenn der Patient wach ist. Es sollte daran erinnert werden, dass bei dieser Patientengruppe möglicherweise mehrere Arzneimittel eingenommen wurden. Eine Dialyse ist wahrscheinlich nicht hilfreich, da CASODEX stark an Proteine gebunden ist und extensiv metabolisiert wird. Eine allgemeine unterstützende Behandlung, einschließlich häufiger Überwachung der Vitalfunktionen und engmaschiger Beobachtung des Patienten, ist angezeigt.
KONTRAINDIKATIONEN
Casodex ist kontraindiziert bei:
Überempfindlichkeit
CASODEX 50 mg ist bei allen Patienten kontraindiziert, die eine Überempfindlichkeitsreaktion auf das Arzneimittel oder einen der Bestandteile der Tablette gezeigt haben. Überempfindlichkeitsreaktionen einschließlich angioneurotischer Ödeme und Urtikaria wurden berichtet.
Frauen
CASODEX 50 mg hat keine Indikation für Frauen und sollte bei dieser Patientengruppe nicht angewendet werden.
Schwangerschaft
CASODEX 50 mg kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
CASODEX 50 mg ist ein nicht-steroidaler Androgenrezeptor-Hemmer. Es hemmt kompetitiv die Wirkung von Androgenen, indem es an Cytosol-Androgenrezeptoren im Zielgewebe bindet. Das Prostatakarzinom ist bekanntermaßen androgensensitiv und spricht auf eine Behandlung an, die der Androgenwirkung entgegenwirkt und/oder die Androgenquelle entfernt.
Wenn CASODEX 50 mg mit einer Therapie mit einem LHRH-Analogon kombiniert wird, wird die durch das LHRH-Analogon induzierte Unterdrückung von Testosteron im Serum nicht beeinflusst. In klinischen Studien mit CASODEX als Einzelwirkstoff bei Prostatakrebs wurden jedoch Anstiege von Testosteron und Östradiol im Serum festgestellt.
Bei einer Untergruppe von Patienten, die mit CASODEX und einem LHRH-Agonisten behandelt wurden und die die Behandlung mit CASODEX 50 mg aufgrund eines fortschreitenden fortgeschrittenen Prostatakrebses abbrechen, kann es zu einer Verringerung des prostataspezifischen Antigens (PSA) und/oder einer klinischen Besserung (Antiandrogen-Entzugsphänomen) kommen beobachtet.
Pharmakokinetik
Absorption
Bicalutamid wird nach oraler Verabreichung gut resorbiert, obwohl die absolute Bioverfügbarkeit nicht bekannt ist. Die gleichzeitige Einnahme von Bicalutamid mit Nahrung hat keinen klinisch signifikanten Einfluss auf die Geschwindigkeit oder das Ausmaß der Resorption.
Verteilung
Bicalutamid ist stark proteingebunden (96 %) [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Stoffwechsel/Ausscheidung
Bicalutamid unterliegt einem stereospezifischen Metabolismus. Das S-Isomer (inaktiv) wird hauptsächlich durch Glucuronidierung metabolisiert. Das R (aktiv)-Isomer unterliegt ebenfalls einer Glucuronidierung, wird jedoch überwiegend zu einem inaktiven Metaboliten oxidiert, gefolgt von einer Glucuronidierung. Sowohl die Ausgangs- als auch die Metaboliten-Glucuronide werden im Urin und Kot ausgeschieden. Das S-Enantiomer wird relativ zum R-Enantiomer schnell ausgeschieden, wobei das R-Enantiomer etwa 99 % der gesamten Steady-State-Plasmaspiegel ausmacht.
Die Pharmakokinetik des aktiven Enantiomers von CASODEX 50 mg bei gesunden Männern und Patienten mit Prostatakrebs ist in Tabelle 3 dargestellt.
Klinische Studien
CASODEX 50 mg täglich in Kombination mit einem LHRH-A
In einer multizentrischen, doppelblinden, kontrollierten klinischen Studie erhielten 813 Patienten mit zuvor unbehandeltem fortgeschrittenem Prostatakrebs randomisiert einmal täglich CASODEX 50 mg (404 Patienten) oder Flutamid 250 mg (409 Patienten) dreimal täglich, jeweils in Kombination mit LHRH-Analoga (entweder Goserelinacetat-Implantat oder Leuprolidacetat-Depot).
In einer Analyse, die nach Erreichen einer medianen Nachbeobachtungszeit von 160 Wochen durchgeführt wurde, waren 213 (52,7 %) Patienten, die mit CASODEX-LHRH-Analogtherapie behandelt wurden, und 235 (57,5 %) Patienten, die mit Flutamid-LHRH-Analogtherapie behandelt worden waren, gestorben. Es gab keinen signifikanten Unterschied im Überleben zwischen den Behandlungsgruppen (siehe Abbildung 1). Die Hazard Ratio für die Zeit bis zum Tod (Überleben) betrug 0,87 (95 % Konfidenzintervall 0,72 bis 1,05).
Abbildung 1 – Die Kaplan-Meier-Sterblichkeitswahrscheinlichkeit für beide Antiandrogen-Behandlungsgruppen. 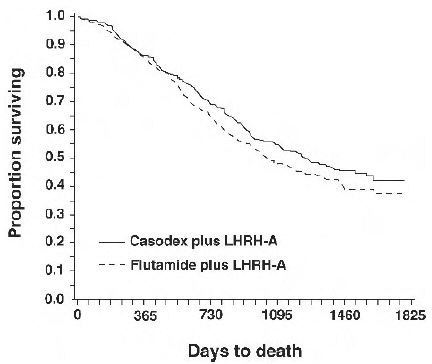
Zwischen den Behandlungsgruppen gab es keinen signifikanten Unterschied in der Zeit bis zur objektiven Tumorprogression (siehe Abbildung 2). Die objektive Tumorprogression wurde definiert als das Auftreten von Knochenmetastasen oder die Verschlechterung bestehender Knochenmetastasen im Knochenscan, die auf eine metastatische Erkrankung zurückzuführen sind, oder eine Zunahme von 25 % oder mehr bestehender messbarer extraskelettaler Metastasen. Das Hazard Ratio für die Zeit bis zur Progression von CASODEX plus LHRH-Analogon zu Flutamid plus LHRH-Analogon betrug 0,93 (95 % Konfidenzintervall, 0,79 bis 1,10).
Abbildung 2 – Kaplan-Meier-Kurve für die Zeit bis zur Progression für beide Antiandrogen-Behandlungsgruppen. 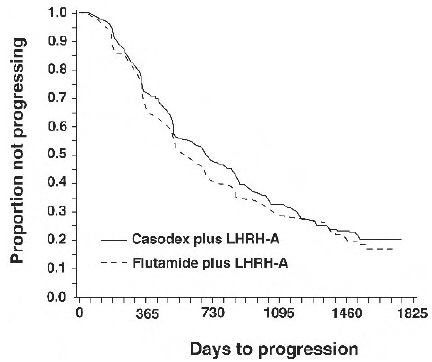
Die Lebensqualität wurde mit selbstausgefüllten Patientenfragebögen zu Schmerzen, sozialer Funktionsfähigkeit, emotionalem Wohlbefinden, Vitalität, Aktivitätseinschränkung, Bettunfähigkeit, allgemeinem Gesundheitszustand, körperlicher Leistungsfähigkeit, allgemeinen Symptomen und behandlungsbedingten Symptomen bewertet. Die Auswertung der Fragebögen zur Lebensqualität ergab keine übereinstimmenden signifikanten Unterschiede zwischen den beiden Behandlungsgruppen.
Sicherheitsdaten aus klinischen Studien mit CASODEX 150 mg
CASODEX 150 mg ist weder allein noch mit anderen Behandlungen zugelassen.
Zwei identische, multizentrische, randomisierte, unverblindete Studien, in denen CASODEX 150 mg täglich als Monotherapie mit Kastration verglichen wurde, wurden bei Patienten mit lokal fortgeschrittenem (T3-4, NX, M0) oder metastasiertem (M1) Prostatakrebs durchgeführt.
Monotherapie – M1-Gruppe
CASODEX 150 mg täglich ist nicht für die Anwendung bei Patienten mit M1-Prostatakrebs zugelassen. Basierend auf einer Zwischenanalyse der beiden Studien zum Überleben empfahl das Data Safety Monitoring Board, die Behandlung mit CASODEX bei den M1-Patienten abzusetzen, da das Sterberisiko 25 % (HR 1,25, 95 % KI 0,87 bis 1,81) und 31 % ( HR 1,31, 95 % KI 0,97 bis 1,77) in der mit CASODEX 50 mg behandelten Gruppe höher als in der kastrierten Gruppe.
Lokal fortgeschrittene (T3-4, NX, M0) Gruppe
CASODEX 150 mg täglich ist nicht für die Anwendung bei Patienten mit lokal fortgeschrittenem (T3-4, NX, M0) Prostatakrebs zugelassen. Nach dem Absetzen aller M1-Patienten wurden die Studien mit den T3-4-, NX- und M0-Patienten bis zum Abschluss der Studie fortgesetzt. In der größeren Studie (N = 352) war das Sterberisiko 25 % (HR 1,25, 95 % KI 0,92 bis 1,71) höher in der CASODEX-Gruppe und in der kleineren Studie (N = 140) war das Sterberisiko 36 % (HR 0,64, 95 %-KI, 0,39 bis 1,03) niedriger in der CASODEX-50-mg-Gruppe.
Zusätzlich zu den beiden oben genannten Studien gibt es drei weitere laufende klinische Studien, die zusätzliche Sicherheitsinformationen für CASODEX 150 mg liefern, eine Dosis, die nicht zur Anwendung zugelassen ist. Dies sind drei multizentrische, randomisierte, doppelblinde Parallelgruppenstudien zum Vergleich von CASODEX 150 mg täglich als Monotherapie (adjuvant zu einer vorherigen Therapie oder unter abwartender Beobachtung) mit Placebo in Bezug auf Tod oder Zeit bis zum Fortschreiten der Krankheit bei einer Population von 8113 Patienten mit lokalisierter oder lokal fortgeschrittener Prostatakrebs.
CASODEX 150 mg täglich ist nicht zur Anwendung als Therapie für Patienten mit lokalisiertem Prostatakrebs zugelassen, die Kandidaten für Watchful Waiting sind. Daten aus einer geplanten Untergruppenanalyse von zwei dieser Studien mit 1627 Patienten mit lokalisiertem Prostatakrebs, die unter Watchful Waiting standen, zeigten einen Trend zu einer verringerten Überlebenszeit im CASODEX-Arm nach einer medianen Nachbeobachtungszeit von 7,4 Jahren. Es gab 294 (37,7 %) Todesfälle bei den mit CASODEX behandelten Patienten im Vergleich zu 279 (32,9 %) Todesfällen bei den mit Placebo behandelten Patienten (lokal überwachte Wartegruppe) bei einer Hazard Ratio von 1,16 (95 % KI 0,99 bis 1,37).
INFORMATIONEN ZUM PATIENTEN
CASODEX® [cas–o–dex] (Bicalutamid) Tablette
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von CASODEX 50 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem medizinischen Betreuer über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist CASODEX 50 mg?
CASODEX ist ein verschreibungspflichtiges Arzneimittel, das als Androgenrezeptorhemmer bezeichnet wird und in Kombination mit Arzneimitteln mit luteinisierendem Hormon-freisetzendem Hormon (LHRH) zur Behandlung von metastasierendem Prostatakrebs im Stadium D2 angewendet wird.
CASODEX ist nicht zur Anwendung bei Frauen bestimmt.
Es ist nicht bekannt, ob CASODEX bei Kindern sicher und wirksam ist.
Wer sollte CASODEX 50 mg nicht einnehmen?
Nehmen Sie CASODEX 50 mg nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von CASODEX mitteilen?
Bevor Sie CASODEX 50 mg einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. CASODEX 50 mg und andere Arzneimittel können sich gegenseitig beeinflussen und Nebenwirkungen verursachen. CASODEX kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von CASODEX 50 mg beeinflussen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Medikamente mit sich, um sie Ihrem Arzt zu zeigen, wenn Sie ein neues Medikament erhalten.
Wie sollte ich CASODEX 50 mg einnehmen?
Eine regelmäßige Überwachung Ihres Prostatakrebses durch Ihren Arzt ist wichtig, um festzustellen, ob sich Ihre Erkrankung verschlimmert.
Was sollte ich während der Einnahme von CASODEX 50 mg vermeiden?
Führen Sie kein Fahrzeug, bedienen Sie keine Maschinen und führen Sie keine anderen gefährlichen Tätigkeiten aus, bis Sie wissen, wie sich CASODEX auf Sie auswirkt.
Bei manchen Menschen kam es während der Einnahme von CASODEX zu Hautempfindlichkeit gegenüber Sonnenlicht. Sie sollten Sonnenlicht oder Höhensonne und Solarium meiden und die Verwendung von Sonnenschutzmitteln während der Behandlung mit CASODEX in Betracht ziehen.
Welche Nebenwirkungen kann CASODEX 50mg haben?
CASODEX kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von CASODEX 50 mg gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von CASODEX. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist CASODEX aufzubewahren?
Lagern Sie CASODEX bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F).
Bewahren Sie CASODEX 50 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von CASODEX.
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie CASODEX nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie CASODEX 50 mg nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu CASODEX zusammen. Wenn Sie weitere Informationen zu CASODEX wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Gesundheitsdienstleister oder Apotheker nach Informationen über CASODEX fragen, die für medizinisches Fachpersonal geschrieben sind. Weitere Informationen erhalten Sie unter www.CASODEX.com oder telefonisch unter 1-800-236-9933.
Was sind die Inhaltsstoffe von CASODEX 50 mg?
Wirkstoff: Bicalutamid.
Inaktive Zutaten: Lactose, Magnesiumstearat, Hypromellose, Polyethylenglykol, Polyvidon, Natriumstärkeglykolat, Titandioxid.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.