Cozaar 25mg, 50mg, 100mg Losartan Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Cozaar 50 mg und wie wird es angewendet?
Cozaar ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie), zur Senkung des Schlaganfallrisikos bei bestimmten Personen mit Herzerkrankungen und diabetischen Nervenschmerzen (Neuropathie). Cozaar 100 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Cozaar 25 mg gehört zu einer Klasse von Arzneimitteln, die Angiotensin-II-Rezeptor-Antagonisten (ARBs) genannt werden.
Es ist nicht bekannt, ob Cozaar 25 mg bei Kindern unter 6 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Cozaar 100 mg haben?
Cozaar 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Cozaar gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cozaar. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
Wenn eine Schwangerschaft festgestellt wird, setzen Sie COZAAR so schnell wie möglich ab. Medikamente, die direkt auf das Renin-Angiotensin-System wirken, können Verletzungen und den Tod des sich entwickelnden Fötus verursachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
BEZEICHNUNG
COZAAR (Losartan-Kalium) ist ein Angiotensin-II-Rezeptorblocker, der auf den AT1-Rezeptorsubtyp wirkt. Losartan-Kalium, ein Nicht-Peptid-Molekül, wird chemisch als 2-Butyl-4-chlor-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]imidazol-5-methanolmonokaliumsalz beschrieben.
Seine Summenformel ist C22H22ClKN6O und seine Strukturformel ist:
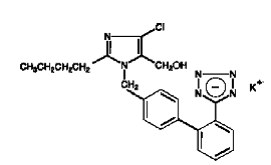
Losartan-Kalium ist ein weißes bis cremefarbenes, frei fließendes, kristallines Pulver mit einem Molekulargewicht von 461,01. Es ist frei löslich in Wasser, löslich in Alkoholen und leicht löslich in üblichen organischen Lösungsmitteln wie Acetonitril und Methylethylketon. Die Oxidation der 5-Hydroxymethylgruppe am Imidazolring führt zum aktiven Metaboliten von Losartan.
COZAAR 100 mg ist als Tabletten zur oralen Verabreichung erhältlich, die entweder 25 mg, 50 mg oder 100 mg Losartan-Kalium und die folgenden Hilfsstoffe enthalten: mikrokristalline Zellulose, wässrige Lactose, vorgelatinierte Stärke, Magnesiumstearat, Hydroxypropylzellulose, Hypromellose und Titandioxid.
COZAAR 25 mg, 50 mg und 100 mg Tabletten enthalten Kalium in den folgenden Mengen: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) bzw. 8,48 mg (0,216 mEq). COZAAR 25 mg, COZAAR 50 mg und COZAAR 100 mg können auch Carnaubawachs enthalten.
INDIKATIONEN
Hypertonie
COZAAR® ist angezeigt zur Behandlung von Bluthochdruck bei Erwachsenen und pädiatrischen Patienten ab 6 Jahren, um den Blutdruck zu senken. Die Senkung des Blutdrucks senkt das Risiko tödlicher und nicht tödlicher kardiovaskulärer (CV) Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen, einschließlich Losartan, beobachtet.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als 1 Medikament, um die Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt Drogen, das ist weitgehend für diese Vorteile verantwortlich. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Sterblichkeit wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass sogar eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Verringerung des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absoluten Risiko ähnlich, sodass der absolute Nutzen bei Patienten mit höherem Risiko unabhängig von ihrer Hypertonie (z. B. Patienten mit Diabetes oder Hyperlipidämie) größer ist, und es ist zu erwarten, dass diese Patienten profitieren von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten.
COZAAR kann zusammen mit anderen Antihypertonika verabreicht werden.
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
COZAAR 25 mg ist indiziert, um das Schlaganfallrisiko bei Patienten mit Bluthochdruck und linksventrikulärer Hypertrophie zu verringern, aber es gibt Hinweise darauf, dass dieser Vorteil nicht für Patienten mit schwarzer Hautfarbe gilt [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ] .
Nephropathie bei Typ-2-Diabetikern
COZAAR ist indiziert zur Behandlung von diabetischer Nephropathie mit erhöhtem Serumkreatinin und Proteinurie (Urin-Albumin-Kreatinin-Verhältnis ≥ 300 mg/g) bei stationären Patienten mit Typ-2-Diabetes und Bluthochdruck in der Anamnese. In dieser Population reduziert COZAAR 50 mg die Progressionsrate der Nephropathie, gemessen anhand des Auftretens einer Verdopplung des Serumkreatinins oder einer Nierenerkrankung im Endstadium (Notwendigkeit einer Dialyse oder Nierentransplantation) [vgl Klinische Studien ] .
DOSIERUNG UND ANWENDUNG
Hypertonie
Bluthochdruck bei Erwachsenen
Die übliche Anfangsdosis von COZAAR 50 mg beträgt 50 mg einmal täglich. Die Dosierung kann bei Bedarf zur Kontrolle des Blutdrucks auf eine Höchstdosis von 100 mg einmal täglich erhöht werden [siehe Klinische Studien ] . Eine Anfangsdosis von 25 mg wird für Patienten mit möglicher intravaskulärer Erschöpfung (z. B. unter Diuretikatherapie) empfohlen.
Pädiatrischer Bluthochdruck
Die übliche empfohlene Anfangsdosis beträgt 0,7 mg pro kg einmal täglich (bis zu 50 mg insgesamt), verabreicht als Tablette oder Suspension [siehe Zubereitung der Suspension (für 200 ml einer 2,5 mg/ml Suspension) ] .Die Dosierung sollte entsprechend der Blutdruckreaktion angepasst werden. Dosen über 1,4 mg pro kg (oder über 100 mg) täglich wurden bei pädiatrischen Patienten nicht untersucht [siehe KLINISCHE PHARMAKOLOGIE , Klinische Studien und WARNUNGEN UND VORSICHTSMASSNAHMEN ] .
COZAAR wird bei pädiatrischen Patienten unter 6 Jahren oder bei pädiatrischen Patienten mit einer geschätzten glomerulären Filtrationsrate von weniger als 30 ml/min/1,73 m 2 nicht empfohlen [siehe Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE und Klinische Studien ] .
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
Die übliche Anfangsdosis beträgt 50 mg COZAAR einmal täglich. Hydrochlorothiazid 12,5 mg täglich sollte hinzugefügt werden und/oder die Dosis von COZAAR sollte auf 100 mg einmal täglich erhöht werden, gefolgt von einer Erhöhung von Hydrochlorothiazid auf 25 mg einmal täglich, basierend auf dem Ansprechen des Blutdrucks [siehe Klinische Studien ] .
Nephropathie bei Typ-2-Diabetikern
Die übliche Anfangsdosis beträgt 50 mg einmal täglich. Die Dosis sollte je nach Ansprechen des Blutdrucks auf 100 mg einmal täglich erhöht werden [siehe Klinische Studien ] .
Dosierungsänderungen bei Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung beträgt die empfohlene Anfangsdosis von COZAAR 25 mg einmal täglich. COZAAR wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ] .
Zubereitung der Suspension (für 200 ml einer 2,5 mg/ml Suspension)
Geben Sie 10 ml gereinigtes Wasser USP in eine bernsteinfarbene 240-ml-Flasche aus Polyethylenterephthalat (PET), die zehn 50-mg-COZAAR-Tabletten enthält. Sofort mindestens 2 Minuten schütteln. Lassen Sie das Konzentrat 1 Stunde stehen und schütteln Sie es dann 1 Minute, um den Tabletteninhalt zu verteilen. Bereiten Sie separat eine volumetrische 50/50-Mischung aus Ora-Plus™ und Ora-Sweet SF™ vor. Geben Sie 190 ml der 50/50 Ora-Plus™/Ora-Sweet SF™-Mischung in die Tabletten- und Wasseraufschlämmung in der PET-Flasche und schütteln Sie sie 1 Minute lang, um die Inhaltsstoffe zu verteilen. Die Suspension sollte bei 2-8°C (36-46°F) gekühlt werden und kann bis zu 4 Wochen gelagert werden. Schütteln Sie die Suspension vor jedem Gebrauch und stellen Sie sie umgehend wieder in den Kühlschrank.
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
COZAAR ist eine weiße Filmtablette, die wie folgt geliefert wird:
Bei 25 °C (77 °F) lagern; Abweichungen bis 15-30°C (59-86°F) zulässig [siehe USP Controlled Room Temperature]. Behälter dicht geschlossen halten. Vor Licht schützen.
Hergestellt für: Organon LLC, eine Tochtergesellschaft von ORGANON & Co., Jersey City, NJ 07302, USA. Überarbeitet: Okt. 2021.
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Hypertonie
Die Sicherheit von COZAAR wurde bei mehr als 3300 erwachsenen Patienten, die wegen essentieller Hypertonie behandelt wurden, und bei insgesamt 4058 Patienten/Probanden untersucht. Über 1200 Patienten wurden über 6 Monate und mehr als 800 über ein Jahr behandelt.
Die Behandlung mit COZAAR 25 mg wurde gut vertragen, mit einer Gesamtinzidenz von Nebenwirkungen ähnlich der von Placebo. In kontrollierten klinischen Studien wurde die Therapie wegen unerwünschter Ereignisse bei 2,3 % der mit COZAAR 25 mg behandelten Patienten und bei 3,7 % der Patienten, die Placebo erhielten, abgebrochen. In 4 klinischen Studien mit über 1000 Patienten, die Losartan-Kalium in verschiedenen Dosen (10-150 mg) erhielten, und über 300 Patienten, die Placebo erhielten, traten bei ≥ 2 % der mit COZAAR 25 mg behandelten Patienten und häufiger als mit Placebo folgende Nebenwirkungen auf: Schwindel (3 % vs. 2 %), Infektionen der oberen Atemwege (8 % vs. 7 %), verstopfte Nase (2 % vs. 1 %) und Rückenschmerzen (2 % vs. 1 %).
Die folgenden weniger häufigen Nebenwirkungen wurden berichtet:
Erkrankungen des Blutes und des Lymphsystems: Anämie.
Psychische Störungen: Depression.
Erkrankungen des Nervensystems: Schläfrigkeit, Kopfschmerzen, Schlafstörungen, Parästhesien, Migräne.
Erkrankungen des Ohrs und des Labyrinths: Schwindel, Ohrensausen.
Herzerkrankungen: Herzklopfen, Synkope, Vorhofflimmern, CVA.
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Dyspnoe.
Gastrointestinale Störungen: Bauchschmerzen, Verstopfung, Übelkeit, Erbrechen.
Erkrankungen der Haut und des Unterhautzellgewebes: Urtikaria, Juckreiz, Hautausschlag, Lichtempfindlichkeit.
Erkrankungen des Bewegungsapparates und des Bindegewebes: Myalgie, Arthralgie.
Störungen des Fortpflanzungssystems und der Brust: Impotenz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Ödem.
Husten
Anhaltender trockener Husten (mit einer Inzidenz von wenigen Prozent) wurde mit der Anwendung von ACE-Hemmern in Verbindung gebracht und kann in der Praxis ein Grund für das Absetzen der ACE-Hemmer-Therapie sein. Zwei prospektive, doppelblinde, randomisierte, kontrollierte Parallelgruppenstudien wurden durchgeführt, um die Wirkungen von Losartan auf die Inzidenz von Hustenpatienten mit Bluthochdruck zu beurteilen, bei denen während der Behandlung mit ACE-Hemmern Husten aufgetreten war. Patienten mit typischem ACE-Hemmer-Husten bei Provokation mit Lisinopril, deren Husten unter Placebo verschwand, wurden randomisiert Losartan 50 mg, Lisinopril 20 mg oder entweder Placebo (eine Studie, n = 97) oder 25 mg Hydrochlorothiazid (n = 135) zugeteilt. Die doppelblinde Behandlungsdauer dauerte bis zu 8 Wochen. Das Auftreten von Husten ist in Tabelle 1 unten gezeigt.
Diese Studien zeigen, dass die Inzidenz von Husten im Zusammenhang mit einer Losartan-Therapie in einer Population, die alle Husten im Zusammenhang mit einer ACE-Hemmer-Therapie hatte, derjenigen im Zusammenhang mit einer Hydrochlorothiazid- oder Placebo-Therapie entspricht.
Nach der Markteinführung wurden Fälle von Husten, einschließlich positiver erneuter Provokationen, bei der Anwendung von Losartan berichtet.
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
In der Studie Losartan Intervention for Endpoint (LIFE) waren die Nebenwirkungen von COZAAR 100 mg ähnlich denen, die zuvor bei Patienten mit Bluthochdruck berichtet wurden.
Nephropathie bei Patienten mit Typ-2-Diabetes
In der Studie „Reduktion der Endpunkte bei NIDDM mit dem Angiotensin-II-Rezeptor-Antagonisten Losartan“ (RENAAL) mit 1513 Patienten, die mit COZAAR 100 mg oder Placebo behandelt wurden, war die Gesamthäufigkeit der gemeldeten unerwünschten Ereignisse in beiden Gruppen ähnlich. Die Abbrüche von COZAAR aufgrund von Nebenwirkungen waren ähnlich wie bei Placebo (19 % bei COZAAR 100 mg, 24 % bei Placebo). Die unerwünschten Ereignisse, die mit einer Inzidenz von ≥ 4 % der mit COZAAR 50 mg behandelten Patienten berichtet wurden und mit einem Unterschied von ≥ 2 % in der Losartan-Gruppe vs. Placebo vor dem Hintergrund einer konventionellen antihypertensiven Therapie auftraten, waren, unabhängig vom Zusammenhang mit dem Arzneimittel, Asthenie/Müdigkeit, Brustschmerzen , Hypotonie, orthostatische Hypotonie, Durchfall, Anämie, Hyperkaliämie, Hypoglykämie, Rückenschmerzen, Muskelschwäche und Harnwegsinfektionen.
Postmarketing-Erfahrung
Die folgenden zusätzlichen Nebenwirkungen wurden nach der Markteinführung mit COZAAR berichtet. Da diese Reaktionen freiwillig von einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
Verdauungs: Hepatitis.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: Unwohlsein.
Hämatologisch: Thrombozytopenie.
Überempfindlichkeit: Angioödeme, einschließlich Schwellungen des Kehlkopfes und der Glottis, die eine Obstruktion der Atemwege und/oder Schwellungen des Gesichts, der Lippen, des Rachens und/oder der Zunge verursachen, wurden selten bei mit Losartan behandelten Patienten berichtet; Bei einigen dieser Patienten kam es zuvor mit anderen Arzneimitteln, einschließlich ACE-Hemmern, zu Angioödemen. Es wurde über Vaskulitis, einschließlich Purpura Schönlein-Henoch, berichtet. Anaphylaktische Reaktionen wurden berichtet.
Stoffwechsel und Ernährung: Hyponatriämie.
Bewegungsapparat: Rhabdomyolyse.
Erkrankungen des Nervensystems: Dysgeusie.
Haut: Erythrodermie.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mittel zur Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von Losartan mit anderen Arzneimitteln, die den Kaliumspiegel im Serum erhöhen, kann zu einer Hyperkaliämie führen. Überwachen Sie bei solchen Patienten das Serumkalium.
Lithium
Bei gleichzeitiger Gabe von Lithium mit Angiotensin-II-Rezeptor-Antagonisten wurde über einen Anstieg der Lithiumkonzentration im Serum und eine Lithiumtoxizität berichtet. Während der gleichzeitigen Anwendung ist der Lithiumspiegel im Serum zu überwachen.
Nichtsteroidale Antirheumatika (NSAIDs) einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretika-Therapie) oder mit eingeschränkter Nierenfunktion kann die gleichzeitige Verabreichung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit Angiotensin-II-Rezeptorantagonisten (einschließlich Losartan) zu einer Verschlechterung der Nierenfunktion führen. einschließlich möglicher akuter Niereninsuffizienz. Diese Effekte sind normalerweise reversibel. Bei Patienten, die mit Losartan und NSAR behandelt werden, ist die Nierenfunktion regelmäßig zu überwachen.
Die blutdrucksenkende Wirkung von Angiotensin-II-Rezeptor-Antagonisten, einschließlich Losartan, kann durch NSAIDs, einschließlich selektiver COX-2-Hemmer, abgeschwächt werden.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Synkope, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden.
In die Studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) wurden 1448 Patienten mit Typ-2-Diabetes, erhöhtem Albumin-zu-Kreatinin-Verhältnis im Urin und verringerter geschätzter glomerulärer Filtrationsrate (GFR 30 auf 89,9 ml/min) aufgenommen und randomisiert auf Lisinopril verteilt oder Placebo vor dem Hintergrund einer Losartan-Therapie und folgten ihnen über einen Median von 2,2 Jahren. Patienten, die die Kombination aus Losartan und Lisinopril erhielten, erzielten im Vergleich zur Monotherapie keinen zusätzlichen Nutzen für den kombinierten Endpunkt Abnahme der GFR, terminale Niereninsuffizienz oder Tod, zeigten jedoch eine erhöhte Inzidenz von Hyperkaliämie und akuter Nierenschädigung im Vergleich zur Monotherapiegruppe.
Bei den meisten Patienten wurde kein Nutzen mit der gleichzeitigen Anwendung von zwei RAS-Hemmern in Verbindung gebracht. Vermeiden Sie im Allgemeinen die kombinierte Anwendung von RAS-Hemmern. Bei Patienten, die COZAAR 100 mg und andere Wirkstoffe, die das RAS beeinflussen, erhalten, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht zusammen mit COZAAR 100 mg bei Patienten mit Diabetes. Vermeiden Sie die Anwendung von Aliskiren mit COZAAR bei Patienten mit eingeschränkter Nierenfunktion (GFR
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Fötale Toxizität
COZAAR kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimesters der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie COZAAR 100 mg so schnell wie möglich ab [siehe Verwendung in bestimmten Bevölkerungsgruppen ] .
Hypotonie bei Patienten mit Volumen- oder Salzmangel
Bei Patienten mit einem aktivierten Renin-Angiotensin-System, wie z. B. Patienten mit Volumen- oder Salzmangel (z. B. Patienten, die mit hochdosierten Diuretika behandelt werden), kann nach Beginn der Behandlung mit COZAAR eine symptomatische Hypotonie auftreten. Korrigieren Sie den Volumen- oder Salzmangel vor der Verabreichung von COZAAR [siehe DOSIERUNG UND ANWENDUNG ] .
Verschlechterung der Nierenfunktion
Veränderungen der Nierenfunktion einschließlich akutem Nierenversagen können durch Arzneimittel, die das Renin-Angiotensin-System hemmen, und durch Diuretika verursacht werden. Patienten, deren Nierenfunktion teilweise von der Aktivität des Renin-Angiotensin-Systems abhängen kann (z. B. Patienten mit Nierenarterienstenose, chronischer Nierenerkrankung, schwerer dekompensierter Herzinsuffizienz oder Volumenmangel), können unter COZAAR einem besonderen Risiko ausgesetzt sein, ein akutes Nierenversagen zu entwickeln. Überwachen Sie die Nierenfunktion bei diesen Patienten regelmäßig. Erwägen Sie das Aussetzen oder Absetzen der Therapie bei Patienten, die unter COZAAR eine klinisch signifikante Abnahme der Nierenfunktion entwickeln [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und Verwendung in bestimmten Bevölkerungsgruppen ] .
Hyperkaliämie
Serumkalium regelmäßig überwachen und entsprechend behandeln. Eine Dosisreduktion oder das Absetzen von COZAAR 25 mg kann erforderlich sein [siehe NEBENWIRKUNGEN ] .
Die gleichzeitige Anwendung anderer Arzneimittel, die das Serumkalium erhöhen können, kann zu Hyperkaliämie führen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ] .
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung (Patienteninformationen) zu lesen.
Schwangerschaft
Informieren Sie Patientinnen im gebärfähigen Alter über die Folgen einer Exposition gegenüber COZAAR 100 mg während der Schwangerschaft. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Weisen Sie die Patientinnen an, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ] .
Kalium-Ergänzungen
Weisen Sie Patienten, die COZAAR erhalten, darauf hin, keine kaliumhaltigen Kaliumpräparate oder kaliumhaltigen Salzersatzmittel ohne Rücksprache mit ihrem medizinischen Betreuer zu verwenden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ] .
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Losartan-Kalium war nicht karzinogen, wenn es Ratten und Mäusen über 105 bzw. 92 Wochen in maximal verträglichen Dosierungen verabreicht wurde. Weibliche Ratten, denen die höchste Dosis (270 mg/kg/Tag) verabreicht wurde, hatten eine etwas höhere Inzidenz von Azinusadenomen des Pankreas. Die maximal tolerierten Dosierungen (270 mg/kg/Tag bei Ratten, 200 mg/kg/Tag bei Mäusen) führten zu systemischen Expositionen für Losartan und seinen pharmakologisch aktiven Metaboliten, die etwa das 160- und 90-fache (Ratten) und das 30- und 15-fache (Mäuse) betrugen. die Exposition eines 50 kg schweren Menschen bei 100 mg pro Tag.
Losartan-Kalium war im mikrobiellen Mutagenese- und V-79-Säugerzell-Mutagenese-Assay sowie im alkalischen In-vitro-Elutions- und In-vitro- und In-vivo-Chromosomenaberrationsassay negativ. Darüber hinaus zeigte der aktive Metabolit keine Hinweise auf Genotoxizität in mikrobiellen Mutagenese-, alkalischen In-vitro-Elutions- und In-vitro-Chromosomenaberrationsassays.
Fertilität und Fortpflanzungsfähigkeit wurden in Studien mit männlichen Ratten, denen Losartan-Kalium in Dosen von bis zu etwa 150 mg/kg/Tag verabreicht wurde, nicht beeinträchtigt. Die Verabreichung toxischer Dosierungen bei Frauen (300/200 mg/kg/Tag) war mit einer signifikanten (p
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
COZAAR kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimesters der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Wenn eine Schwangerschaft festgestellt wird, setzen Sie COZAAR so bald wie möglich ab (siehe Klinische Überlegungen ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Hypertonie in der Schwangerschaft erhöht das mütterliche Risiko für Präeklampsie, Schwangerschaftsdiabetes, Frühgeburt und Geburtskomplikationen (z. B. Notwendigkeit eines Kaiserschnitts, postpartale Blutung). Bluthochdruck erhöht das fötale Risiko für eine intrauterine Wachstumsbeschränkung und einen intrauterinen Tod. Schwangere Frauen mit Bluthochdruck sollten sorgfältig überwacht und entsprechend behandelt werden.
Fetale/neonatale Nebenwirkungen
Oligohydramnion bei Schwangeren, die im zweiten und dritten Trimenon Arzneimittel anwenden, die das Renin-Angiotensin-System beeinflussen, kann zu Folgendem führen: verminderte fetale Nierenfunktion, die zu Anurie und Nierenversagen führt, fetale Lungenhypoplasie, Skelettdeformationen, einschließlich Schädelhypoplasie, Hypotonie , und Tod. In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus.
Führen Sie bei Patientinnen, die COZAAR während der Schwangerschaft einnehmen, serielle Ultraschalluntersuchungen durch, um das intraamniotische Milieu zu beurteilen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Wenn Oligohydramnion beobachtet wird, setzen Sie COZAAR 50 mg ab, es sei denn, es wird als lebensrettend für die Mutter angesehen. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat.
Neugeborene mit COZAAR-Exposition in der Vorgeschichte sind engmaschig auf Hypotonie, Oligurie und Hyperkaliämie zu beobachten. Bei Neugeborenen mit einer Vorgeschichte von COZAAR 100 mg in utero, wenn Oligurie oder Hypotonie auftritt, zur Unterstützung des Blutdrucks und der Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um die Hypotonie umzukehren und die Nierenfunktion zu ersetzen.
Daten
Tierdaten
Losartan-Kalium wurde Ratten während der späten Trächtigkeit bis zur Laktation (15. bis 20. Trächtigkeitstag) in Dosierungen von 10, 25 und 100 mg/kg/Tag oral verabreicht. Es wurde gezeigt, dass Losartan-Kalium bei Rattenföten und Neugeborenen Nebenwirkungen hervorruft, einschließlich verringertem Körpergewicht, verzögerter körperlicher Entwicklung und Verhaltensentwicklung, Mortalität und Nierentoxizität. Mit Ausnahme der Gewichtszunahme bei Neugeborenen (die bereits bei Dosen von nur 10 mg/kg/Tag betroffen war), überstiegen die mit diesen Wirkungen verbundenen Dosen 25 mg/kg/Tag (etwa das Dreifache der maximal empfohlenen Dosis von 100 mg pro mg beim Menschen). /m-Basis). Diese Befunde werden der Arzneimittelexposition in der späten Trächtigkeit und während der Laktation zugeschrieben. Signifikante Konzentrationen von Losartan und seinem aktiven Metaboliten wurden im fötalen Plasma von Ratten während der späten Trächtigkeit und in der Rattenmilch nachgewiesen.
Stillzeit
Zusammenfassung der Risiken
Es ist nicht bekannt, ob Losartan in die Muttermilch übergeht, aber es wurde gezeigt, dass in Rattenmilch signifikante Konzentrationen von Losartan und seinem aktiven Metaboliten vorhanden sind. Wegen möglicher unerwünschter Wirkungen auf das gestillte Kind sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter eine Entscheidung getroffen werden, ob das Stillen beendet oder das Medikament abgesetzt werden soll.
Pädiatrische Verwendung
Antihypertensive Wirkungen von COZAAR wurden bei hypertensiven pädiatrischen Patienten im Alter von 6 bis 16 Jahren nachgewiesen. Sicherheit und Wirksamkeit wurden bei pädiatrischen Patienten unter 6 Jahren oder bei pädiatrischen Patienten mit einer glomerulären Filtrationsrate DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE und Klinische Studien ] .
Geriatrische Verwendung
Von der Gesamtzahl der Patienten, die COZAAR 25 mg in kontrollierten klinischen Studien gegen Bluthochdruck erhielten, waren 391 Patienten (19 %) 65 Jahre und älter, während 37 Patienten (2 %) 75 Jahre und älter waren. In einer kontrollierten klinischen Studie zum Nierenschutz bei Typ-2-Diabetikern mit Proteinurie waren 248 Patienten (33 %) 65 Jahre und älter. In einer kontrollierten klinischen Studie zur Verringerung des kombinierten Risikos für kardiovaskulären Tod, Schlaganfall und Myokardinfarkt bei hypertensiven Patienten mit linksventrikulärer Hypertrophie waren 2857 Patienten (62 %) 65 Jahre und älter, während 808 Patienten (18 %) 75 Jahre und älter waren . Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen diesen Patienten und jüngeren Patienten beobachtet, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Wettrennen
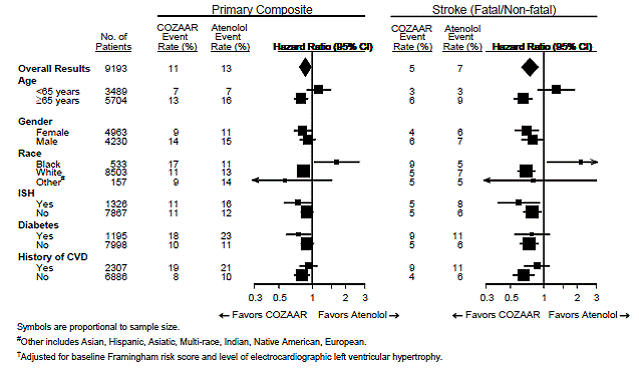
In der LIFE-Studie hatten schwarze Patienten mit Bluthochdruck und linksventrikulärer Hypertrophie, die mit Atenolol behandelt wurden, ein geringeres Risiko, den primären kombinierten Endpunkt zu erreichen, verglichen mit schwarzen Patienten, die mit COZAAR behandelt wurden (beide wurden bei der Mehrzahl der Patienten mit Hydrochlorothiazid kobehandelt). Der primäre Endpunkt war das erste Auftreten von Schlaganfall, Myokardinfarkt oder kardiovaskulärem Tod, analysiert unter Verwendung eines Intention-to-treat (ITT)-Ansatzes. In der Untergruppe der Patienten mit schwarzer Hautfarbe (n = 533, 6 % der Patienten der LIFE-Studie) gab es 29 primäre Endpunkte bei 263 Patienten unter Atenolol (11 %, 26 pro 1000 Patientenjahre) und 46 primäre Endpunkte bei 270 Patienten (17 % , 42 pro 1000 Patientenjahre) auf COZAAR. Dieser Befund konnte nicht auf der Grundlage von Unterschieden in den Populationen außer der Rasse oder irgendwelchen Ungleichgewichten zwischen den Behandlungsgruppen erklärt werden. Darüber hinaus waren die Blutdrucksenkungen in beiden Behandlungsgruppen bei schwarzen und nicht-schwarzen Patienten konsistent. Angesichts der Schwierigkeit bei der Interpretation von Untergruppenunterschieden in großen Studien kann nicht festgestellt werden, ob der beobachtete Unterschied das Ergebnis eines Zufalls ist. Die LIFE-Studie liefert jedoch keinen Beweis dafür, dass die Vorteile von COZAAR 100 mg bei der Verringerung des Risikos kardiovaskulärer Ereignisse bei Bluthochdruckpatienten mit linksventrikulärer Hypertrophie für Patienten mit schwarzer Hautfarbe gelten [siehe Klinische Studien ] .
Nierenfunktionsstörung
Patienten mit Niereninsuffizienz haben im Vergleich zu Patienten mit normaler Nierenfunktion erhöhte Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten. Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich, es sei denn, ein Patient mit eingeschränkter Nierenfunktion hat auch einen Volumenmangel [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ] .
Leberfunktionsstörung
Die empfohlene Anfangsdosis von COZAAR beträgt 25 mg bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung. Nach oraler Gabe bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung waren die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten 5-mal bzw. 1,7-mal höher als bei gesunden Probanden. COZAAR wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ] .
ÜBERDOSIS
Eine signifikante Letalität wurde bei Mäusen und Ratten nach oraler Verabreichung von 1000 mg/kg bzw. 2000 mg/kg beobachtet, was etwa dem 44- bzw. 170-Fachen der maximal empfohlenen Dosis für Menschen auf mg/m2-Basis entspricht.
Bezüglich einer Überdosierung beim Menschen liegen begrenzte Daten vor. Die wahrscheinlichste Manifestation einer Überdosierung wäre Hypotonie und Tachykardie; Bradykardie kann durch parasympathische (vagale) Stimulation auftreten. Wenn eine symptomatische Hypotonie auftritt, sollte eine unterstützende Behandlung eingeleitet werden.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse entfernt werden.
KONTRAINDIKATIONEN
COZAAR 50 mg ist kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Angiotensin II [gebildet aus Angiotensin I in einer durch das Angiotensin-Converting-Enzym (ACE, Kininase II) katalysierten Reaktion] ist ein starker Vasokonstriktor, das primäre vasoaktive Hormon des Renin-Angiotensin-Systems und eine wichtige Komponente in der Pathophysiologie von Bluthochdruck. Es stimuliert auch die Aldosteronsekretion durch die Nebennierenrinde. Losartan und sein aktiver Hauptmetabolit blockieren die vasokonstriktorischen und Aldosteron-sezernierenden Wirkungen von Angiotensin II, indem sie selektiv die Bindung von Angiotensin II an den AT1-Rezeptor blockieren, der in vielen Geweben vorkommt (z. B. glatte Gefäßmuskulatur, Nebenniere). Es gibt auch einen AT1-Rezeptor, der in vielen Geweben gefunden wird, aber es ist nicht bekannt, dass er mit der kardiovaskulären Homöostase assoziiert ist. Weder Losartan noch sein aktiver Hauptmetabolit zeigen eine teilweise agonistische Aktivität am AT1-Rezeptor, und beide haben eine viel größere Affinität (etwa 1000-fach) für den AT1-Rezeptor als für den AT1-Rezeptor. In-vitro-Bindungsstudien weisen darauf hin, dass Losartan ein reversibler, kompetitiver Inhibitor des AT1-Rezeptors ist. Der aktive Metabolit ist 10- bis 40-mal stärker nach Gewicht als Losartan und scheint ein reversibler, nicht kompetitiver Inhibitor des AT1-Rezeptors zu sein.
Weder Losartan noch sein aktiver Metabolit hemmen ACE (Kininase II, das Enzym, das Angiotensin I in Angiotensin II umwandelt und Bradykinin abbaut), noch binden oder blockieren sie andere Hormonrezeptoren oder Ionenkanäle, von denen bekannt ist, dass sie für die kardiovaskuläre Regulation wichtig sind.
Pharmakodynamik
Losartan hemmt die pressorische Wirkung von Angiotensin-II-Infusionen (sowie von Angiotensin-I-Infusionen). Eine Dosis von 100 mg hemmt die pressorische Wirkung um etwa 85 % in der Spitze, wobei eine Hemmung von 25-40 % für 24 Stunden anhält. Die Beseitigung der negativen Rückkopplung von Angiotensin II verursacht eine Verdopplung bis Verdreifachung der Plasma-Renin-Aktivität und einen daraus folgenden Anstieg der Angiotensin-II-Plasmakonzentration bei Bluthochdruckpatienten. Losartan beeinflusst die Reaktion auf Bradykinin nicht, während ACE-Hemmer die Reaktion auf Bradykinin verstärken. Die Aldosteron-Plasmakonzentrationen fallen nach der Gabe von Losartan. Trotz der Wirkung von Losartan auf die Aldosteronsekretion wurde eine sehr geringe Wirkung auf das Serumkalium beobachtet.
Die Wirkung von Losartan ist im Wesentlichen innerhalb einer Woche vorhanden, aber in einigen Studien trat die maximale Wirkung nach 3–6 Wochen auf. In Langzeit-Follow-up-Studien (ohne Placebokontrolle) schien die Wirkung von Losartan bis zu einem Jahr anzuhalten. Es gibt keinen erkennbaren Rebound-Effekt nach abruptem Absetzen von Losartan. In kontrollierten Studien gab es im Wesentlichen keine Veränderung der durchschnittlichen Herzfrequenz bei mit Losartan behandelten Patienten.
Pharmakokinetik
Absorption
Nach oraler Gabe wird Losartan gut resorbiert und unterliegt einem erheblichen First-Pass-Metabolismus. Die systemische Bioverfügbarkeit von Losartan beträgt etwa 33 %. Mittlere Spitzenkonzentrationen von Losartan und seinem aktiven Metaboliten werden nach 1 Stunde bzw. nach 3-4 Stunden erreicht. Während die maximalen Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten ungefähr gleich sind, ist die AUC (Fläche unter der Kurve) des Metaboliten etwa viermal so groß wie die von Losartan. Eine Mahlzeit verlangsamt die Resorption von Losartan und senkt seine Cmax, hat aber nur geringe Auswirkungen auf die AUC von Losartan oder auf die AUC des Metaboliten (Abnahme um etwa 10 %). Die Pharmakokinetik von Losartan und seinem aktiven Metaboliten ist bei oralen Losartan-Dosen bis zu 200 mg linear und ändert sich nicht im Laufe der Zeit.
Verteilung
Das Verteilungsvolumen von Losartan und dem aktiven Metaboliten beträgt etwa 34 Liter bzw. 12 Liter. Sowohl Losartan als auch sein aktiver Metabolit werden stark an Plasmaproteine gebunden, hauptsächlich Albumin, mit plasmafreien Anteilen von 1,3 % bzw. 0,2 %. Die Plasmaproteinbindung ist über den mit den empfohlenen Dosen erreichten Konzentrationsbereich konstant. Studien an Ratten weisen darauf hin, dass Losartan die Blut-Hirn-Schranke, wenn überhaupt, nur schlecht passiert.
Stoffwechsel
Losartan ist ein oral aktiver Wirkstoff, der einem erheblichen First-Pass-Metabolismus durch Cytochrom-P450-Enzyme unterliegt. Es wird teilweise in einen aktiven Carbonsäure-Metaboliten umgewandelt, der für den größten Teil des Angiotensin-II-Rezeptor-Antagonismus nach der Behandlung mit Losartan verantwortlich ist. Etwa 14 % einer oral verabreichten Losartan-Dosis werden in den aktiven Metaboliten umgewandelt. Neben dem aktiven Carbonsäure-Metaboliten werden mehrere inaktive Metaboliten gebildet. In-vitro-Studien weisen darauf hin, dass Cytochrom P450 2C9 und 3A4 an der Biotransformation von Losartan zu seinen Metaboliten beteiligt sind.
Beseitigung
Die Gesamtplasmaclearance von Losartan und dem aktiven Metaboliten beträgt etwa 600 ml/min bzw. 50 ml/min, mit einer renalen Clearance von etwa 75 ml/min bzw. 25 ml/min. Die terminale Halbwertszeit von Losartan beträgt etwa 2 Stunden und die des Metaboliten etwa 6-9 Stunden. Nach oraler Gabe von Losartan-Einzeldosen werden etwa 4 % der Dosis unverändert im Urin und etwa 6 % als aktiver Metabolit im Urin ausgeschieden. Die biliäre Ausscheidung trägt zur Elimination von Losartan und seinen Metaboliten bei. Nach oraler Gabe von 14C-markiertem Losartan werden etwa 35 % der Radioaktivität im Urin und etwa 60 % im Stuhl wiedergefunden. Nach einer intravenösen Dosis von 14C-markiertem Losartan werden etwa 45 % der Radioaktivität im Urin und 50 % im Stuhl wiedergefunden. Weder Losartan noch sein Metabolit reichern sich bei wiederholter einmal täglicher Gabe im Plasma an.
Spezifische Populationen
Pädiatrie
Die pharmakokinetischen Parameter nach mehrfacher Gabe von Losartan (durchschnittliche Dosis 0,7 mg/kg, Bereich 0,36 bis 0,97 mg/kg) als Tablette an 25 Bluthochdruckpatienten im Alter von 6 bis 16 Jahren sind in Tabelle 4 unten aufgeführt. Die Pharmakokinetik von Losartan und seinem aktiven Metaboliten war im Allgemeinen in allen untersuchten Altersgruppen ähnlich und vergleichbar mit historischen pharmakokinetischen Daten bei Erwachsenen. Die wichtigsten pharmakokinetischen Parameter bei Erwachsenen und Kindern sind in der folgenden Tabelle aufgeführt.
Die Bioverfügbarkeit der Suspensionsformulierung wurde mit Losartan-Tabletten bei gesunden Erwachsenen verglichen. Die Suspension und die Tablette sind in ihrer Bioverfügbarkeit sowohl in Bezug auf Losartan als auch den aktiven Metaboliten ähnlich [vgl DOSIERUNG UND ANWENDUNG ] .
Geriatrie und Geschlecht
Die Pharmakokinetik von Losartan wurde bei älteren Patienten (65-75 Jahre) und bei beiden Geschlechtern untersucht. Die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten sind bei älteren und jungen Hypertonikern ähnlich. Die Plasmakonzentrationen von Losartan waren bei weiblichen Hypertonikern etwa doppelt so hoch wie bei männlichen Hypertonikern, aber die Konzentrationen des aktiven Metaboliten waren bei Männern und Frauen ähnlich. Eine Dosisanpassung ist nicht erforderlich [vgl DOSIERUNG UND ANWENDUNG ] .
Wettrennen
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht [siehe Verwendung in bestimmten Bevölkerungsgruppen ] .
Niereninsuffizienz
Nach oraler Gabe sind die Plasmakonzentrationen und AUCs von Losartan und seinem aktiven Metaboliten bei Patienten mit leichter (Kreatinin-Clearance 50 bis 74 ml/min) oder mittelschwerer (Kreatinin-Clearance 30 bis 49 ml/min) Niereninsuffizienz um 50-90 % erhöht . In dieser Studie war die renale Clearance sowohl für Losartan als auch für seinen aktiven Metaboliten bei Patienten mit leichter oder mittelschwerer Niereninsuffizienz um 55-85 % verringert. Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse entfernt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ] .
Leberinsuffizienz
Nach oraler Gabe bei Patienten mit leichter bis mittelschwerer alkoholischer Leberzirrhose waren die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten 5-mal bzw. etwa 1,7-mal höher als bei jungen männlichen Probanden. Im Vergleich zu gesunden Probanden war die Gesamtplasmaclearance von Losartan bei stationären Patienten mit Leberinsuffizienz etwa 50 % niedriger und die orale Bioverfügbarkeit etwa doppelt so hoch. Verwenden Sie eine Anfangsdosis von 25 mg für Patienten mit leichter bis mittelschwerer Leberfunktionsstörung. COZAAR 50 mg wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ] .
Wechselwirkungen mit anderen Medikamenten
In Studien von Losartan-Kalium mit Hydrochlorothiazid, Digoxin, Warfarin, Cimetidin und Phenobarbital wurden keine klinisch signifikanten Arzneimittelwechselwirkungen festgestellt. Es wurde jedoch gezeigt, dass Rifampin die AUC von Losartan und seinem aktiven Metaboliten um 30 % bzw. 40 % senkt. Fluconazol, ein Inhibitor von Cytochrom P450 2C9, verringerte die AUC des aktiven Metaboliten um etwa 40 %, erhöhte jedoch die AUC von Losartan nach Mehrfachgabe um etwa 70 %. Die Umwandlung von Losartan in seinen aktiven Metaboliten nach intravenöser Verabreichung wird durch Ketoconazol nicht beeinflusst. ein Inhibitor von P450 3A4. Die AUC des aktiven Metaboliten nach oraler Gabe von Losartan wurde durch Erythromycin, einen Inhibitor von P450 3A4, nicht beeinflusst, aber die AUC von Losartan war um 30 % erhöht.
Die pharmakodynamischen Folgen einer gleichzeitigen Anwendung von Losartan und Inhibitoren von P450 2C9 wurden nicht untersucht. Bei Probanden, die Losartan nicht zum aktiven Metaboliten metabolisieren, wurde ein spezifischer, seltener Defekt des Cytochrom P450 2C9 nachgewiesen. Diese Daten legen nahe, dass die Umwandlung von Losartan in seinen aktiven Metaboliten hauptsächlich durch P450 2C9 und nicht durch P450 3A4 vermittelt wird.
Klinische Studien
Hypertonie
Bluthochdruck bei Erwachsenen
Die blutdrucksenkende Wirkung von COZAAR 25 mg wurde hauptsächlich in 4 placebokontrollierten 6- bis 12-wöchigen Studien mit Dosierungen von 10 bis 150 mg pro Tag bei Patienten mit einem diastolischen Ausgangsblutdruck von 95-115 nachgewiesen. Die Studien ermöglichten Vergleiche von zwei Dosierungen (50-100 mg/Tag) als einmal tägliche oder zweimal tägliche Verabreichung, Vergleiche von Spitzen- und Taleffekten und Vergleiche des Ansprechens nach Geschlecht, Alter und ethnischer Zugehörigkeit. Drei weitere Studien untersuchten die blutdrucksenkende Wirkung von Losartan und Hydrochlorothiazid in Kombination.
Die 4 Studien zur Losartan-Monotherapie umfassten insgesamt 1075 Patienten, die randomisiert mehrere Losartan-Dosen erhielten, und 334 Patienten, die Placebo erhielten. Die 10- und 25-mg-Dosen erzeugten eine gewisse Wirkung am Höhepunkt (6 Stunden nach der Dosierung), aber kleine und inkonsistente Talreaktionen (24 Stunden). Dosen von 50, 100 und 150 mg einmal täglich führten im Vergleich zu Placebo zu statistisch signifikanten systolischen/diastolischen mittleren Blutdrucksenkungen im Bereich von 5,5–10,5/3,5–7,5 mmHg, wobei die 150-mg-Dosis keine größere Wirkung als 50– 100mg. Die zweimal tägliche Gabe von 50–100 mg/Tag ergab durchgehend stärkere minimale Reaktionen als die einmal tägliche Gabe der gleichen Gesamtdosis. Peak-Effekte (6 Stunden) waren gleichmäßig, aber moderat größer als Tal-Effekte, wobei das Tal-zu-Spitze-Verhältnis für systolische und diastolische Reaktionen 50–95 % bzw. 60–90 % betrug.
Die Zugabe einer niedrigen Dosis Hydrochlorothiazid (12,5 mg) zu Losartan 50 mg einmal täglich führte zu einer placebokorrigierten Blutdrucksenkung von 15,5/9,2 mmHg.
Die Analyse von Alters-, Geschlechts- und ethnischen Untergruppen der Patienten zeigte, dass Männer und Frauen sowie Patienten über und unter 65 Jahren im Allgemeinen ähnliche Reaktionen zeigten. COZAAR 25 mg war bei der Senkung des Blutdrucks unabhängig von der Rasse wirksam, obwohl die Wirkung bei Patienten mit schwarzer Hautfarbe (normalerweise eine Population mit niedrigem Reninspiegel) etwas geringer war.
Pädiatrischer Bluthochdruck
Die blutdrucksenkende Wirkung von Losartan wurde in einer Studie mit 177 pädiatrischen Patienten mit Bluthochdruck im Alter von 6 bis 16 Jahren untersucht. Kinder, die DOSIERUNG UND ANWENDUNG . Die Mehrheit der Kinder litt an Bluthochdruck im Zusammenhang mit Nieren- und Urogenitalerkrankungen. Der diastolische Blutdruck im Sitzen (SiDBP) war bei Studienbeginn höher als das 95. Perzentil für Alter, Geschlecht und Größe des Patienten. Am Ende von drei Wochen senkte Losartan dosisabhängig den systolischen und diastolischen Blutdruck, gemessen am Tiefpunkt. Insgesamt senkten die beiden höheren Dosen (25 bis 50 mg bei Patienten
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
Die LIFE-Studie war eine multinationale, doppelblinde Studie zum Vergleich von COZAAR 50 mg und Atenolol bei 9193 Bluthochdruckpatienten mit EKG-dokumentierter linksventrikulärer Hypertrophie. Patienten mit Myokardinfarkt oder Schlaganfall innerhalb von sechs Monaten vor der Randomisierung wurden ausgeschlossen. Die Patienten wurden randomisiert und erhielten einmal täglich 50 mg COZAAR oder 50 mg Atenolol. Wenn der Zielblutdruck (
Von den randomisierten Patienten waren 4963 (54 %) weiblich und 533 (6 %) schwarz. Das Durchschnittsalter betrug 67 Jahre, wobei 5704 (62 %) ≥ 65 Jahre alt waren. Zu Studienbeginn hatten 1195 (13 %) Diabetes, 1326 (14 %) eine isolierte systolische Hypertonie, 1469 (16 %) eine koronare Herzkrankheit und 728 (8 %) eine zerebrovaskuläre Erkrankung. Der mittlere Blutdruck zu Studienbeginn betrug in beiden Behandlungsgruppen 174/98 mmHg. Die durchschnittliche Nachbeobachtungszeit betrug 4,8 Jahre. Am Ende der Studie oder beim letzten Besuch vor einem primären Endpunkt nahmen 77 % der mit COZAAR 50 mg behandelten Gruppe und 73 % der mit Atenolol behandelten Gruppe noch die Studienmedikation ein. Von den Patienten, die noch Studienmedikation einnahmen, betrugen die mittleren Dosen von COZAAR und Atenolol jeweils etwa 80 mg/Tag, und 15 % nahmen Atenolol oder Losartan als Monotherapie ein, während 77 % zusätzlich Hydrochlorothiazid erhielten (in einer mittleren Dosis von 20 mg/Tag in jede Gruppe). Die am Tiefpunkt gemessene Blutdrucksenkung war für beide Behandlungsgruppen ähnlich, aber der Blutdruck wurde zu keiner anderen Tageszeit gemessen. Am Ende der Studie oder beim letzten Besuch vor einem primären Endpunkt betrug der mittlere Blutdruck 144,1/81,3 mmHg für die mit COZAAR behandelte Gruppe und 145,4/80,9 mmHg für die mit Atenolol behandelte Gruppe; der Unterschied im systolischen Blutdruck (SBP) von 1,3 mmHg war signifikant (p
Der primäre Endpunkt war das erste Auftreten von kardiovaskulärem Tod, nicht tödlichem Schlaganfall oder nicht tödlichem Myokardinfarkt. Patienten mit nicht-tödlichen Ereignissen blieben in der Studie, sodass jeweils das erste Ereignis auch dann untersucht wurde, wenn es nicht das erste Ereignis war (z. B. würde ein Schlaganfall nach einem initialen Myokardinfarkt in der Schlaganfallanalyse mitgezählt). Die Behandlung mit COZAAR 50 mg führte im Vergleich zur Atenolol-Gruppe zu einer 13 %igen Reduktion (p = 0,021) des Risikos für den primären Endpunkt (siehe Abbildung 1 und Tabelle 3); Dieser Unterschied war in erster Linie das Ergebnis einer Auswirkung auf tödliche und nicht tödliche Schlaganfälle. Die Behandlung mit COZAAR reduzierte das Schlaganfallrisiko um 25 % im Vergleich zu Atenolol (p = 0,001) (siehe Abbildung 2 und Tabelle 3).
Abbildung 1: Kaplan-Meier-Schätzungen des primären Endpunkts der Zeit bis zum kardiovaskulären Tod, nicht tödlichen Schlaganfall oder nicht tödlichen Myokardinfarkt in den mit COZAAR 100 mg und Atenolol behandelten Gruppen. Die Risikominderung wird um den Framingham-Risiko-Score zu Studienbeginn und das Ausmaß der elektrokardiographischen linksventrikulären Hypertrophie angepasst
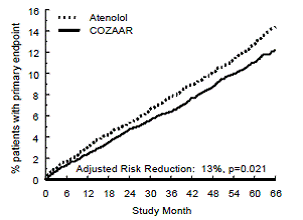
Abbildung 2: Kaplan-Meier-Schätzungen der Zeit bis zum tödlichen/nicht tödlichen Schlaganfall in den mit COZAAR 50 mg und Atenolol behandelten Gruppen. Die Risikominderung wird um den Ausgangs-Framingham-Risiko-Score und das Ausmaß der elektrokardiographischen linksventrikulären Hypertrophie angepasst
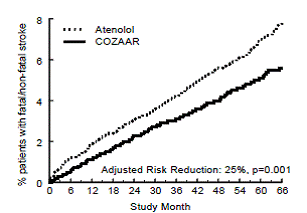
Tabelle 3 zeigt die Ergebnisse für den primären kombinierten Endpunkt und die einzelnen Endpunkte. Der primäre Endpunkt war das erste Auftreten von Schlaganfall, Myokardinfarkt oder kardiovaskulärem Tod, analysiert unter Verwendung eines ITT-Ansatzes. Die Tabelle zeigt die Anzahl der Ereignisse für jede Komponente auf zwei verschiedene Arten. Die Komponenten des primären Endpunkts (als erstes Ereignis) zählen nur die Ereignisse, die den primären Endpunkt definieren, während die sekundären Endpunkte alle ersten Ereignisse eines bestimmten Typs zählen, unabhängig davon, ob ihnen ein anderer Ereignistyp vorangegangen ist oder nicht.
Obwohl die LIFE-Studie COZAAR gegenüber Atenolol in Bezug auf den primären Endpunkt (p = 0,021) favorisierte, stammt dieses Ergebnis aus einer einzigen Studie und ist daher weniger überzeugend als der Unterschied zwischen COZAAR und Placebo. Obwohl nicht direkt gemessen, ist der Unterschied zwischen COZAAR und Placebo überzeugend, da es Beweise dafür gibt, dass Atenolol selbst (im Vergleich zu Placebo) bei der Reduzierung kardiovaskulärer Ereignisse, einschließlich Schlaganfall, bei Bluthochdruckpatienten wirksam ist.
Weitere klinische Endpunkte der LIFE-Studie waren: Gesamtsterblichkeit, Krankenhauseinweisung wegen Herzinsuffizienz oder Angina pectoris, koronare oder periphere Revaskularisierungsverfahren und wiederbelebter Herzstillstand. Es gab keine signifikanten Unterschiede in den Raten dieser Endpunkte zwischen der COZAAR- und der Atenolol-Gruppe.
Für den primären Endpunkt und Schlaganfall sind die Wirkungen von COZAAR 25 mg in Patientenuntergruppen, definiert nach Alter, Geschlecht, Rasse und Vorhandensein oder Nichtvorhandensein von isolierter systolischer Hypertonie (ISH), Diabetes und kardiovaskulärer Erkrankung (CVD) in der Vorgeschichte, in Abbildung 3 unten dargestellt . Subgruppenanalysen können schwierig zu interpretieren sein, und es ist nicht bekannt, ob diese echte Unterschiede oder zufällige Effekte darstellen.
Abbildung 3: Primäre Endpunktereignisse† innerhalb demografischer Untergruppen
Nephropathie bei Typ-2-Diabetikern
Die RENAAL-Studie war eine randomisierte, placebokontrollierte, doppelblinde, multizentrische Studie, die weltweit an 1513 Patienten mit Typ-2-Diabetes mit Nephropathie (definiert als Serumkreatinin 1,3 bis 3,0 mg/dl bei Frauen oder Männern ≤ 60 kg und 1,5 bis 3,0 mg) durchgeführt wurde /dL bei Männern > 60 kg und Proteinurie [Albumin-Kreatinin-Verhältnis im Urin ≥ 300 mg/g]).
Die Patienten wurden randomisiert und erhielten COZAAR 50 mg einmal täglich oder Placebo vor dem Hintergrund einer konventionellen blutdrucksenkenden Therapie, ausgenommen ACE-Hemmer und Angiotensin-II-Antagonisten. Nach einem Monat wurden die Prüfärzte angewiesen, das Studienmedikament auf 100 mg einmal täglich zu titrieren, wenn der Zielwert für den minimalen Blutdruck (140/90 mmHg) nicht erreicht wurde. Insgesamt erhielten 72 % der Patienten die Tagesdosis von 100 mg in mehr als 50 % der Zeit, in der sie das Studienmedikament einnahmen. Da die Studie darauf ausgelegt war, in beiden Gruppen eine gleiche Blutdruckkontrolle zu erreichen, konnten bei Bedarf in beiden Gruppen andere blutdrucksenkende Mittel (Diuretika, Kalziumkanalblocker, Alpha- oder Betablocker und zentral wirkende Mittel) hinzugefügt werden. Die Patienten wurden über eine mittlere Dauer von 3,4 Jahren nachbeobachtet.
Die Studienpopulation war in Bezug auf die Rasse vielfältig (Asiaten 16,7 %, Schwarze 15,2 %, Hispanoamerikaner 18,3 %, Weiße 48,6 %). Insgesamt waren 63,2 % der Patienten Männer und 66,4 % waren jünger als 65 Jahre. Fast alle Patienten (96,6 %) hatten eine Vorgeschichte von Bluthochdruck, und die Patienten wurden mit einem mittleren Serumkreatinin von 1,9 mg/dl und einer mittleren Proteinurie (Urinalbumin/Kreatinin) von 1808 mg/g zu Studienbeginn in die Studie aufgenommen.
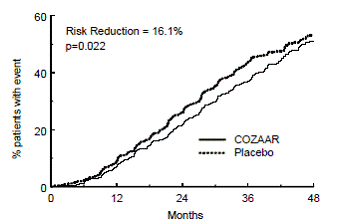
Der primäre Endpunkt der Studie war die Zeit bis zum ersten Auftreten eines der folgenden Ereignisse: Verdopplung des Serumkreatinins, terminale Niereninsuffizienz (ESRD) (Dialyse- oder Transplantationsbedürftigkeit) oder Tod. Die Behandlung mit COZAAR führte bei diesem Endpunkt zu einer Risikoreduktion von 16 % (siehe Abbildung 4 und Tabelle 4). Die Behandlung mit COZAAR reduzierte auch das Auftreten einer anhaltenden Verdopplung des Serumkreatinins um 25 % und der ESRD um 29 % als separate Endpunkte, hatte jedoch keine Auswirkung auf die Gesamtsterblichkeit (siehe Tabelle 4).
Die mittleren Ausgangsblutdrücke betrugen 152/82 mmHg für COZAAR plus konventionelle blutdrucksenkende Therapie und 153/82 mmHg für Placebo plus konventionelle blutdrucksenkende Therapie. Am Ende der Studie betrug der mittlere Blutdruck 143/76 mmHg für die mit COZAAR 100 mg behandelte Gruppe und 146/77 mmHg für die mit Placebo behandelte Gruppe.
Abbildung 4: Kaplan-Meier-Kurve für den primären zusammengesetzten Endpunkt aus Verdopplung des Serumkreatinins, Nierenerkrankung im Endstadium (Dialyse- oder Transplantationsbedarf) oder Tod
Die sekundären Endpunkte der Studie waren die Änderung der Proteinurie, die Änderung der Progressionsrate der Nierenerkrankung und die Kombination aus Morbidität und Mortalität aufgrund kardiovaskulärer Ursachen (Krankenhauseinweisung wegen Herzinsuffizienz, Myokardinfarkt, Revaskularisierung, Schlaganfall, Krankenhauseinweisung wegen instabiler Angina pectoris oder kardiovaskulär Tod). Im Vergleich zu Placebo reduzierte COZAAR signifikant die Proteinurie um durchschnittlich 34 %, eine Wirkung, die innerhalb von 3 Monaten nach Beginn der Therapie offensichtlich war, und reduzierte die Abnahmerate der glomerulären Filtrationsrate während der Studie signifikant um 13 %, gemessen als der Kehrwert der Serumkreatininkonzentration. Es gab keinen signifikanten Unterschied in der Inzidenz des kombinierten Endpunkts aus kardiovaskulärer Morbidität und Mortalität.
Die günstigen Wirkungen von COZAAR wurden bei Patienten beobachtet, die auch andere blutdrucksenkende Arzneimittel (Angiotensin-II-Rezeptor-Antagonisten und Angiotensin-Converting-Enzym-Hemmer waren nicht erlaubt), orale Antidiabetika und Lipidsenker einnahmen.
Für den primären Endpunkt und ESRD sind die Wirkungen von COZAAR in Patientenuntergruppen, definiert nach Alter, Geschlecht und ethnischer Zugehörigkeit, in Tabelle 5 unten dargestellt. Subgruppenanalysen können schwierig zu interpretieren sein und es ist nicht bekannt, ob es sich dabei um echte Unterschiede oder zufällige Effekte handelt.
INFORMATIONEN ZUM PATIENTEN
COZAAR® (CO-zar) (Losartan-Kalium-Tabletten) 25 mg, 50 mg, 100 mg
Lesen Sie die mit COZAAR gelieferte Patienteninformation, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Zustand und Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über COZAAR wissen sollte?
Was ist COZAAR 100 mg?
COZAAR 100 mg ist ein verschreibungspflichtiges Arzneimittel, das als Angiotensin-Rezeptorblocker (ARB) bezeichnet wird. Es ist benutzt:
COZAAR 25 mg wurde bei Kindern unter 6 Jahren oder bei Kindern mit bestimmten Nierenproblemen nicht untersucht.
Bluthochdruck (Hypertonie) Der Blutdruck ist die Kraft in Ihren Blutgefäßen, wenn Ihr Herz schlägt und wenn Ihr Herz ruht. Sie haben Bluthochdruck, wenn die Kraft zu groß ist. COZAAR 25 mg kann Ihren Blutgefäßen helfen, sich zu entspannen, sodass Ihr Blutdruck niedriger ist.
Linksventrikuläre Hypertrophie (LVH) ist eine Vergrößerung der Wände der linken Herzkammer (der Hauptpumpkammer des Herzens). LVH kann aus mehreren Gründen auftreten. Bluthochdruck ist die häufigste Ursache für LVH.
Typ-2-Diabetes mit Nephropathie . Typ-2-Diabetes ist eine Form von Diabetes, die hauptsächlich bei Erwachsenen auftritt. Wenn Sie an diabetischer Nephropathie leiden, bedeutet dies, dass Ihre Nieren aufgrund von Schäden durch Diabetes nicht richtig funktionieren.
Wer sollte COZAAR 100 mg nicht einnehmen?
Was sollte ich meinem Arzt vor der Einnahme von COZAAR 50 mg mitteilen?
Informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. COZAAR und bestimmte andere Arzneimittel können miteinander interagieren. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Wie sollte ich COZAAR 25 mg einnehmen?
Welche Nebenwirkungen kann COZAAR haben?
COZAAR 25 mg kann die folgenden Nebenwirkungen verursachen, die schwerwiegend sein können:
Die häufigsten Nebenwirkungen von COZAAR 50 mg bei Menschen mit Bluthochdruck sind:
Die häufigsten Nebenwirkungen von COZAAR 50 mg bei Menschen mit Typ-2-Diabetes mit diabetischer Nierenerkrankung sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung bemerken, die Sie stört oder die nicht abklingt.
Das ist nicht eine vollständige Liste der Nebenwirkungen. Fragen Sie Ihren Arzt oder Apotheker nach einer vollständigen Liste.
Wie ist COZAAR 100 mg aufzubewahren?
Allgemeine Informationen zu COZAAR
Medikamente werden manchmal für Erkrankungen verschrieben, die nicht in der Packungsbeilage erwähnt sind. Verwenden Sie COZAAR nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie COZAAR nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Broschüre fasst die wichtigsten Informationen über COZAAR zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen über COZAAR bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Was sind die Inhaltsstoffe von COZAAR 25 mg?
Wirkstoffe: Losartan-Kalium
Inaktive Zutaten:
mikrokristalline Zellulose, wässrige Laktose, vorgelatinierte Stärke, Magnesiumstearat, Hydroxypropylzellulose, Hypromellose und Titandioxid. COZAAR 25 mg, COZAAR 50 mg und COZAAR 100 mg können auch Carnaubawachs enthalten.