Hyzaar 12.5mg Hydrochlorothiazide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Hyzaar und wie wird es angewendet?
Hyzaar 12,5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie). Hyzaar kann allein oder mit anderen Medikamenten verwendet werden.
Hyzaar gehört zu einer Klasse von Medikamenten namens ARB/HCTZ Combos.
Es ist nicht bekannt, ob Hyzaar bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Hyzaar 12,5 mg haben?
Hyzaar kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Hyzaar sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Hyzaar. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
Wenn eine Schwangerschaft festgestellt wird, brechen Sie HYZAAR so schnell wie möglich ab. Medikamente, die direkt auf das Renin-Angiotensin-System wirken, können Verletzungen und den Tod des sich entwickelnden Fötus verursachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
BEZEICHNUNG
HYZAAR 50/12,5 (Losartan-Kalium-Hydrochlorothiazid), HYZAAR 100/12,5 (Losartan-Kalium-Hydrochlorothiazid) und HYZAAR 100/25 (Losartan-Kalium-Hydrochlorothiazid) Tabletten kombinieren einen Angiotensin-II-Rezeptorblocker, der auf den AT1-Rezeptor-Subtyp wirkt, und ein Diuretikum, Hydrochlorothiazid.
Losartan-Kalium, ein Nicht-Peptid-Molekül, wird chemisch als 2-Butyl-4-chlor-1-[p-(o-1H-tetrazol-5-ylphenyl)benzyl]imidazol-5-methanolmonokaliumsalz beschrieben. Seine Summenformel ist C22H22ClKN6O und seine Strukturformel ist:
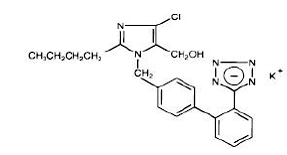
Losartan-Kalium ist ein weißes bis cremefarbenes, frei fließendes, kristallines Pulver mit einem Molekulargewicht von 461,01. Es ist frei löslich in Wasser, löslich in Alkoholen und leicht löslich in üblichen organischen Lösungsmitteln wie Acetonitril und Methylethylketon.
Die Oxidation der 5-Hydroxymethylgruppe am Imidazolring führt zum aktiven Metaboliten von Losartan.
Hydrochlorothiazid ist 6-Chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Seine Summenformel ist C7H8ClN3O4S2 und seine Strukturformel ist:
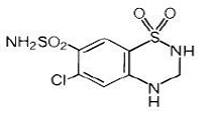
Hydrochlorothiazid ist ein weißes oder praktisch weißes, kristallines Pulver mit einem Molekulargewicht von 297,74, das in Wasser schwer löslich, aber in Natriumhydroxidlösung gut löslich ist.
HYZAAR ist zur oralen Verabreichung in drei Tablettenkombinationen aus Losartan und Hydrochlorothiazid erhältlich. HYZAAR 50/12,5 enthält 50 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid. HYZAAR 100/12,5 enthält 100 mg Losartan-Kalium und 12,5 mg Hydrochlorothiazid. HYZAAR 100/25 enthält 100 mg Losartan-Kalium und 25 mg Hydrochlorothiazid. Inaktive Bestandteile sind mikrokristalline Zellulose, Lactosehydrat, vorgelatinierte Stärke, Magnesiumstearat, Hydroxypropylzellulose, Hypromellose und Titandioxid.
HYZAAR 50/12,5 und HYZAAR 100/25 enthalten auch D&C Yellow Nr. 10 Aluminiumlack. HYZAAR 50/12,5, HYZAAR 100/12,5 und HYZAAR 100/25 können auch Carnaubawachs enthalten.
HYZAAR 50/12,5 enthält 4,24 mg (0,108 mEq) Kalium, HYZAAR 100/12,5 enthält 8,48 mg (0,216 mEq) Kalium und HYZAAR 100/25 enthält 8,48 mg (0,216 mEq) Kalium.
INDIKATIONEN
Hypertonie
HYZAAR® ist zur Behandlung von Bluthochdruck indiziert, um den Blutdruck zu senken. Die Senkung des Blutdrucks senkt das Risiko tödlicher und nicht tödlicher kardiovaskulärer (CV) Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen, einschließlich Losartan und Hydrochlorothiazid, beobachtet.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als 1 Medikament, um die Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt die Medikamente, die größtenteils für diese Vorteile verantwortlich sind. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Mortalität wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass selbst eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Reduktion des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absolutem Risiko ähnlich, sodass der absolute Nutzen bei Patienten größer ist, die unabhängig von ihrer Hypertonie einem höheren Risiko ausgesetzt sind (z. B. Patienten mit Diabetes oder Hyperlipidämie), und solche Patienten wären zu erwarten um von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel zu profitieren.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten.
Diese Fixdosis-Kombination ist nicht für die Initialtherapie der Hypertonie indiziert, es sei denn, die Hypertonie ist so schwer, dass der Wert einer sofortigen Blutdruckkontrolle das Risiko des Beginns einer Kombinationstherapie bei diesen Patienten übersteigt [siehe Klinische Studien und DOSIERUNG UND ANWENDUNG ].
HYZAAR kann zusammen mit anderen Antihypertensiva verabreicht werden.
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
HYZAAR ist indiziert, um das Schlaganfallrisiko bei Patienten mit Bluthochdruck und linksventrikulärer Hypertrophie zu verringern, aber es gibt Hinweise darauf, dass dieser Vorteil nicht für Patienten mit schwarzer Hautfarbe gilt. [Sehen Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE , und DOSIERUNG UND ANWENDUNG .]
DOSIERUNG UND ANWENDUNG
Hypertonie
Die übliche Anfangsdosis von HYZAAR beträgt 50/12,5 (Losartan 50 mg/Hydrochlorothiazid 12,5 mg) einmal täglich. Die Dosierung kann nach 3-wöchiger Therapie auf maximal 100/25 (Losartan 100 mg/Hydrochlorothiazid 25 mg) einmal täglich erhöht werden, um den Blutdruck zu kontrollieren [siehe Klinische Studien ].
Leiten Sie bei einem Patienten, dessen Blutdruck mit Losart nicht ausreichend kontrolliert ist, eine 50-mg-Monotherapie mit HYZAAR 50/12,5 einmal täglich ein. Bleibt der Blutdruck nach etwa 3 Wochen Therapie unkontrolliert, kann die Dosierung auf zwei Tabletten HYZAAR 50/12,5 einmal täglich oder eine Tablette HYZAAR 100/25 einmal täglich erhöht werden.
Beginnen Sie bei einem Patienten, dessen Blutdruck mit Losartan 100 mg Monotherapie nicht ausreichend kontrolliert werden kann, mit HYZAAR 100/12,5 (Losartan 100 mg/Hydrochlorothiazid 12,5 mg) einmal täglich. Bleibt der Blutdruck nach etwa 3 Wochen Therapie unkontrolliert, erhöhen Sie die Dosis auf zwei Tabletten HYZAAR 50/12,5 einmal täglich oder eine Tablette HYZAAR 100/25 einmal täglich.
Beginnen Sie bei einem Patienten, dessen Blutdruck mit 25 mg Hydrochlorothiazid einmal täglich unzureichend eingestellt ist, oder bei dem der Blutdruck unter diesem Regime eingestellt ist, bei dem jedoch eine Hypokaliämie auftritt, mit HYZAAR 50/12,5 einmal täglich und reduzieren Sie die Dosis von Hydrochlorothiazid, ohne die insgesamt erwartete antihypertensive Wirkung zu verringern. Beurteilen Sie das klinische Ansprechen auf HYZAAR 50/12,5 und erhöhen Sie die Dosis auf zwei Tabletten HYZAAR 50/12,5 einmal täglich oder eine Tablette HYZAAR 100/25 einmal täglich, falls der Blutdruck nach etwa 3 Wochen Therapie unkontrolliert bleibt.
Bluthochdruckpatienten mit linksventrikulärer Hypertrophie
Bei Patienten, deren Blutdruck mit 50 mg Losartan-Kalium nicht ausreichend kontrolliert werden kann, ist eine Behandlung mit HYZAAR 50/12,5 einzuleiten. Wenn eine zusätzliche Blutdrucksenkung erforderlich ist, erhöhen Sie die Dosis auf HYZAAR 100/12,5, gefolgt von HYZAAR 100/25. Zur weiteren Blutdrucksenkung fügen Sie andere Antihypertonika hinzu [siehe Klinische Studien ].
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
HYZAAR wird als Filmtablette geliefert.
Bei 25 °C (77 °F) lagern; Exkursionen bis 15-30°C (59-86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Behälter dicht geschlossen halten. Vor Licht schützen.
Hergestellt für: Organon LLC, eine Tochtergesellschaft von ORGANON & Co., Jersey City, NJ 07302, USA. Überarbeitet: Juni 2021
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die Sicherheit von Losartan-Kalium-Hydrochlorothiazid wurde bei 858 Patienten, die wegen essentieller Hypertonie behandelt wurden, und bei 3889 Patienten, die wegen Hypertonie und linksventrikulärer Hypertrophie behandelt wurden, untersucht. Die meisten Nebenwirkungen waren leichter und vorübergehender Natur und erforderten keinen Abbruch der Therapie. In kontrollierten klinischen Studien war ein Abbruch der Therapie aufgrund klinischer Nebenwirkungen nur bei 2,8 % bzw. 2,3 % der mit der Kombination bzw. Placebo behandelten Patienten erforderlich.
In diesen doppelblinden, kontrollierten klinischen Studien traten bei mehr als 2 % der mit Losartan-Hydrochlorothiazid behandelten Patienten und häufiger als unter Placebo folgende Nebenwirkungen auf: Rückenschmerzen (2,1 % vs. 0,6 %), Schwindel (5,7 % vs. 2,9 %). und Infektionen der oberen Atemwege (6,1 % vs. 4,6 %).
Die folgenden zusätzlichen Nebenwirkungen wurden in klinischen Studien mit HYZAAR und/oder den einzelnen Bestandteilen berichtet:
Erkrankungen des Blutes und des Lymphsystems: Anämie, aplastische Anämie, hämolytische Anämie, Leukopenie, Agranulozytose.
Stoffwechsel- und Ernährungsstörungen: Anorexie, Hyperglykämie, Hyperurikämie, Elektrolytstörungen einschließlich Hyponatriämie und Hypokaliämie.
Psychische Störungen: Schlaflosigkeit, Unruhe.
Erkrankungen des Nervensystems: Dysgeusie, Kopfschmerzen, Migräne, Parästhesien.
Augenerkrankungen: Xanthopsie, vorübergehend verschwommenes Sehen.
Herzerkrankungen: Herzklopfen, Tachykardie.
Gefäßerkrankungen: Dosisabhängige orthostatische Wirkungen, nekrotisierende Angiitis (Vaskulitis, kutane Vaskulitis).
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Verstopfte Nase.
Gastrointestinale Störungen: Dyspepsie, Bauchschmerzen, Magenreizung, Krämpfe, Übelkeit, Erbrechen, Pankreatitis, Sialoadenitis.
Leber- und Gallenerkrankungen: Gelbsucht (intrahepatische cholestatische Gelbsucht).
Erkrankungen der Haut und des Unterhautzellgewebes: Hautausschlag, Juckreiz, Purpura, toxische epidermale Nekrolyse, Urtikaria, Lichtempfindlichkeit, kutaner Lupus erythematodes.
Erkrankungen des Bewegungsapparates und des Bindegewebes: Muskelkrämpfe, Muskelkrämpfe.
Erkrankungen der Nieren und Harnwege: Glykosurie, Nierenfunktionsstörung, interstitielle Nephritis, Nierenversagen.
Störungen des Fortpflanzungssystems und der Brust: Erektile Dysfunktion/Impotenz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Brustschmerzen, Unwohlsein, Schwäche.
Untersuchungen: Leberfunktionsstörungen.
Husten
Anhaltender trockener Husten wurde mit der Anwendung von ACE-Hemmern in Verbindung gebracht und kann in der Praxis ein Grund für das Absetzen der ACE-Hemmer-Therapie sein. Zwei prospektive, doppelblinde, randomisierte, kontrollierte Parallelgruppenstudien wurden durchgeführt, um die Wirkungen von Losartan auf das Auftreten von Husten bei Bluthochdruckpatienten zu beurteilen, die während der Behandlung mit ACE-Hemmern Husten hatten. Patienten mit typischem ACE-Hemmer-Husten bei Provokation mit Lisinopril, deren Husten unter Placebo verschwand, wurden randomisiert Losartan 50 mg, Lisinopril 20 mg oder entweder Placebo (eine Studie, n = 97) oder 25 mg Hydrochlorothiazid (n = 135) zugeteilt. Die doppelblinde Behandlungsdauer dauerte bis zu 8 Wochen. Das Auftreten von Husten ist in Tabelle 1 unten gezeigt.
Diese Studien zeigen, dass die Inzidenz von Husten im Zusammenhang mit einer Losartan-Therapie in einer Population, die alle Husten im Zusammenhang mit einer ACE-Hemmer-Therapie hatte, derjenigen im Zusammenhang mit einer Hydrochlorothiazid- oder Placebo-Therapie entspricht.
Nach der Markteinführung wurden Fälle von Husten, einschließlich positiver erneuter Provokationen, bei der Anwendung von Losartan berichtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von HYZAAR nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Verdauungs: Bei mit Losartan behandelten Patienten wurde selten über Hepatitis berichtet.
Hämatologisch: Thrombozytopenie.
Überempfindlichkeit: Bei Patienten, die mit Losartan behandelt wurden, wurde selten über Angioödeme, einschließlich Schwellungen des Kehlkopfes und der Glottis, die eine Obstruktion der Atemwege und/oder Schwellungen des Gesichts, der Lippen, des Rachens und/oder der Zunge verursachten, berichtet; Bei einigen dieser Patienten kam es zuvor mit anderen Arzneimitteln, einschließlich ACE-Hemmern, zu Angioödemen. Unter Losartan wurde über Vaskulitis, einschließlich Purpura Schönlein-Henoch, berichtet. Anaphylaktische Reaktionen wurden berichtet.
Bewegungsapparat: Rhabdomyolyse.
Haut: Erythrodermie.
Nicht-melanozytärer Hautkrebs: Hydrochlorothiazid ist mit einem erhöhten Risiko für nicht-melanozytären Hautkrebs verbunden. In einer im Rahmen des Sentinel-Systems durchgeführten Studie bestand ein erhöhtes Risiko hauptsächlich für Plattenepithelkarzinome (SCC) und für weiße Patienten, die hohe kumulative Dosen einnahmen. Das erhöhte Risiko für SCC in der Gesamtpopulation betrug etwa 1 zusätzlichen Fall pro 16.000 Patienten pro Jahr, und für weiße Patienten, die eine kumulative Dosis von ≥ 50.000 mg einnahmen, betrug die Risikoerhöhung etwa 1 zusätzlichen Fall für SCC pro 6.700 Patienten pro Jahr.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mittel zur Erhöhung des Serumkaliums
Die gleichzeitige Anwendung von Losartan mit anderen Arzneimitteln, die den Kaliumspiegel im Serum erhöhen, kann zu einer Hyperkaliämie führen. Überwachen Sie bei solchen Patienten das Serumkalium.
Lithium
Bei gleichzeitiger Anwendung von Angiotensin-II-Rezeptor-Antagonisten oder Thiazid-Diuretika wurde über einen Anstieg der Serum-Lithium-Konzentration und eine Lithium-Toxizität berichtet. Überwachen Sie den Lithiumspiegel bei Patienten, die HYZAAR 12,5 mg und Lithium erhalten.
Nichtsteroidale Entzündungshemmer, einschließlich selektiver Cyclooxygenase-2-Inhibitoren
Losartan Kalium
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretikatherapie) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit Angiotensin-II-Rezeptorantagonisten (einschließlich Losartan) zu einer Verschlechterung der Nierenfunktion führen Nierenfunktion, einschließlich möglicher akuter Niereninsuffizienz. Diese Effekte sind normalerweise reversibel. Bei Patienten, die mit Losartan und NSAR behandelt werden, ist die Nierenfunktion regelmäßig zu überwachen.
Die blutdrucksenkende Wirkung von Angiotensin-II-Rezeptor-Antagonisten, einschließlich Losartan, kann durch NSAIDs, einschließlich selektiver COX-2-Hemmer, abgeschwächt werden.
Hydrochlorothiazid
Die Verabreichung eines nichtsteroidalen entzündungshemmenden Mittels, einschließlich eines selektiven COX-2-Hemmers, kann die diuretische, natriuretische und blutdrucksenkende Wirkung von Schleifendiuretika, kaliumsparenden Diuretika und Thiaziddiuretika verringern. Daher ist bei gleichzeitiger Anwendung von HYZAAR und nichtsteroidalen entzündungshemmenden Mitteln, einschließlich selektiver COX-2-Hemmer, genau zu beobachten, ob die gewünschte Wirkung des Diuretikums eintritt.
Bei Patienten, die mit Diuretika behandelt werden, kann die gleichzeitige Anwendung von NSAIDs mit Angiotensinrezeptorblockern, einschließlich Losartan, zu einer Verschlechterung der Nierenfunktion führen, einschließlich eines möglichen akuten Nierenversagens. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Hydrochlorothiazid-, Losartan- und NSAID-Therapie erhalten.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Synkope, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden.
In die Studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) wurden 1448 Patienten mit Typ-2-Diabetes, erhöhtem Albumin-zu-Kreatinin-Verhältnis im Urin und verringerter geschätzter glomerulärer Filtrationsrate (GFR 30 bis 89,9 ml/min) aufgenommen und randomisiert Lisinopril oder Placebo vor dem Hintergrund einer Losartan-Therapie und folgten ihnen über einen Median von 2,2 Jahren. Patienten, die die Kombination aus Losartan und Lisinopril erhielten, erzielten im Vergleich zur Monotherapie keinen zusätzlichen Nutzen für den kombinierten Endpunkt Abnahme der GFR, terminale Niereninsuffizienz oder Tod, zeigten jedoch eine erhöhte Inzidenz von Hyperkaliämie und akuter Nierenschädigung im Vergleich zur Monotherapie Gruppe.
Bei Patienten, die mit HYZAAR 12,5 mg und anderen Wirkstoffen, die das RAS beeinflussen, behandelt werden, sind Blutdruck, Nierenfunktion und Elektrolyte engmaschig zu überwachen.
Verabreichen Sie Aliskiren nicht zusammen mit HYZAAR 12,5 mg bei Patienten mit Diabetes. Vermeiden Sie die Anwendung von Aliskiren mit HYZAAR 12,5 mg bei Patienten mit eingeschränkter Nierenfunktion (GFR
Die Verwendung von Hydrochlorothiazid mit anderen Drogen
Bei gleichzeitiger Verabreichung können die folgenden Arzneimittel mit Thiaziddiuretika interagieren [siehe KLINISCHE PHARMAKOLOGIE ]:
Antidiabetika (orale Wirkstoffe und Insulin) – Eine Dosisanpassung des Antidiabetikums kann erforderlich sein.
Cholestyramin- und Colestipolharze – Die Resorption von Hydrochlorothiazid wird in Gegenwart von Anionenaustauscherharzen beeinträchtigt. Einzeldosen von entweder Cholestyramin- oder Colestipolharzen binden das Hydrochlorothiazid und reduzieren seine Resorption aus dem Magen-Darm-Trakt um bis zu 85 bzw. 43 Prozent.
Staffeln Sie die Dosierung von Hydrochlorothiazid und Harz so, dass Hydrochlorothiazid mindestens 4 Stunden vor oder 4 bis 6 Stunden nach der Verabreichung des Harzes verabreicht wird.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Fötale Toxizität
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie HYZAAR 12,5 mg so schnell wie möglich ab.
Thiazide passieren die Plazentaschranke und treten im Nabelschnurblut auf. Zu den Nebenwirkungen zählen fötale oder neonatale Gelbsucht, Thrombozytopenie [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hypotonie bei Patienten mit Volumen- oder Salzmangel
Bei Patienten mit einem aktivierten Renin-Angiotensin-System, wie z. B. Patienten mit Volumen- oder Salzmangel (z. B. Patienten, die mit hochdosierten Diuretika behandelt werden), kann nach Beginn der Behandlung mit HYZAAR eine symptomatische Hypotonie auftreten. Korrigieren Sie den Volumen- oder Salzmangel vor der Verabreichung von HYZAAR. Verwenden Sie HYZAAR nicht als Initialtherapie bei Patienten mit intravaskulärem Volumenmangel.
Beeinträchtigte Nierenfunktion
Veränderungen der Nierenfunktion einschließlich akutem Nierenversagen können durch Arzneimittel, die das Renin-Angiotensin-System hemmen, und durch Diuretika verursacht werden. Patienten, deren Nierenfunktion teilweise von der Aktivität des Renin-Angiotensin-Systems abhängt (z. B. Patienten mit Nierenarterienstenose, chronischer Nierenerkrankung, schwerer dekompensierter Herzinsuffizienz oder Volumenmangel), können einem besonderen Risiko ausgesetzt sein, ein akutes Nierenversagen zu entwickeln HYZAAR. Überwachen Sie die Nierenfunktion bei diesen Patienten regelmäßig. Erwägen Sie das Aussetzen oder Absetzen der Therapie bei Patienten, die unter HYZAAR eine klinisch signifikante Abnahme der Nierenfunktion entwickeln [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Überempfindlichkeit
Überempfindlichkeitsreaktionen auf Hydrochlorothiazid können bei Patienten mit oder ohne Allergie oder Bronchialasthma in der Vorgeschichte auftreten, sind aber bei Patienten mit einer solchen Vorgeschichte wahrscheinlicher.
Elektrolyt- und metabolische Wirkungen
In doppelblinden klinischen Studien mit verschiedenen Dosen von Losartan-Kalium und Hydrochlorothiazid betrug die Inzidenz von hypertensiven Patienten, die eine Hypokaliämie (Serumkalium 5,7 mEq/l) betrug 0,4 % gegenüber 0 % bei Placebo.
HYZAAR enthält Hydrochlorothiazid, das Hypokaliämie, Hyponatriämie und Hypomagnesiämie verursachen kann. Hypomagnesiämie kann zu Hypokaliämie führen, die trotz Kaliumsättigung schwierig zu behandeln sein kann. HYZAAR 12,5 mg enthält auch Losartan, das eine Hyperkaliämie verursachen kann. Überwachen Sie regelmäßig die Serumelektrolyte [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die gleichzeitige Anwendung anderer Arzneimittel, die das Serumkalium erhöhen können, kann zu Hyperkaliämie führen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hydrochlorothiazid kann die Glukosetoleranz verändern und die Serumspiegel von Cholesterin und Triglyceriden erhöhen.
Bei Patienten, die eine Thiazidtherapie erhalten, kann eine Hyperurikämie auftreten oder eine offene Gicht ausgelöst werden. Da Losartan die Harnsäure senkt, schwächt Losartan in Kombination mit Hydrochlorothiazid die Diuretika-induzierte Hyperurikämie ab.
Hydrochlorothiazid verringert die Kalziumausscheidung im Urin und kann Erhöhungen des Serumkalziums verursachen. Überwachen Sie den Kalziumspiegel.
Akute Myopie und sekundäres Engwinkelglaukom
Hydrochlorothiazid, ein Sulfonamid, kann eine idiosynkratische Reaktion hervorrufen, die zu akuter vorübergehender Myopie und akutem Engwinkelglaukom führt. Zu den Symptomen gehören ein akuter Beginn einer verminderten Sehschärfe oder Augenschmerzen und treten typischerweise innerhalb von Stunden bis Wochen nach Beginn der Behandlung auf. Unbehandeltes akutes Engwinkelglaukom kann zu dauerhaftem Sehverlust führen. Die primäre Behandlung besteht darin, Hydrochlorothiazid so schnell wie möglich abzusetzen. Wenn der Augeninnendruck unkontrolliert bleibt, müssen möglicherweise umgehend medizinische oder chirurgische Behandlungen in Betracht gezogen werden. Risikofaktoren für die Entwicklung eines akuten Engwinkelglaukoms können eine Sulfonamid- oder Penicillinallergie in der Vorgeschichte sein.
Systemischer Lupus erythematodes
Es wurde berichtet, dass Thiaziddiuretika eine Exazerbation oder Aktivierung des systemischen Lupus erythematodes verursachen.
Postsympathektomie-Patienten
Die antihypertensiven Wirkungen des Arzneimittels können bei Postsympathektomie-Patienten verstärkt werden.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Schwangerschaft
Informieren Sie Patientinnen im gebärfähigen Alter über die Folgen einer Exposition gegenüber HYZAAR 12,5 mg während der Schwangerschaft. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Weisen Sie die Patientinnen an, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].

Symptomatische Hypotonie
Weisen Sie die Patienten darauf hin, dass insbesondere in den ersten Tagen der Therapie Schwindel auftreten kann, und melden Sie dieses Symptom einem Arzt. Informieren Sie die Patienten darüber, dass Dehydrierung durch unzureichende Flüssigkeitsaufnahme, übermäßiges Schwitzen, Erbrechen oder Durchfall zu einem übermäßigen Abfall des Blutdrucks führen kann. Wenn eine Synkope auftritt, raten Sie den Patienten, sich an ihren Arzt zu wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kalium-Ergänzungen
Weisen Sie die Patienten darauf hin, keine Kaliumpräparate oder kaliumhaltigen Salzersatzmittel ohne Rücksprache mit ihrem Arzt zu verwenden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Akute Myopie und sekundäres Engwinkelglaukom
Weisen Sie die Patienten an, HYZAAR 12,5 mg abzusetzen und sofort einen Arzt aufzusuchen, wenn bei ihnen Symptome einer akuten Myopie oder eines sekundären Engwinkelglaukoms auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Losartan Kalium-Hydrochlorothiazid
Mit der Losartan-Kalium-Hydrochlorothiazid-Kombination wurden keine Kanzerogenitätsstudien durchgeführt.
Losartan-Kalium-Hydrochlorothiazid war bei Tests in einem Gewichtsverhältnis von 4:1 im mikrobiellen Ames-Mutagenese-Assay und im V-79-Lungenzellen-Mutagenese-Assay des chinesischen Hamsters negativ. Darüber hinaus gab es in nicht zytotoxischen Konzentrationen im In-vitro-Test mit alkalischer Elution an Rattenhepatozyten und im In-vitro-Chromosomenaberrationstest an Eierstockzellen des chinesischen Hamsters keine Hinweise auf eine direkte Genotoxizität.
Losartan-Kalium, das zusammen mit Hydrochlorothiazid verabreicht wurde, hatte bei Dosierungen von bis zu 135 mg/kg/Tag Losartan und 33,75 mg/kg/Tag Hydrochlorothiazid keine Auswirkung auf die Fertilität oder das Paarungsverhalten männlicher Ratten. Es hat sich gezeigt, dass diese Dosierungen zu entsprechenden systemischen Expositionen (AUCs) für Losartan, seinen aktiven Metaboliten und Hydrochlorothiazid führen, die etwa 60-, 60- und 30-mal höher sind als die, die beim Menschen mit 100 mg Losartan-Kalium in Kombination mit 25 mg Hydrochlorothiazid erreicht werden. Bei weiblichen Ratten war jedoch die gleichzeitige Verabreichung von so niedrigen Dosen wie 10 mg/kg/Tag Losartan und 2,5 mg/kg/Tag Hydrochlorothiazid mit einer leichten, aber statistisch signifikanten Abnahme der Fruchtbarkeit und der Fertilitätsindizes verbunden. Die AUC-Werte für Losartan, seinen aktiven Metaboliten und Hydrochlorothiazid, extrapoliert aus Daten, die mit Losartan erhalten wurden, das Ratten in einer Dosis von 50 mg/kg/Tag in Kombination mit 12,5 mg/kg/Tag Hydrochlorothiazid verabreicht wurde, betrugen ungefähr 6, 2 und 2 Mal größer als die, die beim Menschen mit 100 mg Losartan in Kombination mit 25 mg Hydrochlorothiazid erreicht werden.
Losartan Kalium
Losartan-Kalium war nicht karzinogen, wenn es Ratten und Mäusen über 105 bzw. 92 Wochen in maximal verträglichen Dosierungen verabreicht wurde. Weibliche Ratten, denen die höchste Dosis (270 mg/kg/Tag) verabreicht wurde, hatten eine etwas höhere Inzidenz von Azinusadenomen des Pankreas. Die maximal tolerierten Dosierungen (270 mg/kg/Tag bei Ratten, 200 mg/kg/Tag bei Mäusen) führten zu einer systemischen Exposition von Losartan und seinem pharmakologisch aktiven Metaboliten, die etwa das 160- und 90-fache (Ratten) und das 30- und 15-fache (Mäuse) betrug ) die Exposition eines 50 kg schweren Menschen bei 100 mg pro Tag.
Losartan-Kalium war im mikrobiellen Mutagenese- und V-79-Säugerzell-Mutagenese-Assay sowie im alkalischen In-vitro-Elutions- und In-vitro- und In-vivo-Chromosomenaberrationsassay negativ. Darüber hinaus zeigte der aktive Metabolit keine Hinweise auf Genotoxizität in mikrobiellen Mutagenese-, alkalischen In-vitro-Elutions- und In-vitro-Chromosomenaberrationsassays.
Fertilität und Fortpflanzungsfähigkeit wurden in Studien mit männlichen Ratten, denen Losartan-Kalium in Dosen von bis zu etwa 150 mg/kg/Tag verabreicht wurde, nicht beeinträchtigt. Die Verabreichung toxischer Dosierungen bei Frauen (300/200 mg/kg/Tag) war mit einer signifikanten (p
Hydrochlorothiazid
Zweijährige Fütterungsstudien an Mäusen und Ratten, die unter der Schirmherrschaft des National Toxicology Program (NTP) durchgeführt wurden, ergaben keine Hinweise auf ein karzinogenes Potenzial von Hydrochlorothiazid bei weiblichen Mäusen (bei Dosen von bis zu etwa 600 mg/kg/Tag) oder bei männlichen und weibliche Ratten (in Dosen von bis zu etwa 100 mg/kg/Tag). Das NTP fand jedoch zweideutige Beweise für die Hepatokanzerogenität bei männlichen Mäusen.
Hydrochlorothiazid war in vitro im Ames-Mutagenitätstest der Salmonella typhimurium-Stämme TA 98, TA 100, TA 1535, TA 1537 und TA 1538 und im Chinese Hamster Ovary (CHO)-Test auf Chromosomenaberrationen oder in vivo in Assays nicht genotoxisch Keimzellchromosomen der Maus, Knochenmarkchromosomen des chinesischen Hamsters und das geschlechtsgebundene rezessive letale Merkmalsgen von Drosophila. Positive Testergebnisse wurden nur in den In-vitro-Assays CHO Sister Chromatid Exchange (Klastogenität) und Maus-Lymphomzellen (Mutagenität) unter Verwendung von Hydrochlorothiazidkonzentrationen von 43 bis 1300 mcg/ml und im Aspergillus nidulans Non-Disjunction-Assay erhalten eine unbestimmte Konzentration.
Hydrochlorothiazid hatte keine nachteiligen Auswirkungen auf die Fertilität von Mäusen und Ratten beiderlei Geschlechts in Studien, in denen diese Arten über ihre Nahrung Dosen von bis zu 100 bzw. 4 mg/kg vor der Paarung und während der gesamten Trächtigkeit ausgesetzt waren.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie D
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie Losartan so schnell wie möglich ab. Diese unerwünschten Wirkungen sind normalerweise mit der Anwendung dieser Arzneimittel im zweiten und dritten Trimenon der Schwangerschaft verbunden. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Eine angemessene Behandlung der mütterlichen Hypertonie während der Schwangerschaft ist wichtig, um die Ergebnisse für Mutter und Fötus zu optimieren.
In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus. Führen Sie serielle Ultraschalluntersuchungen durch, um die intraamniotische Umgebung zu beurteilen. Wenn Oligohydramnion beobachtet wird, HYZAAR absetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat. Beobachten Sie Säuglinge, die in der Vergangenheit HYZAAR 12,5 mg in der Gebärmutter ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie [siehe Pädiatrische Verwendung ].
Es gab keine Hinweise auf Teratogenität bei Ratten oder Kaninchen, die mit einer maximalen Losartan-Kalium-Dosis von 10 mg/kg/Tag in Kombination mit 2,5 mg/kg/Tag Hydrochlorothiazid behandelt wurden. Bei diesen Dosierungen betrugen die jeweiligen Expositionen (AUCs) von Losartan, seinem aktiven Metaboliten und Hydrochlorothiazid bei Kaninchen etwa das 5-, 1,5- und 1,0-fache derjenigen, die beim Menschen mit 100 mg Losartan in Kombination mit 25 mg Hydrochlorothiazid erreicht wurden. Die AUC-Werte für Losartan, seinen aktiven Metaboliten und Hydrochlorothiazid, extrapoliert aus Daten, die mit Losartan erhalten wurden, das Ratten in einer Dosis von 50 mg/kg/Tag in Kombination mit 12,5 mg/kg/Tag Hydrochlorothiazid verabreicht wurde, betrugen ungefähr 6, 2 und 2 Mal größer als die, die beim Menschen mit 100 mg Losartan in Kombination mit 25 mg Hydrochlorothiazid erreicht werden. Eine fötale Toxizität bei Ratten, die sich in einer leichten Zunahme überzähliger Rippen zeigte, wurde beobachtet, wenn weibliche Tiere vor und während der Trächtigkeit mit 10 mg/kg/Tag Losartan in Kombination mit 2,5 mg/kg/Tag Hydrochlorothiazid behandelt wurden. Wie auch in Studien mit Losartan allein beobachtet, traten unerwünschte Wirkungen auf den Fötus und das Neugeborene auf, einschließlich verringertem Körpergewicht, Nierentoxizität und Mortalität, wenn trächtige Ratten während der späten Trächtigkeit und/oder Laktation mit 50 mg/kg/Tag Losartan in Kombination mit behandelt wurden 12,5 mg/kg/Tag Hydrochlorothiazid. Die jeweiligen AUCs für Losartan, seinen aktiven Metaboliten und Hydrochlorothiazid bei diesen Dosierungen waren bei Ratten etwa 35-, 10- und 10-mal höher als die, die beim Menschen nach Verabreichung von 100 mg Losartan in Kombination mit 25 mg Hydrochlorothiazid erreicht wurden. Bei Gabe von Hydrochlorothiazid ohne Losartan an trächtige Mäuse und Ratten während ihrer jeweiligen Phase der Hauptorganogenese in Dosen von bis zu 3000 bzw. 1000 mg/kg/Tag gab es keine Hinweise auf eine Schädigung des Fötus.
Thiazide passieren die Plazentaschranke und treten im Nabelschnurblut auf. Es besteht das Risiko von fötaler oder neonataler Gelbsucht, Thrombozytopenie und möglicherweise anderen Nebenwirkungen, die bei Erwachsenen aufgetreten sind.
Stillende Mutter
Es ist nicht bekannt, ob Losartan in die Muttermilch übergeht, aber es wurde gezeigt, dass in Rattenmilch signifikante Konzentrationen von Losartan und seinem aktiven Metaboliten vorhanden sind. Thiazide treten in der Muttermilch auf. Wegen möglicher unerwünschter Wirkungen auf den Säugling sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen beendet oder das Medikament abgesetzt werden soll.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von HYZAAR bei pädiatrischen Patienten wurde nicht nachgewiesen.
Neugeborene mit einer Vorgeschichte von In-utero-Exposition gegenüber HYZAAR
Wenn Oligurie oder Hypotonie auftritt, lenken Sie die Aufmerksamkeit auf die Unterstützung des Blutdrucks und der Nierendurchblutung. Um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen, kann eine Austauschtransfusion oder Dialyse erforderlich sein.
Geriatrische Verwendung
In einer kontrollierten klinischen Studie zur Verringerung des kombinierten Risikos für kardiovaskulären Tod, Schlaganfall und Myokardinfarkt bei hypertensiven Patienten mit linksventrikulärer Hypertrophie waren 2857 Patienten (62 %) 65 Jahre und älter, während 808 Patienten (18 %) 75 Jahre alt waren und über. Um den Blutdruck in dieser Studie zu kontrollieren, wurde den Patienten Losartan und Hydrochlorothiazid in 74 % der Gesamtzeit, in der sie das Studienmedikament einnahmen, gleichzeitig verabreicht. Insgesamt wurden keine Unterschiede in der Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet. Unerwünschte Ereignisse traten bei älteren Patienten sowohl in der Losartan-Hydrochlorothiazid- als auch in der Kontrollgruppe etwas häufiger auf als bei jüngeren Patienten [siehe KLINISCHE PHARMAKOLOGIE ].
Wettrennen
In der LIFE-Studie (Losartan Intervention For Endpoint Reduction in Hypertension) hatten mit Atenolol behandelte Patienten schwarzer Hautfarbe mit Bluthochdruck und linksventrikulärer Hypertrophie ein geringeres Schlaganfallrisiko, dem primären kombinierten Endpunkt, im Vergleich zu Patienten schwarzer Hautfarbe, die mit Losartan (beide gleichzeitig mit Hydrochlorothiazid behandelt) behandelt wurden bei den meisten Patienten). In der Untergruppe der Patienten mit schwarzer Hautfarbe (n = 533, 6 % der Patienten der LIFE-Studie) gab es 29 primäre Endpunkte bei 263 Patienten unter Atenolol (11 %, 26 pro 1000 Patientenjahre) und 46 primäre Endpunkte bei 270 Patienten (17 %, 42 pro 1000 Patientenjahre) unter Losartan. Dieser Befund konnte nicht auf der Grundlage anderer Unterschiede in den Populationen als der Rasse oder aufgrund von Ungleichgewichten zwischen den Behandlungsgruppen erklärt werden. Darüber hinaus waren die Blutdrucksenkungen in beiden Behandlungsgruppen bei schwarzen und nicht-schwarzen Patienten konsistent. Angesichts der Schwierigkeit, Teilmengenunterschiede in großen Studien zu interpretieren, kann nicht festgestellt werden, ob der beobachtete Unterschied das Ergebnis eines Zufalls ist. Die LIFE-Studie liefert jedoch keine Hinweise darauf, dass die Vorteile von Losartan bei der Verringerung des Risikos kardiovaskulärer Ereignisse bei Patienten mit Hypertonie und linksventrikulärer Hypertrophie auch für Patienten mit schwarzer Hautfarbe gelten [siehe KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Der Beginn der Behandlung mit HYZAAR 12,5 mg wird bei Patienten mit eingeschränkter Leberfunktion nicht empfohlen, da die geeignete Anfangsdosis von Losartan, 25 mg, nicht verfügbar ist.
Nierenfunktionsstörung
Bei empfindlichen Personen wurde über Veränderungen der Nierenfunktion berichtet [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , und KLINISCHE PHARMAKOLOGIE ]. Die Sicherheit und Wirksamkeit von HYZAAR bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance
ÜBERDOSIS
Losartan Kalium
Eine signifikante Letalität wurde bei Mäusen und Ratten nach oraler Verabreichung von 1000 mg/kg bzw. 2000 mg/kg beobachtet, was etwa dem 44- bzw. 170-Fachen der maximal empfohlenen Dosis für Menschen auf mg/m-Basis entspricht.
Bezüglich einer Überdosierung beim Menschen liegen begrenzte Daten vor. Die wahrscheinlichste Manifestation einer Überdosierung wäre Hypotonie und Tachykardie; Bradykardie kann durch parasympathische (vagale) Stimulation auftreten. Wenn eine symptomatische Hypotonie auftritt, sollte eine unterstützende Behandlung eingeleitet werden.
Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse entfernt werden.
Hydrochlorothiazid
Die orale LD von Hydrochlorothiazid liegt sowohl bei Mäusen als auch bei Ratten über 10 g/kg. Die am häufigsten beobachteten Anzeichen und Symptome sind solche, die durch Elektrolytmangel (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydratation infolge übermäßiger Diurese verursacht werden. Wenn auch Digitalis verabreicht wurde, kann eine Hypokaliämie Herzrhythmusstörungen verstärken. Das Ausmaß, in dem Hydrochlorothiazid durch Hämodialyse entfernt wird, wurde nicht ermittelt.
KONTRAINDIKATIONEN
HYZAAR 12,5 mg ist kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Losartan Kalium
Angiotensin II [gebildet aus Angiotensin I in einer durch das Angiotensin-Converting-Enzym (ACE, Kininase II) katalysierten Reaktion] ist ein potenter Vasokonstriktor, das primäre vasoaktive Hormon des Renin-Angiotensin-Systems und eine wichtige Komponente in der Pathophysiologie des Bluthochdrucks. Es stimuliert auch die Aldosteronsekretion durch die Nebennierenrinde. Losartan und sein aktiver Hauptmetabolit blockieren die vasokonstriktorischen und Aldosteron-sezernierenden Wirkungen von Angiotensin II, indem sie selektiv die Bindung von Angiotensin II an den AT1-Rezeptor blockieren, der in vielen Geweben vorkommt (z. B. glatte Gefäßmuskulatur, Nebenniere). Es gibt auch einen AT2-Rezeptor, der in vielen Geweben gefunden wird, aber es ist nicht bekannt, dass er mit der kardiovaskulären Homöostase assoziiert ist. Weder Losartan noch sein aktiver Hauptmetabolit zeigen eine teilweise agonistische Aktivität am AT1-Rezeptor, und beide haben eine viel größere Affinität (etwa 1000-fach) für den AT1-Rezeptor als für den AT2-Rezeptor. In-vitro-Bindungsstudien weisen darauf hin, dass Losartan ein reversibler, kompetitiver Inhibitor des AT1-Rezeptors ist. Der aktive Metabolit ist 10- bis 40-mal stärker nach Gewicht als Losartan und scheint ein reversibler, nicht kompetitiver Inhibitor des AT1-Rezeptors zu sein.
Weder Losartan noch sein aktiver Metabolit hemmen ACE (Kininase II, das Enzym, das Angiotensin I in Angiotensin II umwandelt und Bradykinin abbaut), noch binden oder blockieren sie andere Hormonrezeptoren oder Ionenkanäle, von denen bekannt ist, dass sie für die kardiovaskuläre Regulation wichtig sind.
Hydrochlorothiazid
Hydrochlorothiazid ist ein Thiazid-Diuretikum. Thiazide beeinflussen die renalen tubulären Mechanismen der Elektrolytreabsorption, indem sie direkt die Ausscheidung von Natrium und Chlorid in ungefähr äquivalenten Mengen erhöhen. Indirekt verringert die diuretische Wirkung von Hydrochlorothiazid das Plasmavolumen, was zu einem Anstieg der Plasma-Reninaktivität, einem Anstieg der Aldosteronsekretion, einem Anstieg des Kaliumverlusts im Urin und einem Abfall des Serumkaliums führt. Die Renin-Aldosteron-Verbindung wird durch Angiotensin II vermittelt, sodass die gleichzeitige Verabreichung eines Angiotensin-II-Rezeptorantagonisten dazu neigt, den mit diesen Diuretika verbundenen Kaliumverlust umzukehren. Der Mechanismus der blutdrucksenkenden Wirkung von Thiaziden ist unbekannt.
Pharmakodynamik
Losartan Kalium
Losartan hemmt die pressorische Wirkung von Angiotensin-II-Infusionen (sowie von Angiotensin-I-Infusionen). Eine Dosis von 100 mg hemmt die pressorische Wirkung um etwa 85 % in der Spitze, wobei eine Hemmung von 25-40 % für 24 Stunden anhält. Die Beseitigung der negativen Rückkopplung von Angiotensin II bewirkt eine Verdopplung bis Verdreifachung der Plasma-Renin-Aktivität und einen daraus folgenden Anstieg der Angiotensin-II-Plasmakonzentration bei Bluthochdruckpatienten. Losartan beeinflusst die Reaktion auf Bradykinin nicht, während ACE-Hemmer die Reaktion auf Bradykinin verstärken. Die Aldosteron-Plasmakonzentrationen fallen nach der Gabe von Losartan. Trotz der Wirkung von Losartan auf die Aldosteronsekretion wurde eine sehr geringe Wirkung auf das Serumkalium beobachtet.
Die Wirkung von Losartan ist im Wesentlichen innerhalb einer Woche vorhanden, aber in einigen Studien trat die maximale Wirkung nach 3–6 Wochen auf. In Langzeit-Follow-up-Studien (mit Outplacebo-Kontrolle) schien die Wirkung von Losartan bis zu einem Jahr anzuhalten. Es gibt keinen erkennbaren Rebound-Effekt nach abruptem Absetzen von Losartan. In kontrollierten Studien gab es im Wesentlichen keine Veränderung der durchschnittlichen Herzfrequenz bei mit Losartan behandelten Patienten.
Hydrochlorothiazid
Nach oraler Gabe von Hydrochlorothiazid beginnt die Diurese innerhalb von 2 Stunden, erreicht ihren Höhepunkt nach etwa 4 Stunden und hält etwa 6 bis 12 Stunden an.
Wechselwirkungen mit anderen Medikamenten
Hydrochlorothiazid
Alkohol, Barbiturate oder Betäubungsmittel - Es kann zu einer Potenzierung der orthostatischen Hypotonie kommen.
Andere Antihypertensiva - additive Wirkung oder Potenzierung.
Skelettmuskelrelaxanzien, nicht depolarisierend (z. B. Tubocurarin) - mögliche erhöhte Reaktion auf das Muskelrelaxans.
Kortikosteroide, ACTH oder Glycyrrhizin (in Süßholz enthalten) - verstärkter Elektrolytmangel, insbesondere Hypokaliämie.
Pressoramine (z. B. Norepinephrin) - möglicherweise verringerte Reaktion auf Pressoramine, aber nicht ausreichend, um ihre Verwendung auszuschließen.
Pharmakokinetik
Losartan Kalium
Absorption
Nach oraler Gabe wird Losartan gut resorbiert und unterliegt einem erheblichen First-Pass-Metabolismus. Die systemische Bioverfügbarkeit von Losartan beträgt etwa 33 %. Mittlere Spitzenkonzentrationen von Losartan und seinem aktiven Metaboliten werden nach 1 Stunde bzw. nach 3-4 Stunden erreicht. Während die maximalen Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten ungefähr gleich sind, ist die AUC (Fläche unter der Kurve) des Metaboliten etwa viermal so groß wie die von Losartan. Eine Mahlzeit verlangsamt die Resorption von Losartan und senkt seine Cmax, hat aber nur geringe Auswirkungen auf die AUC von Losartan oder auf die AUC des Metaboliten (Abnahme um etwa 10 %). Die Pharmakokinetik von Losartan und seinem aktiven Metaboliten ist bei oralen Losartan-Dosen von bis zu 200 mg linear und verändert sich im Laufe der Zeit nicht.
Verteilung
Das Verteilungsvolumen von Losartan und dem aktiven Metaboliten beträgt etwa 34 Liter bzw. 12 Liter. Sowohl Losartan als auch sein aktiver Metabolit werden stark an Plasmaproteine gebunden, hauptsächlich Albumin, mit plasmafreien Anteilen von 1,3 % bzw. 0,2 %. Die Plasmaproteinbindung ist über den mit den empfohlenen Dosen erreichten Konzentrationsbereich konstant. Studien an Ratten weisen darauf hin, dass Losartan die Blut-Hirn-Schranke, wenn überhaupt, nur schlecht passiert.
Stoffwechsel
Losartan ist ein oral aktiver Wirkstoff, der einem erheblichen First-Pass-Metabolismus durch Cytochrom-P450-Enzyme unterliegt. Es wird teilweise in einen aktiven Carbonsäure-Metaboliten umgewandelt, der für den größten Teil des Angiotensin-II-Rezeptor-Antagonismus nach der Behandlung mit Losartan verantwortlich ist. Etwa 14 % einer oral verabreichten Losartan-Dosis werden in den aktiven Metaboliten umgewandelt. Neben dem aktiven Carbonsäure-Metaboliten werden mehrere inaktive Metaboliten gebildet. In-vitro-Studien weisen darauf hin, dass Cytochrom P450 2C9 und 3A4 an der Biotransformation von Losartan zu seinen Metaboliten beteiligt sind.
Beseitigung
Die Gesamtplasmaclearance von Losartan und dem aktiven Metaboliten beträgt etwa 600 ml/min bzw. 50 ml/min, mit einer renalen Clearance von etwa 75 ml/min bzw. 25 ml/min. Die terminale Halbwertszeit von Losartan beträgt etwa 2 Stunden und die des Metaboliten etwa 6-9 Stunden. Nach oraler Gabe von Einzeldosen von Losartan werden etwa 4 % der Dosis unverändert im Urin und etwa 6 % als aktiver Metabolit im Urin ausgeschieden. Die biliäre Ausscheidung trägt zur Elimination von Losartan und seinen Metaboliten bei. Nach oraler Gabe von 14C-markiertem Losartan werden etwa 35 % der Radioaktivität im Urin und etwa 60 % im Stuhl wiedergefunden. Nach einer intravenösen Dosis von 14C-markiertem Losartan werden etwa 45 % der Radioaktivität im Urin und 50 % im Stuhl wiedergefunden. Weder Losartan noch sein Metabolit reichern sich bei wiederholter einmal täglicher Gabe im Plasma an.
Hydrochlorothiazid
Hydrochlorothiazid wird nicht metabolisiert, sondern schnell über die Nieren ausgeschieden. Wenn die Plasmaspiegel mindestens 24 Stunden lang beobachtet wurden, wurde beobachtet, dass die Plasmahalbwertszeit zwischen 5,6 und 14,8 Stunden schwankt. Mindestens 61 Prozent der oralen Dosis werden unverändert innerhalb von 24 Stunden ausgeschieden. Hydrochlorothiazid passiert die Plazenta-, aber nicht die Blut-Hirn-Schranke und wird in die Muttermilch ausgeschieden.
Spezifische Populationen
Geriatrie und Geschlecht
Die Pharmakokinetik von Losartan wurde bei älteren Patienten (65-75 Jahre) und bei beiden Geschlechtern untersucht. Die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten sind bei älteren und jungen Hypertonikern ähnlich. Die Plasmakonzentrationen von Losartan waren bei weiblichen Hypertonikern etwa doppelt so hoch wie bei männlichen Hypertonikern, aber die Konzentrationen des aktiven Metaboliten waren bei Männern und Frauen ähnlich.
Wettrennen
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht [siehe auch Verwendung in bestimmten Bevölkerungsgruppen ].
Leberinsuffizienz
Nach oraler Verabreichung an Patienten mit leichter bis mittelschwerer alkoholischer Leberzirrhose waren die Plasmakonzentrationen von Losartan und seinem aktiven Metaboliten 5-mal bzw. etwa 1,7-mal höher als bei jungen männlichen Probanden. Im Vergleich zu gesunden Probanden war die Gesamtplasmaclearance von Losartan bei Patienten mit Leberinsuffizienz etwa 50 % niedriger und die orale Bioverfügbarkeit etwa doppelt so hoch. Die niedrigere Losartan-Anfangsdosis, die für die Anwendung bei Patienten mit eingeschränkter Leberfunktion empfohlen wird, kann nicht mit HYZAAR verabreicht werden. Seine Anwendung bei solchen Patienten als Mittel zur Titration von Losartan wird daher nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Niereninsuffizienz
Losartan
Nach oraler Gabe sind die Plasmakonzentrationen und AUCs von Losartan und seinem aktiven Metaboliten bei Patienten mit leichter (Kreatinin-Clearance 50 bis 74 ml/min) oder mäßiger (Kreatinin-Clearance 30 bis 49 ml/min) Niereninsuffizienz um 50-90 % erhöht. In dieser Studie war die renale Clearance von Losartan und seinem aktiven Metaboliten bei Patienten mit leichter oder mittelschwerer Niereninsuffizienz um 55-85 % verringert. Weder Losartan noch sein aktiver Metabolit können durch Hämodialyse entfernt werden.
Hydrochlorothiazid
Nach oraler Verabreichung ist die AUC von Hydrochlorothiazid bei Patienten mit leichter bzw. mittelschwerer Niereninsuffizienz um 70 % bzw. 700 % erhöht. In dieser Studie verringerte sich die renale Clearance von Hydrochlorothiazid bei Patienten mit leichter bzw. mittelschwerer Nierenfunktionsstörung um 45 % bzw. 85 %.
Wenden Sie die üblichen Therapieschemata mit HYZAAR an, solange die Kreatinin-Clearance des Patienten größer als 30 ml/min ist. Die Sicherheit und Wirksamkeit von HYZAAR 12,5 mg bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance unter 30 ml/min) wurde nicht nachgewiesen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Wechselwirkungen mit anderen Medikamenten
Losartan Kalium
In Studien von Losartan-Kalium mit Hydrochlorothiazid, Digoxin, Warfarin, Cimetidin und Phenobarbital wurden keine klinisch signifikanten Arzneimittelwechselwirkungen festgestellt. Es wurde jedoch gezeigt, dass Rifampin die AUC von Losartan und seinem aktiven Metaboliten um 30 % bzw. 40 % senkt. Fluconazol, ein Inhibitor von Cytochrom P450 2C9, verringerte die AUC des aktiven Metaboliten um etwa 40 %, erhöhte jedoch die AUC von Losartan nach Mehrfachgabe um etwa 70 %. Die Umwandlung von Losartan in seinen aktiven Metaboliten nach intravenöser Verabreichung wird durch Ketoconazol, einen Inhibitor von P450 3A4, nicht beeinflusst. Die AUC des aktiven Metaboliten nach oralem Losartan wurde durch Erythromycin, einen Inhibitor von P450 3A4, nicht beeinflusst, aber die AUC von Losartan wurde um erhöht 30%.
Die pharmakodynamischen Folgen einer gleichzeitigen Anwendung von Losartan und Inhibitoren von P450 2C9 wurden nicht untersucht. Bei Probanden, die Losartan nicht zum aktiven Metaboliten metabolisieren, wurde ein spezifischer, seltener Defekt des Cytochrom P450 2C9 nachgewiesen. Diese Daten legen nahe, dass die Umwandlung von Losartan in seinen aktiven Metaboliten hauptsächlich durch P450 2C9 und nicht durch P450 3A4 vermittelt wird.
Klinische Studien
Losartan-Monotherapie
Reduzierung des Schlaganfallrisikos
Die LIFE-Studie war eine multinationale, doppelblinde Studie zum Vergleich von Losartan und Atenolol bei 9193 Bluthochdruckpatienten mit EKG-dokumentierter linksventrikulärer Hypertrophie. Patienten mit Myokardinfarkt oder Schlaganfall innerhalb von sechs Monaten vor der Randomisierung wurden ausgeschlossen. Die Patienten wurden randomisiert und erhielten einmal täglich 50 mg Losartan oder 50 mg Atenolol. Wenn der Zielblutdruck (
Um den Blutdruck zu kontrollieren, wurde den Patienten in beiden Armen der LIFE-Studie über den größten Teil der Zeit, in der sie das Studienmedikament einnahmen, gleichzeitig Hydrochlorothiazid verabreicht (73,9 % bzw. 72,4 % der Tage in den Losartan- und Atenolol-Armen).
Von den randomisierten Patienten waren 4963 (54 %) weiblich und 533 (6 %) schwarz. Das Durchschnittsalter betrug 67 Jahre, wobei 5704 (62 %) ≥ 65 Jahre alt waren. Zu Studienbeginn hatten 1195 (13 %) Diabetes, 1326 (14 %) eine isolierte systolische Hypertonie, 1469 (16 %) eine koronare Herzkrankheit und 728 (8 %) eine zerebrovaskuläre Erkrankung. Der mittlere Blutdruck zu Studienbeginn betrug in beiden Behandlungsgruppen 174/98 mmHg. Die durchschnittliche Nachbeobachtungszeit betrug 4,8 Jahre. Am Ende der Studie oder beim letzten Besuch vor einem primären Endpunkt nahmen 77 % der mit Losartan behandelten Gruppe und 73 % der mit Atenolol behandelten Gruppe noch die Studienmedikation ein. Von den Patienten, die noch die Studienmedikation einnahmen, betrugen die mittleren Dosen von Losartan und Atenolol jeweils etwa 80 mg/Tag, und 15 % nahmen Atenolol oder Losartan als Monotherapie ein, während 77 % zusätzlich Hydrochlorothiazid erhielten (in einer mittleren Dosis von 20 mg/Tag in jede Gruppe). Die am Tiefpunkt gemessene Blutdrucksenkung war für beide Behandlungsgruppen ähnlich, aber der Blutdruck wurde zu keiner anderen Tageszeit gemessen. Am Ende der Studie oder beim letzten Besuch vor einem primären Endpunkt betrugen die mittleren Blutdruckwerte 144,1/81,3 mmHg für die mit Losartan behandelte Gruppe und 145,4/80,9 mmHg für die mit Atenolol behandelte Gruppe [der Unterschied im SBD betrug 1,3 mmHg signifikant (p
Der primäre Endpunkt war das erste Auftreten von kardiovaskulärem Tod, nicht tödlichem Schlaganfall oder nicht tödlichem Myokardinfarkt. Patienten mit nicht-tödlichen Ereignissen blieben in der Studie, sodass jeweils das erste Ereignis untersucht wurde, auch wenn es nicht das erste Ereignis war (z. B. würde ein Schlaganfall nach einem initialen Myokardinfarkt in der Schlaganfallanalyse gezählt) . Die Behandlung mit Losartan führte im Vergleich zur Atenolol-Gruppe zu einer 13 %igen Reduktion (p = 0,021) des Risikos für den primären Endpunkt; Dieser Unterschied war in erster Linie das Ergebnis einer Auswirkung auf tödlichen und nicht tödlichen Schlaganfall. Die Behandlung mit Losartan verringerte das Schlaganfallrisiko um 25 % im Vergleich zu Atenolol (p = 0,001).
Losartan Kalium-Hydrochlorothiazid
Die 3 kontrollierten Studien zu Losartan und Hydrochlorothiazid umfassten über 1300 Patienten, in denen die antihypertensive Wirksamkeit verschiedener Losartan-Dosen (25, 50 und 100 mg) und der gleichzeitigen Gabe von Hydrochlorothiazid (6,25, 12,5 und 25 mg) untersucht wurde. In einer faktoriellen Studie wurde die Kombination von Losartan/Hydrochlorothiazid 50/12,5 mg mit ihren Bestandteilen und Placebo verglichen. Die Kombination von Losartan/Hydrochlorothiazid 50/12,5 mg führte zu einer annähernd additiven, placebokorrigierten systolischen/diastolischen Reaktion (15,5/9,0 mmHg für die Kombination im Vergleich zu 8,5/5,0 mmHg für Losartan allein und 7,0/3,0 mmHg für Hydrochlorothiazid allein). Eine andere Studie untersuchte die Dosis-Wirkungs-Beziehung verschiedener Dosierungen von Hydrochlorothiazid (6,25, 12,5 und 25 mg) oder Placebo vor einem Hintergrund von Losartan (50 mg) bei Patienten, die nicht ausreichend eingestellt waren (sitzender diastolischer Blutdruck [SiDBP] 93-120 mmHg). Losartan (50 mg) allein. Die dritte Studie untersuchte die Dosis-Wirkungs-Beziehung verschiedener Dosen von Losartan (25, 50 und 100 mg) oder Placebo vor einem Hintergrund von Hydrochlorothiazid (25 mg) bei Patienten, die unter Hydrochlorothiazid (25 mg) nicht ausreichend kontrolliert waren (SiDBP93-120 mmHg). allein. Diese Studien zeigten eine zusätzliche antihypertensive Wirkung beim Tal (24 Stunden nach der Einnahme) von 12,5 oder 25 mg Hydrochlorothiazid in Kombination mit 50 mg Losartan bei 5,5/3,5 bzw. 10,0/6,0 mmHg. In ähnlicher Weise gab es eine zusätzliche antihypertensive Wirkung, wenn Losartan 50 oder 100 mg zu 25 mg Hydrochlorothiazid mit 9,0/5,5 bzw. 12,5/6,5 mmHg hinzugefügt wurde. Es gab keinen signifikanten Einfluss auf die Herzfrequenz.
Es gab keinen Unterschied im Ansprechen zwischen Männern und Frauen oder bei Patienten über oder unter 65 Jahren.
Patienten mit schwarzer Hautfarbe sprachen stärker auf Hydrochlorothiazid an als Patienten mit nicht schwarzer Hautfarbe und weniger auf Losartan. Das Gesamtansprechen auf die Kombination war bei schwarzen und nicht-schwarzen Patienten ähnlich.
Schwere Hypertonie (SiDBP ≥110 mmHg)
Die Sicherheit und Wirksamkeit von HYZAAR als Anfangstherapie bei schwerer Hypertonie (definiert als mittlerer SiDBP ≥ 110 mmHg, bestätigt bei 2 verschiedenen Gelegenheiten nach allen antihypertensiven Therapien) wurde in einer 6-wöchigen, doppelblinden, randomisierten, multizentrischen Studie untersucht. Die Patienten wurden randomisiert entweder Losartan und Hydrochlorothiazid (50/12,5 mg, einmal täglich) oder Losartan (50 mg, einmal täglich) zugeteilt und hinsichtlich des Ansprechens des Blutdrucks nachbeobachtet. Die Patienten wurden in 2-Wochen-Intervallen titriert, wenn ihr SiDBP das Ziel (
In die Studie wurden 585 Patienten aufgenommen, darunter 264 (45 %) Frauen, 124 (21 %) Schwarze und 21 (4 %) im Alter von ≥ 65 Jahren. Der mittlere Blutdruck zu Studienbeginn für die Gesamtpopulation betrug 171/113 mmHg. Das Durchschnittsalter betrug 53 Jahre. Nach 4 Wochen Therapie war der mittlere SiDBP um 3,1 mmHg niedriger und der mittlere SiSBP um 5,6 mmHg niedriger in der mit HYZAAR behandelten Gruppe. Als Ergebnis erreichte ein größerer Anteil der Patienten unter HYZAAR 12,5 mg den diastolischen Zielblutdruck (17,6 % für HYZAAR 12,5 mg, 9,4 % für Losartan; p = 0,006). Ähnliche Trends wurden beobachtet, wenn die Patienten nach Geschlecht, Rasse oder Alter gruppiert wurden (
Nach 6-wöchiger Therapie erreichten mehr Patienten, die das Kombinationsschema erhielten, den diastolischen Zielblutdruck als diejenigen, die das Monotherapie-Schema erhielten (29,8 % versus 12,5 %).
INFORMATIONEN ZUM PATIENTEN
HYZAAR® (HY-zar) (Losartan-Kalium und Hydrochlorothiazid-Tabletten)50/12,5 mg, 100/12,5 mg, 100/25 mg
Lesen Sie die mit HYZAAR ® gelieferte Patienteninformation, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Zustand und Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über HYZAAR wissen sollte?
Was ist HYZAAR 12,5 mg?
HYZAAR 12,5 mg enthält 2 verschreibungspflichtige Arzneimittel, einen Angiotensin-Rezeptorblocker (ARB) und ein Diuretikum (Wasserpille). Es wird verwendet, um:
HYZAAR wurde bei Kindern unter 18 Jahren nicht untersucht.
Bluthochdruck (Hypertonie). Der Blutdruck ist die Kraft in Ihren Blutgefäßen, wenn Ihr Herz schlägt und wenn Ihr Herz ruht. Sie haben Bluthochdruck, wenn die Kraft zu groß ist. Der Inhaltsstoff Losartan in HYZAAR 12,5 mg kann Ihren Blutgefäßen helfen, sich zu entspannen, sodass Ihr Blutdruck sinkt. Das Hydrochlorothiazid in Gredientin HYZAAR bewirkt, dass Ihre Nieren mehr Wasser und Salz ausscheiden.
Linksventrikuläre Hypertrophie (LVH) ist eine Vergrößerung der Wände der linken Herzkammer (der Hauptpumpkammer des Herzens). LVH kann aus mehreren Gründen auftreten. Bluthochdruck ist die häufigste Ursache für LVH.
Wer sollte HYZAAR nicht einnehmen?
Nehmen Sie HYZAAR 12,5 mg nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von HYZAAR mitteilen?
Informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel.
HYZAAR 12,5 mg und bestimmte andere Arzneimittel können miteinander interagieren. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel und zeigen Sie diese Ihrem Arzt und Apotheker, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich HYZAAR 12,5 mg einnehmen?
Welche Nebenwirkungen kann HYZAAR haben?
HYZAAR kann die folgenden Nebenwirkungen verursachen, die schwerwiegend sein können:
Die häufigsten Nebenwirkungen von HYZAAR 12,5 mg bei Menschen mit Bluthochdruck sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung bemerken, die Sie stört oder die nicht abklingt. Dies ist keine vollständige Liste der Nebenwirkungen. Fragen Sie Ihren Arzt oder Apotheker nach einer vollständigen Liste.
Wie soll ich HYZAAR 12,5 mg aufbewahren?
Allgemeine Informationen über HYZAAR
Medikamente werden manchmal für Erkrankungen verschrieben, die nicht in der Packungsbeilage erwähnt sind. Verwenden Sie HYZAAR nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie HYZAAR nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen über HYZAAR zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen bitten, die für medizinisches Fachpersonal geschrieben sind.
Was sind die Inhaltsstoffe von HYZAAR?
Wirkstoffe: Losartan-Kalium, Hydrochlorothiazid
Inaktive Zutaten:
mikrokristalline Zellulose, wässrige Laktose, vorgelatinierte Stärke, Magnesiumstearat, Hydroxypropylzellulose, Hypromellose, Titandioxid. HYZAAR 50/12,5 und HYZAAR 100/25 enthalten auch D&C Yellow Nr. 10 Aluminiumlack.
HYZAAR 50/12,5, HYZAAR 100/12,5 und HYZAAR 100/25 können auch Carnaubawachs enthalten.