Leukeran 2mg, 5mg Chlorambucil Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Leukeran 5 mg und wie wird es angewendet?
Leukeran 5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von chronischer lymphatischer (lymphozytischer) Leukämie und Hodgkin-Lymphom. Leukeran 5 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Leukeran 5 mg gehört zu einer Klasse von Arzneimitteln, die als alkylierende Antineoplastika bezeichnet werden.
Es ist nicht bekannt, ob Leukeran bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Leukeran haben?
Leukeran kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Leukeran gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Leukeran. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
WARNUNG
LEUKERAN (Chlorambucil) kann die Knochenmarkfunktion stark unterdrücken. Chlorambucil ist ein Karzinogen für den Menschen. Chlorambucil ist beim Menschen wahrscheinlich mutagen und teratogen. Chlorambucil verursacht beim Menschen Unfruchtbarkeit (vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ).
BEZEICHNUNG
LEUKERAN (Chlorambucil) wurde erstmals von Everett et al. synthetisiert. Es ist ein bifunktionelles Alkylierungsmittel vom Stickstoff-Lost-Typ, das sich als wirksam gegen ausgewählte menschliche neoplastische Erkrankungen erwiesen hat. Chlorambucil ist chemisch als 4-[Bis(2-chlorethyl)amino]benzolbutansäure bekannt und hat die folgende Strukturformel:
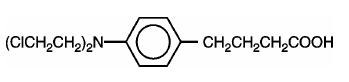
Chlorambucil hydrolysiert in Wasser und hat einen pKa-Wert von 5,8.
LEUKERAN (Chlorambucil) ist in Tablettenform zur oralen Verabreichung erhältlich. Jede Filmtablette enthält 2 mg Chlorambucil und die sonstigen Bestandteile kolloidales Siliciumdioxid, Hypromellose, Lactose (wasserfrei), Macrogol/PEG 400, mikrokristalline Cellulose, rotes Eisenoxid, Stearinsäure, Titandioxid und gelbes Eisenoxid.
INDIKATIONEN
LEUKERAN (Chlorambucil) ist indiziert zur Behandlung von chronischer lymphatischer (lymphozytärer) Leukämie, bösartigen Lymphomen einschließlich Lymphosarkom, Riesenfollikel-Lymphom und Hodgkin-Krankheit. Es ist bei keiner dieser Erkrankungen kurativ, kann aber eine klinisch nützliche Linderung bewirken.
DOSIERUNG UND ANWENDUNG
Die übliche orale Dosierung beträgt 0,1 bis 0,2 mg/kg Körpergewicht täglich für 3 bis 6 Wochen, je nach Bedarf. Dies beläuft sich normalerweise auf 4 bis 10 mg pro Tag für den durchschnittlichen Patienten. Die gesamte Tagesdosis kann auf einmal verabreicht werden. Diese Dosierungen gelten für den Beginn der Therapie oder für kurze Behandlungszyklen. Die Dosierung muss entsprechend dem Ansprechen des Patienten sorgfältig angepasst und reduziert werden, sobald die Anzahl der weißen Blutkörperchen abrupt abfällt. Patienten mit Morbus Hodgkin benötigen normalerweise 0,2 mg/kg täglich, während Patienten mit anderen Lymphomen oder chronischer lymphatischer Leukämie normalerweise nur 0,1 mg/kg täglich benötigen. Wenn eine lymphozytäre Infiltration des Knochenmarks vorliegt oder wenn das Knochenmark hypoplastisch ist, sollte die Tagesdosis 0,1 mg/kg (etwa 6 mg für den durchschnittlichen Patienten) nicht überschreiten.
Es wurde über alternative Behandlungspläne für die Behandlung von chronischer lymphatischer Leukämie mit intermittierenden, zweiwöchentlichen oder einmal monatlichen Pulsdosen von Chlorambucil berichtet. Intermittierende Behandlungsschemata von Chlorambucil beginnen mit einer anfänglichen Einzeldosis von 0,4 mg/kg. Die Dosen werden im Allgemeinen um 0,1 mg/kg erhöht, bis eine Kontrolle der Lymphozytose oder Toxizität beobachtet wird. Nachfolgende Dosen werden modifiziert, um eine leichte hämatologische Toxizität zu erzeugen. Es wird davon ausgegangen, dass die Ansprechrate bei chronischer lymphatischer Leukämie auf die zweiwöchentliche oder einmal monatliche Verabreichung von Chlorambucil ähnlich oder besser ist als die zuvor bei täglicher Verabreichung berichtete und dass die hämatologische Toxizität geringer oder gleich derjenigen war, die in Studien mit täglicher Chlorambucil-Verabreichung festgestellt wurde .
Strahlung und zytotoxische Medikamente machen das Knochenmark anfälliger für Schäden, und Chlorambucil sollte innerhalb von 4 Wochen nach einer vollständigen Strahlentherapie oder Chemotherapie mit besonderer Vorsicht angewendet werden. Kleine Dosen palliativer Bestrahlung über isolierten Herden, die vom Knochenmark entfernt sind, werden jedoch normalerweise die Neutrophilen- und Blutplättchenzahl nicht senken. In diesen Fällen kann Chlorambucil in der üblichen Dosierung verabreicht werden.
Gegenwärtig wird davon ausgegangen, dass kurze Behandlungszyklen sicherer sind als eine kontinuierliche Erhaltungstherapie, obwohl beide Methoden wirksam waren. Es muss beachtet werden, dass eine Dauertherapie bei Patienten, die sich tatsächlich in Remission befinden und keinen unmittelbaren Bedarf an weiteren Medikamenten haben, den Anschein einer „Erhaltungstherapie“ erwecken kann. Wenn eine Erhaltungsdosis verwendet wird, sollte sie 0,1 mg/kg täglich nicht überschreiten und kann durchaus so niedrig wie 0,03 mg/kg täglich sein. Eine typische Erhaltungsdosis beträgt 2 mg bis 4 mg täglich oder weniger, je nach Status des Blutbildes. Es kann daher wünschenswert sein, das Medikament abzusetzen, nachdem eine maximale Kontrolle erreicht wurde, da eine intermittierende Therapie, die zum Zeitpunkt eines Rückfalls wieder aufgenommen wird, genauso wirksam sein kann wie eine kontinuierliche Behandlung.
Verfahren zur ordnungsgemäßen Handhabung und Entsorgung von Krebsmedikamenten sollten angewendet werden. Zu diesem Thema wurden mehrere Leitlinien veröffentlicht.1-4 Es besteht keine allgemeine Einigkeit darüber, dass alle in den Leitlinien empfohlenen Verfahren notwendig oder angemessen sind.
Besondere Populationen
Leberfunktionsstörung
Patienten mit eingeschränkter Leberfunktion sollten engmaschig auf Toxizität überwacht werden. Da Chlorambucil hauptsächlich in der Leber metabolisiert wird, kann eine Dosisreduktion bei Patienten mit eingeschränkter Leberfunktion in Betracht gezogen werden, wenn sie mit LEUKERAN behandelt werden. Es liegen jedoch keine ausreichenden Daten bei Patienten mit eingeschränkter Leberfunktion vor, um eine spezifische Dosierungsempfehlung geben zu können.
WIE GELIEFERT
Leukeran ist als braune, runde, bikonvexe Filmtablette mit 2 mg Chlorambucil in braunen Glasflaschen mit kindergesichertem Verschluss erhältlich. Auf einer Seite ist „GX EG3“ und auf der anderen Seite ein „L“ eingraviert.
Flasche mit 25 ( NDC 76388-635-25)
Im Kühlschrank lagern, 2° bis 8°C (36° bis 46°F).
VERWEISE
1. NIOSH Alert: Verhinderung der beruflichen Exposition gegenüber antineoplastischen und anderen gefährlichen Arzneimitteln im Gesundheitswesen. 2004. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Abschnitt VI: Kapitel 2. Kontrolle der beruflichen Exposition gegenüber gefährlichen Drogen. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP-Richtlinien zum Umgang mit gefährlichen Arzneimitteln. Am J Health-Syst Pharm. (2006) 63:1172–1193.
4. Polovich, M., White, JM, & Kelleher, LO (Hrsg.) 2005. Richtlinien und Empfehlungen für die Chemotherapie und Biotherapie für die Praxis (2. Aufl.) Pittsburgh, PA: Oncology Nursing Society.
Hersteller: Excella GmbH & Co. KG, Feucht, Deutschland. Überarbeitet: März 2017
NEBENWIRKUNGEN
Um VERMUTLICHE NEBENWIRKUNGEN zu melden, kontaktieren Sie Aspen Global Inc. gebührenfrei unter 1-855-800-8165 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
Hämatologisch
Die häufigste Nebenwirkung ist Knochenmarksuppression, Anämie, Leukopenie, Neutropenie, Thrombozytopenie oder Panzytopenie. Obwohl häufig eine Knochenmarkdepression auftritt, ist sie normalerweise reversibel, wenn das Chlorambucil früh genug abgesetzt wird. Es wurde jedoch über irreversibles Knochenmarkversagen berichtet.
Magen-Darm
Gastrointestinale Störungen wie Übelkeit und Erbrechen, Durchfall und orale Ulzerationen treten selten auf.
ZNS
Tremor, Muskelzucken, Myoklonie, Verwirrtheit, Unruhe, Ataxie, schlaffe Parese und Halluzinationen wurden als seltene Nebenwirkungen von Chlorambucil berichtet, die nach Absetzen des Arzneimittels abklingen. Seltene, fokale und/oder generalisierte Krampfanfälle wurden sowohl bei Kindern als auch bei Erwachsenen sowohl bei therapeutischen Tagesdosen als auch bei Pulsdosierungsschemata und bei akuter Überdosierung berichtet (siehe VORSICHTSMASSNAHMEN : Allgemein ).
Dermatologisch
Allergische Reaktionen wie Urtikaria und angioneurotisches Ödem wurden nach Erst- oder Folgedosierung berichtet. Überempfindlichkeit der Haut (einschließlich seltener Berichte über Hautausschlag, der zu Erythema multiforme, toxischer epidermaler Nekrolyse und Stevens-Johnson-Syndrom fortschreitet) wurde berichtet (siehe WARNUNGEN ).
Sonstig
Andere berichtete Nebenwirkungen umfassen: Lungenfibrose, Hepatotoxizität und Gelbsucht, Arzneimittelfieber, periphere Neuropathie, interstitielle Pneumonie, sterile Zystitis, Unfruchtbarkeit, Leukämie und sekundäre Malignome (siehe WARNUNGEN ).

WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es sind keine Arzneimittelwechselwirkungen mit Chlorambucil bekannt.
WARNUNGEN
Aufgrund seiner karzinogenen Eigenschaften sollte Chlorambucil Patienten mit anderen Erkrankungen als chronischer lymphatischer Leukämie oder malignen Lymphomen nicht verabreicht werden. Krampfanfälle, Unfruchtbarkeit, Leukämie und sekundäre Malignome wurden beobachtet, wenn Chlorambucil in der Therapie von malignen und nicht-malignen Erkrankungen eingesetzt wurde.
Es gibt viele Berichte über akute Leukämien, die bei Patienten mit sowohl bösartigen als auch nicht bösartigen Erkrankungen nach einer Behandlung mit Chlorambucil auftraten. In vielen Fällen erhielten diese Patienten auch andere Chemotherapeutika oder eine Form der Strahlentherapie. Die Quantifizierung des Risikos einer Chlorambucil-Induktion von Leukämie oder Karzinom beim Menschen ist nicht möglich. Die Auswertung veröffentlichter Berichte über die Entwicklung von Leukämie bei Patienten, die Chlorambucil (und andere alkylierende Wirkstoffe) erhalten haben, deutet darauf hin, dass das Risiko einer Leukämie sowohl mit chronischer Behandlung als auch mit hohen kumulativen Dosen steigt. Es hat sich jedoch als unmöglich erwiesen, eine kumulative Dosis zu definieren, unterhalb der kein Risiko für die Induktion von sekundären Malignitäten besteht. Der potenzielle Nutzen einer Chlorambucil-Therapie muss individuell gegen das mögliche Risiko der Induktion eines sekundären Malignoms abgewogen werden.
Es wurde gezeigt, dass Chlorambucil beim Menschen Chromatid- oder Chromosomenschäden verursacht. Bei beiden Geschlechtern, die Chlorambucil erhielten, wurde sowohl reversible als auch dauerhafte Sterilität beobachtet.
Eine hohe Inzidenz von Sterilität wurde dokumentiert, wenn Chlorambucil präpubertären und pubertären Männern verabreicht wurde. Auch bei erwachsenen Männern wurde eine anhaltende oder dauerhafte Azoospermie beobachtet. Während sich die meisten Berichte über Gonadenfunktionsstörungen infolge von Chlorambucil auf Männer beziehen, ist die Induktion von Amenorrhoe bei Frauen mit Alkylierungsmitteln gut dokumentiert, und Chlorambucil kann Amenorrhoe hervorrufen. Autopsiestudien der Eierstöcke von Frauen mit malignem Lymphom, die mit einer Kombinationschemotherapie einschließlich Chlorambucil behandelt wurden, haben Fibrose, Vaskulitis und Depletion der Primordialfollikel in unterschiedlichem Ausmaß gezeigt.
Seltene Fälle von Hautausschlag, der zu Erythema multiforme, toxischer epidermaler Nekrolyse oder Stevens-Johnson-Syndrom fortschritt, wurden berichtet. Bei Patienten, die Hautreaktionen entwickeln, sollte Chlorambucil sofort abgesetzt werden.
Schwangerschaft
Schwangerschaftskategorie D
Chlorambucil kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Bei 2 Nachkommen, deren Mütter im ersten Trimenon Chlorambucil erhielten, wurde eine einseitige Nierenagenesie beobachtet. Urogenitale Missbildungen, einschließlich des Fehlens einer Niere, wurden bei Föten von Ratten gefunden, denen Chlorambucil verabreicht wurde. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden. Frauen im gebärfähigen Alter sollte geraten werden, eine Schwangerschaft zu vermeiden.
VORSICHTSMASSNAHMEN
Allgemein
Viele Patienten entwickeln während der Behandlung eine langsam fortschreitende Lymphopenie. Die Lymphozytenzahl kehrt nach Abschluss der medikamentösen Therapie normalerweise schnell auf normale Werte zurück. Die meisten Patienten haben nach der dritten Behandlungswoche eine gewisse Neutropenie, die bis zu 10 Tage nach der letzten Dosis andauern kann. Anschließend normalisiert sich die Neutrophilenzahl normalerweise schnell wieder. Eine schwere Neutropenie scheint dosisabhängig zu sein und tritt normalerweise nur bei Patienten auf, die in einem Behandlungszyklus mit kontinuierlicher Dosierung eine Gesamtdosis von 6,5 mg/kg oder mehr erhalten haben. Bei etwa einem Viertel aller Patienten, die das Schema mit kontinuierlicher Dosierung erhalten, und bei einem Drittel der Patienten, die diese Dosierung innerhalb von 8 Wochen oder weniger erhalten, ist zu erwarten, dass sie eine schwere Neutropenie entwickeln.
Obwohl es nicht notwendig ist, Chlorambucil beim ersten Anzeichen eines Abfalls der Neutrophilenzahl abzusetzen, muss daran erinnert werden, dass der Abfall noch 10 Tage nach der letzten Dosis andauern kann und dass dies der Fall ist, wenn sich die Gesamtdosis 6,5 mg/kg nähert das Risiko einer irreversiblen Schädigung des Knochenmarks. Die Dosis von Chlorambucil sollte verringert werden, wenn die Leukozyten- oder Blutplättchenzahlen unter die Normalwerte fallen, und sollte bei einer schwereren Depression abgesetzt werden.
Chlorambucil sollte nicht wegen der Anfälligkeit des Knochenmarks für Schäden unter diesen Bedingungen vor 4 Wochen nach einer vollständigen Strahlentherapie oder Chemotherapie in voller Dosierung verabreicht werden. Wenn die Leukozyten- oder Blutplättchenzahlen vor Therapiebeginn aufgrund einer Knochenmarkerkrankung vor Beginn der Therapie erniedrigt sind, sollte die Behandlung mit einer reduzierten Dosierung eingeleitet werden.
Anhaltend niedrige Neutrophilen- und Thrombozytenzahlen oder periphere Lymphozytose deuten auf eine Knochenmarkinfiltration hin. Wenn dies durch eine Knochenmarkuntersuchung bestätigt wird, sollte die Tagesdosis von Chlorambucil 0,1 mg/kg nicht überschreiten. Abgesehen von der knochenmarkdepressiven Wirkung scheint Chlorambucil relativ frei von gastrointestinalen Nebenwirkungen oder anderen Hinweisen auf Toxizität zu sein. Beim Menschen können orale Einzeldosen von 20 mg oder mehr Übelkeit und Erbrechen hervorrufen.
Kinder mit nephrotischem Syndrom und Patienten, die hohe Chlorambucil-Pulsdosen erhalten, können ein erhöhtes Risiko für Krampfanfälle haben. Wie bei jedem potenziell epileptogenen Arzneimittel ist bei der Verabreichung von Chlorambucil an Patienten mit Anfallsleiden oder Kopftrauma in der Anamnese oder bei Patienten, die andere potenziell epileptogene Arzneimittel erhalten, Vorsicht geboten.
Die Verabreichung von Lebendimpfstoffen an immungeschwächte Patienten sollte vermieden werden.
Labortests
Die Patienten müssen sorgfältig überwacht werden, um eine lebensgefährliche Schädigung des Knochenmarks während der Behandlung zu vermeiden. Das Blut sollte wöchentlich untersucht werden, um den Hämoglobinspiegel, die Gesamt- und Differentialleukozytenzahl und die quantitative Thrombozytenzahl zu bestimmen. Außerdem wird empfohlen, während der ersten 3 bis 6 Behandlungswochen 3 oder 4 Tage nach jedem der wöchentlichen vollständigen Blutbilder ein Zählen der weißen Blutkörperchen durchzuführen. Galton et al. haben vorgeschlagen, dass es bei der Nachverfolgung von Patienten hilfreich ist, die Blutwerte gleichzeitig mit Körpergewicht, Temperatur, Milzgröße usw. auf einem Diagramm darzustellen. Es gilt als gefährlich, einen Patienten während der Behandlung länger als 2 Wochen ohne hämatologische und klinische Untersuchung auskommen zu lassen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Sehen WARNUNGEN Abschnitt für Informationen zur Karzinogenese, Mutagenese und Beeinträchtigung der Fertilität.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie D
Sehen WARNUNGEN Sektion.
Stillende Mutter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden und aufgrund des Potenzials schwerwiegender Nebenwirkungen von Chlorambucil bei gestillten Säuglingen eine Entscheidung getroffen werden sollte, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien zu Chlorambucil schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Anwendung bei Patienten mit eingeschränkter Nierenfunktion
Die Auswirkung einer Nierenfunktionsstörung auf die Elimination von Chlorambucil wurde nicht formal untersucht. Die renale Ausscheidung von unverändertem Chlorambucil und seinen wichtigsten aktiven Metaboliten, Phenylessigsäure, beträgt weniger als 1 % der verabreichten Dosis. Darüber hinaus war bei 2 Dialysepatienten unter Chlorambucil keine Dosisanpassung erforderlich. Daher wird nicht erwartet, dass eine Nierenfunktionsstörung die Elimination von Chlorambucil signifikant beeinflusst.
Anwendung bei Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit eingeschränkter Leberfunktion wurden keine formellen Studien durchgeführt. Da Chlorambucil hauptsächlich in der Leber metabolisiert wird, sollten Patienten mit eingeschränkter Leberfunktion engmaschig auf Toxizität überwacht werden, und bei Patienten mit eingeschränkter Leberfunktion kann eine Dosisreduktion in Betracht gezogen werden, wenn sie mit LEUKERAN behandelt werden (siehe Abschnitt 4.4). DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Reversible Panzytopenie war der Hauptbefund einer versehentlichen Überdosierung von Chlorambucil. Neurologische Toxizität, die von agitiertem Verhalten und Ataxie bis hin zu multiplen Grand-mal-Anfällen reicht, ist ebenfalls aufgetreten. Da es kein bekanntes Antidot gibt, sollten das Blutbild engmaschig überwacht und allgemeine unterstützende Maßnahmen, gegebenenfalls zusammen mit geeigneten Bluttransfusionen, eingeleitet werden. Chlorambucil ist nicht dialysierbar.
Orale LD50-Einzeldosen bei Mäusen betragen 123 mg/kg. Bei Ratten erzeugt eine intraperitoneale Einzeldosis von 12,5 mg/kg Chlorambucil typische Stickstoff-Senf-Wirkungen; dazu gehören Atrophie der Darmschleimhaut und des lymphatischen Gewebes, schwere Lymphopenie, die in 4 Tagen maximal wird, Anämie und Thrombozytopenie. Nach dieser Dosis beginnen sich die Tiere innerhalb von 3 Tagen zu erholen und erscheinen nach etwa einer Woche wieder normal, obwohl das Knochenmark möglicherweise erst nach etwa 3 Wochen vollständig normal wird. Eine intraperitoneale Dosis von 18,5 mg/kg tötet etwa 50 % der Ratten unter Entwicklung von Krämpfen. Bis zu 50 mg/kg wurden Ratten als Einzeldosis mit Erholung verabreicht. Eine solche Dosis verursacht Bradykardie, übermäßigen Speichelfluss, Hämaturie, Krämpfe und Atemstörungen.
KONTRAINDIKATIONEN
Chlorambucil sollte nicht bei Patienten angewendet werden, deren Krankheit eine vorherige Resistenz gegen das Mittel gezeigt hat. Patienten, die eine Überempfindlichkeit gegen Chlorambucil gezeigt haben, sollten das Arzneimittel nicht erhalten. Es kann zu einer Kreuzallergie (Hautausschlag) zwischen Chlorambucil und anderen alkylierenden Mitteln kommen.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Chlorambucil, ein aromatisches Stickstoffsenfderivat, ist ein Alkylierungsmittel. Chlorambucil interferiert mit der DNA-Replikation und induziert zelluläre Apoptose über die Akkumulation von zytosolischem p53 und die anschließende Aktivierung von Bax, einem Apoptose-Promotor.
Pharmakokinetik
In einer Studie mit 12 Patienten, denen eine orale Einzeldosis von 0,2 mg/kg LEUKERAN 5 mg verabreicht wurde, betrug die mittlere dosisadjustierte (±SD) Cmax von Chlorambucil im Plasma 492 ± 160 ng/ml, die AUC 883 ± 329 ng·h/ml betrug die mittlere Eliminationshalbwertszeit (t½) 1,3 ± 0,5 Stunden und Tmax 0,83 ± 0,53 Stunden. Für den Hauptmetaboliten Phenylessigsäurelost (PAAM) betrug die mittlere dosisangepasste (±SD) Plasma-Cmax 306 ± 73 ng/ml, die AUC 1204 ± 285 ng.h/ml und die mittlere t½ 1,8 ± 0,4 Stunden und die Tmax betrug 1,9 ± 0,7 Stunden.
Nach oralen Einzeldosen von 0,6 bis 1,2 mg/kg werden maximale Chlorambucil-Plasmaspiegel (Cmax) innerhalb von 1 Stunde erreicht und die terminale Eliminationshalbwertszeit (t) der Muttersubstanz wird auf 1,5 Stunden geschätzt.
Absorption
Chlorambucil wird schnell und vollständig (>70%) aus dem Gastrointestinaltrakt resorbiert. Im Einklang mit der schnellen, vorhersagbaren Resorption von Chlorambucil hat sich gezeigt, dass die interindividuelle Variabilität der Plasma-Pharmakokinetik von Chlorambucil nach oraler Gabe von 15 bis 70 mg relativ gering ist (2-fache intrapatientliche Variabilität und 2- bis 4-fache Variabilität). interindividuelle Variabilität der AUC). Die Resorption von Chlorambucil wird reduziert, wenn es nach einer Mahlzeit eingenommen wird. In einer Studie mit zehn Patienten erhöhte die Nahrungsaufnahme die mediane Tmax um das Zweifache und reduzierte die dosisangepassten Cmax- und AUC-Werte um 55 % bzw. 20 %.
Verteilung
Das scheinbare Verteilungsvolumen betrug nach einer oralen Einzeldosis von 0,2 mg/kg Chlorambucil bei 11 Krebspatienten mit chronischer lymphatischer Leukämie durchschnittlich 0,31 l/kg.
Chlorambucil und seine Metaboliten werden weitgehend an Plasma- und Gewebeproteine gebunden. In vitro wird Chlorambucil zu 99 % an Plasmaproteine, insbesondere Albumin, gebunden. Die Konzentrationen von Chlorambucil in der Zerebrospinalflüssigkeit wurden nicht bestimmt.
Stoffwechsel
Chlorambucil wird in der Leber weitgehend zu Phenylessigsäure-Lost metabolisiert, das eine antineoplastische Wirkung hat. Chlorambucil und sein Hauptmetabolit unterliegen einem oxidativen Abbau zu Monohydroxy- und Dihydroxyderivaten.
Ausscheidung
Nach einer Einzeldosis von radioaktiv markiertem Chlorambucil (14C) erscheinen nach 24 Stunden etwa 20 % bis 60 % der Radioaktivität im Urin. Auch hier liegt weniger als 1 % der Radioaktivität im Urin in Form von Chlorambucil oder Phenylessigsäure-Senf vor.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darüber informiert werden, dass die Haupttoxizitäten von Chlorambucil mit Überempfindlichkeit, Arzneimittelfieber, Myelosuppression, Hepatotoxizität, Unfruchtbarkeit, Krampfanfällen, gastrointestinaler Toxizität und sekundären Malignomen zusammenhängen. Patienten sollten das Medikament niemals ohne ärztliche Aufsicht einnehmen dürfen und sollten ihren Arzt konsultieren, wenn sie Hautausschlag, Blutungen, Fieber, Gelbsucht, anhaltenden Husten, Krampfanfälle, Übelkeit, Erbrechen, Amenorrhoe oder ungewöhnliche Knoten/Massen bekommen. Frauen im gebärfähigen Alter sollte geraten werden, eine Schwangerschaft zu vermeiden.