Magen-Darm-Grippe Behandlung: Nexium 20mg, 40mg Esomeprazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Nexium und wie wird es angewendet?
Nexium ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome der gastroösophagealen Refluxkrankheit (GERD) und anderer Erkrankungen mit übermäßiger Magensäure wie dem Zollinger-Ellison-Syndrom. Nexium kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Nexium 20 mg ist ein Protonenpumpenhemmer.
Es ist nicht bekannt, ob Nexium 20 mg bei Kindern unter 1 Monat bei intravenöser Medikation und unter 1 Jahr bei oraler Medikation sicher und wirksam ist.
Welche Nebenwirkungen hat Nexium 40mg?
Nexium kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Nexium 40 mg gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Nexium. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
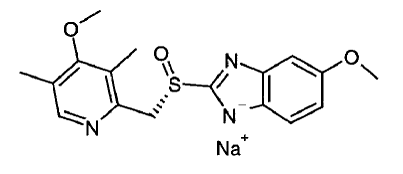
Der Wirkstoff in NEXIUM® IV (Esomeprazol-Natrium) zur Injektion ist (S)-5-Methoxy-2[[(4-methoxy-3,5-dimethyl-2-pyridinyl)-methyl]sulfinyl]-1 H-benzimidazol Natrium, ein Protonenpumpenhemmer, der die Magensäuresekretion hemmt. Esomeprazol ist das S-Isomer von Omeprazol, das eine Mischung aus den S- und R-Isomeren ist. Seine empirische Formel ist C17H18N3O3SNa mit einem Molekulargewicht von 367,4 g/mol (Natriumsalz) und 345,4 g/mol (Stammverbindung).
Esomeprazol-Natrium ist sehr gut wasserlöslich und in Ethanol gut löslich (95 %). Die Strukturformel lautet:
NEXIUM 20 mg i.v. zur Injektion wird als steriler, gefriergetrockneter, weißer bis cremefarbener, poröser Kuchen oder Pulver in einer 5-ml-Durchstechflasche geliefert und ist zur intravenösen Verabreichung nach Rekonstitution mit 0,9 % Natriumchlorid zur Injektion, USP; Laktierte Ringer-Injektion, USP oder 5% Dextrose-Injektion, USP. NEXIUM IV zur Injektion enthält 21,3 mg oder 42,5 mg Esomeprazol-Natrium, entsprechend 20 mg oder 40 mg Esomeprazol, 1,5 mg Dinatriumedetat und Natriumhydroxid qs zur pH-Einstellung. Der pH-Wert der rekonstituierten Lösung von NEXIUM IV zur Injektion hängt vom Rekonstitutionsvolumen ab und liegt im pH-Bereich von 9 bis 11. Die Stabilität von Esomeprazol-Natrium in wässriger Lösung ist stark pH-abhängig. Die Abbaugeschwindigkeit steigt mit sinkendem pH-Wert.
INDIKATIONEN
Behandlung der gastroösophagealen Refluxkrankheit (GERD) mit erosiver Ösophagitis (EE)
NEXIUM IV ist für die Kurzzeitbehandlung von GERD mit EE bei Erwachsenen und pädiatrischen Patienten im Alter von 1 Monat bis einschließlich 17 Jahren indiziert, einschließlich als Alternative zur oralen Therapie, wenn eine orale Gabe von NEXIUM 40 mg nicht möglich oder angemessen ist.
Risikominderung von Nachblutungen bei Magen- oder Zwölffingerdarmgeschwüren nach therapeutischer Endoskopie bei Erwachsenen
NEXIUM 40 mg i.v. ist angezeigt zur Verringerung des Risikos einer erneuten Blutung von Magen- oder Zwölffingerdarmgeschwüren nach einer therapeutischen Endoskopie bei akuten blutenden Magen- oder Zwölffingerdarmgeschwüren bei Erwachsenen.
DOSIERUNG UND ANWENDUNG
Dosierung für GERD mit EE
Erwachsene Patienten
Die empfohlene Dosierung für Erwachsene beträgt entweder 20 mg oder 40 mg NEXIUM 40 mg i.v. einmal täglich als intravenöse Injektion (über mindestens 3 Minuten) oder intravenöse Infusion (10 Minuten bis 30 Minuten) für bis zu 10 Tage [siehe DOSIERUNG UND ANWENDUNG ].
Pädiatrische Patienten
Die empfohlene Dosierung für pädiatrische Patienten basiert auf Alter und Körpergewicht, wie in Tabelle 1 unten gezeigt. Als intravenöse Infusion über 10 bis 30 Minuten einmal täglich für bis zu 10 Tage verabreichen [siehe DOSIERUNG UND ANWENDUNG ].
Abschluss der Behandlung
Dosierung zur Risikominderung von Nachblutungen von Magen- oder Zwölffingerdarmgeschwüren nach therapeutischer Endoskopie bei Erwachsenen
Die empfohlene Dosierung für Erwachsene beträgt 80 mg NEXIUM IV, verabreicht als intravenöse Infusion über 30 Minuten, gefolgt von einer kontinuierlichen Infusion von 8 mg/Stunde für eine Gesamtbehandlungsdauer von 72 Stunden (d. h. umfasst die anfängliche 30-minütige Aufsättigungsdosis plus 71,5 Stunden kontinuierliche Infusion). Infusion) [vgl DOSIERUNG UND ANWENDUNG ].
Die intravenöse Therapie dient ausschließlich der akuten initialen Behandlung von blutenden Magen- oder Zwölffingerdarmgeschwüren und stellt keine vollständige Behandlung dar. Verabreichen Sie eine orale säureunterdrückende Therapie nach einer intravenösen Therapie für einen vollständigen Behandlungszyklus.
Dosisanpassung bei eingeschränkter Leberfunktion
GERD mit EE
Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) beträgt die Höchstdosis 20 mg einmal täglich [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Risikominderung von Nachblutungen von Magen- oder Zwölffingerdarmgeschwüren nach therapeutischer Endoskopie bei Erwachsenen
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klassen A bzw. B) 80 mg als intravenöse Infusion über 30 Minuten, gefolgt von einer kontinuierlichen Infusion von 6 mg/Stunde über 71,5 Stunden.
Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) werden 80 mg als intravenöse Infusion über 30 Minuten verabreicht, gefolgt von einer kontinuierlichen Infusion von 4 mg/Stunde über 71,5 Stunden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Vorbereitungs- und Verabreichungsanweisungen für GERD mit EE
Verabreichen Sie NEXIUM 40 mg i.v. nicht gleichzeitig mit anderen Medikamenten durch dieselbe intravenöse Stelle und/oder denselben Schlauch.
Orale Antazida können während der Behandlung mit NEXIUM 20 mg i.v. verwendet werden
Intravenöse Injektion über mindestens 3 Minuten bei erwachsenen Patienten
Intravenöse Infusion über 10 Minuten bis 30 Minuten bei erwachsenen und pädiatrischen Patienten
Lagerung
Lagern Sie die endgültige (verdünnte) NEXIUM IV-Lösung bei Raumtemperatur bis zu 30 °C (86 °F) und verabreichen Sie sie innerhalb des in Tabelle 2 unten angegebenen Zeitraums.
Zubereitungs- und Verabreichungsanweisungen zur Risikominderung von Nachblutungen bei Magen- oder Zwölffingerdarmgeschwüren bei Erwachsenen
Verabreichen Sie NEXIUM 40 mg i.v. nicht gleichzeitig mit anderen Medikamenten durch dieselbe intravenöse Stelle und/oder denselben Schlauch.
Orale Antazida können während der Behandlung mit NEXIUM IV verwendet werden
Ladedosis (80 mg)
Kontinuierliche Infusion
Lagerung
WIE GELIEFERT
Darreichungsformen und Stärken
Zur Injektion: 40 mg Esomeprazol als weißes bis cremefarbenes lyophilisiertes Pulver in einer Einzeldosis-Durchstechflasche zur Rekonstitution.
Lagerung und Handhabung
NEXIUM 20 mg i.v. wird in einer Einzeldosis-Durchstechflasche als weißes bis cremefarbenes lyophilisiertes Pulver zur Rekonstitution geliefert, das 40 mg Esomeprazol enthält.
NEXIUM 40 mg i.v . ist wie folgt erhältlich:
Lagerung
Bei 25 °C (77 °F) lagern; Ausflüge erlaubt bis 15° bis 30°C (59° bis 86°F). [Sehen USP kontrollierte Raumtemperatur .] Vor Licht schützen. Bis zum Gebrauch im Karton aufbewahren.
Verwerfen Sie nach der Rekonstitution und Verabreichung alle nicht verwendeten Portionen der Esomeprazol-Lösung [siehe DOSIERUNG UND ANWENDUNG ].
Hergestellt für: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Überarbeitet: März 2022
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Symptomatische GERD und EE
Erwachsene
Die Sicherheit von NEXIUM IV basiert auf Ergebnissen klinischer Studien, die an vier verschiedenen Populationen durchgeführt wurden, darunter gesunde Probanden (n=204) und Patienten mit blutenden Magen- oder Zwölffingerdarmgeschwüren (n=375). Die unten beschriebenen Daten spiegeln die Exposition gegenüber NEXIUM 20 mg IV bei 359 Patienten in aktiv kontrollierten Studien wider: symptomatische GERD mit oder ohne EE in der Vorgeschichte (n = 199) und Patienten mit EE (n = 160). Die Bevölkerung war 18 bis 77 Jahre alt; 45 % Männer, 52 % Kaukasier, 17 % Schwarze, 3 % Asiaten und 28 % andere Rassen. Die meisten Patienten erhielten Dosen von entweder 20 oder 40 mg entweder als Infusion oder als Injektion. Nebenwirkungen, die bei mindestens 1 % der Patienten auftraten, sind unten in Tabelle 3 aufgeführt:
Es wurde festgestellt, dass die intravenöse Behandlung mit NEXIUM 20 mg IV 20 und 40 mg, verabreicht als Injektion oder Infusion, ein ähnliches Sicherheitsprofil wie orales Esomeprazol aufweist.
Pädiatrie
Es wurde eine randomisierte, offene, multinationale Studie zur Bewertung der Pharmakokinetik von wiederholten intravenösen Dosen von einmal täglich NEXIUM IV bei pädiatrischen Patienten im Alter von 1 Monat bis einschließlich 17 Jahren durchgeführt [siehe KLINISCHE PHARMAKOLOGIE ]. Die Sicherheitsergebnisse stimmen mit dem bekannten Sicherheitsprofil von Esomeprazol überein und es wurden keine unerwarteten Sicherheitssignale identifiziert.
Risikominderung von Nachblutungen bei Magen- oder Zwölffingerdarmgeschwüren bei Erwachsenen
Die in Tabelle 4 unten beschriebenen Daten spiegeln die Exposition gegenüber NEXIUM 20 mg i.v. bei 375 Patienten wider, die sich in einer placebokontrollierten Studie mit endoskopisch bestätigten Magen- oder Zwölffingerdarmgeschwürblutungen vorstellten. Die Bevölkerung war 18 bis 98 Jahre alt; 68 % Männer, 87 % Kaukasier, 1 % Schwarze, 7 % Asiaten und 4 % andere Rassen. Nach der endoskopischen Hämostase erhielten die Patienten entweder Placebo oder 80 mg NEXIUM IV als intravenöse Infusion über 30 Minuten, gefolgt von einer kontinuierlichen Infusion von 8 mg/Stunde für eine Gesamtbehandlungsdauer von 72 Stunden. Nach den ersten 72 Stunden erhielten alle Patienten 27 Tage lang einen oralen PPI.
Mit Ausnahme der oben beschriebenen Reaktionen an der Injektionsstelle hat die intravenöse Behandlung mit NEXIUM 20 mg i.v., verabreicht als Injektion oder Infusion, ein ähnliches Sicherheitsprofil wie orales Esomeprazol.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Esomeprazol nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blut- und Lymphsystems: Agranulozytose, Panzytopenie;
Augenerkrankungen: verschwommene Sicht;
Gastrointestinale Störungen: Pankreatitis; Stomatitis; mikroskopische Kolitis; Fundusdrüsenpolypen;
Leber- und Gallenerkrankungen: Leberversagen, Hepatitis mit oder ohne Gelbsucht;
Erkrankungen des Immunsystems: anaphylaktische Reaktion/Schock; systemischer Lupus erythematodes;
Infektionen und Schädlinge: GI-Candidiasis;
Stoffwechsel- und Ernährungsstörungen: Hypomagnesiämie (kann zu Hypokalzämie und/oder Hypokaliämie führen) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ], Hyponatriämie;
Erkrankungen des Bewegungsapparates und des Bindegewebes: Muskelschwäche, Myalgie, Knochenbruch;
Erkrankungen des Nervensystems: hepatische Enzephalopathie, Geschmacksstörung;
Psychische Störungen: Aggression, Erregung, Depression, Halluzination;
Nieren- und Harnwegserkrankungen: interstitielle Nephritis;
Störungen des Fortpflanzungssystems und der Brust: Gynäkomastie;
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: Bronchospasmus;
Erkrankungen der Haut und des Unterhautgewebes: Alopezie, Erythema multiforme, Hyperhidrose, Lichtempfindlichkeit, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse (TEN, einige tödlich), Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose (AGEP), kutaner Lupus erythematodes.
Nebenwirkungen im Zusammenhang mit Omeprazol können auch bei NEXIUM IV auftreten. Vollständige Sicherheitsinformationen finden Sie in den vollständigen Verschreibungsinformationen für orales Omeprazol.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Tabellen 5 und 6 enthalten Arzneimittel mit klinisch wichtigen Arzneimittelwechselwirkungen und Wechselwirkungen mit Diagnostika bei gleichzeitiger Verabreichung mit Esomeprazol sowie Anweisungen zu deren Vorbeugung oder Behandlung.
Konsultieren Sie die Kennzeichnung von gleichzeitig angewendeten Arzneimitteln, um weitere Informationen über Wechselwirkungen mit PPIs zu erhalten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Vorhandensein einer malignen Magenerkrankung
Bei Erwachsenen schließt das symptomatische Ansprechen auf die Therapie mit NEXIUM IV das Vorliegen einer malignen Erkrankung des Magens nicht aus. Erwägen Sie zusätzliche Nachsorge und diagnostische Tests bei erwachsenen Patienten, die nach Abschluss der Behandlung mit einem PPI suboptimal ansprechen oder einen frühen symptomatischen Rückfall haben. Erwägen Sie bei älteren Patienten auch eine Endoskopie.
Akute tubulointerstitielle Nephritis
Akute tubulointerstitielle Nephritis (TIN) wurde bei Patienten beobachtet, die PPIs einnahmen, und kann zu jedem Zeitpunkt während der PPI-Therapie auftreten. Die Patienten können unterschiedliche Anzeichen und Symptome aufweisen, von symptomatischen Überempfindlichkeitsreaktionen bis hin zu unspezifischen Symptomen einer verminderten Nierenfunktion (z. B. Unwohlsein, Übelkeit, Anorexie). In gemeldeten Fallserien wurden einige Patienten bei der Biopsie und ohne extrarenale Manifestationen (z. B. Fieber, Hautausschlag oder Arthralgie) diagnostiziert. NEXIUM 20 mg i.v. absetzen und Patienten mit Verdacht auf akute TIN untersuchen [siehe KONTRAINDIKATIONEN ].
Clostridium difficile-assoziierter Durchfall
Veröffentlichte Beobachtungsstudien deuten darauf hin, dass eine PPI-Therapie wie NEXIUM 20 mg i.v. mit einem erhöhten Risiko für Clostridium difficile-assoziierte Diarrhoe verbunden sein kann, insbesondere bei Krankenhauspatienten. Diese Diagnose sollte bei Durchfall in Betracht gezogen werden, der sich nicht bessert [siehe NEBENWIRKUNGEN ].
Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist.
Knochenbruch
Mehrere veröffentlichte Beobachtungsstudien deuten darauf hin, dass die Therapie mit Protonenpumpenhemmern (PPI) mit einem erhöhten Risiko für osteoporosebedingte Frakturen der Hüfte, des Handgelenks oder der Wirbelsäule verbunden sein kann. Das Frakturrisiko war bei Patienten erhöht, die eine hohe Dosis, definiert als mehrere Tagesdosen, und eine PPI-Langzeittherapie (ein Jahr oder länger) erhielten. Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist. Patienten mit einem Risiko für osteoporosebedingte Frakturen sollten gemäß etablierten Behandlungsrichtlinien behandelt werden [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN ].
Schwere kutane Nebenwirkungen
Schwere kutane Nebenwirkungen, einschließlich Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN), Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose (AGEP) wurden im Zusammenhang mit der Anwendung von PPI berichtet [sehen NEBENWIRKUNGEN ]. Setzen Sie NEXIUM IV bei den ersten Anzeichen oder Symptomen schwerer kutaner Nebenwirkungen oder anderer Anzeichen einer Überempfindlichkeit ab und erwägen Sie eine weitere Bewertung.
Kutaner und systemischer Lupus erythematodes
Kutaner Lupus erythematodes (CLE) und systemischer Lupus erythematodes (SLE) wurden bei Patienten berichtet, die PPI, einschließlich Esomeprazol, einnahmen. Diese Ereignisse traten sowohl als Neubeginn als auch als Exazerbation einer bestehenden Autoimmunerkrankung auf. Die Mehrzahl der Fälle von PPI-induziertem Lupus erythematodes waren CLE.
Die häufigste Form von CLE, die bei mit PPI behandelten Patienten berichtet wurde, war subakuter CLE (SCLE) und trat innerhalb von Wochen bis Jahren nach kontinuierlicher medikamentöser Therapie bei Patienten auf, die von Säuglingen bis zu älteren Menschen reichten. Im Allgemeinen wurden histologische Befunde ohne Organbeteiligung beobachtet.
Systemischer Lupus erythematodes (SLE) wird seltener als CLE bei Patienten berichtet, die PPI erhalten. PPI-assoziierter SLE verläuft in der Regel milder als nicht medikamentös induzierter SLE. Der Beginn des SLE trat typischerweise innerhalb von Tagen bis Jahren nach Beginn der Behandlung auf, hauptsächlich bei Patienten, die von jungen Erwachsenen bis zu älteren Menschen reichten. Die Mehrheit der Patienten stellte sich mit Hautausschlag vor; jedoch wurden auch Arthralgie und Zytopenie berichtet.
Vermeiden Sie die Verabreichung von PPI länger als medizinisch angezeigt. Wenn bei Patienten, die NEXIUM 20 mg i.v. erhalten, Anzeichen oder Symptome im Einklang mit CLE oder SLE festgestellt werden, setzen Sie das Medikament ab und überweisen Sie den Patienten zur Untersuchung an den entsprechenden Facharzt. Die meisten Patienten bessern sich nach Absetzen des PPI allein in 4 bis 12 Wochen. Serologische Tests (z. B. ANA) können positiv sein und es kann länger dauern, bis sich erhöhte serologische Testergebnisse auflösen als klinische Manifestationen.
Wechselwirkung mit Clopidogrel
Vermeiden Sie die gleichzeitige Anwendung von NEXIUM IV mit Clopidogrel. Clopidogrel ist ein Prodrug. Die Hemmung der Thrombozytenaggregation durch Clopidogrel ist vollständig auf einen aktiven Metaboliten zurückzuführen. Die Metabolisierung von Clopidogrel zu seinem aktiven Metaboliten kann durch die gleichzeitige Anwendung von Arzneimitteln wie Esomeprazol, die die CYP2C19-Aktivität hemmen, beeinträchtigt werden. Die gleichzeitige Anwendung von Clopidogrel mit 40 mg Esomeprazol verringert die pharmakologische Aktivität von Clopidogrel. Ziehen Sie bei der Anwendung von NEXIUM IV eine alternative Thrombozytenaggregationshemmung in Betracht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Hypomagnesiämie und Mineralstoffwechsel
Hypomagnesiämie, symptomatisch und asymptomatisch, wurde selten bei Patienten berichtet, die mindestens drei Monate lang mit PPI behandelt wurden, in den meisten Fällen nach einem Jahr Therapie. Schwerwiegende Nebenwirkungen sind Tetanie, Arrhythmien und Krampfanfälle. Hypomagnesiämie kann zu Hypokalzämie und/oder Hypokaliämie führen und bei Risikopatienten eine zugrunde liegende Hypokalzämie verschlimmern. Bei den meisten Patienten erforderte die Behandlung der Hypomagnesiämie eine Magnesiumsubstitution und das Absetzen des PPI.
Bei Patienten, die voraussichtlich über einen längeren Zeitraum behandelt werden oder die PPI zusammen mit Medikamenten wie Digoxin oder Arzneimitteln einnehmen, die eine Hypomagnesiämie verursachen können (z. B. Diuretika), kann medizinisches Fachpersonal erwägen, den Magnesiumspiegel vor Beginn der PPI-Behandlung und regelmäßig zu überwachen [siehe NEBENWIRKUNGEN ].
Erwägen Sie die Überwachung der Magnesium- und Calciumspiegel vor Beginn der Behandlung mit NEXIUM IV und regelmäßig während der Behandlung bei Patienten mit einem vorbestehenden Risiko für Hypokalzämie (z. B. Hypoparathyreoidismus). Bei Bedarf mit Magnesium und/oder Calcium ergänzen. Wenn die Hypokalzämie behandlungsresistent ist, sollten Sie erwägen, den PPI abzusetzen.
Wechselwirkung mit Johanniskraut oder Rifampin
Arzneimittel, die CYP2C19 oder CYP3A4 induzieren (z. B. Johanniskraut oder Rifampin), können die Esomeprazol-Konzentration erheblich verringern [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Vermeiden Sie die gleichzeitige Anwendung von NEXIUM 40 mg i.v. mit Johanniskraut oder Rifampin.
Wechselwirkungen mit diagnostischen Untersuchungen für neuroendokrine Tumoren
Die Spiegel von Chromogranin A (CgA) im Serum steigen sekundär zu einer arzneimittelinduzierten Abnahme der Magensäure. Der erhöhte CgA-Spiegel kann bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen. Gesundheitsdienstleister sollten die Behandlung mit Esomeprazol mindestens 14 Tage vor der Bestimmung der CgA-Spiegel vorübergehend beenden und eine Wiederholung des Tests in Betracht ziehen, wenn die anfänglichen CgA-Spiegel hoch sind. Wenn Reihentests durchgeführt werden (z. B. zur Überwachung), sollte dasselbe kommerzielle Labor für die Tests verwendet werden, da die Referenzbereiche zwischen den Tests variieren können [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wechselwirkung mit Methotrexat
Die Literatur legt nahe, dass die gleichzeitige Anwendung von PPI mit Methotrexat (hauptsächlich in hoher Dosis; siehe Verschreibungsinformationen zu Methotrexat) die Serumspiegel von Methotrexat und/oder seines Metaboliten erhöhen und verlängern kann, was möglicherweise zu Methotrexat-Toxizitäten führt. Bei hochdosierter Gabe von Methotrexat kann bei einigen Patienten ein vorübergehendes Absetzen des PPI in Betracht gezogen werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fundusdrüsenpolypen
Die Anwendung von PPI ist mit einem erhöhten Risiko für Fundusdrüsenpolypen verbunden, das bei Langzeitanwendung zunimmt, insbesondere über ein Jahr hinaus. Die meisten PPI-Anwender, die Fundusdrüsenpolypen entwickelten, waren asymptomatisch und Fundusdrüsenpolypen wurden zufällig bei der Endoskopie identifiziert. Verwenden Sie die kürzeste Dauer der PPI-Therapie, die für die zu behandelnde Erkrankung geeignet ist.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Das kanzerogene Potenzial von Esomeprazol wurde anhand von Omeprazol-Studien bewertet. In zwei 24-monatigen oralen Kanzerogenitätsstudien an Ratten wurde Omeprazol in Tagesdosen von 1,7, 3,4, 13,8, 44,0 und 140,8 mg/kg/Tag (etwa das 0,4- bis 34-fache der Humandosis von 40 mg/Tag, ausgedrückt auf einer Körperoberfläche) verabreicht Flächenbasis) bei männlichen und weiblichen Ratten dosisabhängig ECL-Zell-Karzinoide im Magen produzierten; die Inzidenz dieser Wirkung war deutlich höher bei weiblichen Ratten, die höhere Omeprazolspiegel im Blut aufwiesen. Magenkarzinoide treten bei unbehandelten Ratten selten auf. Außerdem war in allen behandelten Gruppen beiderlei Geschlechts eine ECL-Zellhyperplasie vorhanden. In einer dieser Studien wurden weibliche Ratten 1 Jahr lang mit 13,8 mg Omeprazol/kg/Tag (etwa das 3,4-fache der menschlichen Dosis von 40 mg/Tag auf Basis der Körperoberfläche) behandelt, gefolgt von einem weiteren Jahr ohne das Medikament . Bei diesen Ratten wurden keine Karzinoide beobachtet. Am Ende des 1. Jahres wurde eine erhöhte Inzidenz von behandlungsbedingter ECL-Zellhyperplasie beobachtet (94 % Behandelte vs. 10 % Kontrollen). Im zweiten Jahr war der Unterschied zwischen behandelten und Kontrollratten viel kleiner (46 % gegenüber 26 %), zeigte aber immer noch mehr Hyperplasie in der behandelten Gruppe. Bei einer Ratte (2 %) wurde ein Adenokarzinom des Magens beobachtet. Bei männlichen oder weiblichen Ratten, die 2 Jahre lang behandelt wurden, wurde kein ähnlicher Tumor beobachtet. Für diesen Rattenstamm wurde in der Vergangenheit kein ähnlicher Tumor festgestellt, aber ein Befund, der nur einen Tumor betrifft, ist schwer zu interpretieren. Eine 78-wöchige orale Karzinogenitätsstudie mit Omeprazol an Mäusen zeigte kein vermehrtes Auftreten von Tumoren, aber die Studie war nicht schlüssig.
Esomeprazol war im Ames-Mutationstest, im In-vivo-Chromosomenaberrationstest an Knochenmarkszellen der Ratte und im In-vivo-Maus-Mikrokerntest negativ. Esomeprazol war jedoch im In-vitro-Chromosomenaberrationstest mit humanen Lymphozyten positiv. Omeprazol war im In-vitro-Chromosomenaberrationstest an humanen Lymphozyten, im In-vivo-Chromosomenaberrationstest an Knochenmarkszellen der Maus und im In-vivo-Maus-Mikrokerntest positiv.
Die potenziellen Wirkungen von Esomeprazol auf die Fertilität und Fortpflanzungsfähigkeit wurden anhand von Omeprazol-Studien bewertet. Es wurde festgestellt, dass Omeprazol in oralen Dosen von bis zu 138 mg/kg/Tag bei Ratten (etwa das 34-fache der menschlichen Dosis von 40 mg/Tag auf Basis der Körperoberfläche) keine Auswirkungen auf die Fortpflanzungsleistung der Elterntiere hatte.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Es liegen keine adäquaten und gut kontrollierten Studien mit Esomeprazol bei Schwangeren vor. Esomeprazol ist das s-Isomer von Omeprazol. Die verfügbaren epidemiologischen Daten zeigen kein erhöhtes Risiko schwerer angeborener Fehlbildungen oder anderer unerwünschter Schwangerschaftsverläufe bei Anwendung von Omeprazol im ersten Trimenon. Reproduktionsstudien an Ratten und Kaninchen ergaben eine dosisabhängige Embryoletalität bei Omeprazol-Dosen, die etwa dem 3,4- bis 34-Fachen einer oralen Dosis von 40 mg beim Menschen entsprachen (basierend auf der Körperoberfläche einer 60 kg schweren Person).
Teratogenität wurde in Reproduktionsstudien an Tieren bei oraler Verabreichung von Esomeprazol-Magnesium an Ratten und Kaninchen mit ungefähr 68-facher bzw. 42-facher oraler Dosis von 40 mg beim Menschen (basierend auf der Körperoberfläche einer Person mit 60 kg) nicht beobachtet. . Veränderungen der Knochenmorphologie wurden bei den Nachkommen von Ratten beobachtet, denen während des größten Teils der Trächtigkeit und Laktation Dosen verabreicht wurden, die mindestens dem 34-Fachen einer oralen Humandosis von 40 mg entsprachen. Wenn die mütterliche Verabreichung nur auf die Schwangerschaft beschränkt war, gab es in keinem Alter Auswirkungen auf die Knochenphysenmorphologie der Nachkommen (siehe Daten ).
Die geschätzten Hintergrundrisiken schwerer Geburtsfehler und Fehlgeburten für die angegebene Population sind nicht bekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Daten
Menschliche Daten
Esomeprazol ist das S-Isomer von Omeprazol. Vier epidemiologische Studien verglichen die Häufigkeit angeborener Anomalien bei Säuglingen von Frauen, die während der Schwangerschaft Omeprazol einnahmen, mit der Häufigkeit von Anomalien bei Säuglingen von Frauen, die H2-Rezeptor-Antagonisten oder anderen Kontrollpersonen ausgesetzt waren.
Eine bevölkerungsbasierte retrospektive epidemiologische Kohortenstudie des schwedischen medizinischen Geburtenregisters, die ungefähr 99 % der Schwangerschaften von 1995 bis 1999 abdeckte, berichtete über 955 Säuglinge (824 exponierte während des ersten Trimesters, davon 39 exponiert über das erste Trimester hinaus und 131 exponiert danach). im ersten Trimenon), deren Mütter Omeprazol während der Schwangerschaft angewendet haben. Die Anzahl der Säuglinge, die in utero Omeprazol ausgesetzt waren und eine Fehlbildung, ein niedriges Geburtsgewicht, einen niedrigen Apgar-Score oder einen Krankenhausaufenthalt aufwiesen, war ähnlich der Anzahl, die in dieser Population beobachtet wurde. Die Zahl der mit Ventrikelseptumdefekten geborenen Säuglinge und die Zahl der totgeborenen Säuglinge war bei den Omeprazol-exponierten Säuglingen etwas höher als die erwartete Zahl in dieser Population.

Eine bevölkerungsbezogene retrospektive Kohortenstudie, die alle Lebendgeburten in Dänemark von 1996 bis 2009 abdeckte, berichtete über 1.800 Lebendgeburten, deren Mütter Omeprazol im ersten Trimenon der Schwangerschaft einnahmen, und 837.317 Lebendgeburten, deren Mütter keinen Protonenpumpenhemmer einnahmen. Die Gesamtrate von Geburtsfehlern bei Säuglingen von Müttern, die im ersten Trimenon Omeprazol ausgesetzt waren, betrug 2,9 % und 2,6 % bei Säuglingen von Müttern, die im ersten Trimenon keinem Protonenpumpenhemmer ausgesetzt waren.
Eine retrospektive Kohortenstudie berichtete über 689 schwangere Frauen, die im ersten Trimenon entweder H2-Blockern oder Omeprazol ausgesetzt waren (134 exponierte Omeprazol) und 1.572 schwangere Frauen, die im ersten Trimenon keinem der beiden ausgesetzt waren. Die Gesamtfehlbildungsrate bei Nachkommen, die von Müttern geboren wurden, die im ersten Trimenon Omeprazol, einem H2-Blocker, ausgesetzt waren, oder die nicht exponiert waren, betrug 3,6 %, 5,5 % bzw. 4,1 %.
Eine kleine prospektive beobachtende Kohortenstudie folgte 113 Frauen, die während der Schwangerschaft Omeprazol ausgesetzt waren (89 % mit Expositionen im ersten Trimester). Die gemeldete Rate schwerer angeborener Missbildungen betrug 4 % in der Omeprazol-Gruppe, 2 % bei den Kontrollen, die nicht teratogenen Substanzen ausgesetzt waren, und 2,8 % bei den krankheitsverpaarten Kontrollen. Die Raten spontaner und elektiver Abtreibungen, Frühgeburten, Gestationsalter bei der Geburt und mittleres Geburtsgewicht waren in den Gruppen ähnlich.
Mehrere Studien haben keine offensichtlichen kurzfristigen Nebenwirkungen auf den Säugling berichtet, wenn eine orale oder intravenöse Einzeldosis Omeprazol als Prämedikation für einen Kaiserschnitt unter Vollnarkose an über 200 schwangere Frauen verabreicht wurde.
Tierdaten
Omeprazol
Mit Omeprazol durchgeführte Reproduktionsstudien an Ratten in oralen Dosen von bis zu 138 mg/kg/Tag (etwa das 34-Fache einer oralen Dosis von 40 mg beim Menschen bezogen auf die Körperoberfläche) und an Kaninchen in Dosen von bis zu 69,1 mg/kg/Tag ( etwa das 34-fache einer oralen Humandosis von 40 mg auf Basis der Körperoberfläche) während der Organogenese ergaben keine Hinweise auf ein teratogenes Potenzial von Omeprazol. Bei Kaninchen führte Omeprazol in einem Dosisbereich von 6,9 bis 69,1 mg/kg/Tag (etwa das 3,4- bis 34-fache einer oralen Humandosis von 40 mg bezogen auf die Körperoberfläche) während der Organogenese zu einer dosisabhängigen Erhöhung der Embryoletalität. fötale Resorptionen und Schwangerschaftsstörungen. Bei Ratten wurden dosisabhängige embryo-/fötale Toxizität und postnatale Entwicklungstoxizität bei Nachkommen von Eltern beobachtet, die mit 13,8 bis 138,0 mg/kg/Tag Omeprazol behandelt wurden (etwa das 3,4- bis 34-fache einer oralen Humandosis von 40 mg auf einer Körperoberfläche). Flächenbasis), verabreicht vor der Paarung während der Laktationsperiode.
Esomeprazol
In Reproduktionsstudien mit Esomeprazol-Magnesium wurden bei Ratten in oralen Dosen von bis zu 280 mg/kg/Tag (etwa das 68-Fache einer oralen Humandosis von 40 mg bezogen auf die Körperoberfläche) oder bei Kaninchen keine Auswirkungen auf die embryofetale Entwicklung beobachtet orale Dosen von bis zu 86 mg/kg/Tag (etwa das 41-fache der Humandosis bezogen auf die Körperoberfläche), verabreicht während der Organogenese.
Eine prä- und postnatale Entwicklungstoxizitätsstudie an Ratten mit zusätzlichen Endpunkten zur Bewertung der Knochenentwicklung wurde mit Esomeprazol-Magnesium in oralen Dosen von 14 bis 280 mg/kg/Tag (etwa das 3,4- bis 68-fache einer oralen Humandosis von 40 mg pro Körper) durchgeführt Flächenbasis). Die neonatale/frühe postnatale (Geburt bis Entwöhnung) Überlebensrate war bei Dosen gleich oder größer als 138 mg/kg/Tag (etwa das 34-fache einer oralen Humandosis von 40 mg auf Basis der Körperoberfläche) verringert. Körpergewicht und Körpergewichtszunahme waren reduziert und neurologische Verhaltens- oder allgemeine Entwicklungsverzögerungen unmittelbar nach dem Absetzen waren bei Dosen gleich oder größer als 69 mg/kg/Tag (etwa das 17-fache einer oralen Humandosis von 40 mg pro Körper) offensichtlich Flächenbasis). Darüber hinaus wurden bei Dosen von mindestens 14 mg/kg/Tag (etwa das 3,4-Fache einer oralen Dosis beim Menschen) eine verringerte Länge, Breite und Dicke des kortikalen Knochens des Femurs, eine verringerte Dicke der Tibia-Wachstumsfuge und eine minimale bis leichte Hypozellularität des Knochenmarks festgestellt Dosis von 40 mg bezogen auf die Körperoberfläche). Physale Dysplasie im Femur wurde bei den Nachkommen von Ratten beobachtet, die mit oralen Dosen von Esomeprazol-Magnesium in Dosen von mindestens 138 mg/kg/Tag behandelt wurden (etwa das 34-fache einer oralen Dosis von 40 mg beim Menschen auf Basis der Körperoberfläche).
In einer prä- und postnatalen Toxizitätsstudie wurden bei trächtigen und säugenden Ratten Auswirkungen auf den mütterlichen Knochen beobachtet, wenn Esomeprazol-Magnesium in oralen Dosen von 14 bis 280 mg/kg/Tag (etwa das 3,4- bis 68-fache einer oralen Dosis von 40 mg beim Menschen) verabreicht wurde auf Basis der Körperoberfläche). Wenn Ratten vom 7. Trächtigkeitstag bis zum Absetzen am 21. postnatalen Tag eine Dosis verabreicht wurde, wurde eine statistisch signifikante Abnahme des mütterlichen Femurgewichts von bis zu 14 % (im Vergleich zur Placebobehandlung) bei Dosen von 138 mg/kg/Tag oder mehr beobachtet (etwa das 34-fache einer oralen Humandosis von 40 mg auf Basis der Körperoberfläche).
Eine prä- und postnatale Entwicklungsstudie an Ratten mit Esomeprazol-Strontium (unter Verwendung äquimolarer Dosen im Vergleich zur Studie mit Esomeprazol-Magnesium) ergab ähnliche Ergebnisse bei Muttertieren und Jungtieren wie oben beschrieben.
Mit Esomeprazol-Magnesium in oralen Dosen von 280 mg/kg/Tag (etwa das 68-Fache einer oralen Humandosis von 40 mg) wurde eine Folgestudie zur Entwicklungstoxizität an Ratten mit weiteren Zeitpunkten zur Bewertung der Knochenentwicklung der Welpen vom 2. Tag nach der Geburt bis zum Erwachsenenalter durchgeführt basierend auf der Körperoberfläche), wobei Esomeprazol entweder vom 7. oder 16. Schwangerschaftstag bis zur Geburt verabreicht wurde. Wenn die mütterliche Verabreichung nur auf die Trächtigkeit beschränkt war, gab es in keinem Alter Auswirkungen auf die Knochenphysenmorphologie der Nachkommen.
Stillzeit
Zusammenfassung der Risiken
Esomeprazol ist das S-Isomer von Omeprazol und begrenzte Daten deuten darauf hin, dass Omeprazol in der Muttermilch vorhanden sein könnte. Es liegen keine klinischen Daten zu den Wirkungen von Esomeprazol auf den gestillten Säugling oder auf die Milchproduktion vor. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an NEXIUM 20 mg und möglichen Nebenwirkungen von NEXIUM oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von NEXIUM 20 mg i.v. wurden bei pädiatrischen Patienten im Alter von 1 Monat bis 17 Jahren zur Kurzzeitbehandlung von GERD mit EE als Alternative zur oralen Therapie nachgewiesen, wenn eine orale Gabe von NEXIUM 40 mg nicht möglich oder angemessen ist.
Die Anwendung von NEXIUM 40 mg i.v. in dieser Altersgruppe basiert auf der Extrapolation der Wirksamkeit von Erwachsenen auf Kinder und der Auswahl der Dosis auf der Grundlage einer Expositionsabstimmung von Kindern und Erwachsenen, die durch die folgenden Beweise gestützt wird: a) Ergebnisse einer pharmakokinetischen (PK) Studie an NEXIUM 20 mg i.v. zur Injektion bei pädiatrischen Patienten, b) Vorhersagen aus einem Populations-PK-Modell, das IV-PK-Daten zwischen erwachsenen und pädiatrischen Patienten vergleicht, und c) Beziehung zwischen Exposition und pharmakodynamischen Ergebnissen, die aus IV- und pädiatrischen oralen Daten von Erwachsenen erhalten wurden, und d) PK-Ergebnissen aus angemessene und gut kontrollierte Studien, die die Zulassung von NEXIUM 40 mg IV bei Erwachsenen unterstützten [siehe NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE , Klinische Studien ].
Die Sicherheit und Wirksamkeit von NEXIUM IV wurde bei Patienten unter 1 Monat zur Behandlung von GERD mit EE oder zur Risikominderung einer erneuten Blutung von Magen- oder Zwölffingerdarmgeschwüren nach einer therapeutischen Endoskopie nicht nachgewiesen.
Daten von Jungtieren
In einer Toxizitätsstudie an juvenilen Ratten wurde Esomeprazol zusammen mit Magnesium- und Strontiumsalzen in etwa 34- bis 68-facher oraler Dosis einer täglichen Humandosis von 40 mg, basierend auf der Körperoberfläche, verabreicht. Bei der hohen Dosis wurde eine Zunahme der Todesfälle beobachtet, und bei allen Esomeprazol-Dosen gab es eine Abnahme des Körpergewichts, der Körpergewichtszunahme, des Femurgewichts und der Femurlänge sowie eine Abnahme des Gesamtwachstums [siehe Nichtklinische Toxikologie ].
Geriatrische Verwendung
In einer klinischen Studie mit Patienten mit blutenden Magen- oder Zwölffingerdarmgeschwüren waren 52 % von 375 Patienten, die randomisiert NEXIUM IV zugeteilt wurden, 65 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit und Wirksamkeit zwischen älteren und jüngeren Personen beobachtet, und andere berichtete klinische Erfahrungen mit NEXIUM 40 mg i.v. und oralem Esomeprazol haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht sein ausgeschlossen.
Leberfunktionsstörung
GERD mit EE
Die Exposition gegenüber Esomeprazol war bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C), aber nicht bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse A und B) im Vergleich zu Patienten mit normaler Leberfunktion wesentlich erhöht [siehe KLINISCHE PHARMAKOLOGIE ].
Bei erwachsenen Patienten ist bei leichter bis mittelschwerer Leberfunktionsstörung keine Dosisanpassung erforderlich. Für Patienten mit schwerer Leberfunktionsstörung beträgt die empfohlene Höchstdosis 20 mg einmal täglich [siehe DOSIERUNG UND ANWENDUNG ].
Risikominderung von Nachblutungen bei Magen- oder Zwölffingerdarmgeschwüren nach therapeutischer Endoskopie
Es liegen keine pharmakokinetischen Daten für NEXIUM 20 mg i.v. bei kontinuierlicher intravenöser Verabreichung bei Patienten mit eingeschränkter Leberfunktion vor. Die Exposition gegenüber intravenösem Omeprazol, von dem Esomeprazol ein Enantiomer ist, war bei Patienten mit allen Graden der Leberfunktionsstörung im Vergleich zu Patienten mit normaler Leberfunktion erhöht [siehe KLINISCHE PHARMAKOLOGIE ].
Bei erwachsenen Patienten ist keine Dosisanpassung der Anfangsdosis von NEXIUM IV 80 mg bei Patienten mit Leberfunktionsstörungen jeglichen Grades erforderlich. Reduzieren Sie die Rate der kontinuierlichen Infusion auf 6 mg/Stunde bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse A und B) und auf 4 mg/Stunde bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) [siehe DOSIERUNG UND ANWENDUNG ].
ÜBERDOSIS
Die im Zusammenhang mit einer absichtlichen Überdosierung von NEXIUM 40 mg beschriebenen Symptome (begrenzte Erfahrung mit Dosen über 240 mg/Tag) sind vorübergehend. Berichte über eine Überdosierung mit Omeprazol beim Menschen können ebenfalls relevant sein. Die Dosen reichten bis zu 2.400 mg (das 120-fache der üblichen empfohlenen klinischen Dosis). Die Manifestationen waren unterschiedlich, umfassten jedoch Verwirrtheit, Schläfrigkeit, verschwommenes Sehen, Tachykardie, Übelkeit, Diaphorese, Hitzegefühl, Kopfschmerzen, Mundtrockenheit und andere Nebenwirkungen, die denen ähnelten, die bei empfohlenen Dosierungen beobachtet wurden. Vollständige Sicherheitsinformationen finden Sie in den vollständigen Verschreibungsinformationen für orales Omeprazol. Es ist kein spezifisches Antidot für Esomeprazol bekannt. Da Esomeprazol stark an Proteine gebunden ist, wird es voraussichtlich nicht durch Dialyse entfernt. Im Falle einer Überdosierung sollte die Behandlung symptomatisch und unterstützend erfolgen.
Wenn es zu einer Überexposition kommt, rufen Sie Ihre Giftnotrufzentrale unter 1-800-222-1222 an, um aktuelle Informationen zum Umgang mit Vergiftungen oder Überdosierungen zu erhalten.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Esomeprazol gehört zu einer Klasse antisekretorischer Verbindungen, den substituierten Benzimidazolen, die die Magensäuresekretion durch spezifische Hemmung des H+/K+-ATPase-Enzymsystems an der sekretorischen Oberfläche der Belegzellen des Magens unterdrücken. Esomeprazol wird protoniert und im sauren Kompartiment der Belegzelle umgewandelt, wobei der aktive Inhibitor, das achirale Sulfenamid, gebildet wird. Da dieses Enzymsystem als Säure-(Protonen-)Pumpe in der Magenschleimhaut gilt, wurde Esomeprazol als Magensäurepumpenhemmer charakterisiert, indem es den letzten Schritt der Säureproduktion blockiert. Dieser Effekt ist dosisabhängig und führt unabhängig vom Stimulus zu einer Hemmung sowohl der basalen als auch der stimulierten Säuresekretion.
Pharmakodynamik
Antisekretorische Aktivität
Die Wirkung von Esomeprazol auf den intragastrischen 24-Stunden-pH-Wert bei gesunden Probanden wurde in zwei Studien mit 20 mg und 40 mg NEXIUM 20 mg IV untersucht, die einmal täglich über 30 Minuten für 5 Tage intravenös infundiert wurden, wie in Tabelle 7 gezeigt.
Die Wirkung von Esomeprazol auf den intragastrischen pH-Wert über 24 Stunden nach Verabreichung einer intravenösen Infusion von 80 mg NEXIUM.IV über 30 Minuten, gefolgt von einer 23,5-stündigen kontinuierlichen Infusion von 8 mg/Stunde, wurde in zwei Studien untersucht.
Bei H. pylori-negativen gesunden kaukasischen Probanden (n = 24) betrug die prozentuale Zeit über 24 Stunden (95 %-KI), in der der intragastrische pH > 6 und > 7 war, 52,3 % (40,3; 64,4) und 4,8 % (1,8; 7.8).
Bei H. pylori-positiven (n = 8) und H. pylori-negativen (n = 11) gesunden chinesischen Probanden betrug die prozentuale Zeit über 24 Stunden (95 % KI), in der der intragastrische pH-Wert > 6 und > 7 betrug, 53 % ( 45,6, 60,3) und 15,1 % (9,5, 20,7). Der Prozentsatz der Zeit mit intragastrischem pH > 6 [59 % vs. 47 %] und mit pH > 7 [17 % vs. 11 %] war tendenziell größer bei H. pylori-positiven Probanden im Vergleich zu H. pylori-negativen Probanden.
Serum-Gastrin-Effekte
Die Wirkung von Esomeprazol auf die Gastrinkonzentrationen im Serum wurde in klinischen Studien mit bis zu 8 Wochen oralem Esomeprazol bei etwa 2.700 Patienten und bei über 1.300 Patienten, die bis zu 12 Monate behandelt wurden, untersucht. Der mittlere Nüchtern-Gastrinspiegel stieg dosisabhängig an. Der Anstieg der Gastrinkonzentrationen im Serum erreichte innerhalb von zwei bis drei Monaten nach der Therapie ein Plateau und kehrte innerhalb von vier Wochen nach Absetzen der Therapie auf die Ausgangswerte zurück.
Erhöhtes Gastrin verursacht eine Enterochromaffin-ähnliche Zellhyperplasie und erhöhte Chromogranin A (CgA)-Spiegel im Serum. Die erhöhten CgA-Spiegel können bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Enterochromaffin-ähnliche (ECL) Zelleffekte
Es liegen keine Daten zu den Wirkungen von intravenösem Esomeprazol auf ECL-Zellen vor.
Menschliche Magenbiopsieproben wurden von mehr als 3.000 Patienten (sowohl Kindern als auch Erwachsenen) erhalten, die in klinischen Langzeitstudien oral mit Omeprazol behandelt wurden. Die Inzidenz von ECL-Zellhyperplasie nahm in diesen Studien mit der Zeit zu; bei diesen Patienten wurde jedoch kein Fall von ECL-Zell-Karzinoiden, Dysplasie oder Neoplasie gefunden [siehe Nichtklinische Toxikologie ].
Bei über 1.000 Patienten, die bis zu 12 Monate lang mit oralem Esomeprazol (10 mg, 20 mg oder 40 mg/Tag) behandelt wurden, nahm die Prävalenz der ECL-Zellhyperplasie mit der Zeit und der Dosis zu. Kein Patient entwickelte ECL-Zell-Karzinoide, Dysplasien oder Neoplasien in der Magenschleimhaut.
Endokrine Wirkungen
Esomeprazol hatte keine Wirkung auf die Schilddrüsenfunktion, wenn es in oralen Dosen von 20 mg oder 40 mg über 4 Wochen verabreicht wurde. Andere Wirkungen von Esomeprazol auf das endokrine System wurden in Studien mit Omeprazol untersucht. Orale Dosen von 30 mg oder 40 mg Omeprazol pro Tag über 2 bis 4 Wochen hatten keine Wirkung auf den Kohlenhydratstoffwechsel, die zirkulierenden Spiegel von Parathormon, Cortisol, Estradiol, Testosteron, Prolaktin, Cholecystokinin oder Sekretin.
Pharmakokinetik
Absorption
Die Pharmakokinetik von Esomeprazol bei gesunden Probanden nach Verabreichung von NEXIUM IV 20 mg und 40 mg einmal täglich als intravenöse Infusion über 30 Minuten für 5 Tage ist in Tabelle 8 dargestellt.
Nach intravenöser Verabreichung von NEXIUM 40 mg i.v. an 24 gesunde Probanden als Aufsättigungsdosis von 80 mg über 30 Minuten, gefolgt von einer kontinuierlichen Infusion von 8 mg/Stunde über 23,5 Stunden (insgesamt 24 Stunden), zeigten die pharmakokinetischen Parameter von Esomeprazol [geometrischer Mittelwert (95 % KI)] waren wie folgt: AUCt 111,1 Mikromol*h/l (100,5, 122,7 Mikromol*h/l), Cmax 15,0 Mikromol/l (13,5, 16,6 Mikromol/l) und Steady-State-Plasmakonzentration (Css) 3,9 Mikromol/L (3,5, 4,5 Mikromol/L). In einer anderen Studie mit gesunden kaukasischen Probanden wurde dasselbe Behandlungsschema verabreicht.
Esomeprazol ist ein zeitabhängiger Inhibitor von CYP2C19, was zu einer Autoinhibition und nichtlinearen Pharmakokinetik führt. Die systemische Exposition steigt nach mehrfacher oraler Gabe von Esomeprazol mehr als dosisproportional an. Im Vergleich zur ersten Dosis stieg die systemische Exposition (Cmax und AUC0-24h) im Steady State nach einmal täglicher Gabe um 43 % bzw. 90 %, verglichen mit der ersten Dosis bei der 20-mg-Dosis um 95 %. bzw. 159 % für die 40-mg-Dosis.
Verteilung
Esomeprazol wird zu 97 % an Plasmaproteine gebunden. Die Plasmaproteinbindung ist über den Konzentrationsbereich von 2 bis 20 Mikromol/l konstant. Das scheinbare Verteilungsvolumen im Steady State bei gesunden Probanden beträgt etwa 16 l.
Beseitigung
Stoffwechsel
Esomeprazol wird weitgehend in der Leber durch das Enzymsystem Cytochrom P450 (CYP) metabolisiert. Den Metaboliten von Esomeprazol fehlt es an antisekretorischer Aktivität. Der Hauptteil des Metabolismus von Esomeprazol hängt vom CYP2C19-Isoenzym ab, das die Hydroxy- und Desmethyl-Metabolite bildet. Die verbleibende Menge ist abhängig von CYP3A4, das den Sulfonmetaboliten bildet.
Ausscheidung
Esomeprazol wird als Metaboliten hauptsächlich im Urin, aber auch im Stuhl ausgeschieden. Weniger als 1 % der Muttersubstanz wird mit dem Urin ausgeschieden. Esomeprazol wird vollständig aus dem Plasma eliminiert und es kommt zu keiner Akkumulation bei einmal täglicher Gabe. Die Plasmaeliminationshalbwertszeit von Esomeprazol nach intravenöser Gabe von NEXIUM IV beträgt etwa 1,1 bis 1,4 Stunden und verlängert sich mit zunehmender Dosis.
Die Plasmaclearance (CL) beträgt etwa 5,9 bis 7,2 l/h während der Verabreichung von NEXIUM 40 mg i.v. als intravenöse Infusion von 80 mg über 30 Minuten, gefolgt von einer kontinuierlichen Infusion von 8 mg/Stunde über 23,5 Stunden.
Spezifische Populationen
Geriatrische Patienten
Die AUC- und Cmax-Werte von Esomeprazol waren im Steady State bei älteren Patienten etwas höher (25 % bzw. 18 %) als bei jüngeren Probanden. Diese Erhöhung der Exposition wird nicht als klinisch relevant erachtet.
Pädiatrische Patienten
Die Pharmakokinetik von Esomeprazol wurde bei 50 pädiatrischen Patienten im Alter von einschließlich 17 Jahren (davon 44 pädiatrische Patienten im Alter von 1 Monat bis 17 Jahren) in einer randomisierten, offenen, multinationalen Mehrfachdosisstudie mit 20 mg NEXIUM untersucht 40 mg IV verabreicht als einmal tägliche 3-minütige intravenöse Injektion. Die Plasma-AUC-Werte von Esomeprazol waren bei pädiatrischen Patienten im Alter von 6 bis 11 Jahren bzw. 12 bis 17 Jahren um 183 % bzw. 60 % höher als bei Erwachsenen.
Anschließende pharmakokinetische Analysen prognostizierten, dass die folgenden Dosierungsschemata vergleichbare Steady-State-Plasmaspiegel (AUC0-24) erzielen würden wie bei erwachsenen Patienten, denen einmal täglich 20 mg NEXIUM IV verabreicht wurden: 0,5 mg/kg einmal täglich bei pädiatrischen Patienten 1 Monat bis 11 Monate 10 mg einmal täglich für pädiatrische Patienten im Alter von 1 bis 17 Jahren mit einem Körpergewicht von weniger als 55 kg und 20 mg einmal täglich für pädiatrische Patienten im Alter von 1 bis 17 Jahren mit einem Körpergewicht von 55 kg und mehr. Es wurde vorhergesagt, dass eine Erhöhung der Infusionsdauer von 3 Minuten auf 10 Minuten oder 30 Minuten Steady-State-Cmax-Werte hervorrufen würde, die mit denen vergleichbar waren, die bei erwachsenen Patienten mit 40 mg bzw. 20 mg NEXIUM IV-Dosen beobachtet wurden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Männliche und weibliche Patienten
Die AUC- und Cmax-Werte von Esomeprazol waren bei oraler Gabe im Steady State bei Frauen etwas höher (13 %) als bei Männern. Ähnliche Unterschiede wurden bei der intravenösen Verabreichung von Esomeprazol beobachtet. Diese Erhöhung der Exposition wird nicht als klinisch relevant erachtet.
Patienten mit eingeschränkter Nierenfunktion
Es ist nicht zu erwarten, dass die Pharmakokinetik von Esomeprazol bei Patienten mit eingeschränkter Nierenfunktion im Vergleich zu gesunden Probanden verändert ist, da weniger als 1 % von Esomeprazol unverändert im Urin ausgeschieden wird.
Patienten mit eingeschränkter Leberfunktion
Die Steady-State-Pharmakokinetik von Esomeprazol nach oraler Verabreichung von 40 mg einmal täglich an 4 Patienten mit jeweils leichter (Child-Pugh-Klasse A), mittelschwerer (Child-Pugh-Klasse B) und schwerer (Child-Pugh-Klasse C) Leberfunktionsstörung war verglichen mit denen, die bei 36 männlichen und weiblichen GERD-Patienten mit normaler Leberfunktion erhalten wurden. Bei Patienten mit leichter und mittelschwerer Leberfunktionsstörung lagen die AUCs innerhalb des Bereichs, der bei Patienten mit normaler Leberfunktion zu erwarten war. Bei Patienten mit schwerer Leberfunktionsstörung waren die AUCs 2- bis 3-mal höher als bei Patienten mit normaler Leberfunktion. [sehen Verwendung in bestimmten Bevölkerungsgruppen ].
Es liegen keine pharmakokinetischen Daten für die kontinuierliche intravenöse Anwendung von Esomeprazol bei Patienten mit eingeschränkter Leberfunktion vor. Die Pharmakokinetik von intravenösem Omeprazol 80 mg als Infusion über 30 Minuten, gefolgt von 8 mg/Stunde über 47,5 Stunden bei Patienten mit leichter (Child-Pugh-Klasse A; n=5), mittelschwerer (Child-Pugh-Klasse B; n=4) und schwere (Child-Pugh-Klasse C; n = 3) Leberfunktionsstörung wurden mit denen verglichen, die bei 24 männlichen und weiblichen gesunden Probanden festgestellt wurden. Bei Patienten mit leichter und mittelschwerer Leberfunktionsstörung waren die Omeprazol-Clearance und die Steady-State-Plasmakonzentration etwa 35 % niedriger bzw. 50 % höher als bei gesunden Probanden. Bei Patienten mit schwerer Leberfunktionsstörung betrug die Omeprazol-Clearance 50 % derjenigen bei gesunden Probanden und die Steady-State-Plasmakonzentration war doppelt so hoch wie bei gesunden Probanden [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Arzneimittelwechselwirkungsstudien
Wirkung von Esomeprazol/Omeprazol auf andere Medikamente
In-vitro- und In-vivo-Studien haben gezeigt, dass Esomeprazol die CYPs 1A2, 2A6, 2C9, 2D6, 2E1 und 3A4 wahrscheinlich nicht hemmt.
Antiretrovirale Medikamente
Bei einigen antiretroviralen Arzneimitteln wie Rilpivirin, Atazanavir und Nelfinavir wurde bei gemeinsamer Gabe mit Omeprazol über verringerte Serumkonzentrationen berichtet [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Rilpivirin
Nach Mehrfachgabe von Rilpivirin (150 mg täglich) und Omeprazol (20 mg täglich) verringerte sich die AUC von Rilpivirin um 40 %, Cmax um 40 % und Cmin um 33 % [siehe KONTRAINDIKATIONEN ].
Nelfinavir
Nach Mehrfachgabe von Nelfinavir (1250 mg, zweimal täglich) und Omeprazol (40 mg täglich) war die AUC für Nelfinavir und M8 um 36 % bzw. 92 %, Cmax um 37 % bzw. 89 % und Cmin um 39 % bzw. 75 % verringert .
Atazanavir
Nach mehrfacher Gabe von Atazanavir (400 mg täglich) und Omeprazol (40 mg täglich, 2 Stunden vor Atazanavir) verringerte sich die AUC um 94 %, die Cmax um 96 % und die Cmin um 95 %.
Saquinavir
Nach Mehrfachgabe von Saquinavir/Ritonavir (1000/100 mg) zweimal täglich über 15 Tage zusammen mit täglich 40 mg Omeprazol an den Tagen 11 bis 15. Die AUC stieg um 82 %, Cmax um 75 % und Cmin um 106 %. Der Mechanismus hinter dieser Wechselwirkung ist nicht vollständig aufgeklärt.
Clopidogrel
In einer Crossover-Studie wurde gesunden Probanden 29 Tage lang Clopidogrel (300 mg Aufsättigungsdosis gefolgt von 75 mg pro Tag als Erhaltungsdosis für 28 Tage) allein und zusammen mit Esomeprazol (40 mg p.o. einmal täglich gleichzeitig mit Clopidogrel) verabreicht. Die Exposition gegenüber dem aktiven Metaboliten von Clopidogrel wurde in diesem Zeitraum um 35 % bis 40 % reduziert, wenn Clopidogrel und Esomeprazol zusammen verabreicht wurden. Pharmakodynamische Parameter wurden ebenfalls gemessen und zeigten, dass die Veränderung der Hemmung der Thrombozytenaggregation mit der Veränderung der Exposition gegenüber dem aktiven Metaboliten von Clopidogrel zusammenhing [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mycophenolatmofetil
Die Verabreichung von 20 mg Omeprazol zweimal täglich über 4 Tage und einer Einzeldosis von 1000 mg MMF etwa eine Stunde nach der letzten Omeprazol-Dosis an 12 gesunde Probanden in einer Cross-Over-Studie führte zu einer Verringerung der Cmax um 52 % und um 23 % in der AUC von MPA [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Cilostazol
Omeprazol wirkt als Inhibitor von CYP2C19. Omeprazol, verabreicht in Dosen von 40 mg täglich für eine Woche an 20 gesunde Probanden in einer Crossover-Studie, erhöhte die Cmax und AUC von Cilostazol um 18 % bzw. 26 %. Cmax und AUC eines der aktiven Metaboliten, 3,4-Dihydro-Cilostazol, das die 4- bis 7-fache Aktivität von Cilostazol aufweist, waren um 29 % bzw. 69 % erhöht. Es ist zu erwarten, dass die gleichzeitige Anwendung von Cilostazol mit Omeprazol die Konzentrationen von Cilostazol und dem oben erwähnten aktiven Metaboliten erhöht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Diazepam
Die gleichzeitige Anwendung von Esomeprazol 30 mg und Diazepam, einem CYP2C19-Substrat, führte zu einer 45 %igen Verringerung der Clearance von Diazepam. Erhöhte Plasmaspiegel von Diazepam wurden 12 Stunden nach der Einnahme und danach beobachtet. Zu diesem Zeitpunkt lagen die Plasmaspiegel von Diazepam jedoch unterhalb des therapeutischen Intervalls, und daher ist es unwahrscheinlich, dass diese Wechselwirkung von klinischer Relevanz ist.
Digoxin
Die gleichzeitige Verabreichung von Omeprazol 20 mg einmal täglich und Digoxin bei gesunden Probanden erhöhte die Bioverfügbarkeit von Digoxin um 10 % (30 % bei zwei Probanden) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere Drogen
Die gleichzeitige Verabreichung von Esomeprazol und Naproxen (nicht-selektives NSAID) zeigte keine klinisch relevanten Veränderungen in den pharmakokinetischen Profilen dieser NSAIDs.
Wirkung anderer Medikamente auf Esomeprazol/Omeprazol
Johanniskraut
In einer Crossover-Studie mit 12 gesunden männlichen Probanden verringerte Johanniskraut (300 mg dreimal täglich für 14 Tage) die systemische Exposition von Omeprazol bei CYP2C19-Low-Metabolizern signifikant (Cmax und AUC verringerten sich um 37,5 % bzw. 37,9 %). %) und schnelle Metabolisierer (Cmax und AUC verringerten sich um 49,6 % bzw. 43,9 %) [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Voriconazol
Die gleichzeitige Verabreichung von Omeprazol und Voriconazol (einem kombinierten Inhibitor von CYP2C19 und CYP3A4) führte zu einer mehr als Verdopplung der Omeprazol-Exposition. Wenn Voriconazol (400 mg alle 12 Stunden für einen Tag, gefolgt von 200 mg einmal täglich für 6 Tage) zusammen mit Omeprazol (40 mg einmal täglich für 7 Tage) an gesunde Probanden gegeben wurde, waren Cmax und AUC0-24 von Omeprazol im Steady State signifikant erhöht: im Durchschnitt 2-mal (90 % KI: 1,8, 2,6) bzw. 4-mal (90 % KI: 3,3, 4,4) im Vergleich zu Omeprazol ohne Voriconazol [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Andere Drogen
Die gleichzeitige Anwendung von Esomeprazol mit oralen Kontrazeptiva, Diazepam, Phenytoin, Chinidin, Naproxen (nicht-selektives NSAID) schien das pharmakokinetische Profil von Esomeprazol nicht zu verändern.
Mikrobiologie
Auswirkungen auf die mikrobielle Ökologie des Magen-Darm-Trakts
Eine verringerte Magensäure aufgrund von Mitteln, einschließlich Protonenpumpenhemmern, erhöht die Zahl der Bakterien im Magen, die normalerweise im Magen-Darm-Trakt vorhanden sind. Die Behandlung mit Protonenpumpenhemmern kann zu einem leicht erhöhten Risiko für Magen-Darm-Infektionen wie Salmonellen und Campylobacter und bei Krankenhauspatienten möglicherweise auch für Clostridium difficile führen.
Pharmakogenomik
CYP2C19, ein polymorphes Enzym, ist am Metabolismus von Esomeprazol beteiligt. Das CYP2C19*1-Allel ist voll funktionsfähig, während die CYP2C19*2- und *3-Allele nicht funktionsfähig sind. Es gibt andere Allele, die mit keiner oder reduzierter enzymatischer Funktion assoziiert sind. Patienten, die zwei voll funktionsfähige Allele tragen, sind schnelle Metabolisierer, und diejenigen, die zwei Loss-of-Function-Allele tragen, sind langsame Metabolisierer. Die systemische Exposition gegenüber Esomeprazol variiert mit dem Stoffwechselstatus eines Patienten: langsame Metabolisierer > intermediäre Metabolisierer > schnelle Metabolisierer. Etwa 3 % der Kaukasier und 15 bis 20 % der Asiaten sind langsame CYP2C19-Metabolisierer.
Die systemische Esomeprazol-Exposition war bei CYP2C19-Intermediärmetabolisierern (IM; n = 6) im Vergleich zu schnellen Metabolisierern (EM; n = 17) von CYP2C19 geringfügig höher (ca. 17 %). Ähnliche pharmakokinetische Unterschiede wurden bei diesen Genotypen in einer Studie mit gesunden chinesischen Probanden festgestellt, die 7 EMs und 11 IMs umfasste. Aus diesen Studien liegen nur sehr begrenzte pharmakokinetische Informationen für langsame Metabolisierer (PM) vor.
Im Steady State nach einmal täglicher Verabreichung von NEXIUM 40 mg i.v. 40 mg beträgt das Verhältnis der AUC bei schwachen Metabolisierern zur AUC bei der übrigen Bevölkerung (EMs) etwa 1,5. Diese Veränderung der Exposition wird als klinisch nicht bedeutsam erachtet.
Tiertoxikologie und/oder Pharmakologie
Reproduktionsstudien
Reproduktionsstudien wurden an Ratten mit oralen Dosen von bis zu 280 mg/kg/Tag (etwa das 68-Fache einer oralen Dosis von 40 mg beim Menschen bezogen auf die Körperoberfläche) und an Kaninchen mit oralen Dosen von bis zu 86 mg/kg/Tag durchgeführt (etwa das 42-fache einer oralen Humandosis von 40 mg auf Basis der Körperoberfläche) und haben keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus aufgrund von Esomeprazol ergeben [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Jugendtierstudie
Eine 28-tägige Toxizitätsstudie mit einer 14-tägigen Erholungsphase wurde an juvenilen Ratten mit Esomeprazol-Magnesium in Dosen von 70 bis 280 mg/kg/Tag (etwa das 17- bis 68-fache einer täglichen oralen Humandosis von 40 mg auf einer Körperoberfläche) durchgeführt Gebietsbasis). Eine Zunahme der Todesfälle bei der hohen Dosis von 280 mg/kg/Tag wurde beobachtet, wenn juvenilen Ratten Esomeprazol-Magnesium vom 7. bis zum 35. postnatalen Tag verabreicht wurde. Tag (ca. das 34-fache einer oralen Tagesdosis von 40 mg beim Menschen auf Basis der Körperoberfläche) verursachte eine behandlungsbedingte Abnahme des Körpergewichts (ca. 14 %) und der Körpergewichtszunahme, Abnahme des Femurgewichts und der Femurlänge und wirkte sich insgesamt aus Wachstum. Vergleichbare, oben beschriebene Befunde wurden auch in dieser Studie mit einem anderen Esomeprazolsalz, Esomeprazol-Strontium, bei äquimolaren Dosen von Esomeprazol beobachtet.
Klinische Studien
Säureunterdrückung bei GERD
Vier multizentrische, offene Crossover-Studien über zwei Perioden wurden durchgeführt, um die pharmakodynamischen Wirkungen von Esomeprazol nach intravenöser oder oraler Verabreichung auf die Säuresuppression bei 206 Patienten mit Symptomen von GERD mit oder ohne erosive Ösophagitis zu vergleichen. Die Patienten erhielten randomisiert entweder 20 oder 40 mg NEXIUM 40 mg i.v. oder orales Esomeprazol einmal täglich für 10 Tage (Phase 1) und wurden dann in Phase 2 für 10 Tage auf die andere Formulierung umgestellt, die ihrer jeweiligen Dosis aus Phase 1 entsprach. NEXIUM 40 mg i.v. 20 mg und 40 mg wurde in zwei der Studien als 3-minütige Injektion und in den anderen beiden Studien als 15-minütige Infusion verabreicht.
Die Patientenpopulation reichte von 18 bis 72 Jahren; 54 % waren weiblich; 53 % Kaukasier, 24 % Schwarze, 5 % Asiaten und 17 % andere Rassen. Die basale Säureabgabe (BAO) und die maximale Säureabgabe (MAO) wurden 22 bis 24 Stunden nach der Dosis in Periode 1, Tag 11, bestimmt; in Periode 2, Tag 3; und in Periode 2, Tag 11. BAO und MAO wurden aus 1-stündigen kontinuierlichen Sammlungen von Mageninhalt vor und nach (jeweils) der subkutanen Injektion von 6,0 mcg/kg Pentagastrin geschätzt.
In diesen Studien waren NEXIUM IV 20 mg und 40 mg nach 10 Tagen einmal täglicher Verabreichung in ihrer Fähigkeit, BAO und MAO bei diesen GERD-Patienten zu unterdrücken, der entsprechenden oralen Dosierung von Esomeprazol ähnlich (siehe Tabelle 9 unten).
Beim Wechsel zwischen intravenöser und oraler Darreichungsform gab es keine wesentlichen Veränderungen der Säuresuppression.
Blutende Magen- oder Zwölffingerdarmgeschwüre
Eine randomisierte, doppelblinde, placebokontrollierte klinische Studie wurde mit 764 Patienten durchgeführt, die sich mit endoskopisch bestätigten Magen- oder Zwölffingerdarmgeschwürblutungen vorstellten. Die Bevölkerung war 18 bis 98 Jahre alt; 68 % waren Männer, 87 % Kaukasier, 1 % Schwarze, 7 % Asiaten und 4 % andere Rassen. Nach der endoskopischen Blutstillung wurden die Patienten randomisiert entweder Placebo oder NEXIUM IV 80 mg als intravenöse Infusion über 30 Minuten gefolgt von einer kontinuierlichen Infusion von 8 mg/Stunde über insgesamt 72 Stunden zugeteilt. Nach den ersten 72 Stunden erhielten alle Patienten 27 Tage lang einen oralen PPI. Das Auftreten von Nachblutungen innerhalb von 3 Tagen nach der Randomisierung betrug 5,9 % in der mit NEXIUM 20 mg i.v. behandelten Gruppe im Vergleich zu 10,3 % in der Placebogruppe (Behandlungsunterschied -4,4 %; 95 % Konfidenzintervall: -8,3 %, -0,6 %; p=0,03 ). Dieser Behandlungsunterschied war ähnlich dem, der an Tag 7 und Tag 30 beobachtet wurde, als alle Patienten einen oralen PPI erhielten.
Eine randomisierte, doppelblinde, placebokontrollierte monozentrische Studie, die in Hongkong durchgeführt wurde, zeigte außerdem eine Verringerung des Risikos einer erneuten Blutung innerhalb von 72 Stunden im Vergleich zu Placebo bei Patienten mit blutenden Magen- oder Zwölffingerdarmgeschwüren, die razemisches Omeprazol erhielten, von denen 50 % sind das S-Enantiomer Esomeprazol.
INFORMATIONEN ZUM PATIENTEN
Nebenwirkungen
Raten Sie den Patienten, sich an ihren Arzt zu wenden, wenn sie Anzeichen oder Symptome bemerken, die mit Folgendem übereinstimmen:
Wechselwirkungen mit anderen Medikamenten
Raten Sie den Patienten, sich bei ihrem Arzt zu melden, bevor sie mit einer der folgenden Behandlungen beginnen: