Pentasa 400mg Mesalamine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Pentasa und wie wird es angewendet?
Pentasa ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Colitis ulcerosa. Pentasa 400 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Pentasa gehört zu einer Klasse von Arzneimitteln, die als 5-Aminosalicylsäure-Derivate bezeichnet werden.
Es ist nicht bekannt, ob Pentasa bei Kindern über 5 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Pentasa haben?
Pentasa kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Pentasa 400 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Pentasa. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
BEZEICHNUNG
PENTASA (Mesalamin) zur oralen Verabreichung ist eine Formulierung mit kontrollierter Freisetzung von Mesalamin, einem entzündungshemmenden Aminosalicylat-Wirkstoff zur gastrointestinalen Anwendung.
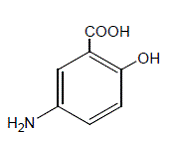
Chemisch gesehen ist Mesalamin 5-Amino-2-hydroxybenzoesäure. Es hat ein Molekulargewicht von 153,14.
Die Strukturformel lautet:
Jede 250-mg-Kapsel enthält 250 mg Mesalamin. Es enthält auch die folgenden inaktiven Inhaltsstoffe: acetyliertes Monoglycerid, Rizinusöl, kolloidales Siliciumdioxid, Ethylcellulose, Hydroxypropylmethylcellulose, Stärke, Stearinsäure, Zucker, Talk und weißes Wachs. Die Kapselhülle enthält D&C Yellow Nr. 10, FD&C Blue Nr. 1, FD&C Green Nr. 3, Gelatine, Titandioxid und andere Inhaltsstoffe.
Jede 500-mg-Kapsel enthält 500 mg Mesalamin. Es enthält auch die folgenden inaktiven Inhaltsstoffe: acetyliertes Monoglycerid, Rizinusöl, kolloidales Siliciumdioxid, Ethylcellulose, Hydroxypropylmethylcellulose, Stärke, Stearinsäure, Zucker, Talk und weißes Wachs. Die Kapselhülle enthält FD&C Blue #1, Gelatine, Titandioxid und andere Inhaltsstoffe.
INDIKATIONEN
PENTASA 400 mg ist angezeigt zur Induktion einer Remission und zur Behandlung von erwachsenen Patienten mit leichter bis mäßig aktiver Colitis ulcerosa.
DOSIERUNG UND ANWENDUNG
Die empfohlene Dosierung für die Induktion einer Remission und die symptomatische Behandlung von leicht bis mittelschwer aktiver Colitis ulcerosa bei Erwachsenen beträgt 1 g (4 PENTASA 250-mg-Kapseln oder 2 PENTASA 500-mg-Kapseln) 4-mal täglich für eine Gesamttagesdosis von 4 g. Die Behandlungsdauer in kontrollierten Studien betrug bis zu 8 Wochen.
PENTASA-Kapseln können ganz geschluckt werden, oder alternativ kann die Kapsel geöffnet und der gesamte Inhalt auf Apfelmus oder Joghurt gestreut werden. Der gesamte Inhalt sollte sofort verzehrt werden. Die Kapseln und der Kapselinhalt dürfen nicht zerdrückt oder gekaut werden.
Trinken Sie ausreichend Flüssigkeit.
Sicherheit und Wirksamkeit von PENTASA 400 mg bei pädiatrischen Patienten wurden nicht nachgewiesen.
WIE GELIEFERT
PENTASA mit verlängerter Freisetzung 250 mg Kapseln werden in Flaschen mit 240 Kapseln geliefert ( NDC 54092-189-81). Jede grüne und blaue Kapsel enthält 250 mg Mesalamin in Kügelchen mit verlängerter Freisetzung. PENTASA-Kapseln mit verlängerter Freisetzung sind mit einem fünfeckigen Starburst-Logo und der Nummer 2010 auf dem grünen Teil und S429 250 mg auf dem blauen Teil der Kapseln gekennzeichnet.
PENTASA mit verlängerter Freisetzung 500 mg Kapseln werden in Flaschen mit 120 Kapseln geliefert ( NDC 54092-191-12). Jede blaue Kapsel enthält 500 mg Mesalamin in Kügelchen mit verlängerter Freisetzung. PENTASA 400 mg Kapseln mit verlängerter Freisetzung sind mit einem fünfeckigen Starburst-Logo und S429 500 mg auf den Kapseln gekennzeichnet.
Bei 25 °C (77 °F) lagern; Abweichungen bis 15 °C bis 30 °C (59 °F bis 86 °F) zulässig [siehe USP Controlled Room Temperature].
Um VERMUTLICHE NEBENWIRKUNGEN zu melden, kontaktieren Sie Takeda Pharmaceuticals unter 1800-828-2088 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
Vertrieb durch: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, USA. Überarbeitet: November 2021
NEBENWIRKUNGEN
In kombinierten in- und ausländischen klinischen Studien erhielten mehr als 2100 Patienten mit Colitis ulcerosa oder Morbus Crohn eine PENTASA-Therapie. Im Allgemeinen wurde die PENTASA-Therapie gut vertragen. Die häufigsten Ereignisse (d. h. größer oder gleich 1 %) waren Durchfall (3,4 %), Kopfschmerzen (2,0 %), Übelkeit (1,8 %), Bauchschmerzen (1,7 %), Dyspepsie (1,6 %), Erbrechen (1,5 %) und Hautausschlag (1,0 %).
In zwei inländischen placebokontrollierten Studien mit über 600 Patienten mit Colitis ulcerosa traten bei den mit PENTASA (Mesalamin) behandelten Patienten weniger Nebenwirkungen auf als in der Placebogruppe (PENTASA 14 % vs. Placebo 18 %) und waren nicht dosisabhängig. Ereignisse, die bei mehr als 1 % auftreten, sind in der folgenden Tabelle aufgeführt. Von diesen traten in der PENTASA-Gruppe nur Übelkeit und Erbrechen häufiger auf. Ein Therapieabbruch aufgrund von Nebenwirkungen war unter Placebo häufiger als unter PENTASA (7 % vs. 4 %).
Klinische Labormessungen zeigten bei keinem Test, einschließlich der Messung der hämatologischen, Leber- und Nierenfunktion, signifikante abnormale Trends.
Die folgenden unerwünschten Ereignisse, dargestellt nach Körpersystemen, wurden selten (dh weniger als 1 %) in Studien zu häuslicher Colitis ulcerosa und Morbus Crohn berichtet. In vielen Fällen wurde die Beziehung zu PENTASA nicht hergestellt.
Magen-Darm: Blähungen, Anorexie, Verstopfung, Zwölffingerdarmgeschwür, Dysphagie, Aufstoßen, Ösophagusgeschwür, Stuhlinkontinenz, GGTP-Anstieg, GI-Blutung, erhöhte alkalische Phosphatase, LDH-Anstieg, Mundgeschwür, orale Moniliasis, Pankreatitis, rektale Blutung, SGOT-Anstieg, SGPT-Anstieg, Stuhlanomalien (Farb- oder Texturänderung), Durst
Dermatologisch: Akne, Alopezie, trockene Haut, Ekzeme, Erythema nodosum, Nagelerkrankungen, Lichtempfindlichkeit, Pruritus, Schwitzen, Urtikaria
Nervöses System: Depression, Schwindel, Schlaflosigkeit, Somnolenz, Parästhesien
Herz-Kreislauf: Herzklopfen, Perikarditis, Vasodilatation
Sonstiges: Albuminurie, Amenorrhoe, Amylaseanstieg, Arthralgie, Asthenie, Brustschmerzen, Konjunktivitis, Ekchymose, Ödeme, Fieber, Hämaturie, Hypomenorrhoe, Kawasaki-ähnliches Syndrom, Beinkrämpfe, Lichen planus, Lipaseanstieg, Unwohlsein, Menorrhagie, Metrorrhagie, Myalgie, Lungeninfiltrate , Thrombozythämie, Thrombozytopenie, häufiges Wasserlassen
Eine Woche nach Abschluss einer 8-wöchigen Colitis ulcerosa-Studie entwickelte ein 72-jähriger Mann ohne Vorgeschichte von Lungenproblemen Dyspnoe. Bei dem Patienten wurde anschließend von einem Arzt eine interstitielle Lungenfibrose ohne Eosinophilie und von einem zweiten Arzt eine Bronchiolitis obliterans mit organisierender Pneumonitis diagnostiziert. Ein kausaler Zusammenhang zwischen diesem Ereignis und der Mesalamintherapie wurde nicht hergestellt.
Veröffentlichte Fallberichte und/oder spontane Postmarketing-Überwachungen haben seltene Fälle von Perikarditis, tödlicher Myokarditis, Brustschmerzen und T-Wellen-Anomalien, Überempfindlichkeitspneumonitis, Pankreatitis, nephrotisches Syndrom, interstitielle Nephritis, Hepatitis, aplastische Anämie, Panzytopenie, Leukopenie, Agranulozytose oder beschrieben Anämie während einer Mesalamintherapie. Anämie kann ein Teil der klinischen Präsentation einer entzündlichen Darmerkrankung sein. Allergische Reaktionen, die mit einer Eosinophilie einhergehen können, können im Zusammenhang mit einer Therapie mit PENTASA 400 mg beobachtet werden.
Postmarketing-Berichte
Die folgenden Ereignisse wurden während der Anwendung von Mesalamin der Marke PENTASA in der klinischen Praxis nach der Zulassung festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet wurden, können keine Schätzungen zur Häufigkeit vorgenommen werden. Diese Ereignisse wurden aufgrund einer Kombination aus Schweregrad, Meldehäufigkeit oder möglichem kausalen Zusammenhang mit Mesalamin für die Aufnahme ausgewählt:
Magen-Darm: Berichte über Hepatotoxizität, einschließlich erhöhter Leberenzyme (SGOT/AST, SGPT/ALT, GGT, LDH, alkalische Phosphatase, Bilirubin), Hepatitis, Gelbsucht, cholestatischer Gelbsucht, Zirrhose und möglicher hepatozellulärer Schädigung einschließlich Lebernekrose und Leberversagen. Einige dieser Fälle verliefen tödlich. Es wurde auch über einen Fall von Kawasaki-ähnlichem Syndrom mit Leberfunktionsveränderungen berichtet.
Sonstiges: anaphylaktische Reaktion, SJS/TEN, DRESS, AGEP, Pleuritis/Pleuritis, Pneumonitis, Granulozytopenie, systemischer Lupus erythematodes, Lupus-ähnliches Syndrom, akutes Nierenversagen, interstitielle Lungenerkrankung, Überempfindlichkeitspneumonitis (einschließlich interstitieller Pneumonitis, allergischer Alveolitis, eosinophiler Pneumonitis), chronisches Nierenversagen, nephrogener Diabetes insipidus, Nephrolithiasis, intrakranielle Hypertonie, Angioödem und Oligospermie (reversibel).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es wurden keine Untersuchungen zu Wechselwirkungen zwischen PENTASA 400 mg und anderen Arzneimitteln durchgeführt; Für mesalaminhaltige Produkte wurden jedoch die folgenden Arzneimittelwechselwirkungen berichtet:
Nephrotoxische Mittel, einschließlich nichtsteroidaler entzündungshemmender Arzneimittel
Die gleichzeitige Anwendung von Mesalamin mit bekannten nephrotoxischen Wirkstoffen, einschließlich nichtsteroidaler Antirheumatika (NSAIDs), kann das Risiko einer Nephrotoxizität erhöhen. Überwachen Sie Patienten, die nephrotoxische Medikamente einnehmen, auf Veränderungen der Nierenfunktion und mesalaminbedingte Nebenwirkungen.

Azathioprin oder 6-Mercaptopurin
Die gleichzeitige Anwendung von Mesalamin mit Azathioprin oder 6-Mercaptopurin und/oder anderen Arzneimitteln, von denen bekannt ist, dass sie Myelotoxizität verursachen, kann das Risiko für Bluterkrankungen, Knochenmarkversagen und damit verbundene Komplikationen erhöhen. Wenn die gleichzeitige Anwendung von PENTASA und Azathioprin oder 6-Mercaptopurin nicht vermieden werden kann, überwachen Sie die Bluttests, einschließlich des vollständigen Blutbildes und der Blutplättchenzahl.
WARNUNGEN
Keine Informationen bereitgestellt
VORSICHTSMASSNAHMEN
Nierenfunktionsstörung
Nierenfunktionsstörungen, einschließlich Minimal Change Disease, akute und chronische interstitielle Nephritis und Nierenversagen wurden bei Patienten berichtet, denen PENTASA oder andere Produkte verabreicht wurden, die Mesalamin enthalten oder in Mesalamin umgewandelt werden.
Es ist bekannt, dass Mesalamin im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Beurteilen Sie die Nierenfunktion bei allen Patienten vor Beginn und in regelmäßigen Abständen während der Therapie mit PENTASA. Bewerten Sie die Risiken und Vorteile der Anwendung von PENTASA bei Patienten mit bekannter Nierenfunktionsstörung oder einer Nierenerkrankung in der Vorgeschichte oder bei gleichzeitiger Einnahme von nephrotoxischen Arzneimitteln.
Mesalamin-induziertes akutes Intoleranzsyndrom
Mesalamin wurde mit einem akuten Unverträglichkeitssyndrom in Verbindung gebracht, das möglicherweise schwer von einem Schub einer entzündlichen Darmerkrankung zu unterscheiden ist. Zu den Symptomen gehören Krämpfe, akute Bauchschmerzen, blutiger Durchfall und manchmal Fieber, Kopfschmerzen und Hautausschlag. Überwachen Sie die Patienten während der Behandlung auf eine Verschlechterung dieser Symptome. Bei Verdacht auf ein akutes Intoleranzsyndrom ist die Behandlung mit PENTASA unverzüglich abzubrechen.
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen wurden bei Patienten berichtet, die Sulfasalazin einnahmen. Einige Patienten reagieren möglicherweise ähnlich auf PENTASA oder andere Verbindungen, die Mesalamin enthalten oder in Mesalamin umgewandelt werden.
Wie bei Sulfasalazin können Mesalamin-induzierte Überempfindlichkeitsreaktionen als Beteiligung innerer Organe auftreten, einschließlich Myokarditis, Perikarditis, Nephritis, Hepatitis, Pneumonitis und hämatologische Anomalien. Patienten sofort untersuchen, wenn Anzeichen oder Symptome einer Überempfindlichkeitsreaktion vorhanden sind. PENTASA absetzen, wenn keine alternative Ätiologie für die Anzeichen und Symptome festgestellt werden kann.
Leberversagen
Es liegen Berichte über Leberversagen bei Patienten mit vorbestehender Lebererkrankung vor, denen andere Produkte verabreicht wurden, die Mesalamin enthalten. Bewerten Sie die Risiken und Vorteile der Anwendung von PENTASA 400 mg bei Patienten mit bekannter Leberfunktionsstörung.
Schwere kutane Nebenwirkungen
Schwere kutane Nebenwirkungen wie Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN), Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose (AGEP) wurden bei der Anwendung von Mesalamin berichtet (sehen NEBENWIRKUNGEN ). Setzen Sie PENTASA bei den ersten Anzeichen oder Symptomen schwerer kutaner Nebenwirkungen oder anderer Anzeichen einer Überempfindlichkeit ab und ziehen Sie eine weitere Untersuchung in Betracht.
Lichtempfindlichkeit
Patienten mit vorbestehenden Hauterkrankungen wie atopischer Dermatitis und atopischem Ekzem haben über schwerere Lichtempfindlichkeitsreaktionen berichtet. Weisen Sie die Patienten darauf hin, Sonneneinstrahlung zu vermeiden, Schutzkleidung zu tragen und im Freien einen Breitband-Sonnenschutz zu verwenden.
Nephrolithiasis
Fälle von Nephrolithiasis wurden bei der Anwendung von Mesalamin berichtet, einschließlich Steinen mit 100 % Mesalamingehalt. Mesalaminhaltige Steine sind röntgentransparent und mit Standardradiographie oder Computertomographie (CT) nicht nachweisbar. Achten Sie während der Behandlung auf eine ausreichende Flüssigkeitszufuhr.
Beeinträchtigung von Labortests
Die Verwendung von Mesalamin kann aufgrund der Ähnlichkeit in den Chromatogrammen von Normetanephrin und dem Hauptmetaboliten von Mesalamin, N-Acetyl-5-aminosalicylsäure (N-Ac-5-ASA ). Erwägen Sie einen alternativen, selektiven Assay für Normetanephrin.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen Kanzerogenitätsstudie mit Mesalamin wurden CD-1-Mäuse mit Dosen von bis zu 2500 mg/kg/Tag behandelt und es war nicht tumorerzeugend. Für eine 50 kg schwere Person mit durchschnittlicher Körpergröße (1,46 m2 Körperoberfläche) entspricht dies dem 2,5-fachen der empfohlenen menschlichen Dosis auf Basis der Körperoberfläche (2960 mg/m2/Tag). In einer 104-wöchigen Kanzerogenitätsstudie an Wistar-Ratten war Mesalamin bis zu einer Dosis von 800 mg/kg/Tag nicht tumorerzeugend. Diese Dosis entspricht dem 1,5-fachen der empfohlenen Humandosis bezogen auf die Körperoberfläche.
In einem In-vitro-Ames-Test und in einem In-vivo-Maus-Mikrokerntest wurden keine Hinweise auf Mutagenität beobachtet.
Bei oralen Mesalamin-Dosen von bis zu 400 mg/kg/Tag (das 0,8-Fache der empfohlenen Humandosis bezogen auf die Körperoberfläche) wurden bei männlichen oder weiblichen Ratten keine Auswirkungen auf die Fertilität oder Fortpflanzungsfähigkeit beobachtet.
Spermaanomalien und Unfruchtbarkeit bei Männern, die im Zusammenhang mit Sulfasalazin berichtet wurden, wurden in kontrollierten klinischen Studien mit PENTASA 400 mg Kapseln nicht beobachtet.
Schwangerschaft
Teratogene Wirkungen
Veröffentlichte Daten aus Metaanalysen, Kohortenstudien und Fallserien zur Anwendung von Mesalamin während der Schwangerschaft haben keinen zuverlässigen Hinweis auf einen Zusammenhang mit Mesalamin und schweren Geburtsfehlern, Fehlgeburten oder unerwünschten mütterlichen oder fetalen Folgen gegeben. Es gibt keine eindeutigen Beweise dafür, dass eine Mesalamin-Exposition in der Frühschwangerschaft mit einem erhöhten Risiko für schwere angeborene Fehlbildungen, einschließlich Herzfehlbildungen, verbunden ist. Veröffentlichte epidemiologische Studien weisen erhebliche methodische Einschränkungen auf, die die Interpretation der Daten erschweren, einschließlich der Unfähigkeit, Confounder wie zugrunde liegende Erkrankungen der Mutter, gleichzeitige Einnahme von Medikamenten durch die Mutter und fehlende Informationen zur Dosis und Anwendungsdauer von Mesalamin-Produkten zu kontrollieren. PENTASA sollte während der Schwangerschaft nur angewendet werden, wenn der Nutzen die Risiken überwiegt.
In Reproduktionsstudien an Tieren ergab die orale Verabreichung von Mesalamin während der Organogenese an trächtige Ratten in Dosen von bis zu 1000 mg/kg/Tag (5900 mg/m²) und Kaninchen in Dosen von 800 mg/kg/Tag (6856 mg/m²) keine Hinweise von teratogenen Wirkungen oder Schädigung des Fötus durch Mesalamin.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften 2 % bis 4 % bzw. 15 % bis 20 %.
Nicht teratogene Wirkungen
Veröffentlichte Daten deuten darauf hin, dass eine erhöhte Krankheitsaktivität mit dem Risiko verbunden ist, bei Frauen mit Colitis ulcerosa unerwünschte Schwangerschaftsverläufe zu entwickeln. Unerwünschte Schwangerschaftsergebnisse umfassen Frühgeburten (vor der 37. Schwangerschaftswoche), Säuglinge mit niedrigem Geburtsgewicht (weniger als 2500 g) und ein für das Gestationsalter bei der Geburt zu kleines Alter.
Stillende Mutter
Daten aus der veröffentlichten Literatur berichten über das Vorhandensein von Mesalamin und seinem Metaboliten N-Acetyl-5-aminosalicylsäure in der Muttermilch in kleinen Mengen mit relativen Säuglingsdosen (RID) von 0,1 % oder weniger für Mesalamin. Die klinische Bedeutung davon wurde nicht bestimmt und es gibt nur begrenzte Erfahrung mit stillenden Frauen, die Mesalamin verwenden.
Es gibt Berichte über Durchfall bei gestillten Säuglingen, die Mesalamin ausgesetzt waren. Die Wirkung von PENTASA 400 mg auf die Milchproduktion ist nicht bekannt. Seien Sie vorsichtig, wenn PENTASA 400 mg einer stillenden Frau verabreicht wird, und überwachen Sie gestillte Säuglinge auf Durchfall.
In veröffentlichten Laktationsstudien lagen die Dosen von mütterlichem Mesalamin aus verschiedenen oralen und rektalen Formulierungen und Produkten zwischen 500 mg und 4,8 g täglich. Die durchschnittliche Konzentration von Mesalamin in Milch reichte von nicht nachweisbar bis 0,5 mg/l. Die durchschnittliche Konzentration von N-Acetyl-5-aminosalicylsäure in Milch lag im Bereich von 0,2 bis 9,3 mg/l. Basierend auf diesen Konzentrationen betragen die geschätzten täglichen Säuglingsdosen für einen ausschließlich gestillten Säugling 0 bis 0,075 mg/kg/Tag Mesalamin (RID 0 % bis 0,1 %) und 0,03 bis 1,4 mg/kg/Tag N-Acetyl-5-aminosalicylsäure Säure.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von PENTASA bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit PENTASA 400 mg schlossen keine ausreichende Anzahl von Patienten ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Berichte aus unkontrollierten klinischen Studien und Meldesystemen nach Markteinführung deuteten auf eine höhere Inzidenz von Blutdyskrasie (dh Agranulozytose, Neutropenie und Panzytopenie) bei Patienten hin, die Mesalamin-haltige Produkte wie PENTASA 400 mg erhielten und die 65 Jahre oder älter waren, im Vergleich zu jüngeren Patienten. Überwachen Sie bei älteren Patienten während der Behandlung mit PENTASA das vollständige Blutbild und die Anzahl der Blutplättchen.
Im Allgemeinen ist bei der Verschreibung von PENTASA die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer gleichzeitigen Erkrankung oder einer anderen medikamentösen Therapie bei älteren Patienten zu berücksichtigen.
ÜBERDOSIS
PENTASA 400 mg ist ein Aminosalicylat, und es können Symptome einer Salicylat-Toxizität auftreten, wie z. B. Übelkeit, Erbrechen, Bauchschmerzen, Tachypnoe, Hyperventilation, Tinnitus und neurologische Symptome (Kopfschmerzen, Schwindel, Verwirrtheit, Krampfanfälle). Eine schwere Intoxikation mit Salicylaten kann zu einem Ungleichgewicht der Elektrolyte und des Blut-pH-Werts und möglicherweise zu anderen Organschäden (z. B. Nieren und Leber) führen.
Behandlung einer Überdosierung
Es gibt kein spezifisches Antidot für eine Mesalamin-Überdosierung; Eine konventionelle Therapie der Salicylat-Toxizität kann jedoch im Falle einer akuten Überdosierung von Vorteil sein und kann eine Dekontamination des Gastrointestinaltrakts umfassen, um eine weitere Resorption zu verhindern. Korrigieren Sie das Flüssigkeits- und Elektrolytungleichgewicht durch die Verabreichung einer geeigneten intravenösen Therapie und erhalten Sie eine angemessene Nierenfunktion aufrecht.
KONTRAINDIKATIONEN
PENTASA ist kontraindiziert bei Patienten mit bekannter oder vermuteter Überempfindlichkeit gegenüber Salicylaten, Aminosalicylaten oder anderen Bestandteilen dieses Medikaments.
KLINISCHE PHARMAKOLOGIE
Sulfasalazin wird durch Bakterien im Dickdarm in Sulfapyridin (SP) und Mesalamin (5-ASA) gespalten. Die übliche orale Sulfasalazin-Dosis bei aktiver Colitis ulcerosa bei Erwachsenen beträgt 2 bis 4 g pro Tag in aufgeteilten Dosen. Vier Gramm Sulfasalazin versorgen den Dickdarm mit 1,6 g freiem Mesalamin.
Der Wirkungsmechanismus von Mesalamin (und Sulfasalazin) ist nicht vollständig geklärt, aber es scheint sich um eine topische entzündungshemmende Wirkung auf Epithelzellen des Dickdarms zu handeln. Die Schleimhautproduktion von Arachidonsäure (AA)-Metaboliten, sowohl über die Cyclooxygenasewege (dh Prostanoide) als auch über die Lipoxygenasewege (dh Leukotriene (LTs) und Hydroxyeicosatetraensäuren (HETEs), ist bei Patienten mit Colitis ulcerosa erhöht, und das ist sie auch Es ist möglich, dass Mesalamin Entzündungen verringert, indem es die Cyclooxygenase blockiert und die Produktion von Prostaglandin (PG) im Dickdarm hemmt.
Menschliche Pharmakokinetik und Metabolismus
Absorption
PENTASA ist eine mit Ethylcellulose beschichtete Mesalaminformulierung mit verlängerter Freisetzung, die darauf ausgelegt ist, therapeutische Mengen an Mesalamin im gesamten Magen-Darm-Trakt freizusetzen. Basierend auf Daten zur Ausscheidung im Urin werden 20 % bis 30 % des Mesalamins in PENTASA resorbiert. Im Gegensatz dazu wird Mesalamin, wenn es oral als unformulierte wässrige Suspension von 1 g verabreicht wird, zu etwa 80 % resorbiert.
Die Plasma-Mesalamin-Konzentration erreichte 3 Stunden nach einer 1-g-PENTASA-Dosis einen Spitzenwert von etwa 1 µg/ml und nahm zweiphasig ab. In der Literatur wird für Mesalamin nach intravenöser Gabe eine mittlere terminale Halbwertszeit von 42 Minuten beschrieben. Aufgrund der kontinuierlichen Freisetzung und Resorption von Mesalamin aus PENTASA im gesamten Gastrointestinaltrakt kann die tatsächliche Eliminationshalbwertszeit nach oraler Verabreichung nicht bestimmt werden. N-Acetyl-5-aminosalicylsäure, der Hauptmetabolit von Mesalamin (5-Aminosalicylsäure), erreichte nach etwa 3 Stunden einen Höchstwert von 1,8 mcg/ml, und seine Konzentration folgte einem zweiphasigen Abfall. Die pharmakologischen Aktivitäten von N-Acetyl-5-aminosalicylsäure sind nicht bekannt, und andere Metaboliten wurden nicht identifiziert.
Die Pharmakokinetik von oralem Mesalamin war nichtlinear, wenn PENTASA-Kapseln viermal täglich mit 250 mg bis 1 g dosiert wurden, wobei die Steady-State-Mesalamin-Plasmakonzentrationen etwa neunmal von 0,14 µg/ml auf 1,21 µg/ml anstiegen, was auf einen sättigbaren First-Pass-Metabolismus hindeutet. Die Pharmakokinetik von N-Acetyl-5-aminosalicylsäure war linear.
Beseitigung
Etwa 130 mg freies Mesalamin wurden nach einer Einzeldosis von 1 g PENTASA 400 mg im Stuhl wiedergefunden, was vergleichbar war mit den 140 mg Mesalamin, die aus der molaren äquivalenten Sulfasalazin-Tablettendosis von 2,5 g wiedergefunden wurden. Die Elimination von freiem Mesalamin und Salicylaten im Stuhl nahm proportional mit der PENTASA-Dosis zu. N-Acetyl-5-aminosalicylsäure war die primäre Verbindung, die nach der Gabe von PENTASA 400 mg im Urin ausgeschieden wurde (19 % bis 30 %).
Klinische Versuche
In zwei randomisierten, doppelblinden, placebokontrollierten Dosis-Wirkungs-Studien (UC-1 und UC-2) mit 625 Patienten mit aktiver leichter bis mittelschwerer Colitis ulcerosa wurde PENTASA 400 mg in einer oralen Dosis von 4 g/Tag verabreicht 1 g viermal täglich führte zu einer konsistenten Verbesserung der prospektiv identifizierten primären Wirksamkeitsparameter PGA, Tx F und SI, wie in der folgenden Tabelle gezeigt.
Die 4-g-Dosis von PENTASA führte auch zu einer konsistenten Verbesserung der sekundären Wirksamkeitsparameter, nämlich der Häufigkeit von Toilettengängen, der Stuhlkonsistenz, rektalen Blutungen, abdominalen/rektalen Schmerzen und Harndrang. Die 4-g-Dosis von PENTASA induzierte eine Remission, wie durch endoskopische und symptomatische Endpunkte beurteilt.
Bei einigen Patienten wurde beobachtet, dass die 2-g-Dosis von PENTASA 400 mg die gemessenen Wirksamkeitsparameter verbesserte. Die 2-g-Dosis ergab jedoch in den beiden angemessenen und gut kontrollierten Studien widersprüchliche Ergebnisse bei den primären Wirksamkeitsparametern.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die VORSICHTSMASSNAHMEN Sektion.