Prevacid 15mg, 30mg Lansoprazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Prevacid und wie wird es angewendet?
Prevacid 15 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Magen- und Darmgeschwüren und zur Verringerung der im Magen produzierten Säuremenge. Prevacid 15 mg kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Prevacid 30mg haben?
Prevacid 30 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Prevacid 15 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prevacid. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
PREVACID (Lansoprazol) oral zerfallende Tabletten mit verzögerter Freisetzung
BEZEICHNUNG
Der Wirkstoff in PREVACID 30 mg Retardkapseln und PREVACID 15 mg SoluTab Retardtabletten zum Einnehmen ist Lansoprazol, ein substituiertes Benzimidazol, 2-[[[3-Methyl-4-(2,2,2trifluorethoxy)-2-pyridyl] Methyl] Sulfinyl] Benzimidazol, eine Verbindung, die die Magensäuresekretion hemmt. Seine Summenformel ist C16H14F3N3O2S mit einem Molekulargewicht von 369,37. Lansoprazol hat die folgende Struktur:
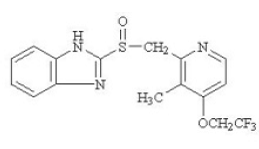
Lansoprazol ist ein weißes bis bräunlich-weißes, geruchloses, kristallines Pulver, das unter Zersetzung bei etwa 166 °C schmilzt. Lansoprazol ist in Dimethylformamid frei löslich; löslich in Methanol; schwer löslich in Ethanol; leicht löslich in Ethylacetat, Dichlormethan und Acetonitril; sehr wenig löslich in Ether und praktisch unlöslich in Hexan und Wasser.
Lansoprazol ist bei Lichteinwirkung bis zu zwei Monate stabil. Die Abbaugeschwindigkeit der Verbindung in einer wässrigen Lösung nimmt mit abnehmendem pH-Wert zu. Die Abbauhalbwertszeit des Arzneimittels in einer wässrigen Lösung bei 25 °C beträgt etwa 0,5 Stunden bei pH 5,0 und etwa 18 Stunden bei pH 7,0.
PREVACID wird in Kapseln mit verzögerter Freisetzung geliefert und PREVACID 15 mg SoluTab wird in oral zerfallenden Tabletten mit verzögerter Freisetzung (SoluTab) zur oralen Verabreichung geliefert.
PREVACID ist in zwei Dosierungsstärken erhältlich: 15 und 30 mg Lansoprazol pro Kapsel. Jede Kapsel mit verzögerter Wirkstofffreisetzung enthält magensaftresistentes Granulat bestehend aus 15 oder 30 mg Lansoprazol (Wirkstoff) und den folgenden Hilfsstoffen: Zuckerkügelchen, Saccharose, Methacrylsäure-Copolymer, niedrig substituierte Hydroxypropylcellulose, Stärke, Magnesiumcarbonat, Talkum, Polyethylen Glykol, Titandioxid, Polysorbat 80, Hydroxypropylcellulose, kolloidales Siliciumdioxid, D&C Red Nr. 28, FD&C Blue Nr. 1, FD&C Green Nr. 31 und FD&C Red Nr. 40.
PREVACID 30 mg SoluTab ist in zwei Dosierungsstärken erhältlich: 15 und 30 mg Lansoprazol pro Tablette. Jede oral zerfallende Tablette mit verzögerter Wirkstofffreisetzung enthält magensaftresistente Mikrogranulate, bestehend aus 15 oder 30 mg Lansoprazol (Wirkstoff) und den folgenden Hilfsstoffen: Mannit, Methacrylsäure, Hydroxypropylcellulose, Lactose-Monohydrat-mikrokristalline Cellulosekügelchen, Triethylcitrat, Crospovidon, Polyacrylat, Magnesiumcarbonat, Aspartam2, Glycerylmonostearat, Hypromellose, Magnesiumstearat, Zitronensäure, Titandioxid, Talkum, künstliches Erdbeeraroma, Polyethylenglycol, Polysorbat 80 und Eisenoxid.
1 Nur PREVACID 15 mg Kapseln. 2Phenylketonurika: PREVACID SoluTab enthält 2,5 mg Phenylalanin pro 15-mg-Tablette und 5,1 mg pro 30-mg-Tablette.
INDIKATIONEN
Behandlung von aktivem Zwölffingerdarmgeschwür
PREVACID und PREVACID SoluTab sind bei Erwachsenen zur Kurzzeitbehandlung (über vier Wochen) zur Heilung und Linderung der Symptome eines aktiven Zwölffingerdarmgeschwürs indiziert [siehe Klinische Studien ].
Ausrottung von H. pylori, um das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren zu verringern
Dreifachtherapie: PREVACID oder PREVACID SoluTab/Amoxicillin/Clarithromycin
PREVACID oder PREVACID 30 mg SoluTab in Kombination mit Amoxicillin plus Clarithromycin als Dreifachtherapie ist bei Erwachsenen zur Behandlung von Patienten mit H. pylori-Infektion und Zwölffingerdarmgeschwür (aktives oder einjähriges Zwölffingerdarmgeschwür) zur Eradikation von H. pylori indiziert. Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert [siehe Klinische Studien ].
Bitte beachten Sie die vollständigen Verschreibungsinformationen für Amoxicillin und Clarithromycin.
Duale Therapie: PREVACID oder PREVACID SoluTab/Amoxicillin
PREVACID oder PREVACID 15 mg SoluTab in Kombination mit Amoxicillin als Zweifachtherapie ist angezeigt bei Erwachsenen zur Behandlung von Patienten mit H.-pylori-Infektion und Zwölffingerdarmgeschwür-Erkrankung (aktives oder seit einem Jahr bestehendes Zwölffingerdarm-Geschwür), die entweder allergisch oder intolerant gegenüber Clarithromycin sind bei denen eine Resistenz gegen Clarithromycin bekannt ist oder vermutet wird (siehe Verschreibungsinformationen zu Clarithromycin, Abschnitt Mikrobiologie). Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert [siehe Klinische Studien ].
Bitte beachten Sie die vollständigen Verschreibungsinformationen für Amoxicillin.
Pflege geheilter Zwölffingerdarmgeschwüre
PREVACID und PREVACID SoluTab sind bei Erwachsenen indiziert, um die Heilung von Zwölffingerdarmgeschwüren aufrechtzuerhalten. Kontrollierte Studien erstrecken sich nicht über 12 Monate [vgl Klinische Studien ].
Behandlung von aktivem gutartigem Magengeschwür
PREVACID und PREVACID 30 mg SoluTab sind bei Erwachsenen zur Kurzzeitbehandlung (bis zu acht Wochen) zur Heilung und Symptomlinderung eines aktiven gutartigen Magengeschwürs indiziert [siehe Klinische Studien ].
Heilung von NSAID-assoziiertem Magengeschwür
PREVACID 30 mg und PREVACID SoluTab sind angezeigt bei Erwachsenen zur Behandlung von NSAID-assoziierten Magengeschwüren bei Patienten, die weiterhin NSAIDs anwenden. Kontrollierte Studien erstreckten sich nicht über acht Wochen [vgl Klinische Studien ].
Risikominderung von NSAID-assoziiertem Magengeschwür
PREVACID 15 mg und PREVACID SoluTab sind angezeigt bei Erwachsenen zur Verringerung des Risikos von NSAID-assoziierten Magengeschwüren bei Patienten mit dokumentiertem Magengeschwür in der Vorgeschichte, die die Anwendung eines NSAID benötigen. Kontrollierte Studien erstreckten sich nicht über 12 Wochen [vgl Klinische Studien ].
Behandlung der symptomatischen gastroösophagealen Refluxkrankheit (GERD)
PREVACID 15 mg und PREVACID 30 mg SoluTab sind indiziert zur Kurzzeitbehandlung bei Erwachsenen und Kindern und Jugendlichen im Alter von 12 bis 17 Jahren (bis zu acht Wochen) und Kindern und Jugendlichen im Alter von 1 bis 11 Jahren (bis zu 12 Wochen) zur Behandlung von Sodbrennen und andere Symptome im Zusammenhang mit GERD [siehe Klinische Studien ].
Behandlung der erosiven Ösophagitis (EE)
PREVACID 15 mg und PREVACID 30 mg SoluTab sind zur Kurzzeitbehandlung bei Erwachsenen und pädiatrischen Patienten im Alter von 12 bis 17 Jahren (bis zu acht Wochen) und pädiatrischen Patienten im Alter von 1 bis 11 Jahren (bis zu 12 Wochen) zur Heilung und Linderung der Symptome indiziert aller Grade von EE.
Bei Erwachsenen, die mit PREVACID 30 mg oder PREVACID 15 mg SoluTab acht Wochen lang (5 bis 10 %) nicht ausheilen, kann es hilfreich sein, eine weitere achtwöchige Behandlung zu geben. Bei einem Wiederauftreten der erosiven Ösophagitis kann eine zusätzliche achtwöchige Behandlung mit PREVACID 30 mg oder PREVACID SoluTab in Erwägung gezogen werden [siehe Klinische Studien ].
Aufrechterhaltung der Heilung von EE
PREVACID und PREVACID SoluTab sind bei Erwachsenen indiziert, um die Heilung von EE aufrechtzuerhalten. Kontrollierte Studien erstreckten sich nicht über 12 Monate [vgl Klinische Studien ].
Pathologische hypersekretorische Zustände einschließlich Zollinger-Ellison-Syndrom (ZES)
PREVACID 15 mg und PREVACID SoluTab sind angezeigt bei Erwachsenen zur Langzeitbehandlung pathologischer hypersekretorischer Zustände, einschließlich des Zollinger-Ellison-Syndroms [siehe Klinische Studien ].
DOSIERUNG UND ANWENDUNG
Empfohlene Dosierung für Erwachsene nach Indikation
Empfohlene pädiatrische Dosierung nach Indikation
Pädiatrische Patienten im Alter von 1 bis 11 Jahren
In klinischen Studien wurde PREVACID bei 1- bis 11-Jährigen nicht länger als 12 Wochen verabreicht. Es ist nicht bekannt, ob PREVACID sicher und wirksam ist, wenn es länger als die empfohlene Dauer angewendet wird. Überschreiten Sie nicht die empfohlene Dosis und Anwendungsdauer bei pädiatrischen Patienten, wie unten beschrieben [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Leberfunktionsstörung
Die empfohlene Dosierung beträgt 15 mg täglich oral bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Wichtige Verwaltungsinformationen
PREVACID-Kapseln
Verabreichung in weichen Lebensmitteln (Apfelmus, ENSURE-Pudding, Hüttenkäse, Joghurt oder passierte Birnen):
Verabreichung in Flüssigkeiten (Apfelsaft, Orangensaft oder Tomatensaft):
Verabreichung mit Apfelsaft über eine Magensonde (≥16 French)
PREVACID 15mg SoluTab
Verabreichung mit Wasser in einer oralen Spritze
Verabreichung mit Wasser über eine NG-Sonde (≥8 French)
WIE GELIEFERT
Darreichungsformen und Stärken
PREVACID 15 mg Kapseln mit verzögerter Freisetzung
PREVACID 30 mg SoluTab Oral zerfallende Tabletten mit verzögerter Freisetzung
Lagerung und Handhabung
PREVACID-Kapseln mit verzögerter Freisetzung , 15 mg, sind undurchsichtig, rosa und grün mit dem Aufdruck „TAP“ und „PREVACID 15“ auf den Kapseln. Die 30-mg-Kapseln mit verzögerter Freisetzung sind undurchsichtig, rosa und schwarz mit dem Aufdruck „TAP“ und „PREVACID 30“ auf den Kapseln. Sie sind wie folgt erhältlich:
PREVACID 30 mg SoluTab oral zerfallende Tabletten mit verzögerter Freisetzung , 15 mg, sind weiße bis gelblich-weiße, runde, unbeschichtete Tabletten mit orangen bis dunkelbraunen Sprenkeln und der Prägung „15“ auf einer Seite der Tablette. Die 30 mg sind weiße bis gelblich-weiße, runde, unbeschichtete Tabletten mit orangen bis dunkelbraunen Sprenkeln und der Prägung „30“ auf einer Seite der Tablette. Die Tabletten sind wie folgt erhältlich:
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15-30°C (59-86°F)[siehe USP kontrollierte Raumtemperatur ].
Vertrieb durch: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Überarbeitet: Juni 2018
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Weltweit wurden über 10.000 Patienten mit PREVACID 30 mg in klinischen Phase-2- oder Phase-3-Studien mit unterschiedlichen Dosierungen und Behandlungsdauern behandelt. Im Allgemeinen wurde die Behandlung mit PREVACID 30 mg sowohl in Kurzzeit- als auch in Langzeitstudien gut vertragen.
Die folgenden Nebenwirkungen wurden vom behandelnden Arzt bei 1 % oder mehr der mit PREVACID behandelten Patienten in einem möglichen oder wahrscheinlichen Zusammenhang mit dem Arzneimittel gemeldet und traten bei den mit PREVACID behandelten Patienten häufiger auf als bei den mit Placebo behandelten Patienten in Tabelle 1.
Kopfschmerzen wurden ebenfalls mit einer Inzidenz von mehr als 1 % beobachtet, traten jedoch unter Placebo häufiger auf. Die Inzidenz von Durchfall war bei Patienten, die Placebo erhielten, und Patienten, die 15 und 30 mg PREVACID erhielten, ähnlich, aber höher bei den Patienten, die 60 mg PREVACID erhielten (2,9, 1,4, 4,2 bzw. 7,4 %).
Die am häufigsten berichtete mögliche oder wahrscheinlich behandlungsbedingte Nebenwirkung während der Erhaltungstherapie war Durchfall.
In der Studie zur Risikominderung von PREVACID bei NSAID-assoziierten Magengeschwüren betrug die Inzidenz von Durchfall bei Patienten, die mit PREVACID 30 mg, Misoprostol und Placebo behandelt wurden, 5, 22 bzw. 3 %.
Eine andere Studie für die gleiche Indikation, bei der Patienten entweder einen COX-2-Hemmer oder Lansoprazol und Naproxen einnahmen, zeigte, dass das Sicherheitsprofil ähnlich der vorherigen Studie war. Zusätzliche Reaktionen aus dieser Studie, die zuvor nicht in anderen klinischen Studien mit PREVACID 30 mg beobachtet wurden, waren Kontusion, Zwölffingerdarmentzündung, Oberbauchbeschwerden, Speiseröhrenbeschwerden, Müdigkeit, Hunger, Hiatushernie, Heiserkeit, gestörte Magenentleerung, Metaplasie und Nierenfunktionsstörung.
Weitere Nebenwirkungen, die bei weniger als 1 % der Patienten oder Probanden auftraten, die PREVACID 15 mg in inländischen Studien erhielten, sind nachstehend aufgeführt:
Körper als Ganzes - vergrößerter Bauch, allergische Reaktion, Asthenie, Rückenschmerzen, Candidiasis, Karzinom, Brustschmerzen (nicht anders angegeben), Schüttelfrost, Ödeme, Fieber, Grippesyndrom, Mundgeruch, Infektion (nicht anders angegeben), Unwohlsein, Nackenschmerzen, Nackensteifigkeit, Schmerzen , Schmerzen im Beckenbereich
Herz-Kreislauf-System - Angina pectoris, Arrhythmie, Bradykardie, Schlaganfall/Hirninfarkt, Hypertonie/Hypotonie, Migräne, Myokardinfarkt, Palpitationen, Schock (Kreislaufversagen), Synkope, Tachykardie, Vasodilatation
Verdauungstrakt - anormaler Stuhlgang, Anorexie, Bezoar, Kardiospasmus, Cholelithiasis, Colitis, Mundtrockenheit, Dyspepsie, Dysphagie, Enteritis, Aufstoßen, Ösophagusstenose, Ösophagusulcus, Ösophagitis, Stuhlverfärbung, Blähungen, Magenknötchen/Fundusdrüsenpolypen, Gastritis, Gastroenteritis, gastrointestinale Anomalie , Magen-Darm-Erkrankung, Magen-Darm-Blutung, Glossitis, Zahnfleischblutung, Hämatemesis, gesteigerter Appetit, erhöhter Speichelfluss, Meläna, Geschwüre im Mund, Übelkeit und Erbrechen, Übelkeit und Erbrechen und Durchfall, gastrointestinale Moniliasis, rektale Erkrankung, rektale Blutung, Stomatitis, Tenesmus, Durst, Zungenerkrankung, Colitis ulcerosa, Stomatitis ulcerosa
Hormonsystem - Diabetes mellitus, Kropf, Hypothyreose Blut- und Lymphsystem - Anämie, Hämolyse, Lymphadenopathie
Stoffwechsel- und Ernährungsstörungen - Avitaminose, Gicht, Dehydration, Hyperglykämie/Hypoglykämie, periphere Ödeme, Gewichtszunahme/-abnahme
Bewegungsapparat - Arthralgie, Arthritis, Knochenerkrankungen, Gelenkerkrankungen, Beinkrämpfe, Muskel-Skelett-Schmerzen, Myalgie, Myasthenie, Ptosis, Synovitis
Nervöses System - anormale Träume, Unruhe, Amnesie, Angst, Apathie, Verwirrtheit, Krämpfe, Demenz, Depersonalisation, Depression, Diplopie, Schwindel, emotionale Labilität, Halluzinationen, Hemiplegie, verstärkte Feindseligkeit, Hyperkinesie, Hypertonie, Hypästhesie, Schlaflosigkeit, verminderte/erhöhte Libido, Nervosität, Neurose, Parästhesien, Schlafstörungen, Somnolenz, Denkstörungen, Zittern, Schwindel
Atmungssystem - Asthma, Bronchitis, verstärkter Husten, Dyspnoe, Epistaxis, Hämoptyse, Schluckauf, Larynxneoplasie, Lungenfibrose, Pharyngitis, Pleuraerkrankung, Pneumonie, Atemwegserkrankung, Entzündung/Infektion der oberen Atemwege, Rhinitis, Sinusitis, Stridor
Haut und Anhängsel - Akne, Alopezie, Kontaktdermatitis, trockene Haut, fixierter Ausschlag, Haarerkrankung, makulopapulöser Ausschlag, Nagelerkrankung, Pruritus, Hautausschlag, Hautkarzinom, Hauterkrankung, Schwitzen, Urtikaria
Besondere Sinne - Sehstörungen, Amblyopie, Blepharitis, verschwommenes Sehen, Katarakt, Konjunktivitis, Taubheit, trockene Augen, Ohren-/Augenerkrankungen, Augenschmerzen, Glaukom, Mittelohrentzündung, Parosmie, Photophobie, Netzhautdegeneration/-störung, Geschmacksverlust, Geschmacksperversion, Tinnitus, Sehstörungen Feld defekt
Urogenitalsystem - abnorme Menstruation, Brustvergrößerung, Brustschmerzen, Brustspannen, Dysmenorrhoe, Dysurie, Gynäkomastie, Impotenz, Nierensteine, Nierenschmerzen, Leukorrhoe, Menorrhagie, Menstruationsstörung, Penisstörung, Polyurie, Hodenstörung, Harnröhrenschmerzen, Harnfrequenz, Harnverhalt, Harnwegsinfektion, Harndrang, beeinträchtigtes Wasserlassen, Vaginitis
Postmarketing-Erfahrung
Seit der Markteinführung von PREVACID und PREVACID 30 mg SoluTab wurden weitere Nebenwirkungen berichtet. Die Mehrheit dieser Fälle stammt aus dem Ausland, und ein Zusammenhang mit PREVACID 15 mg oder PREVACID SoluTab wurde nicht hergestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet wurden, kann die Häufigkeit nicht geschätzt werden. Diese Ereignisse sind unten nach COSTART-Körpersystem aufgelistet.
Körper als Ganzes - anaphylaktische/anaphylaktoide Reaktionen, systemischer Lupus erythematodes;
Verdauungstrakt - Hepatotoxizität, Pankreatitis, Erbrechen;
Hämisches und lymphatisches System - Agranulozytose, aplastische Anämie, hämolytische Anämie, Leukopenie, Neutropenie, Panzytopenie, Thrombozytopenie und thrombotisch-thrombozytopenische Purpura;
Infektionen und Schädlinge - Clostridium difficile-assoziierter Durchfall;
Stoffwechsel- und Ernährungsstörungen - Hypomagnesiämie, Hypokalzämie, Hypokaliämie, Hyponatriämie;
Bewegungsapparat - Knochenbruch, Myositis;
Haut und Anhängsel - schwere dermatologische Reaktionen einschließlich Erythema multiforme, SJS/TEN (einige mit tödlichem Ausgang), DRESS, AGEP, kutaner Lupus erythematodes;
Besondere Sinne - Sprachstörung;
Urogenitalsystem - interstitielle Nephritis, Harnverhalt.
Kombinationstherapie mit Amoxicillin und Clarithromycin
In klinischen Studien zur Kombinationstherapie mit PREVACID plus Amoxicillin und Clarithromycin und PREVACID 30 mg plus Amoxicillin wurden keine für diese Arzneimittelkombinationen typischen Nebenwirkungen beobachtet. Die aufgetretenen Nebenwirkungen beschränkten sich auf diejenigen, die zuvor mit PREVACID 15 mg, Amoxicillin oder Clarithromycin berichtet wurden.
Dreifachtherapie: PREVACID/Amoxicillin/Clarithromycin
Die am häufigsten berichteten Nebenwirkungen bei Patienten, die eine Dreifachtherapie über 14 Tage erhielten, waren Durchfall (7 %), Kopfschmerzen (6 %) und Geschmacksstörungen (5 %). Es gab keine statistisch signifikanten Unterschiede in der Häufigkeit berichteter Nebenwirkungen zwischen den 10- und 14-tägigen Dreifachtherapieschemata. Bei der Dreifachtherapie wurden keine behandlungsbedingten Nebenwirkungen in signifikant höherer Häufigkeit beobachtet als bei jeder Zweifachtherapie.
Duale Therapie: PREVACID/Amoxicillin
Die am häufigsten berichteten Nebenwirkungen bei Patienten, die PREVACID 30 mg dreimal täglich plus Amoxicillin dreimal täglich als Zweifachtherapie erhielten, waren Durchfall (8 %) und Kopfschmerzen (7 %). Unter der Kombinationstherapie PREVACID 30 mg dreimal täglich plus Amoxicillin dreimal täglich wurden keine behandlungsbedingten Nebenwirkungen mit signifikant höheren Häufigkeiten beobachtet als unter PREVACID 15 mg allein.
Informationen zu Nebenwirkungen von Antibiotika (Amoxicillin und Clarithromycin), die in Kombination mit PREVACID oder PREVACID SoluTab angezeigt werden, finden Sie im Abschnitt „Nebenwirkungen“ der jeweiligen Verschreibungsinformationen.
Laborwerte
Die folgenden Veränderungen der Laborparameter bei Patienten, die PREVACID 30 mg erhielten, wurden als Nebenwirkungen berichtet:
Abnormale Leberfunktionstests, erhöhte SGOT (AST), erhöhte SGPT (ALT), erhöhtes Kreatinin, erhöhte alkalische Phosphatase, erhöhte Globuline, erhöhtes GGTP, erhöhte/erniedrigte/abnorme WBC, abnormes AG-Verhältnis, abnorme Erythrozyten, Bilirubinämie, erhöhtes Kalium im Blut, Blutharnstoff erhöht, Kristallurin vorhanden, Eosinophilie, Hämoglobin erniedrigt, Hyperlipämie, erhöhte/erniedrigte Elektrolyte, erhöhte/erniedrigte Cholesterinwerte, erhöhte Glukokortikoide, erhöhtes LDH, erhöhte/erniedrigte/anormale Blutplättchen, erhöhte Gastrinspiegel und positives okkultes Blut im Stuhl. Urinanomalien wie Albuminurie, Glykosurie und Hämaturie wurden ebenfalls berichtet. Es wurden weitere vereinzelte Laboranomalien gemeldet.
In den placebokontrollierten Studien, bei denen SGOT (AST) und SGPT (ALT) ausgewertet wurden, wiesen 0,4 % (4/978) bzw. 0,4 % (11/2677) der Patienten, die Placebo bzw. PREVACID erhielten, Enzymerhöhungen von mehr als auf das Dreifache der Obergrenze des Normalbereichs beim letzten Behandlungsbesuch. Keiner dieser Patienten, die PREVACID 30 mg erhielten, berichtete zu irgendeinem Zeitpunkt während der Studie über Gelbsucht.
In klinischen Studien zur Kombinationstherapie mit PREVACID 15 mg plus Amoxicillin und Clarithromycin und PREVACID plus Amoxicillin wurden keine erhöhten Laborwerte speziell für diese Arzneimittelkombinationen beobachtet.
Informationen zu Änderungen der Laborwerte bei antibakteriellen Wirkstoffen (Amoxicillin und Clarithromycin), die in Kombination mit PREVACID oder PREVACID 30 mg SoluTab angegeben sind, finden Sie im Abschnitt „Nebenwirkungen“ der jeweiligen Verschreibungsinformationen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Tabellen 2 und 3 enthalten Arzneimittel mit klinisch wichtigen Arzneimittelwechselwirkungen und Wechselwirkungen mit Diagnostika bei gleichzeitiger Verabreichung mit PREVACID 15 mg oder PREVACID SoluTab sowie Anweisungen zu deren Vorbeugung oder Behandlung.
Konsultieren Sie die Kennzeichnung von gleichzeitig angewendeten Arzneimitteln, um weitere Informationen über Wechselwirkungen mit PPIs zu erhalten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Vorhandensein einer malignen Magenerkrankung
Bei Erwachsenen schließt das symptomatische Ansprechen auf die Therapie mit PREVACID 15 mg oder PREVACID SoluTab das Vorliegen einer malignen Erkrankung des Magens nicht aus. Erwägen Sie zusätzliche Nachsorge und diagnostische Tests bei erwachsenen Patienten, die nach Abschluss der Behandlung mit einem PPI ein suboptimales Ansprechen oder einen frühen symptomatischen Rückfall zeigen. Ziehen Sie bei älteren Patienten auch eine Endoskopie in Betracht.
Akute tubulointerstitielle Nephritis
Akute tubulointerstitielle Nephritis (TIN) wurde bei Patienten beobachtet, die PPIs einnahmen, und kann zu jedem Zeitpunkt während der PPI-Therapie auftreten. Die Patienten können unterschiedliche Anzeichen und Symptome aufweisen, von symptomatischen Überempfindlichkeitsreaktionen bis hin zu unspezifischen Symptomen einer verminderten Nierenfunktion (z. B. Unwohlsein, Übelkeit, Anorexie). In gemeldeten Fallserien wurden einige Patienten bei der Biopsie und ohne extrarenale Manifestationen (z. B. Fieber, Hautausschlag oder Arthralgie) diagnostiziert. Setzen Sie PREVACID oder PREVACID 15 mg SoluTab ab und untersuchen Sie Patienten mit Verdacht auf akute TIN [siehe KONTRAINDIKATIONEN ].
Clostridium difficile-assoziierter Durchfall
Veröffentlichte Beobachtungsstudien deuten darauf hin, dass PPI-Therapien wie PREVACID 30 mg und PREVACID 30 mg SoluTab mit einem erhöhten Risiko für Clostridium difficile-assoziierte Diarrhoe (CDAD) verbunden sein können, insbesondere bei Krankenhauspatienten. Diese Diagnose sollte bei Durchfall in Betracht gezogen werden, der sich nicht bessert [siehe NEBENWIRKUNGEN ].
Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist.
CDAD wurde bei der Anwendung von fast allen antibakteriellen Mitteln berichtet. Weitere Informationen speziell zu antibakteriellen Wirkstoffen (Clarithromycin und Amoxicillin), die zur Verwendung in Kombination mit PREVACID 15 mg oder PREVACID 15 mg SoluTab indiziert sind, finden Sie im Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ der jeweiligen Verschreibungsinformationen.
Knochenbruch
Mehrere veröffentlichte Beobachtungsstudien deuten darauf hin, dass die PPI-Therapie mit einem erhöhten Risiko für osteoporosebedingte Frakturen der Hüfte, des Handgelenks oder der Wirbelsäule verbunden sein kann. Das Frakturrisiko war bei Patienten erhöht, die eine hohe Dosis, definiert als mehrere Tagesdosen, und eine PPI-Langzeittherapie (ein Jahr oder länger) erhielten. Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist. Patienten mit einem Risiko für osteoporosebedingte Frakturen sollten gemäß etablierten Behandlungsrichtlinien behandelt werden [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN ].
Schwere kutane Nebenwirkungen
Schwere kutane Nebenwirkungen, einschließlich Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN), Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose (AGEP) wurden im Zusammenhang mit der Anwendung von PPI berichtet [sehen NEBENWIRKUNGEN ]. Setzen Sie PREVACID 30 mg oder PREVACID SoluTab bei den ersten Anzeichen oder Symptomen schwerer kutaner Nebenwirkungen oder anderer Anzeichen einer Überempfindlichkeit ab und erwägen Sie eine weitere Bewertung.
Kutaner und systemischer Lupus erythematodes
Kutaner Lupus erythematodes (CLE) und systemischer Lupus erythematodes (SLE) wurden bei Patienten berichtet, die PPI, einschließlich Lansoprazol, einnahmen. Diese Ereignisse traten sowohl als Neubeginn als auch als Exazerbation einer bestehenden Autoimmunerkrankung auf. Die Mehrzahl der Fälle von PPI-induziertem Lupus erythematodes waren CLE.
Die häufigste Form von CLE, die bei mit PPI behandelten Patienten berichtet wurde, war subakuter CLE (SCLE) und trat innerhalb von Wochen bis Jahren nach kontinuierlicher medikamentöser Therapie bei Patienten auf, die von Säuglingen bis zu älteren Menschen reichten. Im Allgemeinen wurden histologische Befunde ohne Organbeteiligung beobachtet.
Systemischer Lupus erythematodes (SLE) wird seltener als CLE bei Patienten berichtet, die PPI erhalten. PPI-assoziierter SLE verläuft in der Regel milder als nicht medikamentös induzierter SLE. Der Beginn des SLE trat typischerweise innerhalb von Tagen bis Jahren nach Beginn der Behandlung auf, hauptsächlich bei Patienten, die von jungen Erwachsenen bis zu älteren Menschen reichten. Die Mehrheit der Patienten stellte sich mit Hautausschlag vor; jedoch wurden auch Arthralgie und Zytopenie berichtet.
Vermeiden Sie die Verabreichung von PPI länger als medizinisch angezeigt. Wenn bei Patienten, die PREVACID 15 mg oder PREVACID SoluTab erhalten, Anzeichen oder Symptome festgestellt werden, die mit CLE oder SLE übereinstimmen, ist das Medikament abzusetzen und der Patient zur Untersuchung an den entsprechenden Facharzt zu überweisen. Bei den meisten Patienten bessert sich der Zustand nach Absetzen des PPI allein in vier bis 12 Wochen. Serologische Tests (z. B. ANA) können positiv sein und es kann länger dauern, bis sich erhöhte serologische Testergebnisse auflösen als klinische Manifestationen.
Cyanocobalamin (Vitamin B12)-Mangel
Die tägliche Behandlung mit säureunterdrückenden Medikamenten über einen längeren Zeitraum (z. B. länger als drei Jahre) kann zu einer durch Hypo- oder Achlorhydrie verursachten Malabsorption von Cyanocobalamin (Vitamin B12) führen. In der Literatur wurde in seltenen Fällen über einen Cyanocobalamin-Mangel berichtet, der bei einer säureunterdrückenden Therapie auftrat. Diese Diagnose sollte erwogen werden, wenn bei Patienten, die mit PREVACID oder PREVACID SoluTab behandelt werden, klinische Symptome beobachtet werden, die mit einem Cyanocobalamin-Mangel einhergehen.
Hypomagnesiämie und Mineralstoffwechsel
Hypomagnesiämie, symptomatisch und asymptomatisch, wurde selten bei Patienten berichtet, die mindestens drei Monate lang mit PPI behandelt wurden, in den meisten Fällen nach einem Jahr Therapie. Schwerwiegende Nebenwirkungen sind Tetanie, Arrhythmien und Krampfanfälle. Hypomagnesiämie kann zu Hypokalzämie und/oder Hypokaliämie führen und bei Risikopatienten eine zugrunde liegende Hypokalzämie verschlimmern. Bei den meisten Patienten erforderte die Behandlung der Hypomagnesiämie eine Magnesiumsubstitution und das Absetzen des PPI.
Bei Patienten, die voraussichtlich über einen längeren Zeitraum behandelt werden oder die PPI zusammen mit Medikamenten wie Digoxin oder Arzneimitteln einnehmen, die eine Hypomagnesiämie verursachen können (z. B. Diuretika), kann medizinisches Fachpersonal erwägen, den Magnesiumspiegel vor Beginn der PPI-Behandlung und regelmäßig zu überwachen [siehe NEBENWIRKUNGEN ].
Erwägen Sie die Überwachung der Magnesium- und Calciumspiegel vor Beginn der Behandlung mit PREVACID 30 mg oder PREVACID SoluTab und regelmäßig während der Behandlung bei Patienten mit einem vorbestehenden Risiko einer Hypokalzämie (z. B. Hypoparathyreoidismus). Bei Bedarf mit Magnesium und/oder Calcium ergänzen. Wenn die Hypokalzämie behandlungsresistent ist, sollten Sie erwägen, den PPI abzusetzen.
Wechselwirkungen mit Untersuchungen zu neuroendokrinen Tumoren
Die Spiegel von Chromogranin A (CgA) im Serum steigen sekundär zu einer arzneimittelinduzierten Abnahme der Magensäure. Der erhöhte CgA-Spiegel kann bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen. Gesundheitsdienstleister sollten die Behandlung mit Lansoprazol mindestens 14 Tage vor der Bestimmung der CgA-Spiegel vorübergehend beenden und eine Wiederholung des Tests in Betracht ziehen, wenn die anfänglichen CgA-Spiegel hoch sind. Wenn Reihentests durchgeführt werden (z. B. zur Überwachung), sollte dasselbe kommerzielle Labor für die Tests verwendet werden, da die Referenzbereiche zwischen den Tests variieren können [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Wechselwirkung mit Methotrexat
Die Literatur legt nahe, dass die gleichzeitige Anwendung von PPI mit Methotrexat (hauptsächlich in hoher Dosis) die Serumspiegel von Methotrexat und/oder seines Metaboliten erhöhen und verlängern kann, was möglicherweise zu Methotrexat-Toxizitäten führt. Bei hochdosierter Gabe von Methotrexat kann bei einigen Patienten ein vorübergehendes Absetzen des PPI in Betracht gezogen werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Patienten mit Phenylketonurie
Phenylalanin kann für Patienten mit Phenylketonurie (PKU) schädlich sein. PREVACID 30 mg SoluTab enthält Phenylalanin, einen Bestandteil von Aspartam. Jede 15-mg-Tablette enthält 2,5 mg und jede 30-mg-Tablette enthält 5,1 mg Phenylalanin. Bevor Sie einem Patienten mit PKU PREVACID SoluTab verschreiben, berücksichtigen Sie die kombinierte tägliche Menge an Phenylalanin aus allen Quellen, einschließlich PREVACID 30 mg SoluTab.
Fundusdrüsenpolypen
Die Anwendung von PPI ist mit einem erhöhten Risiko für Fundusdrüsenpolypen verbunden, das bei Langzeitanwendung zunimmt, insbesondere über ein Jahr hinaus. Die meisten PPI-Anwender, die Fundusdrüsenpolypen entwickelten, waren asymptomatisch und Fundusdrüsenpolypen wurden zufällig bei der Endoskopie identifiziert. Verwenden Sie die kürzeste Dauer der PPI-Therapie, die für die zu behandelnde Erkrankung geeignet ist.
Risiko einer Herzklappenverdickung bei pädiatrischen Patienten unter einem Jahr
PREVACID 30 mg und PREVACID SoluTab sind für pädiatrische Patienten unter einem Jahr nicht zugelassen. Präklinische Studien mit Lansoprazol an juvenilen Ratten haben eine nachteilige Wirkung einer Herzklappenverdickung gezeigt. Das Risiko einer Herzklappenverletzung scheint für Patienten ab einem Alter von einem Jahr nicht relevant zu sein [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente und Gebrauchsanweisung ).
Empfehlen Sie den Patienten:
Akute tubulointerstitielle Nephritis
Ihren Arzt anzurufen, wenn bei Ihnen Anzeichen und/oder Symptome einer akuten tubulointerstitiellen Nephritis auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Clostridium difficile-assoziierter Durchfall
Sofort ihren Arzt anzurufen, wenn Durchfall auftritt, der sich nicht bessert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Knochenbruch
Alle Frakturen, insbesondere der Hüfte, des Handgelenks oder der Wirbelsäule, ihrem medizinischen Betreuer zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwere kutane Nebenwirkungen
PREVACID oder PREVACID 30 mg SoluTab abzusetzen und unverzüglich ihren Arzt zur weiteren Beurteilung anzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kutaner und systemischer Lupus erythematodes
Bei neuen oder sich verschlechternden Symptomen im Zusammenhang mit kutanem oder systemischem Lupus erythematodes unverzüglich ihren Arzt anzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Cyanocobalamin (Vitamin B12)-Mangel
 Dem medizinischen Betreuer alle klinischen Symptome zu melden, die mit einem Cyanocobalamin-Mangel in Zusammenhang stehen könnten, wenn sie PREVACID oder PREVACID SoluTab länger als drei Jahre erhalten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypomagnesiämie und Mineral
Metabolismus Das Melden jeglicher klinischer Symptome, die möglicherweise mit Hypomagnesiämie, Hypokalzämie und/oder Hypokaliämie verbunden sind, an ihren medizinischen Betreuer, wenn sie PREVACID oder PREVACID 15 mg SoluTab für mindestens drei Monate erhalten haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wechselwirkungen mit anderen Medikamenten
Raten Sie den Patienten, sich bei ihrem Arzt zu melden, wenn sie Rilpivirin-haltige Produkte einnehmen [siehe KONTRAINDIKATIONEN ] oder hochdosiertes Methotrexat [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwangerschaft
Informieren Sie eine schwangere Frau über das potenzielle Risiko für einen Fötus. Weisen Sie gebärfähige Frauen an, ihren Arzt über eine bekannte oder vermutete Schwangerschaft zu informieren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Verwaltung
PREVACID-Kapseln
PREVACID SoluTab
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In zwei 24-monatigen Kanzerogenitätsstudien wurden Sprague-Dawley-Ratten mit oralen Lansoprazol-Dosen von 5 bis 150 mg/kg/Tag behandelt, was etwa dem 1- bis 40-fachen der Exposition auf einer Körperoberfläche (mg/m²) einer 50 kg schweren Person entspricht von durchschnittlicher Größe [1,46 m² Körperoberfläche (KOF)] bei der für den Menschen empfohlenen Dosis von 30 mg/Tag. Lansoprazol führte sowohl bei männlichen als auch bei weiblichen Ratten zu einer dosisabhängigen Magen-Enterochromaffin-ähnlichen (ECL)-Zellhyperplasie und ECL-Zell-Karzinoiden. Es erhöhte auch die Inzidenz von intestinaler Metaplasie des Magenepithels bei beiden Geschlechtern. Bei männlichen Ratten führte Lansoprazol zu einer dosisabhängigen Zunahme von Adenomen testikulärer interstitieller Zellen. Die Inzidenz dieser Adenome bei Ratten, die Dosen von 15 bis 150 mg/kg/Tag (das Vier- bis 40-fache der empfohlenen Humandosis, basierend auf BSA) erhielten, überstieg die niedrige Hintergrundinzidenz (Bereich = 1,4 bis 10 %) für diesen Rattenstamm.
In einer 24-monatigen Karzinogenitätsstudie wurden CD-1-Mäuse mit oralen Lansoprazol-Dosen von 15 bis 600 mg/kg/Tag behandelt, was dem Zwei- bis 80-Fachen der empfohlenen Humandosis, basierend auf KOF, entspricht. Lansoprazol führte zu einer dosisabhängig erhöhten Inzidenz von Magen-ECL-Zell-Hyperplasie. Es führte auch zu einer erhöhten Inzidenz von Lebertumoren (hepatozelluläres Adenom plus Karzinom). Die Tumorinzidenzen bei männlichen Mäusen, die mit 300 und 600 mg/kg/Tag (dem 40- bis 80-Fachen der empfohlenen Humandosis basierend auf BSA) behandelt wurden, und bei weiblichen Mäusen, die mit 150 bis 600 mg/kg/Tag (dem 20- bis 80-Fachen der empfohlenen Humandosis) behandelt wurden Dosis basierend auf BSA) überschritten die Bereiche der Hintergrundinzidenzen in historischen Kontrollen für diesen Mäusestamm. Die Behandlung mit Lansoprazol führte bei männlichen Mäusen, die 75 bis 600 mg/kg/Tag (das 10- bis 80-fache der empfohlenen Humandosis, basierend auf BSA) erhielten, zu Adenomen des Rete testis.
Eine 26-wöchige Karzinogenitätsstudie mit p53 (+/-) transgenen Mäusen war nicht positiv.
Lansoprazol war im Ames-Test und im In-vitro-Chromosomenaberrationstest mit humanen Lymphozyten positiv. Lansoprazol war im Ex-vivo-Ratten-Hepatozyten-Unscheduled-DNA-Synthesetest (UDS), im In-vivo-Maus-Mikrokerntest oder im Ratten-Knochenmarkzellen-Chromosomenaberrationstest nicht genotoxisch.
Es wurde festgestellt, dass Lansoprazol in oralen Dosen von bis zu 150 mg/kg/Tag (das 40-Fache der empfohlenen Humandosis basierend auf KOF) keine Auswirkungen auf die Fertilität und Reproduktionsleistung von männlichen und weiblichen Ratten hat.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die verfügbaren Daten aus veröffentlichten Beobachtungsstudien weisen insgesamt nicht auf einen Zusammenhang zwischen unerwünschten Schwangerschaftsausgängen und der Behandlung mit Lansoprazol hin (siehe Daten ).
In Reproduktionsstudien an Tieren führte die orale Verabreichung von Lansoprazol an Ratten während der Organogenese durch die Laktation in Höhe des 6,4-Fachen der maximal empfohlenen Humandosis zu einer Verringerung des Femurgewichts, der Femurlänge, der Scheitel-Steiß-Länge und der Dicke der Wachstumsfuge (nur bei Männchen) am Tag nach der Geburt bei den Nachkommen 21 (vgl Daten ). Diese Wirkungen waren mit einer Verringerung der Körpergewichtszunahme verbunden. Informieren Sie schwangere Frauen über das potenzielle Risiko für den Fötus.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebenen Populationen ist nicht bekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere nachteilige Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Wenn PREVACID 15 mg oder PREVACID 15 mg SoluTab zusammen mit Clarithromycin verabreicht werden, gelten die Schwangerschaftsinformationen für Clarithromycin auch für das Kombinationsschema. Weitere Informationen zur Anwendung in der Schwangerschaft finden Sie in den Verschreibungsinformationen von Clarithromycin.
Daten
Menschliche Daten
Verfügbare Daten aus veröffentlichten Beobachtungsstudien konnten keinen Zusammenhang zwischen schwangerschaftsbedingten Nebenwirkungen und der Anwendung von Lansoprazol nachweisen. Methodische Limitationen dieser Beobachtungsstudien können ein arzneimittelassoziiertes Risiko während der Schwangerschaft nicht definitiv feststellen oder ausschließen. In einer prospektiven Studie des European Network of Teratology Information Services wurden die Ergebnisse einer Gruppe von 62 schwangeren Frauen, denen Lansoprazol in einer mittleren Tagesdosis von 30 mg verabreicht wurde, mit einer Kontrollgruppe von 868 schwangeren Frauen verglichen, die keine PPI einnahmen. Es gab keinen Unterschied in der Rate schwerer Missbildungen zwischen Frauen, die PPIs ausgesetzt waren, und der Kontrollgruppe, was einem relativen Risiko (RR) = 1,04 entspricht [95 % Konfidenzintervall (KI) 0,25–4,21]. In einer bevölkerungsbezogenen retrospektiven Kohortenstudie, die alle Lebendgeburten in Dänemark von 1996 bis 2008 umfasste, gab es während der Analyse der Lansoprazol-Exposition im ersten Trimenon bei 794 Lebendgeburten keinen signifikanten Anstieg schwerer Geburtsfehler. Eine Metaanalyse, die 1.530 schwangere Frauen, die mindestens im ersten Trimenon PPI ausgesetzt waren, mit 133.410 nicht exponierten schwangeren Frauen verglich, zeigte keine signifikante Erhöhung des Risikos für angeborene Fehlbildungen oder spontane Fehlgeburten bei Exposition gegenüber PPI (für schwere Fehlbildungen Odds Ratio (OR) = 1,12 , [95 % CI 0,86-1,45] und für Spontanaborte OR=1,29, [95 % CI 0,841,97]).
Tierdaten
In Studien mit oralen Lansoprazol-Dosen von bis zu 150 mg/kg/Tag (das 40-Fache der empfohlenen Humandosis [30 mg/Tag] basierend auf der Körperoberfläche), die während der Organogenese und verabreicht wurden, traten keine Nebenwirkungen auf die embryofetale Entwicklung auf trächtigen Kaninchen in oralen Lansoprazol-Dosen von bis zu 30 mg/kg/Tag (das 16-Fache der empfohlenen Humandosis basierend auf der Körperoberfläche) verabreicht während der Organogenese.
Eine prä- und postnatale Entwicklungstoxizitätsstudie an Ratten mit zusätzlichen Endpunkten zur Beurteilung der Knochenentwicklung wurde mit Lansoprazol in oralen Dosen von 10 bis 100 mg/kg/Tag (dem 0,7- bis 6,4-Fachen der maximal empfohlenen humanen Lansoprazol-Dosis von 30 mg, basierend auf der AUC) durchgeführt [Fläche unter der Plasmakonzentrations-Zeit-Kurve]), verabreicht während der Organogenese bis zur Laktation. Bei 100 mg/kg/Tag (dem 6,4-fachen der maximal empfohlenen humanen Lansoprazol-Dosis von 30 mg, basierend auf der AUC) beobachtete maternale Effekte schlossen eine verlängerte Tragzeit, eine verringerte Körpergewichtszunahme während der Trächtigkeit und eine verringerte Nahrungsaufnahme ein. Die Zahl der Totgeburten war bei dieser Dosis erhöht, was möglicherweise sekundär zur maternalen Toxizität war. Das Körpergewicht der Jungtiere wurde ab dem 11. postnatalen Tag um 100 mg/kg/Tag reduziert. Das Femurgewicht, die Femurlänge und die Scheitel-Steiß-Länge wurden am 21. postnatalen Tag um 100 mg/kg/Tag reduziert. Das Femurgewicht war weiterhin verringert die Gruppe mit 100 mg/kg/Tag im Alter von 17 bis 18 Wochen. Die Dicke der Wachstumsfuge war bei den 100 mg/kg/Tag-Männchen am postnatalen Tag 21 verringert und bei den 30 und 100 mg/kg/Tag-Männchen im Alter von 17 bis 18 Wochen erhöht. Die Auswirkungen auf die Knochenparameter waren mit einer Verringerung der Körpergewichtszunahme verbunden.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von Lansoprazol in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Lansoprazol und seine Metaboliten sind jedoch in Rattenmilch vorhanden. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an PREVACID 30 mg oder PREVACID 30 mg SoluTab und allen möglichen Nebenwirkungen auf das gestillte Kind durch PREVACID 30 mg oder PREVACID SoluTab oder durch die zugrunde liegende Erkrankung der Mutter berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PREVACID 15 mg und PREVACID 30 mg SoluTab wurden bei pädiatrischen Patienten im Alter von einem Jahr bis 17 Jahren zur Kurzzeitbehandlung von symptomatischer GERD und erosiver Ösophagitis nachgewiesen.
In klinischen Studien zu symptomatischer GERD und erosiver Ösophagitis wurde PREVACID 30 mg Patienten im Alter von einem Jahr bis 11 Jahren nicht länger als 12 Wochen verabreicht. Es ist nicht bekannt, ob PREVACID 30 mg und PREVACID SoluTab sicher und wirksam sind, wenn sie länger als die empfohlene Dauer angewendet werden. Überschreiten Sie nicht die empfohlene Dosis und Anwendungsdauer bei pädiatrischen Patienten (siehe Toxizitätsdaten für Jungtiere ).
PREVACID war in einer multizentrischen, doppelblinden, placebokontrollierten Studie bei pädiatrischen Patienten mit symptomatischer GERD im Alter von einem Monat bis unter einem Jahr nicht wirksam. Daher wurden Sicherheit und Wirksamkeit bei Patienten unter einem Jahr nicht nachgewiesen. Präklinische Studien an juvenilen Ratten haben eine unerwünschte Wirkung einer Herzklappenverdickung und Knochenveränderungen bei Lansoprazol-Dosen gezeigt, die höher als die maximal empfohlene äquivalente Humandosis waren.
Neugeborene bis zu einem Alter von weniger als einem Jahr
Die Pharmakokinetik von Lansoprazol wurde bei pädiatrischen Patienten mit GERD im Alter von weniger als 28 Tagen und einem bis 11 Monaten untersucht. Im Vergleich zu gesunden Erwachsenen, die 30 mg erhielten, hatten Neugeborene eine höhere Exposition (durchschnittliche gewichtsbasierte normalisierte AUC-Werte 2,04- bzw. 1,88-fach höher bei Dosen von 0,5 bzw. 1 mg/kg/Tag). Kleinkinder im Alter von ≤ 10 Wochen hatten Clearance- und Expositionswerte, die denen von Neugeborenen ähnlich waren. Säuglinge im Alter von über 10 Wochen, die 1 mg/kg/Tag erhielten, hatten ähnliche mittlere AUC-Werte wie Erwachsene, die eine Dosis von 30 mg erhielten.
Lansoprazol erwies sich in einer vierwöchigen, multizentrischen, doppelblinden, placebokontrollierten Parallelgruppenstudie in den USA und Polen mit 162 Patienten im Alter zwischen einem Monat und unter 12 Monaten mit symptomatischer GERD basierend auf einer Anamnese als nicht wirksam von Weinen/Aufregung/Reizbarkeit im Zusammenhang mit der Nahrungsaufnahme, die sieben bis 14 Tage lang nicht auf eine konservative GERD-Behandlung (dh nichtpharmakologische Intervention) angesprochen hatten. Patienten erhalten
Lansoprazol als Suspension täglich (0,2 bis 0,3 mg/kg/Tag bei Säuglingen ≤ 10 Wochen oder 1,0 bis 1,5 mg/kg/Tag bei Säuglingen über 10 Wochen oder Placebo) für bis zu vier Wochen einer doppelblinden Behandlung.
Der primäre Wirksamkeitsendpunkt wurde anhand einer Reduktion von mehr als 50 % gegenüber dem Ausgangswert entweder beim Prozentsatz der Fütterungen mit einer Episode von Weinen/Unruhe/Reizbarkeit oder der Dauer (Minuten) einer Episode von Weinen/Unruhe/Reizbarkeit innerhalb einer Stunde nach der Fütterung bewertet.
Es gab keinen Unterschied im Prozentsatz der Responder zwischen der pädiatrischen Lansoprazol-Suspensionsgruppe und der Placebogruppe (54 % in beiden Gruppen).
In pädiatrischen klinischen Studien (im Alter von einem Monat bis unter 12 Monaten) wurden keine unerwünschten Ereignisse berichtet, die nicht zuvor bei Erwachsenen beobachtet wurden.
Basierend auf den Ergebnissen der Phase-3-Wirksamkeitsstudie hat sich Lansoprazol nicht als wirksam erwiesen. Daher unterstützen diese Ergebnisse nicht die Verwendung von Lansoprazol bei der Behandlung von symptomatischer GERD bei Säuglingen.
Ein Jahr bis 11 Jahre alt
In einer unkontrollierten, unverblindeten, multizentrischen Studie in den USA wurden 66 pädiatrische Patienten (im Alter von 1 Jahr bis 11 Jahren) mit GERD basierend auf dem Körpergewicht einer Anfangsdosis von entweder 15 mg PREVACID täglich bei ≤ 30 kg oder PREVACID 30 mg täglich bei mehr als 30 kg, verabreicht über 8 bis 12 Wochen. Die PREVACID-Dosis wurde bei 24 von 66 pädiatrischen Patienten nach zwei- oder mehrwöchiger Behandlung erhöht (auf bis zu 30 mg zweimal täglich), wenn sie weiterhin symptomatisch waren. Zu Studienbeginn hatten 85 % der Patienten insgesamt leichte bis mittelschwere GERD-Symptome (beurteilt durch ein Prüfarztgespräch), 58 % hatten eine nicht-erosive GERD und 42 % eine erosive Ösophagitis (beurteilt durch Endoskopie).
Nach acht- bis zwölfwöchiger Behandlung mit PREVACID 15 mg zeigte die Intent-to-treat-Analyse eine etwa 50 %ige Verringerung der Häufigkeit und Schwere der GERD-Symptome.
Einundzwanzig von 27 Patienten mit erosiver Ösophagitis waren nach acht Wochen geheilt und 100 % der Patienten waren nach 12 Wochen durch Endoskopie geheilt (Tabelle 4).
In einer Studie mit 66 pädiatrischen Patienten in der Altersgruppe von 1 Jahr bis 11 Jahren nach oraler Behandlung mit PREVACID 15 mg in Dosen von 15 mg täglich bis 30 mg zweimal täglich war der Anstieg der Gastrinspiegel im Serum ähnlich wie in Studien mit Erwachsenen beobachtet. Die mittleren Nüchterngastrinspiegel im Serum stiegen um 89 % von 51 pg/ml zu Studienbeginn auf 97 pg/ml [Interquartilsabstand (25. bis 75. Perzentil) von 71 bis 130 pg/ml] beim letzten Besuch.
Die pädiatrische Sicherheit von PREVACID 30 mg Kapseln wurde bei 66 pädiatrischen Patienten im Alter von 1 bis 11 Jahren untersucht. Von den 66 Patienten mit GERD nahmen 85 % (56/66) PREVACID 30 mg acht Wochen lang ein und 15 % (10/66) nahmen es zwölf Wochen lang ein.
Die am häufigsten berichteten (bei zwei oder mehr Patienten) behandlungsbedingten Nebenwirkungen bei Patienten im Alter von 1 bis 11 Jahren (N = 66) waren Verstopfung (5 %) und Kopfschmerzen (3 %).
Zwölf bis 17 Jahre alt
In einer unkontrollierten, offenen, multizentrischen US-Studie wurden 87 jugendliche Patienten (12 bis 17 Jahre) mit symptomatischer GERD acht bis zwölf Wochen lang mit PREVACID behandelt. Obere Endoskopien zu Studienbeginn klassifizierten diese Patienten in zwei Gruppen: 64 (74 %) mit nicht-erosiver GERD und 23 (26 %) mit erosiver Ösophagitis (EE). Die nicht-erosiven GERD-Patienten erhielten 8 Wochen lang täglich 15 mg PREVACID und die EE-Patienten 8 bis 12 Wochen lang täglich 30 mg PREVACID. Zu Studienbeginn hatten 89 % dieser Patienten insgesamt leichte bis mittelschwere GERD-Symptome (beurteilt durch Untersuchungsgespräche). Während der achtwöchigen Behandlung mit PREVACID 15 mg erlebten jugendliche Patienten basierend auf Tagebuchergebnissen eine Verringerung der Häufigkeit um 63 % und eine Verringerung der Schwere der GERD-Symptome um 69 %.
Einundzwanzig von 22 (95,5 %) jugendlichen Patienten mit erosiver Ösophagitis wurden nach achtwöchiger Behandlung mit PREVACID 15 mg geheilt. Ein Patient blieb nach 12-wöchiger Behandlung ungeheilt (Tabelle 5).
Bei diesen 87 jugendlichen Patienten waren die Anstiege der Gastrinspiegel im Serum ähnlich denen, die in Studien mit Erwachsenen beobachtet wurden, die medianen Serumgastrinspiegel im Nüchternzustand stiegen um 42 % von 45 pg/ml zu Studienbeginn auf 64 pg/ml [Interquartilbereich (25. bis 75. Perzentil) von 44 bis 88 pg/ml] beim letzten Besuch. (Normale Gastrinspiegel im Serum sind 25 bis 111 pg/ml.)
Die Sicherheit von PREVACID-Kapseln wurde bei diesen 87 jugendlichen Patienten untersucht. Von den 87 jugendlichen Patienten mit GERD nahmen 6 % (5/87) PREVACID 15 mg weniger als sechs Wochen, 93 % (81/87) sechs bis zehn Wochen und 1 % (1/87) länger als zehn Wochen ein .
Die am häufigsten berichteten (mindestens 3 %) behandlungsbedingten Nebenwirkungen bei diesen Patienten waren Kopfschmerzen (7 %), Bauchschmerzen (5 %), Übelkeit (3 %) und Schwindel (3 %). Behandlungsbedingter Schwindel, von dem in dieser Verschreibungsinformation berichtet wird, dass er bei weniger als 1 % der erwachsenen Patienten auftrat, wurde in dieser Studie von drei jugendlichen Patienten mit nicht-erosiver GERD berichtet, die Schwindel gleichzeitig mit anderen Reaktionen (wie Migräne, Dyspnoe, und Erbrechen).
Toxizitätsdaten für Jungtiere
Herzklappenverdickung
In zwei oralen Toxizitätsstudien trat bei jungen Ratten, die mit Lansoprazol behandelt wurden, eine Verdickung der Mitralherzklappe auf. Eine Herzklappenverdickung wurde hauptsächlich bei oraler Gabe beobachtet, die an Tag 7 nach der Geburt (Alter entspricht dem Neugeborenen) und Tag 14 nach der Geburt (Alter entspricht dem Menschen ungefähr einem Jahr) bei Dosen von 250 mg/kg/Tag und höher (am Tag 7 der Geburt) begann und postnatal Tag 14, jeweils das 6,2-fache bzw. das 4,2-fache der pädiatrischen Tagesdosis von 15 mg bei pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit einem Körpergewicht von 30 kg oder weniger, basierend auf der AUC). Die mit der Herzklappenverdickung verbundene Behandlungsdauer reichte von 5 Tagen bis 8 Wochen. Die Befunde kehrten sich nach einer 4-wöchigen arzneimittelfreien Erholungsphase um oder tendierten in Richtung Reversibilität. Die Inzidenz von Herzklappenverdickung nach Beginn der Dosierung am postnatalen Tag 21 (entspricht dem menschlichen Alter von etwa zwei Jahren) war auf eine einzige Ratte (1/24) in Gruppen beschränkt, denen 500 mg/kg/Tag für 4 oder 8 Wochen (ca 5,2-fache der pädiatrischen Tagesdosis von 15 mg bei pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit einem Körpergewicht von 30 kg oder weniger, basierend auf der AUC). Basierend auf den Expositionsgrenzen scheint das Risiko einer Herzklappenverletzung für Patienten ab einem Alter von einem Jahr nicht relevant zu sein.
Knochenveränderungen
In einer achtwöchigen oralen Toxizitätsstudie an juvenilen Ratten, bei der die Dosierung am 7. Tag nach der Geburt begonnen wurde, wurden Dosen von mindestens 100 mg/kg/Tag (das 2,5-fache der pädiatrischen Tagesdosis von 15 mg bei Kindern im Alter von 1 bis 11 Jahren mit einem Körpergewicht von 30 Jahren) verabreicht kg oder weniger, basierend auf der AUC) führte zu einem verzögerten Wachstum, wobei eine Beeinträchtigung der Gewichtszunahme bereits am 10. Tag nach der Geburt beobachtet wurde (das Alter entspricht dem eines Neugeborenen). Am Ende der Behandlung umfassten die Anzeichen für ein beeinträchtigtes Wachstum bei 100 mg/kg/Tag und höher eine Verringerung des Körpergewichts (14 bis 44 % im Vergleich zu den Kontrollen), des absoluten Gewichts mehrerer Organe, des Femurgewichts, der Femurlänge und des Scheitels. Rumpflänge. Die Dicke der femoralen Wachstumsfuge war nur bei Männern und nur bei einer Dosis von 500 mg/kg/Tag reduziert. Die Auswirkungen im Zusammenhang mit verzögertem Wachstum hielten bis zum Ende der vierwöchigen Erholungsphase an. Längerfristige Daten wurden nicht erhoben.
Geriatrische Verwendung
Von der Gesamtzahl der Patienten (n = 21.486) in klinischen Studien mit PREVACID waren 16 % der Patienten 65 Jahre und älter, während 4 % 75 Jahre und älter waren. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine signifikanten Unterschiede im Ansprechen zwischen geriatrischen und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden [siehe KLINISCHE PHARMAKOLOGIE ].

Leberfunktionsstörung
Bei Patienten mit unterschiedlich stark ausgeprägter chronischer Leberfunktionsstörung war die Lansoprazol-Exposition im Vergleich zu gesunden Probanden mit normaler Leberfunktion erhöht [vgl KLINISCHE PHARMAKOLOGIE ]. Bei Patienten mit leichter (Child-Pugh-Klasse A) oder mäßiger (Child-Pugh-Klasse B) Leberfunktionsstörung ist keine Dosisanpassung für PREVACID oder PREVACID SoluTab erforderlich. Die empfohlene Dosierung beträgt 15 mg täglich oral bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) [siehe DOSIERUNG UND ANWENDUNG ].
ÜBERDOSIS
Lansoprazol wird nicht durch Hämodialyse aus dem Kreislauf entfernt. Bei einer gemeldeten Überdosierung nahm ein Patient 600 mg PREVACID 15 mg ohne Nebenwirkungen ein. Orale Lansoprazol-Dosen von bis zu 5000 mg/kg bei Ratten [ungefähr das 1300-fache der 30-mg-Menschdosis basierend auf der Körperoberfläche (KOF)] und bei Mäusen (etwa das 675,7-fache der 30-mg-Menschdosis basierend auf der KOF) führten nicht zu Todesfällen oder irgendwelche klinischen Anzeichen.
Im Falle einer Überexposition sollte die Behandlung symptomatisch und unterstützend sein.
Wenn es zu einer Überexposition kommt, rufen Sie Ihre Giftnotrufzentrale unter 1-800-222-1222 an, um aktuelle Informationen zum Umgang mit Vergiftungen oder Überexposition zu erhalten.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Lansoprazol gehört zu einer Klasse antisekretorischer Verbindungen, den substituierten Benzimidazolen, die die Magensäuresekretion durch spezifische Hemmung des (H+, K+)-ATPase-Enzymsystems an der sekretorischen Oberfläche der Belegzellen des Magens unterdrücken. Da dieses Enzymsystem als Säure-(Protonen-)Pumpe innerhalb der Belegzellen angesehen wird, wurde Lansoprazol als Magensäurepumpenhemmer charakterisiert, indem es den letzten Schritt der Säureproduktion blockiert. Dieser Effekt ist dosisabhängig und führt unabhängig vom Stimulus zu einer Hemmung sowohl der basalen als auch der stimulierten Magensäuresekretion. Lansoprazol zeigt keine anticholinerge oder Histamin-Typ-2-antagonistische Aktivität.
Pharmakodynamik
Antisekretorische Aktivität
Nach oraler Verabreichung wurde gezeigt, dass Lansoprazol die basale Säureabgabe signifikant senkt und den mittleren Magen-pH signifikant erhöht und den Prozentsatz der Zeit, in der der Magen-pH größer als drei und größer als vier war. Lansoprazol reduzierte auch signifikant die durch Mahlzeiten stimulierte Magensäureproduktion und das Sekretionsvolumen sowie die durch Pentagastrin stimulierte Säureproduktion. Bei Patienten mit Hypersekretion von Säure reduzierte Lansoprazol signifikant die basale und Pentagastrin-stimulierte Magensäuresekretion. Lansoprazol hemmte die durch Insulin induzierte normale Erhöhung des Sekretionsvolumens, des Säuregehalts und der Säureabgabe.
Die intragastrischen pH-Ergebnisse einer fünftägigen, pharmakodynamischen Crossover-Studie mit einmal täglich 15 und 30 mg Lansoprazol sind in Tabelle 6 dargestellt:
Nach der Anfangsdosis in dieser Studie wurde innerhalb von ein bis zwei Stunden mit 30 mg Lansoprazol und zwei bis drei Stunden mit 15 mg Lansoprazol ein erhöhter Magen-pH-Wert beobachtet. Nach mehrfacher täglicher Einnahme wurde innerhalb der ersten Stunde nach Einnahme von 30 mg Lansoprazol und innerhalb von ein bis zwei Stunden nach Einnahme von 15 mg Lansoprazol ein erhöhter Magen-pH-Wert beobachtet.
Säureunterdrückung kann die Wirkung von antimikrobiellen Mitteln bei der Eradikation von Helicobacter pylori (H. pylori) verstärken. Der Prozentsatz der Zeit, in der der pH-Wert des Magens über fünf und sechs erhöht war, wurde in einer Crossover-Studie mit PREVACID bei täglicher, zweimal täglicher und dreimal täglicher Verabreichung bewertet (Tabelle 7).
Die Hemmung der Magensäuresekretion, gemessen anhand des intragastrischen pH-Werts, normalisierte sich allmählich über zwei bis vier Tage nach mehreren Dosen. Es gab keinen Hinweis auf Rebound-Magensäure.
Enterochromaffin-ähnliche (ECL) Zelleffekte
Während der lebenslangen Exposition von Ratten mit bis zu 150 mg/kg/Tag Lansoprazol an sieben Tagen pro Woche wurde eine ausgeprägte Hypergastrinämie beobachtet, gefolgt von einer ECL-Zellproliferation und der Bildung von karzinoiden Tumoren, insbesondere bei weiblichen Ratten. Magenbiopsieproben aus dem Körper des Magens von etwa 150 Patienten, die mindestens ein Jahr lang kontinuierlich mit Lansoprazol behandelt wurden, zeigten keine Anzeichen von ECL-Zell-Wirkungen ähnlich denen, die in Studien an Ratten beobachtet wurden. Langzeitdaten sind erforderlich, um die Möglichkeit eines erhöhten Risikos für die Entwicklung von Magentumoren bei Patienten auszuschließen, die eine Langzeittherapie mit Lansoprazol erhalten [siehe Nichtklinische Toxikologie ].
Andere Magenwirkungen beim Menschen
Lansoprazol hatte keinen signifikanten Einfluss auf die Durchblutung der Schleimhaut im Fundus des Magens. Aufgrund der normalen physiologischen Wirkung, die durch die Hemmung der Magensäuresekretion verursacht wird, wurde eine Abnahme des Blutflusses in Antrum, Pylorus und Bulbus duodeni um etwa 17 % beobachtet. Lansoprazol verlangsamte signifikant die Magenentleerung von verdaulichen Feststoffen. Lansoprazol erhöhte die Pepsinogenspiegel im Serum und verringerte die Pepsinaktivität unter Grundbedingungen und als Reaktion auf eine Mahlzeitstimulation oder Insulininjektion. Wie bei anderen Mitteln, die den intragastrischen pH-Wert erhöhen, war bei Patienten mit Magengeschwür ein Anstieg des pH-Werts im Magen mit einem Anstieg nitratreduzierender Bakterien und einem Anstieg der Nitritkonzentration im Magensaft verbunden. Es wurde kein signifikanter Anstieg der Nitrosaminkonzentrationen beobachtet.
Serum-Gastrin-Effekte
Bei über 2100 Patienten stiegen die mittleren Nüchterngastrinspiegel im Serum um 50 bis 100 % gegenüber dem Ausgangswert, blieben aber nach der Behandlung mit 15 bis 60 mg oralem Lansoprazol im Normbereich. Diese Erhöhungen erreichten innerhalb von zwei Monaten nach der Therapie ein Plateau und kehrten innerhalb von vier Wochen nach Absetzen der Therapie auf die Werte vor der Behandlung zurück.
Erhöhtes Gastrin verursacht eine Enterochromaffin-ähnliche Zellhyperplasie und erhöhte Serum-CgA-Spiegel. Die erhöhten CgA-Spiegel können bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Endokrine Wirkungen
Humanstudien von bis zu einem Jahr haben keine klinisch signifikanten Wirkungen auf das endokrine System festgestellt. Zu den untersuchten Hormonen gehören Testosteron, luteinisierendes Hormon (LH), follikelstimulierendes Hormon (FSH), Sexualhormon-bindendes Globulin (SHBG), Dehydroepiandrosteronsulfat (DHEA-S), Prolaktin, Cortisol, Estradiol, Insulin, Aldosteron, Parathormon, Glucagon, Schilddrüsen-stimulierend Hormon (TSH), Trijodthyronin (T3), Thyroxin (T4) und somatotropes Hormon (STH). Lansoprazol hatte in oralen Dosen von 15 bis 60 mg für bis zu einem Jahr keine klinisch signifikante Wirkung auf die Sexualfunktion. Darüber hinaus hatte Lansoprazol in oralen Dosen von 15 bis 60 mg über zwei bis acht Wochen keine klinisch signifikante Wirkung auf die Schilddrüsenfunktion. In 24-monatigen Kanzerogenitätsstudien an Sprague-Dawley-Ratten mit täglichen Lansoprazol-Dosen von bis zu 150 mg/kg waren proliferative Veränderungen in den Leydig-Zellen der Hoden, einschließlich gutartiger Neoplasien, im Vergleich zu Kontrollratten erhöht.
Andere Effekte
Beim Menschen wurden keine systemischen Wirkungen von Lansoprazol auf das zentrale Nervensystem, das lymphatische, hämatopoetische, renale, hepatische, kardiovaskuläre oder respiratorische System festgestellt. Bei 56 Patienten, bei denen zu Studienbeginn umfangreiche Augenuntersuchungen durchgeführt wurden, wurde nach einer Behandlung mit Lansoprazol (bis zu 180 mg/Tag) über einen Zeitraum von bis zu 58 Monaten keine visuelle Toxizität beobachtet. Nach lebenslanger Lansoprazol-Exposition bei Ratten wurden fokale Pankreas-Atrophie, diffuse lymphoide Hyperplasie im Thymus und spontane Netzhaut-Atrophie beobachtet.
Pharmakokinetik
Absorption
PREVACID 15 mg und PREVACID SoluTab enthalten eine magensaftresistente Granulatformulierung von Lansoprazol (da Lansoprazol säurelabil ist), sodass die Resorption von Lansoprazol erst beginnt, nachdem das Granulat den Magen verlassen hat. Die mittleren maximalen Plasmaspiegel von Lansoprazol treten nach etwa 1,7 Stunden auf. Nach Verabreichung einer Einzeldosis von 15 bis 60 mg Lansoprazol zum Einnehmen waren die maximalen Plasmakonzentrationen (Cmax) von Lansoprazol und die Fläche unter den Plasmakonzentrationskurven (AUCs) von Lansoprazol ungefähr proportional zur verabreichten Dosis. Lansoprazol akkumuliert nicht und seine Pharmakokinetik bleibt durch Mehrfachdosierung unverändert. Die absolute Bioverfügbarkeit liegt bei über 80 %. Bei gesunden Probanden betrug die mittlere (±SD) Plasmahalbwertszeit 1,5 (±1,0) Stunden. Sowohl die Cmax als auch die AUC werden um etwa 50 bis 70 % verringert, wenn Lansoprazol 30 Minuten nach dem Essen gegeben wird, verglichen mit dem nüchternen Zustand. Wenn Lansoprazol vor den Mahlzeiten eingenommen wird, gibt es keine signifikanten Auswirkungen auf die Nahrung.
Verteilung
Lansoprazol wird zu 97 % an Plasmaproteine gebunden. Die Plasmaproteinbindung ist über den Konzentrationsbereich von 0,05 bis 5 µg/ml konstant.
Beseitigung
Stoffwechsel
Lansoprazol wird weitgehend in der Leber metabolisiert. Zwei Metaboliten wurden in messbaren Mengen im Plasma identifiziert (die hydroxylierten Sulfinyl- und Sulfonderivate von Lansoprazol). Diese Metaboliten haben sehr geringe oder keine antisekretorische Aktivität. Es wird angenommen, dass Lansoprazol in zwei aktive Spezies umgewandelt wird, die die Säuresekretion hemmen, indem sie die Protonenpumpe [(H+, K+)-ATPase-Enzymsystem] an der sekretorischen Oberfläche der Belegzellen des Magens blockieren. Die beiden aktiven Spezies sind im systemischen Kreislauf nicht vorhanden. Die Plasmaeliminationshalbwertszeit von Lansoprazol beträgt weniger als zwei Stunden, während die säurehemmende Wirkung mehr als 24 Stunden anhält. Daher spiegelt die Plasmaeliminationshalbwertszeit von Lansoprazol nicht die Dauer der Unterdrückung der Magensäuresekretion wider.
Ausscheidung
Nach oraler Gabe einer Einzeldosis von PREVACID wurde praktisch kein unverändertes Lansoprazol im Urin ausgeschieden. In einer Studie wurde nach einer oralen Einzeldosis von 14Clansoprazol etwa ein Drittel der verabreichten Strahlung im Urin ausgeschieden und zwei Drittel im Stuhl wiedergefunden. Dies impliziert eine signifikante biliäre Ausscheidung der Lansoprazol-Metaboliten.
Spezifische Populationen
Pädiatrische Patienten
Ein bis 17 Jahre alt
Die Pharmakokinetik von Lansoprazol wurde bei pädiatrischen Patienten mit GERD im Alter von 1 bis 11 Jahren und 12 bis 17 Jahren in zwei getrennten klinischen Studien untersucht. Bei Kindern im Alter von 1 bis 11 Jahren wurde Lansoprazol täglich 15 mg bei Patienten mit einem Körpergewicht von ≤ 30 kg und 30 mg täglich bei Patienten mit einem Körpergewicht über 30 kg verabreicht. Die an Tag 5 der Dosierung beobachteten mittleren Cmax- und AUC-Werte waren zwischen den beiden Dosisgruppen ähnlich und wurden innerhalb der in der Studie verwendeten gewichtsangepassten Dosisgruppen nicht durch Gewicht oder Alter beeinflusst. Bei jugendlichen Probanden im Alter von 12 bis 17 Jahren erhielten die Probanden randomisiert 15 oder 30 mg Lansoprazol täglich. Die mittleren Cmax- und AUC-Werte von Lansoprazol wurden nicht durch Körpergewicht oder Alter beeinflusst; Zwischen den beiden Dosisgruppen in der Studie wurden nahezu dosisproportionale Anstiege der mittleren Cmax- und AUC-Werte beobachtet. Insgesamt war die Pharmakokinetik von Lansoprazol bei pädiatrischen Patienten im Alter von 1 bis 17 Jahren ähnlich wie bei gesunden erwachsenen Probanden.
Geriatrische Patienten
Die Clearance von Lansoprazol ist bei älteren Patienten verringert, wobei die Eliminationshalbwertszeit um etwa 50 bis 100 % verlängert ist. Da die mittlere Halbwertszeit bei älteren Patienten zwischen 1,9 und 2,9 Stunden liegt, führt eine wiederholte einmal tägliche Gabe nicht zu einer Akkumulation von Lansoprazol. Die maximalen Plasmaspiegel waren bei älteren Menschen nicht erhöht [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Männliche und weibliche Patienten
In einer Studie, in der 12 männliche und sechs weibliche Probanden, die Lansoprazol erhielten, verglichen wurden, wurden keine geschlechtsbezogenen Unterschiede in der Pharmakokinetik und den intragastrischen pH-Ergebnissen gefunden.
Rassen- oder ethnische Gruppen
Die gepoolten mittleren pharmakokinetischen Parameter von PREVACID aus zwölf US-amerikanischen Studien (N = 513) wurden mit den mittleren pharmakokinetischen Parametern aus zwei asiatischen Studien (N = 20) verglichen. Die mittleren AUCs von PREVACID 30 mg bei asiatischen Probanden waren etwa doppelt so hoch wie die gepoolten US-Daten; die interindividuelle Variabilität war jedoch hoch. Die Cmax-Werte waren vergleichbar.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit schwerer Nierenfunktionsstörung nahm die Plasmaproteinbindung nach Gabe von 60 mg Lansoprazol um 1 bis 1,5 % ab. Patienten mit eingeschränkter Nierenfunktion hatten eine verkürzte Eliminationshalbwertszeit und eine verringerte Gesamt-AUC (frei und gebunden). Die AUC für freies Lansoprazol im Plasma war jedoch nicht mit dem Grad der Nierenfunktionsstörung verbunden; und Cmax und Tmax (Zeit bis zum Erreichen der maximalen Konzentration) unterschieden sich nicht von Cmax und Tmax von Probanden mit normaler Nierenfunktion. Daher war die Pharmakokinetik von Lansoprazol bei Patienten mit leichter, mäßiger oder schwerer Nierenfunktionsstörung klinisch nicht anders als bei gesunden Probanden mit normaler Nierenfunktion.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter (Child-Pugh-Klasse A) oder mäßiger (Child-Pugh-Klasse B) Leberfunktionsstörung kam es nach mehrfacher oraler Gabe von 30 mg PREVACID 30 mg zu einem ungefähr 3-fachen Anstieg der mittleren AUC im Vergleich zu gesunden Probanden mit normaler Leberfunktion für sieben Tage. Die entsprechende mittlere Plasmahalbwertszeit von Lansoprazol wurde von 1,5 auf vier Stunden (Child-Pugh A) oder fünf Stunden (Child-Pugh B) verlängert.
Bei Patienten mit kompensierter und dekompensierter Zirrhose kam es im Vergleich zu gesunden Probanden mit normaler Leberfunktion nach einer oralen Einzeldosis von 30 mg PREVACID zu einem ungefähr 6- bzw. 5-fachen Anstieg der AUC [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Arzneimittelwechselwirkungsstudien
Wirkung von Lansoprazol auf andere Medikamente
Cytochrom P450-Wechselwirkungen
Lansoprazol wird über das Cytochrom-P450-System metabolisiert, insbesondere über die Isoenzyme CYP3A und CYP2C19. Studien haben gezeigt, dass PREVACID 15 mg bei gesunden Probanden keine klinisch signifikanten Wechselwirkungen mit anderen Arzneimitteln hat, die durch das Cytochrom-P450-System metabolisiert werden, wie Warfarin, Antipyrin, Indomethacin, Ibuprofen, Phenytoin, Propranolol, Prednison, Diazepam oder Clarithromycin. Diese Verbindungen werden durch verschiedene Cytochrom-P450-Isozyme, einschließlich CYP1A2, CYP2C9, CYP2C19, CYP2D6 und CYP3A, metabolisiert.
Theophyllin
Bei gleichzeitiger Gabe von PREVACID 30 mg und Theophyllin (CYP1A2, CYP3A) wurde eine geringfügige Erhöhung (10 %) der Clearance von Theophyllin beobachtet. Aufgrund des geringen Ausmaßes und der Richtung der Wirkung auf die Theophyllin-Clearance ist es unwahrscheinlich, dass diese Wechselwirkung von klinischer Bedeutung ist [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Methotrexat und 7-Hydroxymethotrexat
In einer offenen, einarmigen, achttägigen pharmakokinetischen Studie mit 28 erwachsenen Patienten mit rheumatoider Arthritis (die eine chronische Anwendung von 7,5 bis 15 mg Methotrexat in wöchentlicher Gabe benötigten) wurde Naproxen 500 mg zweimal täglich und PREVACID über sieben Tage verabreicht 30 mg täglich hatten keine Auswirkung auf die Pharmakokinetik von Methotrexat und 7-Hydroxymethotrexat. Obwohl diese Studie nicht darauf ausgelegt war, die Sicherheit dieser Arzneimittelkombination zu beurteilen, wurden keine schwerwiegenden Nebenwirkungen festgestellt. Diese Studie wurde jedoch mit niedrigen Methotrexat-Dosen durchgeführt. Eine Wechselwirkungsstudie mit hohen Methotrexat-Dosen wurde nicht durchgeführt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Amoxicillin
Es wurde auch gezeigt, dass PREVACID 30 mg keine klinisch signifikante Wechselwirkung mit Amoxicillin hat.
Sucralfat
In einer Einzeldosis-Crossover-Studie, in der 30 mg PREVACID allein und gleichzeitig mit 1 g Sucralfat untersucht wurden, war die Resorption von Lansoprazol verzögert und die Bioverfügbarkeit um 17 % reduziert, wenn es gleichzeitig mit Sucralfat verabreicht wurde [siehe DOSIERUNG UND ANWENDUNG , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Antazida
In klinischen Studien wurden Antazida gleichzeitig mit PREVACID 15 mg verabreicht, und es gab keine Hinweise auf eine Veränderung der Wirksamkeit von PREVACID.
Clopidogrel
Clopidogrel wird teilweise durch CYP2C19 zu seinem aktiven Metaboliten metabolisiert. Es wurde eine Studie mit gesunden Probanden durchgeführt, die schnelle CYP2C19-Metabolisierer waren, die einmal täglich Clopidogrel 75 mg allein oder gleichzeitig mit PREVACID 30 mg (n = 40) über neun Tage erhielten. Die mittlere AUC des aktiven Metaboliten von Clopidogrel war bei gleichzeitiger Gabe von PREVACID im Vergleich zur Gabe von Clopidogrel allein um etwa 14 % reduziert (das mittlere AUC-Verhältnis betrug 86 %, mit einem 90 %-KI von 80 bis 92 %).
Pharmakodynamische Parameter wurden ebenfalls gemessen und zeigten, dass die Veränderung der Hemmung der Thrombozytenaggregation (induziert durch 5 mcM ADP) mit der Veränderung der Exposition gegenüber dem aktiven Metaboliten von Clopidogrel in Zusammenhang stand. Die Wirkung auf die Exposition gegenüber dem aktiven Metaboliten von Clopidogrel und auf die durch Clopidogrel induzierte Thrombozytenhemmung wird als klinisch nicht relevant erachtet.
Wirkung anderer Medikamente auf Lansoprazol
Da Lansoprazol durch CYP2C19 und CYP3A4 metabolisiert wird, können Induktoren und Inhibitoren dieser Enzyme möglicherweise die Lansoprazol-Exposition verändern.
Mikrobiologie
Mikrobiologie
Es wurde gezeigt, dass Lansoprazol, Clarithromycin und/oder Amoxicillin in vitro und bei klinischen Infektionen gegen die meisten Stämme von Helicobacter pylori wirksam sind [siehe INDIKATIONEN UND VERWENDUNG ].
Helicobacter Pylori-Vorbehandlungsresistenz
Die Clarithromycin-Vorbehandlungsresistenz (≥2,0 mcg/ml) betrug 9,5 % (91/960) im E-Test und 11,3 % (12/106) im Agarverdünnungsverfahren in den klinischen Studien mit Zweifach- und Dreifachtherapie (M93-125, M93-130, M93131, M95-392 und M95-399).
Bei 97,8 % (936/957) bzw. 98,0 % (98/100) der Patienten in den klinischen Studien mit Zweifach- und Dreifachtherapie traten Isolate auf, die für Amoxicillin vor der Behandlung empfindlich waren (≤ 0,25 µg/ml). Einundzwanzig von 957 Patienten (2,2 %) nach E-Test und zwei von 100 Patienten (2,0 %) nach Agar-Verdünnung hatten vor der Behandlung Amoxicillin-MHK-Werte von mehr als 0,25 mcg/ml. Ein Patient mit dem 14-tägigen Dreifachtherapieschema hatte eine unbestätigte minimale Hemmkonzentration (MIC) von Amoxicillin vor der Behandlung von mehr als 256 mcg/ml gemäß E-Test und der Patient wurde von H. pylori eradiziert (Tabelle 8).
Patienten, die H. pylori nach einer Dreifachtherapie mit Lansoprazol/Amoxicillin/Clarithromycin nicht eradiziert haben, werden wahrscheinlich Clarithromycin-resistente H. pylori haben. Daher sollte bei Patienten, bei denen die Therapie versagt, nach Möglichkeit ein Clarithromycin-Empfindlichkeitstest durchgeführt werden. Patienten mit Clarithromycin-resistentem H. pylori sollten nicht mit einer Lansoprazol/Amoxicillin/Clarithromycin-Dreifachtherapie oder mit Schemata behandelt werden, die Clarithromycin als einziges antimikrobielles Mittel enthalten.
Amoxicillin-Empfindlichkeitstestergebnisse und klinische/bakteriologische Ergebnisse
In den klinischen Studien mit Zweifach- und Dreifachtherapie wurde H. pylori bei 82,6 % (195/236) der Patienten, die vor der Behandlung Amoxicillin-empfindliche MHK (≤ 0,25 µg/ml) aufwiesen, eradiziert. Von den Patienten mit Amoxicillin-MHK von mehr als 0,25 mcg/ml vor der Behandlung wurde bei drei von sechs H. pylori ausgerottet. Bei insgesamt 30 % (21/70) der Patienten versagten die Kombinationstherapie Lansoprazol 30 mg dreimal täglich/Amoxicillin 1 g dreimal täglich und bei insgesamt 12,8 % (22/172) der Patienten versagten die 10- und 14-tägige Dreifachtherapie Therapieschemata. Bei 11 der Patienten, bei denen die Therapie versagt hatte, wurden keine Ergebnisse zur Empfindlichkeit nach der Behandlung erhalten. Neun der 11 Patienten mit Amoxicillin-MHK nach der Behandlung, bei denen die Dreifachtherapie versagt hatte, hatten auch Clarithromycin-resistente H. pylori-Isolate.
Empfindlichkeitstest für Helicobacter pylori
Informationen zu Empfindlichkeitstests zu Helicobacter pylori finden Sie unter Abschnitt Mikrobiologie in den Verschreibungsinformationen für Clarithromycin und Amoxicillin .
Klinische Studien
Zwölffingerdarmgeschwür
In einer US-amerikanischen multizentrischen, doppelblinden, placebokontrollierten Dosis-Wirkungs-Studie (15, 30 und 60 mg PREVACID einmal täglich) mit 284 Patienten mit endoskopisch dokumentiertem Zwölffingerdarmgeschwür war der Prozentsatz der Patienten, die nach zwei und vier Wochen geheilt waren, gleich signifikant höher bei allen PREVACID-Dosen als bei Placebo. Es gab keine Hinweise auf ein stärkeres oder früheres Ansprechen auf die beiden höheren Dosen im Vergleich zu PREVACID 15 mg. Basierend auf dieser Studie und der unten beschriebenen zweiten Studie beträgt die empfohlene Dosis von PREVACID 15 mg bei Zwölffingerdarmgeschwüren 15 mg pro Tag (Tabelle 9).
PREVACID 15 mg war signifikant wirksamer als Placebo bei der Linderung von Bauchschmerzen bei Tag und Nacht und bei der Verringerung der Menge an Antazida, die pro Tag eingenommen wurde.
In einer zweiten US-Multicenter-Studie, ebenfalls doppelblind, placebokontrolliert, Dosisvergleich (15 und 30 mg PREVACID 15 mg einmal täglich) und einschließlich eines Vergleichs mit Ranitidin, bei 280 Patienten mit endoskopisch dokumentiertem Zwölffingerdarmgeschwür, der Prozentsatz von Patienten, die nach vier Wochen geheilt waren, war bei beiden Dosen von PREVACID 15 mg signifikant höher als bei Placebo. Es gab keine Hinweise auf ein stärkeres oder früheres Ansprechen auf die höhere Dosis von PREVACID. Obwohl die 15-mg-Dosis von PREVACID Ranitidin nach vier Wochen überlegen war, lässt das Fehlen eines signifikanten Unterschieds nach zwei Wochen und das Fehlen eines Unterschieds zwischen 30 mg PREVACID und Ranitidin die vergleichende Wirksamkeit der beiden Wirkstoffe unbestimmt (Tabelle 10) [ sehen INDIKATIONEN UND VERWENDUNG ].
Ausrottung von H. pylori, um das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren zu verringern
Randomisierte, doppelblinde klinische Studien, die in den USA bei Patienten mit H. pylori und Zwölffingerdarmgeschwüren (definiert als aktives Geschwür oder Geschwüre in der Vorgeschichte innerhalb eines Jahres) durchgeführt wurden, bewerteten die Wirksamkeit von PREVACID in Kombination mit Amoxicillin und Clarithromycin als dreifach 14 Tagestherapie oder in Kombination mit Amoxicillin als duale 14-tägige Therapie zur Eradikation von H. pylori. Basierend auf den Ergebnissen dieser Studien wurden die Sicherheit und Wirksamkeit von zwei verschiedenen Eradikationsschemata festgestellt:
Triple-Therapie : PREVACID 30 mg zweimal täglich/Amoxicillin 1 g zweimal täglich/Clarithromycin 500 mg zweimal täglich
Duale Therapie : PREVACID 30 mg dreimal täglich/Amoxicillin 1 g dreimal täglich
Alle Behandlungen dauerten 14 Tage. Die Eradikation von H. pylori wurde als zwei negative Tests (Kultur und Histologie) vier bis sechs Wochen nach Behandlungsende definiert.
Die Dreifachtherapie erwies sich als wirksamer als alle möglichen Zweifachtherapie-Kombinationen. Die duale Therapie erwies sich als wirksamer als beide Monotherapien. Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert.
Eine randomisierte, doppelblinde klinische Studie, die in den USA bei Patienten mit H. pylori und Zwölffingerdarmgeschwüren (definiert als aktives Geschwür oder Geschwüre in der Anamnese innerhalb eines Jahres) durchgeführt wurde, verglich die Wirksamkeit der PREVACID-Dreifachtherapie über 10 und 14 Tage. Diese Studie stellte fest, dass die 10-tägige Dreifachtherapie der 14-tägigen Dreifachtherapie bei der Eradikation von H. pylori gleichwertig war (Tabellen 11 und 12) [siehe INDIKATIONEN UND VERWENDUNG ].
Pflege geheilter Zwölffingerdarmgeschwüre
PREVACID verhindert nachweislich das Wiederauftreten von Zwölffingerdarmgeschwüren. Zwei unabhängige, doppelblinde, multizentrische, kontrollierte Studien wurden bei Patienten mit endoskopisch bestätigten geheilten Zwölffingerdarmgeschwüren durchgeführt. Die Patienten blieben signifikant länger geheilt und die Anzahl der Rezidive von Zwölffingerdarmgeschwüren war bei Patienten, die mit PREVACID 15 mg behandelt wurden, signifikant geringer als bei Patienten, die über einen Zeitraum von 12 Monaten mit Placebo behandelt wurden (Tabelle 13) [siehe INDIKATIONEN UND VERWENDUNG ].
In Studie Nr. 2 wurde kein signifikanter Unterschied zwischen PREVACID 15 und 30 mg bei der Aufrechterhaltung der Remission festgestellt.
Magengeschwür
In einer US-amerikanischen multizentrischen, doppelblinden, placebokontrollierten Studie mit 253 Patienten mit endoskopisch dokumentiertem Magengeschwür war der Prozentsatz der Patienten, die nach vier und acht Wochen geheilt waren, mit PREVACID 15 und 30 mg einmal täglich signifikant höher als mit Placebo (Tabelle 14 ) [sehen INDIKATIONEN UND VERWENDUNG ].
Patienten, die mit einer beliebigen PREVACID-Dosis behandelt wurden, berichteten von signifikant weniger Bauchschmerzen bei Tag und Nacht, zusammen mit weniger Tagen der Antazida-Einnahme und weniger Antazida-Tabletten, die pro Tag eingenommen wurden, als die Placebo-Gruppe.
Der unabhängige Nachweis der Wirksamkeit von PREVACID 30 mg wurde durch eine Metaanalyse veröffentlichter und unveröffentlichter Daten erbracht.
Heilung von NSAID-assoziiertem Magengeschwür
In zwei multizentrischen, doppelblinden, aktiv kontrollierten Studien in den USA und Kanada bei Patienten mit endoskopisch bestätigtem NSAID-assoziiertem Magengeschwür, die ihre NSAID-Anwendung fortsetzten, war der Prozentsatz der Patienten, die nach acht Wochen geheilt waren, mit 30 mg PREVACID statistisch signifikant höher als mit die aktive Steuerung. Insgesamt wurden 711 Patienten in die Studie aufgenommen und 701 Patienten behandelt. Das Alter der Patienten lag zwischen 18 und 88 Jahren (Durchschnittsalter 59 Jahre), wobei 67 % weibliche Patienten und 33 % männliche Patienten waren. Die Rasse war wie folgt verteilt: 87 % Kaukasier, 8 % Schwarze, 5 % Andere. Es gab keinen statistisch signifikanten Unterschied zwischen PREVACID 30 mg täglich und der aktiven Kontrolle bezüglich der Symptomlinderung (dh Bauchschmerzen) (Tabelle 15) [siehe INDIKATIONEN UND VERWENDUNG ].
Risikominderung von NSAID-assoziiertem Magengeschwür
In einer großen US-amerikanischen, multizentrischen, doppelblinden, Placebo- und Misoprostol-kontrollierten (Misoprostol nur für den Endoskopiker verblindeten) Studie bei Patienten, die eine chronische Anwendung eines NSAID benötigten und die eine Vorgeschichte eines endoskopisch dokumentierten Magengeschwürs hatten, der Anteil von Patienten, die nach vier, acht und 12 Wochen frei von Magengeschwüren blieben, war bei 15 oder 30 mg PREVACID 15 mg signifikant höher als bei Placebo. Insgesamt wurden 537 Patienten in die Studie aufgenommen und 535 Patienten behandelt. Das Alter der Patienten lag zwischen 23 und 89 Jahren (Durchschnittsalter 60 Jahre), wobei 65 % weibliche Patienten und 35 % männliche Patienten waren. Die Rasse war wie folgt verteilt: 90 % Kaukasier, 6 % Schwarze, 4 % Andere. Die 30-mg-Dosis PREVACID zeigte gegenüber der 15-mg-Dosis keinen zusätzlichen Vorteil bei der Risikominderung des NSAID-assoziierten Magengeschwürs (Tabelle 16) [siehe INDIKATIONEN UND VERWENDUNG ].
Symptomatische gastroösophageale Refluxkrankheit (GERD)
Symptomatische GERD
In einer multizentrischen, doppelblinden, placebokontrollierten US-Studie mit 214 Patienten mit häufigen GERD-Symptomen, aber ohne endoskopische Erosionen der Speiseröhre, wurde eine signifikant größere Linderung des mit GERD verbundenen Sodbrennens bei der Verabreichung von Lansoprazol 15 mg einmal täglich bis zu acht beobachtet Wochen als mit Placebo. Es wurde kein signifikanter zusätzlicher Nutzen von Lansoprazol 30 mg einmal täglich beobachtet.
Die Intent-to-treat-Analysen zeigten eine signifikante Verringerung der Häufigkeit und Schwere von Sodbrennen am Tag und in der Nacht. Daten zu Häufigkeit und Schweregrad für den achtwöchigen Behandlungszeitraum sind in Tabelle 17 und in den Abbildungen 1 und 2 dargestellt:
Abbildung 1: Mittlerer Schweregrad von Sodbrennen pro Tag nach Studientag für auswertbare Patienten (3=schwer, 2=mäßig, 1=leicht, 0=keine)
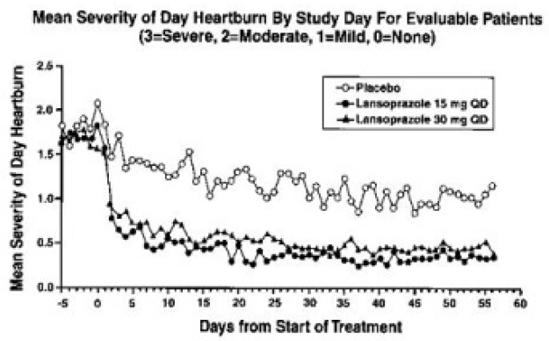
Abbildung 2: Mittlerer Schweregrad von nächtlichem Sodbrennen nach Studientag für auswertbare Patienten (3=schwer, 2=mäßig, 1=leicht, 0=keine)
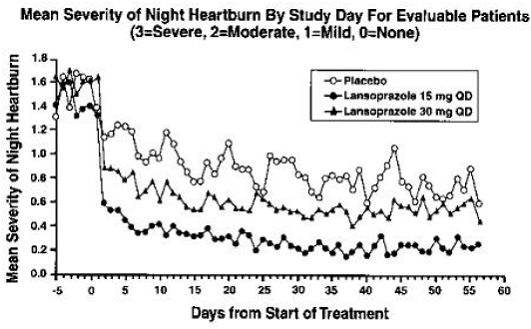
In zwei US-amerikanischen, multizentrischen, doppelblinden, Ranitidin-kontrollierten Studien mit insgesamt 925 Patienten mit häufigen GERD-Symptomen, aber ohne endoskopische Erosionen der Speiseröhre, war Lansoprazol 15 mg Ranitidin 150 mg (zweimal täglich) bei der Verringerung der Häufigkeit und Schwere des Tages überlegen und nächtliches Sodbrennen im Zusammenhang mit GERD für den achtwöchigen Behandlungszeitraum. Es wurde kein signifikanter zusätzlicher Nutzen von Lansoprazol 30 mg einmal täglich beobachtet [siehe INDIKATIONEN UND VERWENDUNG ].
Erosive Ösophagitis
In einer US-amerikanischen, multizentrischen, doppelblinden, placebokontrollierten Studie mit 269 Patienten, die mit einer endoskopischen Diagnose einer Ösophagitis mit einem Schleimhautgrad von zwei oder mehr und den Graden drei und vier, die eine erosive Erkrankung bedeuten, aufgenommen wurden, sind die Prozentsätze der Patienten mit Heilung in der Tabelle dargestellt 18:
In dieser Studie berichteten alle PREVACID-Gruppen über eine signifikant stärkere Linderung von Sodbrennen und weniger Tag- und Nacht-Bauchschmerzen zusammen mit weniger Tagen der Antazida-Einnahme und weniger Antazida-Tabletten, die pro Tag eingenommen wurden, als die Placebo-Gruppe. Obwohl alle Dosen wirksam waren, legt die frühere Heilung bei den beiden höheren Dosen nahe, dass 30 mg täglich die empfohlene Dosis ist.
PREVACID wurde außerdem in einer multizentrischen Doppelblindstudie in den USA mit einer niedrigen Dosis Ranitidin bei 242 Patienten mit erosiver Refluxösophagitis verglichen. PREVACID in einer Dosis von 30 mg war signifikant wirksamer als Ranitidin 150 mg zweimal täglich, wie unten gezeigt (Tabelle 19).
Darüber hinaus berichteten Patienten, die mit PREVACID 30 mg behandelt wurden, über weniger Sodbrennen am Tag und in der Nacht und nahmen weniger Antazida-Tabletten für weniger Tage ein als Patienten, die zweimal täglich 150 mg Ranitidin einnahmen.
Obwohl diese Studie die Wirksamkeit von PREVACID 15 mg bei der Heilung von erosiver Ösophagitis zeigt, stellt sie keinen angemessenen Vergleich mit Ranitidin dar, da die empfohlene Dosis von Ranitidin bei Ösophagitis 150 mg viermal täglich beträgt, das Doppelte der in dieser Studie verwendeten Dosis.
In den beiden beschriebenen Studien und in mehreren kleineren Studien, an denen Patienten mit mittelschwerer bis schwerer erosiver Ösophagitis teilnahmen, erzielte PREVACID ähnliche Heilungsraten wie oben gezeigt.
In einer multizentrischen, doppelblinden, aktiv kontrollierten Studie in den USA wurden 30 mg PREVACID 30 mg mit zweimal täglich 150 mg Ranitidin bei 151 Patienten mit erosiver Refluxösophagitis verglichen, die auf eine mindestens 12-wöchige Behandlung mit schlecht ansprachen ein H2-Rezeptor-Antagonist in der zur Symptomlinderung angegebenen Dosis oder höher, nämlich Cimetidin 800 mg/Tag, Ranitidin 300 mg/Tag, Famotidin 40 mg/Tag oder Nizatidin 300 mg/Tag. PREVACID 30 mg war wirksamer als Ranitidin 150 mg zweimal täglich bei der Heilung von Refluxösophagitis, und der Prozentsatz der Patienten mit Heilung war wie folgt. Diese Studie stellt keinen Vergleich der Wirksamkeit von Histamin-H2-Rezeptor-Antagonisten mit PREVACID 30 mg dar, da alle Patienten auf die Behandlung mit Histamin-H2-Rezeptor-Antagonisten nicht ansprachen. Es weist jedoch darauf hin, dass PREVACID 30 mg bei Patienten nützlich sein kann, bei denen ein Histamin-H2-Rezeptor-Antagonist versagt (Tabelle 20) [siehe INDIKATIONEN UND VERWENDUNG ].
Aufrechterhaltung der Heilung der erosiven Ösophagitis
Zwei unabhängige, doppelblinde, multizentrische, kontrollierte Studien wurden bei Patienten mit endoskopisch bestätigter geheilter Ösophagitis durchgeführt. Die Patienten blieben signifikant länger in Remission und die Anzahl der Rezidive der erosiven Ösophagitis war bei Patienten, die mit PREVACID 30 mg behandelt wurden, signifikant geringer als bei Patienten, die über einen Zeitraum von 12 Monaten mit Placebo behandelt wurden (Tabelle 21).
Unabhängig vom anfänglichen Grad der erosiven Ösophagitis waren PREVACID 15 und 30 mg bei der Aufrechterhaltung der Remission ähnlich.
In einer randomisierten, doppelblinden US-Studie wurde PREVACID 15 mg täglich (n = 100) mit Ranitidin 150 mg zweimal täglich (n = 106) in der empfohlenen Dosierung bei Patienten mit endoskopisch nachgewiesener geheilter erosiver Ösophagitis über a verglichen 12 Monate Laufzeit. Die Behandlung mit PREVACID 15 mg führte dazu, dass Patienten von erosiver Ösophagitis über signifikant längere Zeiträume geheilt blieben (Läsionen Grad 0) als diejenigen, die mit Ranitidin behandelt wurden (p INDIKATIONEN UND VERWENDUNG ].
Pathologische hypersekretorische Zustände einschließlich Zollinger-Ellison-Syndrom
In offenen Studien an 57 Patienten mit pathologischen hypersekretorischen Zuständen wie dem Zollinger-Ellison-Syndrom (ZES) mit oder ohne multiplen endokrinen Adenomen hemmte PREVACID 15 mg die Magensäuresekretion signifikant und kontrollierte die damit verbundenen Symptome von Durchfall, Anorexie und Schmerzen. Dosen im Bereich von 15 mg jeden zweiten Tag bis 180 mg pro Tag hielten die basale Säuresekretion bei Patienten ohne vorherige Magenoperation unter 10 mEq/h und bei Patienten mit vorheriger Magenoperation unter 5 mEq/h.
Die Anfangsdosen wurden auf die individuellen Bedürfnisse des Patienten titriert, und bei einigen Patienten waren im Laufe der Zeit Anpassungen erforderlich [siehe DOSIERUNG UND ANWENDUNG ]. PREVACID wurde bei diesen hohen Dosierungen über einen längeren Zeitraum (bei einigen Patienten länger als vier Jahre) gut vertragen. Bei den meisten ZES-Patienten wurden die Gastrinspiegel im Serum durch PREVACID nicht verändert. Bei manchen Patienten stieg das Gastrin im Serum jedoch auf Werte an, die höher waren als die, die vor Beginn der Lansoprazol-Therapie vorhanden waren [siehe INDIKATIONEN UND VERWENDUNG ].
INFORMATIONEN ZUM PATIENTEN
PREVACID (prev-a-sid) (Lansoprazol) Kapseln mit verzögerter Freisetzung zum Einnehmen und
PREVACID SoluTab (prev-a-sid sol-u-tab) (Lansoprazol) oral zerfallende Tabletten mit verzögerter Freisetzung
Was sind die wichtigsten Informationen, die ich über PREVACID und PREVACID 15mg SoluTab wissen sollte?
Sie sollten PREVACID und PREVACID 15 mg SoluTab genau nach Vorschrift, in der geringstmöglichen Dosis und für die kürzest erforderliche Zeit einnehmen.
PREVACID und PREVACID SoluTab können bei Ihren säurebedingten Symptomen helfen, aber Sie könnten trotzdem ernsthafte Magenprobleme haben.
Sprechen Sie mit Ihrem Arzt. PREVACID 30 mg und PREVACID 30 mg SoluTab können schwerwiegende Nebenwirkungen verursachen, darunter:
Sprechen Sie mit Ihrem Arzt über Ihr Risiko für diese schwerwiegenden Nebenwirkungen.
PREVACID 15 mg und PREVACID SoluTab können andere schwerwiegende Nebenwirkungen haben. Sehen „Was sind die möglichen Nebenwirkungen von PREVACID und PREVACID SoluTab?“.
Was sind PREVACID und PREVACID 30mg SoluTab?
Ein verschreibungspflichtiges Medikament namens Protonenpumpenhemmer (PPI), das verwendet wird, um die Menge an Säure in Ihrem Magen zu reduzieren.
Bei Erwachsenen PREVACID 15 mg und PREVACID SoluTab werden verwendet für:
Kinder: Geben Sie PREVACID 30 mg und PREVACID 30 mg SoluTab genau nach Anweisung des Arztes Ihres Kindes. Erhöhen Sie die Dosis von PREVACID und PREVACID SoluTab nicht und geben Sie Ihrem Kind PREVACID 15 mg und PREVACID 15 mg SoluTab nicht länger als von Ihrem Arzt verordnet.
Bei Kindern im Alter von 1 bis 11 Jahren PREVACID 15mg und PREVACID 15mg SoluTab werden angewendet bei:
Bei Kindern im Alter von 12 bis 17 Jahren, PREVACID und PREVACID SoluTab werden verwendet für:
PREVACID 30 mg und PREVACID SoluTab werden nicht zur Behandlung der Symptome von GERD bei Kindern unter 1 Jahr empfohlen und können diesen schaden.
Nehmen Sie PREVACID oder PREVACID 15 mg SoluTab nicht ein, wenn Sie:
Bevor Sie PREVACID 15 mg oder PREVACID SoluTab einnehmen, informieren Sie Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Methotrexat (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP) einnehmen.
Wie sollte ich PREVACID 15 mg und PREVACID 30 mg SoluTab einnehmen?
PREVACID 15 mg Kapseln:
PREVACID SoluTab:
Was sind die möglichen Nebenwirkungen von PREVACID und PREVACID SoluTab?
PREVACID und PREVACID SoluTab können schwerwiegende Nebenwirkungen verursachen, darunter:
Beenden Sie die Einnahme von PREVACID und rufen Sie sofort Ihren Arzt an. Diese Symptome können das erste Anzeichen einer schweren Hautreaktion sein.
Zu den häufigsten Nebenwirkungen von PREVACID und PREVACID SoluTab gehören: Durchfall, Bauchschmerzen, Übelkeit und Verstopfung.
Dies sind nicht alle möglichen Nebenwirkungen von PREVACID 30 mg und PREVACID 30 mg SoluTab.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an.
Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist PREVACID und PREVACID 30 mg SoluTab aufzubewahren?
Bewahren Sie PREVACID bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F) auf.
Bewahren Sie PREVACID 15 mg und PREVACID SoluTab sowie alle Arzneimittel für Kinder unzugänglich auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PREVACID 15mg und PREVACID SoluTab.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie PREVACID oder PREVACID 30 mg SoluTab nicht bei Erkrankungen, für die es nicht verschrieben wurde. Geben Sie PREVACID 30 mg oder PREVACID SoluTab nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt oder Apotheker um Informationen zu PREVACID 30 mg und PREVACID 15 mg SoluTab bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Was sind die Inhaltsstoffe von PREVACID und PREVACID SoluTab?
Wirkstoff: Lansoprazol.
Inaktive Inhaltsstoffe in PREVACID 30 mg Kapseln: Zuckerkügelchen, Saccharose, Methacrylsäure-Copolymer, niedrig substituierte Hydroxypropylcellulose, Stärke, Magnesiumcarbonat, Talk, Polyethylenglycol, Titandioxid, Polysorbat 80, Hydroxypropylcellulose, kolloidales Siliciumdioxid, D&C Red Nr. 28, FD&C Blue Nr. 1 und FD&C Rot Nr. 40.
Nur PREVACID 15 mg Kapsel: FD&C Grün Nr. 3.
Hilfsstoffe in PREVACID 15mg SoluTab: Mannit, Methacrylsäure, Hydroxypropylcellulose, Lactose-Monohydrat-Mikrokristalline Cellulose-Kugel, Triethylcitrat, Crospovidon, Polyacrylat, Magnesiumcarbonat, Aspartam, Glycerylmonostearat, Hypromellose, Magnesiumstearat, Zitronensäure, Titandioxid, Talkum, künstliches Erdbeeraroma, Polyethylenglycol, Polysorbat 80 und Eisenoxid.
PREVACID SoluTab enthält 2,5 mg Phenylalanin in jeder 15-mg-Tablette und 5,1 mg Phenylalanin in jeder 30-mg-Tablette.
GEBRAUCHSANWEISUNG
PREVACID (prev-a-sid) (Lansoprazol) Kapseln mit verzögerter Freisetzung zum Einnehmen und
PREVACID SoluTab (prev-a-sid sol-u-tab) (Lansoprazol) oral zerfallende Tabletten mit verzögerter Freisetzung
Wichtig:
PREVACID Kapseln mit verzögerter Freisetzung (PREVACID 30 mg Kapseln)
Einnahme von PREVACID 15 mg Kapseln zusammen mit bestimmten Nahrungsmitteln:
Sie können nur Apfelmus, ENSURE-Pudding, Hüttenkäse, Joghurt oder passierte Birnen verwenden.
Einnahme von PREVACID Kapseln mit bestimmten Säften:
Sie können nur Apfelsaft, Orangensaft oder Tomatensaft verwenden.
Gabe von PREVACID-Kapseln über eine nasogastrale Sonde (NG-Sonde) Größe 16 French oder größer:
Sie können nur Apfelsaft verwenden.
PREVACID 15 mg SoluTab Oral zerfallende Tabletten mit verzögerter Freisetzung (PREVACID SoluTab)
Bei Patienten, die Schwierigkeiten beim Schlucken von Tabletten haben, kann PREVACID SoluTab wie folgt verabreicht werden:
Verabreichung von PREVACID SoluTab mit Wasser unter Verwendung einer Applikationsspritze für Zubereitungen zum Einnehmen:
Gabe von PREVACID 15 mg SoluTab mit Wasser über eine nasogastrale Sonde (NG-Sonde) Größe 8 French oder größer:
Wie ist PREVACID und PREVACID 30 mg SoluTab aufzubewahren?
Bewahren Sie PREVACID und PREVACID 30mg SoluTab sowie alle Arzneimittel für Kinder unzugänglich auf.
Diese Gebrauchsanweisung wurde von der US Food and Drug Administration genehmigt.