Prilosec 40mg, 10mg, 20mg Omeprazole Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Prilosec 40 mg und wie wird es angewendet?
Prilosec 40 mg ist ein verschreibungspflichtiges und rezeptfreies Arzneimittel zur Behandlung der Symptome der gastroösophagealen Refluxkrankheit (GERD), von Magengeschwüren und anderen Erkrankungen, die durch überschüssige Magensäure verursacht werden. Prilosec 10 mg kann allein oder mit anderen Medikamenten verwendet werden.
Prilosec gehört zu einer Klasse von Medikamenten, die als Protonenpumpenhemmer bezeichnet werden.
Es ist nicht bekannt, ob Prilosec 40 mg bei Kindern unter 1 Monat sicher und wirksam ist.
Welche Nebenwirkungen kann Prilosec 10mg haben?
Prilosec kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Prilosec gehören:
BEZEICHNUNG
Der Wirkstoff in PRILOSEC (Omeprazol) Retardkapseln ist ein substituiertes Benzimidazol, 5-Methoxy-2-[[(4-methoxy-3, 5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol, a Verbindung, die die Magensäuresekretion hemmt. Seine Summenformel ist C17H19N3O3S mit einem Molekulargewicht von 345,42. Die Strukturformel lautet:
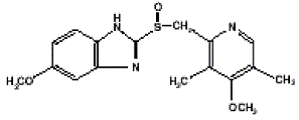
Omeprazol ist ein weißes bis cremefarbenes kristallines Pulver, das bei etwa 155 °C unter Zersetzung schmilzt. Es ist eine schwache Base, gut löslich in Ethanol und Methanol, leicht löslich in Aceton und Isopropanol und sehr leicht löslich in Wasser. Die Stabilität von Omeprazol ist eine Funktion des pH-Werts; es wird in sauren Medien schnell abgebaut, hat aber unter alkalischen Bedingungen eine akzeptable Stabilität.
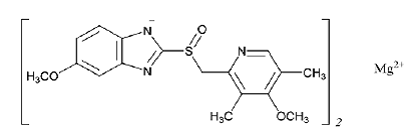
Der Wirkstoff in PRILOSEC (Omeprazol-Magnesium) für die orale Suspension mit verzögerter Freisetzung ist 5-Methoxy-2-[[(4-methoxy-3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol, Magnesium Salz (2:1)
Omeprazol-Magnesium ist ein weißes bis cremefarbenes Pulver mit einem Schmelzpunkt unter Zersetzung bei 200 °C. Das Salz ist in Wasser bei 25°C leicht löslich (0,25 mg/ml) und in Methanol löslich. Die Halbwertszeit ist stark pH-abhängig.
Die empirische Formel für Omeprazol-Magnesium ist (C17H18N3O3S)2 Mg, das Molekulargewicht ist 713,12 und die Strukturformel ist:
PRILOSEC wird als Kapseln mit verzögerter Freisetzung zur oralen Verabreichung geliefert. Jede Kapsel mit verzögerter Wirkstofffreisetzung enthält entweder 10 mg, 20 mg oder 40 mg Omeprazol in Form eines magensaftresistenten Granulats mit den folgenden Hilfsstoffen: Cellulose, Dinatriumhydrogenphosphat, Hydroxypropylcellulose, Hypromellose, Lactose, Mannit, Natriumlaurylsulfat u andere Zutaten. Die Kapselhüllen enthalten die folgenden inaktiven Inhaltsstoffe: Gelatine-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, Titandioxid, synthetisches schwarzes Eisenoxid, Isopropanol, Butylalkohol, FD&C Blue #2, D&C Red #7 Calcium Lake, und zusätzlich enthalten die 10 mg und 40 mg Kapselhüllen auch D&C Yellow #10.
Jede Packung PRILOSEC Retard-Suspension zum Einnehmen enthält entweder 2,8 mg oder 11,2 mg Omeprazol-Magnesium (entsprechend 2,5 mg oder 10 mg Omeprazol) in Form eines magensaftresistenten Granulats mit den folgenden Hilfsstoffen: Glycerylmonostearat, Hydroxypropyl Cellulose, Hypromellose, Magnesiumstearat, Methacrylsäure-Copolymer C, Polysorbat, Zuckerkügelchen, Talk und Triethylcitrat sowie inaktive Granulate. Das inaktive Granulat besteht aus den folgenden Inhaltsstoffen: Citronensäure, Crospovidon, Dextrose, Hydroxypropylcellulose, Eisenoxid und Xanthangummi. Das Omeprazol-Granulat und das inaktive Granulat werden mit Wasser zubereitet, um eine Suspension zu bilden, und werden durch orale, nasale oder direkte Magenverabreichung verabreicht.
INDIKATIONEN
Behandlung von aktivem Zwölffingerdarmgeschwür
PRILOSEC 20 mg ist für die Kurzzeitbehandlung aktiver Zwölffingerdarmgeschwüre bei Erwachsenen indiziert. Die meisten Patienten heilen innerhalb von vier Wochen. Einige Patienten benötigen möglicherweise eine zusätzliche vierwöchige Therapie.
Helicobacter pylori-Eradikation zur Verringerung des Risikos eines erneuten Auftretens von Zwölffingerdarmgeschwüren
Es wurde gezeigt, dass die Eradikation von H. pylori das Risiko eines erneuten Auftretens von Zwölffingerdarmgeschwüren verringert.
Triple-Therapie
PRILOSEC 40 mg in Kombination mit Clarithromycin und Amoxicillin ist angezeigt zur Behandlung von Patienten mit H. pylori-Infektion und Zwölffingerdarmgeschwür (aktiv oder bis zu 1 Jahr in der Anamnese) zur Eradikation von H. pylori bei Erwachsenen.
Duale Therapie
PRILOSEC in Kombination mit Clarithromycin ist angezeigt zur Behandlung von Patienten mit H. pylori-Infektion und Zwölffingerdarmgeschwüren zur Eradikation von H. pylori bei Erwachsenen.
Bei Patienten, bei denen die Therapie versagt, ist PRILOSEC mit Clarithromycin eher mit der Entwicklung einer Clarithromycin-Resistenz verbunden als bei einer Dreifachtherapie. Bei Patienten, bei denen die Therapie versagt, sollte eine Empfindlichkeitsprüfung durchgeführt werden. Wenn eine Resistenz gegen Clarithromycin nachgewiesen wird oder eine Empfindlichkeitsprüfung nicht möglich ist, sollte eine alternative antimikrobielle Therapie eingeleitet werden [siehe KLINISCHE PHARMAKOLOGIE und die Clarithromycin-Verschreibungsinformationen, Abschnitt Mikrobiologie].
Behandlung von aktivem gutartigem Magengeschwür
PRILOSEC ist für die Kurzzeitbehandlung (4 bis 8 Wochen) aktiver gutartiger Magengeschwüre bei Erwachsenen indiziert.
Behandlung der symptomatischen gastroösophagealen Refluxkrankheit (GERD)
PRILOSEC ist für die Behandlung von Sodbrennen und anderen Symptomen im Zusammenhang mit GERD für bis zu 4 Wochen bei Patienten ab einem Alter von 1 Jahr indiziert.
Behandlung der erosiven Ösophagitis (EE) aufgrund von säurevermittelter GERD
Pädiatrische Patienten im Alter von 1 Jahr bis zu Erwachsenen
PRILOSEC 20 mg ist angezeigt für die Kurzzeitbehandlung (4 bis 8 Wochen) von EE aufgrund von säurevermittelter GERD, die endoskopisch bei Patienten im Alter von 1 Jahr und älter diagnostiziert wurde.
Die Wirksamkeit von PRILOSEC 10 mg, das länger als 8 Wochen bei Patienten mit EE angewendet wurde, wurde nicht nachgewiesen. Wenn ein Patient auf eine 8-wöchige Behandlung nicht anspricht, kann eine weitere 4-wöchige Behandlung durchgeführt werden. Bei erneutem Auftreten von EE- oder GERD-Symptomen (z. B. Sodbrennen) können zusätzliche 4- bis 8-wöchige Behandlungen mit PRILOSEC in Betracht gezogen werden.
Pädiatrische Patienten im Alter von 1 Monat bis unter 1 Jahr
PRILOSEC ist indiziert für die Kurzzeitbehandlung (bis zu 6 Wochen) von EE aufgrund von säurevermittelter GERD bei pädiatrischen Patienten im Alter von 1 Monat bis unter 1 Jahr.
Aufrechterhaltung der Heilung von EE aufgrund von säurevermittelter GERD
PRILOSEC 40 mg ist für die Erhaltungsheilung von EE aufgrund von säurevermittelter GERD bei Patienten ab 1 Jahr indiziert.
Kontrollierte Studien erstrecken sich nicht über 12 Monate.
Pathologische hypersekretorische Zustände
PRILOSEC 40 mg ist für die Langzeitbehandlung pathologischer hypersekretorischer Zustände (z. B. Zollinger-Ellison-Syndrom, multiple endokrine Adenome und systemische Mastozytose) bei Erwachsenen indiziert.
DOSIERUNG UND ANWENDUNG
Empfohlenes Dosierungsschema für Erwachsene nach Indikation
Tabelle 1 zeigt die empfohlene Dosierung von PRILOSEC 40 mg bei erwachsenen Patienten nach Indikation.
Empfohlenes pädiatrisches Dosierungsschema nach Indikation
Tabelle 2 zeigt die empfohlene Dosierung von PRILOSEC bei pädiatrischen Patienten nach Indikation.
Verwaltungsanweisungen
Orale Verabreichung in Wasser
Verabreichung mit Wasser über ein NG oder eine Magensonde (Größe 6 oder größer)
WIE GELIEFERT
Darreichungsformen und Stärken
PRILOSEC Retard-Suspension zum Einnehmen: 2,5 mg und 10 mg Omeprazol in Einzeldosispackungen mit einem feinen gelben Pulver, bestehend aus weißen bis bräunlichen Omeprazol-Magnesium-Körnchen und blassgelben inaktiven Körnchen.
Lagerung und Handhabung
PRILOSEC (Omeprazol-Magnesium) zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung, 2,5 mg oder 10 mg Omeprazol, wird als Einzeldosispackung geliefert, die ein feines gelbes Pulver enthält, das aus weißen bis bräunlichen Omeprazol-Magnesium-Körnchen und blassgelben inaktiven Körnchen besteht. PRILOSEC Einzeldosispackungen werden wie folgt geliefert:
NDC 70515-625–01 Einzeldosispackungen mit 30: 2,5-mg-Packungen NDC 70515-610–01 Einzeldosispackungen mit 30: 10-mg-Packungen
Lagerung
Lagern Sie PRILOSEC für die orale Suspension mit verzögerter Freisetzung bei 25 °C (77 °F); Ausflüge erlaubt bis 15 – 30°C (59 – 86°F). [Sehen USP kontrollierte Raumtemperatur .]
Hergestellt für: Covis Pharma, Zug, 6300 Schweiz. Überarbeitet: März 2022
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrungen aus klinischen Studien mit PRILOSEC
Monotherapie
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die unten beschriebenen Sicherheitsdaten spiegeln die Exposition gegenüber Omeprazol-Magnesium-Retardkapseln bei 3096 Patienten aus weltweiten klinischen Studien wider (465 Patienten aus US-amerikanischen Studien und 2631 Patienten aus internationalen Studien). Zu den in US-amerikanischen Studien klinisch untersuchten Indikationen gehörten Zwölffingerdarmgeschwür, resistentes Geschwür und das Zollinger-Ellison-Syndrom. Die internationalen klinischen Studien waren doppelblind und offen konzipiert. Die am häufigsten berichteten Nebenwirkungen (d. h. mit einer Inzidenzrate von ≥ 2 %) bei mit PRILOSEC behandelten Patienten, die an diesen Studien teilnahmen, waren Kopfschmerzen (7 %), Bauchschmerzen (5 %), Übelkeit (4 %), Durchfall (4 % ), Erbrechen (3 %) und Blähungen (3 %).
Weitere Nebenwirkungen, die mit einer Inzidenz von ≥ 1 % berichtet wurden, waren saures Aufstoßen (2 %), Infektion der oberen Atemwege (2 %), Verstopfung (2 %), Schwindel (2 %), Hautausschlag (2 %), Asthenie (1 % ), Rückenschmerzen (1 %) und Husten (1 %).
Das Sicherheitsprofil der klinischen Studie bei Patienten über 65 Jahren war ähnlich wie bei Patienten unter 65 Jahren.
Das Sicherheitsprofil aus klinischen Studien bei pädiatrischen Patienten, die Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung erhielten, war ähnlich wie bei erwachsenen Patienten. Einzig in der pädiatrischen Population wurden jedoch Nebenwirkungen des Atmungssystems häufig in der Altersgruppe von 1 Monat bis Verwendung in bestimmten Bevölkerungsgruppen ].
Erfahrungen aus klinischen Studien mit PRILOSEC 20 mg in der Kombinationstherapie zur Eradikation von H. pylori
In klinischen Studien, in denen entweder eine Zweifachtherapie mit Omeprazol-Magnesium-Kapseln mit verzögerter Wirkstofffreisetzung und Clarithromycin oder eine Dreifachtherapie mit Omeprazol-Magnesium-Kapseln mit verzögerter Wirkstofffreisetzung, Clarithromycin und Amoxicillin angewendet wurden, wurden keine Nebenwirkungen beobachtet, die nur für diese Arzneimittelkombinationen gelten. Die beobachteten Nebenwirkungen beschränkten sich auf die zuvor mit Omeprazol, Clarithromycin oder Amoxicillin allein berichteten.
Duale Therapie (Omeprazol-Magnesium-Retardkapseln/Clarithromycin)
Nebenwirkungen, die in kontrollierten klinischen Studien zur Kombinationstherapie mit Omeprazol-Magnesium-Kapseln mit verzögerter Wirkstofffreisetzung und Clarithromycin (n = 346) beobachtet wurden und sich von denen unterschieden, die zuvor für Omeprazol-Magnesium-Kapseln mit verzögerter Wirkstofffreisetzung allein beschrieben wurden, waren Geschmacksveränderungen (15 %), Zungenverfärbung (2 %), Rhinitis (2 %), Pharyngitis (1 %) und Grippesyndrom (1 %). (Weitere Informationen zu Clarithromycin finden Sie in den Verschreibungsinformationen zu Clarithromycin, Abschnitt „Nebenwirkungen“.)
Dreifachtherapie (Omeprazol-Magnesium-Retardkapseln/Clarithromycin/Amoxicillin)
Die häufigsten Nebenwirkungen, die in klinischen Studien mit einer Kombinationstherapie mit Omeprazol-Magnesium-Retardkapseln, Clarithromycin und Amoxicillin (n = 274) beobachtet wurden, waren Durchfall (14 %), Geschmacksstörungen (10 %) und Kopfschmerzen (7 %). Keines davon trat häufiger auf als bei Patienten, die nur antimikrobielle Mittel einnahmen. (Weitere Informationen zu Clarithromycin oder Amoxicillin finden Sie in den jeweiligen Verschreibungsinformationen, Abschnitten über Nebenwirkungen.)
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Omeprazol nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre tatsächliche Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Überempfindlichkeitsreaktionen einschließlich Anaphylaxie, anaphylaktischer Schock, Angioödem, Bronchospasmus, interstitielle Nephritis, Urtikaria (siehe auch „Haut“ unten); Fieber; Schmerzen; Ermüdung; Unwohlsein; systemischer Lupus erythematodes
Herz-Kreislauf: Brustschmerzen oder Angina pectoris, Tachykardie, Bradykardie, Herzklopfen, erhöhter Blutdruck, periphere Ödeme
Endokrin: Gynäkomastie
Magen-Darm: Pankreatitis (einige mit tödlichem Ausgang), Anorexie, Reizdarm, Stuhlverfärbung, Candidiasis der Speiseröhre, Schleimhautatrophie der Zunge, Stomatitis, Bauchschwellung, Mundtrockenheit, mikroskopische Kolitis, Fundusdrüsenpolypen.
Gastroduodenale Karzinoide wurden bei Patienten mit ZE-Syndrom unter Langzeitbehandlung mit Omeprazol berichtet. Es wird angenommen, dass dieser Befund eine Manifestation der zugrunde liegenden Erkrankung ist, von der bekannt ist, dass sie mit solchen Tumoren assoziiert ist.
Leber: Lebererkrankung einschließlich Leberversagen (einige mit tödlichem Ausgang), Lebernekrose (einige mit tödlichem Ausgang), hepatische Enzephalopathie, hepatozelluläre Erkrankung, cholestatische Erkrankung, gemischte Hepatitis, Gelbsucht und Erhöhung der Leberfunktionstests [ALT, AST, GGT, alkalische Phosphatase und Bilirubin]
Infektionen und Schädlinge: Clostridium difficile-assoziierter Durchfall
Stoffwechsel- und Ernährungsstörungen: Hypomagnesiämie, Hypokalzämie, Hypokaliämie [Warnhinweise und Vorsichtsmaßnahmen 5.9], Hyponatriämie, Hypoglykämie, Gewichtszunahme
Bewegungsapparat: Muskelschwäche, Myalgie, Muskelkrämpfe, Gelenkschmerzen, Beinschmerzen, Knochenbruch
Nervensystem/Psychiatrie: Psychiatrische und Schlafstörungen, einschließlich Depression, Erregung, Aggression, Halluzinationen, Verwirrtheit, Schlaflosigkeit, Nervosität, Apathie, Somnolenz, Angst und Traumanomalien; Zittern, Parästhesien; Schwindel
Atmung: Nasenbluten, Rachenschmerzen
Haut: Schwere allgemeine Hautreaktionen einschließlich toxischem SJS/TEN (einige mit tödlichem Ausgang), DRESS, AGEP, kutanem Lupus erythematodes und Erythema multiforme; Lichtempfindlichkeit; Urtikaria; Ausschlag; Hautentzündung; Juckreiz; Petechien; Purpura; Alopezie; trockene Haut; Hyperhidrose
Besondere Sinne: Tinnitus, Geschmacksperversion
Okular: Optikusatrophie, anteriore ischämische Optikusneuropathie, Optikusneuritis, Syndrom des trockenen Auges, Augenreizung, verschwommenes Sehen, Doppeltsehen
Urogenital: Interstitielle Nephritis, Hämaturie, Proteinurie, erhöhtes Serumkreatinin, mikroskopische Pyurie, Harnwegsinfektion, Glykosurie, häufiges Wasserlassen, Hodenschmerzen
Hämatologisch: Agranulozytose (einige mit tödlichem Ausgang), hämolytische Anämie, Panzytopenie, Neutropenie, Anämie, Thrombozytopenie, Leukopenie, Leukozytose
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die Tabellen 3 und 4 enthalten Arzneimittel mit klinisch bedeutsamen Arzneimittelwechselwirkungen und Wechselwirkungen mit Diagnostika bei gleichzeitiger Verabreichung mit Omeprazol sowie Anweisungen zu deren Vorbeugung oder Behandlung.
Konsultieren Sie die Kennzeichnung von gleichzeitig angewendeten Arzneimitteln, um weitere Informationen über Wechselwirkungen mit PPIs zu erhalten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Vorhandensein einer malignen Magenerkrankung
Bei Erwachsenen schließt das symptomatische Ansprechen auf die Therapie mit PRILOSEC das Vorliegen einer malignen Erkrankung des Magens nicht aus. Erwägen Sie zusätzliche Nachsorge und diagnostische Tests bei erwachsenen Patienten, die nach Abschluss der Behandlung mit einem PPI ein suboptimales Ansprechen oder einen frühen symptomatischen Rückfall zeigen. Ziehen Sie bei älteren Patienten auch eine Endoskopie in Betracht.
Akute tubulointerstitielle Nephritis
Akute tubulointerstitielle Nephritis (TIN) wurde bei Patienten beobachtet, die PPIs einnahmen, und kann zu jedem Zeitpunkt während der PPI-Therapie auftreten. Die Patienten können unterschiedliche Anzeichen und Symptome aufweisen, von symptomatischen Überempfindlichkeitsreaktionen bis hin zu unspezifischen Symptomen einer verminderten Nierenfunktion (z. B. Unwohlsein, Übelkeit, Anorexie). In gemeldeten Fallserien wurden einige Patienten bei der Biopsie und ohne extrarenale Manifestationen (z. B. Fieber, Hautausschlag oder Arthralgie) diagnostiziert. Setzen Sie PRILOSEC 40 mg ab und untersuchen Sie Patienten mit Verdacht auf akute TIN [siehe KONTRAINDIKATIONEN ].
Clostridium difficile-assoziierter Durchfall
Veröffentlichte Beobachtungsstudien deuten darauf hin, dass eine PPI-Therapie wie PRILOSEC mit einem erhöhten Risiko für Clostridium-difficile-assoziierte Diarrhoe verbunden sein kann, insbesondere bei Krankenhauspatienten. Diese Diagnose sollte bei Durchfall in Betracht gezogen werden, der sich nicht bessert [siehe NEBENWIRKUNGEN ].
Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist.
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln berichtet. Weitere spezifische Informationen zu antibakteriellen Wirkstoffen (Clarithromycin und Amoxicillin), die zur Verwendung in Kombination mit PRILOSEC indiziert sind, finden Sie in den Abschnitten „Warnhinweise und Vorsichtsmaßnahmen“ der entsprechenden Verschreibungsinformationen.
Knochenbruch
Mehrere veröffentlichte Beobachtungsstudien deuten darauf hin, dass die Therapie mit Protonenpumpenhemmern (PPI) mit einem erhöhten Risiko für osteoporosebedingte Frakturen der Hüfte, des Handgelenks oder der Wirbelsäule verbunden sein kann. Das Frakturrisiko war bei Patienten erhöht, die eine hohe Dosis, definiert als mehrere Tagesdosen, und eine PPI-Langzeittherapie (ein Jahr oder länger) erhielten. Die Patienten sollten die niedrigste Dosis und kürzeste Dauer der PPI-Therapie anwenden, die für die zu behandelnde Erkrankung geeignet ist. Patienten mit einem Risiko für osteoporosebedingte Frakturen sollten gemäß etablierten Behandlungsrichtlinien behandelt werden [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN ].
Schwere kutane Nebenwirkungen
Schwere kutane Nebenwirkungen, einschließlich Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN), Arzneimittelreaktionen mit Eosinophilie und systemischen Symptomen (DRESS) und akute generalisierte exanthematische Pustulose (AGEP) wurden im Zusammenhang mit der Anwendung von PPI berichtet [sehen NEBENWIRKUNGEN ]. Setzen Sie PRILOSEC bei den ersten Anzeichen oder Symptomen schwerer kutaner Nebenwirkungen oder anderer Anzeichen einer Überempfindlichkeit ab und erwägen Sie eine weitere Bewertung.
Kutaner und systemischer Lupus erythematodes
Kutaner Lupus erythematodes (CLE) und systemischer Lupus erythematodes (SLE) wurden bei Patienten berichtet, die PPI, einschließlich Omeprazol, einnahmen. Diese Ereignisse traten sowohl als Neubeginn als auch als Exazerbation einer bestehenden Autoimmunerkrankung auf. Die Mehrzahl der Fälle von PPI-induziertem Lupus erythematodes waren CLE.
Die häufigste Form von CLE, die bei mit PPI behandelten Patienten berichtet wurde, war subakuter CLE (SCLE) und trat innerhalb von Wochen bis Jahren nach kontinuierlicher medikamentöser Therapie bei Patienten auf, die von Säuglingen bis zu älteren Menschen reichten. Im Allgemeinen wurden histologische Befunde ohne Organbeteiligung beobachtet.
Systemischer Lupus erythematodes (SLE) wird seltener als CLE bei Patienten berichtet, die PPI erhalten. PPI-assoziierter SLE verläuft in der Regel milder als nicht medikamentös induzierter SLE. Der Beginn des SLE trat typischerweise innerhalb von Tagen bis Jahren nach Beginn der Behandlung auf, hauptsächlich bei Patienten, die von jungen Erwachsenen bis zu älteren Menschen reichten. Die Mehrheit der Patienten stellte sich mit Hautausschlag vor; jedoch wurden auch Arthralgie und Zytopenie berichtet.
Vermeiden Sie die Verabreichung von PPI länger als medizinisch angezeigt. Wenn bei Patienten, die PRILOSEC 10 mg erhalten, Anzeichen oder Symptome im Einklang mit CLE oder SLE festgestellt werden, ist das Medikament abzusetzen und der Patient zur Untersuchung an den entsprechenden Facharzt zu verweisen. Die meisten Patienten bessern sich nach Absetzen des PPI allein in 4 bis 12 Wochen. Serologische Tests (z. B. ANA) können positiv sein und es kann länger dauern, bis sich erhöhte serologische Testergebnisse auflösen als klinische Manifestationen.
Wechselwirkung mit Clopidogrel
Vermeiden Sie die gleichzeitige Anwendung von PRILOSEC 10 mg mit Clopidogrel. Clopidogrel ist ein Prodrug. Die Hemmung der Thrombozytenaggregation durch Clopidogrel ist vollständig auf einen aktiven Metaboliten zurückzuführen. Die Metabolisierung von Clopidogrel zu seinem aktiven Metaboliten kann durch die gleichzeitige Anwendung von Arzneimitteln wie Omeprazol, die die CYP2C19-Aktivität hemmen, beeinträchtigt werden. Die gleichzeitige Anwendung von Clopidogrel mit 80 mg Omeprazol verringert die pharmakologische Aktivität von Clopidogrel, selbst wenn es im Abstand von 12 Stunden verabreicht wird.
Ziehen Sie bei der Anwendung von PRILOSEC eine alternative Thrombozytenaggregationshemmung in Betracht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Cyanocobalamin (Vitamin B-12)-Mangel
Die tägliche Behandlung mit säureunterdrückenden Medikamenten über einen längeren Zeitraum (z. B. länger als 3 Jahre) kann zu einer durch Hypo- oder Achlorhydrie verursachten Malabsorption von Cyanocobalamin (Vitamin B-12) führen. In der Literatur wurde in seltenen Fällen über einen Cyanocobalamin-Mangel berichtet, der bei einer säureunterdrückenden Therapie auftrat. Diese Diagnose sollte erwogen werden, wenn bei Patienten, die mit PRILOSEC behandelt werden, klinische Symptome beobachtet werden, die mit einem Cyanocobalamin-Mangel einhergehen.
Hypomagnesiämie und Mineralstoffwechsel
Hypomagnesiämie, symptomatisch und asymptomatisch, wurde selten bei Patienten berichtet, die mindestens drei Monate lang mit PPI behandelt wurden, in den meisten Fällen nach einem Jahr Therapie. Schwerwiegende Nebenwirkungen sind Tetanie, Arrhythmien und Krampfanfälle. Hypomagnesiämie kann zu Hypokalzämie und/oder Hypokaliämie führen und bei Risikopatienten eine zugrunde liegende Hypokalzämie verschlimmern. Bei den meisten Patienten erforderte die Behandlung der Hypomagnesiämie eine Magnesiumsubstitution und das Absetzen des PPI.
Bei Patienten, die voraussichtlich über einen längeren Zeitraum behandelt werden oder die PPI zusammen mit Medikamenten wie Digoxin oder Arzneimitteln einnehmen, die eine Hypomagnesiämie verursachen können (z. B. Diuretika), kann medizinisches Fachpersonal erwägen, den Magnesiumspiegel vor Beginn der PPI-Behandlung und regelmäßig zu überwachen [siehe NEBENWIRKUNGEN ].
Bei Patienten mit vorbestehendem Risiko für Hypokalzämie (z. B. Hypoparathyreoidismus) sollten die Magnesium- und Calciumspiegel vor Beginn der Behandlung mit PRILOSEC und in regelmäßigen Abständen während der Behandlung überwacht werden. Bei Bedarf mit Magnesium und/oder Calcium ergänzen. Wenn die Hypokalzämie behandlungsresistent ist, sollten Sie erwägen, den PPI abzusetzen.
Wechselwirkung mit Johanniskraut oder Rifampin
Arzneimittel, die CYP2C19 oder CYP3A4 induzieren (z. B. Johanniskraut oder Rifampin), können die Omeprazol-Konzentration erheblich verringern [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Vermeiden Sie die gleichzeitige Anwendung von PRILOSEC mit Johanniskraut oder Rifampin.
Wechselwirkungen mit diagnostischen Untersuchungen für neuroendokrine Tumoren
Die Spiegel von Chromogranin A (CgA) im Serum steigen sekundär zu einer arzneimittelinduzierten Abnahme der Magensäure. Der erhöhte CgA-Spiegel kann bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen. Gesundheitsdienstleister sollten die Behandlung mit PRILOSEC 20 mg mindestens 14 Tage vor der Bestimmung der CgA-Spiegel vorübergehend abbrechen und eine Wiederholung des Tests in Betracht ziehen, wenn die anfänglichen CgA-Spiegel hoch sind. Wenn Reihentests durchgeführt werden (z. B. zur Überwachung), sollte dasselbe kommerzielle Labor für die Tests verwendet werden, da die Referenzbereiche zwischen den Tests variieren können [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wechselwirkung mit Methotrexat
Die Literatur legt nahe, dass die gleichzeitige Anwendung von PPI mit Methotrexat (hauptsächlich in hoher Dosis) die Serumspiegel von Methotrexat und/oder seines Metaboliten erhöhen und verlängern kann, was möglicherweise zu Methotrexat-Toxizitäten führt. Bei hochdosierter Gabe von Methotrexat kann bei einigen Patienten ein vorübergehendes Absetzen des PPI in Betracht gezogen werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fundusdrüsenpolypen
Die Anwendung von PPI ist mit einem erhöhten Risiko für Fundusdrüsenpolypen verbunden, das bei Langzeitanwendung zunimmt, insbesondere über ein Jahr hinaus. Die meisten PPI-Anwender, die Fundusdrüsenpolypen entwickelten, waren asymptomatisch und Fundusdrüsenpolypen wurden zufällig bei der Endoskopie identifiziert. Verwenden Sie die kürzeste Dauer der PPI-Therapie, die für die zu behandelnde Erkrankung geeignet ist.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Medikationsleitfaden und Gebrauchsanweisung ).
Akute tubulointerstitielle Nephritis
Weisen Sie den Patienten oder die Pflegekraft an, unverzüglich den Arzt des Patienten anzurufen, wenn bei ihm Anzeichen und/oder Symptome einer akuten tubulointerstitiellen Nephritis auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Clostridium difficile-assoziierter Durchfall
Weisen Sie den Patienten oder die Pflegekraft an, sofort den Arzt des Patienten anzurufen, wenn Durchfall auftritt, der sich nicht bessert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Knochenbruch
Weisen Sie den Patienten oder die Pflegekraft an, Frakturen, insbesondere der Hüfte, des Handgelenks oder der Wirbelsäule, dem medizinischen Betreuer des Patienten zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwere kutane Nebenwirkungen
Weisen Sie den Patienten oder die Pflegeperson an, PRILOSEC 40 mg abzusetzen und sich beim ersten Auftreten einer schweren Hautreaktion oder eines anderen Anzeichens einer Überempfindlichkeit an ihren Arzt zu wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kutaner und systemischer Lupus erythematodes
Weisen Sie den Patienten oder die Pflegekraft an, bei neuen oder sich verschlechternden Symptomen im Zusammenhang mit kutanem oder systemischem Lupus erythematodes unverzüglich den Arzt des Patienten anzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Cyanocobalamin (Vitamin B-12)-Mangel
Weisen Sie den Patienten oder die Pflegekraft an, alle klinischen Symptome, die mit einem Cyanocobalamin-Mangel in Zusammenhang stehen könnten, dem medizinischen Betreuer des Patienten zu melden, wenn sie PRILOSEC länger als 3 Jahre erhalten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypomagnesiämie und Mineralstoffwechsel
Weisen Sie den Patienten oder die Pflegekraft an, alle klinischen Symptome, die mit Hypomagnesiämie, Hypokalzämie und/oder Hypokaliämie verbunden sein können, dem medizinischen Betreuer des Patienten zu melden, wenn sie PRILOSEC für mindestens 3 Monate erhalten haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wechselwirkungen mit anderen Medikamenten
Raten Sie den Patienten, sich bei ihrem Arzt zu melden, wenn sie eine Behandlung mit Rilpivirin-haltigen Produkten, Clopidogrel, Johanniskraut oder Rifampin beginnen; oder, wenn sie hochdosiertes Methotrexat einnehmen [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verwaltung
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In zwei 24-monatigen Karzinogenitätsstudien an Ratten wurde Omeprazol in Tagesdosen von 1,7, 3,4, 13,8, 44,0 und 140,8 mg/kg/Tag (etwa das 0,4- bis 34-fache einer menschlichen Dosis von 40 mg/Tag, ausgedrückt auf einer Körperoberfläche) verabreicht Flächenbasis) bei männlichen und weiblichen Ratten dosisabhängig ECL-Zell-Karzinoide im Magen produzierten; die Inzidenz dieser Wirkung war deutlich höher bei weiblichen Ratten, die höhere Omeprazolspiegel im Blut aufwiesen. Magenkarzinoide treten bei unbehandelten Ratten selten auf. Außerdem war in allen behandelten Gruppen beiderlei Geschlechts eine ECL-Zellhyperplasie vorhanden. In einer dieser Studien wurden weibliche Ratten ein Jahr lang mit 13,8 mg Omeprazol/kg/Tag (etwa das 3,4-fache einer menschlichen Dosis von 40 mg/Tag, basierend auf der Körperoberfläche) behandelt und dann für ein weiteres Jahr ohne Omeprazol behandelt Arzneimittel. Bei diesen Ratten wurden keine Karzinoide beobachtet. Am Ende eines Jahres wurde eine erhöhte Inzidenz von behandlungsbedingter ECL-Zellhyperplasie beobachtet (94 % Behandelte vs. 10 % Kontrollen). Im zweiten Jahr war der Unterschied zwischen behandelten und Kontrollratten viel kleiner (46 % gegenüber 26 %), zeigte aber immer noch mehr Hyperplasie in der behandelten Gruppe. Bei einer Ratte (2 %) wurde ein Adenokarzinom des Magens beobachtet. Bei männlichen oder weiblichen Ratten, die zwei Jahre lang behandelt wurden, wurde kein ähnlicher Tumor beobachtet. Für diesen Rattenstamm wurde in der Vergangenheit kein ähnlicher Tumor festgestellt, aber ein Befund, der nur einen Tumor betrifft, ist schwer zu interpretieren. In einer 52-wöchigen Toxizitätsstudie an Sprague-Dawley-Ratten wurden Astrozytome im Gehirn bei einer kleinen Anzahl von Männchen gefunden, die Omeprazol in Dosierungen von 0,4, 2 und 16 mg/kg/Tag (etwa das 0,1- bis 3,9-fache der Humandosis) erhielten von 40 mg/Tag, bezogen auf die Körperoberfläche). In dieser Studie wurden bei weiblichen Ratten keine Astrozytome beobachtet. In einer 2-Jahres-Karzinogenitätsstudie an Sprague-Dawley-Ratten wurden bei Männchen oder Weibchen unter der hohen Dosis von 140,8 mg/kg/Tag (etwa das 34-fache der Humandosis von 40 mg/Tag, bezogen auf die Körperoberfläche) keine Astrozytome gefunden. . Eine 78-wöchige Karzinogenitätsstudie mit Omeprazol an Mäusen zeigte kein erhöhtes Auftreten von Tumoren, aber die Studie war nicht schlüssig. Eine 26-wöchige Kanzerogenitätsstudie mit p53 (+/-) transgenen Mäusen war nicht positiv.
Omeprazol war in einem In-vitro-Chromosomenaberrationstest an humanen Lymphozyten, in einem von zwei In-vivo-Maus-Mikrokerntests und in einem In-vivo-Chromosomenaberrationstest an Knochenmarkszellen positiv auf klastogene Wirkungen. Omeprazol war im In-vitro-Ames-Test, einem In-vitro-Maus-Lymphomzell-Vorwärtsmutationstest und einem In-vivo-Test auf DNA-Schäden an der Rattenleber negativ.
Es wurde festgestellt, dass Omeprazol in oralen Dosen von bis zu 138 mg/kg/Tag bei Ratten (etwa das 34-Fache einer oralen Dosis von 40 mg beim Menschen bezogen auf die Körperoberfläche) keine Auswirkungen auf die Fruchtbarkeit und Fortpflanzungsfähigkeit hat.
In 24-monatigen Karzinogenitätsstudien an Ratten wurde sowohl bei männlichen als auch bei weiblichen Tieren eine dosisabhängige signifikante Zunahme von Magenkarzinoiden und ECL-Zell-Hyperplasie beobachtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Karzinoide Tumoren wurden auch bei Ratten beobachtet, die einer Fundektomie oder Langzeitbehandlung mit anderen Protonenpumpenhemmern oder hohen Dosen von H2-Rezeptorantagonisten unterzogen wurden.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Es liegen keine ausreichenden und gut kontrollierten Studien mit Omeprazol bei Schwangeren vor. Die verfügbaren epidemiologischen Daten zeigen kein erhöhtes Risiko schwerer angeborener Fehlbildungen oder anderer unerwünschter Schwangerschaftsverläufe bei Anwendung von Omeprazol im ersten Trimenon. Reproduktionsstudien an Ratten und Kaninchen ergaben eine dosisabhängige Embryoletalität bei Omeprazol-Dosen, die etwa dem 3,4- bis 34-Fachen einer oralen Dosis von 40 mg beim Menschen entsprachen (basierend auf der Körperoberfläche einer 60 kg schweren Person).
Teratogenität wurde in Reproduktionsstudien an Tieren bei oraler Gabe von Esomeprazol (einem Enantiomer von Omeprazol) Magnesium an Ratten und Kaninchen während der Organogenese mit etwa 68-facher bzw. 42-facher Dosis einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol ( bezogen auf die Körperoberfläche einer 60 kg schweren Person).
Veränderungen der Knochenmorphologie wurden bei den Nachkommen von Ratten beobachtet, denen während des größten Teils der Trächtigkeit und Laktation Dosen verabreicht wurden, die mindestens dem 34-Fachen einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol entsprachen. Wenn die mütterliche Verabreichung nur auf die Trächtigkeit beschränkt war, gab es in keinem Alter Auswirkungen auf die Knochenphysenmorphologie bei den Nachkommen [siehe Daten ].
Die geschätzten Hintergrundrisiken schwerer Geburtsfehler und Fehlgeburten für die angegebene Population sind nicht bekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Daten
Menschliche Daten
Vier veröffentlichte epidemiologische Studien verglichen die Häufigkeit angeborener Anomalien bei Säuglingen von Frauen, die während der Schwangerschaft Omeprazol einnahmen, mit der Häufigkeit von Anomalien bei Säuglingen von Frauen, die H2-Rezeptor-Antagonisten oder anderen Kontrollpersonen ausgesetzt waren.
Eine bevölkerungsbezogene retrospektive epidemiologische Kohortenstudie des schwedischen medizinischen Geburtenregisters, die ungefähr 99 % der Schwangerschaften von 1995 bis 1999 abdeckte, berichtete über 955 Säuglinge (824 exponierte während des ersten Trimesters, 39 davon exponiert über das erste Trimester hinaus und 131 exponiert nach dem ersten Trimester), deren Mütter während der Schwangerschaft Omeprazol angewendet haben. Die Anzahl der Säuglinge, die in utero Omeprazol ausgesetzt waren und eine Fehlbildung, ein niedriges Geburtsgewicht, einen niedrigen Apgar-Score oder einen Krankenhausaufenthalt aufwiesen, war ähnlich der Anzahl, die in dieser Population beobachtet wurde. Die Zahl der mit Ventrikelseptumdefekten geborenen Säuglinge und die Zahl der totgeborenen Säuglinge war bei den Omeprazol-exponierten Säuglingen etwas höher als die erwartete Zahl in dieser Population.
Eine bevölkerungsbezogene retrospektive Kohortenstudie, die alle Lebendgeburten in Dänemark von 1996 bis 2009 abdeckte, berichtete über 1.800 Lebendgeburten, deren Mütter Omeprazol im ersten Trimenon der Schwangerschaft einnahmen, und 837.317 Lebendgeburten, deren Mütter keinen Protonenpumpenhemmer einnahmen. Die Gesamtrate von Geburtsfehlern bei Säuglingen von Müttern, die im ersten Trimenon Omeprazol ausgesetzt waren, betrug 2,9 % und 2,6 % bei Säuglingen von Müttern, die im ersten Trimenon keinem Protonenpumpenhemmer ausgesetzt waren.
Eine retrospektive Kohortenstudie berichtete über 689 schwangere Frauen, die im ersten Trimenon entweder H2-Blockern oder Omeprazol ausgesetzt waren (134 exponierte Omeprazol) und 1.572 schwangere Frauen, die im ersten Trimenon keinem der beiden ausgesetzt waren. Die Gesamtfehlbildungsrate bei Nachkommen, die von Müttern geboren wurden, die im ersten Trimenon Omeprazol, einem H2-Blocker, ausgesetzt waren, oder die nicht exponiert waren, betrug 3,6 %, 5,5 % bzw. 4,1 %.
Eine kleine prospektive beobachtende Kohortenstudie folgte 113 Frauen, die während der Schwangerschaft Omeprazol ausgesetzt waren (89 % mit Expositionen im ersten Trimester). Die gemeldete Rate schwerer angeborener Fehlbildungen betrug 4 % in der Omeprazol-Gruppe, 2 % bei Kontrollen, die nicht teratogenen Substanzen ausgesetzt waren, und 2,8 % bei Kontrollen mit Krankheitspaar. Die Raten spontaner und elektiver Abtreibungen, Frühgeburten, Gestationsalter bei der Geburt und mittleres Geburtsgewicht waren in den Gruppen ähnlich.
Mehrere Studien haben keine offensichtlichen kurzfristigen Nebenwirkungen auf den Säugling berichtet, wenn eine orale oder intravenöse Einzeldosis Omeprazol als Prämedikation für einen Kaiserschnitt unter Vollnarkose an über 200 schwangere Frauen verabreicht wurde.
Tierdaten
Omeprazol
Mit Omeprazol durchgeführte Reproduktionsstudien an Ratten in oralen Dosen von bis zu 138 mg/kg/Tag (etwa das 34-Fache einer oralen Dosis von 40 mg beim Menschen bezogen auf die Körperoberfläche) und an Kaninchen in Dosen von bis zu 69,1 mg/kg/Tag ( etwa das 34-fache einer oralen Humandosis von 40 mg auf Basis der Körperoberfläche) während der Organogenese ergaben keine Hinweise auf ein teratogenes Potenzial von Omeprazol. Bei Kaninchen führte Omeprazol in einem Dosisbereich von 6,9 bis 69,1 mg/kg/Tag (etwa das 3,4- bis 34-fache einer oralen Humandosis von 40 mg bezogen auf die Körperoberfläche) während der Organogenese zu einer dosisabhängigen Erhöhung der Embryoletalität. fötale Resorptionen und Schwangerschaftsstörungen. Bei Ratten wurden dosisabhängige embryo-/fötale Toxizität und postnatale Entwicklungstoxizität bei Nachkommen von Eltern beobachtet, die mit 13,8 bis 138,0 mg/kg/Tag Omeprazol behandelt wurden (etwa das 3,4- bis 34-fache einer oralen Humandosis von 40 mg auf einer Körperoberfläche). Flächenbasis), verabreicht vor der Paarung während der Laktationsperiode.
Esomeprazol
Die unten beschriebenen Daten stammen aus Studien mit Esomeprazol, einem Enantiomer von Omeprazol. Die Tier-zu-Mensch-Dosis-Multiples basieren auf der Annahme einer gleichen systemischen Exposition gegenüber Esomeprazol beim Menschen nach oraler Verabreichung von entweder 40 mg Esomeprazol oder 40 mg Omeprazol.
In Reproduktionsstudien mit Esomeprazol-Magnesium wurden bei Ratten in oralen Dosen von bis zu 280 mg/kg/Tag (etwa das 68-Fache einer oralen Humandosis von 40 mg bezogen auf die Körperoberfläche) oder bei Kaninchen keine Auswirkungen auf die embryofetale Entwicklung beobachtet orale Dosen von bis zu 86 mg/kg/Tag (etwa das 42-fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol auf Basis der Körperoberfläche), verabreicht während der Organogenese.
Eine prä- und postnatale Entwicklungstoxizitätsstudie an Ratten mit zusätzlichen Endpunkten zur Bewertung der Knochenentwicklung wurde mit Esomeprazol-Magnesium in oralen Dosen von 14 bis 280 mg/kg/Tag (etwa das 3,4- bis 68-Fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Esomeprazol) durchgeführt mg Omeprazol auf Basis der Körperoberfläche). Die neonatale/frühe postnatale (Geburt bis Entwöhnung) Überlebensrate war bei Dosen gleich oder größer als 138 mg/kg/Tag (etwa das 34-Fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol bezogen auf die Körperoberfläche) verringert. Körpergewicht und Körpergewichtszunahme waren reduziert und neurologische oder allgemeine Entwicklungsverzögerungen unmittelbar nach dem Absetzen waren bei Dosen gleich oder größer als 69 mg/kg/Tag (etwa das 17-fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Esomeprazol) offensichtlich mg Omeprazol auf Basis der Körperoberfläche). Darüber hinaus wurden bei Dosen von mindestens 14 mg/kg/Tag (etwa das 3,4-Fache einer oralen Dosis beim Menschen) eine verringerte Länge, Breite und Dicke des kortikalen Knochens des Femurs, eine verringerte Dicke der Tibia-Wachstumsfuge und eine minimale bis leichte Hypozellularität des Knochenmarks festgestellt Dosis von 40 mg Esomeprazol oder 40 mg Omeprazol pro Körperoberfläche). Physale Dysplasie im Femur wurde bei den Nachkommen von Ratten beobachtet, die mit oralen Dosen von Esomeprazol-Magnesium in Dosen von mindestens 138 mg/kg/Tag behandelt wurden (etwa das 34-fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol pro Körper). Flächenbasis).
Bei trächtigen und laktierenden Ratten wurden in der prä- und postnatalen Toxizitätsstudie Auswirkungen auf den mütterlichen Knochen beobachtet, wenn Esomeprazol-Magnesium in oralen Dosen von 14 bis 280 mg/kg/Tag verabreicht wurde (etwa das 3,4- bis 68-Fache einer oralen Dosis von 40 mg Esomeprazol beim Menschen). oder 40 mg Omeprazol pro Körperoberfläche). Wenn Ratten vom 7. Trächtigkeitstag bis zum Absetzen am 21. postnatalen Tag eine Dosis verabreicht wurde, wurde eine statistisch signifikante Abnahme des mütterlichen Femurgewichts von bis zu 14 % (im Vergleich zur Placebobehandlung) bei Dosen von 138 mg/kg/Tag oder mehr beobachtet (etwa das 34-fache einer oralen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol, bezogen auf die Körperoberfläche).
Eine prä- und postnatale Entwicklungsstudie an Ratten mit Esomeprazol-Strontium (unter Verwendung äquimolarer Dosen im Vergleich zur Studie mit Esomeprazol-Magnesium) ergab ähnliche Ergebnisse bei Muttertieren und Jungtieren wie oben beschrieben.
Mit Esomeprazol-Magnesium in oralen Dosen von 280 mg/kg/Tag (etwa das 68-Fache einer oralen Humandosis von 40 mg) wurde eine Folgestudie zur Entwicklungstoxizität an Ratten mit weiteren Zeitpunkten zur Bewertung der Knochenentwicklung der Welpen vom 2. Tag nach der Geburt bis zum Erwachsenenalter durchgeführt basierend auf der Körperoberfläche), wobei Esomeprazol entweder vom 7. oder 16. Schwangerschaftstag bis zur Geburt verabreicht wurde. Wenn die mütterliche Verabreichung nur auf die Trächtigkeit beschränkt war, gab es in keinem Alter Auswirkungen auf die Knochenphysenmorphologie der Nachkommen.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten deuten darauf hin, dass Omeprazol in der Muttermilch vorhanden sein könnte. Es liegen keine klinischen Daten zu den Wirkungen von Omeprazol auf den gestillten Säugling oder auf die Milchproduktion vor. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an PRILOSEC 40 mg und möglichen Nebenwirkungen von PRILOSEC 20 mg auf den gestillten Säugling oder aufgrund des zugrunde liegenden Zustands der Mutter berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von PRILOSEC 40 mg wurde bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren zur Behandlung von symptomatischer GERD, Behandlung von EE aufgrund von säurevermittelter GERD und Aufrechterhaltung der Heilung von EE aufgrund von säurevermittelter GERD nachgewiesen. Die Anwendung von PRILOSEC 10 mg in dieser Altersgruppe wird durch adäquate und gut kontrollierte Studien an Erwachsenen und unkontrollierte Studien zur Sicherheit, Wirksamkeit und Pharmakokinetik, die an pädiatrischen und jugendlichen Patienten durchgeführt wurden, gestützt [siehe KLINISCHE PHARMAKOLOGIE , Klinische Studien ].
Die Sicherheit und Wirksamkeit von PRILOSEC 10 mg wurde bei pädiatrischen Patienten im Alter von 1 Monat bis unter 1 Jahr zur Behandlung von EE aufgrund von säurevermittelter GERD nachgewiesen und wird durch angemessene und gut kontrollierte Studien an Erwachsenen und Sicherheit, Pharmakokinetik, und pharmakodynamische Studien, die an pädiatrischen Patienten durchgeführt wurden [siehe KLINISCHE PHARMAKOLOGIE ].
Bei Kindern und Jugendlichen wurden in der gesamten Altersgruppe (1 Monat bis 16 Jahre) häufig Nebenwirkungen der Atemwege berichtet. Otitis media wurde häufig in der Altersgruppe von 1 Monat bis NEBENWIRKUNGEN ].
Die Sicherheit und Wirksamkeit von PRILOSEC wurde nicht nachgewiesen bei:
Daten von Jungtieren
Es wurde gezeigt, dass Esomeprazol, ein Enantiomer von Omeprazol, das Körpergewicht, die Körpergewichtszunahme, das Femurgewicht, die Femurlänge und das Gesamtwachstum bei oralen Dosen von etwa dem 34- bis 68-Fachen einer täglichen Humandosis von 40 mg Esomeprazol oder 40 mg Omeprazol, bezogen auf den Körper, verringert Oberfläche in einer Toxizitätsstudie an juvenilen Ratten. Die Tier-zu-Mensch-Dosis-Multiples basieren auf der Annahme einer gleichen systemischen Exposition gegenüber Esomeprazol beim Menschen nach oraler Verabreichung von entweder 40 mg Esomeprazol oder 40 mg Omeprazol.
Eine 28-tägige Toxizitätsstudie mit einer 14-tägigen Erholungsphase wurde an juvenilen Ratten mit Esomeprazol-Magnesium in Dosen von 70 bis 280 mg/kg/Tag (etwa das 17- bis 68-fache einer täglichen oralen Humandosis von 40 mg Esomeprazol oder 40 mg) durchgeführt Omeprazol auf Basis der Körperoberfläche). Eine Zunahme der Todesfälle bei der hohen Dosis von 280 mg/kg/Tag wurde beobachtet, wenn juvenilen Ratten Esomeprazol-Magnesium vom 7. bis zum 35. postnatalen Tag verabreicht wurde. Tag (etwa das 34-fache einer oralen Tagesdosis von 40 mg Esomeprazol oder 40 mg Omeprazol beim Menschen, bezogen auf die Körperoberfläche), führte zu einer behandlungsbedingten Abnahme des Körpergewichts (ca Länge und beeinträchtigtes Gesamtwachstum. Vergleichbare, oben beschriebene Befunde wurden auch in dieser Studie mit einem anderen Esomeprazolsalz, Esomeprazol-Strontium, bei äquimolaren Dosen von Esomeprazol beobachtet.
Geriatrische Verwendung
Omeprazol wurde in klinischen Studien in den USA und Europa an über 2000 ältere Personen (≥ 65 Jahre) verabreicht. Es gab keine Unterschiede in der Sicherheit und Wirksamkeit zwischen älteren und jüngeren Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede in der Reaktion zwischen älteren und jüngeren Probanden festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Pharmakokinetische Studien haben gezeigt, dass die Eliminationsrate bei älteren Menschen etwas verringert und die Bioverfügbarkeit erhöht war. Die Plasmaclearance von Omeprazol betrug 250 ml/min (etwa die Hälfte der von jungen Probanden) und seine Plasmahalbwertszeit betrug im Durchschnitt eine Stunde, etwa das Doppelte der von jungen gesunden Probanden. Bei älteren Patienten ist jedoch keine Dosisanpassung erforderlich [vgl KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Bei Patienten mit eingeschränkter Leberfunktion (Child-Pugh-Klasse A, B oder C) war die Omeprazol-Exposition im Vergleich zu gesunden Probanden deutlich erhöht. Eine Dosisreduktion von PRILOSEC 10 mg auf 10 mg einmal täglich wird für Patienten mit eingeschränkter Leberfunktion zur Aufrechterhaltung der Heilung von EE empfohlen [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Asiatische Bevölkerung
In Studien mit gesunden Probanden hatten Asiaten eine ungefähr viermal höhere Exposition als Kaukasier. Eine Dosisreduktion von PRILOSEC 20 mg auf 10 mg einmal täglich wird für asiatische Patienten zur Aufrechterhaltung der Heilung von EE empfohlen [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es liegen Berichte über eine Überdosierung mit Omeprazol beim Menschen vor. Die Dosen reichten bis zu 2400 mg (das 120-fache der üblichen empfohlenen klinischen Dosis). Die Manifestationen waren unterschiedlich, umfassten jedoch Verwirrtheit, Schläfrigkeit, verschwommenes Sehen, Tachykardie, Übelkeit, Erbrechen, Diaphorese, Hitzewallungen, Kopfschmerzen, Mundtrockenheit und andere Nebenwirkungen, die denen ähnlich sind, die bei normaler klinischer Erfahrung beobachtet werden [siehe NEBENWIRKUNGEN ]. Die Symptome waren vorübergehend, und es wurden keine schwerwiegenden klinischen Folgen berichtet, wenn PRILOSEC 20 mg allein eingenommen wurde. Es ist kein spezifisches Antidot für eine Omeprazol-Überdosierung bekannt.
Omeprazol ist stark proteingebunden und daher nicht leicht dialysierbar. Im Falle einer Überdosierung sollte die Behandlung symptomatisch und unterstützend erfolgen.
Wenn es zu einer Überexposition kommt, rufen Sie Ihre Giftnotrufzentrale unter 1-800-222-1222 an, um aktuelle Informationen zum Umgang mit Vergiftungen oder Überdosierungen zu erhalten.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Omeprazol gehört zu einer Klasse antisekretorischer Verbindungen, den substituierten Benzimidazolen, die die Magensäuresekretion durch spezifische Hemmung des H+/K+-ATPase-Enzymsystems an der sekretorischen Oberfläche der Belegzellen des Magens unterdrücken. Da dieses Enzymsystem als Säure-(Protonen-)Pumpe innerhalb der Magenschleimhaut angesehen wird, wurde Omeprazol als Magensäurepumpenhemmer charakterisiert, indem es den letzten Schritt der Säureproduktion blockiert. Dieser Effekt ist dosisabhängig und führt unabhängig vom Stimulus zu einer Hemmung sowohl der basalen als auch der stimulierten Säuresekretion.
Pharmakodynamik
Antisekretorische Aktivität
Nach oraler Gabe setzt die antisekretorische Wirkung von Omeprazol innerhalb einer Stunde ein, wobei die maximale Wirkung innerhalb von zwei Stunden eintritt. Die Hemmung der Sekretion beträgt etwa 50 % des Maximums nach 24 Stunden und die Dauer der Hemmung dauert bis zu 72 Stunden. Die antisekretorische Wirkung hält daher viel länger an, als aufgrund der sehr kurzen Plasmahalbwertszeit (weniger als eine Stunde) zu erwarten wäre, offenbar aufgrund der verlängerten Bindung an das parietale H+/K+-ATPase-Enzym. Wenn das Medikament abgesetzt wird, kehrt die sekretorische Aktivität allmählich über 3 bis 5 Tage zurück. Die hemmende Wirkung von Omeprazol auf die Säuresekretion nimmt bei wiederholter einmal täglicher Gabe zu und erreicht nach vier Tagen ein Plateau.
Ergebnisse aus zahlreichen Studien zur antisekretorischen Wirkung von Mehrfachdosen von 20 mg und 40 mg Omeprazol bei gesunden Probanden und Patienten sind nachstehend aufgeführt. Der „Max“-Wert stellt Bestimmungen zum Zeitpunkt der maximalen Wirkung dar (2 bis 6 Stunden nach der Einnahme), während die „Min“-Werte jene 24 Stunden nach der letzten Omeprazol-Dosis sind.
Einmalige tägliche orale Dosen von Omeprazol im Bereich von 10 mg bis 40 mg haben bei einigen Patienten eine 100%ige Hemmung der intragastrischen 24-Stunden-Säure bewirkt.
Serum-Gastrin-Effekte
In Studien mit mehr als 200 Patienten stiegen die Gastrinspiegel im Serum während der ersten 1 bis 2 Wochen der einmal täglichen Gabe therapeutischer Dosen von Omeprazol parallel zur Hemmung der Säuresekretion an. Bei fortgesetzter Behandlung trat kein weiterer Anstieg des Serumgastrins auf. Im Vergleich zu Histamin-H2-Rezeptor-Antagonisten waren die medianen Anstiege bei Omeprazol-Dosen von 20 mg höher (1,3- bis 3,6-facher vs. 1,1- bis 1,8-facher Anstieg). Die Gastrin-Werte kehrten in der Regel innerhalb von 1 bis 2 Wochen nach Absetzen der Therapie auf die Werte vor der Behandlung zurück.
Erhöhtes Gastrin verursacht eine Enterochromaffin-ähnliche Zellhyperplasie und erhöhte Chromogranin A (CgA)-Spiegel im Serum. Die erhöhten CgA-Spiegel können bei diagnostischen Untersuchungen auf neuroendokrine Tumore zu falsch positiven Ergebnissen führen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Enterochromaffin-ähnliche (ECL) Zelleffekte
Menschliche Magenbiopsieproben wurden von mehr als 3000 Patienten (sowohl Kindern als auch Erwachsenen) erhalten, die in klinischen Langzeitstudien mit Omeprazol behandelt wurden. Die Inzidenz von ECL-Zellhyperplasie nahm in diesen Studien mit der Zeit zu; bei diesen Patienten wurde jedoch kein Fall von ECL-Zell-Karzinoiden, Dysplasie oder Neoplasie gefunden. Diese Studien sind jedoch von unzureichender Dauer und Größe, um den möglichen Einfluss einer Langzeitanwendung von Omeprazol auf die Entwicklung von prämalignen oder bösartigen Erkrankungen auszuschließen.
Andere Effekte
Systemische Wirkungen von Omeprazol im ZNS, kardiovaskulären und respiratorischen System wurden bisher nicht gefunden. Omeprazol, verabreicht in oralen Dosen von 30 oder 40 mg über 2 bis 4 Wochen, hatte keine Wirkung auf die Schilddrüsenfunktion, den Kohlenhydratstoffwechsel oder die zirkulierenden Spiegel von Parathormon, Cortisol, Estradiol, Testosteron, Prolaktin, Cholecystokinin oder Sekretin.
Nach einer Einzeldosis von 90 mg Omeprazol wurde keine Auswirkung der festen und flüssigen Bestandteile einer Testmahlzeit auf die Magenentleerung nachgewiesen. Bei gesunden Probanden hatte eine intravenöse Einzeldosis Omeprazol (0,35 mg/kg) keine Wirkung auf die Intrinsic-Factor-Sekretion. Beim Menschen wurde keine systematische dosisabhängige Wirkung auf die basale oder stimulierte Pepsinabgabe beobachtet.
Wenn der intragastrische pH-Wert jedoch bei 4,0 oder darüber gehalten wird, ist die basale Pepsinabgabe niedrig und die Pepsinaktivität verringert.
Wie andere Mittel, die den intragastrischen pH-Wert erhöhen, führte Omeprazol, das 14 Tage lang bei gesunden Probanden verabreicht wurde, zu einem signifikanten Anstieg der intragastrischen Konzentrationen lebensfähiger Bakterien. Das Muster der Bakterienspezies war gegenüber dem im Speichel üblichen Muster unverändert. Alle Veränderungen klangen innerhalb von drei Tagen nach Beendigung der Behandlung ab.
Der Verlauf des Barrett-Ösophagus wurde bei 106 Patienten in einer doppelblinden, kontrollierten US-Studie mit PRILOSEC 40 mg zweimal täglich für 12 Monate, gefolgt von 20 mg zweimal täglich für 12 Monate oder Ranitidin 300 mg zweimal täglich für 24 Monate untersucht. Es wurde keine klinisch signifikante Wirkung auf die Barrett-Schleimhaut durch eine antisekretorische Therapie beobachtet. Obwohl sich während der antisekretorischen Therapie ein neosquamöses Epithel entwickelte, wurde eine vollständige Beseitigung der Barrett-Mukosa nicht erreicht. Zwischen den Behandlungsgruppen wurde kein signifikanter Unterschied in der Entwicklung einer Dysplasie der Barrett-Schleimhaut beobachtet, und kein Patient entwickelte während der Behandlung ein Ösophaguskarzinom. Es wurden keine signifikanten Unterschiede zwischen den Behandlungsgruppen bei der Entwicklung von ECL-Zellhyperplasie, atrophischer Gastritis des Corpus, intestinaler Metaplasie des Corpus oder Dickdarmpolypen mit einem Durchmesser von mehr als 3 mm beobachtet.
Pharmakokinetik
Absorption
PRILOSEC 20 mg zur oralen Suspension mit verzögerter Wirkstofffreisetzung enthält Omeprazol-Magnesium-Granulat und inaktives Granulat zur Verabreichung in Wasser. Die Resorption von Omeprazol beginnt erst, nachdem das magensaftresistente Granulat den Magen verlassen hat. Die Pharmakokinetik von Omeprazol ist zeitabhängig, mit höheren Plasmakonzentrationen im Steady State im Vergleich zu nach einer Einzeldosis. Die systemische Exposition (AUC und Cmax) von Omeprazol nach einmal täglicher Gabe von 20 mg Suspension zum Einnehmen mit verzögerter Freisetzung über 5 Tage ist um 51 % bzw. 58 % höher als nach der ersten Dosis. Maximale Plasmakonzentrationen von Omeprazol nach wiederholter Gabe einer Suspension zum Einnehmen mit verzögerter Freisetzung treten innerhalb von 1,5 bis 2 Stunden auf. Bei gesunden Probanden beträgt die Plasmahalbwertszeit 0,5 bis 1 Stunde.
Verteilung
Die Proteinbindung beträgt etwa 95 %.
Beseitigung
Stoffwechsel
Omeprazol wird weitgehend durch das Cytochrom P450 (CYP)-Enzymsystem metabolisiert. Der Hauptteil seines Metabolismus hängt von dem polymorph exprimierten CYP2C19 ab, das für die Bildung von Hydroxyomeprazol, dem Hauptmetaboliten im Plasma, verantwortlich ist. Der verbleibende Teil ist abhängig von einer anderen spezifischen Isoform, CYP3A4, die für die Bildung von Omeprazolsulfon verantwortlich ist.
Ausscheidung
Nach oraler Gabe einer Einzeldosis einer gepufferten Lösung von Omeprazol wurde wenig oder gar kein unveränderter Wirkstoff mit dem Urin ausgeschieden. Der größte Teil der Dosis (ca. 77 %) wurde in Form von mindestens sechs Metaboliten im Urin ausgeschieden. Zwei wurden als Hydroxyomeprazol und die entsprechende Carbonsäure identifiziert. Der Rest der Dosis war im Kot nachweisbar. Dies impliziert eine signifikante biliäre Ausscheidung der Metaboliten von Omeprazol. Im Plasma wurden drei Metaboliten identifiziert, die Sulfid- und Sulfonderivate von Omeprazol und Hydroxyomeprazol. Diese Metaboliten haben sehr geringe oder keine antisekretorische Aktivität.
Kombinationstherapie mit Antibiotika
Omeprazol 40 mg täglich wurde in Kombination mit Clarithromycin 500 mg alle 8 Stunden an gesunde erwachsene männliche Probanden verabreicht. Die Steady-State-Plasmakonzentrationen von Omeprazol wurden durch die gleichzeitige Gabe von Clarithromycin erhöht (Anstieg von Cmax, AUC0-24 und T½ um 30 %, 89 % bzw. 34 %). Der beobachtete Anstieg der Omeprazol-Plasmakonzentration wurde mit den folgenden pharmakologischen Wirkungen in Verbindung gebracht. Der mittlere 24-Stunden-Magen-pH-Wert betrug bei alleiniger Gabe von Omeprazol und 5,7 bei gleichzeitiger Gabe von Clarithromycin.
Die Plasmakonzentrationen von Clarithromycin und 14-Hydroxy-Clarithromycin wurden durch die gleichzeitige Verabreichung von Omeprazol erhöht. Bei Clarithromycin war die mittlere Cmax um 10 % höher, die mittlere Cmin um 27 % höher und die mittlere AUC0-8 um 15 % höher, wenn Clarithromycin zusammen mit Omeprazol verabreicht wurde, als wenn Clarithromycin allein verabreicht wurde. Ähnliche Ergebnisse wurden für 14-Hydroxy-Clarithromycin beobachtet, die mittlere Cmax war um 45 % höher, die mittlere Cmin war um 57 % höher und die mittlere AUC0-8 war um 45 % höher. Clarithromycin-Konzentrationen im Magengewebe und Schleim wurden auch durch die gleichzeitige Gabe von Omeprazol erhöht.
Spezifische Populationen
Geriatrische Patienten
Bei älteren Patienten war die Eliminationsrate von Omeprazol etwas verringert und die Bioverfügbarkeit erhöht. Omeprazol war zu 76 % bioverfügbar, wenn gesunden älteren Probanden eine orale Einzeldosis von 40 mg Omeprazol (gepufferte Lösung) verabreicht wurde, gegenüber 58 % bei jungen Probanden, denen dieselbe Dosis verabreicht wurde. Nahezu 70 % der Dosis wurden als Metaboliten von Omeprazol im Urin wiedergefunden, und es wurde kein unveränderter Wirkstoff nachgewiesen. Die Plasmaclearance von Omeprazol betrug 250 ml/min (etwa die Hälfte der von jungen Probanden) und seine Plasmahalbwertszeit betrug im Durchschnitt eine Stunde, etwa das Doppelte der von jungen gesunden Probanden.
Pädiatrische Patienten
2 bis 16 Jahre alt
Die Pharmakokinetik von Omeprazol wurde bei pädiatrischen Patienten im Alter von 2 bis 16 Jahren untersucht:
Nach vergleichbaren mg/kg-Dosen von Omeprazol haben jüngere Kinder (im Alter von 2 bis 5 Jahren) niedrigere AUCs als Kinder im Alter von 6 bis 16 Jahren oder Erwachsene; Die AUCs der beiden letztgenannten Gruppen unterschieden sich nicht [vgl DOSIERUNG UND ANWENDUNG ].
1 bis 11 Monate alt
Ein populationspharmakokinetisches Modell wurde verwendet, um geeignete Dosen von PRILOSEC 40 mg bei pädiatrischen Patienten zu bestimmen
1 Monat bis unter 1 Jahr zur Behandlung (bis zu 6 Wochen) von erosiver Ösophagitis aufgrund von säurevermittelter GERD. Das Modell basierte auf Daten von 64 Kindern im Alter von 0,5 Monaten bis 16 Jahren. Bei Kindern unter 1 Jahr lagen nur begrenzte Daten vor. Omeprazol wurde den pädiatrischen Patienten in diesen Studien als orale Suspension verabreicht, die aus den Kapseln mit verzögerter Freisetzung hergestellt wurde. Kinderdosen wurden in der Altersgruppe von 1 bis 11 Monaten simuliert, um vergleichbare Omeprazol-Expositionen mit Erwachsenen nach einer Behandlung mit 20 mg einmal täglich zu erreichen [siehe DOSIERUNG UND ANWENDUNG ].
Rassen- oder ethnische Gruppen
[Sehen KLINISCHE PHARMAKOLOGIE ].
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit chronischer Nierenfunktionsstörung (Kreatinin-Clearance zwischen 10 und 62 ml/min/1,73 m²) war die Disposition von Omeprazol der von gesunden Probanden sehr ähnlich, obwohl die Bioverfügbarkeit leicht erhöht war. Da die Ausscheidung über den Urin ein Hauptweg der Ausscheidung von Omeprazol-Metaboliten ist, verlangsamte sich ihre Elimination proportional zur verringerten Kreatinin-Clearance. Diese Erhöhung der Bioverfügbarkeit wird nicht als klinisch bedeutsam angesehen.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit chronischer Lebererkrankung, klassifiziert als Child-Pugh-Klasse A (n = 3), B (n = 4) und C (n = 1), stieg die Bioverfügbarkeit im Vergleich zu gesunden Probanden auf etwa 100 % an, was eine verringerte First-pass-Rate widerspiegelt Wirkung, und die Plasmahalbwertszeit des Medikaments erhöhte sich auf fast 3 Stunden im Vergleich zu der Halbwertszeit bei gesunden Probanden von 0,5 bis 1 Stunde. Die Plasmaclearance betrug im Durchschnitt 70 ml/min, verglichen mit einem Wert von 500 bis 600 ml/min bei gesunden Probanden [vgl DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Arzneimittelwechselwirkungsstudien
Wirkung von Omeprazol auf andere Medikamente
Omeprazol ist ein zeitabhängiger Inhibitor von CYP2C19 und kann die systemische Exposition von gleichzeitig angewendeten Arzneimitteln, die CYP2C19-Substrate sind, erhöhen. Darüber hinaus erhöht die Verabreichung von Omeprazol den intragastrischen pH-Wert und kann die systemische Exposition bestimmter Arzneimittel verändern, die eine pH-abhängige Löslichkeit aufweisen.
Antiretrovirale Medikamente
Bei einigen antiretroviralen Arzneimitteln wie Rilpivirin, Atazanavir und Nelfinavir wurde bei gemeinsamer Gabe mit Omeprazol über verringerte Serumkonzentrationen berichtet [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Rilpivirin: Nach Mehrfachgabe von Rilpivirin (150 mg täglich) und Omeprazol (20 mg täglich) verringerte sich die AUC von Rilpivirin um 40 %, Cmax um 40 % und Cmin um 33 %.
Nelfinavir: Nach Mehrfachgabe von Nelfinavir (1250 mg, zweimal täglich) und Omeprazol (40 mg täglich) war die AUC für Nelfinavir und M8 um 36 % bzw. 92 %, Cmax um 37 % bzw. 89 % und Cmin um 39 % bzw. 75 % verringert .
Atazanavir: Nach mehrfacher Gabe von Atazanavir (400 mg täglich) und Omeprazol (40 mg täglich, 2 Stunden vor Atazanavir) verringerte sich die AUC um 94 %, die Cmax um 96 % und die Cmin um 95 %.
Saquinavir: Nach mehrfacher Gabe von Saquinavir/Ritonavir (1000/100 mg) zweimal täglich über 15 Tage zusammen mit täglich 40 mg Omeprazol an den Tagen 11 bis 15.
AUC war um 82 %, Cmax um 75 % und Cmin um 106 % erhöht. Der Mechanismus hinter dieser Wechselwirkung ist nicht vollständig aufgeklärt.
Clopidogrel
In einer klinischen Crossover-Studie wurde 72 gesunden Probanden 5 Tage lang Clopidogrel (300 mg Aufsättigungsdosis, gefolgt von 75 mg pro Tag) allein und zusammen mit Omeprazol (80 mg gleichzeitig mit Clopidogrel) verabreicht. Die Exposition gegenüber dem aktiven Metaboliten von Clopidogrel wurde um 46 % (Tag 1) und 42 % (Tag 5) verringert, wenn Clopidogrel und Omeprazol zusammen verabreicht wurden.
Die Ergebnisse einer anderen Crossover-Studie bei gesunden Probanden zeigten eine ähnliche pharmakokinetische Wechselwirkung zwischen Clopidogrel (300 mg Aufsättigungsdosis/75 mg tägliche Erhaltungsdosis) und Omeprazol 80 mg täglich bei gleichzeitiger Anwendung über 30 Tage. Die Exposition gegenüber dem aktiven Metaboliten von Clopidogrel wurde in diesem Zeitraum um 41 % bis 46 % reduziert.
In einer anderen Studie erhielten 72 gesunde Probanden die gleichen Dosen von Clopidogrel und 80 mg Omeprazol, aber die Medikamente wurden im Abstand von 12 Stunden verabreicht; die Ergebnisse waren ähnlich, was darauf hindeutet, dass die Verabreichung von Clopidogrel und Omeprazol zu unterschiedlichen Zeiten ihre Wechselwirkung nicht verhindert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mycophenolatmofetil
Die Verabreichung von 20 mg Omeprazol zweimal täglich über 4 Tage und einer Einzeldosis von 1000 mg MMF etwa eine Stunde nach der letzten Omeprazol-Dosis an 12 gesunde Probanden in einer Cross-Over-Studie führte zu einer Verringerung der Cmax um 52 % und um 23 % in der AUC von MPA [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Cilostazol
Omeprazol wirkt als Inhibitor von CYP2C19. Omeprazol, verabreicht in Dosen von 40 mg täglich für eine Woche an 20 gesunde Probanden in einer Crossover-Studie, erhöhte die Cmax und AUC von Cilostazol um 18 % bzw. 26 %. Cmax und AUC eines der aktiven Metaboliten, 3,4-Dihydro-Cilostazol, das die 4- bis 7-fache Aktivität von Cilostazol aufweist, waren um 29 % bzw. 69 % erhöht. Es ist zu erwarten, dass die gleichzeitige Anwendung von Cilostazol mit Omeprazol die Konzentrationen von Cilostazol und dem oben erwähnten aktiven Metaboliten erhöht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Diazepam
Die gleichzeitige Gabe von Omeprazol 20 mg einmal täglich und Diazepam 0,1 mg/kg intravenös verabreicht führte zu einer Abnahme der Clearance um 27 % und einer Verlängerung der Halbwertszeit von Diazepam um 36 % [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Digoxin
Die gleichzeitige Verabreichung von Omeprazol 20 mg einmal täglich und Digoxin bei gesunden Probanden erhöhte die Bioverfügbarkeit von Digoxin um 10 % (30 % bei zwei Probanden) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Wirkung anderer Medikamente auf Omeprazol
Voriconazol
Die gleichzeitige Verabreichung von Omeprazol und Voriconazol (einem kombinierten Inhibitor von CYP2C19 und CYP3A4) führte zu einer mehr als Verdopplung der Omeprazol-Exposition. Wenn Voriconazol (400 mg alle 12 Stunden für einen Tag, gefolgt von 200 mg einmal täglich für 6 Tage) zusammen mit Omeprazol (40 mg einmal täglich für 7 Tage) an gesunde Probanden gegeben wurde, waren Cmax und AUC0-24 von Omeprazol im Steady State signifikant erhöht: im Durchschnitt 2-mal (90 % KI: 1,8, 2,6) bzw. 4-mal (90 % KI: 3,3, 4,4) im Vergleich zu Omeprazol ohne Voriconazol [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Mikrobiologie
Die Doppeltherapie mit Omeprazol und Clarithromycin und die Dreifachtherapie mit Omeprazol, Clarithromycin und Amoxicillin haben sich in vitro und bei klinischen Infektionen als wirksam gegen die meisten Stämme von Helicobacter pylori erwiesen [siehe INDIKATIONEN UND VERWENDUNG , Klinische Studien ].
Helicobacter pylori
Empfindlichkeitstests von H. pylori-Isolaten wurden für Amoxicillin und Clarithromycin unter Verwendung der Agar-Verdünnungsmethode1 durchgeführt, und die minimalen Hemmkonzentrationen (MHK) wurden bestimmt.
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollmikroorganismen, um die technischen Aspekte der Laborverfahren zu kontrollieren.
Vorbehandlungswiderstand
Die Resistenzraten vor der Behandlung mit Clarithromycin betrugen 3,5 % (4/113) in den Studien mit Omeprazol/Clarithromycin-Doppeltherapie (4 und 5) und 9,3 % (41/439) in den Studien mit Omeprazol/Clarithromycin/Amoxicillin-Dreifachtherapie (1, 2 und 3).
Bei 99,3 % (436/439) der Patienten in den Omeprazol/Clarithromycin/Amoxicillin-Dreifachtherapie-Studien (1, 2 und 3) wurden gegenüber Amoxicillin vor der Behandlung empfindliche Isolate (≤ 0,25 μg/ml) gefunden. Minimale Hemmkonzentrationen (MHK) von Amoxicillin vor der Behandlung traten bei 0,7 % (3/439) der Patienten auf, die alle im Studienarm mit Clarithromycin und Amoxicillin waren. Ein Patient hatte eine unbestätigte minimale Amoxicillin-Hemmkonzentration (MHK) vor der Behandlung von > 256 μg/ml laut Etest®.
Patienten, die nach einer Omeprazol/Clarithromycin/Amoxicillin-Dreifachtherapie oder einer Omeprazol/Clarithromycin-Dualtherapie nicht von H. pylori eradiziert sind, werden wahrscheinlich Clarithromycin-resistente H. pylori-Isolate aufweisen. Daher sollte nach Möglichkeit ein Clarithromycin-Empfindlichkeitstest durchgeführt werden. Patienten mit Clarithromycin-resistentem H. pylori sollten nicht mit einer der folgenden Behandlungen behandelt werden: Omeprazol/Clarithromycin-Dualtherapie, Omeprazol/Clarithromycin/Amoxicillin-Dreifachtherapie oder andere Behandlungsschemata, die Clarithromycin als einziges antimikrobielles Mittel beinhalten.
Amoxicillin-Empfindlichkeitstestergebnisse und klinische/bakteriologische Ergebnisse
In den klinischen Studien zur Dreifachtherapie wurde H. pylori bei 84,9 % (157/185) der Patienten in der Omeprazol/Clarithromycin/Amoxicillin-Behandlungsgruppe, die vor der Behandlung Amoxicillin-empfindliche MHK (≤ 0,25 μg/ml) hatten, eradiziert und bei 15,1 % (28 /185) erfolglose Therapie. Von den 28 Patienten, bei denen die Triple-Therapie versagt hatte, hatten 11 nach der Behandlung keine Empfindlichkeitstestergebnisse und 17 hatten nach der Behandlung H. pylori-Isolate mit Amoxicillin-empfindlichen MICs. Elf der Patienten, bei denen die Dreifachtherapie fehlschlug, hatten nach der Behandlung H. pylori-Isolate mit Clarithromycin-resistenten MHK.
Empfindlichkeitstest für Helicobacter pylori
Informationen zu Empfindlichkeitstests zu Helicobacter pylori finden Sie im Abschnitt „Mikrobiologie“ in den Verschreibungsinformationen für Clarithromycin und Amoxicillin.
Auswirkungen auf die mikrobielle Ökologie des Magen-Darm-Trakts
Eine verringerte Magensäure aufgrund von Mitteln, einschließlich Protonenpumpenhemmern, erhöht die Zahl der Bakterien im Magen, die normalerweise im Magen-Darm-Trakt vorhanden sind. Die Behandlung mit Protonenpumpenhemmern kann zu einem leicht erhöhten Risiko für Magen-Darm-Infektionen wie Salmonellen und Campylobacter und bei Krankenhauspatienten möglicherweise auch für Clostridium difficile führen.
Pharmakogenomik
CYP2C19, ein polymorphes Enzym, ist am Metabolismus von Omeprazol beteiligt. Das CYP2C19*1-Allel ist voll funktionsfähig, während die CYP2C19*2- und *3-Allele nicht funktionsfähig sind. Es gibt andere Allele, die mit keiner oder reduzierter enzymatischer Funktion assoziiert sind. Patienten, die zwei voll funktionsfähige Allele tragen, sind schnelle Metabolisierer, und diejenigen, die zwei Loss-of-Function-Allele tragen, sind langsame Metabolisierer. Bei schnellen Metabolisierern wird Omeprazol hauptsächlich durch CYP2C19 metabolisiert.
Die systemische Exposition gegenüber Omeprazol variiert mit dem Stoffwechselstatus eines Patienten: langsame Metabolisierer > intermediäre Metabolisierer > schnelle Metabolisierer. Etwa 3 % der Kaukasier und 15 bis 20 % der Asiaten sind langsame CYP2C19-Metabolisierer.
In einer pharmakokinetischen Studie mit einer Einzeldosis von 20 mg Omeprazol war die AUC von Omeprazol bei asiatischen Probanden ungefähr viermal so hoch wie bei Kaukasiern [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Klinische Studien
Aktives Zwölffingerdarmgeschwür
In einer multizentrischen, doppelblinden, placebokontrollierten Studie mit 147 Patienten mit endoskopisch dokumentiertem Zwölffingerdarmgeschwür war der Prozentsatz der Patienten, die (gemäß Protokoll) nach 2 und 4 Wochen geheilt wurden, mit Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung 20 mg einmal täglich signifikant höher als mit Placebo (p ≤ 0,01).
Behandlung von aktivem Zwölffingerdarmgeschwür % der Patienten geheilt
Eine vollständige Schmerzlinderung tagsüber und nachts trat signifikant schneller (p ≤ 0,01) bei Patienten auf, die mit 20 mg Omeprazol-Magnesium-Retardkapseln behandelt wurden, als bei Patienten, die mit Placebo behandelt wurden. Am Ende der Studie hatten signifikant mehr Patienten, die Omeprazol-Magnesium-Retardkapseln erhalten hatten, eine vollständige Linderung der Tagesschmerzen (p ≤ 0,05) und Nachtschmerzen (p ≤ 0,01).
In einer multizentrischen, doppelblinden Studie mit 293 Patienten mit endoskopisch dokumentiertem Zwölffingerdarmgeschwür war der Prozentsatz der geheilten Patienten (gemäß Protokoll) nach 4 Wochen unter Omeprazol-Magnesium-Retardkapseln mit verzögerter Freisetzung 20 mg einmal täglich signifikant höher als unter Ranitidin 150 mg zweimal täglich ( p
Behandlung von aktivem Zwölffingerdarmgeschwür % der Patienten geheilt
Die Heilung erfolgte signifikant schneller bei Patienten, die mit Omeprazol-Magnesium-Retardkapseln behandelt wurden, als bei Patienten, die mit Ranitidin 150 mg zweimal täglich behandelt wurden (p
In einer ausländischen multinationalen randomisierten Doppelblindstudie mit 105 Patienten mit endoskopisch dokumentiertem Zwölffingerdarmgeschwür wurden 20 mg und 40 mg Omeprazol-Magnesium-Retardkapseln mit 150 mg Ranitidin zweimal täglich nach 2, 4 und 8 Wochen verglichen. Nach 2 und 4 Wochen waren beide Dosierungen von PRILOSEC 10 mg Ranitidin (pro Protokoll) statistisch überlegen, aber 40 mg waren 20 mg Omeprazol-Magnesium-Retardkapseln nicht überlegen, und nach 8 Wochen gab es keinen signifikanten Unterschied zwischen den beiden aktive Medikamente.
Behandlung von aktivem Zwölffingerdarmgeschwür % der Patienten geheilt
H. pylori-Eradikation bei Patienten mit Zwölffingerdarmgeschwüren
Dreifachtherapie (Omeprazol-Magnesium-Retardkapseln/Clarithromycin/Amoxicillin)
Drei randomisierte, doppelblinde klinische Studien in den USA bei Patienten mit H.-pylori-Infektion und Ulcus duodeni (n = 558) verglichen Omeprazol-Magnesium-Retardkapseln mit verzögerter Freisetzung plus Clarithromycin plus Amoxicillin mit Clarithromycin plus Amoxicillin. Zwei Studien (1 und 2) wurden bei Patienten mit einem aktiven Zwölffingerdarmgeschwür durchgeführt, und die andere Studie (3) wurde bei Patienten mit Zwölffingerdarmgeschwüren in der Vorgeschichte in den letzten 5 Jahren, aber ohne ein zum Zeitpunkt der Aufnahme bestehendes Zwölffingerdarmgeschwür durchgeführt . Das Dosierungsschema in den Studien war: Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung 20 mg zweimal täglich plus Clarithromycin 500 mg zweimal täglich plus Amoxicillin 1 g zweimal täglich für 10 Tage; oder Clarithromycin 500 mg zweimal täglich plus Amoxicillin 1 g zweimal täglich für 10 Tage. In den Studien 1 und 2 erhielten Patienten, die das Omeprazol-Schema einnahmen, zusätzlich 18 Tage lang einmal täglich 20 mg Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung. Die untersuchten Endpunkte waren die Eradikation von H. pylori und die Heilung von Zwölffingerdarmgeschwüren (nur Studien 1 und 2). Der H. pylori-Status wurde in allen drei Studien durch CLOtest®, Histologie und Kultur bestimmt. Bei einem bestimmten Patienten galt H. pylori als ausgerottet, wenn mindestens zwei dieser Tests negativ und keiner positiv war.
Die Kombination von Omeprazol plus Clarithromycin plus Amoxicillin war wirksam bei der Eradikation von H. pylori.
Duale Therapie (Omeprazol-Magnesium-Retardkapseln/Clarithromycin)
Vier randomisierte, doppelblinde, multizentrische Studien (4, 5, 6 und 7) untersuchten Omeprazol-Magnesium-Kapseln mit verzögerter Wirkstofffreisetzung 40 mg einmal täglich plus Clarithromycin 500 mg dreimal täglich für 14 Tage, gefolgt von Omeprazol-Magnesium-Retardkapseln Kapseln 20 mg einmal täglich (Studien 4, 5 und 7) oder durch Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung 40 mg einmal täglich (Studie 6) für weitere 14 Tage bei Patienten mit aktivem Zwölffingerdarmgeschwür in Verbindung mit H. pylori. Die Studien 4 und 5 wurden in den USA und Kanada durchgeführt und schlossen 242 bzw. 256 Patienten ein. H.-pylori-Infektion und Zwölffingerdarmgeschwür wurden bei 219 Patienten in Studie 4 und 228 Patienten in Studie 5 bestätigt. Diese Studien verglichen das Kombinationsschema mit Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung und Clarithromycin-Monotherapien. Die Studien 6 und 7 wurden in Europa durchgeführt und schlossen 154 bzw. 215 Patienten ein. H.-pylori-Infektion und Zwölffingerdarmgeschwür wurden bei 148 Patienten in Studie 6 und 208 Patienten in Studie 7 bestätigt. In diesen Studien wurde das Kombinationsschema mit einer Omeprazol-Monotherapie verglichen. Die Ergebnisse der Wirksamkeitsanalysen für diese Studien werden im Folgenden beschrieben. H. pylori-Eradikation wurde definiert als kein positiver Test (Kultur oder Histologie) 4 Wochen nach Ende der Behandlung, und zwei negative Tests waren erforderlich, um als H. pylori-eradiziert zu gelten. In der Per-Protocol-Analyse wurden die folgenden Patienten ausgeschlossen: Studienabbrecher, Patienten mit fehlenden H.-pylori-Tests nach der Behandlung und Patienten, die nicht auf H.-pylori-Eradikation untersucht wurden, weil bei ihnen am Ende der Behandlung ein Geschwür festgestellt wurde .
Die Kombination von Omeprazol und Clarithromycin war wirksam bei der Beseitigung von H. pylori.
Die Ulkusheilung war nicht signifikant unterschiedlich, wenn Clarithromycin zur Omeprazol-Therapie hinzugefügt wurde, verglichen mit der Omeprazol-Therapie allein.
Die Kombination von Omeprazol und Clarithromycin war wirksam bei der Eradikation von H. pylori und verringerte das Wiederauftreten von Zwölffingerdarmgeschwüren.
Aktives gutartiges Magengeschwür
In einer multizentrischen Doppelblindstudie in den USA mit einmal täglich 40 mg Omeprazol, einmal täglich 20 mg Omeprazol und Placebo bei 520 Patienten mit endoskopisch diagnostiziertem Magengeschwür wurden die folgenden Ergebnisse erzielt.
Behandlung von Magengeschwüren % der geheilten Patienten (alle behandelten Patienten)
Bei den stratifizierten Patientengruppen mit einer Geschwürgröße von kleiner oder gleich 1 cm wurde weder nach 4 noch nach 8 Wochen ein Unterschied in den Heilungsraten zwischen 40 mg und 20 mg festgestellt. Bei Patienten mit einer Geschwürgröße von mehr als 1 cm waren 40 mg nach 8 Wochen signifikant wirksamer als 20 mg.
In einer ausländischen, multinationalen, doppelblinden Studie mit 602 Patienten mit endoskopisch diagnostiziertem Magengeschwür wurden Omeprazol 40 mg einmal täglich, 20 mg einmal täglich und Ranitidin 150 mg zweimal täglich untersucht.
Behandlung von Magengeschwüren % der geheilten Patienten (alle behandelten Patienten)
Symptomatische GERD
In Skandinavien wurde eine placebokontrollierte Studie durchgeführt, um die Wirksamkeit von Omeprazol 20 mg oder 10 mg einmal täglich für bis zu 4 Wochen bei der Behandlung von Sodbrennen und anderen Symptomen bei GERD-Patienten ohne EE zu vergleichen. Die Ergebnisse sind unten gezeigt.
% erfolgreiches symptomatisches Ergebnis1
EE aufgrund von säurevermittelter GERD
In einer multizentrischen, doppelblinden, placebokontrollierten Studie in den USA mit 20 mg oder 40 mg Omeprazol-Magnesium-Retardkapseln bei Patienten mit Symptomen von GERD und endoskopisch diagnostizierter EE von Grad 2 oder höher waren die prozentualen Heilungsraten (pro Protokoll) wie folgt :
In dieser Studie war die 40-mg-Dosis der 20-mg-Dosis von Omeprazol-Magnesium-Retardkapseln in der prozentualen Heilungsrate nicht überlegen. Andere kontrollierte klinische Studien haben ebenfalls gezeigt, dass Omeprazol-Magnesium-Retardkapseln bei schwerer GERD wirksam sind. Im Vergleich mit Histamin-H2-Rezeptor-Antagonisten bei Patienten mit EE Grad 2 oder höher war Omeprazol-Magnesium-Retardkapseln in einer Dosis von 20 mg signifikant wirksamer als die aktiven Kontrollen. Eine vollständige Linderung von Sodbrennen tagsüber und nachts trat signifikant schneller (p
In dieser und fünf anderen kontrollierten GERD-Studien berichteten signifikant mehr Patienten, die 20 mg Omeprazol einnahmen (84 %), von einer vollständigen Linderung der GERD-Symptome als Patienten, die Placebo erhielten (12 %).
Aufrechterhaltung der Heilung von EE aufgrund von säurevermittelter GERD
In einer doppelblinden, randomisierten, multizentrischen, placebokontrollierten Studie in den USA wurden zwei Dosierungsschemata von Omeprazol-Magnesium-Retardkapseln bei Patienten mit endoskopisch bestätigter abgeheilter Ösophagitis untersucht. Die Ergebnisse zur Bestimmung der Aufrechterhaltung der Heilung von EE sind unten gezeigt.
Sterbetafelanalyse
In einer internationalen multizentrischen Doppelblindstudie wurden täglich 20 mg und 10 mg Omeprazol-Magnesium-Retardkapseln mit zweimal täglich 150 mg Ranitidin bei Patienten mit endoskopisch bestätigter abgeheilter Ösophagitis verglichen. Die folgende Tabelle enthält die Ergebnisse dieser Studie zur Aufrechterhaltung der Heilung von EE.
Sterbetafelanalyse
Bei Patienten, die anfänglich eine erosive Ösophagitis Grad 3 oder 4 hatten, waren zur Erhaltung nach Heilung 20 mg Omeprazol-Magnesium-Retardkapseln täglich wirksam, während 10 mg keine Wirksamkeit zeigten.
Pathologische hypersekretorische Zustände
In offenen Studien an 136 Patienten mit pathologischen hypersekretorischen Zuständen wie dem Zollinger-Ellison (ZE)-Syndrom mit oder ohne multiplen endokrinen Adenomen hemmten Omeprazol-Magnesium-Retardkapseln signifikant die Magensäuresekretion und kontrollierten die damit verbundenen Symptome von Durchfall, Anorexie und Schmerzen. Dosen im Bereich von 20 mg jeden zweiten Tag bis 360 mg pro Tag hielten die basale Säuresekretion bei Patienten ohne vorherige Magenoperation unter 10 mEq/h und bei Patienten mit vorheriger Magenoperation unter 5 mEq/h.
Die Anfangsdosen wurden auf die individuellen Bedürfnisse des Patienten titriert, und bei einigen Patienten waren im Laufe der Zeit Anpassungen erforderlich [siehe DOSIERUNG UND ANWENDUNG ]. Omeprazol-Magnesium-Retardkapseln wurden bei diesen hohen Dosierungen über längere Zeiträume (> 5 Jahre bei einigen Patienten) gut vertragen. Bei den meisten ZE-Patienten wurden die Gastrinspiegel im Serum nicht durch Omeprazol-Magnesium-Retardkapseln verändert. Allerdings stieg bei einigen Patienten das Gastrin im Serum auf Werte an, die höher waren als die, die vor Beginn der Omeprazol-Therapie vorhanden waren. Mindestens 11 Patienten mit ZE-Syndrom unter Langzeitbehandlung mit Omeprazol-Magnesium-Retardkapseln entwickelten Magenkarzinoide. Es wird angenommen, dass diese Befunde eine Manifestation der zugrunde liegenden Erkrankung sind, von der bekannt ist, dass sie mit solchen Tumoren assoziiert ist, und nicht das Ergebnis der Verabreichung von Omeprazol-Magnesium-Kapseln mit verzögerter Freisetzung [siehe NEBENWIRKUNGEN ].
Pädiatrische Studien zur Behandlung von symptomatischer GERD, Behandlung von EE aufgrund von säurevermittelter GERD und Aufrechterhaltung der Heilung von EE aufgrund von säurevermittelter GERD
Behandlung von symptomatischer GERD
Die Wirksamkeit von Omeprazol-Magnesium-Retardkapseln zur Behandlung der symptomatischen GERD bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren basiert zum Teil auf Daten, die bei 125 pädiatrischen Patienten in zwei unkontrollierten klinischen Studien erhoben wurden.
In die erste Studie wurden 12 pädiatrische Patienten im Alter von 1 bis 2 Jahren mit klinisch diagnostizierter GERD in der Vorgeschichte aufgenommen. Den Patienten wurde 8 Wochen lang eine Einzeldosis Omeprazol (0,5 mg/kg, 1 mg/kg oder 1,5 mg/kg) als offene Kapsel in 8,4 %iger Natriumbicarbonatlösung verabreicht. Fünfundsiebzig Prozent (9/12) der Patienten hatten Erbrechen/Regurgitationsepisoden, die gegenüber dem Ausgangswert um mindestens 50 % zurückgegangen waren.
Die zweite Studie umfasste 113 pädiatrische Patienten im Alter von 2 bis 16 Jahren mit einer Vorgeschichte von Symptomen, die auf eine symptomatische GERD hindeuten. Den Patienten wurde eine Einzeldosis Omeprazol (10 mg oder 20 mg, basierend auf dem Körpergewicht) über 4 Wochen entweder als intakte Kapsel oder als offene Kapsel in Apfelmus verabreicht. Erfolgreiches Ansprechen wurde definiert als keine mittelschweren oder schweren Episoden von schmerzbezogenen Symptomen oder Erbrechen/Aufstoßen während der letzten 4 Behandlungstage. Die Ergebnisse zeigten Erfolgsraten von 60 % (9/15; 10 mg Omeprazol) bzw. 59 % (58/98; 20 mg Omeprazol).
Behandlung von EE aufgrund von säurevermittelter GERD
In einer unkontrollierten, unverblindeten Dosistitrationsstudie zur Behandlung von EE bei pädiatrischen Patienten im Alter von 1 bis 16 Jahren waren Dosen im Bereich von 0,7 bis 3,5 mg/kg/Tag (80 mg/Tag) erforderlich. Dosen wurden mit 0,7 mg/kg/Tag begonnen. Die Dosen wurden in Schritten von 0,7 mg/kg/Tag erhöht (wenn der intraösophageale pH-Wert für weniger als 6 % einer 24-Stunden-Studie einen pH-Wert von
Aufrechterhaltung der Heilung von EE aufgrund von säurevermittelter GERD
In einer unkontrollierten, unverblindeten Studie zur Aufrechterhaltung der Heilung von EE bei 46 pädiatrischen Patienten im Alter von 1 bis 16 Jahren benötigten 54 % der Patienten die Hälfte der Heilungsdosis. Die restlichen Patienten erhöhten die Heilungsdosis (0,7 bis maximal 2,8 mg/kg/Tag) entweder für die gesamte Erhaltungsperiode oder kehrten vor Abschluss zur Hälfte der Dosis zurück. Von den 46 Patienten, die in die Erhaltungsphase eintraten, hatten 19 (41 %) während der Nachbeobachtung keinen Rückfall (Bereich 4 bis 25 Monate). Darüber hinaus führte die Erhaltungstherapie bei EE-Patienten dazu, dass 63 % der Patienten insgesamt keine Symptome aufwiesen.
VERWEISE
1. Clinical and Laboratory Standards Institute (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard – Zehnte Ausgabe. CLSI-Dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
INFORMATIONEN ZUM PATIENTEN
PRILOSEC® (pry-lo-sec) (Omeprazol-Magnesium) zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung
Was sind die wichtigsten Informationen, die ich über PRILOSEC wissen sollte?
PRILOSEC 10 mg kann bei Ihren säurebedingten Symptomen helfen, aber Sie könnten trotzdem ernsthafte Magenprobleme haben. Sprechen Sie mit Ihrem Arzt.
PRILOSEC kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Sprechen Sie mit Ihrem Arzt über Ihr Risiko für diese schwerwiegenden Nebenwirkungen. PRILOSEC 10 mg kann andere schwerwiegende Nebenwirkungen haben. Siehe „Was sind die möglichen Nebenwirkungen von PRILOSEC 20 mg?“
Was ist PRILOSEC 20 mg?
Ein verschreibungspflichtiges Medikament namens Protonenpumpenhemmer (PPI), das verwendet wird, um die Menge an Säure in Ihrem Magen zu reduzieren.
Bei Erwachsenen PRILOSEC 20mg wird verwendet für:
Bei Kindern im Alter von 1 bis 16 Jahren, PRILOSEC 20mg wird verwendet für:
Bei Kindern im Alter von 1 Monat bis unter 12 Monaten PRILOSEC 10 mg wird verwendet für:
Nehmen Sie PRILOSEC nicht ein, wenn Sie:
Informieren Sie vor der Einnahme von PRILOSEC 20 mg Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Wie sollte ich PRILOSEC 20 mg einnehmen?
Welche Nebenwirkungen kann PRILOSEC 40mg haben?
PRILOSEC kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Beenden Sie die Einnahme von PRILOSEC 20 mg und rufen Sie sofort Ihren Arzt an. Diese Symptome können das erste Anzeichen einer schweren Hautreaktion sein.
Zu den häufigsten Nebenwirkungen von PRILOSEC 40 mg bei Erwachsenen gehören: Kopfschmerzen, Bauchschmerzen, Übelkeit, Durchfall, Erbrechen und Blähungen.
Zu den häufigsten Nebenwirkungen von PRILOSEC bei Kindern im Alter von 1 bis 16 Jahren gehören: Infektion der oberen Atemwege, Fieber, Kopfschmerzen, Bauchschmerzen, Übelkeit, Durchfall, Erbrechen und Blähungen. Dies sind nicht alle möglichen Nebenwirkungen von PRILOSEC. Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich PRILOSEC 40 mg aufbewahren?
Lagern Sie PRILOSEC bei Raumtemperatur zwischen 20 °C und 25 °C (68 °F bis 77 °F).
Bewahren Sie PRILOSEC 20 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von PRILOSEC.
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie PRILOSEC nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie PRILOSEC 40 mg nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Arzt oder Apotheker um Informationen zu PRILOSEC 20 mg bitten, die für medizinisches Fachpersonal bestimmt sind.
Was sind die Inhaltsstoffe von PRILOSEC?
Wirkstoff: Omeprazol Magnesium
Inaktive Zutaten: Glycerylmonostearat, Hydroxypropylcellulose, Hypromellose, Magnesiumstearat, Methacrylsäurecopolymer C, Polysorbat, Zuckerkügelchen, Talk und Triethylcitrat sowie inaktive Granulate. Das inaktive Granulat besteht aus Citronensäure, Crospovidon, Dextrose, Hydroxypropylcellulose, Eisenoxid und Xanthangummi.
GEBRAUCHSANWEISUNG
PRILOSEC® (pry-lo-sec) (Omeprazol-Magnesium) zur Herstellung einer Suspension zum Einnehmen mit verzögerter Freisetzung
Einnahme von PRILOSEC 40 mg in Wasser:
Gabe von PRILOSEC mit Wasser durch eine nasogastrale (NG) Sonde oder eine Magensonde:
Personen mit einer NG-Sonde oder einer Magensonde der Größe 6 oder größer kann PRILOSEC wie folgt verabreicht werden:
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt