Zestoretic 5/12.5g/mg Lisinopril Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zestoretic und wie wird es angewendet?
Zestoretic ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Hypertonie (Bluthochdruck) und Flüssigkeitsretention. Zestoretic 5 mg kann allein oder mit anderen Medikamenten verwendet werden.
Es ist nicht bekannt, ob Zestoretic 5 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Zestoretic 5mg haben?
Zestoretic kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zestoretic gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zestoretic. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Fötale Toxizität
BEZEICHNUNG
ZESTORETIC® (Lisinopril und Hydrochlorothiazid) kombiniert einen Angiotensin-Converting-Enzym-Hemmer, Lisinopril, und ein Diuretikum, Hydrochlorothiazid.
Lisinopril, ein synthetisches Peptidderivat, ist ein oral einzunehmender Hemmer des Angiotensin-Converting-Enzyms. Es wird chemisch als (S)-1-[N2-(1-Carboxy-3-phenylpropyl)-L-lysyl]-L-prolin-Dihydrat beschrieben. Seine Summenformel ist C21H31N3O5 . 2H2O und seine Strukturformel lautet:
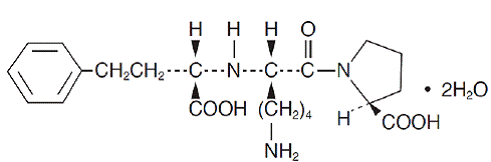
Lisinopril ist ein weißes bis cremefarbenes, kristallines Pulver mit einem Molekulargewicht von 441,53. Es ist wasserlöslich, in Methanol kaum löslich und in Ethanol praktisch unlöslich.
Hydrochlorothiazid ist 6-Chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Seine Summenformel ist C7H8ClN3O4S2 und seine Strukturformel ist:
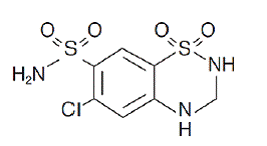
Hydrochlorothiazid ist ein weißes oder praktisch weißes, kristallines Pulver mit einem Molekulargewicht von 297,72, das in Wasser schwer löslich, aber in Natronlauge gut löslich ist.
ZESTORETIC 5 mg ist zur oralen Anwendung in drei Tablettenkombinationen von Lisinopril mit Hydrochlorothiazid erhältlich: ZESTORETIC 10-12,5 enthält 10 mg Lisinopril und 12,5 mg Hydrochlorothiazid; ZESTORETIC 20Referenz 12.5 mit 20 mg Lisinopril und 12,5 mg Hydrochlorothiazid; und ZESTORETIC 20-25 mit 20 mg Lisinopril und 25 mg Hydrochlorothiazid.
Inaktive Zutaten
10-12,5 Tabletten - Calciumphosphat, Magnesiumstearat, Mannit, rotes Eisenoxid, Maisstärke, gelbes Eisenoxid.
20-12,5 Tabletten - Calciumphosphat, Magnesiumstearat, Mannit, Maisstärke.
20-25 Tabletten – Calciumphosphat, Magnesiumstearat, Mannit, rotes Eisenoxid, Maisstärke, gelbes Eisenoxid.
INDIKATIONEN
ZESTORETIC ist angezeigt zur Behandlung von Bluthochdruck, um den Blutdruck zu senken. Die Senkung des Blutdrucks senkt das Risiko tödlicher und nicht tödlicher kardiovaskulärer Ereignisse, vor allem Schlaganfälle und Myokardinfarkte. Diese Vorteile wurden in kontrollierten Studien mit blutdrucksenkenden Arzneimitteln aus einer Vielzahl von pharmakologischen Klassen, einschließlich Lisinopril und Hydrochlorothiazid, beobachtet.
Die Kontrolle des Bluthochdrucks sollte Teil eines umfassenden kardiovaskulären Risikomanagements sein, einschließlich, soweit angemessen, Lipidkontrolle, Diabetesmanagement, antithrombotische Therapie, Raucherentwöhnung, Bewegung und begrenzte Natriumaufnahme. Viele Patienten benötigen mehr als 1 Medikament, um die Blutdruckziele zu erreichen. Spezifische Ratschläge zu Zielen und Management finden Sie in den veröffentlichten Richtlinien, wie denen des Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) des National High Blood Pressure Education Program.
In randomisierten kontrollierten Studien wurde gezeigt, dass zahlreiche Antihypertensiva aus einer Vielzahl von pharmakologischen Klassen und mit unterschiedlichen Wirkmechanismen die kardiovaskuläre Morbidität und Mortalität verringern, und es kann geschlussfolgert werden, dass es sich um eine Blutdrucksenkung und nicht um eine andere pharmakologische Eigenschaft handelt die Medikamente, die größtenteils für diese Vorteile verantwortlich sind. Der größte und beständigste Nutzen für das kardiovaskuläre Ergebnis war eine Verringerung des Schlaganfallrisikos, aber auch eine Verringerung des Myokardinfarkts und der kardiovaskulären Mortalität wurde regelmäßig beobachtet.
Ein erhöhter systolischer oder diastolischer Druck verursacht ein erhöhtes kardiovaskuläres Risiko, und der absolute Risikoanstieg pro mmHg ist bei höheren Blutdrucken größer, so dass selbst eine geringfügige Verringerung einer schweren Hypertonie einen erheblichen Nutzen bringen kann. Die Reduktion des relativen Risikos durch Blutdrucksenkung ist in Populationen mit unterschiedlichem absolutem Risiko ähnlich, sodass der absolute Nutzen bei Patienten größer ist, die unabhängig von ihrer Hypertonie einem höheren Risiko ausgesetzt sind (z. B. Patienten mit Diabetes oder Hyperlipidämie), und solche Patienten wären zu erwarten um von einer aggressiveren Behandlung zu einem niedrigeren Blutdruckziel zu profitieren.
Einige Antihypertensiva haben geringere Blutdruckwirkungen (als Monotherapie) bei Patienten mit schwarzer Hautfarbe, und viele Antihypertensiva haben zusätzliche zugelassene Indikationen und Wirkungen (z. B. bei Angina pectoris, Herzinsuffizienz oder diabetischer Nierenerkrankung). Diese Überlegungen können die Auswahl der Therapie leiten.
Diese Fixdosis-Kombinationen sind nicht für die Initialtherapie indiziert (vgl DOSIERUNG UND ANWENDUNG ).
Bei der Anwendung von ZESTORETIC sollte berücksichtigt werden, dass ein Hemmer des Angiotensin-Converting-Enzyms, Captopril, eine Agranulozytose verursacht hat, insbesondere bei Patienten mit eingeschränkter Nierenfunktion oder Kollagenose, und dass die verfügbaren Daten nicht ausreichen, um zu zeigen, dass Lisinopril keine a ähnliches Risiko (vgl WARNUNGEN ).
Bei der Erwägung der Anwendung von ZESTORETIC mg sollte beachtet werden, dass ACE-Hemmer mit einer höheren Rate von Angioödemen bei Patienten mit schwarzer Hautfarbe als bei Patienten mit nicht schwarzer Hautfarbe in Verbindung gebracht wurden (siehe WARNUNGEN , Lisinopril ).
DOSIERUNG UND ANWENDUNG
Lisinopril-Monotherapie ist eine wirksame Behandlung von Bluthochdruck in Dosen von 10 mg bis 80 mg einmal täglich, während Hydrochlorothiazid-Monotherapie in Dosen von 12,5 mg pro Tag bis 50 mg pro Tag wirksam ist. In klinischen Studien zur Lisinopril/Hydrochlorothiazid-Kombinationstherapie mit Lisinopril-Dosen von 10 mg bis 80 mg und Hydrochlorothiazid-Dosen von 6,25 mg bis 50 mg nahmen die antihypertensiven Ansprechraten im Allgemeinen mit zunehmender Dosis einer der beiden Komponenten zu.
Die Nebenwirkungen (vgl WARNUNGEN ) von Lisinopril sind im Allgemeinen selten und offenbar dosisunabhängig; die von Hydrochlorothiazid sind eine Mischung aus dosisabhängigen Phänomenen (hauptsächlich Hypokaliämie) und dosisunabhängigen Phänomenen (z. B. Pankreatitis), wobei erstere viel häufiger auftreten als letztere. Die Therapie mit jeder Kombination von Lisinopril und Hydrochlorothiazid kann mit einer oder beiden dosisunabhängigen oder dosisabhängigen Nebenwirkungen einhergehen, aber die Zugabe von Lisinopril in klinischen Studien dämpfte die normalerweise bei Diuretika beobachtete Hypokaliämie.
Um dosisabhängige Nebenwirkungen zu minimieren, ist es in der Regel angebracht, mit der Kombinationstherapie erst zu beginnen, nachdem ein Patient mit der Monotherapie nicht die gewünschte Wirkung erzielt hat.
Dosistitration nach klinischer Wirkung
Ein Patient, dessen Blutdruck weder mit Lisinopril noch mit Hydrochlorothiazid als Monotherapie ausreichend kontrolliert ist, kann je nach aktueller Monotherapiedosis auf Lisinopril/HCTZ 10/12,5 oder Lisinopril/HCTZ 20/12,5 umgestellt werden. Weitere Steigerungen einer oder beider Komponenten sollten vom klinischen Ansprechen abhängen, wobei der Blutdruck im Intervall zwischen den Dosierungen gemessen wird, um sicherzustellen, dass zu diesem Zeitpunkt eine angemessene antihypertensive Wirkung vorhanden ist. Die Hydrochlorothiazid-Dosis sollte im Allgemeinen erst nach 2 bis 3 Wochen erhöht werden. Nach Zugabe des Diuretikums kann es möglich sein, die Lisinopril-Dosis zu reduzieren. Patienten, deren Blutdruck mit 25 mg Hydrochlorothiazid täglich ausreichend kontrolliert werden kann, die jedoch einen signifikanten Kaliumverlust mit diesem Regime erfahren, können eine ähnliche oder bessere Blutdruckkontrolle ohne Elektrolytstörungen erreichen, wenn sie auf Lisinopril/HCTZ 10/12,5 umgestellt werden.
Bei Patienten, die derzeit mit einem Diuretikum behandelt werden, kann nach der Anfangsdosis von Lisinopril gelegentlich eine symptomatische Hypotonie auftreten. Das Diuretikum sollte, wenn möglich, zwei bis drei Tage vor Beginn der Therapie mit Lisinopril abgesetzt werden, um die Wahrscheinlichkeit einer Hypotonie zu verringern (siehe WARNUNGEN ). Wenn der Blutdruck des Patienten mit Lisinopril allein nicht kontrolliert werden kann, kann die diuretische Therapie wieder aufgenommen werden.
Wenn das Diuretikum nicht abgesetzt werden kann, sollte eine Anfangsdosis von 5 mg Lisinopril unter ärztlicher Aufsicht für mindestens zwei Stunden und bis zur Stabilisierung des Blutdrucks für mindestens eine weitere Stunde angewendet werden (siehe Abschnitt 4.4). WARNUNGEN und VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Die gleichzeitige Verabreichung von ZESTORETIC mit Kaliumpräparaten, Kaliumsalzersatzmitteln oder kaliumsparenden Diuretika kann zu einem Anstieg des Serumkaliums führen (siehe VORSICHTSMASSNAHMEN ).
Ersatztherapie
Die Kombination kann die titrierten Einzelkomponenten ersetzen.
Verwendung bei eingeschränkter Nierenfunktion
Therapieschemata mit Lisinopril/HCTZ müssen die Nierenfunktion nicht berücksichtigen, solange die Kreatinin-Clearance des Patienten > 30 ml/min/1,7 m2 beträgt (Serum-Kreatinin etwa ≤ 3 mg/dl oder 265 μmol/l). Bei Patienten mit schwerer Nierenfunktionsstörung werden Schleifendiuretika gegenüber Thiaziden bevorzugt, daher wird Lisinopril/HCTZ nicht empfohlen (siehe WARNUNGEN , Anaphylaktoide Reaktionen während der Membranexposition ).
WIE GELIEFERT
ZESTORETIC 10-12,5 Tabletten: Pfirsichfarbene, runde, bikonvexe, unbeschichtete Tabletten mit der Prägung „141“ auf der einen Seite und „ZESTORETIC“ auf der anderen Seite sind in Flaschen mit 90 Tabletten ( NDC 52427-435-90) und Flaschen mit 100 Tabletten ( NDC 52427-435-01).
Zestoretic 20-12,5 Tabletten : Weiße, runde, bikonvexe, unbeschichtete Tabletten mit der Prägung „142“ auf der einen Seite und „ZESTORETIC“ auf der anderen Seite sind in Flaschen mit 90 Tabletten erhältlich ( NDC 52427-436-90) und Flaschen mit 100 Tabletten ( NDC 52427-436-01).
Zestoretic 20-25 Tabletten Pfirsichfarbene, runde, bikonvexe, unbeschichtete Tabletten mit der Prägung „145“ auf der einen Seite und „ZESTORETIC“ auf der anderen Seite sind in Flaschen mit 90 Tabletten erhältlich ( NDC 52427-43790) und Flaschen mit 100 Tabletten ( NDC 52427-437-01).
Lagerung
Bei kontrollierter Raumtemperatur lagern, 20-25°C (68-77°F) [siehe USP]. Vor übermäßigem Licht und Feuchtigkeit schützen.
Vertrieb durch: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Überarbeitet: Juli 2017.
NEBENWIRKUNGEN
ZESTORETIC 12,5 gmg wurde bei 930 Patienten, darunter 100 Patienten, die 50 Wochen oder länger behandelt wurden, auf Sicherheit untersucht.
In klinischen Studien mit ZESTORETIC wurden keine für dieses Kombinationsarzneimittel typischen Nebenwirkungen beobachtet. Die aufgetretenen Nebenwirkungen beschränken sich auf diejenigen, die zuvor mit Lisinopril oder Hydrochlorothiazid berichtet wurden.
Die häufigsten klinischen Nebenwirkungen in kontrollierten Studien (einschließlich Open-Label-Verlängerungen) mit einer beliebigen Kombination von Lisinopril und Hydrochlorothiazid waren: Schwindel (7,5 %), Kopfschmerzen (5,2 %), Husten (3,9 %), Müdigkeit (3,7 %) und orthostatische Wirkungen (3,2 %), die alle häufiger auftraten als bei den mit Placebo behandelten Patienten. Im Allgemeinen waren negative Erfahrungen mild und vorübergehender Natur, aber sehen Sie WARNUNGEN bezüglich Angioödem und übermäßiger Hypotonie oder Synkope. Bei 4,4 % der Patienten war ein Therapieabbruch aufgrund von Nebenwirkungen erforderlich, hauptsächlich wegen Schwindel, Husten, Müdigkeit und Muskelkrämpfen.
Unerwünschte Erfahrungen, die bei mehr als einem Prozent der Patienten auftraten, die in kontrollierten klinischen Studien mit Lisinopril plus Hydrochlorothiazid behandelt wurden, sind unten aufgeführt.
Prozent der Patienten in kontrollierten Studien
Klinische Nebenwirkungen, die bei 0,3 % bis 1,0 % der Patienten in kontrollierten Studien auftraten, und seltenere, schwerwiegende, möglicherweise arzneimittelbedingte Ereignisse, über die in der Markterfahrung berichtet wurde, sind nachstehend aufgeführt:
Körper als Ganzes: Brustschmerzen, Bauchschmerzen, Synkope, Brustbeschwerden, Fieber, Trauma, Virusinfektion. Herz-Kreislauf: Herzklopfen, orthostatische Hypotonie. Verdauungs: Magen-Darm-Krämpfe, Mundtrockenheit, Verstopfung, Sodbrennen. Bewegungsapparat: Rückenschmerzen, Schulterschmerzen, Knieschmerzen, Rückenschmerzen, Myalgie, Fußschmerzen. Nervös/psychiatrisch: Verminderte Libido, Schwindel, Depression, Schläfrigkeit. Atmung: Erkältung, verstopfte Nase, Grippe, Bronchitis, Rachenschmerzen, Dyspnoe, Lungenstauung, chronische Sinusitis, allergische Rhinitis, Rachenbeschwerden. Haut: Flush, Pruritus, Hautentzündung, Diaphorese, kutanes Pseudolymphom. Besondere Sinne: Verschwommenes Sehen, Tinnitus, Ohrenschmerzen. Urogenital: Infektion der Harnwege.
Angioödem: Angioödeme des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze und/oder des Kehlkopfes wurden berichtet (siehe WARNUNGEN ).
In seltenen Fällen wurde nach Markteinführung über intestinales Angioödem berichtet.
Hypotonie: In klinischen Studien traten folgende Nebenwirkungen im Zusammenhang mit Hypotonie auf: Hypotonie (1,4 %), orthostatische Hypotonie (0,5 %), andere orthostatische Wirkungen (3,2 %). Außerdem traten bei 0,8 % der Patienten Synkopen auf (vgl WARNUNGEN ).
Husten: Sehen VORSICHTSMASSNAHMEN - Husten .
Klinische Labortestergebnisse
Serumelektrolyte
(Sehen VORSICHTSMASSNAHMEN ).
Kreatinin, Blut-Harnstoff-Stickstoff
Bei Patienten mit essenzieller Hypertonie, die mit ZESTORETIC behandelt wurden, wurden geringfügige reversible Anstiege des Blut-Harnstoff-Stickstoffs und des Serum-Kreatinins beobachtet. Es wurden auch deutlichere Anstiege berichtet, die eher bei Patienten mit Nierenarterienstenose auftraten (siehe VORSICHTSMASSNAHMEN ).
Serum-Harnsäure, Glukose, Magnesium, Cholesterin, Triglyceride und Calcium
(Sehen VORSICHTSMASSNAHMEN ).
Hämoglobin und Hämatokrit
Leichte Abnahmen von Hämoglobin und Hämatokrit (mittlere Abnahmen von etwa 0,5 g% bzw. 1,5 Vol.-%) traten häufig bei hypertensiven Patienten auf, die mit ZESTORETIC 5 mg behandelt wurden, waren aber selten von klinischer Bedeutung, es sei denn, es bestand gleichzeitig eine andere Ursache der Anämie. In klinischen Studien brachen 0,4 % der Patienten die Therapie wegen Anämie ab.
Leberfunktionstest
Selten sind Erhöhungen der Leberenzyme und/oder des Serumbilirubins aufgetreten. (Sehen WARNUNGEN , Leberversagen ).
Andere Nebenwirkungen, die mit den einzelnen Bestandteilen berichtet wurden, sind unten aufgeführt:
Lisinopril
In klinischen Studien wurden Nebenwirkungen, die unter Lisinopril auftraten, auch unter ZESTORETIC beobachtet. Darüber hinaus wurden seit der Markteinführung von Lisinopril die folgenden Nebenwirkungen im Zusammenhang mit Lisinopril berichtet und sollten als potenzielle Nebenwirkungen von ZESTORETIC betrachtet werden: Körper als Ganzes: Anaphylaktoide Reaktionen (vgl WARNUNGEN , Anaphylaktoide Reaktionen während der Membranexposition ), Unwohlsein, Ödeme, Gesichtsödeme, Schmerzen, Beckenschmerzen, Flankenschmerzen, Schüttelfrost; Herz-Kreislauf: Herzstillstand, Myokardinfarkt oder zerebrovaskulärer Zwischenfall, möglicherweise infolge einer übermäßigen Hypotonie bei Hochrisikopatienten (siehe WARNUNGEN , Hypotonie ), Lungenembolie und -infarkt, Verschlechterung der Herzinsuffizienz, Arrhythmien (einschließlich Tachykardie, ventrikuläre Tachykardie, atriale Tachykardie, Vorhofflimmern, Bradykardie und vorzeitige ventrikuläre Kontraktionen), Angina pectoris, transitorische ischämische Attacken, paroxysmale nächtliche Dyspnoe, erniedrigter Blutdruck, peripher Ödem, Vaskulitis; Verdauungs: Pankreatitis, Hepatitis (hepatozelluläre oder cholestatische Gelbsucht) (vgl WARNUNGEN , Leberversagen ), Gastritis, Anorexie, Blähungen, erhöhter Speichelfluss; Endokrin: Diabetes mellitus, unangemessene Sekretion des antidiuretischen Hormons; Hämatologisch: Seltene Fälle von Knochenmarkdepression, hämolytischer Anämie, Leukopenie/Neutropenie und Thrombozytopenie wurden berichtet, bei denen ein kausaler Zusammenhang mit Lisinopril nicht ausgeschlossen werden kann; Stoffwechsel: Gicht, Gewichtsverlust, Dehydrierung, Flüssigkeitsüberlastung, Gewichtszunahme; Bewegungsapparat: Arthritis, Arthralgie, Nackenschmerzen, Hüftschmerzen, Gelenkschmerzen, Beinschmerzen, Armschmerzen, Hexenschuss; Nervensystem/Psychiatrie: Ataxie, Gedächtnisstörungen, Tremor, Schlaflosigkeit, Schlaganfall, Nervosität, Verwirrtheit, periphere Neuropathie (z. B. Parästhesie, Dysästhesie), Krämpfe, Hypersomnie, Reizbarkeit; Stimmungsschwankungen (einschließlich depressiver Symptome); Halluzinationen; Atmung: Bösartige Lungenneoplasmen, Hämoptyse, Lungenödem, Lungeninfiltrate, Bronchospasmus, Asthma, Pleuraerguss, Pneumonie, eosinophile Pneumonitis, Keuchen, Orthopnoe, schmerzhafte Atmung, Epistaxis, Laryngitis, Sinusitis, Pharyngitis, Rhinitis, Rhinorrhö, Anomalien der Brustgeräusche; Haut: Urtikaria, Alopezie, Herpes zoster, Lichtempfindlichkeit, Hautläsionen, Hautinfektionen, Pemphigus, Erythem, Psoriasis, seltene Fälle anderer schwerer Hautreaktionen, einschließlich toxischer epidermaler Nekrolyse und Stevens-Johnson-Syndrom (kausaler Zusammenhang wurde nicht nachgewiesen); Besondere Sinne: Sehverlust, Diplopie, Photophobie, Geschmacksveränderung, Geruchsstörung; Urogenital: Akute Niereninsuffizienz, Oligurie, Anurie, Urämie, fortschreitende Azotämie, Nierenfunktionsstörung (vgl VORSICHTSMASSNAHMEN und DOSIERUNG UND ANWENDUNG ), Pyelonephritis, Dysurie, Brustschmerzen.
Sonstig
Es wurde über einen Symptomkomplex berichtet, der eine positive ANA, eine erhöhte Erythrozytensedimentationsrate, Arthralgie/Arthritis, Myalgie, Fieber, Vaskulitis, Eosinophilie und Leukozytose umfassen kann. Hautausschlag, Lichtempfindlichkeit oder andere dermatologische Manifestationen können allein oder in Kombination mit diesen Symptomen auftreten.
Hydrochlorothiazid
Körper als Ganzes: Die Schwäche; Verdauungs: Anorexie, Magenreizung, Krämpfe, Gelbsucht (intrahepatischer cholestatischer Ikterus) (vgl WARNUNGEN , Leberversagen ), Pankreatitis, Sialoadenitis, Verstopfung; Hämatologisch: Leukopenie, Agranulozytose, Thrombozytopenie, aplastische Anämie, hämolytische Anämie; Bewegungsapparat: Muskelkrampf; Nervensystem/Psychiatrie: Unruhe; Nieren: Nierenversagen, Nierenfunktionsstörung, interstitielle Nephritis (vgl WARNUNGEN ); Haut: Erythema multiforme einschließlich Stevens-Johnson-Syndrom, exfoliative Dermatitis einschließlich toxischer epidermaler Nekrolyse, Alopezie; Besondere Sinne: Xanthopsie; Überempfindlichkeit: Purpura, Lichtempfindlichkeit, Urtikaria, nekrotisierende Angiitis (Vaskulitis und kutane Vaskulitis), Atemnot einschließlich Pneumonitis und Lungenödem, anaphylaktische Reaktionen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Lisinopril
Hypotonie – Patienten unter diuretischer Therapie
Bei Patienten, die mit Diuretika behandelt werden, und insbesondere bei Patienten, bei denen vor kurzem eine diuretische Therapie begonnen wurde, kann es nach Beginn der Behandlung mit Lisinopril gelegentlich zu einer übermäßigen Blutdrucksenkung kommen. Die Möglichkeit blutdrucksenkender Wirkungen von Lisinopril kann minimiert werden, indem entweder das Diuretikum abgesetzt oder die Salzaufnahme vor Beginn der Behandlung mit Lisinopril erhöht wird. Wenn es notwendig ist, das Diuretikum fortzusetzen, beginnen Sie die Therapie mit Lisinopril in einer Dosis von 5 mg täglich und sorgen Sie nach der Anfangsdosis für mindestens zwei Stunden und bis zur Stabilisierung des Blutdrucks für mindestens eine weitere Stunde für eine engmaschige ärztliche Überwachung (siehe WARNUNGEN , und DOSIERUNG UND ANWENDUNG ). Wenn der Therapie eines Patienten, der Lisinopril erhält, ein Diuretikum hinzugefügt wird, wird normalerweise eine zusätzliche antihypertensive Wirkung beobachtet (siehe DOSIERUNG UND ANWENDUNG ).
Nicht-steroidale Entzündungshemmer einschließlich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer)
Bei älteren Patienten, Patienten mit Volumenmangel (einschließlich Patienten unter Diuretikatherapie) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von NSAIDs, einschließlich selektiver COX-2-Hemmer, mit ACE-Hemmern, einschließlich Lisinopril, zu einer Verschlechterung der Nierenfunktion führen , einschließlich möglicher akuter Niereninsuffizienz. Diese Effekte sind normalerweise reversibel. Überwachen Sie regelmäßig die Nierenfunktion bei Patienten, die eine Therapie mit Lisinopril und NSAR erhalten.
Die blutdrucksenkende Wirkung von ACE-Hemmern, einschließlich Lisinopril, kann durch NSAR abgeschwächt werden.
Duale Blockade des Renin-Angiotensin-Systems (RAS)
Die duale Blockade des RAS mit Angiotensinrezeptorblockern, ACE-Hemmern oder Aliskiren ist im Vergleich zur Monotherapie mit einem erhöhten Risiko für Hypotonie, Hyperkaliämie und Veränderungen der Nierenfunktion (einschließlich akutem Nierenversagen) verbunden.
In die VA NEPHRON-Studie wurden 1448 Patienten mit Typ-2-Diabetes, erhöhtem Urin-Albumin-Kreatinin-Verhältnis und verringerter geschätzter glomerulärer Filtrationsrate (GFR 30 bis 89,9 ml/min) aufgenommen, randomisiert zu Lisinopril oder Placebo vor dem Hintergrund einer Losartan-Therapie und anschließend weiterverfolgt sie für einen Median von 2,2 Jahren. Patienten, die die Kombination aus Losartan und Lisinopril erhielten, erzielten im Vergleich zur Monotherapie keinen zusätzlichen Nutzen für den kombinierten Endpunkt Abnahme der GFR, Nierenerkrankung im Endstadium oder Tod, zeigten jedoch eine erhöhte Inzidenz von Hyperkaliämie und akuter Nierenschädigung im Vergleich zur Monotherapiegruppe .
Im Allgemeinen ist die kombinierte Anwendung von RAS-Hemmern zu vermeiden, Blutdruck, Nierenfunktion und Elektrolyte bei Patienten unter ZESTORETIC und anderen Mitteln, die das RAS beeinflussen, genau zu überwachen.
Verabreichen Sie Aliskiren nicht gleichzeitig mit ZESTORETIC bei Patienten mit Diabetes. Vermeiden Sie die Anwendung von Aliskiren zusammen mit ZESTORETIC 5 mg bei Patienten mit eingeschränkter Nierenfunktion (GFR
Andere Agenten
Lisinopril wurde gleichzeitig mit Nitraten und/oder Digoxin ohne Hinweise auf klinisch signifikante unerwünschte Wechselwirkungen angewendet. Bei gleichzeitiger Anwendung von Lisinopril mit Propranolol, Digoxin oder Hydrochlorothiazid traten keine bedeutsamen klinisch bedeutsamen pharmakokinetischen Wechselwirkungen auf. Das Vorhandensein von Nahrung im Magen verändert die Bioverfügbarkeit von Lisinopril nicht.
Mittel zur Erhöhung des Serumkaliums
Lisinopril dämpft den durch Diuretika vom Thiazidtyp verursachten Kaliumverlust. Die Anwendung von Lisinopril mit kaliumsparenden Diuretika (z. B. Spironolacton, Eplerenon, Triamteren oder Amilorid), Kaliumpräparaten oder kaliumhaltigen Salzersatzmitteln kann zu einem signifikanten Anstieg des Serumkaliums führen. Wenn die gleichzeitige Anwendung dieser Arzneimittel aufgrund einer nachgewiesenen Hypokaliämie indiziert ist, sollten sie daher mit Vorsicht und unter häufiger Überwachung des Serumkaliums angewendet werden.
Lithium
Lithiumtoxizität wurde bei Patienten berichtet, die Lithium gleichzeitig mit Arzneimitteln erhielten, die eine Elimination von Natrium verursachen, einschließlich ACE-Hemmern. Die Lithiumtoxizität war in der Regel nach Absetzen von Lithium und dem ACE-Hemmer reversibel. Es wird empfohlen, die Lithiumspiegel im Serum häufig zu überwachen, wenn Lisinopril gleichzeitig mit Lithium verabreicht wird.
mTOR (mammalian Target Of Rapamycin)-Inhibitoren
Bei Patienten, die eine gleichzeitige Therapie mit ACE-Hemmern und mTOR-Hemmern (z. B. Temsirolimus, Sirolimus, Everolimus) erhalten, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem. (sehen WARNUNGEN )
Neprilysin-Inhibitoren
Bei Patienten, die gleichzeitig Neprilysin-Inhibitoren einnehmen, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem. (sehen WARNUNGEN )
Hydrochlorothiazid
Bei gleichzeitiger Verabreichung können die folgenden Arzneimittel mit Thiaziddiuretika interagieren.
Alkohol, Barbiturate oder Betäubungsmittel - Es kann zu einer Verstärkung der orthostatischen Hypotonie kommen.
Antidiabetika (orale Wirkstoffe und Insulin) - Eine Dosisanpassung des Antidiabetikums kann erforderlich sein.
Andere Antihypertensiva -Additive Wirkung oder Potenzierung.
Cholestyramin- und Colestipolharze -Die Resorption von Hydrochlorothiazid wird in Gegenwart von Anionenaustauscherharzen beeinträchtigt. Einzeldosen von entweder Cholestyramin- oder Colestipolharzen binden das Hydrochlorothiazid und reduzieren seine Resorption aus dem Gastrointestinaltrakt um bis zu 85 % bzw. 43 %.
Kortikosteroide, ACTH - verstärkter Elektrolytmangel, insbesondere Hypokaliämie.
Pressoramine (z. B. Norepinephrin) -Möglicherweise verringerte Reaktion auf Pressoramine, aber nicht ausreichend, um ihre Verwendung auszuschließen.
Skelettmuskelrelaxanzien, nicht depolarisierend (z. B. Tubocurarin) -mögliche erhöhte Reaktionsfähigkeit auf das Muskelrelaxans.
Lithium -sollten generell nicht zusammen mit Diuretika gegeben werden. Diuretika reduzieren die renale Clearance von Lithium und erhöhen das Risiko einer Lithiumtoxizität. Lesen Sie vor der Anwendung solcher Präparate mit ZESTORETIC die Packungsbeilage für Lithiumpräparate.
Nicht-steroidale entzündungshemmende Medikamente -Bei einigen Patienten kann die Verabreichung eines nichtsteroidalen Antirheumatikums die diuretische, natriuretische und blutdrucksenkende Wirkung von Schleifen-, kaliumsparenden und Thiaziddiuretika verringern. Daher sollte der Patient bei gleichzeitiger Anwendung von ZESTORETIC und nichtsteroidalen Antirheumatika engmaschig beobachtet werden, um festzustellen, ob die gewünschte Wirkung von ZESTORETIC 5 mg eintritt.
Gold
Nitritoidreaktionen (Symptome umfassen Gesichtsrötung, Übelkeit, Erbrechen und Hypotonie) wurden selten bei Patienten unter Therapie mit injizierbarem Gold (Natriumaurothiomalat) und gleichzeitiger Therapie mit ACE-Hemmern, einschließlich ZESTORETIC, berichtet.
WARNUNGEN
Lisinopril
Anaphylaktoide und möglicherweise verwandte Reaktionen
Da Angiotensin-Converting-Enzym-Hemmer vermutlich den Metabolismus von Eicosanoiden und Polypeptiden, einschließlich endogenem Bradykinin, beeinflussen, können bei Patienten, die ACE-Hemmer (einschließlich ZESTORETIC) erhalten, verschiedene Nebenwirkungen auftreten, von denen einige schwerwiegend sind.
Kopf-Hals-Angioödem
Bei Patienten, die mit Angiotensin-Converting-Enzym-Hemmern, einschließlich Lisinopril, behandelt wurden, wurde über Angioödeme des Gesichts, der Extremitäten, der Lippen, der Zunge, der Stimmritze und/oder des Kehlkopfes berichtet. Dies kann jederzeit während der Behandlung auftreten. ACE-Hemmer wurden mit einer höheren Rate von Angioödemen bei Patienten mit schwarzer Hautfarbe als bei Patienten mit nicht schwarzer Hautfarbe in Verbindung gebracht. ZESTORETIC 12,5 gmg sollte unverzüglich abgesetzt werden und es sollte eine geeignete Therapie und Überwachung erfolgen, bis eine vollständige und anhaltende Auflösung der Anzeichen und Symptome eingetreten ist. Selbst in Fällen, in denen nur die Zunge geschwollen ist, ohne Atemnot, können Patienten eine längere Beobachtung benötigen, da die Behandlung mit Antihistaminika und Kortikosteroiden möglicherweise nicht ausreicht. Sehr selten wurde über Todesfälle aufgrund von Angioödemen in Verbindung mit Kehlkopfödemen oder Zungenödemen berichtet. Bei Patienten mit Beteiligung der Zunge, Glottis oder des Kehlkopfes ist mit hoher Wahrscheinlichkeit eine Obstruktion der Atemwege zu beobachten, insbesondere bei Patienten mit Atemwegsoperationen in der Vorgeschichte. Bei Beteiligung von Zunge, Glottis oder Kehlkopf, die wahrscheinlich eine Obstruktion der Atemwege verursacht, sollten umgehend subkutane Epinephrinlösung 1:1000 (0,3 ml bis 0,5 ml) und/oder Maßnahmen ergriffen werden, um einen freien Atemweg zu gewährleisten (siehe NEBENWIRKUNGEN). .
Bei Patienten, die gleichzeitig mit einem ACE-Hemmer und einem mTOR-Hemmer (mammalian target of rapamycin) (z. B. Temsirolimus, Sirolimus, Everolimus) oder einem Neprilysin-Hemmer behandelt werden, besteht möglicherweise ein erhöhtes Risiko für ein Angioödem (siehe Abschnitt 4.4). VORSICHTSMASSNAHMEN ).
Darm-Angioödem
Bei Patienten, die mit ACE-Hemmern behandelt wurden, wurde über intestinales Angioödem berichtet. Diese Patienten zeigten Bauchschmerzen (mit oder ohne Übelkeit oder Erbrechen); in manchen Fällen gab es in der Vorgeschichte kein faziales Angioödem und die C-1-Esterasespiegel waren normal. Das Angioödem wurde durch Verfahren wie Bauch-CT oder Ultraschall oder bei einer Operation diagnostiziert, und die Symptome verschwanden nach dem Absetzen des ACE-Hemmers. Intestinale Angioödeme sollten in die Differentialdiagnose von Patienten mit ACE-Hemmern einbezogen werden, die sich mit Bauchschmerzen vorstellen.
Patienten mit Angioödem in der Anamnese, die nicht mit einer ACE-Hemmer-Therapie in Zusammenhang stehen, können während der Behandlung mit einem ACE-Hemmer ein erhöhtes Risiko für ein Angioödem haben (siehe INDIKATIONEN und KONTRAINDIKATIONEN ).
Anaphylaktoide Reaktionen während der Desensibilisierung
Zwei Patienten, die sich einer desensibilisierenden Behandlung mit Hymenopterengift unterzogen, während sie ACE-Hemmer erhielten, erlitten lebensbedrohliche anaphylaktoide Reaktionen.
Bei denselben Patienten wurden diese Reaktionen vermieden, wenn ACE-Hemmer vorübergehend abgesetzt wurden, aber sie traten bei einer versehentlichen erneuten Provokation wieder auf.
Anaphylaktoide Reaktionen während der Membranexposition
Thiazidhaltige Kombinationspräparate werden bei Patienten mit schwerer Nierenfunktionsstörung nicht empfohlen. Plötzliche und potenziell lebensbedrohliche anaphylaktoide Reaktionen wurden bei einigen Patienten berichtet, die mit High-Flux-Membranen (z. B. AN69®**) dialysiert und gleichzeitig mit einem ACE-Hemmer behandelt wurden. Bei solchen Patienten muss die Dialyse sofort abgebrochen und eine aggressive Therapie gegen anaphylaktoide Reaktionen eingeleitet werden. Die Symptome wurden in diesen Situationen durch Antihistaminika nicht gelindert. Bei diesen Patienten sollte die Anwendung einer anderen Art von Dialysemembran oder einer anderen Klasse von Antihypertensiva in Betracht gezogen werden. Anaphylaktoide Reaktionen wurden auch bei Patienten berichtet, die sich einer Low-Density-Lipoprotein-Apherese mit Dextransulfat-Absorption unterzogen.
Hypotonie und verwandte Effekte
Übermäßige Hypotonie wurde selten bei Patienten mit unkompliziertem Bluthochdruck beobachtet, ist aber eine mögliche Folge der Anwendung von Lisinopril bei Personen mit Salz-/Volumenmangel, wie z WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und NEBENWIRKUNGEN ).
Synkopen wurden bei 0,8 Prozent der mit ZESTORETIC behandelten Patienten berichtet. Bei Patienten mit Bluthochdruck, die Lisinopril allein erhielten, lag die Inzidenz von Synkopen bei 0,1 Prozent. Die Gesamtinzidenz von Synkopen kann durch die richtige Titration der einzelnen Komponenten reduziert werden (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , NEBENWIRKUNGEN und DOSIERUNG UND ANWENDUNG ).
Bei Patienten mit schwerer dekompensierter Herzinsuffizienz mit oder ohne begleitender Niereninsuffizienz wurde eine übermäßige Hypotonie beobachtet, die mit Oligurie und/oder fortschreitender Azotämie und selten mit akutem Nierenversagen und/oder Tod einhergehen kann. Wegen des möglichen Blutdruckabfalls bei diesen Patienten sollte die Therapie unter sehr engmaschiger ärztlicher Überwachung begonnen werden. Solche Patienten sollten in den ersten beiden Behandlungswochen und immer dann, wenn die Dosis von Lisinopril und/oder Diuretikum erhöht wird, engmaschig überwacht werden. Ähnliche Erwägungen gelten für Patienten mit ischämischer Herzkrankheit oder zerebrovaskulärer Erkrankung, bei denen ein übermäßiger Blutdruckabfall zu einem Myokardinfarkt oder einem Schlaganfall führen könnte.
Wenn eine Hypotonie auftritt, sollte der Patient in Rückenlage gebracht werden und, falls erforderlich, eine intravenöse Infusion mit normaler Kochsalzlösung erhalten. Eine vorübergehende hypotensive Reaktion ist keine Kontraindikation für weitere Dosen, die normalerweise problemlos verabreicht werden können, sobald der Blutdruck nach Volumenexpansion angestiegen ist.
Leukopenie/Neutropenie/Agranulozytose
Ein anderer Hemmer des Angiotensin-Converting-Enzyms, Captopril, verursacht nachweislich Agranulozytose und Knochenmarksdepression, selten bei unkomplizierten Patienten, aber häufiger bei Patienten mit eingeschränkter Nierenfunktion, insbesondere wenn sie auch eine Kollagenose haben. Die verfügbaren Daten aus klinischen Studien mit Lisinopril reichen nicht aus, um zu zeigen, dass Lisinopril keine Agranulozytose mit ähnlichen Häufigkeiten verursacht. Die Markterfahrung hat seltene Fälle von Leukopenie/Neutropenie und Knochenmarkdepression gezeigt, bei denen ein kausaler Zusammenhang mit Lisinopril nicht ausgeschlossen werden kann. Eine regelmäßige Überwachung der Leukozytenzahl bei Patienten mit Kollagenose und Nierenerkrankungen sollte in Erwägung gezogen werden.
Leberversagen
Selten wurden ACE-Hemmer mit einem Syndrom in Verbindung gebracht, das mit cholestatischer Gelbsucht oder Hepatitis beginnt und zu einer fulminanten hepatischen Nekrose und (manchmal) zum Tod fortschreitet. Der Mechanismus dieses Syndroms ist nicht verstanden. Patienten, die ACE-Hemmer erhalten und eine Gelbsucht oder deutliche Erhöhungen der Leberenzymwerte entwickeln, sollten den ACE-Hemmer absetzen und eine angemessene medizinische Nachsorge erhalten.
Fötale Toxizität
Schwangerschaftskategorie D
Die Einnahme von Arzneimitteln, die während des zweiten und dritten Trimenons der Schwangerschaft auf das Renin-Angiotensin-System wirken, verringert die fetale Nierenfunktion und erhöht die fötale und neonatale Morbidität und den Tod. Das resultierende Oligohydramnion kann mit fetaler Lungenhypoplasie und Skelettdeformationen einhergehen. Mögliche Nebenwirkungen bei Neugeborenen sind Schädelhypoplasie, Anurie, Hypotonie, Nierenversagen und Tod. Wenn eine Schwangerschaft festgestellt wird, setzen Sie ZESTORETIC so schnell wie möglich ab. Diese unerwünschten Wirkungen sind normalerweise mit der Anwendung dieser Arzneimittel im zweiten und dritten Trimenon der Schwangerschaft verbunden. Die meisten epidemiologischen Studien, die fötale Anomalien nach Anwendung von Antihypertensiva im ersten Trimenon untersuchten, haben Arzneimittel, die das Renin-Angiotensin-System beeinflussen, nicht von anderen Antihypertonika unterschieden. Eine angemessene Behandlung der mütterlichen Hypertonie während der Schwangerschaft ist wichtig, um die Ergebnisse für Mutter und Fötus zu optimieren.
In dem ungewöhnlichen Fall, dass es für einen bestimmten Patienten keine geeignete Alternative zu einer Therapie mit Arzneimitteln gibt, die das Renin-Angiotensin-System beeinflussen, informieren Sie die Mutter über das potenzielle Risiko für den Fötus. Führen Sie serielle Ultraschalluntersuchungen durch, um die intraamniotische Umgebung zu beurteilen. Wenn Oligohydramnion beobachtet wird, ist ZESTORETIC abzusetzen, es sei denn, es wird als lebensrettend für die Mutter angesehen. Abhängig von der Schwangerschaftswoche kann ein fetaler Test angebracht sein. Patienten und Ärzte sollten sich jedoch darüber im Klaren sein, dass Oligohydramnion möglicherweise erst auftritt, nachdem der Fötus eine irreversible Verletzung erlitten hat. Beobachten Sie Säuglinge, die ZESTORETIC in der Vorgeschichte in utero ausgesetzt waren, genau auf Hypotonie, Oligurie und Hyperkaliämie. (Sehen VORSICHTSMASSNAHMEN, pädiatrische Verwendung ).
In Studien an trächtigen Ratten, Mäusen und Kaninchen wurden keine teratogenen Wirkungen von Lisinopril beobachtet. Auf mg/kg-Basis betrugen die verwendeten Dosen das bis zu 625-fache (bei Mäusen), 188-fache (bei Ratten) und 0,6-fache (bei Kaninchen) der maximal empfohlenen Humandosis.
Lisinopril und Hydrochlorothiazid
Teratogenitätsstudien wurden an Mäusen und Ratten mit bis zu 90 mg/kg/Tag Lisinopril (56-fache der empfohlenen Höchstdosis für den Menschen) in Kombination mit 10 mg/kg/Tag Hydrochlorothiazid (2,5-fache der empfohlenen Höchstdosis für den Menschen) durchgeführt. Bei Mäusen wurden mit der Kombination keine mütterlichen oder fetotoxischen Wirkungen beobachtet. Bei Ratten trat eine verringerte Gewichtszunahme des Muttertiers und ein verringertes fötales Gewicht bis hinunter zu 3/10 mg/kg/Tag auf (die niedrigste getestete Dosis). Verbunden mit dem verringerten fötalen Gewicht war eine Verzögerung der fötalen Ossifikation. Das verringerte fötale Gewicht und die Verzögerung der fötalen Ossifikation wurden bei mit Kochsalzlösung ergänzten Tieren, die 90/10 mg/kg/Tag erhielten, nicht beobachtet.
Bei Anwendung in der Schwangerschaft, während des zweiten und dritten Trimesters, können ACE-Hemmer zu Verletzungen und sogar zum Tod des sich entwickelnden Fötus führen. Wenn eine Schwangerschaft festgestellt wird, setzen Sie ZESTORETIC 5 mg so schnell wie möglich ab ( Siehe Lisinopril, Fötale Toxizität ).
Hydrochlorothiazid
Akute Myopie und sekundäres Engwinkelglaukom
Hydrochlorothiazid, ein Sulfonamid, kann eine idiosynkratische Reaktion hervorrufen, die zu akuter vorübergehender Myopie und akutem Engwinkelglaukom führt. Zu den Symptomen gehören ein akuter Beginn einer verminderten Sehschärfe oder Augenschmerzen und treten typischerweise innerhalb von Stunden bis Wochen nach Beginn der Behandlung auf. Unbehandeltes akutes Engwinkelglaukom kann zu dauerhaftem Sehverlust führen. Die primäre Behandlung besteht darin, Hydrochlorothiazid so schnell wie möglich abzusetzen. Wenn der Augeninnendruck unkontrolliert bleibt, müssen möglicherweise umgehend medizinische oder chirurgische Behandlungen in Betracht gezogen werden. Risikofaktoren für die Entwicklung eines akuten Engwinkelglaukoms können eine Sulfonamid- oder Penicillinallergie in der Vorgeschichte sein.
Teratogene Wirkungen
Reproduktionsstudien an Kaninchen, Mäusen und Ratten mit Dosen bis zu 100 mg/kg/Tag (50-fache Dosis beim Menschen) zeigten keine Hinweise auf äußere Anomalien des Fötus aufgrund von Hydrochlorothiazid. Hydrochlorothiazid, das in einer Zwei-Wurf-Studie an Ratten in Dosen von 4 mg/kg/Tag bis 5,6 mg/kg/Tag (etwa das 1- bis 2-fache der üblichen Tagesdosis beim Menschen) verabreicht wurde, beeinträchtigte nicht die Fertilität oder verursachte Geburtsanomalien bei den Nachkommen. Thiazide passieren die Plazentaschranke und treten im Nabelschnurblut auf.
Nicht teratogene Wirkungen
Dazu können fötale oder neonatale Gelbsucht, Thrombozytopenie und möglicherweise andere Nebenwirkungen gehören, die bei Erwachsenen aufgetreten sind.
Hydrochlorothiazid
Thiazide sollten bei schweren Nierenerkrankungen mit Vorsicht angewendet werden. Bei Patienten mit Nierenerkrankungen können Thiazide eine Azotämie auslösen. Bei Patienten mit eingeschränkter Nierenfunktion können sich kumulative Wirkungen des Arzneimittels entwickeln.
Thiazide sollten bei Patienten mit eingeschränkter Leberfunktion oder fortschreitender Lebererkrankung mit Vorsicht angewendet werden, da geringfügige Veränderungen des Flüssigkeits- und Elektrolythaushalts ein hepatisches Koma auslösen können.
Empfindlichkeitsreaktionen können bei Patienten mit oder ohne Allergie oder Bronchialasthma in der Vorgeschichte auftreten.
Es wurde über die Möglichkeit einer Exazerbation oder Aktivierung des systemischen Lupus erythematodes berichtet.
Lithium sollte im Allgemeinen nicht zusammen mit Thiaziden gegeben werden (vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , Lisinopril und Hydrochlorothiazid ).
VORSICHTSMASSNAHMEN
Allgemein
Lisinopril
Aortenstenose/hypertrophe Kardiomyopathie
Wie alle Vasodilatatoren sollte Lisinopril bei Patienten mit Obstruktion im Ausflusstrakt des linken Ventrikels mit Vorsicht angewendet werden.
Beeinträchtigte Nierenfunktion
Als Folge der Hemmung des Renin-Angiotensin-Aldosteron-Systems sind bei empfindlichen Personen Veränderungen der Nierenfunktion zu erwarten. Bei Patienten mit schwerer dekompensierter Herzinsuffizienz, deren Nierenfunktion von der Aktivität des Renin-Angiotensin-Aldosteron-Systems abhängen kann, kann die Behandlung mit Angiotensin-Converting-Enzym-Hemmern, einschließlich Lisinopril, mit Oligurie und/oder fortschreitender Azotämie und selten mit akuter Nierenerkrankung einhergehen Versagen und/oder Tod.
Bei Bluthochdruckpatienten mit einseitiger oder beidseitiger Nierenarterienstenose können Anstiege des Harnstoffstickstoffs im Blut und des Serumkreatinins auftreten. Erfahrungen mit einem anderen Angiotensin-Converting-Enzym-Hemmer deuten darauf hin, dass diese Anstiege normalerweise nach Absetzen von Lisinopril und/oder Diuretika reversibel sind. Bei solchen Patienten sollte die Nierenfunktion während der ersten Behandlungswochen überwacht werden.
Einige Bluthochdruckpatienten ohne offensichtliche vorbestehende Nierengefäßerkrankung haben einen Anstieg des Blutharnstoffs und des Serumkreatinins entwickelt, der gewöhnlich geringfügig und vorübergehend ist, insbesondere wenn Lisinopril gleichzeitig mit einem Diuretikum gegeben wurde. Dies tritt eher bei Patienten mit vorbestehender Nierenfunktionsstörung auf. Eine Dosisreduktion von Lisinopril und/oder das Absetzen des Diuretikums kann erforderlich sein.
Die Beurteilung des Patienten mit Bluthochdruck sollte immer eine Beurteilung der Nierenfunktion umfassen (siehe DOSIERUNG UND VERABREICHUNG).
Hyperkaliämie
In klinischen Studien trat bei etwa 1,4 Prozent der mit Lisinopril plus Hydrochlorothiazid behandelten hypertensiven Patienten eine Hyperkaliämie (Serumkalium größer als 5,7 mEq/l) auf. In den meisten Fällen handelte es sich um isolierte Werte, die sich trotz fortgesetzter Therapie zurückbildeten. Hyperkaliämie war kein Grund für einen Therapieabbruch. Risikofaktoren für die Entwicklung einer Hyperkaliämie sind Niereninsuffizienz, Diabetes mellitus und die gleichzeitige Anwendung von kaliumsparenden Diuretika, Kaliumpräparaten und/oder kaliumhaltigen Salzersatzmitteln. Hyperkaliämie kann schwere, manchmal tödliche Arrhythmien verursachen. ZESTORETIC sollte, wenn überhaupt, mit diesen Mitteln vorsichtig und unter häufiger Überwachung des Serumkaliums angewendet werden (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Husten
Vermutlich aufgrund der Hemmung des Abbaus von körpereigenem Bradykinin wurde bei allen ACE-Hemmern über anhaltenden unproduktiven Husten berichtet, der fast immer nach Absetzen der Therapie zurückging. ACE-Hemmer-induzierter Husten sollte bei der Differentialdiagnose des Hustens in Betracht gezogen werden.
Chirurgie/Anästhesie
Bei Patienten, die sich einem größeren chirurgischen Eingriff unterziehen oder während einer Anästhesie mit Mitteln, die eine Hypotonie hervorrufen, kann Lisinopril die Angiotensin-II-Bildung als Folge einer kompensatorischen Reninfreisetzung blockieren. Wenn Hypotonie auftritt und auf diesen Mechanismus zurückzuführen ist, kann sie durch Volumenexpansion korrigiert werden.
Hydrochlorothiazid
In angemessenen Abständen sollte eine regelmäßige Bestimmung der Serumelektrolyte durchgeführt werden, um ein mögliches Elektrolytungleichgewicht festzustellen.
Alle Patienten, die eine Thiazidtherapie erhalten, sollten auf klinische Anzeichen eines Flüssigkeits- oder Elektrolytungleichgewichts beobachtet werden: nämlich Hyponatriämie, hypochlorämische Alkalose und Hypokaliämie. Serum- und Urinelektrolytbestimmungen sind besonders wichtig, wenn der Patient übermäßig erbricht oder parenterale Flüssigkeiten erhält. Warnzeichen oder Symptome eines Ungleichgewichts im Flüssigkeits- und Elektrolythaushalt sind unabhängig von der Ursache Mundtrockenheit, Durst, Schwäche, Lethargie, Schläfrigkeit, Unruhe, Verwirrtheit, Krampfanfälle, Muskelschmerzen oder -krämpfe, Muskelermüdung, Hypotonie, Oligurie, Tachykardie und gastrointestinale Störungen wie Übelkeit und Erbrechen.
Eine Hypokaliämie kann sich entwickeln, insbesondere bei lebhafter Diurese, wenn eine schwere Zirrhose vorliegt oder nach längerer Therapie.
Eine Beeinträchtigung einer ausreichenden oralen Elektrolytzufuhr trägt ebenfalls zur Hypokaliämie bei. Hypokaliämie kann Herzrhythmusstörungen verursachen und kann auch die Reaktion des Herzens auf die toxischen Wirkungen von Digitalis (z. B. erhöhte ventrikuläre Reizbarkeit) sensibilisieren oder verstärken. Da Lisinopril die Produktion von Aldosteron reduziert, dämpft die gleichzeitige Therapie mit Lisinopril den Diuretika-induzierten Kaliumverlust (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , Mittel zur Erhöhung des Serumkaliums ).
Obwohl jeder Chloridmangel im Allgemeinen leicht ist und normalerweise keine besondere Behandlung erfordert, außer unter außergewöhnlichen Umständen (wie bei Lebererkrankungen oder Nierenerkrankungen), kann bei der Behandlung einer metabolischen Alkalose eine Chloridsubstitution erforderlich sein.
Bei ödematösen Patienten kann es bei heißem Wetter zu einer Verdünnungshyponatriämie kommen; Eine geeignete Therapie ist Wasserrestriktion anstelle der Verabreichung von Salz, außer in seltenen Fällen, wenn die Hyponatriämie lebensbedrohlich ist. Bei tatsächlichem Salzmangel ist ein angemessener Ersatz die Therapie der Wahl.
Bei bestimmten Patienten, die eine Thiazid-Therapie erhalten, kann eine Hyperurikämie auftreten oder eine offene Gicht ausgelöst werden.
Bei Diabetikern kann eine Dosisanpassung von Insulin oder oralen Antidiabetika erforderlich sein. Unter Thiaziddiuretika kann es zu einer Hyperglykämie kommen. So kann sich unter Thiazidtherapie ein latenter Diabetes mellitus manifestieren.
Die antihypertensiven Wirkungen des Arzneimittels können bei Postsympathektomie-Patienten verstärkt werden.
Wenn eine fortschreitende Nierenfunktionsstörung offensichtlich wird, erwägen Sie, die diuretische Therapie auszusetzen oder abzubrechen.
Es wurde gezeigt, dass Thiazide die Ausscheidung von Magnesium über den Urin erhöhen; dies kann zu einer Hypomagnesiämie führen.
Thiazide können die Kalziumausscheidung im Urin verringern. Thiazide können einen intermittierenden und leichten Anstieg des Serumcalciums verursachen, wenn keine bekannten Störungen des Calciumstoffwechsels vorliegen. Eine ausgeprägte Hyperkalzämie kann ein Hinweis auf einen versteckten Hyperparathyreoidismus sein. Thiazide sollten abgesetzt werden, bevor Tests zur Nebenschilddrüsenfunktion durchgeführt werden.
Erhöhte Cholesterin- und Triglyzeridspiegel können mit einer Therapie mit Thiazid-Diuretika in Verbindung gebracht werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Lisinopril und Hydrochlorothiazid
Lisinopril in Kombination mit Hydrochlorothiazid war in einem mikrobiellen Mutagentest mit Salmonella typhimurium (Ames-Test) oder Escherichia coli mit oder ohne metabolischer Aktivierung oder in einem Vorwärtsmutationsassay mit Lungenzellen des Chinesischen Hamsters nicht mutagen. Lisinopril und Hydrochlorothiazid führten in einem In-vitro-Hepatozytentest mit alkalischer Elution an Ratten nicht zu DNA-Einzelstrangbrüchen. Darüber hinaus führte es in einem In-vitro-Test an Eierstockzellen des chinesischen Hamsters oder in einer In-vivo-Studie im Knochenmark von Mäusen nicht zu einer Zunahme von Chromosomenaberrationen.
Lisinopril
Es gab keine Hinweise auf eine tumorerzeugende Wirkung, wenn Lisinopril 105 Wochen lang männlichen und weiblichen Ratten in Dosen bis zu 90 mg/kg/Tag (etwa das 56- oder 9-fache* der maximalen Tagesdosis beim Menschen, basierend auf Körpergewicht und Körperoberfläche) verabreicht wurde Bereich bzw.). Es gab keine Hinweise auf Karzinogenität, als Lisinopril (männlichen und weiblichen) Mäusen 92 Wochen lang in Dosen von bis zu 135 mg/kg/Tag (etwa das 84-fache* der maximal empfohlenen Tagesdosis für den Menschen) verabreicht wurde. Diese Dosis war das 6,8-fache der maximalen menschlichen Dosis, basierend auf der Körperoberfläche bei Mäusen.
*Berechnungen gehen von einem menschlichen Gewicht von 50 kg und einer menschlichen Körperoberfläche von 1,62 m2 aus.
Lisinopril war im mikrobiellen Mutagentest von Ames mit oder ohne metabolische Aktivierung nicht mutagen. Es war auch in einem Vorwärtsmutationstest unter Verwendung von Lungenzellen chinesischer Hamster negativ. Lisinopril führte in einem In-vitro-Hepatozytentest mit alkalischer Elution an Ratten nicht zu Einzelstrang-DNA-Brüchen. Darüber hinaus führte Lisinopril in einem In-vitro-Test an Eierstockzellen des chinesischen Hamsters oder in einer In-vivo-Studie im Knochenmark von Mäusen nicht zu einer Zunahme von Chromosomenaberrationen.
Bei männlichen und weiblichen Ratten, die mit bis zu 300 mg/kg/Tag Lisinopril behandelt wurden, traten keine nachteiligen Auswirkungen auf die Fortpflanzungsfähigkeit auf. Diese Dosis beträgt das 188-fache bzw. das 30-fache der maximalen Tagesdosis für den Menschen, basierend auf mg/kg bzw. mg/m2.
Hydrochlorothiazid
Zweijährige Fütterungsstudien an Mäusen und Ratten, die unter der Schirmherrschaft des National Toxicology Program (NTP) durchgeführt wurden, ergaben keine Hinweise auf ein karzinogenes Potenzial von Hydrochlorothiazid bei weiblichen Mäusen (bei Dosen von bis zu etwa 600 mg/kg/Tag) oder bei männlichen und weibliche Ratten (in Dosen von bis zu etwa 100 mg/kg/Tag). Diese Dosen betragen das 150-fache und 12-fache für Mäuse und das 25-fache und 4-fache für Ratten der maximalen menschlichen Tagesdosis, basierend auf mg/kg bzw. mg/m2. Das NTP fand jedoch zweideutige Beweise für die Hepatokanzerogenität bei männlichen Mäusen.
Hydrochlorothiazid war in vitro im Ames-Mutagenitätstest der Salmonella typhimurium-Stämme TA 98, TA 100, TA 1535, TA 1537 und TA 1538 und im Chinese Hamster Ovary (CHO)-Test auf Chromosomenaberrationen oder in vivo in Assays nicht genotoxisch Keimzellchromosomen der Maus, Knochenmarkchromosomen des chinesischen Hamsters und das geschlechtsgebundene rezessive letale Merkmalsgen von Drosophila. Positive Testergebnisse wurden nur im In-vitro-CHO-Schwesterchromatidaustausch- (Klastogenitäts-) und im Maus-Lymphomzellen- (Mutagenitäts-) Assay unter Verwendung von Hydrochlorothiazid-Konzentrationen von 43 µg/ml bis 1300 µg/ml und im Aspergillus nidulans Nondisjunction-Assay erhalten in einer unbestimmten Konzentration.
Hydrochlorothiazid hatte keine nachteiligen Auswirkungen auf die Fertilität von Mäusen und Ratten beiderlei Geschlechts in Studien, in denen diese Spezies über ihre Nahrung Dosen von bis zu 100 mg/kg bzw. 4 mg/kg vor der Empfängnis und während der gesamten Trächtigkeit ausgesetzt waren . Bei Mäusen beträgt diese Dosis das 25-fache bzw. das 2-fache der maximalen menschlichen Tagesdosis, basierend auf mg/kg bzw. mg/m2. Bei Ratten beträgt diese Dosis das 1-fache bzw. das 0,2-fache der maximalen Tagesdosis beim Menschen, basierend auf mg/kg bzw. mg/m2.
Stillende Mutter
Es ist nicht bekannt, ob Lisinopril in die Muttermilch übergeht. Allerdings enthält die Milch säugender Ratten nach Verabreichung von 14C-Lisinopril Radioaktivität. In einer anderen Studie war Lisinopril in Rattenmilch in Konzentrationen vorhanden, die den Plasmakonzentrationen bei den Muttertieren ähnelten. Thiazide kommen in der Muttermilch vor. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen durch ACE-Hemmer und Hydrochlorothiazid sollte eine Entscheidung getroffen werden, ob das Stillen abgebrochen und/oder Zestoretic 12,5 g abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Neugeborene mit einer Vorgeschichte von In-utero-Exposition gegenüber ZESTORETIC
Wenn Oligurie oder Hypotonie auftritt, lenken Sie die Aufmerksamkeit auf die Unterstützung des Blutdrucks und der Nierendurchblutung. Austauschtransfusionen oder Dialyse können erforderlich sein, um eine Hypotonie umzukehren und/oder eine gestörte Nierenfunktion zu ersetzen. Lisinopril, das die Plazenta passiert, wurde mit einigem klinischen Nutzen durch Peritonealdialyse aus dem neonatalen Kreislauf entfernt und kann theoretisch durch Austauschtransfusion entfernt werden, obwohl es keine Erfahrung mit dem letzteren Verfahren gibt.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit ZESTORETIC mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden. Die Beurteilung des Bluthochdruckpatienten sollte immer eine Beurteilung der Nierenfunktion beinhalten.
ÜBERDOSIS
Zur Behandlung einer Überdosierung mit ZESTORETIC liegen keine spezifischen Informationen vor. Die Behandlung ist symptomatisch und unterstützend. Die Therapie mit ZESTORETIC 12,5 gmg sollte abgebrochen und der Patient engmaschig überwacht werden. Zu den vorgeschlagenen Maßnahmen gehören die Induktion von Erbrechen und/oder Magenspülung sowie die Korrektur von Dehydratation, Elektrolytstörungen und Hypotonie durch etablierte Verfahren.
Lisinopril
Nach einer oralen Einzeldosis von 20 g/kg trat bei Ratten keine Letalität auf, und bei einer von 20 Mäusen, die die gleiche Dosis erhielten, trat der Tod auf. Die wahrscheinlichste Manifestation einer Überdosierung wäre Hypotonie, für die die übliche Behandlung eine intravenöse Infusion normaler Kochsalzlösung wäre.
Lisinopril kann durch Hämodialyse entfernt werden (siehe WARNUNGEN , Anaphylaktoide Reaktion während Membranexposition ).
Hydrochlorothiazid
Die orale Verabreichung einer oralen Einzeldosis von 10 g/kg an Mäuse und Ratten war nicht tödlich. Die am häufigsten beobachteten Anzeichen und Symptome sind solche, die durch Elektrolytmangel (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydratation infolge übermäßiger Diurese verursacht werden. Wenn auch Digitalis verabreicht wurde, kann eine Hypokaliämie Herzrhythmusstörungen verstärken.
KONTRAINDIKATIONEN
ZESTORETIC 12,5 gmg ist kontraindiziert bei Patienten, die auf dieses Produkt überempfindlich reagieren, und bei Patienten mit Angioödem in der Anamnese im Zusammenhang mit einer früheren Behandlung mit einem Angiotensin-Converting-Enzym-Hemmer und bei Patienten mit hereditärem oder idiopathischem Angioödem. Aufgrund der Hydrochlorothiazid-Komponente ist dieses Produkt bei Patienten mit Anurie oder Überempfindlichkeit gegenüber anderen von Sulfonamiden abgeleiteten Arzneimitteln kontraindiziert.
Zestoretic 12,5 g mg ist kontraindiziert in Kombination mit einem Neprilysin-Inhibitor (z. B. Sacubitril). Verabreichen Sie ZESTORETIC 5 mg nicht innerhalb von 36 Stunden nach der Umstellung auf oder von Sacubitril/Valsartan, einem Neprilysin-Hemmer (siehe WARNUNGEN ).
Verabreichen Sie Aliskiren nicht zusammen mit ZESTORETIC bei Patienten mit Diabetes (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
KLINISCHE PHARMAKOLOGIE
Lisinopril und Hydrochlorothiazid
Aufgrund seiner diuretischen Wirkung erhöht Hydrochlorothiazid die Plasma-Renin-Aktivität, erhöht die Aldosteronsekretion und senkt das Serumkalium. Die Verabreichung von Lisinopril blockiert die Renin-Angiotensin-Aldosteron-Achse und neigt dazu, den mit dem Diuretikum verbundenen Kaliumverlust umzukehren.
In klinischen Studien war das Ausmaß der Blutdrucksenkung, das bei der Kombination von Lisinopril und Hydrochlorothiazid beobachtet wurde, ungefähr additiv. Die Kombination ZESTORETIC 10-12,5 wirkte bei schwarzen und weißen Patienten gleichermaßen gut. Die Kombinationen ZESTORETIC 20-12,5 und ZESTORETIC 20-25 schienen bei Patienten mit schwarzer Hautfarbe etwas weniger wirksam zu sein, aber relativ wenige Patienten mit schwarzer Hautfarbe wurden untersucht. Bei den meisten Patienten hielt die blutdrucksenkende Wirkung von ZESTORETIC für mindestens 24 Stunden an.
In einem randomisierten, kontrollierten Vergleich waren die mittleren blutdrucksenkenden Wirkungen von ZESTORETIC 20-12,5 und ZESTORETIC 20-25 ähnlich, was darauf hindeutet, dass viele Patienten, die auf die letztere Kombination angemessen ansprechen, mit ZESTORETIC 20-12,5 kontrolliert werden können (siehe DOSIERUNG UND ANWENDUNG ).
Die gleichzeitige Verabreichung von Lisinopril und Hydrochlorothiazid hat wenig oder keine Auswirkung auf die Bioverfügbarkeit der beiden Arzneimittel. Die Kombinationstablette ist bioäquivalent zur gleichzeitigen Verabreichung der einzelnen Einheiten.
Lisinopril
Wirkmechanismus
Lisinopril hemmt das Angiotensin-Converting-Enzym (ACE) bei Menschen und Tieren. ACE ist eine Peptidyldipeptidase, die die Umwandlung von Angiotensin I in die vasokonstriktorische Substanz Angiotensin II katalysiert. Angiotensin II stimuliert auch die Aldosteronsekretion durch die Nebennierenrinde. Die Hemmung von ACE führt zu einem verringerten Plasma-Angiotensin II, was zu einer verringerten vasopressorischen Aktivität und zu einer verringerten Aldosteronsekretion führt. Die letztere Abnahme kann zu einem geringen Anstieg des Serumkaliums führen. Die Beseitigung der negativen Rückkopplung von Angiotensin II auf die Reninsekretion führt zu einer erhöhten Plasma-Renin-Aktivität. Bei hypertensiven Patienten mit normaler Nierenfunktion, die bis zu 24 Wochen mit Lisinopril allein behandelt wurden, betrug der mittlere Anstieg des Serumkaliums weniger als 0,1 mEq/l; jedoch hatten etwa 15 Prozent der Patienten Anstiege von mehr als 0,5 mEq/l und etwa 6 Prozent eine Abnahme von mehr als 0,5 mEq/l. In derselben Studie zeigten Patienten, die mit Lisinopril plus einem Thiaziddiuretikum behandelt wurden, im Wesentlichen keine Veränderung des Serumkaliums (siehe VORSICHTSMASSNAHMEN ).
ACE ist identisch mit Kininase, einem Enzym, das Bradykinin abbaut. Ob erhöhte Spiegel von Bradykinin, einem potenten Vasodepressor-Peptid, eine Rolle bei der therapeutischen Wirkung von Lisinopril spielen, muss noch geklärt werden.
Während angenommen wird, dass der Mechanismus, durch den Lisinopril den Blutdruck senkt, in erster Linie die Unterdrückung des Renin-Angiotensin-Aldosteron-Systems ist, wirkt Lisinopril selbst bei Patienten mit niedrigem Renin-Hypertonie blutdrucksenkend. Obwohl Lisinopril bei allen untersuchten Rassen blutdrucksenkend wirkte, sprachen schwarze Bluthochdruckpatienten (normalerweise eine hypertensive Population mit niedrigem Reninspiegel) im Durchschnitt weniger gut auf eine Lisinopril-Monotherapie an als nicht schwarze Patienten.
Pharmakokinetik und Stoffwechsel
Nach oraler Gabe von Lisinopril treten innerhalb von etwa 7 Stunden maximale Serumkonzentrationen auf. Abnehmende Serumkonzentrationen weisen eine verlängerte Endphase auf, die nicht zur Arzneimittelakkumulation beiträgt. Diese Endphase stellt wahrscheinlich eine sättigbare Bindung an ACE dar und ist nicht proportional zur Dosis. Lisinopril scheint nicht an andere Serumproteine gebunden zu sein.
Lisinopril unterliegt keinem Metabolismus und wird unverändert vollständig mit dem Urin ausgeschieden. Basierend auf der Wiederfindung im Urin beträgt das mittlere Ausmaß der Resorption von Lisinopril etwa 25 Prozent, mit großer interindividueller Variabilität (6 % bis 60 %) bei allen getesteten Dosen (5 mg bis 80 mg). Die Resorption von Lisinopril wird durch die Anwesenheit von Nahrung im Magen-Darm-Trakt nicht beeinflusst.
Bei Mehrfachgabe weist Lisinopril eine effektive Akkumulationshalbwertszeit von 12 Stunden auf.
Eine eingeschränkte Nierenfunktion verringert die Elimination von Lisinopril, das hauptsächlich über die Nieren ausgeschieden wird, aber diese Verringerung wird nur dann klinisch bedeutsam, wenn die glomeruläre Filtrationsrate unter 30 ml/min liegt. Oberhalb dieser glomerulären Filtrationsrate ändert sich die Eliminationshalbwertszeit kaum. Bei stärkerer Beeinträchtigung steigen jedoch die Spitzen- und Talspiegel von Lisinopril, die Zeit bis zum Erreichen der Spitzenkonzentration nimmt zu und die Zeit bis zum Erreichen des Steady State verlängert sich. Ältere Patienten haben im Durchschnitt (etwa doppelt so) höhere Blutspiegel und Flächen unter der Plasmakonzentrations-Zeit-Kurve (AUC) als jüngere Patienten (vgl DOSIERUNG UND ANWENDUNG ). In einer pharmakokinetischen Studie mit Mehrfachdosis bei älteren Patienten im Vergleich zu jungen Patienten mit Bluthochdruck unter Verwendung der Kombination Lisinopril/Hydrochlorothiazid stieg die AUC bei älteren Patienten um etwa 120 % für Lisinopril und um etwa 80 % für Hydrochlorothiazid. Lisinopril kann durch Hämodialyse entfernt werden.
Studien an Ratten weisen darauf hin, dass Lisinopril die Blut-Hirn-Schranke schlecht passiert. Mehrfachdosen von Lisinopril bei Ratten führen zu keiner Akkumulation in irgendeinem Gewebe; Milch säugender Ratten enthält jedoch nach Verabreichung von 14C-Lisinopril Radioaktivität. Durch Ganzkörper-Autoradiographie wurde Radioaktivität in der Plazenta nach Verabreichung des markierten Medikaments an trächtige Ratten gefunden, aber keine wurde in den Föten gefunden.
Pharmakodynamik
Die Verabreichung von Lisinopril an Patienten mit Hypertonie führt zu einer Senkung des Blutdrucks im Liegen und im Stehen in etwa gleichem Ausmaß ohne kompensatorische Tachykardie. Eine symptomatische orthostatische Hypotonie wird normalerweise nicht beobachtet, obwohl sie bei Patienten mit Volumen- und/oder Salzmangel auftreten kann und erwartet werden sollte (siehe WARNUNGEN ).
Bei den meisten untersuchten Patienten wurde der Beginn der blutdrucksenkenden Wirkung eine Stunde nach oraler Gabe einer Einzeldosis von Lisinopril beobachtet, wobei die maximale Blutdrucksenkung nach sechs Stunden erreicht wurde.
Bei manchen Patienten kann das Erreichen einer optimalen Blutdrucksenkung eine zwei- bis vierwöchige Therapie erfordern.
Bei empfohlener täglicher Einzeldosis hielt die blutdrucksenkende Wirkung für mindestens 24 Stunden nach der Einnahme an, obwohl die Wirkung 24 Stunden nach der Einnahme wesentlich geringer war als die Wirkung sechs Stunden nach der Einnahme.
Die blutdrucksenkende Wirkung von Lisinopril hielt während der Langzeittherapie an. Ein abruptes Absetzen von Lisinopril wurde nicht mit einem raschen Anstieg des Blutdrucks in Verbindung gebracht; noch mit einer signifikanten Überschreitung des Blutdrucks vor der Behandlung.
In hämodynamischen Studien bei Patienten mit essenzieller Hypertonie ging die Blutdrucksenkung mit einer Verringerung des peripheren arteriellen Widerstands einher, bei geringer oder keiner Änderung des Herzzeitvolumens und der Herzfrequenz. In einer Studie mit neun Bluthochdruckpatienten kam es nach der Verabreichung von Lisinopril zu einem nicht signifikanten Anstieg des mittleren renalen Blutflusses. Daten aus mehreren kleinen Studien sind in Bezug auf die Wirkung von Lisinopril auf die glomeruläre Filtrationsrate bei Bluthochdruckpatienten mit normaler Nierenfunktion widersprüchlich, deuten jedoch darauf hin, dass Änderungen, falls vorhanden, nicht groß sind.
Bei Patienten mit renovaskulärer Hypertonie hat sich Lisinopril als gut verträglich und wirksam bei der Blutdruckkontrolle erwiesen (vgl VORSICHTSMASSNAHMEN ).
Hydrochlorothiazid
Der Mechanismus der blutdrucksenkenden Wirkung von Thiaziden ist unbekannt. Thiazide haben normalerweise keinen Einfluss auf den normalen Blutdruck.
Hydrochlorothiazid ist ein Diuretikum und Antihypertensivum. Es beeinflusst den distalen renalen tubulären Mechanismus der Elektrolytreabsorption. Hydrochlorothiazid erhöht die Ausscheidung von Natrium und Chlorid in etwa äquivalenten Mengen. Die Natriurese kann von einem gewissen Kalium- und Bikarbonatverlust begleitet sein.
Nach oraler Einnahme beginnt die Diurese innerhalb von zwei Stunden, erreicht ihren Höhepunkt nach etwa vier Stunden und dauert etwa 6 bis 12 Stunden.
Hydrochlorothiazid wird nicht metabolisiert, sondern schnell über die Nieren ausgeschieden. Wenn die Plasmaspiegel mindestens 24 Stunden lang beobachtet wurden, wurde beobachtet, dass die Plasmahalbwertszeit zwischen 5,6 und 14,8 Stunden schwankt. Mindestens 61 Prozent der oralen Dosis werden unverändert innerhalb von 24 Stunden ausgeschieden. Hydrochlorothiazid passiert die Plazenta, aber nicht die Blut-Hirn-Schranke.
INFORMATIONEN ZUM PATIENTEN
Angioödem
Angioödeme, einschließlich Larynxödeme, können jederzeit während der Behandlung mit Angiotensin-Converting-Enzym-Hemmern, einschließlich ZESTORETIC, auftreten. Die Patienten sollten darauf hingewiesen und aufgefordert werden, sofort alle Anzeichen oder Symptome zu melden, die auf ein Angioödem hindeuten (Schwellung von Gesicht, Extremitäten, Augen, Lippen, Zunge, Schluck- oder Atembeschwerden) und kein Medikament mehr einnehmen, bis sie den verschreibenden Arzt konsultiert haben.
Symptomatische Hypotonie
Die Patienten sollten davor gewarnt werden, vor allem in den ersten Tagen der Therapie über Benommenheit zu berichten. Wenn tatsächlich eine Synkope auftritt, sollten die Patienten angewiesen werden, das Medikament abzusetzen, bis sie den verschreibenden Arzt konsultiert haben.
Alle Patienten sollten darauf hingewiesen werden, dass übermäßiges Schwitzen und Austrocknung aufgrund der Verringerung des Flüssigkeitsvolumens zu einem übermäßigen Abfall des Blutdrucks führen können. Auch andere Ursachen für einen Volumenmangel wie Erbrechen oder Durchfall können zu einem Abfall des Blutdrucks führen; Patienten sollten angewiesen werden, ihren Arzt zu konsultieren.
Hyperkaliämie
Die Patienten sollten darauf hingewiesen werden, keine kaliumhaltigen Salzersatzstoffe ohne Rücksprache mit ihrem Arzt zu verwenden.
Leukopenie/Neutropenie
Die Patienten sollten angewiesen werden, unverzüglich alle Anzeichen einer Infektion (z. B. Halsschmerzen, Fieber) zu melden, die ein Zeichen von Leukopenie/Neutropenie sein können.
Schwangerschaft
Patientinnen im gebärfähigen Alter sollten über die Folgen einer Exposition gegenüber ZESTORETIC während der Schwangerschaft aufgeklärt werden. Besprechen Sie Behandlungsmöglichkeiten mit Frauen, die eine Schwangerschaft planen. Patientinnen sollten aufgefordert werden, Schwangerschaften so schnell wie möglich ihrem Arzt zu melden.
HINWEIS: Wie bei vielen anderen Arzneimitteln sind bestimmte Ratschläge für Patienten, die mit ZESTORETIC 12,5 g mg behandelt werden, gerechtfertigt. Diese Informationen sollen bei der sicheren und wirksamen Anwendung dieses Medikaments helfen. Es handelt sich nicht um eine Offenlegung aller möglichen nachteiligen oder beabsichtigten Wirkungen.