Zofran 4mg, 8mg Ondansetron Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zofran und wie wird es angewendet?
Zofran 4 mg ist ein verschreibungspflichtiges Arzneimittel, das als Prophylaxe und zur Behandlung von Symptomen von Übelkeit und Erbrechen aufgrund bestimmter Medikamente oder postoperativ verwendet wird. Zofran 8 mg kann allein oder mit anderen Medikamenten verwendet werden.
Zofran gehört zu einer Klasse von Arzneimitteln namens Antiemetika, selektive 5-HT3-Antagonisten.
Es ist nicht bekannt, ob Zofran 4 mg bei Kindern unter 1 Monat sicher und wirksam ist.
Welche Nebenwirkungen kann Zofran haben?
Zofran kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zofran gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zofran. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Der Wirkstoff in ZOFRAN 4 mg Tabletten und ZOFRAN Lösung zum Einnehmen ist Ondansetronhydrochlorid als Dihydrat, die racemische Form von Ondansetron und ein selektiver Blocker des Serotonin-5-HT3-Rezeptortyps. Chemisch ist es (±) 1,2,3,9-Tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on, Monohydrochlorid, Dihydrat . Es hat die folgende Strukturformel:
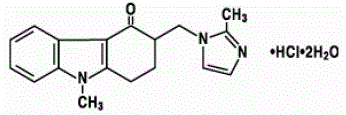
Die empirische Formel ist C18H19N3O·HCl·2H2O, was einem Molekulargewicht von 365,9 entspricht.
Ondansetronhydrochlorid-Dihydrat ist ein weißes bis cremefarbenes Pulver, das in Wasser und normaler Kochsalzlösung löslich ist.
Der Wirkstoff in ZOFRAN 4 mg ODT-Tabletten zum Einnehmen ist Ondansetron-Base, die racemische Form von Ondansetron, und ein selektiver Blocker des Serotonin-5-HT3-Rezeptortyps. Chemisch ist es (±) 1,2,3,9-Tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on. Es hat die folgende Strukturformel:
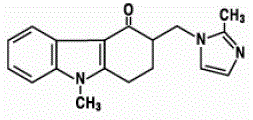
Die empirische Formel ist C18H19N3O, was ein Molekulargewicht von 293,4 darstellt.
Jede 4-mg-ZOFRAN-8-mg-Tablette zur oralen Verabreichung enthält Ondansetronhydrochlorid-Dihydrat, entsprechend 4 mg Ondansetron. Jede 8-mg-ZOFRAN-8-mg-Tablette zur oralen Verabreichung enthält Ondansetronhydrochlorid-Dihydrat, entsprechend 8 mg Ondansetron. Jede Tablette enthält außerdem die sonstigen Bestandteile Hypromellose, gelbes Eisenoxid (nur 8-mg-Tablette), Lactose, Magnesiumstearat, mikrokristalline Cellulose, vorverkleisterte Stärke, Triacetin und Titandioxid.
Jede 4 mg ZOFRAN 8 mg ODT Schmelztablette zur oralen Verabreichung enthält 4 mg Ondansetron-Base. Jede 8 mg ZOFRAN 4 mg ODT Schmelztablette zur oralen Verabreichung enthält 8 mg Ondansetron-Base. Jede ZOFRAN ODT Tablette enthält außerdem die inaktiven Inhaltsstoffe Aspartam, Gelatine, Mannit, Methylparaben-Natrium, Propylparaben-Natrium und Erdbeeraroma. ZOFRAN ODT Tabletten sind eine gefriergetrocknete, oral verabreichte Formulierung von Ondansetron, die auf der Zunge zerfällt und kein Wasser benötigt, um die Auflösung oder das Schlucken zu unterstützen.
Jede 5 ml ZOFRAN-Lösung zum Einnehmen enthält 5 mg Ondansetronhydrochlorid-Dihydrat, entsprechend 4 mg Ondansetron. ZOFRAN 8 mg Lösung zum Einnehmen enthält die inaktiven Bestandteile Citronensäure, gereinigtes Wasser, Natriumbenzoat, Natriumcitrat, Sorbitol und Erdbeeraroma.
INDIKATIONEN
ZOFRAN ist angezeigt zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit:
ZOFRAN ist auch angezeigt zur Vorbeugung von postoperativer Übelkeit und/oder Erbrechen.
DOSIERUNG UND ANWENDUNG
Dosierung
Die empfohlenen Dosierungsschemata für erwachsene und pädiatrische Patienten sind in Tabelle 1 bzw. Tabelle 2 beschrieben. Entsprechende Dosen von ZOFRAN Tabletten, ZOFRAN ODT® im Mund zerfallenden Tabletten und ZOFRAN Lösung zum Einnehmen können austauschbar verwendet werden.
Dosierung bei eingeschränkter Leberfunktion
Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Score von 10 oder höher) darf eine Tagesgesamtdosis von 8 mg nicht überschritten werden [siehe Verwendung in bestimmten Bevölkerungsgruppen , KLINISCHE PHARMAKOLOGIE ].
Verabreichungshinweise für ZOFRAN ODT oral zerfallende Tabletten
Versuchen Sie nicht, die im Mund zerfallenden ZOFRAN ODT-Tabletten durch die Folienrückseite zu drücken. Ziehen Sie mit trockenen Händen die Folienrückseite von 1 Blister ab und entfernen Sie die Tablette VORSICHTIG. Legen Sie die ZOFRAN 4 mg ODT Tablette, die sich im Mund auflöst, SOFORT auf die Zunge, wo sie sich in Sekunden auflöst, und schlucken Sie sie dann mit Speichel herunter. Eine Verabreichung mit Flüssigkeit ist nicht erforderlich.
WIE GELIEFERT
Darreichungsformen und Stärken
ZOFRAN-Tabletten sind ovale Filmtabletten mit der Prägung „Zofran“ auf einer Seite und sind in folgenden Stärken erhältlich:
ZOFRAN ODT im Mund zerfallende Tabletten sind weiße, runde und plankonvexe Tabletten, die in den folgenden Stärken erhältlich sind:
ZOFRAN 4 mg Lösung zum Einnehmen 4 mg/5 ml, ist eine klare, farblose bis hellgelbe Flüssigkeit mit charakteristischem Erdbeergeruch, erhältlich in einer 50-ml-Flasche.
Lagerung und Handhabung
ZOFRAN-Tabletten
4 mg (Ondansetronhydrochlorid-Dihydrat, entsprechend 4 mg Ondansetron), sind weiße, ovale Filmtabletten mit der Prägung „Zofran“ auf der einen Seite und „4“ auf der anderen Seite in Flaschen mit 30 Tabletten (NDC 0078-0675-15 ).
Zwischen 2°C und 30°C (36°F und 86°F) lagern. Vor Licht schützen. In einem dichten, lichtbeständigen Behälter gemäß USP abgeben.
8 mg (Ondansetronhydrochlorid-Dihydrat, entsprechend 8 mg Ondansetron) sind gelbe, ovale Filmtabletten mit der Prägung „Zofran“ auf der einen Seite und „8“ auf der anderen Seite in Flaschen mit 30 Tabletten (NDC 0078-0676-15 ).
Zwischen 2°C und 30°C (36°F und 86°F) lagern. Vor Licht schützen. In einem dichten, lichtbeständigen Behälter gemäß USP abgeben.
ZOFRAN 8mg ODT Oral zerfallende Tabletten
4 mg (als 4 mg Ondansetron-Base) sind weiße, runde und plankonvexe Tabletten mit der Prägung „Z4“ auf einer Seite in Einzeldosispackungen mit 30 Tabletten (NDC 0078-0679-19).
mg (als 8 mg Ondansetron-Base) sind weiße, runde und plankonvexe Tabletten mit der Prägung „Z8“ auf einer Seite in Einzeldosispackungen mit 30 Tabletten (NDC 0078-0680-19).
Zwischen 2°C und 30°C (36°F und 86°F) lagern.
ZOFRAN 4 mg Lösung zum Einnehmen
eine klare, farblose bis hellgelbe Flüssigkeit mit charakteristischem Erdbeergeruch, enthält 5 mg Ondansetronhydrochlorid-Dihydrat, entsprechend 4 mg Ondansetron pro 5 ml, in Braunglasflaschen zu 50 ml mit kindergesichertem Verschluss (NDC 0078-0677-22) .
Aufrecht zwischen 15°C und 30°C (59°F und 86°F) lagern. Vor Licht schützen. Flaschen aufrecht in Kartons lagern.
Vertrieb durch: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Überarbeitet: April 2021
NEBENWIRKUNGEN
Die folgenden klinisch signifikanten Nebenwirkungen werden an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die folgenden Nebenwirkungen wurden in klinischen Studien bei Patienten berichtet, die mit Ondansetron, dem Wirkstoff von ZOFRAN, behandelt wurden. Ein kausaler Zusammenhang zur Therapie mit ZOFRAN war in vielen Fällen unklar.
Prävention von Chemotherapie-induzierter Übelkeit und Erbrechen
Die häufigsten Nebenwirkungen, die bei mehr als oder gleich 4 % von 300 Erwachsenen berichtet wurden, die eine orale Einzeldosis von 24 mg ZOFRAN 4 mg in 2 Studien zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer stark emetogenen Chemotherapie (Cisplatin größer oder gleich 50 mg /m²) waren: Kopfschmerzen (11 %) und Durchfall (4 %).
Die häufigsten Nebenwirkungen, die in 4 Studien bei Erwachsenen zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer mäßig emetogenen Chemotherapie (hauptsächlich Cyclophosphamid-basierte Therapien) berichtet wurden, sind in Tabelle 3 aufgeführt.
Weniger häufige Nebenwirkungen
Zentrales Nervensystem
Extrapyramidale Reaktionen (weniger als 1 % der Patienten).
Leber
Die Aspartat-Transaminase (AST)- und/oder Alanin-Transaminase (ALT)-Werte überstiegen bei etwa 1 % bis 2 % von 723 Patienten, die ZOFRAN 8 mg und eine Chemotherapie auf Cyclophosphamid-Basis in klinischen Studien in den USA erhielten, das Zweifache der oberen Normgrenze. Die Anstiege waren vorübergehend und schienen nicht mit der Dosis oder Dauer der Therapie in Zusammenhang zu stehen. Bei wiederholter Exposition traten in einigen Behandlungszyklen ähnliche vorübergehende Erhöhungen der Transaminasenwerte auf, aber eine symptomatische Lebererkrankung trat nicht auf. Die Rolle der Krebs-Chemotherapie bei diesen biochemischen Veränderungen ist unklar.
Leberversagen und Tod wurden bei Krebspatienten berichtet, die gleichzeitig Medikamente erhielten, einschließlich potenziell hepatotoxischer, zytotoxischer Chemotherapie und Antibiotika. Die Ätiologie des Leberversagens ist unklar.
Integumentär
Hautausschlag (ca. 1 % der Patienten).
Andere (weniger als 2 %)
Anaphylaxie, Bronchospasmus, Tachykardie, Angina pectoris, Hypokaliämie, elektrokardiographische Veränderungen, Gefäßverschlussereignisse und Grand-Mal-Anfälle. Abgesehen von Bronchospasmus und Anaphylaxie ist die Beziehung zu ZOFRAN 4 mg unklar.
Prävention von strahleninduzierter Übelkeit und Erbrechen
Die häufigsten Nebenwirkungen (mehr als oder gleich 2 %), die bei Patienten berichtet wurden, die ZOFRAN und eine gleichzeitige Strahlentherapie erhielten, waren ähnlich denen, die bei Patienten berichtet wurden, die ZOFRAN und eine gleichzeitige Chemotherapie erhielten, und waren Kopfschmerzen, Verstopfung und Durchfall.
Prävention von postoperativer Übelkeit und Erbrechen
Die häufigsten Nebenwirkungen, die bei Erwachsenen in Studien zur Prävention von postoperativer Übelkeit und Erbrechen berichtet wurden, sind in Tabelle 4 aufgeführt. In diesen Studien erhielten die Patienten in beiden Behandlungsgruppen gleichzeitig mehrere perioperative und postoperative Medikamente.
In einer Crossover-Studie mit 25 Probanden wurde über Kopfschmerzen bei 6 Probanden berichtet, denen ZOFRAN 8 mg ODT als oral zerfallende Tablette mit Wasser verabreicht wurde (24 %), im Vergleich zu 2 Probanden, denen ZOFRAN 8 mg ODT als oral zerfallende Tablette ohne Wasser verabreicht wurde (8 %).
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Ondansetron nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Herz-Kreislauf
Arrhythmien (einschließlich ventrikulärer und supraventrikulärer Tachykardie, vorzeitiger ventrikulärer Kontraktionen und Vorhofflimmern), Bradykardie, elektrokardiographische Veränderungen (einschließlich Herzblock zweiten Grades, QT/QTc-Intervallverlängerung und ST-Streckensenkung), Palpitationen und Synkopen. Selten und überwiegend bei intravenöser Anwendung von Ondansetron wurden vorübergehende EKG-Veränderungen, einschließlich einer Verlängerung des QT-Intervalls, berichtet.
Allgemein
Spülung
Seltene Fälle von Überempfindlichkeitsreaktionen, manchmal schwerwiegend (z. B. anaphylaktische Reaktionen, Angioödem, Bronchospasmus, Kurzatmigkeit, Hypotonie, Larynxödem, Stridor), wurden ebenfalls berichtet. Laryngospasmus, Schock und Herz-Lungen-Stillstand sind während allergischer Reaktionen bei Patienten aufgetreten, die injizierbares Ondansetron erhielten.
Hepatobiliär
Anomalien der Leberenzyme.
Untere Atemwege
Schluckauf.
Neurologie
Okulogyrische Krise, die allein auftritt, sowie mit anderen dystonischen Reaktionen.
Haut
Urtikaria, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse.
Augenerkrankungen
Fälle von vorübergehender Erblindung, hauptsächlich während der intravenösen Verabreichung, wurden berichtet. Es wurde berichtet, dass diese Fälle von vorübergehender Erblindung innerhalb weniger Minuten bis zu 48 Stunden abklingen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Serotonerge Medikamente
Ein Serotonin-Syndrom (einschließlich verändertem Geisteszustand, autonomer Instabilität und neuromuskulären Symptomen) wurde nach gleichzeitiger Anwendung von 5-HT3-Rezeptorantagonisten und anderen serotonergen Arzneimitteln, einschließlich SSRIs und SNRIs, beschrieben. Überwachen Sie das Auftreten eines Serotonin-Syndroms. Wenn Symptome auftreten, setzen Sie ZOFRAN 4 mg ab und leiten Sie eine unterstützende Behandlung ein [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Medikamente, die Cytochrom P-450-Enzyme beeinflussen
Ondansetron selbst scheint das Cytochrom-P-450-Wirkstoff-metabolisierende Enzymsystem der Leber nicht zu induzieren oder zu hemmen [siehe KLINISCHE PHARMAKOLOGIE ]. Da Ondansetron durch hepatische Cytochrom-P450-Medikamente metabolisierende Enzyme (CYP3A4, CYP2D6, CYP1A2) metabolisiert wird, können Induktoren oder Inhibitoren dieser Enzyme die Clearance und damit die Halbwertszeit von Ondansetron verändern. Bei Patienten, die mit potenten Induktoren von CYP3A4 (dh Phenytoin, Carbamazepin und Rifampin) behandelt wurden, war die Clearance von Ondansetron signifikant erhöht und die Blutkonzentration von Ondansetron verringert. Auf der Grundlage der verfügbaren Daten wird jedoch für Patienten, die diese Arzneimittel einnehmen, keine Dosisanpassung für ZOFRAN 8 mg empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
Tramadol
Obwohl keine pharmakokinetischen Arzneimittelwechselwirkungen zwischen Ondansetron und Tramadol beobachtet wurden, deuten Daten aus 2 kleinen Studien darauf hin, dass ZOFRAN 8 mg bei gemeinsamer Anwendung die patientenkontrollierte Verabreichung von Tramadol erhöhen kann. Überwachen Sie die Patienten, um eine angemessene Schmerzkontrolle sicherzustellen, wenn Ondansetron zusammen mit Tramadol verabreicht wird.
Chemotherapie
Carmustin, Etoposid und Cisplatin beeinflussen die Pharmakokinetik von Ondansetron nicht.
In einer Crossover-Studie mit 76 pädiatrischen Patienten erhöhte intravenöses Ondansetron die systemischen Konzentrationen von hochdosiertem Methotrexat nicht.
Alfentanil und Atracurium
ZOFRAN 4 mg verändert nicht die atemdepressive Wirkung von Alfentanil oder den Grad der neuromuskulären Blockade von Atracurium. Wechselwirkungen mit Allgemein- oder Lokalanästhetika wurden nicht untersucht.
Drogenmissbrauch und -abhängigkeit
Tierstudien haben gezeigt, dass Ondansetron in direkten Suchtstudien weder als Benzodiazepin diskriminiert wird noch Benzodiazepine ersetzt.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie und Bronchospasmus, wurden bei Patienten berichtet, die eine Überempfindlichkeit gegenüber anderen selektiven 5-HT3-Rezeptorantagonisten gezeigt haben. Wenn Überempfindlichkeitsreaktionen auftreten, stellen Sie die Anwendung von ZOFRAN ein; unverzüglich gemäß Behandlungsstandard behandeln und überwachen, bis die Anzeichen und Symptome abgeklungen sind [siehe KONTRAINDIKATIONEN ].
QT-Verlängerung
Bei Patienten, die Ondansetron erhielten, wurden Veränderungen im Elektrokardiogramm (EKG), einschließlich einer Verlängerung des QT-Intervalls, beobachtet. Darüber hinaus wurden Postmarketing-Fälle von Torsade de Pointes bei Patienten berichtet, die ZOFRAN angewendet haben. Vermeiden Sie ZOFRAN 8 mg bei Patienten mit angeborenem Long-QT-Syndrom. Eine EKG-Überwachung wird bei Patienten mit Elektrolytanomalien (z. B. Hypokaliämie oder Hypomagnesiämie), dekompensierter Herzinsuffizienz, Bradyarrhythmien oder Patienten, die andere Arzneimittel einnehmen, die zu einer QT-Verlängerung führen, empfohlen [siehe KLINISCHE PHARMAKOLOGIE ].
Serotonin-Syndrom
Bei alleiniger Gabe von 5-HT3-Rezeptorantagonisten wurde über die Entwicklung eines Serotonin-Syndroms berichtet. Die meisten Berichte beziehen sich auf die gleichzeitige Anwendung von serotonergen Arzneimitteln (z. B. selektive Serotonin-Wiederaufnahmehemmer (SSRIs), Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SNRIs), Monoaminoxidase-Hemmer, Mirtazapin, Fentanyl, Lithium, Tramadol und intravenöses Methylenblau). Einige der gemeldeten Fälle verliefen tödlich. Es wurde auch über ein Serotonin-Syndrom berichtet, das bei einer Überdosierung von ZOFRAN 4 mg allein auftrat. Die meisten Berichte über ein Serotonin-Syndrom im Zusammenhang mit der Anwendung von 5-HT3-Rezeptor-Antagonisten traten in einer Pflegestation nach der Anästhesie oder einem Infusionszentrum auf.
Symptome im Zusammenhang mit dem Serotonin-Syndrom können die folgende Kombination von Anzeichen und Symptomen umfassen: Änderungen des mentalen Status (z. B. Unruhe, Halluzinationen, Delirium und Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Hitzewallungen, Hyperthermie) , neuromuskuläre Symptome (z. B. Tremor, Steifheit, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle mit oder ohne gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Durchfall). Patienten sollten auf das Auftreten eines Serotoninsyndroms überwacht werden, insbesondere bei gleichzeitiger Anwendung von ZOFRAN 4 mg und anderen serotonergen Arzneimitteln. Wenn Symptome eines Serotonin-Syndroms auftreten, ist ZOFRAN abzusetzen und eine unterstützende Behandlung einzuleiten. Die Patienten sollten über das erhöhte Risiko eines Serotoninsyndroms informiert werden, insbesondere wenn ZOFRAN gleichzeitig mit anderen serotonergen Arzneimitteln angewendet wird [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , ÜBERDOSIERUNG ].
Maskierung von progressivem Ileus und Magendehnung
Die Anwendung von ZOFRAN bei Patienten nach einer Bauchoperation oder bei Patienten mit Chemotherapie-induzierter Übelkeit und Erbrechen kann einen progressiven Ileus und/oder eine Magendehnung maskieren. Achten Sie auf verminderte Darmtätigkeit, insbesondere bei Patienten mit Risikofaktoren für eine gastrointestinale Obstruktion.
ZOFRAN 8mg ist kein Medikament, das die Magen- oder Darmperistaltik anregt. Es sollte nicht anstelle einer nasogastralen Absaugung verwendet werden.
Phenylketonurie
Patienten mit Phenylketonurie sollten darüber informiert werden, dass ZOFRAN ODT Tabletten mit oraler Auflösung Phenylalanin (ein Bestandteil von Aspartam) enthalten. Jede 4-mg- und 8-mg-Tablette zum Einnehmen enthält weniger als 0,03 mg Phenylalanin.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogene Wirkungen wurden in 2-Jahres-Studien an Ratten und Mäusen mit oralen Ondansetron-Dosen von bis zu 10 mg/kg pro Tag bzw. 30 mg/kg pro Tag (ungefähr das 4- bzw. 6-fache der maximal empfohlenen oralen Dosis von 24 mg beim Menschen) beobachtet pro Tag, bezogen auf die Körperoberfläche).
Ondansetron war in Standard-Mutagenitätstests nicht mutagen.
Die orale Verabreichung von Ondansetron von bis zu 15 mg/kg pro Tag (etwa das 6-fache der maximal empfohlenen oralen Humandosis von 24 mg pro Tag, basierend auf der Körperoberfläche) hatte keinen Einfluss auf die Fertilität oder die allgemeine Fortpflanzungsfähigkeit von männlichen und weiblichen Ratten.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Veröffentlichte epidemiologische Studien zum Zusammenhang zwischen der Anwendung von Ondansetron und schwerwiegenden Geburtsfehlern haben widersprüchliche Ergebnisse gemeldet und weisen wichtige methodische Einschränkungen auf, die Schlussfolgerungen über die Sicherheit der Anwendung von Ondansetron in der Schwangerschaft ausschließen (siehe Daten ). Verfügbare Postmarketing-Daten haben kein arzneimittelbedingtes Risiko einer Fehlgeburt oder ungünstiger mütterlicher Folgen identifiziert. Reproduktionsstudien an Ratten und Kaninchen zeigten keine Hinweise auf eine Schädigung des Fötus, wenn Ondansetron während der Organogenese in etwa dem 6- bzw Daten ).
Das Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Fehlgeburten oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften 2 % bis 4 % bzw. 15 % bis 20 %.
Daten
Menschliche Daten
Verfügbare Daten zur Anwendung von Ondansetron bei Schwangeren aus mehreren veröffentlichten epidemiologischen Studien schließen eine Bewertung eines arzneimittelbedingten Risikos unerwünschter fetaler Folgen aufgrund wichtiger methodischer Einschränkungen aus, einschließlich der Ungewissheit, ob Frauen, die ein Rezept ausgestellt haben, das Medikament tatsächlich einnahmen, die gleichzeitige Anwendung von anderen Medikamenten oder Behandlungen, Recall Bias und andere unadjustierte Confounder.
Die Ondansetron-Exposition in utero wurde in Gesamtanalysen nicht mit insgesamt schwerwiegenden angeborenen Fehlbildungen in Verbindung gebracht. Eine große retrospektive Kohortenstudie untersuchte 1970 Frauen, denen Ondansetron während der Schwangerschaft verschrieben wurde, und berichtete keinen Zusammenhang zwischen der Ondansetron-Exposition und schweren angeborenen Fehlbildungen, Fehlgeburten, Totgeburten, Frühgeburten, Säuglingen mit niedrigem Geburtsgewicht oder Säuglingen, die klein für das Gestationsalter waren.
Zwei große retrospektive Kohortenstudien und eine Fall-Kontroll-Studie haben die Ondansetron-Exposition im ersten Trimenon und das Risiko für kardiovaskuläre Defekte mit widersprüchlichen Ergebnissen bewertet. Relative Risiken (RR) reichten von 0,97 (95 % KI 0,86 bis 1,10) bis 1,62 (95 % KI 1,04, 2,54). Eine Subgruppenanalyse in einer der Kohortenstudien ergab, dass Ondansetron spezifisch mit Herzseptumdefekten assoziiert war (RR 2,05, 95 % KI 1,19, 3,28); dieser Zusammenhang wurde jedoch in anderen Studien nicht bestätigt.
Mehrere Studien haben Ondansetron und das Risiko von Mundspalten mit widersprüchlichen Ergebnissen bewertet. Eine retrospektive Kohortenstudie mit 1,8 Millionen Schwangerschaften in der US Medicaid Database zeigte ein erhöhtes Risiko für Mundspalten bei 88.467 Schwangerschaften, bei denen orales Ondansetron im ersten Trimester verschrieben wurde (RR 1,24, 95 % CI 1,03, 1,48), aber kein solcher Zusammenhang bestand berichtet mit intravenösem Ondansetron bei 23.866 Schwangerschaften (RR 0,95, 95 % KI 0,63, 1,43). In der Untergruppe der Frauen, die beide Verabreichungsformen erhielten, betrug das RR 1,07 (95 % KI 0,59; 1,93). Zwei Fall-Kontroll-Studien, die Daten aus Programmen zur Überwachung von Geburtsfehlern verwendeten, berichteten über widersprüchliche Zusammenhänge zwischen der Anwendung von Ondansetron durch die Mutter und einer isolierten Gaumenspalte (OR 1,6 [95 % KI 1,1, 2,3] und 0,5 [95 % KI 0,3, 1,0]). Es ist nicht bekannt, ob die Ondansetron-Exposition in utero bei Gaumenspalten während der Gaumenbildung erfolgte (der Gaumen wird zwischen der 6. und 9. Schwangerschaftswoche gebildet).
Tierdaten
In Studien zur embryofetalen Entwicklung an Ratten und Kaninchen erhielten trächtige Tiere während der Organogenese orale Ondansetron-Dosen von bis zu 15 mg/kg/Tag bzw. 30 mg/kg/Tag. Mit Ausnahme einer leichten Abnahme der mütterlichen Körpergewichtszunahme bei den Kaninchen gab es keine signifikanten Wirkungen von Ondansetron auf die mütterlichen Tiere oder die Entwicklung der Nachkommen. Bei Dosen von 15 mg/kg/Tag bei Ratten und 30 mg/kg/Tag bei Kaninchen betrug die maternale Expositionsspanne etwa das 6- bzw. 24-fache der maximal empfohlenen oralen Dosis von 24 mg/Tag beim Menschen, basierend auf der Körperoberfläche .
In einer Studie zur prä- und postnatalen Entwicklungstoxizität erhielten trächtige Ratten vom 17. Tag der Trächtigkeit bis zum 21. Tag des Wurfes orale Ondansetron-Dosen von bis zu 15 mg/kg/Tag keine Auswirkungen auf die trächtigen Ratten und die prä- und postnatale Entwicklung ihrer Nachkommen, einschließlich der Fortpflanzungsleistung der begatteten F1-Generation. Bei einer Dosis von 15 mg/kg/Tag bei Ratten betrug die maternale Expositionsgrenze etwa das 6-fache der maximal empfohlenen oralen Dosis von 24 mg/Tag beim Menschen, basierend auf der Körperoberfläche.
Stillzeit
Zusammenfassung der Risiken
Es ist nicht bekannt, ob Ondansetron in der Muttermilch vorhanden ist. Es liegen keine Daten zu den Auswirkungen von ZOFRAN 8 mg auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Es wurde jedoch nachgewiesen, dass Ondansetron in der Milch von Ratten vorhanden ist. Wenn ein Arzneimittel in tierischer Milch vorhanden ist, ist es wahrscheinlich, dass das Arzneimittel auch in der Muttermilch vorhanden ist.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an ZOFRAN 4 mg und möglichen Nebenwirkungen von ZOFRAN oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von oral verabreichtem ZOFRAN wurde bei pädiatrischen Patienten ab 4 Jahren zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer mäßig emetogenen Krebs-Chemotherapie nachgewiesen. Die Anwendung von ZOFRAN 4 mg in diesen Altersgruppen wird durch Belege aus angemessenen und gut kontrollierten Studien zu ZOFRAN bei Erwachsenen mit zusätzlichen Daten aus 3 offenen, unkontrollierten Studien außerhalb der USA mit 182 pädiatrischen Patienten im Alter von 4 bis 18 Jahren mit Krebs gestützt die eine Vielzahl von Cisplatin- oder Nicht-Cisplatin-Schemata erhielten [siehe DOSIERUNG UND ANWENDUNG , Klinische Studien ].
Weitere Informationen zur Anwendung von Ondansetron bei pädiatrischen Patienten finden Sie in den Verschreibungsinformationen für ZOFRAN Injektionen.
Die Sicherheit und Wirksamkeit von oral verabreichtem ZOFRAN 4 mg wurde bei pädiatrischen Patienten nicht nachgewiesen für:
Geriatrische Verwendung
Von der Gesamtzahl der Probanden, die an durch Chemotherapie verursachter und postoperativer Übelkeit und Erbrechen bei Krebserkrankungen in US-amerikanischen und ausländischen kontrollierten klinischen Studien, für die Subgruppenanalysen vorlagen, teilnahmen, waren 938 (19 %) 65 Jahre und älter.
Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen Probanden im Alter von 65 Jahren und älteren und jüngeren Probanden beobachtet. Bei Patienten über 75 Jahren wurde im Vergleich zu jüngeren Probanden eine Verringerung der Clearance und eine Verlängerung der Eliminationshalbwertszeit beobachtet [vgl KLINISCHE PHARMAKOLOGIE ]. In den klinischen Studien gab es eine unzureichende Anzahl von Patienten, die älter als 75 Jahre waren, um Schlussfolgerungen zur Sicherheit oder Wirksamkeit in dieser Altersgruppe zuzulassen. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Leberfunktionsstörung
Bei Patienten mit leichter oder mittelschwerer Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Bei Patienten mit schwerer Leberfunktionsstörung ist die Clearance reduziert und das scheinbare Verteilungsvolumen erhöht, was zu einer signifikanten Verlängerung der Halbwertszeit von Ondansetron führt. Daher darf bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Score von 10 oder höher) eine tägliche Gesamtdosis von 8 mg nicht überschritten werden [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Für Patienten mit eingeschränkter Nierenfunktion (leicht, mäßig oder schwer) wird keine Dosisanpassung empfohlen. Es liegen keine Erfahrungen über die Anwendung von Ondansetron am ersten Tag hinaus vor [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es gibt kein spezifisches Antidot für eine Ondansetron-Überdosierung. Die Patienten sollten mit einer geeigneten unterstützenden Therapie behandelt werden.
Zusätzlich zu den oben aufgeführten Nebenwirkungen wurden die folgenden Nebenwirkungen im Zusammenhang mit einer Ondansetron-Überdosierung beschrieben: „Plötzliche Erblindung“ (Amaurose) von 2 bis 3 Minuten Dauer plus schwere Verstopfung trat bei einem Patienten auf, dem 72 mg verabreicht wurden von Ondansetron intravenös als Einzeldosis. Hypotonie (und Ohnmacht) trat bei einem Patienten auf, der 48 mg ZOFRAN-Tabletten einnahm. Nach einer Infusion von 32 mg über einen Zeitraum von nur 4 Minuten wurde eine vasovagale Episode mit vorübergehendem Herzblock zweiten Grades beobachtet. In allen Fällen verschwanden die Nebenwirkungen vollständig.
Fälle bei Kindern, die mit einem Serotonin-Syndrom einhergehen, wurden nach versehentlicher oraler Überdosierung von Ondansetron (die die geschätzte Einnahme von 5 mg pro kg übersteigt) bei kleinen Kindern berichtet. Zu den berichteten Symptomen gehörten Schläfrigkeit, Unruhe, Tachykardie, Tachypnoe, Bluthochdruck, Hitzewallungen, Mydriasis, Diaphorese, myoklonische Bewegungen, horizontaler Nystagmus, Hyperreflexie und Krampfanfälle. Die Patienten benötigten unterstützende Behandlung, einschließlich Intubation in einigen Fällen, mit vollständiger Genesung ohne Folgeerscheinungen innerhalb von 1 bis 2 Tagen.
KONTRAINDIKATIONEN
ZOFRAN ist kontraindiziert bei Patienten:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Ondansetron ist ein selektiver 5-HT3-Rezeptorantagonist. Obwohl sein Wirkmechanismus noch nicht vollständig charakterisiert ist, ist Ondansetron kein Dopamin-Rezeptor-Antagonist. Serotoninrezeptoren vom 5-HT3-Typ sind sowohl peripher an vagalen Nervenenden als auch zentral in der Chemorezeptor-Triggerzone der Area postrema vorhanden. Es ist nicht sicher, ob die antiemetische Wirkung von Ondansetron zentral, peripher oder an beiden Stellen vermittelt wird. Jedoch scheint eine zytotoxische Chemotherapie mit der Freisetzung von Serotonin aus den enterochromaffinen Zellen des Dünndarms verbunden zu sein. Beim Menschen steigt die Ausscheidung von 5-Hydroxyindolessigsäure (5-HIAA) im Urin nach Verabreichung von Cisplatin parallel zum Einsetzen von Erbrechen. Das freigesetzte Serotonin kann über die 5-HT3-Rezeptoren die vagalen Afferenzen stimulieren und den Brechreflex auslösen.
Pharmakodynamik
Bei gesunden Probanden hatten intravenöse Einzeldosen von 0,15 mg/kg Ondansetron keine Auswirkung auf die Motilität des Ösophagus, die Motilität des Magens, den niedrigeren Ösophagussphinkterdruck oder die Dünndarmpassagezeit. Es wurde gezeigt, dass die mehrtägige Verabreichung von Ondansetron den Dickdarmtransit bei gesunden Probanden verlangsamt. Ondansetron hat keine Wirkung auf die Plasmaprolaktinkonzentrationen.
Herzelektrophysiologie
Die Verlängerung des QTc-Intervalls wurde in einer doppelblinden, Placebo- und positiv-kontrollierten Crossover-Studie mit einmaliger intravenöser Gabe an 58 gesunden Probanden untersucht. Die maximale mittlere (95 % obere Konfidenzgrenze) QTcF-Differenz gegenüber Placebo nach Korrektur der Baseline betrug 19,5 (21,8) Millisekunden und 5,6 (7,4) Millisekunden nach 15-minütiger intravenöser Infusion von 32 mg bzw. 8 mg Ondansetron-Injektion. Zwischen der Ondansetron-Konzentration und ΔΔQTcF wurde eine signifikante Expositions-Wirkungs-Beziehung festgestellt. Unter Verwendung der etablierten Expositions-Wirkungs-Beziehung hatten 24 mg, intravenös über 15 Minuten infundiert, ein mittleres vorhergesagtes (95 % oberes Vorhersageintervall) ΔΔQTcF von 14,0 (16,3) Millisekunden. Im Gegensatz dazu hatten 16 mg intravenös über 15 Minuten infundiert unter Verwendung des gleichen Modells ein mittleres vorhergesagtes (95 % oberes Vorhersageintervall) ΔΔQTcF von 9,1 (11,2) Millisekunden. In dieser Studie verlängerte die über 15 Minuten infundierte 8-mg-Dosis das QT-Intervall nicht in klinisch relevantem Ausmaß.
Pharmakokinetik
Absorption
Ondansetron wird aus dem Gastrointestinaltrakt resorbiert und unterliegt einem First-Pass-Metabolismus. Die mittlere Bioverfügbarkeit bei gesunden Probanden beträgt nach Verabreichung einer einzelnen 8-mg-Tablette etwa 56 %.
Die systemische Ondansetron-Exposition steigt nicht proportional zur Dosis. Die Fläche unter der Kurve (AUC) einer 16-mg-Tablette war um 24 % größer als bei einer 8-mg-Tablettendosis vorhergesagt. Dies kann eine gewisse Verringerung des First-Pass-Metabolismus bei höheren oralen Dosen widerspiegeln.
Auswirkungen auf Lebensmittel
Die Bioverfügbarkeit wird auch durch die Anwesenheit von Nahrungsmitteln leicht erhöht.
Verteilung
Die in vitro gemessene Plasmaproteinbindung von Ondansetron betrug 70 % bis 76 % über den Konzentrationsbereich von 10 bis 500 ng/ml. Zirkulierendes Medikament verteilt sich auch in Erythrozyten.
Beseitigung
Stoffwechsel und Ausscheidung
Ondansetron wird beim Menschen weitgehend metabolisiert, wobei etwa 5 % einer radioaktiv markierten Dosis als Muttersubstanz aus dem Urin wiedergefunden werden. Die Metaboliten werden im Urin beobachtet. Der primäre Stoffwechselweg ist die Hydroxylierung am Indolring, gefolgt von einer anschließenden Glucuronid- oder Sulfatkonjugation.
In-vitro-Stoffwechselstudien haben gezeigt, dass Ondansetron ein Substrat für humane hepatische Cytochrom-P-450-Enzyme, einschließlich CYP1A2, CYP2D6 und CYP3A4, ist. Hinsichtlich des Gesamtumsatzes von Ondansetron spielte CYP3A4 die vorherrschende Rolle. Aufgrund der Vielzahl metabolischer Enzyme, die Ondansetron metabolisieren können, ist es wahrscheinlich, dass die Hemmung oder der Verlust eines Enzyms (z. B. genetischer CYP2D6-Mangel) durch andere kompensiert wird und zu einer geringen Änderung der Gesamtausscheidungsrate von Ondansetron führen kann.
Obwohl einige nicht konjugierte Metaboliten eine pharmakologische Aktivität aufweisen, werden diese im Plasma nicht in Konzentrationen gefunden, die wahrscheinlich signifikant zur biologischen Aktivität von Ondansetron beitragen.
Spezifische Populationen
Alter: Geriatrische Bevölkerung
Bei Patienten, die älter als 75 Jahre sind, wird im Vergleich zu jüngeren Patienten eine Verringerung der Clearance und eine Verlängerung der Eliminationshalbwertszeit beobachtet [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Sex
Geschlechtsspezifische Unterschiede zeigten sich in der Disposition von Ondansetron als Einzeldosis. Das Ausmaß und die Resorptionsrate sind bei Frauen größer als bei Männern. Eine langsamere Clearance bei Frauen, ein kleineres scheinbares Verteilungsvolumen (gewichtsbereinigt) und eine höhere absolute Bioverfügbarkeit führten zu höheren Plasmakonzentrationen von Ondansetron. Diese höheren Plasmakonzentrationen können teilweise durch Unterschiede im Körpergewicht zwischen Männern und Frauen erklärt werden. Es ist nicht bekannt, ob diese geschlechtsbezogenen Unterschiede klinisch relevant waren. Ausführlichere pharmakokinetische Informationen sind in den Tabellen 5 und 6 enthalten.
Nierenfunktionsstörung
Es ist nicht zu erwarten, dass eine eingeschränkte Nierenfunktion die Gesamtclearance von Ondansetron signifikant beeinflusst, da die renale Clearance nur 5 % der Gesamtclearance ausmacht. Allerdings war die mittlere Plasma-Clearance von Ondansetron bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance unter 30 ml/min) um etwa 50 % verringert. Die Verringerung der Clearance war variabel und stimmte nicht mit einer Verlängerung der Halbwertszeit überein [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Leberfunktionsstörung
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung ist die Clearance um das Zweifache verringert und die mittlere Halbwertszeit auf 11,6 Stunden erhöht, verglichen mit 5,7 Stunden bei gesunden Probanden. Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Score von 10 oder höher) ist die Clearance um das 2- bis 3-Fache reduziert und das scheinbare Verteilungsvolumen ist erhöht, was zu einer Verlängerung der Halbwertszeit auf 20 Stunden führt [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Arzneimittelwechselwirkungsstudien
CYP 3A4-Induktoren
Die Elimination von Ondansetron kann durch Cytochrom-P-450-Induktoren beeinflusst werden. In einer pharmakokinetischen Studie mit 16 epileptischen Patienten, die chronisch auf CYP3A4-Induktoren, Carbamazepin oder Phenytoin gehalten wurden, wurde eine Verringerung der AUC, Cmax und t½ von Ondansetron beobachtet. Dies führte zu einer signifikanten Erhöhung der Clearance von Ondansetron. Es wird jedoch angenommen, dass dieser Anstieg klinisch nicht relevant ist [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Chemotherapeutische Mittel
Carmustin, Etoposid und Cisplatin beeinflussen die Pharmakokinetik von Ondansetron nicht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Antazida
Die gleichzeitige Verabreichung von Antazida verändert die Resorption von Ondansetron nicht.
Klinische Studien
Prävention von Chemotherapie-induzierter Übelkeit und Erbrechen
Hochemetogene Chemotherapie
In 2 randomisierten, doppelblinden Monotherapie-Studien war eine orale Einzeldosis von 24 mg ZOFRAN einer relevanten historischen Placebo-Kontrolle bei der Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer hoch emetogenen Krebs-Chemotherapie, einschließlich Cisplatin, von mindestens 50 überlegen Milligramm/m². Die Verabreichung von Steroiden war von diesen klinischen Studien ausgeschlossen. Mehr als 90 % der Patienten, die eine Cisplatin-Dosis von mindestens 50 mg/m² in der Vergleichstherapie mit historischem Placebo erhielten, erbrachen ohne antiemetische Therapie.
In der ersten Studie wurden orale Dosen von 24 mg Ondansetron als Einzeldosis, 8 mg alle 8 Stunden für 2 Dosen und 32 mg als Einzeldosis bei 357 erwachsenen Krebspatienten verglichen, die Chemotherapieschemata erhielten, die Cisplatin von mindestens 50 mg/m² enthielten . Die erste oder Einzeldosis wurde 30 Minuten vor der Chemotherapie verabreicht. Insgesamt 66 % der Patienten in der Gruppe mit 24 mg Ondansetron einmal täglich, 55 % in der Gruppe mit 8 mg Ondansetron zweimal täglich und 55 % in der Gruppe mit 32 mg Ondansetron einmal täglich schlossen die Behandlung ab die 24-stündige Versuchsperiode mit 0 emetischen Episoden und ohne antiemetische Notfallmedikation, dem primären Endpunkt der Wirksamkeit. Jede der 3 Behandlungsgruppen war einer historischen Placebo-Kontrolle statistisch signifikant überlegen.
In derselben Studie verspürten 56 % der Patienten, die eine orale Einzeldosis von 24 mg Ondansetron erhielten, während des 24-stündigen Studienzeitraums keine Übelkeit, verglichen mit 36 % der Patienten in der Gruppe mit zweimal täglich 8 mg oralem Ondansetron ( P = 0,001) und 50 % in der Gruppe mit oralem Ondansetron 32 mg einmal täglich. Dosierungsschemata von ZOFRAN 8 mg zweimal täglich und 32 mg einmal täglich werden nicht zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer stark emetogenen Chemotherapie empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
In einer zweiten Studie wurde die Wirksamkeit einer oralen Einzeldosis von 24 mg ZOFRAN 4 mg zur Vorbeugung von Übelkeit und Erbrechen im Zusammenhang mit einer stark emetogenen Krebs-Chemotherapie, einschließlich Cisplatin von mindestens 50 mg/m², bestätigt.
Mäßig emetogene Chemotherapie
In den USA wurde eine randomisierte, placebokontrollierte Doppelblindstudie mit 67 Patienten durchgeführt, die eine auf Cyclophosphamid basierende Chemotherapie mit Doxorubicin erhielten. Die erste 8-mg-Dosis von ZOFRAN 8 mg wurde 30 Minuten vor Beginn der Chemotherapie verabreicht, mit einer Folgedosis 8 Stunden nach der ersten Dosis, gefolgt von 8 mg ZOFRAN 8 mg zweimal täglich für 2 Tage nach Abschluss der Chemotherapie. ZOFRAN war bei der Vorbeugung von Erbrechen signifikant wirksamer als Placebo. Das Ansprechen auf die Behandlung basierte auf der Gesamtzahl der emetischen Episoden während des 3-tägigen Versuchszeitraums. Die Ergebnisse dieser Studie sind in Tabelle 7 zusammengefasst.
In einer doppelblinden US-Studie mit 336 Patienten, die eine auf Cyclophosphamid basierende Chemotherapie erhielten, die entweder Methotrexat oder Doxorubicin enthielt, war ZOFRAN 8 mg, zweimal täglich verabreicht, bei der Vorbeugung von Übelkeit und Erbrechen genauso wirksam wie ZOFRAN 8 mg, dreimal täglich verabreicht. ZOFRAN 8 mg dreimal täglich ist kein empfohlenes Schema zur Behandlung einer mäßig emetogenen Chemotherapie [siehe DOSIERUNG UND ANWENDUNG ].
Das Ansprechen auf die Behandlung basierte auf der Gesamtzahl der emetischen Episoden während des 3-tägigen Versuchszeitraums. Siehe Tabelle 8 für Einzelheiten der untersuchten Dosierungsschemata und Ergebnisse dieser Studie.
Nachbehandlung
In einarmigen Studien wurden 148 Patienten, die eine Cyclophosphamid-basierte Chemotherapie erhielten, mit ZOFRAN 8 mg dreimal täglich während der anschließenden Chemotherapie für insgesamt 396 Wiederholungsbehandlungszyklen erneut behandelt. In 314 (79 %) der Wiederholungsbehandlungszyklen traten keine emetischen Episoden auf, und in 43 (11 %) der Wiederholungsbehandlungszyklen traten nur 1 bis 2 emetische Episoden auf.
Pädiatrische Studien
Drei unverblindete, einarmige Studien außerhalb der USA wurden mit 182 pädiatrischen Patienten im Alter von 4 bis 18 Jahren mit Krebs durchgeführt, denen verschiedene Therapien mit Cisplatin oder Nicht-Cisplatin verabreicht wurden. Die Anfangsdosis von ZOFRAN 4 mg als Injektion reichte von 0,04 bis 0,87 mg pro kg (Gesamtdosis von 2,16 mg bis 12 mg), gefolgt von der oralen Verabreichung von ZOFRAN 4 mg in Dosen von 4 bis 24 mg täglich für 3 Tage. In diesen Studien zeigten 58 % der 170 auswertbaren Patienten an Tag 1 ein vollständiges Ansprechen (keine emetischen Episoden). In 2 Studien waren die Ansprechraten auf ZOFRAN 4 mg dreimal täglich bei Patienten unter 12 Jahren ähnlich denen von ZOFRAN 8 mg dreimal täglich bei Patienten zwischen 12 und 18 Jahren. Die Prävention von Erbrechen bei diesen pädiatrischen Patienten war im Wesentlichen die gleiche wie bei Erwachsenen.
Strahlungsinduzierte Übelkeit und Erbrechen
Ganzkörperbestrahlung
In einer randomisierten, placebokontrollierten, doppelblinden Studie mit 20 Patienten war 8 mg ZOFRAN, verabreicht 1,5 Stunden vor jeder Fraktion der Strahlentherapie für 4 Tage, signifikant wirksamer als Placebo bei der Vorbeugung von durch Ganzkörperbestrahlung induziertem Erbrechen. Die Ganzkörperbestrahlung bestand aus 11 Fraktionen (120 cGy pro Fraktion) über 4 Tage mit insgesamt 1.320 cGy. Die Patienten erhielten 3 Tage lang 3 Fraktionen, dann 2 Fraktionen an Tag 4.
Einzelne hochdosierte Fraktionsstrahlentherapie
In einer aktiv kontrollierten, doppelblinden Studie mit 105 Patienten, die eine einzelne Hochdosis-Strahlentherapie (800 bis 1.000 cGy) über ein vorderes oder hinteres Feld von mindestens 80 cm² bis zum Abdomen erhielten, war ZOFRAN 4 mg signifikant wirksamer als Metoclopramid in Bezug auf die vollständige Kontrolle des Erbrechens (0 emetische Episoden). Die Patienten erhielten die erste Dosis ZOFRAN (8 mg) oder Metoclopramid (10 mg) 1 bis 2 Stunden vor der Strahlentherapie. Wenn die Strahlentherapie am Morgen gegeben wurde, wurden 8 mg ZOFRAN 8 mg oder 10 mg Metoclopramid am späten Nachmittag verabreicht und vor dem Schlafengehen erneut wiederholt. Wenn die Strahlentherapie am Nachmittag durchgeführt wurde, nahmen die Patienten 8 mg ZOFRAN 4 mg oder 10 mg Metoclopramid nur einmal vor dem Schlafengehen ein. Die Patienten setzten die Dosen der oralen Medikation dreimal täglich für 3 Tage fort.
Tägliche fraktionierte Strahlentherapie
In einer aktiv kontrollierten, doppelblinden Studie mit 135 Patienten, die eine 1- bis 4-wöchige fraktionierte Strahlentherapie (Dosen von 180 cGy) über eine Feldgröße von mindestens 100 cm² bis zum Abdomen erhielten, war ZOFRAN 4 mg signifikant wirksamer als Prochlorperazin in Bezug auf die vollständige Kontrolle des Erbrechens (0 emetische Episoden). Die Patienten erhielten die erste Dosis von ZOFRAN (8 mg) oder Prochlorperazin (10 mg) 1 bis 2 Stunden vor der ersten täglichen Strahlentherapiefraktion, mit anschließenden 8-mg-Dosen ungefähr alle 8 Stunden an jedem Tag der Strahlentherapie.
Postoperative Übelkeit und Erbrechen
In 2 placebokontrollierten, doppelblinden Studien (eine durchgeführt in den USA und die andere außerhalb der USA) an 865 Frauen, die sich stationären chirurgischen Eingriffen unterzogen, wurde ZOFRAN 16 mg als Einzeldosis oder Placebo eine Stunde vor der Einleitung eines allgemeinen Gleichgewichts verabreicht Anästhesie (Barbiturat, Opioid, Lachgas, neuromuskuläre Blockade und zusätzliches Isofluran oder Enfluran) war ZOFRAN-Tabletten bei der Vorbeugung von postoperativer Übelkeit und Erbrechen signifikant wirksamer als Placebo.
Bei Männern wurden keine Studien durchgeführt.
INFORMATIONEN ZUM PATIENTEN
QT-Verlängerung
Informieren Sie die Patienten darüber, dass ZOFRAN schwerwiegende Herzrhythmusstörungen wie QT-Verlängerung verursachen kann. Weisen Sie die Patienten an, sofort ihren Arzt zu informieren, wenn sie eine Veränderung ihrer Herzfrequenz bemerken, wenn sie sich benommen fühlen oder wenn sie eine Synkopenepisode haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Überempfindlichkeitsreaktionen
Informieren Sie die Patienten darüber, dass ZOFRAN 4 mg Überempfindlichkeitsreaktionen hervorrufen kann, von denen einige so schwerwiegend sind wie Anaphylaxie und Bronchospasmus. Weisen Sie die Patienten an, alle Anzeichen und Symptome von Überempfindlichkeitsreaktionen, einschließlich Fieber, Schüttelfrost, Hautausschlag oder Atembeschwerden, unverzüglich ihrem medizinischen Betreuer zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Maskierung von progressivem Ileus und Magendehnung
Informieren Sie Patienten nach einer Bauchoperation oder Patienten mit Chemotherapie-induzierter Übelkeit und Erbrechen darüber, dass ZOFRAN 4 mg Anzeichen und Symptome eines Darmverschlusses maskieren kann. Weisen Sie die Patienten an, alle Anzeichen oder Symptome, die auf einen möglichen Darmverschluss hindeuten, unverzüglich ihrem medizinischen Betreuer zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wechselwirkungen mit anderen Medikamenten
Verabreichung von ZOFRAN 4 mg ODT im Mund zerfallende Tabletten
Weisen Sie die Patienten an, die im Mund zerfallenden ZOFRAN 4 mg ODT-Tabletten erst kurz vor der Einnahme aus der Blisterpackung zu nehmen.