Xalatan 2.5ml Latanoprost Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
XALATAN® (Latanoprost) Augenlösung
BEZEICHNUNG
Latanoprost ist ein Prostaglandin-F2α-Analogon. Sein chemischer Name ist Isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroxy-2-[(3R)-3-hydroxy-5-phenylpentyl]cyclopentyl]-5-heptenoat. Seine Summenformel ist C26H40O5 und seine chemische Struktur ist:
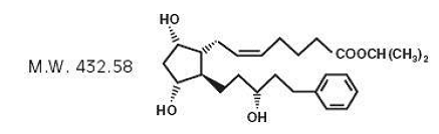
Latanoprost ist ein farbloses bis leicht gelbes Öl, das in Acetonitril sehr gut löslich und in Aceton, Ethanol, Ethylacetat, Isopropanol, Methanol und Octanol gut löslich ist. Es ist in Wasser praktisch unlöslich.
XALATAN (Latanoprost-Augenlösung) 0,005 % wird als sterile, isotonische, gepufferte wässrige Lösung von Latanoprost mit einem pH-Wert von etwa 6,7 und einer Osmolalität von etwa 267 mOsmol/kg geliefert. Jeder ml XALATAN enthält 50 µg Latanoprost. Als Konservierungsmittel wird 0,02 % Benzalkoniumchlorid zugesetzt. Die inaktiven Bestandteile sind: Natriumchlorid, Natriumdihydrogenphosphat-Monohydrat, wasserfreies Dinatriumhydrogenphosphat und Wasser für Injektionszwecke. Ein Tropfen enthält etwa 1,5 µg Latanoprost.
INDIKATIONEN
XALATAN 2,5 ml ist angezeigt zur Senkung des erhöhten Augeninnendrucks bei Patienten mit Offenwinkelglaukom oder okulärer Hypertonie.
DOSIERUNG UND ANWENDUNG
Die empfohlene Dosierung beträgt einmal täglich abends einen Tropfen in das/die betroffene(n) Auge(n). Wenn eine Dosis ausgelassen wurde, sollte die Behandlung wie gewohnt mit der nächsten Dosis fortgesetzt werden.
Die Dosierung von XALATAN sollte einmal täglich nicht überschritten werden; Die kombinierte Anwendung von zwei oder mehr Prostaglandinen oder Prostaglandin-Analoga einschließlich XALATAN 2,5 ml wird nicht empfohlen. Es wurde gezeigt, dass die mehr als einmal tägliche Verabreichung dieser Prostaglandin-Arzneimittel die den Augeninnendruck (IOD) senkende Wirkung verringern oder paradoxe Erhöhungen des IOD verursachen kann.
Die Senkung des Augeninnendrucks beginnt etwa 3 bis 4 Stunden nach der Verabreichung und die maximale Wirkung wird nach 8 bis 12 Stunden erreicht.
XALATAN kann gleichzeitig mit anderen topischen ophthalmologischen Arzneimitteln zur Senkung des Augeninnendrucks angewendet werden. Wenn mehr als ein topisches Augenarzneimittel verwendet wird, sollten die Arzneimittel im Abstand von mindestens fünf (5) Minuten verabreicht werden. Kontaktlinsen sollten vor der Verabreichung von XALATAN 2,5 ml entfernt werden und können 15 Minuten nach der Verabreichung wieder eingesetzt werden
WIE GELIEFERT
Darreichungsformen und Stärken
Sterile Augenlösung mit 50 µg/ml Latanoprost.
Lagerung und Handhabung
Xalatan ist eine klare, isotonische, gepufferte, konservierte farblose Lösung von 0,005 % (50 µg/ml) Latanoprost. Es wird als 2,5-ml-Lösung in einer 5-ml-Flasche aus klarem Polyethylen niedriger Dichte mit einer Tropfspitze aus klarem Polyethylen, einem türkisfarbenen Schraubverschluss aus Polyethylen hoher Dichte und einer manipulationssicheren Überkappe aus klarem Polyethylen niedriger Dichte geliefert.
2,5-ml-Füllung, 0,005 % (50 mcg/ml): Packung mit 1 Flasche: NDC 0013-8303-04 2,5-ml-Füllung, 0,005 % (50 mcg/ml): Mehrfachpackung mit 3 Flaschen: NDC 0013-8303-01
Lagerung
Vor Licht schützen. Ungeöffnete Flasche(n) im Kühlschrank bei 2° bis 8°C (36° bis 46°F) lagern. Während des Versands an den Patienten kann die Flasche bei Temperaturen bis zu 40 °C (104 °F) für einen Zeitraum von höchstens 8 Tagen aufbewahrt werden. Sobald eine Flasche zum Gebrauch geöffnet wurde, kann sie bei Raumtemperatur bis zu 25 °C (77 °F) 6 Wochen lang gelagert werden.
Vertrieb durch: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgien. Überarbeitet: n/a
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen wurden nach der Markteinführung berichtet und werden in anderen Abschnitten des Etiketts ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
XALATAN 2,5 ml wurde in drei multizentrischen, randomisierten, kontrollierten klinischen Studien untersucht. Die Patienten erhielten einmal täglich 50 µg/ml XALATAN oder zweimal täglich 5 mg/ml aktives Vergleichspräparat (Timolol). Die untersuchte Patientenpopulation hatte ein mittleres Alter von 65 ± 10 Jahren. Sieben Prozent der Patienten brachen die Studie vor dem 6-Monats-Endpunkt ab.
Weniger als 1 % der mit XALATAN 2,5 ml behandelten Patienten mussten die Therapie wegen Unverträglichkeit gegenüber konjunktivaler Hyperämie abbrechen.
Das okulare Ereignis/Anzeichen und Symptome einer Blepharitis wurden durch die Analyse von Daten aus klinischen Studien als „häufig beobachtet“ identifiziert.
Postmarketing-Erfahrung
Die folgenden Reaktionen wurden nach der Markteinführung von XALATAN in der klinischen Praxis festgestellt. Da sie freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Zu den Reaktionen, die aufgrund ihrer Schwere, Meldehäufigkeit, möglichen kausalen Verbindung zu XALATAN 2,5 ml oder einer Kombination dieser Faktoren für die Aufnahme ausgewählt wurden, gehören:
Erkrankungen des Nervensystems: Schwindel; Kopfschmerzen; toxische epidermale Nekrolyse
Augenerkrankungen: Wimpern- und Vellushaarveränderungen des Augenlids (erhöhte Länge, Dicke, Pigmentierung und Anzahl der Wimpern); Keratitis; Hornhautödem und Erosionen; intraokulare Entzündung (Iritis/Uveitis); Makulaödem, einschließlich zystoides Makulaödem; Trichiasis; periorbitale und Lidveränderungen, die zu einer Vertiefung der Augenlidfurche führen; Iriszyste; Verdunkelung der Augenlidhaut; lokalisierte Hautreaktion auf den Augenlidern; Bindehautentzündung; Pseudopemphigoid der Augenbindehaut
Erkrankungen der Atemwege, des Brustraums und des Mediastinums: Asthma und Verschlimmerung von Asthma; Dyspnoe
Erkrankungen der Haut und des Unterhautgewebes: Juckreiz
Infektionen und Schädlinge: Herpes-Keratitis
Herzerkrankungen: Angina; Herzklopfen; Angina instabil
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort: Brustschmerzen
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
In-vitro-Studien haben gezeigt, dass es zu Ausfällungen kommt, wenn Augentropfen, die Thimerosal enthalten, mit XALATAN gemischt werden. Wenn solche Medikamente verwendet werden, sollten sie im Abstand von mindestens fünf (5) Minuten verabreicht werden.
Die kombinierte Anwendung von zwei oder mehr Prostaglandinen oder Prostaglandin-Analoga einschließlich XALATAN 2,5 ml wird nicht empfohlen. Es hat sich gezeigt, dass die mehr als einmal tägliche Verabreichung dieser Prostaglandin-Arzneimittel die Augeninnendruck-senkende Wirkung verringern oder paradoxe Erhöhungen des Augeninnendrucks verursachen kann.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Pigmentierung
Es wurde berichtet, dass XALATAN Veränderungen an pigmentiertem Gewebe verursacht. Die am häufigsten berichteten Veränderungen waren eine verstärkte Pigmentierung der Iris, des periorbitalen Gewebes (Augenlids) und der Wimpern. Es ist zu erwarten, dass die Pigmentierung zunimmt, solange Latanoprost verabreicht wird.
Die Pigmentveränderung ist eher auf einen erhöhten Melaningehalt in den Melanozyten als auf eine Zunahme der Melanozytenzahl zurückzuführen. Nach Absetzen von Latanoprost ist die Pigmentierung der Iris wahrscheinlich dauerhaft, während die Pigmentierung des periorbitalen Gewebes und Wimpernveränderungen bei einigen Patienten reversibel waren. Patienten, die behandelt werden, sollten über die Möglichkeit einer verstärkten Pigmentierung informiert werden. Über 5 Jahre hinaus sind die Auswirkungen einer erhöhten Pigmentierung nicht bekannt [siehe Klinische Studien ].
Die Iris-Farbveränderung ist möglicherweise mehrere Monate bis Jahre lang nicht wahrnehmbar. Typischerweise breitet sich die braune Pigmentierung um die Pupille herum konzentrisch zur Peripherie der Iris aus und die gesamte Iris oder Teile der Iris werden bräunlicher. Weder Nävi noch Sommersprossen der Iris scheinen von der Behandlung betroffen zu sein. Während die Behandlung mit XALATAN 2,5 ml bei Patienten fortgesetzt werden kann, die eine merklich verstärkte Irispigmentierung entwickeln, sollten diese Patienten regelmäßig untersucht werden [siehe INFORMATIONEN ZUM PATIENTEN ].
Wimpernveränderungen
XALATAN 2,5 ml kann Wimpern und Flaumhaar im behandelten Auge allmählich verändern; Zu diesen Veränderungen gehören eine erhöhte Länge, Dicke, Pigmentierung, die Anzahl der Wimpern oder Haare und ein fehlgeleitetes Wimpernwachstum. Wimpernveränderungen sind in der Regel nach Absetzen der Behandlung reversibel [siehe INFORMATIONEN ZUM PATIENTEN ].
Intraokulare Entzündung
XALATAN 2,5 ml sollte bei Patienten mit intraokularer Entzündung (Iritis/Uveitis) in der Anamnese mit Vorsicht angewendet werden und sollte im Allgemeinen nicht bei Patienten mit aktiver intraokularer Entzündung angewendet werden, da sich die Entzündung verschlimmern kann.
Makulaödem
Makulaödem, einschließlich zystoides Makulaödem, wurde während der Behandlung mit XALATAN berichtet. XALATAN 2,5 ml sollte bei aphaken Patienten, bei pseudophaken Patienten mit einer zerrissenen hinteren Linsenkapsel oder bei Patienten mit bekannten Risikofaktoren für ein Makulaödem mit Vorsicht angewendet werden.
Herpetische Keratitis
Während der Behandlung mit XALATAN wurde über eine Reaktivierung einer Herpes-simplex-Keratitis berichtet. XALATAN 2,5 ml sollte bei Patienten mit herpetischer Keratitis in der Vorgeschichte mit Vorsicht angewendet werden. XALATAN 2,5 ml sollte bei aktiver Herpes-simplex-Keratitis vermieden werden, da die Entzündung verschlimmert werden kann.
Bakterielle Keratitis
Es gibt Berichte über bakterielle Keratitis im Zusammenhang mit der Verwendung von Mehrfachdosisbehältnissen topischer ophthalmischer Produkte. Diese Behälter waren versehentlich von Patienten kontaminiert worden, die in den meisten Fällen gleichzeitig eine Hornhauterkrankung oder eine Störung der Augenepitheloberfläche hatten [siehe INFORMATIONEN ZUM PATIENTEN ].
Verwendung mit Kontaktlinsen
Kontaktlinsen sollten vor der Verabreichung von XALATAN entfernt werden und können 15 Minuten nach der Verabreichung wieder eingesetzt werden.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Latanoprost war weder bei Mäusen noch bei Ratten karzinogen, wenn es über eine Dauer von bis zu 20 bzw. 24 Monaten in Dosen von bis zu 170 mcg/kg/Tag (etwa das 2800-fache der empfohlenen maximalen Humandosis) per Schlundsonde verabreicht wurde.
Latanoprost war nicht mutagen bei Bakterien, Maus-Lymphomen oder Mikronukleus-Tests an Mäusen. Bei humanen Lymphozyten wurden in vitro Chromosomenaberrationen beobachtet. Weitere In-vitro- und In-vivo-Studien zur außerplanmäßigen DNA-Synthese bei Ratten verliefen negativ.
In tierexperimentellen Studien wurde festgestellt, dass Latanoprost keine Auswirkungen auf die männliche oder weibliche Fertilität hat.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C.
Reproduktionsstudien wurden an Ratten und Kaninchen durchgeführt. Bei Kaninchen hatten 4 von 16 Muttertieren keine lebensfähigen Föten bei einer Dosis, die ungefähr dem 80-fachen der maximalen Humandosis entsprach, und die höchste nicht-embryozide Dosis bei Kaninchen war ungefähr das 15-fache der maximalen Humandosis.
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. XALATAN 2,5 ml sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Es ist nicht bekannt, ob dieses Arzneimittel oder seine Metaboliten in die Muttermilch übergehen. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn XALATAN 2,5 ml einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet.
ÜBERDOSIS
Die intravenöse Infusion von bis zu 3 mcg/kg bei gesunden Probanden führte zu 200-mal höheren mittleren Plasmakonzentrationen als während der klinischen Behandlung, und es wurden keine Nebenwirkungen beobachtet. Intravenöse Dosierungen von 5,5 bis 10 mcg/kg verursachten Bauchschmerzen, Schwindel, Müdigkeit, Hitzewallungen, Übelkeit und Schwitzen. Wenn eine Überdosierung mit XALATAN auftritt, sollte die Behandlung symptomatisch sein.
KONTRAINDIKATIONEN
Bekannte Überempfindlichkeit gegen Latanoprost, Benzalkoniumchlorid oder andere Bestandteile dieses Produkts.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Latanoprost ist ein Prostanoid-selektiver FP-Rezeptoragonist, von dem angenommen wird, dass er den Augeninnendruck (IOD) senkt, indem er den Abfluss von Kammerwasser erhöht. Studien an Tieren und Menschen legen nahe, dass der Hauptwirkungsmechanismus ein erhöhter uveoskleraler Abfluss ist. Ein erhöhter Augeninnendruck stellt einen Hauptrisikofaktor für einen glaukomatösen Gesichtsfeldverlust dar. Je höher der IOP-Wert, desto größer ist die Wahrscheinlichkeit einer Schädigung des Sehnervs und eines Gesichtsfeldverlusts.
Pharmakodynamik
Die Senkung des IOP beim Menschen beginnt etwa 3-4 Stunden nach der Verabreichung und die maximale Wirkung wird nach 8-12 Stunden erreicht. Die IOP-Reduktion besteht für mindestens 24 Stunden.
Pharmakokinetik
Absorption
Latanoprost wird durch die Hornhaut absorbiert, wo das Isopropylester-Prodrug zur Säureform hydrolysiert wird, um biologisch aktiv zu werden.
Verteilung
Das Verteilungsvolumen beim Menschen beträgt 0,16 ± 0,02 l/kg. Die Säure von Latanoprost kann während der ersten 4 Stunden im Kammerwasser und nur während der ersten Stunde nach lokaler Verabreichung im Plasma gemessen werden. Studien am Menschen weisen darauf hin, dass die Spitzenkonzentration im Kammerwasser etwa zwei Stunden nach topischer Verabreichung erreicht wird.
Stoffwechsel
Latanoprost, ein Isopropylester-Prodrug, wird durch Esterasen in der Hornhaut zur biologisch aktiven Säure hydrolysiert. Die aktive Säure von Latanoprost, die den systemischen Kreislauf erreicht, wird hauptsächlich durch die Leber zu den 1,2-Dinor- und 1,2,3,4-Tetranor-Metaboliten über Fettsäure-β-Oxidation metabolisiert.
Ausscheidung
Die Elimination der Säure von Latanoprost aus dem menschlichen Plasma erfolgt schnell (t½ = 17 min) sowohl nach intravenöser als auch nach topischer Verabreichung. Die systemische Clearance beträgt etwa 7 ml/min/kg. Nach hepatischer β-Oxidation werden die Metaboliten hauptsächlich über die Nieren ausgeschieden. Etwa 88 % bzw. 98 % der verabreichten Dosis werden nach topischer bzw. intravenöser Gabe im Urin wiedergefunden.
Klinische Studien
Erhöhter Ausgangs-IOD
Patienten mit einem mittleren Ausgangs-IOD von 24–25 mmHg, die 6 Monate lang in multizentrischen, randomisierten, kontrollierten Studien behandelt wurden, zeigten eine Verringerung des IOD um 6–8 mmHg. Diese IOP-Senkung bei einmal täglicher Gabe von 0,005 % XALATAN entsprach der Wirkung von zweimal täglich 0,5 % Timolol.
Fortschreiten der erhöhten Irispigmentierung
Eine 3-jährige offene, prospektive Sicherheitsstudie mit einer 2-jährigen Verlängerungsphase wurde durchgeführt, um das Fortschreiten einer erhöhten Irispigmentierung bei kontinuierlicher Anwendung von XALATAN einmal täglich als Zusatztherapie bei 519 Patienten mit Offenwinkelglaukom zu bewerten. Die Analyse basierte auf der Population der beobachteten Fälle der 380 Patienten, die in der Verlängerungsphase fortfuhren.
Die Ergebnisse zeigten, dass der Beginn einer merklich erhöhten Irispigmentierung bei der Mehrheit der Patienten, die eine merklich erhöhte Irispigmentierung entwickelten, innerhalb des ersten Behandlungsjahres auftrat. Die Patienten zeigten während der fünf Jahre der Studie weiterhin Anzeichen einer zunehmenden Irispigmentierung. Die Beobachtung einer erhöhten Irispigmentierung hatte keinen Einfluss auf das Auftreten, die Art oder den Schweregrad der in der Studie aufgezeichneten unerwünschten Ereignisse (außer einer erhöhten Irispigmentierung). Die IOP-Reduktion war ähnlich, unabhängig von der Entwicklung einer erhöhten Irispigmentierung während der Studie.
INFORMATIONEN ZUM PATIENTEN
Potenzial für Pigmentierung
Informieren Sie die Patienten über die Möglichkeit einer verstärkten braunen Pigmentierung der Iris, die dauerhaft sein kann. Informieren Sie die Patienten über die Möglichkeit einer Dunkelfärbung der Augenlider, die nach Absetzen von XALATAN reversibel sein kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Potenzial für Wimpernveränderungen
Informieren Sie die Patienten über die Möglichkeit von Wimpern- und Vellushaarveränderungen im behandelten Auge während der Behandlung mit XALATAN. Diese Veränderungen können zu einer Ungleichheit zwischen den Augen in Länge, Dicke, Pigmentierung, Anzahl der Wimpern oder Vellushaare und/oder Richtung des Wimpernwachstums führen. Wimpernveränderungen sind in der Regel nach Absetzen der Behandlung reversibel.
Umgang mit dem Container
Weisen Sie die Patienten an, den Kontakt der Spitze des Spenderbehälters mit dem Auge oder umgebenden Strukturen zu vermeiden, da dies dazu führen könnte, dass die Spitze durch häufig vorkommende Bakterien kontaminiert wird, von denen bekannt ist, dass sie Augeninfektionen verursachen. Schwere Augenschäden und nachfolgender Verlust des Sehvermögens können durch die Verwendung kontaminierter Lösungen verursacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Wann Sie ärztlichen Rat einholen sollten
Weisen Sie die Patienten darauf hin, dass sie bei Auftreten einer interkurrenten Augenerkrankung (z. B. Trauma oder Infektion) oder einer Augenoperation oder bei Augenreaktionen, insbesondere Konjunktivitis und Augenlidreaktionen, unverzüglich den Rat ihres Arztes bezüglich der weiteren Anwendung der Mehrfachdosis einholen sollten Container.
Verwendung mit Kontaktlinsen
Weisen Sie die Patienten darauf hin, dass XALATAN 2,5 ml Benzalkoniumchlorid enthält, das von Kontaktlinsen absorbiert werden kann. Kontaktlinsen sollten vor der Verabreichung der Lösung entfernt werden. Linsen können 15 Minuten nach Verabreichung von XALATAN wieder eingesetzt werden.
Verwendung mit anderen Augenmedikamenten
Wenn mehr als ein topisches Augenarzneimittel verwendet wird, sollten die Arzneimittel im Abstand von mindestens fünf (5) Minuten verabreicht werden.