Propecia 1mg, 5mg Finasteride Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Propecia 1 mg und wie wird es angewendet?
Propecia ist ein verschreibungspflichtiges Medikament zur Behandlung der Symptome von benigner Prostatahyperplasie (BPH), Haarausfall bei Männern (androgenetische Alopezie). Propecia kann allein oder mit anderen Medikamenten verwendet werden.
Propecia 1 mg gehört zu einer Klasse von Arzneimitteln, die als 5-Alpha-Reduktase-Hemmer bezeichnet werden.
Es ist nicht bekannt, ob Propecia 1 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Propecia 5mg haben?
Propecia 1 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Propecia 5mg sind:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Propecia. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Propecia (Finasterid) Tabletten enthalten Finasterid als Wirkstoff. Finasterid, eine synthetische 4-Azasteroid-Verbindung, ist ein spezifischer Inhibitor der Steroid-Typ-II-5α-Reduktase, eines intrazellulären Enzyms, das das Androgen Testosteron in 5α-Dihydrotestosteron (DHT) umwandelt.
Der chemische Name von Finasterid ist N-tert-Butyl-3-oxo-4-aza-5α-androst-1-ene-17β-carboxamide. Die empirische Formel von Finasterid ist C23H36N2O2 und sein Molekulargewicht beträgt 372,55. Seine Strukturformel lautet:
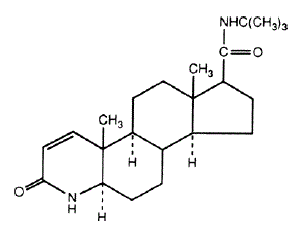
Finasterid ist ein weißes kristallines Pulver mit einem Schmelzpunkt nahe 250 °C. Es ist frei löslich in Chloroform und in niederen Alkohollösungsmitteln, aber praktisch unlöslich in Wasser.
Propecia (Finasterid) Tabletten sind Filmtabletten zur oralen Verabreichung. Jede Tablette enthält 1 mg Finasterid und die folgenden Hilfsstoffe: Lactose-Monohydrat, mikrokristalline Cellulose, vorverkleisterte Stärke, Carboxymethylstärke-Natrium, Hydroxypropylmethylcellulose, Hydroxypropylcellulose, Titandioxid, Magnesiumstearat, Talk, Natriumdocusat, gelbes Eisenoxid und rotes Eisenoxid Oxid.
INDIKATIONEN
PROPECIA® ist NUR bei MÄNNERN für die Behandlung von männlichem Haarausfall (androgenetische Alopezie) indiziert.
Die Wirksamkeit bei bitemporaler Rezession wurde nicht nachgewiesen.
Propecia ist nicht für die Anwendung bei Frauen angezeigt.
DOSIERUNG UND ANWENDUNG
Propecia kann mit oder ohne Mahlzeiten verabreicht werden.
Die empfohlene Dosis von Propecia ist eine Tablette (1 mg) einmal täglich.
Im Allgemeinen ist eine tägliche Anwendung für mindestens drei Monate erforderlich, bevor ein Nutzen eintritt. Eine fortgesetzte Anwendung wird empfohlen, um den Nutzen aufrechtzuerhalten, der regelmäßig neu bewertet werden sollte. Ein Absetzen der Behandlung führt innerhalb von 12 Monaten zur Aufhebung der Wirkung.
WIE GELIEFERT
Darreichungsformen und Stärken
PROPECIA 5 mg Tabletten (1 mg) sind hellbraune, achteckige, konvexe Filmtabletten mit dem Logo „stilisiertes P“ auf der einen Seite und PROPECIA 5 mg auf der anderen Seite.
PROPECIA Tabletten, 1 mg, sind hellbraune, achteckige, konvexe Filmtabletten mit dem Logo „stilisiertes P“ auf der einen Seite und PROPECIA auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 78206-152-01 Flaschen zu 30 (mit Trockenmittel) NDC 78206-152-02 PROPAK-Flaschen mit 90 ® (mit Trockenmittel).
Lagerung und Handhabung
Bei Raumtemperatur lagern, 15-30°C (59-86°F). Behälter geschlossen halten und vor Feuchtigkeit schützen.
Frauen sollten wegen der Möglichkeit einer Resorption von Finasterid und dem daraus resultierenden potenziellen Risiko für einen männlichen Fötus keine zerkleinerten oder zerbrochenen Propecia-Tabletten handhaben, wenn sie schwanger sind oder möglicherweise schwanger sind. PROPECIA 5 mg Tabletten sind überzogen und verhindern den Kontakt mit dem Wirkstoff bei normaler Handhabung, vorausgesetzt, dass die Tabletten nicht zerbrochen oder zerdrückt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen und Informationen zur Patientenberatung ].
Dist. von: Organon LLC, eine Tochtergesellschaft von ORGANON & Co., Jersey City, NJ 07302, USA. Überarbeitet: Juni 2021
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Klinische Studien für Propecia (Finasterid 1 mg) bei der Behandlung von männlichem Haarausfall
In drei kontrollierten klinischen Studien zu Propecia 5 mg mit einer Dauer von 12 Monaten brachen 1,4 % der Patienten, die Propecia einnahmen (n = 945), aufgrund von Nebenwirkungen ab, die als möglicherweise, wahrscheinlich oder definitiv arzneimittelbedingt angesehen wurden (1,6 % für Placebo; n = 934).
Klinische Nebenwirkungen, die bei ≥ 1 % der mit Propecia oder Placebo behandelten Patienten als möglicherweise, wahrscheinlich oder definitiv arzneimittelbedingt berichtet wurden, sind in Tabelle 1 aufgeführt.
TABELLE 1: Arzneimittelbedingte Nebenwirkungen von Propecia (Finasterid 1 mg) in Jahr 1 (%) HAARVERLUST MIT MÄNNLICHEM MUSTER
Die integrierte Analyse klinischer Nebenwirkungen zeigte, dass während der Behandlung mit Propecia 1 mg 36 (3,8 %) von 945 Männern über eine oder mehrere dieser Nebenwirkungen berichteten, verglichen mit 20 (2,1 %) von 934 Männern, die mit Placebo behandelt wurden (p = 0,04). . Bei Männern, die die Therapie mit Propecia aufgrund dieser Nebenwirkungen abbrachen, und bei den meisten Männern, die die Therapie fortsetzten, kam es zu einer Rückbildung. Die Inzidenz jeder der oben genannten Nebenwirkungen sank bis zum fünften Behandlungsjahr mit Propecia auf ≤ 0,3 %.
In einer Studie mit täglich 1 mg Finasterid bei gesunden Männern wurde nach 48-wöchiger Behandlung eine mediane Abnahme des Ejakulatvolumens um 0,3 ml (-11 %) im Vergleich zu 0,2 ml (-8 %) bei Placebo beobachtet. Zwei weitere Studien zeigten, dass Finasterid bei der 5-fachen Dosierung von Propecia (5 mg täglich) im Vergleich zu Placebo zu einer signifikanten medianen Abnahme des Ejakulatvolumens von etwa 0,5 ml (-25 %) führte, dies war jedoch nach Absetzen der Behandlung reversibel.
In den klinischen Studien mit Propecia unterschied sich die Häufigkeit von Brustspannen und -vergrößerung, Überempfindlichkeitsreaktionen und Hodenschmerzen bei mit Finasterid behandelten Patienten nicht von denen bei Patienten, die mit Placebo behandelt wurden.
Kontrollierte klinische Studien und langfristige offene Verlängerungsstudien für PROSCAR® (Finasterid 5 mg) und AVODART (Dutasterid) bei der Behandlung von benigner Prostatahyperplasie
In der PROSCAR Long-Term Efficacy and Safety Study (PLESS), einer 4-jährigen kontrollierten klinischen Studie, wurden 3040 Patienten im Alter zwischen 45 und 78 Jahren mit symptomatischer BPH und einer vergrößerten Prostata auf Sicherheit über einen Zeitraum von 4 Jahren untersucht (1524 unter PROSCAR 5 mg/Tag und 1516 unter Placebo). 3,7 % (57 Patienten), die mit PROSCAR 5 mg behandelt wurden, und 2,1 % (32 Patienten), die mit Placebo behandelt wurden, brachen die Therapie aufgrund von Nebenwirkungen im Zusammenhang mit der Sexualfunktion ab, die die am häufigsten berichteten Nebenwirkungen sind.
Tabelle 2 zeigt die einzigen klinischen Nebenwirkungen, die vom Prüfarzt als möglicherweise, wahrscheinlich oder definitiv arzneimittelbedingt angesehen wurden und deren Inzidenz unter PROSCAR ≥ 1 % und höher als unter Placebo über die 4 Jahre der Studie war. In den Jahren 2-4 der Studie gab es keinen signifikanten Unterschied zwischen den Behandlungsgruppen in Bezug auf das Auftreten von Impotenz, verminderter Libido und Ejakulationsstörung.
TABELLE 2: Arzneimittelbedingte Nebenwirkungen bei PROSCAR (Finasterid 5 mg) BETIGNE PROSTATAHYPERPLASIE
Die Nebenwirkungsprofile in den 1-jährigen, placebokontrollierten Phase-III-BPH-Studien und den 5-jährigen offenen Verlängerungen mit PROSCAR 5 mg und PLESS waren ähnlich.
Es gibt keine Hinweise auf vermehrte sexuelle Nebenwirkungen bei längerer Behandlungsdauer mit PROSCAR 5 mg. Neue Berichte über arzneimittelbezogene sexuelle Nebenwirkungen nahmen mit der Dauer der Therapie ab.
Während der 4- bis 6-jährigen placebo- und komparatorkontrollierten MTOPS-Studie (Medical Therapy of Prostatic Symptoms), an der 3047 Männer teilnahmen, traten 4 Fälle von Brustkrebs bei Männern auf, die mit PROSCAR behandelt wurden, aber keine Fälle bei Männern, die nicht mit PROSCAR behandelt wurden. Während der 4-jährigen placebokontrollierten PLESS-Studie, an der 3040 Männer teilnahmen, gab es 2 Fälle von Brustkrebs bei mit Placebo behandelten Männern, aber es wurden keine Fälle bei Männern berichtet, die mit PROSCAR behandelt wurden.
Während der 7-jährigen placebokontrollierten Prostate Cancer Prevention Trial (PCPT), an der 18.882 Männer teilnahmen, trat 1 Fall von Brustkrebs bei mit PROSCAR behandelten Männern und 1 Fall von Brustkrebs bei mit Placebo behandelten Männern auf. Der Zusammenhang zwischen der Langzeitanwendung von Finasterid und Neoplasien der männlichen Brust ist derzeit nicht bekannt.
Die PCPT-Studie war eine 7-jährige randomisierte, doppelblinde, placebokontrollierte Studie, an der 18.882 gesunde Männer im Alter von ≥ 55 Jahren mit normaler digital-rektaler Untersuchung und einem PSA-Wert von ≤ 3,0 ng/ml teilnahmen. Männer erhielten täglich entweder PROSCAR (Finasterid 5 mg) oder Placebo. Die Patienten wurden jährlich mit PSA- und digital-rektalen Untersuchungen untersucht. Biopsien wurden bei erhöhtem PSA, einer anormalen digitalen rektalen Untersuchung oder dem Ende der Studie durchgeführt. Die Inzidenz von Prostatakrebs mit einem Gleason-Score von 8-10 war bei mit Finasterid behandelten Männern höher (1,8 %) als bei den mit Placebo behandelten (1,1 %). In einer 4-jährigen placebokontrollierten klinischen Studie mit einem anderen 5α-Reduktase-Hemmer [AVODART (Dutasterid)] wurden ähnliche Ergebnisse für Prostatakrebs mit Gleason-Score 8-10 beobachtet (1 % Dutasterid vs. 0,5 % Placebo). Die klinische Bedeutung dieser Ergebnisse in Bezug auf die Anwendung von Propecia durch Männer ist nicht bekannt.
Bei mit PROSCAR behandelten Patienten mit Prostatakrebs wurde kein klinischer Nutzen nachgewiesen. PROSCAR ist nicht zur Verringerung des Risikos der Entwicklung von Prostatakrebs zugelassen.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Propecia nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
Überempfindlichkeitsreaktion: Überempfindlichkeitsreaktionen wie Hautausschlag, Juckreiz, Urtikaria und Angioödem (einschließlich Schwellung von Lippen, Zunge, Rachen und Gesicht);
Fortpflanzungsapparat: sexuelle Dysfunktion, die nach Absetzen der Behandlung anhielt, einschließlich erektiler Dysfunktion, Libidostörungen, Ejakulationsstörungen und Orgasmusstörungen; männliche Unfruchtbarkeit und/oder schlechte Samenqualität (nach Absetzen von Finasterid wurde über eine Normalisierung oder Verbesserung der Samenqualität berichtet); Hodenschmerzen; Hämospermie.
Neubildungen: männlicher Brustkrebs;
Brusterkrankungen: Brustspannen und -vergrößerung;
Nervensystem/Psychiatrie: Depression
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Cytochrom P450-Linked Drug Metabolizing Enzyme System
Es wurden keine Arzneimittelwechselwirkungen von klinischer Bedeutung festgestellt. Finasterid scheint das mit Cytochrom P450 verbundene Enzymsystem zur Metabolisierung von Arzneimitteln nicht zu beeinflussen. Zu den am Menschen getesteten Verbindungen gehören Antipyrin, Digoxin, Propranolol, Theophyllin und Warfarin, und es wurden keine klinisch bedeutsamen Wechselwirkungen gefunden.
Andere Begleittherapie
Obwohl keine spezifischen Wechselwirkungsstudien durchgeführt wurden, wurden Finasterid-Dosen von 1 mg oder mehr gleichzeitig in klinischen Studien mit Paracetamol, Acetylsalicylsäure, α-Blockern, Analgetika, Angiotensin-Converting-Enzym (ACE)-Hemmern, Antikonvulsiva, Benzodiazepinen, Betablockern und Calcium angewendet -Kanalblocker, Herznitrate, Diuretika, H2-Antagonisten, HMG-CoA-Reduktase-Hemmer, Prostaglandin-Synthetase-Hemmer (auch als NSAR bezeichnet) und Chinolon-Antiinfektiva ohne Nachweis klinisch signifikanter unerwünschter Wechselwirkungen.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Exposition von Frauen – Risiko für männlichen Fötus
Propecia ist nicht für die Anwendung bei Frauen angezeigt. Frauen sollten wegen der Möglichkeit einer Resorption von Finasterid und dem daraus resultierenden potenziellen Risiko für einen männlichen Fötus keine zerkleinerten oder zerbrochenen Propecia-Tabletten handhaben, wenn sie schwanger sind oder möglicherweise schwanger sind. PROPECIA-Tabletten sind überzogen und verhindern bei normaler Handhabung den Kontakt mit dem Wirkstoff, sofern die Tabletten nicht zerbrochen oder zerdrückt wurden. [Sehen INDIKATIONEN UND VERWENDUNG , KONTRAINDIKATIONEN , Verwendung in bestimmten Bevölkerungsgruppen , WIE GELIEFERT / Lagerung und Handhabung und Informationen zur Patientenberatung ]
Auswirkungen auf das prostataspezifische Antigen (PSA)
In klinischen Studien mit Propecia (Finasterid, 1 mg) bei Männern im Alter von 18 bis 41 Jahren sank der Mittelwert des prostataspezifischen Antigens (PSA) im Serum von 0,7 ng/ml zu Studienbeginn auf 0,5 ng/ml in Monat 12. In klinischen Studien mit PROSCAR (Finasterid, 5 mg) bei Anwendung bei älteren Männern mit gutartiger Prostatahyperplasie (BPH) wurden die PSA-Werte um etwa 50 % gesenkt. Andere Studien mit PROSCAR zeigten, dass es auch bei Vorliegen von Prostatakrebs zu einer Abnahme des Serum-PSA führen kann. Diese Befunde sollten bei der Beurteilung von mit Finasterid behandelten Männern für die richtige Interpretation des Serum-PSA berücksichtigt werden. Jeder bestätigte Anstieg vom niedrigsten PSA-Wert während der Behandlung mit Propecia kann auf das Vorhandensein von Prostatakrebs hindeuten und sollte untersucht werden, selbst wenn die PSA-Werte bei Männern, die keinen 5α-Reduktase-Hemmer einnehmen, immer noch im normalen Bereich liegen. Die Nichteinhaltung der Therapie mit Propecia 5 mg kann auch die PSA-Testergebnisse beeinflussen.
Erhöhtes Risiko für hochgradigen Prostatakrebs mit 5α-Reduktase-Inhibitoren
Männer ab 55 Jahren mit normaler digital-rektaler Untersuchung und PSA ≤ 3,0 ng/ml zu Studienbeginn, die in der 7-jährigen Prostate Cancer Prevention Trial (PCPT) Finasterid 5 mg/Tag (5-fache Dosis von Propecia) einnahmen, hatten ein erhöhtes Risiko des Gleason-Scores 8–10 Prostatakrebs (Finasterid 1,8 % vs. Placebo 1,1 %). [Sehen NEBENWIRKUNGEN ] Ähnliche Ergebnisse wurden in einer 4-jährigen placebokontrollierten klinischen Studie mit einem anderen 5α-Reduktasehemmer (Dutasterid, AVODART) beobachtet (1 % Dutasterid vs. 0,5 % Placebo). 5α-Reduktase-Hemmer können das Risiko für die Entwicklung von hochgradigem Prostatakrebs erhöhen. Ob die Wirkung von 5α-Reduktase-Inhibitoren zur Verringerung des Prostatavolumens oder studienbezogene Faktoren die Ergebnisse dieser Studien beeinflussten, wurde nicht nachgewiesen.
Pädiatrische Patienten
Propecia ist nicht für die Anwendung bei pädiatrischen Patienten indiziert [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Exposition von Frauen – Risiko für männlichen Fötus
Ärzte sollten die Patientinnen darüber informieren, dass Frauen, die schwanger sind oder schwanger sein könnten, wegen der Möglichkeit der Resorption von Finasterid und des daraus resultierenden potenziellen Risikos für einen männlichen Fötus nicht mit zerkleinerten oder zerbrochenen Propecia-Tabletten umgehen sollten. PROPECIA 5 mg Tabletten sind überzogen und verhindern den Kontakt mit dem Wirkstoff bei normaler Handhabung, vorausgesetzt, die Tabletten wurden nicht zerbrochen oder zerdrückt. Wenn eine schwangere oder möglicherweise schwangere Frau mit zerkleinerten oder zerbrochenen PROPECIA 1 mg-Tabletten in Kontakt kommt, sollte der Kontaktbereich sofort mit Seife und Wasser gewaschen werden [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , Verwendung in bestimmten Bevölkerungsgruppen  und WIE GELIEFERT / Lagerung und Handhabung ].
Erhöhtes Risiko für hochgradigen Prostatakrebs
Die Patienten sollten darüber informiert werden, dass es bei Männern, die mit 5α-Reduktase-Hemmern behandelt wurden, die für eine BPH-Behandlung indiziert sind, im Vergleich zu denen, die mit Placebo behandelt wurden, in Studien, die sich mit der Verwendung dieser Arzneimittel zur Vorbeugung von Prostatakrebs befassten, eine Zunahme von hochgradigem Prostatakrebs gab [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
zusätzliche Anweisungen
Ärzte sollten ihre Patientinnen anweisen, alle Veränderungen ihrer Brüste wie Knoten, Schmerzen oder Ausfluss aus der Brustwarze umgehend zu melden. Brustveränderungen, einschließlich Brustvergrößerung, Druckempfindlichkeit und Neubildungen, wurden berichtet [siehe NEBENWIRKUNGEN ].
Ärzte sollten ihre Patienten anweisen, die Packungsbeilage für Patienten vor Beginn der Behandlung mit Propecia zu lesen und sie jedes Mal erneut zu lesen, wenn die Verschreibung verlängert wird, damit sie die aktuellen Informationen für Patienten bezüglich Propecia kennen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 24-monatigen Studie an Sprague-Dawley-Ratten, die Finasterid-Dosen von bis zu 160 mg/kg/Tag bei Männchen und 320 mg/kg/Tag bei Weibchen erhielten, wurden keine Hinweise auf eine tumorerzeugende Wirkung beobachtet. Diese Dosen führten bei Ratten zu einer 888- bzw. 2192-fachen systemischen Exposition gegenüber derjenigen, die beim Menschen beobachtet wurde, der die empfohlene Humandosis von 1 mg/Tag erhielt. Alle Expositionsberechnungen basierten auf der berechneten AUC(0-24h) für Tiere und der mittleren AUC(0-24h) für den Menschen (0,05 μg•h/ml).
In einer 19-monatigen Karzinogenitätsstudie an CD-1-Mäusen wurde eine statistisch signifikante (p ≤ 0,05) Zunahme der Inzidenz testikulärer Leydig-Zell-Adenome beim 1824-Fachen der menschlichen Exposition (250 mg/kg/Tag) beobachtet. Bei Mäusen wurde bei 184-facher Exposition beim Menschen (schätzungsweise 25 mg/kg/Tag) und bei Ratten bei 312-facher Exposition beim Menschen (≥ 40 mg/kg/Tag) eine Zunahme der Leydig-Zell-Hyperplasie beobachtet. Eine positive Korrelation zwischen den proliferativen Veränderungen in den Leydig-Zellen und einem Anstieg der Serum-LH-Spiegel (2- bis 3-fach über der Kontrolle) wurde bei beiden Nagetierarten nachgewiesen, die mit hohen Finasterid-Dosen behandelt wurden. Weder bei Ratten noch bei Hunden, die 1 Jahr lang 240- bzw. 2800-mal Finasterid (20 mg/kg/Tag bzw. 45 mg/kg/Tag) mit Finasterid behandelt wurden, oder bei Mäusen, die 19 Monate lang behandelt wurden, wurden keine arzneimittelbedingten Veränderungen der Leydig-Zellen beobachtet beim 18,4-fachen der menschlichen Exposition, geschätzt (2,5 mg/kg/Tag).
In einem In-vitro-Bakterien-Mutagenese-Assay, einem Säugerzell-Mutagenese-Assay oder in einem In-vitro-Alkali-Elutions-Assay wurden keine Hinweise auf Mutagenität beobachtet. In einem In-vitro-Chromosomenaberrationstest mit Ovarialzellen chinesischer Hamster zeigte sich ein leichter Anstieg der Chromosomenaberrationen. In einem In-vivo-Chromosomenaberrationstest an Mäusen wurde bei der maximal tolerierten Dosis von 250 mg/kg/Tag (1824-fache der Exposition beim Menschen) von Finasterid, wie in den Karzinogenitätsstudien bestimmt, keine behandlungsbedingte Zunahme der Chromosomenaberration beobachtet.
Bei geschlechtsreifen männlichen Kaninchen, die bis zu 12 Wochen lang mit dem 4344-fachen der humantherapeutischen Exposition (80 mg/kg/Tag) mit Finasterid behandelt wurden, wurde keine Wirkung auf die Fertilität, die Spermienzahl oder das Ejakulatvolumen beobachtet. Bei geschlechtsreifen männlichen Ratten, die mit dem 488-fachen der Humanexposition (80 mg/kg/Tag) behandelt wurden, gab es nach 6 oder 12 Behandlungswochen keine signifikanten Auswirkungen auf die Fertilität; Wenn die Behandlung jedoch bis zu 24 oder 30 Wochen fortgesetzt wurde, kam es zu einer offensichtlichen Abnahme der Fertilität, Fruchtbarkeit und einer damit verbundenen signifikanten Abnahme des Gewichts der Samenbläschen und der Prostata. Alle diese Wirkungen waren innerhalb von 6 Wochen nach Absetzen der Behandlung reversibel. Bei Ratten oder Kaninchen wurden keine arzneimittelbedingten Auswirkungen auf die Hoden oder die Paarungsleistung beobachtet. Diese Abnahme der Fertilität bei mit Finasterid behandelten Ratten ist sekundär zu seiner Wirkung auf akzessorische Geschlechtsorgane (Prostata und Samenbläschen), was dazu führt, dass kein Samenpfropfen gebildet wird. Der Samenpfropfen ist für die normale Fruchtbarkeit bei Ratten unerlässlich, aber beim Menschen nicht relevant.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie X [vgl KONTRAINDIKATIONEN ]. Propecia 5 mg ist kontraindiziert für die Anwendung bei Frauen, die schwanger sind oder schwanger werden könnten. PROPECIA 5 mg ist ein 5α-Reduktase-Hemmer vom Typ II, der die Umwandlung von Testosteron in 5α-Dihydrotestosteron (DHT) verhindert, ein Hormon, das für die normale Entwicklung der männlichen Genitalien notwendig ist. In Tierversuchen verursachte Finasterid bei männlichen Föten eine abnormale Entwicklung der äußeren Genitalien. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den männlichen Fötus informiert werden.
Eine abnorme männliche Genitalentwicklung ist eine erwartete Folge, wenn die Umwandlung von Testosteron in 5α-Dihydrotestosteron (DHT) durch 5α-Reduktase-Inhibitoren gehemmt wird. Diese Ergebnisse ähneln denen, die bei männlichen Säuglingen mit genetischem 5α-Reduktase-Mangel berichtet wurden. Frauen könnten Finasterid durch Kontakt mit zerkleinerten oder zerbrochenen 5-mg-Tabletten von Propecia oder dem Sperma eines männlichen Partners, der Propecia einnimmt, ausgesetzt werden. Im Hinblick auf die Finasterid-Exposition durch die Haut sind Propecia-Tabletten beschichtet und verhindern den Hautkontakt mit Finasterid bei normaler Handhabung, wenn die Tabletten nicht zerdrückt oder zerbrochen wurden. Frauen, die schwanger sind oder schwanger werden könnten, sollten wegen der möglichen Exposition eines männlichen Fötus keine zerkleinerten oder zerbrochenen Propecia 5 mg-Tabletten handhaben. Wenn eine schwangere Frau mit zerkleinerten oder zerbrochenen Tabletten von Propecia 1 mg in Kontakt kommt, sollte der Kontaktbereich sofort mit Wasser und Seife gewaschen werden. Im Hinblick auf eine potenzielle Finasterid-Exposition durch Sperma wurde eine Studie an Männern durchgeführt, die 1 mg Propecia pro Tag erhielten, in der die Finasterid-Konzentrationen im Sperma gemessen wurden [siehe KLINISCHE PHARMAKOLOGIE ].
In einer Studie zur embryofetalen Entwicklung erhielten trächtige Ratten Finasterid während der Phase der Hauptorganogenese (6. bis 17. Trächtigkeitstag). Bei maternalen Dosen von oralem Finasterid, die etwa dem 1- bis 684-Fachen der empfohlenen Humandosis (RHD) von 1 mg/Tag (basierend auf der AUC bei Tierdosen von 0,1 bis 100 mg/kg/Tag) entsprachen, kam es zu einer dosisabhängigen Zunahme von Hypospadie, die in auftrat 3,6 bis 100 % der männlichen Nachkommen. Expositions-Multiples wurden anhand von Daten von nicht trächtigen Ratten geschätzt. Die Tage 16 bis 17 der Trächtigkeit sind bei männlichen fötalen Ratten ein kritischer Zeitraum für die Differenzierung der äußeren Genitalien. Bei oralen mütterlichen Dosen, die ungefähr dem 0,2-Fachen der RHD (basierend auf der AUC bei einer Tierdosis von 0,03 mg/kg/Tag) entsprachen, hatten die männlichen Nachkommen ein verringertes Prostata- und Samenbläschengewicht, eine verzögerte Präputialablösung und eine vorübergehende Brustwarzenentwicklung. Bei männlichen Nachkommen trächtiger Ratten, die etwa das 0,02-fache der RHD (basierend auf der AUC bei einer Tierdosis von 0,003 mg/kg/Tag) erhielten, trat eine verringerte anogenitale Distanz auf. Bei weiblichen Nachkommen, die in utero einer Finasterid-Dosis ausgesetzt waren, wurden keine Anomalien beobachtet.
Bei den Nachkommen von unbehandelten Weibchen, die mit Finasterid-behandelten männlichen Ratten gepaart wurden, die etwa das 488-fache der RHD erhielten (basierend auf der AUC bei einer Tierdosis von 80 mg/kg/Tag), wurden keine Entwicklungsanomalien beobachtet. Eine leicht verringerte Fertilität wurde bei männlichen Nachkommen nach Verabreichung des etwa 20-Fachen der RHD (basierend auf der AUC bei einer Tierdosis von 3 mg/kg/Tag) an weibliche Ratten während der späten Trächtigkeit und Laktation beobachtet. Unter diesen Bedingungen wurden bei weiblichen Nachkommen keine Auswirkungen auf die Fertilität beobachtet.
Bei Kaninchenföten, die Finasterid während der Phase der Hauptorganogenese (6. bis 18. Trächtigkeitstag) bei maternalen Dosen von bis zu 100 mg/kg/Tag (Finasterid-Expositionsspiegel wurden nicht gemessen) Kaninchen). Diese Studie hat jedoch möglicherweise nicht den kritischen Zeitraum für die Auswirkungen von Finasterid auf die Entwicklung der männlichen äußeren Genitalien beim Kaninchen berücksichtigt.
Die fetalen Wirkungen einer mütterlichen Finasterid-Exposition während der embryonalen und fetalen Entwicklung wurden bei Rhesusaffen (20.–100. Trächtigkeitstag) untersucht, und zwar in einer Spezies und einem Entwicklungszeitraum, die spezifischere Wirkungen beim Menschen besser vorhersagen als die Studien an Ratten und Kaninchen. Die intravenöse Verabreichung von Finasterid an trächtige Affen in Dosen von bis zu 800 ng/Tag (geschätzte maximale Blutkonzentration von 1,86 ng/ml oder etwa das 930-fache der höchsten geschätzten Exposition von Schwangeren gegenüber Finasterid aus Samen von Männern, die 1 mg/Tag einnahmen) resultierte keine Anomalien bei männlichen Föten. Zur Bestätigung der Relevanz des Rhesus-Modells für die Entwicklung des menschlichen Fötus ist die orale Gabe einer Finasterid-Dosis (2 mg/kg/Tag oder etwa das 120.000-fache der höchsten geschätzten Blutspiegel von Finasterid aus dem Samen von Männern, die 1 mg/Tag einnehmen) zu verabreichen trächtige Affen führten bei männlichen Föten zu äußeren Genitalanomalien. Bei männlichen Föten wurden keine anderen Anomalien beobachtet, und bei weiblichen Föten wurden bei keiner Dosis andere Anomalien im Zusammenhang mit Finasterid beobachtet.
Stillende Mutter
Propecia ist nicht für die Anwendung bei Frauen angezeigt.
Es ist nicht bekannt, ob Finasterid in die Muttermilch übergeht.
Pädiatrische Verwendung
Propecia 1 mg ist nicht für die Anwendung bei pädiatrischen Patienten indiziert.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Klinische Wirksamkeitsstudien mit PROPECIA schlossen keine Probanden ab 65 Jahren ein. Basierend auf der Pharmakokinetik von Finasterid 5 mg ist bei älteren Patienten für Propecia keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ]. Die Wirksamkeit von Propecia 1 mg bei älteren Patienten wurde jedoch nicht nachgewiesen.
Leberfunktionsstörung
Bei der Verabreichung von Propecia 5 mg an Patienten mit Leberfunktionsstörungen ist Vorsicht geboten, da Finasterid extensiv in der Leber metabolisiert wird [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
In klinischen Studien führten Einzeldosen von Finasterid bis zu 400 mg und Mehrfachdosen von Finasterid bis zu 80 mg/Tag über drei Monate zu keinen Nebenwirkungen. Bis weitere Erfahrungen vorliegen, kann keine spezifische Behandlung einer Überdosierung mit Finasterid empfohlen werden.
Eine signifikante Letalität wurde bei männlichen und weiblichen Mäusen bei oralen Einzeldosen von 1500 mg/m² (500 mg/kg) und bei weiblichen und männlichen Ratten bei oralen Einzeldosen von 2360 mg/m² (400 mg/kg) und 5900 mg/m beobachtet (1000 mg/kg).
KONTRAINDIKATIONEN
Propecia 5 mg ist kontraindiziert bei:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Finasterid ist ein kompetitiver und spezifischer Inhibitor der Typ-II-5α-Reduktase, eines intrazellulären Enzyms, das das Androgen Testosteron in DHT umwandelt. Zwei unterschiedliche Isozyme kommen in Mäusen, Ratten, Affen und Menschen vor: Typ I und II. Jedes dieser Isoenzyme wird in Geweben und Entwicklungsstadien unterschiedlich exprimiert. Beim Menschen ist Typ I 5α-Reduktase in den Talgdrüsen der meisten Hautregionen, einschließlich der Kopfhaut und der Leber, vorherrschend. Typ I 5α-Reduktase ist für etwa ein Drittel des zirkulierenden DHT verantwortlich. Das Typ-II-5α-Reduktase-Isozym kommt hauptsächlich in Prostata, Samenbläschen, Nebenhoden und Haarfollikeln sowie in der Leber vor und ist für zwei Drittel des zirkulierenden DHT verantwortlich.
Beim Menschen beruht der Wirkmechanismus von Finasterid auf seiner bevorzugten Hemmung des Typ-II-Isozyms. Unter Verwendung von nativem Gewebe (Kopfhaut und Prostata) zeigten In-vitro-Bindungsstudien, die das Potenzial von Finasterid untersuchten, beide Isozyme zu hemmen, eine 100-fache Selektivität für die humane Typ-II-5α-Reduktase gegenüber Typ-I-Isozym (IC50 = 500 und 4,2 nM für Typ I bzw. II). Bei beiden Isoenzymen geht die Hemmung durch Finasterid mit einer Reduktion des Inhibitors zu Dihydrofinasterid und einer Adduktbildung mit NADP+ einher. Der Turnover für den Enzymkomplex ist langsam (t 1/2 ungefähr 30 Tage für den Typ-II-Enzymkomplex und 14 Tage für den Typ-I-Komplex). Die Hemmung der Typ-II-5α-Reduktase blockiert die periphere Umwandlung von Testosteron in DHT, was zu einer signifikanten Abnahme der Serum- und Gewebe-DHT-Konzentrationen führt.
Bei Männern mit männlichem Haarausfall (androgenetische Alopezie) enthält die kahl werdende Kopfhaut miniaturisierte Haarfollikel und erhöhte Mengen an DHT im Vergleich zu behaarter Kopfhaut. Die Verabreichung von Finasterid verringert bei diesen Männern die Kopfhaut- und Serum-DHT-Konzentration. Die relativen Beiträge dieser Reduktionen zum Behandlungseffekt von Finasterid wurden nicht definiert. Durch diesen Mechanismus scheint Finasterid einen Schlüsselfaktor bei der Entwicklung von androgenetischer Alopezie bei genetisch prädisponierten Patienten zu unterbrechen.
Pharmakodynamik
Finasterid bewirkt eine rasche Senkung der DHT-Konzentration im Serum und erreicht innerhalb von 24 Stunden nach oraler Gabe einer 1-mg-Tablette eine Unterdrückung von 65 %. Die mittleren zirkulierenden Testosteron- und Östradiolspiegel waren im Vergleich zum Ausgangswert um etwa 15 % erhöht, blieben jedoch im physiologischen Bereich.
Finasterid hat keine Affinität zum Androgenrezeptor und hat keine androgenen, antiandrogenen, östrogenen, antiöstrogenen oder gestagenen Wirkungen. In Studien mit Finasterid wurden keine klinisch bedeutsamen Veränderungen des luteinisierenden Hormons (LH), des follikelstimulierenden Hormons (FSH) oder des Prolaktins festgestellt. Bei gesunden Probanden veränderte die Behandlung mit Finasterid die Reaktion von LH und FSH auf das Gonadotropin-Releasing-Hormon nicht, was darauf hindeutet, dass die Hypothalamus-Hypophysen-Hoden-Achse nicht betroffen war.
Finasterid hatte keine Wirkung auf die zirkulierenden Spiegel von Cortisol, Schilddrüsen-stimulierendem Hormon oder Thyroxin, noch beeinflusste es das Plasmalipidprofil (z. B. Gesamtcholesterin, Low-Density-Lipoproteine, High-Density-Lipoproteine und Triglyceride) oder die Knochenmineraldichte.
Pharmakokinetik
Absorption
In einer Studie mit 15 gesunden jungen männlichen Probanden betrug die mittlere Bioverfügbarkeit von Finasterid 1-mg-Tabletten 65 % (Bereich 26–170 %), basierend auf dem Verhältnis der Fläche unter der Kurve (AUC) im Vergleich zu einer intravenösen (IV) Referenz Dosis. Im Steady State nach Gabe von 1 mg/Tag (n = 12) betrug die maximale Plasmakonzentration von Finasterid durchschnittlich 9,2 ng/ml (Bereich 4,9–13,7 ng/ml) und wurde 1 bis 2 Stunden nach der Einnahme erreicht; Die AUC betrug 53 ng•h/ml (Bereich 20–154 ng•h/ml). Die Bioverfügbarkeit von Finasterid wurde durch Nahrung nicht beeinflusst.
Verteilung
Das mittlere Verteilungsvolumen im Steady State betrug 76 Liter (Bereich 44–96 Liter; n = 15). Etwa 90 % des zirkulierenden Finasterids ist an Plasmaproteine gebunden. Bei Finasterid gibt es nach Mehrfachgabe eine langsame Akkumulationsphase.
Es wurde festgestellt, dass Finasterid die Blut-Hirn-Schranke überwindet.
Bei 35 Männern, die Finasterid 1 mg/Tag über 6 Wochen einnahmen, wurden die Samenspiegel gemessen. Bei 60 % (21 von 35) der Proben waren Finasteridspiegel nicht nachweisbar ( Verwendung in bestimmten Bevölkerungsgruppen ]
Stoffwechsel
Finasterid wird weitgehend in der Leber metabolisiert, hauptsächlich über die Enzymunterfamilie Cytochrom P450 3A4. Zwei Metaboliten, die monohydroxylierte t-Butyl-Seitenkette und Monocarbonsäure-Metaboliten, wurden identifiziert, die nicht mehr als 20 % der 5α-Reduktase-Hemmaktivität von Finasterid besitzen.
Ausscheidung
Nach intravenöser Infusion bei gesunden jungen Probanden (n = 15) betrug die mittlere Plasmaclearance von Finasterid 165 ml/min (Bereich 70–279 ml/min). Die mittlere terminale Halbwertszeit im Plasma betrug 4,5 Stunden (Bereich 3,3–13,4 Stunden; n = 12). Nach oraler Gabe von 14C-Finasterid beim Menschen (n = 6) wurden im Mittel 39 % (Bereich 32–46 %) der Dosis in Form von Metaboliten im Urin ausgeschieden; 57 % (Bereich 51–64 %) wurden mit dem Kot ausgeschieden.
Die mittlere terminale Halbwertszeit beträgt etwa 5 – 6 Stunden bei Männern im Alter von 18 – 60 Jahren und 8 Stunden bei Männern über 70 Jahren.
TABELLE 3: Mittlere (SD) pharmakokinetische Parameter bei gesunden Männern (Alter 18-26)
TABELLE 4: Mittlere (SD) nichtkompartimentelle pharmakokinetische Parameter nach mehreren Dosen von 1 mg/Tag bei gesunden Männern (Alter 19-42)
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Bei Patienten mit chronischer Nierenfunktionsstörung mit einer Kreatinin-Clearance im Bereich von 9,0 bis 55 ml/min waren AUC, maximale Plasmakonzentration, Halbwertszeit und Proteinbindung nach einer Einzeldosis von 14C-Finasterid ähnlich wie bei gesunden Probanden. Die Ausscheidung von Metaboliten im Urin war bei Patienten mit eingeschränkter Nierenfunktion verringert. Diese Abnahme war mit einer Zunahme der fäkalen Ausscheidung von Metaboliten verbunden. Die Plasmakonzentrationen der Metaboliten waren bei Patienten mit eingeschränkter Nierenfunktion signifikant höher (basierend auf einem Anstieg der AUC der Gesamtradioaktivität um 60 %). Finasterid wurde jedoch von Männern mit normaler Nierenfunktion vertragen, die 12 Wochen lang bis zu 80 mg/Tag erhielten, wobei die Exposition dieser Patienten gegenüber Metaboliten vermutlich viel größer wäre.
Leberfunktionsstörung
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Finasterid wurde nicht untersucht. Bei der Verabreichung von Propecia 1 mg an Patienten mit Leberfunktionsstörungen ist Vorsicht geboten, da Finasterid extensiv in der Leber metabolisiert wird.
Klinische Studien
Studien bei Männern
Die Wirksamkeit von Propecia 1 mg wurde bei Männern (88 % Kaukasier) mit leichter bis mittelschwerer androgenetischer Alopezie (männlicher Haarausfall) zwischen 18 und 41 Jahren nachgewiesen. Um einer seborrhoischen Dermatitis vorzubeugen, die die Beurteilung des Haarwachstums in diesen Studien verfälschen könnte, wurden alle Männer, ob sie mit Finasterid oder Placebo behandelt wurden, angewiesen, während der Behandlung ein spezielles, wirkstoffhaltiges Shampoo auf Teerbasis (Neutrogena T/Gel® Shampoo) zu verwenden die ersten 2 Jahre des Studiums.
Es gab drei doppelblinde, randomisierte, placebokontrollierte Studien mit einer Dauer von 12 Monaten. Die beiden primären Endpunkte waren die Haarzahl und die Selbsteinschätzung des Patienten; Die beiden sekundären Endpunkte waren die Beurteilung durch den Prüfarzt und die Bewertung von Fotos. Darüber hinaus wurden Informationen zur sexuellen Funktion (basierend auf einem selbstausgefüllten Fragebogen) und zum Wachstum der Körperbehaarung außerhalb der Kopfhaut erhoben. Die drei Studien wurden an 1879 Männern mit leichtem bis mäßigem, aber nicht vollständigem Haarausfall durchgeführt. Zwei der Studien schlossen Männer mit vorwiegend leichtem bis mittelschwerem Haarausfall am Scheitel ein (n=1553). Die dritte Studie umfasste Männer mit leichtem bis mittelschwerem Haarausfall im vorderen Mittelkopfbereich mit oder ohne Scheitelkahlheit (n=326).
Studien an Männern mit Scheitelkahlheit
Von den Männern, die die ersten 12 Monate der beiden Scheitelkahlheitsstudien abgeschlossen hatten, entschieden sich 1215 für die Fortsetzung der doppelblinden, placebokontrollierten 12-monatigen Verlängerungsstudien. Es gab 547 Männer, die Propecia 5 mg sowohl für die Anfangsstudie als auch für die ersten Verlängerungsperioden (bis zu 2 Jahre Behandlung) erhielten, und 60 Männer erhielten Placebo für die gleichen Zeiträume. Die Verlängerungsstudien wurden für 3 weitere Jahre fortgesetzt, wobei 323 Männer mit 5 mg Propecia und 23 mit Placebo in das fünfte Jahr der Studie eintraten.
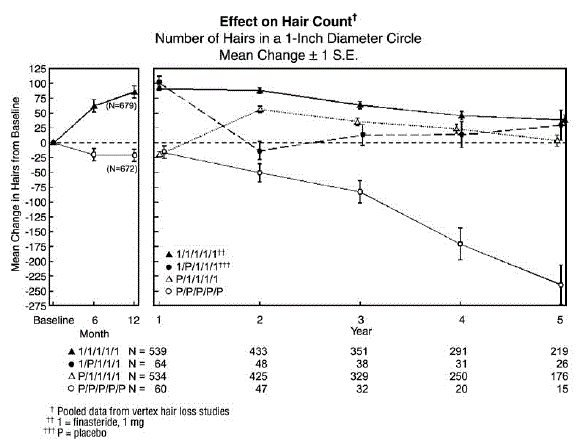
Um die Wirkung des Absetzens der Therapie zu bewerten, erhielten 65 Männer Propecia 5 mg für die ersten 12 Monate, gefolgt von Placebo in der ersten 12-monatigen Verlängerungsphase. Einige dieser Männer nahmen an zusätzlichen Verlängerungsstudien teil und wurden wieder auf die Behandlung mit Propecia 5 mg umgestellt, wobei 32 Männer in das fünfte Jahr der Studie eintraten. Schließlich gab es 543 Männer, die in den ersten 12 Monaten Placebo erhielten, gefolgt von Propecia in der ersten 12-monatigen Verlängerungsphase. Einige dieser Männer nahmen an zusätzlichen Verlängerungsstudien teil, die Propecia 5 mg erhielten, wobei 290 Männer in das fünfte Jahr der Studie eintraten (siehe Abbildung 1 unten).
Die Haarzahlen wurden durch fotografische Vergrößerungen eines repräsentativen Bereichs mit aktivem Haarausfall bewertet. In diesen beiden Studien an Männern mit Scheitelkahlheit wurde bei mit Propecia 5 mg behandelten Männern nach 6 und 12 Monaten eine signifikante Zunahme der Haarzahl nachgewiesen, während bei den mit Placebo behandelten Männern ein signifikanter Haarausfall gegenüber dem Ausgangswert nachgewiesen wurde. Nach 12 Monaten gab es einen Unterschied von 107 Haaren zu Placebo (p
Patienten, die von Placebo auf Propecia umgestellt wurden (n = 425), hatten eine Abnahme der Haarzahl am Ende der anfänglichen 12-monatigen Placebo-Periode, gefolgt von einer Zunahme der Haarzahl nach 1 Jahr Behandlung mit Propecia. Diese Zunahme der Haarzahl war geringer (56 Haare über dem ursprünglichen Ausgangswert) als die Zunahme (91 Haare über dem ursprünglichen Ausgangswert), die nach 1-jähriger Behandlung bei Männern beobachtet wurde, die ursprünglich auf Propecia randomisiert wurden. Obwohl die Zunahme der Haarzahl im Vergleich zum Zeitpunkt des Therapiebeginns zwischen diesen beiden Gruppen vergleichbar war, wurde eine höhere absolute Haarzahl bei Patienten erreicht, die in der ersten Studie mit der Behandlung mit Propecia begonnen hatten. Dieser Vorteil wurde während der verbleibenden 3 Jahre des Studiums beibehalten. Ein Wechsel der Behandlung von Propecia 5 mg zu Placebo (n = 48) am Ende der ersten 12 Monate führte 12 Monate später, nach 24 Monaten, zu einer Umkehrung der Zunahme der Haarzahl (siehe Abbildung 1 unten).
Nach 12 Monaten hatten 58 % der Männer in der Placebogruppe weiteren Haarausfall (definiert als jede Abnahme der Haarzahl gegenüber dem Ausgangswert), verglichen mit 14 % der Männer, die mit Propecia behandelt wurden. Bei Männern, die bis zu 2 Jahre behandelt wurden, zeigten 72 % der Männer in der Placebogruppe Haarausfall, verglichen mit 17 % der Männer, die mit Propecia behandelt wurden. Nach 5 Jahren zeigten 100 % der Männer in der Placebogruppe Haarausfall, verglichen mit 35 % der Männer, die mit Propecia behandelt wurden.
Abbildung 1
Die Selbsteinschätzung der Patienten wurde bei jedem Klinikbesuch anhand eines selbst auszufüllenden Fragebogens erhoben, der Fragen zu ihrer Wahrnehmung von Haarwuchs, Haarausfall und Aussehen enthielt. Diese Selbsteinschätzung zeigte eine Zunahme der Haarmenge, eine Abnahme des Haarausfalls und eine Verbesserung des Aussehens bei Männern, die mit Propecia behandelt wurden. Die Gesamtverbesserung im Vergleich zu Placebo wurde bereits nach 3 Monaten (p
Die Beurteilung durch den Prüfarzt basierte auf einer 7-Punkte-Skala, die die Zunahme oder Abnahme der Kopfbehaarung bei jedem Patientenbesuch bewertete. Diese Bewertung zeigte bereits nach 3 Monaten eine signifikant stärkere Zunahme des Haarwachstums bei mit Propecia behandelten Männern im Vergleich zu Placebo (p
Ein unabhängiges Gremium bewertete verblindet standardisierte Fotos des Kopfes auf der Grundlage der Zunahme oder Abnahme der Kopfbehaarung unter Verwendung derselben 7-Punkte-Skala wie die Beurteilung durch den Prüfarzt. Nach 12 Monaten hatten 48 % der mit Propecia behandelten Männer einen Anstieg im Vergleich zu 7 % der mit Placebo behandelten Männer. Nach 2 Jahren wurde bei 66 % der mit Propecia 5 mg behandelten Männer eine Zunahme des Haarwuchses nachgewiesen, verglichen mit 7 % der mit Placebo behandelten Männer. Nach 5 Jahren zeigten 48 % der mit Propecia 5 mg behandelten Männer eine Zunahme des Haarwachstums, 42 % wurden als unverändert (kein weiteres sichtbares Fortschreiten des Haarausfalls gegenüber dem Ausgangswert) und 10 % als mit Haarausfall im Vergleich zu bewertet Grundlinie. Im Vergleich zum Ausgangswert zeigten 6 % der mit Placebo behandelten Männer eine Zunahme des Haarwachstums, 19 % wurden als unverändert und 75 % als Haarausfall eingestuft.
In eine 48-wöchige placebokontrollierte Studie zur Bewertung der Wirkung von PROPECIA auf die gesamten und aktiv wachsenden (anagenen) Kopfhaare bei Scheitelkahlheit mittels Phototrichogramm wurden 212 Männer mit androgenetischer Alopezie aufgenommen. Zu Studienbeginn und nach 48 Wochen wurden Gesamt- und Anagenhaarzahlen in einem 1 cm² großen Zielbereich der Kopfhaut ermittelt. Mit Propecia behandelte Männer zeigten gegenüber dem Ausgangswert eine Zunahme der Gesamt- und Anagenhaarzahl von 7 Haaren bzw. 18 Haaren, während Männer, die mit Placebo behandelt wurden, Abnahmen von 10 Haaren bzw. 9 Haaren aufwiesen. Diese Veränderungen in der Haarzahl führten zu einem Unterschied zwischen den Gruppen von 17 Haaren in der Gesamthaarzahl (p
Andere Ergebnisse in Scheitelkahlheitsstudien
Ein Fragebogen zur sexuellen Funktion wurde von den Patienten, die an den beiden Scheitelkahlheitsstudien teilnahmen, selbst durchgeführt, um subtilere Veränderungen der sexuellen Funktion zu erkennen. In Monat 12 wurden in 3 von 4 Bereichen (sexuelles Interesse, Erektionen und Wahrnehmung sexueller Probleme) statistisch signifikante Unterschiede zugunsten von Placebo festgestellt. Bei der Frage nach der allgemeinen Zufriedenheit mit dem Sexualleben zeigte sich jedoch kein signifikanter Unterschied.
In einer der beiden Scheitelkahlheitsstudien wurden die Patienten zum Wachstum der Körperbehaarung außerhalb der Kopfhaut befragt. Propecia schien das Körperhaar außerhalb der Kopfhaut nicht zu beeinflussen.
Studie bei Männern mit Haarausfall im vorderen Mittelkopfbereich
Eine 12-monatige Studie zur Bewertung der Wirksamkeit von Propecia 5 mg bei Männern mit Haarausfall im vorderen mittleren Kopfhautbereich zeigte ebenfalls eine signifikante Zunahme der Haarzahl im Vergleich zu Placebo. Eine Zunahme der Haarzahl wurde begleitet von Verbesserungen bei der Selbsteinschätzung der Patienten, der Beurteilung durch den Prüfarzt und den Bewertungen auf der Grundlage standardisierter Fotografien. Haarzählungen wurden im vorderen mittleren Kopfhautbereich erhalten und schlossen den Bereich der bitemporalen Rezession oder den vorderen Haaransatz nicht ein.
Zusammenfassung klinischer Studien bei Männern
Klinische Studien wurden an Männern im Alter von 18 bis 41 Jahren mit leichtem bis mittelschwerem Grad androgenetischer Alopezie durchgeführt. Alle Männer, die mit Propecia 5 mg oder Placebo behandelt wurden, erhielten während der ersten 2 Studienjahre ein Shampoo auf Teerbasis (Neutrogena T/Gel® Shampoo). Klinische Besserung wurde bereits nach 3 Monaten bei den mit Propecia 5 mg behandelten Patienten beobachtet und führte zu einer Nettozunahme der Kopfhaarzahl und des Haarwachstums. In klinischen Studien über bis zu 5 Jahre verlangsamte die Behandlung mit Propecia 5 mg das weitere Fortschreiten des Haarausfalls, das in der Placebogruppe beobachtet wurde. Im Allgemeinen nahm der Unterschied zwischen den Behandlungsgruppen während der 5 Jahre der Studien weiter zu.
Ethnische Analyse klinischer Daten von Männern
In einer kombinierten Analyse der beiden Studien zur Scheitelkahlheit betrugen die mittleren Veränderungen der Haarzahl gegenüber dem Ausgangswert 91 vs. -19 Haare (PROPECIA 5 mg vs. Placebo) bei Kaukasiern (n=1185), 49 vs. -27 Haare bei Schwarzen (n=84). , 53 vs. -38 Haare bei Asiaten (n=17), 67 vs. 5 Haare bei Hispanics (n=45) und 67 vs. -15 Haare bei anderen ethnischen Gruppen (n=20). Die Selbsteinschätzung der Patienten zeigte eine Verbesserung über die Rassengruppen hinweg mit der Propecia-Behandlung, mit Ausnahme der Zufriedenheit des vorderen Haaransatzes und des Scheitels bei schwarzen Männern, die insgesamt zufrieden waren.
Studieren bei Frauen
In einer Studie mit 137 postmenopausalen Frauen mit androgenetischer Alopezie, die 12 Monate lang mit Propecia (n = 67) oder Placebo (n = 70) behandelt wurden, konnte die Wirksamkeit nicht nachgewiesen werden. Bei den mit Propecia behandelten Frauen gab es im Vergleich zur Placebogruppe keine Verbesserung bei der Haarzahl, der Selbsteinschätzung der Patientin, der Beurteilung durch den Prüfarzt oder der Bewertung standardisierter Fotografien [siehe INDIKATIONEN UND VERWENDUNG ].
INFORMATIONEN ZUM PATIENTEN
PROPECIA (Pro-pee-sha) (Finasterid) Tabletten
PROPECIA® ist NUR für MÄNNER bestimmt und sollte NICHT von Frauen oder Kindern verwendet werden.
Lesen Sie diese Patienteninformation, bevor Sie mit der Einnahme von Propecia 5 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist Propecia 5 mg?
PROPECIA 5 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Haarausfall bei Männern (androgenetische Alopezie).
Es ist nicht bekannt, ob PROPECIA 5 mg bei Geheimratsecken auf beiden Seiten und über Ihrer Stirn (Schläfenbereich) wirkt.
Propecia 5 mg ist nicht für Frauen und Kinder bestimmt.
Wer sollte Propecia 5 mg nicht einnehmen?
Nehmen Sie Propecia 1 mg nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von Propecia 5 mg mitteilen?
Vor der Einnahme von Propecia 5 mg, Informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich Propecia 5 mg einnehmen?
PROPECIA wird nicht schneller oder besser wirken, wenn Sie es mehr als einmal täglich einnehmen.
Welche Nebenwirkungen kann Propecia haben?
Zu den häufigsten Nebenwirkungen von Propecia gehören:
Folgendes wurde im allgemeinen Gebrauch mit Propecia berichtet:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Propecia. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich Propecia 1 mg aufbewahren?
Bewahren Sie Propecia und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von Propecia.
Arzneimittel werden manchmal zu anderen als den in dieser Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie Propecia 5 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Propecia nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu Propecia zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über PROPECIA fragen, die für Angehörige der Gesundheitsberufe geschrieben wurden. Weitere Informationen erhalten Sie telefonisch unter 1-844-674-3200.
Was sind die Inhaltsstoffe von Propecia 1 mg?
Wirkstoff: Finasterid.
Inaktive Inhaltsstoffe: Lactose-Monohydrat, mikrokristalline Cellulose, vorgelatinierte Stärke, Natriumstärkeglykolat, Hydroxypropylmethylcellulose, Hydroxypropylcellulose, Titandioxid, Magnesiumstearat, Talkum, Natriumdocusat, gelbes Eisenoxid und rotes Eisenoxid.
Diese Patienteninformation wurde von der US Food and Drug Administration genehmigt.