Proscar 5mg Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Proscar 5mg und wie wird es angewendet?
Proscar ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von benigner Prostatahyperplasie und androgener Alopezie. Dieses Arzneimittel ist nur zur Anwendung bei Männern bestimmt. Proscar 5 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Proscar gehört zu einer Klasse von Arzneimitteln, die als 5-Alpha-Reduktase-Hemmer bezeichnet werden.
Es ist nicht bekannt, ob Proscar 5 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Proscar 5mg haben?
Proscar kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Proscar gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Proscar. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
PROSCAR (Finasterid), eine synthetische 4-Azasteroid-Verbindung, ist ein spezifischer Inhibitor der Steroid-Typ-II-5α-Reduktase, eines intrazellulären Enzyms, das das Androgen Testosteron in 5α-Dihydrotestosteron (DHT) umwandelt.
Finasterid ist 4-Azaandrost-1-en-17-carboxamid, N-(1,1-Dimethylethyl)-3-oxo-,(5α,17ß)-. Die empirische Formel von Finasterid ist C23H36N2O2 und sein Molekulargewicht beträgt 372,55. Seine Strukturformel lautet:
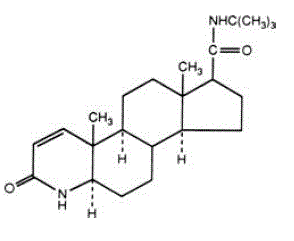
Finasterid ist ein weißes kristallines Pulver mit einem Schmelzpunkt nahe 250 °C. Es ist in Chloroform und in niederen Alkohollösungsmitteln frei löslich, in Wasser jedoch praktisch unlöslich.
PROSCAR (Finasterid) Tabletten zur oralen Verabreichung sind Filmtabletten, die 5 mg Finasterid und die folgenden Hilfsstoffe enthalten: wässrige Lactose, mikrokristalline Cellulose, vorverkleisterte Stärke, Carboxymethylstärke-Natrium, Hydroxypropylcellulose LF, Hydroxypropylmethylcellulose, Titandioxid, Magnesiumstearat , Talk, Docusatnatrium, FD&C Blue 2 Aluminiumlack und gelbes Eisenoxid.
INDIKATIONEN
Monotherapie
PROSCAR® ist indiziert zur Behandlung der symptomatischen benignen Prostatahyperplasie (BPH) bei Männern mit vergrößerter Prostata bei:
Kombination mit Alpha-Blocker
PROSCAR 5 mg, verabreicht in Kombination mit dem Alpha-Blocker Doxazosin, ist angezeigt, um das Risiko einer symptomatischen Progression der BPH zu verringern (ein bestätigter Anstieg des Symptom-Scores der American Urological Association (AUA) um ≥ 4 Punkte).
Nutzungsbeschränkungen
PROSCAR ist nicht zur Vorbeugung von Prostatakrebs zugelassen.
DOSIERUNG UND ANWENDUNG
PROSCAR kann mit oder ohne Mahlzeiten verabreicht werden.
Monotherapie
Die empfohlene Dosis von PROSCAR ist eine Tablette (5 mg) einmal täglich [siehe Klinische Studien ].
Kombination mit Alpha-Blocker
Die empfohlene Dosis von PROSCAR ist eine Tablette (5 mg) einmal täglich in Kombination mit dem Alpha-Blocker Doxazosin [siehe Klinische Studien ].
WIE GELIEFERT
Darreichungsformen und Stärken
5 mg blaue, modifizierte apfelförmige Filmtabletten mit dem Code MSD 72 auf der einen Seite und PROSCAR 5 mg auf der anderen Seite.
Lagerung und Handhabung
Nr. 3094 - PROSCAR-Tabletten 5 mg sind blaue, modifizierte apfelförmige Filmtabletten mit dem Code MSD 72 auf der einen und PROSCAR auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 0006-0072-31 Verwendungseinheit Flaschen zu 30 NDC 0006-0072-58 Verwendungseinheit Flaschen zu 100.
Lagerung und Handhabung
Bei Raumtemperatur unter 30 °C (86 °F) lagern. Vor Licht schützen und Behälter dicht geschlossen halten.
Frauen sollten keine zerkleinerten oder zerbrochenen PROSCAR 5-mg-Tabletten anfassen, wenn sie schwanger sind oder möglicherweise schwanger sein könnten, da die Möglichkeit einer Resorption von Finasterid und das daraus resultierende potenzielle Risiko für einen männlichen Fötus bestehen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN  und Verwendung in bestimmten Bevölkerungsgruppen ].
Vertrieb durch: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: Juni 2021
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Placebokontrollierte 4-Jahres-Studie (PLESS)
In PLESS wurde die Sicherheit von 1524 mit PROSCAR behandelten Patienten und 1516 mit Placebo behandelten Patienten über einen Zeitraum von 4 Jahren untersucht. Die am häufigsten berichteten Nebenwirkungen betrafen die sexuelle Funktion. 3,7 % (57 Patienten), die mit PROSCAR 5 mg behandelt wurden, und 2,1 % (32 Patienten), die mit Placebo behandelt wurden, brachen die Therapie aufgrund von Nebenwirkungen im Zusammenhang mit der Sexualfunktion ab, die die am häufigsten berichteten Nebenwirkungen sind.
Tabelle 1 zeigt die einzigen klinischen Nebenwirkungen, die vom Prüfarzt als möglicherweise, wahrscheinlich oder definitiv mit dem Arzneimittel in Zusammenhang stehend betrachtet wurden und deren Inzidenz unter PROSCAR 5 mg ≥ 1 % und größer als unter Placebo über die 4 Jahre der Studie war. In den Jahren 2-4 der Studie gab es keinen signifikanten Unterschied zwischen den Behandlungsgruppen in Bezug auf das Auftreten von Impotenz, verminderter Libido und Ejakulationsstörung.
Phase-III-Studien und offene 5-Jahres-Verlängerungen
Das Nebenwirkungsprofil in den 1-jährigen placebokontrollierten Phase-III-Studien, den 5-jährigen offenen Verlängerungen und PLESS war ähnlich.
Studie zur medizinischen Therapie von Prostatasymptomen (MTOPS).
In der MTOPS-Studie wurden 3047 Männer mit symptomatischer BPH randomisiert und erhielten PROSCAR 5 mg/Tag (n=768), Doxazosin 4 oder 8 mg/Tag (n=756), die Kombination von PROSCAR 5 mg/Tag und Doxazosin 4 oder 8 mg/Tag (n=786) oder Placebo (n=737) für 4 bis 6 Jahre. [Ein ... sehen Klinische Studien .]
Die Inzidenzraten arzneimittelbedingter Nebenwirkungen, die von ≥ 2 % der Patienten in jeder Behandlungsgruppe der MTOPS-Studie berichtet wurden, sind in Tabelle 2 aufgeführt.
Die einzelnen Nebenwirkungen, die in der Kombinationsgruppe häufiger auftraten als bei jedem Arzneimittel allein, waren: Asthenie, orthostatische Hypotonie, periphere Ödeme, Schwindel, verminderte Libido, Rhinitis, abnorme Ejakulation, Impotenz und abnorme Sexualfunktion (siehe Tabelle 2). Von diesen war die Inzidenz abnormaler Ejakulation bei Patienten, die eine Kombinationstherapie erhielten, vergleichbar mit der Summe der Inzidenzen dieser Nebenwirkungen, die für die beiden Monotherapien berichtet wurden.
Die Kombinationstherapie mit Finasterid und Doxazosin war mit keinen neuen klinischen Nebenwirkungen verbunden.
Vier Patienten in MTOPS berichteten über die Nebenwirkung Brustkrebs. Drei dieser Patienten erhielten nur Finasterid und einer eine Kombinationstherapie. [Ein ... sehen Langzeitdaten .]
Die MTOPS-Studie wurde nicht speziell entwickelt, um statistische Vergleiche zwischen Gruppen für berichtete Nebenwirkungen anzustellen. Darüber hinaus sind direkte Vergleiche der Sicherheitsdaten zwischen der MTOPS-Studie und früheren Studien der Einzelwirkstoffe aufgrund von Unterschieden in der Patientenpopulation, der Dosierung oder dem Dosierungsschema und anderen Verfahrens- und Studiendesignelementen möglicherweise nicht angemessen.
Langzeitdaten
Hochgradiger Prostatakrebs
Die PCPT-Studie war eine 7-jährige randomisierte, doppelblinde, placebokontrollierte Studie, an der 18.882 Männer im Alter von ≥ 55 Jahren mit einer normalen digitalen rektalen Untersuchung und einem PSA-Wert von ≤ 3,0 ng/ml teilnahmen. Männer erhielten täglich entweder PROSCAR (Finasterid 5 mg) oder Placebo. Die Patienten wurden jährlich mit PSA- und digital-rektalen Untersuchungen untersucht. Biopsien wurden bei erhöhtem PSA, einer anormalen digitalen rektalen Untersuchung oder dem Ende der Studie durchgeführt. Die Inzidenz von Prostatakrebs mit einem Gleason-Score von 8-10 war bei Männern, die mit Finasterid behandelt wurden (1,8 %), höher als bei denen, die mit Placebo behandelt wurden (1,1 %). INDIKATIONEN  und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. In einer 4-jährigen placebokontrollierten klinischen Studie mit einem anderen 5α-Reduktase-Hemmer (Dutasterid, AVODART) wurden ähnliche Ergebnisse für Prostatakrebs mit Gleason-Score 8-10 beobachtet (1 % Dutasterid vs. 0,5 % Placebo).
Bei mit PROSCAR behandelten Patienten mit Prostatakrebs wurde kein klinischer Nutzen nachgewiesen.
Brustkrebs
Während der 4- bis 6-jährigen placebo- und komparatorkontrollierten MTOPS-Studie, an der 3047 Männer teilnahmen, gab es 4 Fälle von Brustkrebs bei Männern, die mit Finasterid behandelt wurden, aber keine Fälle bei Männern, die nicht mit Finasterid behandelt wurden. Während der 4-jährigen placebokontrollierten PLESS-Studie, an der 3040 Männer teilnahmen, gab es 2 Fälle von Brustkrebs bei mit Placebo behandelten Männern, aber keine Fälle bei Männern, die mit Finasterid behandelt wurden. Während der 7-jährigen placebokontrollierten Prostate Cancer Prevention Trial (PCPT), an der 18.882 Männer teilnahmen, gab es 1 Fall von Brustkrebs bei Männern, die mit Finasterid behandelt wurden, und 1 Fall von Brustkrebs bei Männern, die mit Placebo behandelt wurden. Der Zusammenhang zwischen der Langzeitanwendung von Finasterid und Neoplasien der männlichen Brust ist derzeit nicht bekannt.
Sexuelle Funktion
Es gibt keine Hinweise auf vermehrte sexuelle Nebenwirkungen bei längerer Behandlungsdauer mit PROSCAR. Neue Berichte über arzneimittelbezogene sexuelle Nebenwirkungen nahmen mit der Dauer der Therapie ab.
Postmarketing-Erfahrung
Die folgenden zusätzlichen unerwünschten Ereignisse wurden nach der Markteinführung mit PROSCAR berichtet. Da diese Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
Das folgende zusätzliche unerwünschte Ereignis im Zusammenhang mit einer sexuellen Dysfunktion, die nach Absetzen der Behandlung anhielt, wurde in Postmarketing-Erfahrungen mit Finasterid in niedrigeren Dosen zur Behandlung von Haarausfall bei Männern berichtet. Da das Ereignis freiwillig von einer Population ungewisser Größe gemeldet wird, ist es nicht immer möglich, seine Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Cytochrom P450-Linked Drug Metabolizing Enzyme System
Es wurden keine Arzneimittelwechselwirkungen von klinischer Bedeutung festgestellt. Finasterid scheint das mit Cytochrom P450 verbundene Enzymsystem zur Metabolisierung von Arzneimitteln nicht zu beeinflussen. Zu den am Menschen getesteten Verbindungen gehörten Antipyrin, Digoxin, Propranolol, Theophyllin und Warfarin, und es wurden keine klinisch bedeutsamen Wechselwirkungen gefunden.
Andere Begleittherapie
Obwohl keine spezifischen Interaktionsstudien durchgeführt wurden, wurde PROSCAR 5 mg gleichzeitig in klinischen Studien mit Paracetamol, Acetylsalicylsäure, α-Blockern, Angiotensin-Converting-Enzym (ACE)-Hemmern, Analgetika, Antikonvulsiva, Betablockern, Diuretika und Calcium angewendet Kanalblocker, Herznitrate, HMG-CoA-Reduktasehemmer, nichtsteroidale Antirheumatika (NSAIDs), Benzodiazepine, H2-Antagonisten und Chinolon-Antiinfektiva ohne Nachweis klinisch signifikanter unerwünschter Wechselwirkungen.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Auswirkungen auf das prostataspezifische Antigen (PSA) und die Verwendung von PSA bei der Erkennung von Prostatakrebs
In klinischen Studien senkte PROSCAR die Serum-PSA-Konzentration innerhalb von sechs Behandlungsmonaten um etwa 50 %. Diese Abnahme ist über den gesamten Bereich der PSA-Werte bei Patienten mit symptomatischer BPH vorhersagbar, obwohl sie individuell variieren kann.
Zur Interpretation serieller PSA-Werte bei Männern, die PROSCAR einnehmen, sollte mindestens sechs Monate nach Beginn der Behandlung ein neuer PSA-Basiswert festgelegt und der PSA-Wert danach regelmäßig überwacht werden. Jeder bestätigte Anstieg vom niedrigsten PSA-Wert während der Einnahme von PROSCAR 5 mg kann auf das Vorhandensein von Prostatakrebs hindeuten und sollte ausgewertet werden, selbst wenn die PSA-Werte bei Männern, die keinen 5α-Reduktasehemmer einnehmen, immer noch im normalen Bereich liegen. Die Nichteinhaltung der PROSCAR-Therapie kann auch die PSA-Testergebnisse beeinflussen. Um einen isolierten PSA-Wert bei Patienten zu interpretieren, die sechs Monate oder länger mit PROSCAR 5 mg behandelt wurden, sollten die PSA-Werte zum Vergleich mit normalen Bereichen bei unbehandelten Männern verdoppelt werden. Diese Anpassungen bewahren den Nutzen von PSA zur Erkennung von Prostatakrebs bei mit PROSCAR behandelten Männern.
PROSCAR kann auch bei Vorliegen von Prostatakrebs zu einer Abnahme des PSA-Serumspiegels führen.
Das Verhältnis von freiem zu Gesamt-PSA (Prozent freies PSA) bleibt auch unter dem Einfluss von PROSCAR konstant. Wenn sich Ärzte dafür entscheiden, den Prozentsatz an freiem PSA als Hilfsmittel bei der Erkennung von Prostatakrebs bei Männern zu verwenden, die sich einer Finasterid-Therapie unterziehen, erscheint keine Anpassung dieses Werts erforderlich.
Erhöhtes Risiko für hochgradigen Prostatakrebs
Männer ab 55 Jahren mit einer normalen digital-rektalen Untersuchung und einem PSA-Wert von ≤ 3,0 ng/ml zu Studienbeginn, die Finasterid 5 mg/Tag in der 7-jährigen Prostate Cancer Prevention Trial (PCPT) einnahmen, hatten ein erhöhtes Risiko für Prostatakrebs im Gleason-Score 8-10 (Finasterid 1,8 % vs. Placebo 1,1 %). [Ein ... sehen INDIKATIONEN  und NEBENWIRKUNGEN .] Ähnliche Ergebnisse wurden in einer 4-jährigen placebokontrollierten klinischen Studie mit einem anderen 5α-Reduktase-Hemmer (Dutasterid, AVODART) beobachtet (1 % Dutasterid vs. 0,5 % Placebo). 5α-Reduktase-Hemmer können das Risiko für die Entwicklung von hochgradigem Prostatakrebs erhöhen. Ob die Wirkung von 5α-Reduktase-Hemmern zur Verringerung des Prostatavolumens oder studienbezogene Faktoren die Ergebnisse dieser Studien beeinflussten, wurde nicht nachgewiesen.
Exposition von Frauen
Risiko für den männlichen Fötus
PROSCAR ist bei schwangeren Frauen und bei Frauen, die möglicherweise schwanger sind, kontraindiziert und nicht zur Anwendung bei Frauen indiziert. Basierend auf Tierversuchen und dem Wirkungsmechanismus kann PROSCAR 5 mg eine abnormale Entwicklung der äußeren Genitalien bei einem männlichen Fötus verursachen, wenn es einer schwangeren Frau verabreicht wird. Frauen, die schwanger sind oder schwanger sein könnten, sollten keine zerkleinerten oder zerbrochenen PROSCAR 5-mg-Tabletten handhaben. PROSCAR 5 mg Tabletten sind beschichtet und verhindern den Kontakt mit dem Wirkstoff bei normaler Handhabung, vorausgesetzt, die Tabletten wurden nicht zerbrochen oder zerdrückt. Wenn eine schwangere Frau mit zerkleinerten oder zerbrochenen PROSCAR 5 mg-Tabletten in Kontakt kommt, sollte der Kontaktbereich sofort mit Wasser und Seife gewaschen werden. [Ein ... sehen KONTRAINDIKATIONEN ,EIN Verwendung in bestimmten Bevölkerungsgruppen ,EIN KLINISCHE PHARMAKOLOGIE , und ein WIE GELIEFERT .]
Pädiatrische Patienten und Frauen
PROSCAR ist nicht für die Anwendung bei pädiatrischen Patienten indiziert [siehe Verwendung in bestimmten Bevölkerungsgruppen  und KLINISCHE PHARMAKOLOGIE ] oder Weibchen [siehe auch WARNUNGEN UND VORSICHTSMASSNAHMEN ,EIN Verwendung in bestimmten Bevölkerungsgruppen ,EIN KLINISCHE PHARMAKOLOGIE , und ein WIE GELIEFERT ].
Auswirkung auf die Sameneigenschaften
Die 24-wöchige Behandlung mit PROSCAR zur Bewertung der Samenparameter bei gesunden männlichen Freiwilligen zeigte keine klinisch bedeutsamen Auswirkungen auf die Konzentration, Mobilität, Morphologie oder den pH-Wert der Spermien. Es wurde eine mediane Abnahme des Ejakulatvolumens um 0,6 ml (22,1 %) bei gleichzeitiger Abnahme der Gesamtzahl der Spermien pro Ejakulat beobachtet. Diese Parameter blieben im normalen Bereich und waren nach Absetzen der Therapie reversibel, mit einer durchschnittlichen Zeit bis zur Rückkehr zum Ausgangswert von 84 Wochen.
Berücksichtigung anderer urologischer Erkrankungen
Vor Beginn der Behandlung mit PROSCAR 5 mg sollten andere urologische Erkrankungen berücksichtigt werden, die ähnliche Symptome verursachen können. Außerdem können Prostatakrebs und BPH koexistieren.
Patienten mit großem Restharnvolumen und/oder stark vermindertem Harnfluss sollten sorgfältig auf obstruktive Uropathie überwacht werden. Diese Patienten sind möglicherweise keine Kandidaten für eine Finasterid-Therapie.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Erhöhtes Risiko für hochgradigen Prostatakrebs
Die Patienten sollten darüber informiert werden, dass es bei Männern, die mit 5α-Reduktase-Hemmern behandelt wurden, die für eine BPH-Behandlung indiziert sind, einschließlich PROSCAR 5 mg, im Vergleich zu denen, die mit Placebo behandelt wurden, in Studien, die sich mit der Verwendung dieser Arzneimittel zur Prostataprävention befassten, eine Zunahme von hochgradigem Prostatakrebs gab Krebs [siehe INDIKATIONEN ,EIN WARNUNGEN UND VORSICHTSMASSNAHMEN , und ein NEBENWIRKUNGEN ].
Exposition von Frauen – Risiko für männliche Föten
Ärzte sollten Patienten darüber informieren, dass Frauen, die schwanger sind oder schwanger sein könnten, aufgrund der Möglichkeit einer Resorption von Finasterid und des daraus resultierenden potenziellen Risikos für den männlichen Fötus nicht mit zerkleinerten oder zerbrochenen PROSCAR-Tabletten umgehen sollten. PROSCAR-Tabletten sind beschichtet und verhindern bei normaler Handhabung den Kontakt mit dem Wirkstoff, sofern die Tabletten nicht zerbrochen oder zerdrückt wurden. Wenn eine schwangere oder möglicherweise schwangere Frau mit zerkleinerten oder zerbrochenen PROSCAR-Tabletten in Kontakt kommt, sollte der Kontaktbereich sofort mit Wasser und Seife gewaschen werden [siehe KONTRAINDIKATIONEN ,EIN WARNUNGEN UND VORSICHTSMASSNAHMEN ,EIN Verwendung in bestimmten Bevölkerungsgruppen  und WIE GELIEFERT ].
zusätzliche Anweisungen
Ärzte sollten die Patienten darüber informieren, dass das Ejakulatvolumen bei manchen Patienten während der Behandlung mit PROSCAR abnehmen kann. Diese Abnahme scheint die normale Sexualfunktion nicht zu beeinträchtigen. Bei Patienten, die mit PROSCAR behandelt werden, können jedoch Impotenz und verminderte Libido auftreten [siehe NEBENWIRKUNGEN ].
Ärzte sollten ihre Patientinnen anweisen, alle Veränderungen ihrer Brüste wie Knoten, Schmerzen oder Ausfluss aus der Brustwarze umgehend zu melden. Brustveränderungen, einschließlich Brustvergrößerung, Druckempfindlichkeit und Neubildungen, wurden berichtet [siehe NEBENWIRKUNGEN ].
Ärzte sollten ihre Patienten anweisen, die Packungsbeilage für Patienten vor Beginn der Behandlung mit PROSCAR 5 mg zu lesen und sie jedes Mal erneut zu lesen, wenn die Verschreibung verlängert wird, damit sie die aktuellen Informationen für Patienten bezüglich PROSCAR kennen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
In einer 24-monatigen Studie an Sprague-Dawley-Ratten, die Finasterid-Dosen von bis zu 160 mg/kg/Tag bei Männchen und 320 mg/kg/Tag bei Weibchen erhielten, wurden keine Hinweise auf eine tumorerzeugende Wirkung beobachtet. Diese Dosen führten bei Ratten zu einer 111- bzw. 274-fachen systemischen Exposition gegenüber derjenigen, die beim Menschen beobachtet wurde, der die empfohlene Humandosis von 5 mg/Tag erhielt. Alle Expositionsberechnungen basierten auf der berechneten AUC(0-24 h) für Tiere und der mittleren AUC(0-24 h) für den Menschen (0,4 μg•h/ml).
In einer 19-monatigen Karzinogenitätsstudie an CD-1-Mäusen wurde eine statistisch signifikante (p ≤ 0,05) Zunahme der Inzidenz testikulärer Leydig-Zell-Adenome beim 228-Fachen der Humanexposition (250 mg/kg/Tag) beobachtet. Bei Mäusen wurde bei 23-facher Exposition beim Menschen (schätzungsweise 25 mg/kg/Tag) und bei Ratten bei 39-facher Exposition beim Menschen (40 mg/kg/Tag) eine Zunahme der Inzidenz von Leydig-Zell-Hyperplasie beobachtet. Eine positive Korrelation zwischen den proliferativen Veränderungen in den Leydig-Zellen und einem Anstieg der Serum-LH-Spiegel (2- bis 3-fach über der Kontrolle) wurde bei beiden Nagetierarten nachgewiesen, die mit hohen Finasterid-Dosen behandelt wurden. Weder bei Ratten noch bei Hunden, die 1 Jahr lang mit 30- bzw. 350-mal Finasterid (20 mg/kg/Tag bzw. 45 mg/kg/Tag) mit Finasterid behandelt wurden, oder bei Mäusen, die 19 Monate lang mit Finasterid behandelt wurden, wurden keine arzneimittelbedingten Leydig-Zell-Veränderungen beobachtet 2,3-fache Exposition beim Menschen, geschätzt (2,5 mg/kg/Tag).
Mutagenese
In einem bakteriellen In-vitro-Mutagenese-Assay, einem Säugerzell-Mutagenese-Assay oder in einem alkalischen In-vitro-Elutions-Assay wurden keine Hinweise auf Mutagenität beobachtet. In einem In-vitro-Chromosomenaberrationstest mit Ovarialzellen chinesischer Hamster gab es einen leichten Anstieg der Chromosomenaberrationen. Diese Konzentrationen entsprechen dem 4000- bis 5000-fachen der maximalen Plasmaspiegel beim Menschen bei einer Gesamtdosis von 5 mg. In einem In-vivo-Chromosomenaberrationstest an Mäusen wurde bei der maximal tolerierten Dosis von 250 mg/kg/Tag (228-fache der Exposition beim Menschen) von Finasterid, wie in Karzinogenitätsstudien bestimmt, keine behandlungsbedingte Zunahme der Chromosomenaberration beobachtet.
Beeinträchtigung der Fruchtbarkeit
Bei geschlechtsreifen männlichen Kaninchen, die bis zu 12 Wochen lang mit dem 543-Fachen der humantherapeutischen Exposition (80 mg/kg/Tag) mit Finasterid behandelt wurden, wurde keine Auswirkung auf die Fertilität, die Spermienzahl oder das Ejakulatvolumen beobachtet. Bei geschlechtsreifen männlichen Ratten, die mit der 61-fachen humantherapeutischen Exposition (80 mg/kg/Tag) behandelt wurden, gab es nach 6 oder 12 Behandlungswochen keine signifikanten Auswirkungen auf die Fertilität; Wenn die Behandlung jedoch bis zu 24 oder 30 Wochen fortgesetzt wurde, kam es zu einer offensichtlichen Abnahme der Fertilität, Fruchtbarkeit und einer damit verbundenen signifikanten Abnahme des Gewichts der Samenbläschen und der Prostata. Alle diese Wirkungen waren innerhalb von 6 Wochen nach Absetzen der Behandlung reversibel. Bei Ratten oder Kaninchen wurden keine arzneimittelbedingten Auswirkungen auf die Hoden oder die Paarungsleistung beobachtet. Diese Abnahme der Fertilität bei mit Finasterid behandelten Ratten ist sekundär zu seiner Wirkung auf akzessorische Geschlechtsorgane (Prostata und Samenbläschen), was dazu führt, dass kein Samenpfropfen gebildet wird. Der Samenpfropfen ist für die normale Fruchtbarkeit bei Ratten unerlässlich und beim Menschen nicht relevant.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
PROSCAR ist bei schwangeren Frauen kontraindiziert und nicht zur Anwendung bei Frauen indiziert. Basierend auf Tierversuchen und dem Wirkungsmechanismus kann PROSCAR 5 mg eine abnormale Entwicklung der äußeren Genitalien bei einem männlichen Fötus verursachen, wenn es einer schwangeren Frau verabreicht wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN  und KLINISCHE PHARMAKOLOGIE ].
In einer Studie zur embryofetalen Entwicklung bei Ratten gab es eine dosisabhängige Zunahme von Hypospadie, die bei 3,6 bis 100 % der männlichen Nachkommen von trächtigen Ratten auftrat, denen Finasterid während der Phase der Hauptorganogenese in Dosen verabreicht wurde, die ungefähr dem 0,1- bis 86-Fachen des Maximums entsprachen empfohlene Humandosis (MRHD) von 5 mg/Tag (basierend auf der AUC bei Tierdosen von 0,1 bis 100 mg/kg/Tag).
Verringertes Prostata- und Samenblasengewicht, verzögerte Präputialtrennung und vorübergehende Brustwarzenentwicklung wurden auch bei männlichen Nachkommen bei oralen mütterlichen Dosen beobachtet, die etwa dem 0,03-fachen der MRHD (basierend auf der AUC bei einer Tierdosis von 0,03 mg/kg/Tag) entsprachen, zusammen mit einer verringerten anogenitalen Distanz bei männlichen Nachkommen bei oralen mütterlichen Dosen etwa dem 0,003-fachen der MRHD (basierend auf der AUC bei einer Tierdosis von 0,003 mg/kg/Tag).
PROSCAR ist ein 5α-Reduktase-Hemmer vom Typ II, der die Umwandlung von Testosteron in 5α-Dihydrotestosteron (DHT) verhindert, ein Hormon, das für die normale Entwicklung der männlichen Genitalien notwendig ist. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den männlichen Fötus informiert werden.
Eine abnorme männliche Genitalentwicklung ist eine erwartete Folge, wenn die Umwandlung von Testosteron in 5α-Dihydrotestosteron (DHT) durch 5α-Reduktase-Inhibitoren gehemmt wird. Diese Ergebnisse ähneln denen, die bei männlichen Säuglingen mit genetischem 5α-Reduktase-Mangel berichtet wurden. Frauen könnten Finasterid durch Kontakt mit zerdrückten oder zerbrochenen PROSCAR-Tabletten oder Samen eines männlichen Partners, der PROSCAR einnimmt, ausgesetzt werden. Im Hinblick auf die Finasterid-Exposition durch die Haut sind PROSCAR 5 mg-Tabletten beschichtet und verhindern den Hautkontakt mit Finasterid bei normaler Handhabung, wenn die Tabletten nicht zerdrückt oder zerbrochen wurden. Frauen, die schwanger sind oder schwanger sein könnten, sollten wegen der möglichen Exposition eines männlichen Fötus keine zerdrückten oder zerbrochenen PROSCAR 5-mg-Tabletten handhaben. Im Hinblick auf eine mögliche Finasterid-Exposition durch Sperma wurden drei Studien durchgeführt, in denen Finasterid-Konzentrationen im Sperma von Männern gemessen wurden, die PROSCAR 5 mg/Tag erhielten. In diesen Studien wurde die höchste Finasterid-Menge im Sperma auf das 50- bis 100-fache der Finasterid-Dosis (5 μg) geschätzt, die keine Wirkung auf die zirkulierenden DHT-Spiegel bei Männern hatte [siehe Daten  und KLINISCHE PHARMAKOLOGIE ].
Daten
Menschliche Daten
In 2 Studien mit gesunden Probanden (n=69), die PROSCAR 5 mg/Tag über 6-24 Wochen erhielten, reichten die Finasteridkonzentrationen im Sperma von nicht nachweisbar ( KLINISCHE PHARMAKOLOGIE ].
Tierdaten
In einer Studie zur embryofetalen Entwicklung erhielten trächtige Ratten Finasterid während der Phase der Hauptorganogenese (6. bis 17. Trächtigkeitstag). Bei maternalen Dosen von oralem Finasterid, die etwa dem 0,1- bis 86-Fachen der maximal empfohlenen Dosis beim Menschen (MRHD) von 5 mg/Tag (basierend auf der AUC bei Tierdosen von 0,1 bis 100 mg/kg/Tag) entsprachen, kam es zu einem dosisabhängigen Anstieg der Hypospadie das trat bei 3,6 bis 100 % der männlichen Nachkommen auf. Expositions-Multiples wurden anhand von Daten von nicht trächtigen Ratten geschätzt. Die Tage 16 bis 17 der Trächtigkeit sind bei männlichen fötalen Ratten ein kritischer Zeitraum für die Differenzierung der äußeren Genitalien. Bei oralen mütterlichen Dosen, die ungefähr dem 0,03-fachen der MRHD (basierend auf der AUC bei einer Tierdosis von 0,03 mg/kg/Tag) entsprachen, wiesen männliche Nachkommen ein verringertes Prostata- und Samenbläschengewicht, eine verzögerte Präputialtrennung und eine vorübergehende Brustwarzenentwicklung auf. Eine verringerte anogenitale Distanz trat bei männlichen Nachkommen trächtiger Ratten auf, die das ungefähr 0,003-fache der MRHD erhielten (basierend auf der AUC bei einer Tierdosis von 0,003 mg/kg/Tag). Bei weiblichen Nachkommen wurden bei keiner Finasterid-Dosis der Mutter Anomalien beobachtet.
Bei den Nachkommen von unbehandelten Weibchen, die mit Finasterid-behandelten männlichen Ratten gepaart wurden, die etwa das 61-fache der MRHD erhielten (basierend auf der AUC bei einer Tierdosis von 80 mg/kg/Tag), wurden keine Entwicklungsanomalien beobachtet. Eine leicht verminderte Fertilität wurde bei männlichen Nachkommen nach Verabreichung von etwa dem Dreifachen der MRHD (basierend auf der AUC bei einer Tierdosis von 3 mg/kg/Tag) an weibliche Ratten während der späten Trächtigkeit und Laktation beobachtet. Unter diesen Bedingungen wurden bei weiblichen Nachkommen keine Auswirkungen auf die Fertilität beobachtet.
Bei Kaninchenföten, die Finasterid während des Zeitraums der Hauptorganogenese (6. bis 18. Trächtigkeitstag) bei maternalen oralen Dosen von bis zu 100 mg/kg/Tag ausgesetzt waren, wurden keine Hinweise auf männliche äußere Genitalmissbildungen oder andere Anomalien beobachtet (Finasterid-Expositionsspiegel waren es nicht bei Kaninchen gemessen). Diese Studie hat jedoch möglicherweise nicht den kritischen Zeitraum für die Auswirkungen von Finasterid auf die Entwicklung der männlichen äußeren Genitalien beim Kaninchen berücksichtigt.
Die fetalen Wirkungen einer mütterlichen Finasterid-Exposition während der embryonalen und fetalen Entwicklung wurden bei Rhesusaffen (20.–100. Trächtigkeitstag) untersucht, und zwar in einer Spezies und einem Entwicklungszeitraum, die spezifischere Wirkungen beim Menschen besser vorhersagen als die Studien an Ratten und Kaninchen. Die intravenöse Verabreichung von Finasterid an trächtige Affen in Dosen von bis zu 800 ng/Tag (geschätzte maximale Blutkonzentration von 1,86 ng/ml oder etwa das 143-fache der höchsten geschätzten Exposition von trächtigen Frauen gegenüber Finasterid aus dem Samen von Männern, die 5 mg/Tag einnahmen) resultierte keine Anomalien bei männlichen Föten. Zur Bestätigung der Relevanz des Rhesus-Modells für die Entwicklung des menschlichen Fötus ist die orale Gabe einer Finasterid-Dosis (2 mg/kg/Tag oder etwa das 18.000-fache der höchsten geschätzten Blutspiegel von Finasterid aus dem Samen von Männern, die 5 mg/Tag einnehmen) zu verabreichen trächtige Affen führten bei männlichen Föten zu äußeren Genitalanomalien. Bei männlichen Föten wurden keine anderen Anomalien beobachtet, und bei weiblichen Föten wurden bei keiner Dosis finasteridbedingte Anomalien beobachtet.
Stillzeit
Zusammenfassung der Risiken
PROSCAR ist nicht zur Anwendung bei Frauen indiziert.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
PROSCAR ist nicht zur Anwendung bei Frauen indiziert.
Männchen
Die 24-wöchige Behandlung mit PROSCAR zur Bewertung der Samenparameter bei gesunden männlichen Freiwilligen zeigte keine klinisch bedeutsamen Auswirkungen auf die Konzentration, Mobilität, Morphologie oder den pH-Wert der Spermien. Es wurde eine mediane Abnahme des Ejakulatvolumens um 0,6 ml (22,1 %) bei gleichzeitiger Abnahme der Gesamtzahl der Spermien pro Ejakulat beobachtet. Diese Parameter blieben im normalen Bereich und waren nach Absetzen der Therapie reversibel, mit einer durchschnittlichen Zeit bis zur Rückkehr zum Ausgangswert von 84 Wochen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Es gab Postmarketing-Berichte über männliche Unfruchtbarkeit und/oder schlechte Samenqualität; Nach Absetzen von Finasterid wurde über eine Normalisierung oder Verbesserung der Samenqualität berichtet [siehe NEBENWIRKUNGEN ].
Pädiatrische Verwendung
PROSCAR 5 mg ist nicht für die Anwendung bei pädiatrischen Patienten indiziert.
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Von der Gesamtzahl der in PLESS eingeschlossenen Probanden waren 1480 und 105 Probanden 65 Jahre und älter bzw. 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Bei älteren Menschen ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE  und Klinische Studien ].
Leberfunktionsstörung
Bei der Verabreichung von PROSCAR an Patienten mit Leberfunktionsstörungen ist Vorsicht geboten, da Finasterid extensiv in der Leber metabolisiert wird [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Die Patienten erhielten drei Monate lang Einzeldosen von PROSCAR 5 mg bis zu 400 mg und Mehrfachdosen von PROSCAR 5 mg bis zu 80 mg/Tag ohne Nebenwirkungen. Bis weitere Erfahrungen vorliegen, kann keine spezifische Behandlung einer Überdosierung mit PROSCAR empfohlen werden.
Bei männlichen und weiblichen Mäusen wurde bei oralen Einzeldosen von 1500 mg/m2 (500 mg/kg) und bei weiblichen und männlichen Ratten bei oralen Einzeldosen von 2360 mg/m2 (400 mg/kg) und 5900 mg/m2 eine signifikante Letalität beobachtet (1000 mg/kg).
KONTRAINDIKATIONEN
PROSCAR ist kontraindiziert bei:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Die Entwicklung und Vergrößerung der Prostata ist abhängig vom potenten Androgen 5α-Dihydrotestosteron (DHT). Typ II 5α-Reduktase wandelt Testosteron in der Prostata, der Leber und der Haut zu DHT um. DHT induziert androgene Wirkungen, indem es an Androgenrezeptoren in den Zellkernen dieser Organe bindet.
Finasterid ist ein kompetitiver und spezifischer Inhibitor der Typ-II-5α-Reduktase, mit der es langsam einen stabilen Enzymkomplex bildet. Der Umsatz dieses Komplexes ist extrem langsam (t½ bis 30 Tage). Dies wurde sowohl in vivo als auch in vitro nachgewiesen. Finasterid hat keine Affinität zum Androgenrezeptor. Beim Menschen sind die 5α-reduzierten Steroidmetaboliten im Blut und Urin nach Verabreichung von Finasterid erniedrigt.
Pharmakodynamik
Beim Menschen führt eine orale Einzeldosis von 5 mg PROSCAR zu einer raschen Verringerung der Serum-DHT-Konzentration, wobei die maximale Wirkung 8 Stunden nach der ersten Dosis beobachtet wird. Die Unterdrückung von DHT wird während des 24-stündigen Dosierungsintervalls und bei fortgesetzter Behandlung aufrechterhalten. Es hat sich gezeigt, dass die tägliche Gabe von PROSCAR mit 5 mg/Tag über einen Zeitraum von bis zu 4 Jahren die Serum-DHT-Konzentration um etwa 70 % senkt. Der mittlere zirkulierende Testosteronspiegel stieg um etwa 10–20 % an, blieb aber innerhalb des physiologischen Bereichs. In einer separaten Studie mit gesunden Männern, die mit Finasterid 1 mg pro Tag (n = 82) oder Placebo (n = 69) behandelt wurden, waren die mittleren zirkulierenden Testosteron- und Estradiolspiegel im Vergleich zum Ausgangswert um etwa 15 % erhöht, blieben jedoch innerhalb der Physiologischer Bereich.
Bei Patienten, die PROSCAR 5 mg/Tag erhielten, wurde ein Anstieg des luteinisierenden Hormons (LH) und des follikelstimulierenden Hormons (FSH) um etwa 10 % beobachtet, die Spiegel blieben jedoch im normalen Bereich. Bei gesunden Probanden veränderte die Behandlung mit PROSCAR 5 mg die Reaktion von LH und FSH auf das Gonadotropin-Releasing-Hormon nicht, was darauf hindeutet, dass die Hypothalamus-Hypophysen-Hoden-Achse nicht betroffen war.
Bei Patienten mit BPH hat PROSCAR keine Wirkung auf die zirkulierenden Spiegel von Cortisol, Prolaktin, Schilddrüsen-stimulierendem Hormon oder Thyroxin. Es wurde keine klinisch bedeutsame Wirkung auf das Plasmalipidprofil (dh Gesamtcholesterin, Lipoproteine niedriger Dichte, Lipoproteine hoher Dichte und Triglyceride) oder die Knochenmineraldichte beobachtet.
Erwachsene Männer mit genetisch vererbtem 5α-Reduktase-Mangel vom Typ II haben ebenfalls verringerte DHT-Spiegel. Abgesehen von den damit verbundenen urogenitalen Defekten, die bei der Geburt vorhanden waren, wurden bei diesen Personen keine anderen klinischen Anomalien im Zusammenhang mit einem Typ-II-5α-Reduktase-Mangel beobachtet. Diese Personen haben ihr ganzes Leben lang eine kleine Prostata und entwickeln keine BPH.
Bei Patienten mit BPH, die 7-10 Tage vor der Prostatektomie mit Finasterid (1-100 mg/Tag) behandelt wurden, wurde ein etwa 80 % niedrigerer DHT-Gehalt im bei der Operation entfernten Prostatagewebe im Vergleich zu Placebo gemessen; Die Testosteron-Gewebekonzentration war im Vergleich zu Placebo bis zu 10-mal höher als vor der Behandlung. Der intraprostatische PSA-Gehalt war ebenfalls verringert.
Bei gesunden männlichen Freiwilligen, die 14 Tage lang mit PROSCAR 5 mg behandelt wurden, führte das Absetzen der Therapie innerhalb von etwa 2 Wochen zu einer Rückkehr der DHT-Spiegel auf die Werte vor der Behandlung. Bei Patienten, die drei Monate lang behandelt wurden, kehrte das Prostatavolumen, das um etwa 20 % abnahm, nach etwa drei Monaten Absetzen der Therapie auf nahezu den Ausgangswert zurück.
Pharmakokinetik
Absorption
In einer Studie mit 15 gesunden jungen Probanden betrug die mittlere Bioverfügbarkeit von Finasterid 5-mg-Tabletten 63 % (Bereich 34–108 %), basierend auf dem Verhältnis der Fläche unter der Kurve (AUC) relativ zu einer intravenösen (i.v.) Referenzdosis . Die maximale Plasmakonzentration von Finasterid betrug durchschnittlich 37 ng/ml (Bereich 27-49 ng/ml) und wurde 1-2 Stunden nach der Einnahme erreicht. Die Bioverfügbarkeit von Finasterid wurde durch Nahrung nicht beeinflusst.
Verteilung
Das mittlere Verteilungsvolumen im Steady State betrug 76 Liter (Bereich 44–96 Liter). Etwa 90 % des zirkulierenden Finasterids ist an Plasmaproteine gebunden. Bei Finasterid gibt es nach Mehrfachgabe eine langsame Akkumulationsphase. Nach 17-tägiger Gabe von 5 mg/Tag Finasterid waren die Plasmakonzentrationen von Finasterid bei Männern im Alter von 45 bis 60 Jahren (n = 12) und ≥ 70 Jahren (n = 12) um 47 bzw. 54 % höher als nach der ersten Dosis. , beziehungsweise. Die mittleren Talkonzentrationen nach 17 Tagen Dosierung betrugen in den beiden Altersgruppen 6,2 ng/ml (Bereich 2,49,8 ng/ml) bzw. 8,1 ng/ml (Bereich 1,8–19,7 ng/ml). Obwohl in dieser Studie kein Steady State erreicht wurde, betrug die mittlere Talplasmakonzentration in einer anderen Studie bei Patienten mit BPH (Durchschnittsalter 65 Jahre), die 5 mg/Tag erhielten, 9,4 ng/ml (Bereich 7,1–13,3 ng/ml; n= 22) nach über einem Jahr Einnahme.
Finasterid überwindet nachweislich die Blut-Hirn-Schranke, verteilt sich aber offenbar nicht bevorzugt im Liquor.
In 2 Studien mit gesunden Probanden (n=69), die PROSCAR 5 mg/Tag über 6-24 Wochen erhielten, reichten die Finasteridkonzentrationen im Sperma von nicht nachweisbar ( Verwendung in bestimmten Bevölkerungsgruppen ].
Stoffwechsel
Finasterid wird weitgehend in der Leber metabolisiert, hauptsächlich über die Enzymunterfamilie Cytochrom P450 3A4. Zwei Metaboliten, die monohydroxylierte t-Butyl-Seitenkette und Monocarbonsäure-Metaboliten, wurden identifiziert, die nicht mehr als 20 % der 5α-Reduktase-Hemmaktivität von Finasterid besitzen.
Ausscheidung
Bei gesunden jungen Probanden (n = 15) betrug die mittlere Plasmaclearance von Finasterid 165 ml/min (Bereich 70279 ml/min) und die mittlere Eliminationshalbwertszeit im Plasma 6 Stunden (Bereich 3–16 Stunden). Nach einer oralen Dosis von 14C-Finasterid beim Menschen (n = 6) wurden durchschnittlich 39 % (Bereich 32–46 %) der Dosis in Form von Metaboliten im Urin ausgeschieden; 57 % (Bereich 51–64 %) wurden mit dem Kot ausgeschieden.
Die mittlere terminale Halbwertszeit von Finasterid bei Personen im Alter von ≥ 70 Jahren betrug etwa 8 Stunden (Bereich 6–15 Stunden; n=12), verglichen mit 6 Stunden (Bereich 4–12 Stunden; n=12) bei Personen 45-60 Jahre alt. Als Ergebnis war die mittlere AUC(0-24 Std.) nach 17-tägiger Einnahme bei Probanden im Alter von ≥ 70 Jahren um 15 % höher als bei Probanden im Alter von 45 bis 60 Jahren (p = 0,02).
Pädiatrie
Die Pharmakokinetik von Finasterid wurde bei Patienten unter 18 Jahren nicht untersucht.
Finasterid ist nicht für die Anwendung bei pädiatrischen Patienten indiziert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ,EIN Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
Finasterid ist nicht zur Anwendung bei Frauen indiziert [siehe KONTRAINDIKATIONEN ,EIN WARNUNGEN UND VORSICHTSMASSNAHMEN ,EIN Verwendung in bestimmten Bevölkerungsgruppen , und ein WIE GELIEFERT ].
Geriatrie
Bei älteren Patienten ist keine Dosisanpassung erforderlich. Obwohl die Eliminationsrate von Finasterid bei älteren Menschen verringert ist, sind diese Befunde ohne klinische Bedeutung. [Ein ... sehen Pharmakokinetik  und Verwendung in bestimmten Bevölkerungsgruppen .]
Wettrennen
Die Auswirkung der ethnischen Zugehörigkeit auf die Pharmakokinetik von Finasterid wurde nicht untersucht.
Leberfunktionsstörung
Die Auswirkung einer Leberfunktionsstörung auf die Pharmakokinetik von Finasterid wurde nicht untersucht. Bei der Verabreichung von PROSCAR 5 mg an Patienten mit Leberfunktionsstörungen ist Vorsicht geboten, da Finasterid extensiv in der Leber metabolisiert wird. Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich. Bei Patienten mit chronischer Nierenfunktionsstörung mit einer Kreatinin-Clearance im Bereich von 9,0 bis 55 ml/min waren AUC, maximale Plasmakonzentration, Halbwertszeit und Proteinbindung nach einer Einzeldosis von 14C-Finasterid ähnlich wie bei gesunden Probanden. Die Ausscheidung von Metaboliten im Urin war bei Patienten mit eingeschränkter Nierenfunktion verringert. Diese Abnahme war mit einer Zunahme der fäkalen Ausscheidung von Metaboliten verbunden. Die Plasmakonzentrationen der Metaboliten waren bei Patienten mit eingeschränkter Nierenfunktion signifikant höher (basierend auf einem Anstieg der AUC der Gesamtradioaktivität um 60 %). Finasterid wurde jedoch von BPH-Patienten mit normaler Nierenfunktion, die 12 Wochen lang bis zu 80 mg/Tag erhielten, gut vertragen, wobei die Exposition dieser Patienten gegenüber Metaboliten vermutlich viel größer wäre.
Klinische Studien
Monotherapie
PROSCAR 5 mg/Tag wurde anfänglich bei Patienten mit BPH-Symptomen und vergrößerter Prostata durch digital-rektale Untersuchung in zwei 1-jährigen, placebokontrollierten, randomisierten, doppelblinden Studien und deren offenen 5-Jahres-Verlängerungen untersucht.
PROSCAR 5 mg wurde in der PROSCAR Long-Term Efficacy and Safety Study (PLESS), einer doppelblinden, randomisierten, placebokontrollierten, 4-jährigen, multizentrischen Studie, weiter untersucht. 3.040 Patienten im Alter zwischen 45 und 78 Jahren mit mittelschweren bis schweren BPH-Symptomen und einer vergrößerten Prostata bei einer digital-rektalen Untersuchung wurden randomisiert in die Studie aufgenommen (1.524 zu Finasterid, 1.516 zu Placebo), und 3.016 Patienten waren hinsichtlich der Wirksamkeit auswertbar. 1883 Patienten beendeten die 4-Jahres-Studie (1000 in der Finasterid-Gruppe, 883 in der Placebo-Gruppe).
Auswirkung auf den Symptom-Score
Die Symptomatik wurde mit einem Score ähnlich dem American Urological Association Symptom Score quantifiziert, der sowohl obstruktive Symptome (Beeinträchtigung der Strahlstärke und -stärke, Gefühl unvollständiger Blasenentleerung, verzögertes oder unterbrochenes Wasserlassen) als auch irritative Symptome (Nykturie, Tagesfrequenz, Bedürfnis) bewertete den Urinfluss zu belasten oder zu drängen) durch Bewertung auf einer Skala von 0 bis 5 für sechs Symptome und einer Skala von 0 bis 4 für ein Symptom, für eine mögliche Gesamtpunktzahl von 34.
Patienten in PLESS hatten zu Studienbeginn mittelschwere bis schwere Symptome (Mittelwert von etwa 15 Punkten auf einer Skala von 0–34 Punkten). Patienten, die zu PROSCAR randomisiert wurden und die Therapie 4 Jahre lang fortsetzten, hatten eine mittlere (± 1 SD) Abnahme des Symptom-Scores von 3,3 (± 5,8) Punkten im Vergleich zu 1,3 (± 5,6) Punkten in der Placebogruppe. (Siehe Abbildung 1.) Eine statistisch signifikante Verbesserung des Symptom-Scores war nach 1 Jahr bei mit PROSCAR behandelten Patienten im Vergleich zu Placebo offensichtlich (–2,3 gegenüber –1,6), und diese Verbesserung hielt bis zum 4. Jahr an.
Abbildung 1 Symptom-Score in PLESS
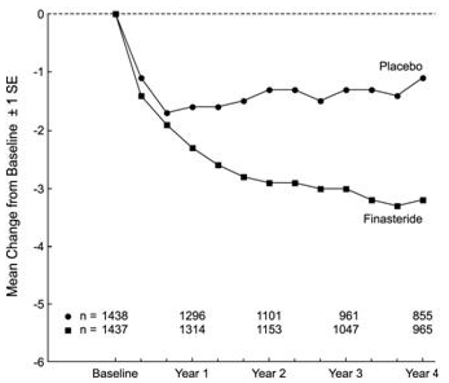
Die in früheren Studien beobachteten Ergebnisse waren mit denen in PLESS vergleichbar. Obwohl bei einigen Patienten eine frühzeitige Besserung der Harnsymptome beobachtet wurde, war im Allgemeinen ein Therapieversuch von mindestens 6 Monaten erforderlich, um zu beurteilen, ob eine positive Reaktion bei der Linderung der Symptome erzielt wurde. Die Verbesserung der BPH-Symptome wurde im ersten Jahr beobachtet und über weitere 5 Jahre in offenen Verlängerungsstudien aufrechterhalten.
Wirkung auf die akute Harnverhaltung und die Notwendigkeit einer Operation
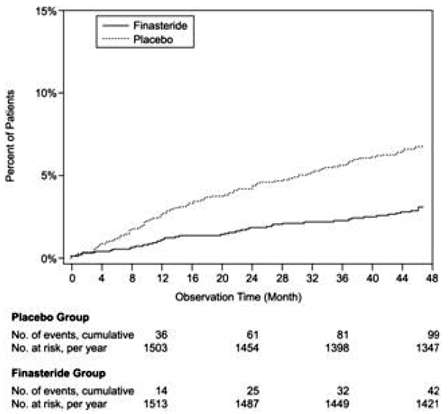
Bei PLESS wurde die Wirksamkeit auch durch die Bewertung von Behandlungsversagen bewertet. Behandlungsversagen wurde prospektiv definiert als BPH-bedingte urologische Ereignisse oder klinische Verschlechterung, ausbleibende Besserung und/oder die Notwendigkeit einer alternativen Therapie. BPH-bedingte urologische Ereignisse wurden als urologische chirurgische Eingriffe und akuter Harnverhalt, der eine Katheterisierung erforderte, definiert. Für 92 % der Patienten waren vollständige Ereignisinformationen verfügbar. Die folgende Tabelle (Tabelle 5) fasst die Ergebnisse zusammen.
Im Vergleich zu Placebo war PROSCAR mit einem signifikant geringeren Risiko für einen akuten Harnverhalt oder die Notwendigkeit einer BPH-bedingten Operation verbunden [13,2 % für Placebo vs. 6,6 % für PROSCAR; 51 % Risikoreduktion, 95 % KI: (34 bis 63 %)]. Im Vergleich zu Placebo war PROSCAR 5 mg mit einem signifikant geringeren Operationsrisiko verbunden [10,1 % für Placebo gegenüber 4,6 % für PROSCAR; 55 % Risikoreduktion, 95 % KI: (37 bis 68 %)] und mit einem signifikant geringeren Risiko für akuten Harnverhalt [6,6 % für Placebo vs. 2,8 % für PROSCAR; 57 % Risikominderung, 95 % KI: (34 bis 72 %)]; siehe Abbildungen 2 und 3.
Abbildung 2 Prozent der Patienten, die wegen BPH operiert wurden, einschließlich TURP
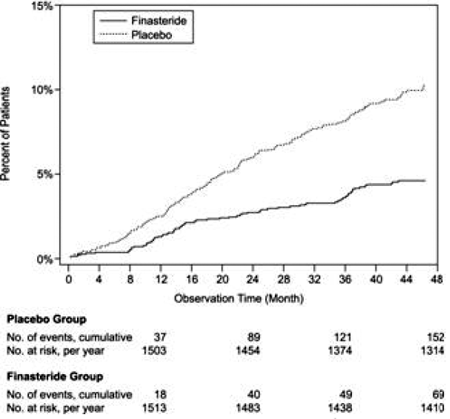
Abbildung 3 Prozent der Patienten, die einen akuten Harnverhalt entwickeln (spontan und präzipitiert)
Auswirkung auf die maximale Harnflussrate
Bei den Patienten in PLESS, die für die Dauer der Studie unter Therapie blieben und auswertbare Harnflussdaten hatten, erhöhte PROSCAR 5 mg die maximale Harnflussrate um 1,9 ml/s im Vergleich zu 0,2 ml/s in der Placebogruppe.
Es gab einen deutlichen Unterschied zwischen den Behandlungsgruppen in der maximalen Harnflussrate zugunsten von PROSCAR 5 mg bis Monat 4 (1,0 vs. 0,3 ml/s), der während der gesamten Studie beibehalten wurde. In den früheren 1-Jahres-Studien war der Anstieg der maximalen Harnflussrate vergleichbar mit PLESS und wurde während des ersten Jahres und während weiterer 5 Jahre offener Verlängerungsstudien aufrechterhalten.
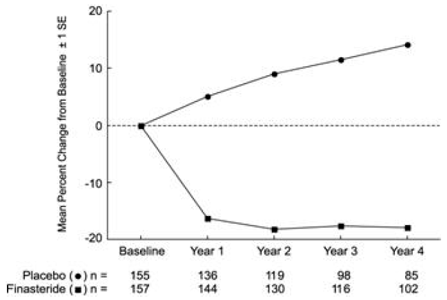
Wirkung auf das Prostatavolumen
Bei PLESS wurde das Prostatavolumen bei einer Untergruppe von Patienten jährlich mittels Magnetresonanztomographie (MRT) beurteilt. Bei mit PROSCAR 5 mg behandelten Patienten, die die Therapie beibehielten, war das Prostatavolumen während der 4-jährigen Studie im Vergleich zum Ausgangswert und zum Placebo reduziert. PROSCAR verringerte das Prostatavolumen um 17,9 % (von 55,9 cc zu Studienbeginn auf 45,8 cc nach 4 Jahren), verglichen mit einem Anstieg von 14,1 % (von 51,3 cc auf 58,5 cc) in der Placebogruppe (p
Die in früheren Studien beobachteten Ergebnisse waren mit denen in PLESS vergleichbar. Das mittlere Prostatavolumen zu Studienbeginn lag zwischen 40 und 50 cm³. Die Verringerung des Prostatavolumens wurde im ersten Jahr beobachtet und über weitere fünf Jahre offener Verlängerungsstudien aufrechterhalten.
Abbildung 4 Prostatavolumen bei PLESS
Prostatavolumen als Prädiktor des therapeutischen Ansprechens
Eine Metaanalyse, in der 1-Jahres-Daten aus sieben doppelblinden, placebokontrollierten Studien mit ähnlichem Design, einschließlich 4491 Patienten mit symptomatischer BPH, kombiniert wurden, zeigte, dass bei mit PROSCAR behandelten Patienten das Ausmaß der Symptomreaktion und der Grad der Verbesserung maximal waren Die Harnflussrate war bei Patienten mit vergrößerter Prostata zu Studienbeginn größer.
Kombination mit Alpha-Blocker-Therapie
Die Studie Medical Therapy of Prostatic Symptoms (MTOPS) war eine doppelblinde, randomisierte, placebokontrollierte, multizentrische Studie über 4 bis 6 Jahre (durchschnittlich 5 Jahre) mit 3047 Männern mit symptomatischer BPH, die randomisiert PROSCAR 5 erhielten mg/Tag (n=768), Doxazosin 4 oder 8 mg/Tag (n=756), die Kombination von PROSCAR 5 mg/Tag und Doxazosin 4 oder 8 mg/Tag (n=786) oder Placebo (n=737). ). Alle Teilnehmer wurden einer wöchentlichen Titration von Doxazosin (oder seinem Placebo) von 1 auf 2 auf 4 auf 8 mg/Tag unterzogen. Nur diejenigen, die die Dosis von 4 oder 8 mg tolerierten, wurden in der Studie weiterhin mit Doxazosin (oder seinem Placebo) behandelt. Die endgültig tolerierte Dosis des Teilnehmers (entweder 4 mg oder 8 mg) wurde beginnend am Ende von Woche 4 verabreicht. Die letzte Doxazosin-Dosis wurde einmal täglich vor dem Schlafengehen verabreicht.
Das mittlere Patientenalter bei Randomisierung betrug 62,6 Jahre (±7,3 Jahre). Die Patienten waren Kaukasier (82 %), Afroamerikaner (9 %), Hispanoamerikaner (7 %), Asiaten (1 %) oder Indianer (
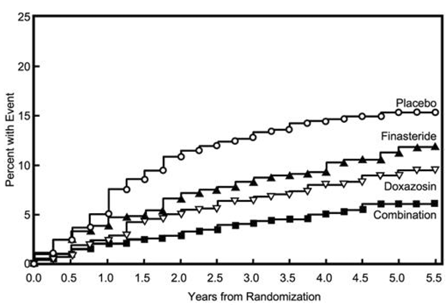
Der primäre Endpunkt war ein zusammengesetztes Maß für das erste Auftreten eines der folgenden fünf Ergebnisse: ein ≥ 4-Punkte-bestätigter Anstieg des Symptom-Scores gegenüber dem Ausgangswert, akuter Harnverhalt, BPH-bedingte Niereninsuffizienz (Kreatininanstieg), wiederkehrende Harnwegsinfektionen oder Urosepsis oder Inkontinenz. Im Vergleich zu Placebo führte die Behandlung mit PROSCAR 5 mg, Doxazosin oder einer Kombinationstherapie zu einer Verringerung des Risikos, eines dieser fünf Outcome-Ereignisse zu erleiden, um 34 % (p = 0,002), 39 % (p
Die Mehrheit der Ereignisse (274 von 351; 78 %) war ein bestätigter Anstieg des Symptom-Scores um ≥ 4 Punkte, der als Symptom-Score-Progression bezeichnet wird. Das Risiko einer Symptom-Score-Progression wurde um 30 % (p = 0,016), 46 % (p
Abbildung 5 Kumulative Inzidenz eines 4-Punkte-Anstiegs des AUA-Symptom-Scores nach Behandlungsgruppe
Die Behandlung mit PROSCAR 5 mg, Doxazosin oder der Kombination von PROSCAR mit Doxazosin reduzierte den mittleren Symptomscore gegenüber dem Ausgangswert in Jahr 4. Tabelle 7 zeigt die mittlere Veränderung des AUA-Symptomscores gegenüber dem Ausgangswert nach Behandlungsgruppe für Patienten, die die Therapie vier Jahre lang fortsetzten.
Die Ergebnisse von MTOPS stimmen mit den Ergebnissen der 4-jährigen placebokontrollierten Studie PLESS überein [siehe Monotherapie ], da die Behandlung mit PROSCAR das Risiko eines akuten Harnverhalts und die Notwendigkeit einer BPH-bedingten Operation reduziert. Bei MTOPS war das Risiko, einen akuten Harnverhalt zu entwickeln, bei mit PROSCAR behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten um 67 % reduziert (0,8 % für PROSCAR und 2,4 % für Placebo). Auch das Risiko, eine BPH-bedingte invasive Therapie zu benötigen, wurde bei mit PROSCAR behandelten Patienten im Vergleich zu mit Placebo behandelten Patienten um 64 % reduziert (2,0 % für PROSCAR 5 mg und 5,4 % für Placebo).
Zusammenfassung der klinischen Studien
Die Daten aus diesen Studien, die eine Verbesserung der BPH-bedingten Symptome, eine Verringerung des Behandlungsversagens (BPH-bedingte urologische Ereignisse), erhöhte maximale Harnflussraten und eine Verringerung des Prostatavolumens zeigen, deuten darauf hin, dass PROSCAR den Krankheitsprozess von BPH bei Männern mit anhält vergrößerte Prostata.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN UND VORSICHTSMASSNAHMEN Sektion.