Dostinex 0.25mg, 0.5mg Cabergoline Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Dostinex 0,25 mg und wie wird es angewendet?
Dostinex (Cabergolin) ist ein Dopaminrezeptorantagonist, der zur Behandlung eines Hormonungleichgewichts angewendet wird, bei dem zu viel Prolaktin im Blut vorhanden ist (auch als Hyperprolaktinämie bezeichnet).
Was sind Nebenwirkungen von Dostinex?
Häufige Nebenwirkungen von Dostinex 0,25 mg sind:
Informieren Sie Ihren Arzt, wenn bei Ihnen seltene, aber schwerwiegende Nebenwirkungen von Dostinex auftreten, einschließlich:
BEZEICHNUNG
DOSTINEX Tabletten enthalten Cabergolin, einen Dopaminrezeptoragonisten. Der chemische Name für Cabergolin ist 1-[(6-Allylergolin-8β-yl)-carbonyl]-1-[3-(dimethylamino)propyl]-3-ethylharnstoff. Seine empirische Formel ist C26H37N5O2 und sein Molekulargewicht ist 451,62. Die Strukturformel lautet wie folgt:
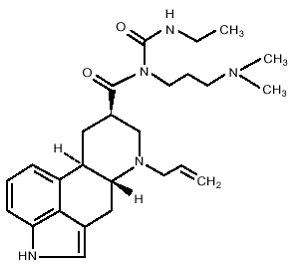
Cabergolin ist ein weißes Pulver, das in Ethylalkohol, Chloroform und N, N-Dimethylformamid (DMF) löslich ist; leicht löslich in 0,1 N Salzsäure; sehr wenig löslich in n-Hexan; und wasserunlöslich.
DOSTINEX 0,25 mg Tabletten zur oralen Verabreichung enthalten 0,5 mg Cabergolin. Inaktive Inhaltsstoffe bestehen aus Leucin, USP, und Laktose, NF.
INDIKATIONEN
DOSTINEX 0,5 mg Tabletten sind angezeigt zur Behandlung von hyperprolaktinämischen Störungen, entweder idiopathisch oder aufgrund von Hypophysenadenomen.
DOSIERUNG UND ANWENDUNG
Die empfohlene Dosierung von DOSTINEX 0,25 mg Tabletten zu Beginn der Therapie beträgt 0,25 mg zweimal wöchentlich. Die Dosierung kann entsprechend dem Serumprolaktinspiegel des Patienten um 0,25 mg zweimal wöchentlich bis zu einer Dosierung von 1 mg zweimal wöchentlich erhöht werden. Vor Beginn der Behandlung sollte eine kardiovaskuläre Untersuchung durchgeführt und eine Echokardiographie zur Beurteilung einer Herzklappenerkrankung in Betracht gezogen werden.
Dosiserhöhungen sollten nicht schneller als alle 4 Wochen erfolgen, damit der Arzt die Reaktion des Patienten auf jede Dosisstufe beurteilen kann. Wenn der Patient nicht ausreichend anspricht und bei höheren Dosen kein zusätzlicher Nutzen zu beobachten ist, sollte die niedrigste Dosis verwendet werden, die eine maximale Reaktion erzielt hat, und andere therapeutische Ansätze in Betracht gezogen werden. Patienten, die eine Langzeitbehandlung mit DOSTINEX 0,25 mg erhalten, sollten sich einer regelmäßigen Überprüfung ihres Herzstatus unterziehen und eine Echokardiographie in Betracht ziehen.
Nachdem über 6 Monate ein normaler Serum-Prolaktinspiegel aufrechterhalten wurde, kann DOSTINEX 0,5 mg abgesetzt werden, wobei der Serum-Prolaktinspiegel regelmäßig überwacht wird, um festzustellen, ob oder wann die Behandlung mit DOSTINEX wieder aufgenommen werden sollte. Die Dauerhaftigkeit der Wirksamkeit über 24 Monate Therapie mit DOSTINEX hinaus wurde nicht nachgewiesen.
WIE GELIEFERT
DOSTINEX Tabletten sind weiße, kapselförmige Tabletten mit Bruchrille, die 0,5 mg Cabergolin enthalten. Jede Tablette ist auf einer Seite eingekerbt und trägt den Buchstaben P und den Buchstaben U auf beiden Seiten der Bruchkerbe. Auf der anderen Seite der Tafel ist die Zahl 700 eingraviert.
DOSTINEX ist wie folgt erhältlich:
Flaschen mit 8 Tabletten NDC 0013-7001-12
Lagerung
Bei kontrollierter Raumtemperatur von 20 bis 25 °C (68 bis 77 °F) lagern [siehe USP ].
Das Etikett dieses Produkts wurde möglicherweise aktualisiert. Für aktuelle vollständige Verschreibungsinformationen besuchen Sie bitte www.pfizer.com
Vertrieb durch: Pharmacia & Upjohn Company Division of Pfizer Inc., NY, NY 10017. Überarbeitet: September 2014
NEBENWIRKUNGEN
Die Sicherheit von DOSTINEX 0,25 mg Tabletten wurde bei mehr als 900 Patienten mit hyperprolaktinämischen Erkrankungen untersucht. Die meisten Nebenwirkungen waren leicht oder mittelschwer.
In einer 4-wöchigen, doppelblinden, placebokontrollierten Studie bestand die Behandlung aus Placebo oder Cabergolin in festen Dosen von 0,125, 0,5, 0,75 oder 1,0 mg zweimal wöchentlich. Die Dosis wurde in der ersten Woche halbiert. Da nur bei Übelkeit eine mögliche dosisabhängige Wirkung beobachtet wurde, wurden die vier Cabergolin-Behandlungsgruppen kombiniert. Die Inzidenz der häufigsten unerwünschten Ereignisse während der placebokontrollierten Studie ist in der folgenden Tabelle dargestellt.
Auftreten von gemeldeten Nebenwirkungen während der 4-wöchigen, doppelblinden, Placebo-kontrollierten Studie
In der 8-wöchigen, doppelblinden Phase der Vergleichsstudie mit Bromocriptin wurde DOSTINEX (in einer Dosis von 0,5 mg zweimal wöchentlich) wegen eines unerwünschten Ereignisses bei 4 von 221 Patienten (2 %) abgesetzt, während Bromocriptin (in einer Dosis von 0,5 mg zweimal wöchentlich) abgesetzt wurde von 2,5 mg zweimal täglich) wurde bei 14 von 231 Patienten (6 %) abgesetzt. Die häufigsten Gründe für das Absetzen von DOSTINEX waren Kopfschmerzen, Übelkeit und Erbrechen (jeweils 3, 2 und 2 Patienten); die häufigsten Gründe für das Absetzen von Bromocriptin waren Übelkeit, Erbrechen, Kopfschmerzen und Schwindel oder Schwindel (jeweils 10, 3, 3 und 3 Patienten). Die Inzidenz der häufigsten unerwünschten Ereignisse während des doppelblinden Teils der Vergleichsstudie mit Bromocriptin ist in der folgenden Tabelle dargestellt.
Häufigkeit gemeldeter unerwünschter Ereignisse während der 8-wöchigen, doppelblinden Phase der Vergleichsstudie mit Bromocriptin
Es folgen weitere unerwünschte Ereignisse, die in den gesamten klinischen Studien mit einer Inzidenz von
Körper als Ganzes: Gesichtsödem, grippeähnliche Symptome, Unwohlsein
Herz-Kreislauf-System: Hypotonie, Synkope, Herzklopfen
Verdauungstrakt: Mundtrockenheit, Blähungen, Durchfall, Anorexie
Stoffwechsel- und Ernährungssystem: Gewichtsverlust, Gewichtszunahme
Nervöses System: Schläfrigkeit, Nervosität, Parästhesien, Schlaflosigkeit, Angstzustände
Atmungssystem: verstopfte Nase, Epistaxis
Haut und Anhängsel: Akne, Juckreiz
Besondere Sinne: abnormales Sehen
Urogenitalsystem: Dysmenorrhoe, gesteigerte Libido
Die Sicherheit von Cabergolin wurde bei etwa 1.200 Patienten mit Parkinson-Krankheit in kontrollierten und unkontrollierten Studien mit Dosierungen von bis zu 11,5 mg/Tag untersucht, was die empfohlene Höchstdosis von Cabergolin für hyperprolaktinämische Erkrankungen bei weitem übersteigt. Zusätzlich zu den Nebenwirkungen, die bei Patienten mit hyperprolaktinämischen Störungen auftraten, waren die häufigsten Nebenwirkungen bei Patienten mit Morbus Parkinson Dyskinesie, Halluzinationen, Verwirrtheit und periphere Ödeme. Herzinsuffizienz, Pleuraerguss, Lungenfibrose und Magen- oder Zwölffingerdarmgeschwür traten selten auf. Ein Fall von konstriktiver Perikarditis wurde berichtet.
Postmarketing-Überwachungsdaten
Die folgenden Ereignisse wurden im Zusammenhang mit DOSTINEX berichtet: Herzklappenerkrankung und extrakardiale fibrotische Reaktionen (vgl WARNUNGEN , Herzvalvulopathie und extrakardiale fibrotische Reaktionen ).
Andere Ereignisse wurden im Zusammenhang mit Cabergoline berichtet: Hypersexualität, gesteigerte Libido und pathologisches Spielen (siehe VORSICHTSMASSNAHMEN , Psychiatrisch ). Darüber hinaus wurden bei Patienten, die DOSTINEX einnahmen, Fälle von Alopezie, Aggression und psychotischen Störungen berichtet. Einige dieser Berichte betrafen Patienten, bei denen zuvor Nebenwirkungen auf Dopamin-Agonisten-Produkte auftraten.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
DOSTINEX 0,5 mg sollte nicht gleichzeitig mit D-Antagonisten wie Phenothiazinen, Butyrophenonen, Thioxanthenen oder Metoclopramid verabreicht werden.
WARNUNGEN
Schwangerschaft
Dopaminagonisten sollten im Allgemeinen nicht bei Patientinnen mit schwangerschaftsinduziertem Bluthochdruck, z. B. Präeklampsie, Eklampsie und postpartalem Bluthochdruck, angewendet werden, es sei denn, der potenzielle Nutzen überwiegt das mögliche Risiko.
Fibrotische Komplikationen
Herzvalvulopathie
Alle Patienten sollten sich einer kardiovaskulären Untersuchung, einschließlich Echokardiogramm, unterziehen, um das mögliche Vorliegen einer Herzklappenerkrankung zu beurteilen. Wenn eine Herzklappenerkrankung festgestellt wird, sollte der Patient nicht mit DOSTINEX behandelt werden. (Sehen KONTRAINDIKATIONEN ) Postmarketing-Fälle von Herzklappenerkrankungen wurden bei Patienten berichtet, die DOSTINEX erhielten. Diese Fälle traten im Allgemeinen während der Verabreichung hoher Dosen von DOSTINEX (> 2 mg/Tag) zur Behandlung der Parkinson-Krankheit auf. Fälle von Herzklappenerkrankungen wurden auch bei Patienten berichtet, die niedrigere Dosen von DOSTINEX zur Behandlung von hyperprolaktinämischen Erkrankungen erhielten.
Es wurde eine länderübergreifende, retrospektive Kohortenstudie unter Verwendung allgemeinmedizinischer Aufzeichnungen und Aufzeichnungsverknüpfungssysteme im Vereinigten Königreich, Italien und den Niederlanden durchgeführt, um den Zusammenhang zwischen der neuen Anwendung von Dopaminagonisten, einschließlich Cabergolin (n = 27.812), bei der Parkinson-Krankheit und Hyperprolaktinämie und Herzerkrankungen zu bewerten Herzklappeninsuffizienz (CVR), andere Fibrosen und andere kardiopulmonale Ereignisse über maximal 12 Jahre Nachbeobachtung. In dieser Studie war die Anwendung von Cabergolin bei Personen mit Parkinson-Krankheit mit einem erhöhten CVR-Risiko im Vergleich zu nicht aus dem Mutterkorn stammenden Dopaminagonisten (DAs) und Levodopa verbunden [Inzidenzrate (IR) pro 10.000 Personenjahre von 68,1 (95 % Konfidenzintervall (KI): 37,2–115,3) für Cabergoline vs. 10,0 (95 % KI: 5,2–19,4) für DAs ohne Mutterkorn und 11,3 (95 % KI: 7,2–17,0) für Levodopa]. In der Studienanalyse, die auf Personen mit mit Dopaminagonisten behandelter Hyperprolaktinämie (n = 8.386) beschränkt war, hatten Personen, die Cabergolin ausgesetzt waren, im Vergleich zur Nichtanwendung (n = 15.147) kein erhöhtes CVR-Risiko. Die Ergebnisse in Bezug auf das CVR-Risiko im Zusammenhang mit der Cabergolin-Behandlung bei Personen mit Parkinson-Krankheit (erhöhtes Risiko) und Personen mit Hyperprolaktinämie (kein erhöhtes Risiko) stimmen mit den Ergebnissen in anderen veröffentlichten Studien überein.
Ärzte sollten die niedrigste wirksame Dosis von DOSTINEX zur Behandlung von hyperprolaktinämischen Störungen anwenden und die Notwendigkeit einer Fortsetzung der Therapie mit DOSTINEX regelmäßig neu bewerten. Nach Beginn der Behandlung sollte eine klinische und diagnostische Überwachung (z. B. Thoraxröntgen, CT-Scan und Herzechokardiogramm) durchgeführt werden, um das Risiko einer Herzklappenerkrankung einzuschätzen. Die empfohlene Häufigkeit der routinemäßigen echokardiographischen Überwachung ist alle 6 bis 12 Monate oder wie klinisch indiziert bei Vorliegen von Anzeichen und Symptomen wie Ödemen, neuem Herzgeräusch, Dyspnoe oder dekompensierter Herzinsuffizienz.
DOSTINEX sollte abgesetzt werden, wenn ein Echokardiogramm eine neue Klappeninsuffizienz, eine Klappenrestriktion oder eine Verdickung der Klappensegel zeigt.
DOSTINEX sollte bei Patienten, die anderen Arzneimitteln im Zusammenhang mit Valvulopathie ausgesetzt waren, mit Vorsicht angewendet werden.

Extrakardiale fibrotische Reaktionen
Postmarketing-Fälle von pleuraler, perikardialer und retroperitonealer Fibrose wurden nach Verabreichung von DOSTINEX berichtet. Einige Berichte betrafen Patienten, die zuvor mit anderen ergotinischen Dopaminagonisten behandelt wurden. DOSTINEX sollte nicht bei Patienten mit kardialen oder extrakardialen fibrotischen Erkrankungen in der Vorgeschichte angewendet werden.
Fibrotische Erkrankungen können einen schleichenden Beginn haben und Patienten sollten auf Manifestationen einer fortschreitenden Fibrose überwacht werden. Daher sollte während der Behandlung auf folgende Anzeichen und Symptome geachtet werden:
Klinische und diagnostische Überwachung wie Erythrozytensedimentationsrate, Röntgenaufnahme des Brustkorbs, Serumkreatininmessungen und andere Untersuchungen sollten zu Studienbeginn und bei Bedarf während der Behandlung der Patienten mit DOSTINEX in Betracht gezogen werden.
Nach der Diagnose eines Pleuraergusses oder einer Lungenfibrose wurde berichtet, dass das Absetzen von DOSTINEX zu einer Besserung der Anzeichen und Symptome führte.
VORSICHTSMASSNAHMEN
Allgemein
Anfangsdosen von mehr als 1,0 mg können eine orthostatische Hypotonie hervorrufen. Bei der Verabreichung von DOSTINEX zusammen mit anderen Arzneimitteln, von denen bekannt ist, dass sie den Blutdruck senken, ist Vorsicht geboten.
Hemmung oder Unterdrückung der postpartalen Laktation
DOSTINEX 0,25 mg ist nicht zur Hemmung oder Unterdrückung der physiologischen Laktation indiziert. Die Anwendung von Bromocriptin, einem anderen Dopaminagonisten für diesen Zweck, wurde mit Fällen von Bluthochdruck, Schlaganfällen und Krampfanfällen in Verbindung gebracht.
Leberfunktionsstörung
Da Cabergolin extensiv von der Leber metabolisiert wird, sollte bei der Verabreichung von DOSTINEX 0,5 mg an Patienten mit eingeschränkter Leberfunktion Vorsicht geboten sein und eine sorgfältige Überwachung erfolgen.
Psychiatrisch
Spielsucht, gesteigerte Libido und Hypersexualität wurden bei Patienten berichtet, die mit Dopaminagonisten einschließlich Cabergolin behandelt wurden. Dies war im Allgemeinen nach Reduzierung der Dosis oder Absetzen der Behandlung reversibel (siehe Postmarketing-Überwachungsdaten ).
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenitätsstudien wurden an Mäusen und Ratten mit Cabergolin durchgeführt, das per Schlundsonde in Dosen von bis zu 0,98 mg/kg/Tag bzw. 0,32 mg/kg/Tag verabreicht wurde. Diese Dosen sind das 7-fache und das 4-fache der maximal empfohlenen Dosis beim Menschen, berechnet auf Basis der Körperoberfläche unter Verwendung der Gesamtmenge an mg/m2/Woche bei Nagetieren und mg/m/Woche bei einem 50 kg schweren Menschen.
Es gab einen leichten Anstieg der Inzidenz von zervikalen und uterinen Leiomyomen und uterinen Leiomyosarkomen bei Mäusen. Bei Ratten kam es zu einem leichten Anstieg bösartiger Tumoren des Gebärmutterhalses und des Uterus sowie Adenomen interstitieller Zellen. Das Auftreten von Tumoren bei weiblichen Nagern kann mit der anhaltenden Unterdrückung der Prolaktinsekretion zusammenhängen, da Prolaktin bei Nagern für die Aufrechterhaltung des Corpus luteum benötigt wird. In Abwesenheit von Prolaktin ist das Östrogen/Progesteron-Verhältnis erhöht, wodurch das Risiko für Gebärmuttertumoren steigt. Bei männlichen Nagetieren war die Abnahme des Prolaktinspiegels im Serum mit einem Anstieg des luteinisierenden Hormons im Serum verbunden, von dem angenommen wird, dass es sich um einen kompensatorischen Effekt zur Aufrechterhaltung der testikulären Steroidsynthese handelt. Da angenommen wird, dass diese hormonellen Mechanismen artspezifisch sind, ist die Relevanz dieser Tumoren für den Menschen nicht bekannt.
Das mutagene Potenzial von Cabergolin wurde in einer Reihe von In-vitro-Tests bewertet und für negativ befunden. Diese Tests umfassten den bakteriellen Mutationstest (Ames) mit Salmonella typhimurium, den Genmutationstest mit Zellen des chinesischen Hamsters Schizosaccharomyces pombe P1 und V79, DNA-Schäden und -Reparatur in Saccharomyces cerevisiae D4 und Chromosomenaberrationen in menschlichen Lymphozyten. Cabergolin war auch im Knochenmark-Mikronukleus-Test bei der Maus negativ.
Bei weiblichen Ratten hemmte eine tägliche Dosis von 0,003 mg/kg für 2 Wochen vor der Paarung und während der gesamten Paarungszeit die Empfängnis. Diese Dosis entspricht etwa 1/28 der empfohlenen Höchstdosis für den Menschen, berechnet auf Basis der Körperoberfläche unter Verwendung der Gesamtmenge an mg/m2/Woche bei Ratten und mg/m/Woche bei einem 50 kg schweren Menschen.
Schwangerschaft
Teratogene Wirkungen - Kategorie B
Es wurden Reproduktionsstudien mit Cabergolin an Mäusen, Ratten und Kaninchen durchgeführt, die per Schlundsonde verabreicht wurden. (Vielfache der empfohlenen Höchstdosis für den Menschen in diesem Abschnitt werden auf Basis der Körperoberfläche berechnet, wobei die Gesamtmenge an mg/m2/Woche für Tiere und mg/m/Woche für einen 50 kg schweren Menschen verwendet wird.)
Es gab maternotoxische Wirkungen, aber keine teratogenen Wirkungen bei Mäusen, denen Cabergolin in Dosen von bis zu 8 mg/kg/Tag (ungefähr das 55-fache der maximal empfohlenen Humandosis) während der Organogenesezeit verabreicht wurde.
Eine Dosis von 0,012 mg/kg/Tag (ungefähr 1/7 der maximal empfohlenen Humandosis) während der Organogenese bei Ratten verursachte einen Anstieg der embryofetalen Verluste nach der Implantation. Diese Verluste könnten auf die prolaktinhemmenden Eigenschaften von Cabergolin bei Ratten zurückzuführen sein. Bei Tagesdosen von 0,5 mg/kg/Tag (ungefähr das 19-fache der beim Menschen empfohlenen Höchstdosis) verursachte Cabergolin während der Zeit der Organogenese beim Kaninchen eine maternotoxische Wirkung, die durch einen Verlust an Körpergewicht und eine verminderte Nahrungsaufnahme gekennzeichnet war. Dosen von 4 mg/kg/Tag (ungefähr das 150-fache der maximal empfohlenen Humandosis) während der Zeit der Organogenese beim Kaninchen verursachten ein vermehrtes Auftreten verschiedener Missbildungen. In einer anderen Studie an Kaninchen wurden jedoch bei Dosen bis zu 8 mg/kg/Tag (ungefähr das 300-Fache der maximal empfohlenen Dosis beim Menschen) keine behandlungsbedingten Missbildungen oder Embryofetotoxizität beobachtet.
Bei Ratten hemmten Dosen von mehr als 0,003 mg/kg/Tag (etwa 1/28 der beim Menschen empfohlenen Höchstdosis) ab 6 Tagen vor der Geburt und während der gesamten Laktationsperiode das Wachstum und verursachten den Tod der Nachkommenschaft aufgrund einer verminderten Milchsekretion.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden und aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von Cabergolin beim gestillten Säugling, sollte eine Entscheidung getroffen werden, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist. Die Anwendung von DOSTINEX zur Hemmung oder Unterdrückung der physiologischen Laktation wird nicht empfohlen (siehe VORSICHTSMASSNAHMEN Sektion).
Die prolaktinsenkende Wirkung von Cabergolin deutet darauf hin, dass es die Laktation stört. Aufgrund dieser Störung der Laktation sollte DOSTINEX 0,5 mg Frauen nach der Geburt, die stillen oder stillen möchten, nicht verabreicht werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von DOSTINEX 0,5 mg bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit DOSTINEX 0,5 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Bei einer Überdosierung ist mit verstopfter Nase, Synkopen oder Halluzinationen zu rechnen. Gegebenenfalls sollten blutdruckunterstützende Maßnahmen ergriffen werden.
KONTRAINDIKATIONEN
DOSTINEX Tabletten sind kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Die Sekretion von Prolactin durch den Hypophysenvorderlappen steht hauptsächlich unter hypothalamischer inhibitorischer Kontrolle, die wahrscheinlich durch die Freisetzung von Dopamin durch tuberoinfundibuläre Neuronen ausgeübt wird. Cabergolin ist ein langwirksamer Dopaminrezeptoragonist mit einer hohen Affinität zu D2-Rezeptoren. Ergebnisse von In-vitro-Studien zeigen, dass Cabergolin eine direkte hemmende Wirkung auf die Sekretion von Prolaktin durch Ratten-Hypophysen-Lactotrophe ausübt. Cabergolin senkte die Prolaktinspiegel im Serum bei reserpinisierten Ratten. Rezeptorbindungsstudien weisen darauf hin, dass Cabergolin eine geringe Affinität zu Dopamin-D1-, α1- und α2-adrenergen und 5-HT1- und 5-HT2-Serotoninrezeptoren aufweist.
Klinische Studien
Die prolaktinsenkende Wirksamkeit von DOSTINEX 0,25 mg wurde bei Frauen mit Hyperprolaktinämie in zwei randomisierten, doppelblinden Vergleichsstudien nachgewiesen, eine mit Placebo und die andere mit Bromocriptin. In der placebokontrollierten Studie (Placebo n = 20; Cabergolin n = 168) führte DOSTINEX 0,5 mg zu einer dosisabhängigen Abnahme der Prolaktinspiegel im Serum, wobei sich das Prolaktin nach 4-wöchiger Behandlung bei 29 %, 76 %, 74 % und 95 % normalisierte % der Patienten, die 0,125, 0,5, 0,75 bzw. 1,0 mg zweimal wöchentlich erhielten.
In der 8-wöchigen, doppelblinden Phase der Vergleichsstudie mit Bromocriptin (Cabergolin n = 223; Bromocriptin n = 236 in der Intent-to-treat-Analyse) normalisierte sich das Prolaktin bei 77 % der mit DOSTINEX bei 0,5 mg behandelten Patienten zweimal wöchentlich im Vergleich zu 59 % der Patienten, die zweimal täglich 2,5 mg Bromocriptin erhielten. Bei 77 % der mit DOSTINEX behandelten Frauen kam es zu einer Wiederherstellung der Menstruation, verglichen mit 70 % der mit Bromocriptin behandelten Frauen. Bei Patienten mit Galaktorrhoe verschwand dieses Symptom bei 73 % der mit DOSTINEX behandelten Patienten, verglichen mit 56 % der mit Bromocriptin behandelten Patienten.
Pharmakokinetik
Absorption
Nach einmaliger oraler Gabe von 0,5 mg bis 1,5 mg an 12 gesunde erwachsene Freiwillige wurden innerhalb von 2 bis 3 Stunden mittlere Spitzenplasmaspiegel von 30 bis 70 Picogramm (pg)/ml Cabergolin beobachtet. Über den Dosisbereich von 0,5 bis 7 mg schienen die Cabergolin-Plasmaspiegel bei 12 gesunden erwachsenen Probanden und neun erwachsenen Parkinson-Patienten dosisproportional zu sein. Eine Studie mit wiederholter Gabe an 12 gesunden Freiwilligen deutet darauf hin, dass Steady-State-Spiegel nach einem einmal wöchentlichen Dosierungsplan voraussichtlich zwei- bis dreifach höher sind als nach einer Einzeldosis. Die absolute Bioverfügbarkeit von Cabergolin ist nicht bekannt. Ein erheblicher Teil der verabreichten Dosis unterliegt einem First-Pass-Effekt. Die anhand von Urindaten von 12 gesunden Probanden geschätzte Eliminationshalbwertszeit von Cabergolin lag zwischen 63 und 69 Stunden. Die anhaltende prolaktinsenkende Wirkung von Cabergolin kann mit seiner langsamen Elimination und langen Halbwertszeit zusammenhängen.
Verteilung
Bei Tieren hat Cabergolin (und/oder seine Metaboliten) basierend auf der Gesamtradioaktivität eine ausgedehnte Gewebeverteilung gezeigt. Die Radioaktivität in der Hypophyse überstieg die im Plasma um das > 100-fache und wurde mit einer Halbwertszeit von etwa 60 Stunden eliminiert. Dieser Befund steht im Einklang mit der lang anhaltenden prolaktinsenkenden Wirkung des Medikaments. Ganzkörper-Autoradiographiestudien an trächtigen Ratten zeigten keine fötale Aufnahme, aber hohe Konzentrationen in der Uteruswand. Eine signifikante Radioaktivität (Mutter plus Metabolite), die in der Milch säugender Ratten nachgewiesen wurde, deutet auf eine potenzielle Exposition von gestillten Säuglingen hin. Das Medikament wird weitgehend im ganzen Körper verteilt. Cabergolin wird konzentrationsunabhängig mäßig (40 % bis 42 %) an menschliche Plasmaproteine gebunden. Es ist unwahrscheinlich, dass die gleichzeitige Gabe von Arzneimitteln mit hoher Proteinbindung die Disposition beeinflusst.
Stoffwechsel
Sowohl bei Tieren als auch bei Menschen wird Cabergolin extensiv metabolisiert, hauptsächlich über die Hydrolyse der Acylharnstoffbindung oder der Harnstoffeinheit. Der durch Cytochrom P-450 vermittelte Metabolismus scheint minimal zu sein. Cabergolin verursacht bei der Ratte keine Enzyminduktion und/oder -hemmung. Die Hydrolyse der Acylharnstoff- oder Harnstoffeinheit hebt die prolaktinsenkende Wirkung von Cabergolin auf, und die bisher identifizierten Hauptmetaboliten tragen nicht zur therapeutischen Wirkung bei.
Ausscheidung
Nach oraler Gabe von radioaktivem Cabergolin an fünf gesunde Probanden wurden etwa 22 % bzw. 60 % der Dosis innerhalb von 20 Tagen mit dem Urin bzw. den Fäzes ausgeschieden. Weniger als 4 % der Dosis wurden unverändert im Urin ausgeschieden. Die nichtrenale und renale Clearance für Cabergolin beträgt etwa 3,2 l/min bzw. 0,08 l/min. Die Urinausscheidung bei Patienten mit Hyperprolaktinämie war ähnlich.
Besondere Populationen
Niereninsuffizienz
Die Pharmakokinetik von Cabergolin war bei 12 Patienten mit mittelschwerer bis schwerer Niereninsuffizienz nicht verändert, wie anhand der Kreatinin-Clearance festgestellt wurde.
Leberinsuffizienz
Bei 12 Patienten mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Score ≤ 10) wurde keine Wirkung auf die mittlere Cmax von Cabergolin oder die Fläche unter der Plasmakonzentrationskurve (AUC) beobachtet. Patienten mit schwerer Insuffizienz (Child-Pugh-Score > 10) zeigen jedoch einen erheblichen Anstieg der mittleren Cmax und AUC von Cabergolin und erfordern daher Vorsicht.
Alten
Die Auswirkung des Alters auf die Pharmakokinetik von Cabergolin wurde nicht untersucht.
Wechselwirkungen zwischen Lebensmitteln und Arzneimitteln
Bei 12 gesunden erwachsenen Probanden veränderte die Nahrung die Cabergoline-Kinetik nicht.
Pharmakodynamik
Die Dosisreaktion mit Hemmung des Plasmaprolaktins, Einsetzen der maximalen Wirkung und Wirkungsdauer wurde nach Einzeldosen von Cabergolin an gesunde Probanden (0,05 bis 1,5 mg) und hyperprolaktinämische Patienten (0,3 bis 1 mg) dokumentiert. Bei Freiwilligen war die Prolaktinhemmung bei Dosen > 0,2 mg offensichtlich, während Dosen ≥ 0,5 mg bei den meisten Probanden eine maximale Unterdrückung bewirkten. Höhere Dosen führen bei einem größeren Anteil der Probanden zu einer Prolaktinsuppression und mit einem früheren Wirkungseintritt und einer längeren Wirkungsdauer. Bei 12 gesunden Probanden führten 0,5-, 1- und 1,5-mg-Dosen zu einer vollständigen Prolaktinhemmung mit einer maximalen Wirkung innerhalb von 3 Stunden bei 92 % bis 100 % der Probanden nach den 1- und 1,5-mg-Dosen, verglichen mit 50 % der Probanden nach der 0,5-mg-Dosierung mg-Dosis.
Bei hyperprolaktinämischen Patienten (N = 51) war die maximale Prolaktinsenkung nach einer Einzeldosis von 0,6 mg Cabergolin vergleichbar mit 2,5 mg Bromocriptin; die Wirkungsdauer war jedoch deutlich länger (14 Tage vs. 24 Stunden). Die Zeit bis zur maximalen Wirkung war bei Bromocriptin kürzer als bei Cabergolin (6 Stunden vs. 48 Stunden).
Bei 72 gesunden Freiwilligen führten Einzel- oder Mehrfachdosen (bis zu 2 mg) von Cabergolin zu einer selektiven Hemmung von Prolaktin ohne erkennbare Wirkung auf andere Hypophysenvorderlappenhormone (GH, FSH, LH, ACTH und TSH) oder Cortisol.
INFORMATIONEN ZUM PATIENTEN
Patientinnen sollten angewiesen werden, ihren Arzt zu benachrichtigen, wenn sie vermuten, schwanger zu sein, schwanger zu werden oder beabsichtigen, während der Therapie schwanger zu werden. Bei Verdacht auf eine Schwangerschaft sollte ein Schwangerschaftstest durchgeführt und die Fortsetzung der Behandlung mit dem Arzt besprochen werden.
Patienten sollten ihren Arzt benachrichtigen, wenn sie Kurzatmigkeit, anhaltenden Husten, Atembeschwerden im Liegen oder Schwellungen in den Extremitäten entwickeln.