Lasix 40mg, 100mg Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lasix und wie wird es angewendet?
Lasix ist ein verschreibungspflichtiges Medikament zur Behandlung der Symptome von Flüssigkeitsretention (Ödem) bei Personen mit kongestiver Herzinsuffizienz, Lebererkrankungen oder Nierenerkrankungen. Lasix kann allein oder mit anderen Medikamenten verwendet werden.
Lasix gehört zu einer Klasse von Medikamenten namens Diuretika, Loop.
Es ist nicht bekannt, ob Lasix 40 mg sicher und wirksam bei Kindern unter 1 Jahr ist, wenn es zur Behandlung von resistentem Bluthochdruck verwendet wird.
Was sind die möglichen Nebenwirkungen von Lasix 40mg?
Lasix 40 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Lasix 40 mg sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Lasix. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
LASIX® (Furosemid) ist ein starkes Diuretikum, das bei übermäßiger Gabe zu einer starken Diurese mit Wasser- und Elektrolytmangel führen kann. Daher ist eine sorgfältige ärztliche Überwachung erforderlich und die Dosis und das Dosierungsschema müssen an die individuellen Bedürfnisse des Patienten angepasst werden. (Siehe DOSIERUNG UND VERABREICHUNG.)
BEZEICHNUNG
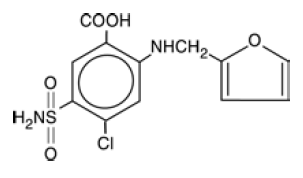
LASIX® ist ein Diuretikum, das ein Anthranilsäurederivat ist. LASIX 100 mg Tabletten zur oralen Verabreichung enthalten Furosemid als Wirkstoff und die folgenden Hilfsstoffe: Lactose-Monohydrat NF, Magnesiumstearat NF, Stärke NF, Talkum USP und kolloidales Siliciumdioxid NF. Chemisch handelt es sich um 4-Chlor-N-furfuryl-5-sulfamoylanthranilsäure. LASIX ist als weiße Tabletten zur oralen Verabreichung in den Dosierungsstärken 20, 40 und 80 mg erhältlich. Furosemid ist ein weißes bis cremefarbenes, geruchloses, kristallines Pulver. Es ist praktisch unlöslich in Wasser, schwer löslich in Alkohol, gut löslich in verdünnten Alkalilösungen und unlöslich in verdünnten Säuren.
Die CAS-Registrierungsnummer lautet 54-31-9.
Die Strukturformel lautet wie folgt:
INDIKATIONEN
Ödem
LASIX ist indiziert bei Erwachsenen und pädiatrischen Patienten zur Behandlung von Ödemen im Zusammenhang mit dekompensierter Herzinsuffizienz, Leberzirrhose und Nierenerkrankungen, einschließlich des nephrotischen Syndroms. LASIX 100 mg ist besonders nützlich, wenn ein Mittel mit größerem diuretischem Potenzial gewünscht wird.
Hypertonie
Orales LASIX 40 mg kann bei Erwachsenen zur Behandlung von Bluthochdruck allein oder in Kombination mit anderen blutdrucksenkenden Mitteln angewendet werden. Bluthochdruckpatienten, die mit Thiaziden nicht ausreichend kontrolliert werden können, werden wahrscheinlich auch mit LASIX allein nicht ausreichend kontrolliert werden.
DOSIERUNG UND ANWENDUNG
Ödem
Die Therapie sollte entsprechend dem Ansprechen des Patienten individualisiert werden, um ein maximales therapeutisches Ansprechen zu erzielen und um die minimale Dosis zu bestimmen, die erforderlich ist, um dieses Ansprechen aufrechtzuerhalten.
Erwachsene
Die übliche Anfangsdosis von LASIX beträgt 20 bis 80 mg als Einzeldosis. Normalerweise folgt eine prompte Diurese. Bei Bedarf kann die gleiche Dosis 6 bis 8 Stunden später verabreicht oder die Dosis erhöht werden. Die Dosis kann um 20 oder 40 mg erhöht und frühestens 6 bis 8 Stunden nach der vorherigen Dosis verabreicht werden, bis die gewünschte diuretische Wirkung erreicht ist. Die individuell festgelegte Einzeldosis sollte dann ein- bis zweimal täglich (z. B. um 8 Uhr und 14 Uhr) verabreicht werden. Die Dosis von LASIX 100 mg kann bei Patienten mit klinisch schweren ödematösen Zuständen vorsichtig auf bis zu 600 mg/Tag titriert werden.
Ödeme können am effizientesten und sichersten mobilisiert werden, indem LASIX 100 mg an 2 bis 4 aufeinanderfolgenden Tagen pro Woche verabreicht wird.
Wenn Dosierungen von mehr als 80 mg/Tag über einen längeren Zeitraum verabreicht werden, ist eine sorgfältige klinische Beobachtung und Laborüberwachung besonders ratsam. (Sehen VORSICHTSMASSNAHMEN : Labortests .)
Geriatrische Patienten
Im Allgemeinen sollte die Dosisauswahl für ältere Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen (siehe VORSICHTSMASSNAHMEN : Geriatrische Verwendung ).
Pädiatrische Patienten
Die übliche Anfangsdosis von oralem LASIX 40 mg bei pädiatrischen Patienten beträgt 2 mg/kg Körpergewicht als Einzeldosis. Wenn die diuretische Reaktion nach der Anfangsdosis nicht zufriedenstellend ist, kann die Dosis frühestens 6 bis 8 Stunden nach der vorherigen Dosis um 1 oder 2 mg/kg erhöht werden. Dosen über 6 mg/kg Körpergewicht werden nicht empfohlen. Für die Erhaltungstherapie bei pädiatrischen Patienten sollte die Dosis auf die minimal wirksame Dosis angepasst werden.
Hypertonie
Die Therapie sollte entsprechend dem Ansprechen des Patienten individualisiert werden, um ein maximales therapeutisches Ansprechen zu erzielen und um die zur Aufrechterhaltung des therapeutischen Ansprechens erforderliche Mindestdosis zu bestimmen.
Erwachsene
Die übliche Anfangsdosis von LASIX bei Bluthochdruck beträgt 80 mg, normalerweise aufgeteilt in 40 mg zweimal täglich. Die Dosierung sollte dann entsprechend dem Ansprechen angepasst werden. Wenn das Ansprechen nicht zufriedenstellend ist, fügen Sie andere blutdrucksenkende Mittel hinzu.
Veränderungen des Blutdrucks müssen sorgfältig überwacht werden, wenn LASIX 40 mg zusammen mit anderen blutdrucksenkenden Arzneimitteln angewendet wird, insbesondere während der Anfangstherapie. Um einen übermäßigen Blutdruckabfall zu vermeiden, sollte die Dosierung anderer Wirkstoffe um mindestens 50 Prozent reduziert werden, wenn LASIX 100 mg zum Regime hinzugefügt wird. Da der Blutdruck unter der potenzierenden Wirkung von LASIX 100 mg abfällt, kann eine weitere Dosisreduktion oder sogar das Absetzen anderer blutdrucksenkender Arzneimittel erforderlich sein.
Geriatrische Patienten
Im Allgemeinen sollte die Dosisauswahl und Dosisanpassung für ältere Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen (siehe VORSICHTSMASSNAHMEN : Geriatrische Verwendung ).
WIE GELIEFERT
LASIX (Furosemid) Tabletten 20 mg sind als weiße, ovale, monogrammierte Tabletten in Flaschen mit 100 ( NDC 0039-0067-10) und 1000 ( NDC 0039-0067-70). Die 20-mg-Tabletten sind auf einer Seite mit „Lasix®“ bedruckt.
LASIX-Tabletten 40 mg sind als weiße, runde, monogrammierte Tabletten mit Bruchkerbe in Flaschen mit 100 ( NDC 0039-0060-13), 500 ( NDC 0039-0060-50) und 1000 ( NDC 0039-0060-70). Die 40-mg-Tabletten sind auf einer Seite mit „Lasix® 40“ bedruckt.
LASIX-Tabletten 80 mg sind als weiße, runde, monogrammierte Tabletten mit facettierten Kanten in Flaschen mit 50 ( NDC 0039-0066-05) und 500 ( NDC 0039-0066-50). Die 80-mg-Tabletten sind auf einer Seite mit „Lasix® 80“ bedruckt.
Notiz: In gut verschlossene, lichtbeständige Behälter füllen. Lichteinwirkung kann zu einer leichten Verfärbung führen. Verfärbte Tabletten sollten nicht ausgegeben werden.
Getestet durch USP-Auflösungstest 2
Bei 25 °C (77 °F) lagern; Ausflüge erlaubt bis 15 -30° C (59 -86° F). [Sehen USP kontrollierte Raumtemperatur .]
Hergestellt für: sanofi-aventis US LLC Bridgewater, NJ 08807. Ein Unternehmen von Sanofi. Überarbeitet: März 2016
NEBENWIRKUNGEN
Die Nebenwirkungen sind unten nach Organsystem kategorisiert und nach abnehmendem Schweregrad aufgelistet.
Reaktionen des Gastrointestinalsystems
Systemische Überempfindlichkeitsreaktionen
Reaktionen des zentralen Nervensystems
Hämatologische Reaktionen
Dermatologische Überempfindlichkeitsreaktionen
Herz-Kreislauf-Reaktion
Andere Reaktionen
Bei mittelschweren oder schweren Nebenwirkungen sollte die LASIX-Dosis reduziert oder die Therapie abgebrochen werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
LASIX 100 mg kann das ototoxische Potenzial von Aminoglykosid-Antibiotika erhöhen, insbesondere bei eingeschränkter Nierenfunktion. Vermeiden Sie diese Kombination, außer in lebensbedrohlichen Situationen.
LASIX sollte wegen der Möglichkeit einer Ototoxizität nicht gleichzeitig mit Ethacrynsäure angewendet werden. Bei Patienten, die hohe Dosen von Salicylaten gleichzeitig mit LASIX erhalten, wie bei rheumatischen Erkrankungen, kann es bei niedrigeren Dosen aufgrund konkurrierender renaler Ausscheidungsstellen zu einer Salicylat-Toxizität kommen.
Bei gleichzeitiger Gabe von Cisplatin und LASIX besteht das Risiko ototoxischer Wirkungen. Darüber hinaus kann die Nephrotoxizität von nephrotoxischen Arzneimitteln wie Cisplatin verstärkt werden, wenn LASIX 100 mg nicht in niedrigeren Dosen und mit positiver Flüssigkeitsbilanz verabreicht wird, wenn es zur Erzielung einer forcierten Diurese während der Behandlung mit Cisplatin verwendet wird.
LASIX neigt dazu, die skelettmuskelrelaxierende Wirkung von Tubocurarin zu antagonisieren und kann die Wirkung von Succinylcholin verstärken.
Lithium sollte im Allgemeinen nicht zusammen mit Diuretika verabreicht werden, da sie die renale Clearance von Lithium verringern und ein hohes Risiko einer Lithiumtoxizität hinzufügen.
LASIX 40 mg in Kombination mit Angiotensin-Converting-Enzym-Hemmern oder Angiotensin-II-Rezeptorblockern kann zu schwerer Hypotonie und Verschlechterung der Nierenfunktion, einschließlich Nierenversagen, führen. Eine Unterbrechung oder Reduzierung der Dosierung von LASIX, Angiotensin-Converting-Enzym-Hemmern oder Angiotensin-Rezeptorblockern kann erforderlich sein.
Eine Potenzierung erfolgt mit ganglionären oder peripheren adrenergen Blockern.
LASIX 40 mg kann die arterielle Ansprechbarkeit auf Norepinephrin verringern. Norepinephrin kann jedoch immer noch effektiv verwendet werden.
Die gleichzeitige Verabreichung von Sucralfat und LASIX 100 mg Tabletten kann die natriuretische und blutdrucksenkende Wirkung von LASIX verringern. Patienten, die beide Arzneimittel erhalten, sollten engmaschig überwacht werden, um festzustellen, ob die gewünschte diuretische und/oder blutdrucksenkende Wirkung von LASIX 40 mg erreicht wird. Die Einnahme von LASIX 100 mg und Sucralfat sollte mindestens zwei Stunden auseinander liegen.
In Einzelfällen kann die intravenöse Gabe von LASIX innerhalb von 24 Stunden nach der Einnahme von Chloralhydrat zu Hitzewallungen, Schweißausbrüchen, Unruhe, Übelkeit, Blutdruckanstieg und Tachykardie führen. Die gleichzeitige Anwendung von LASIX 40 mg und Chloralhydrat wird daher nicht empfohlen.
Phenytoin interferiert direkt mit der renalen Wirkung von LASIX. Es gibt Hinweise darauf, dass die Behandlung mit Phenytoin zu einer verringerten intestinalen Resorption von LASIX und folglich zu niedrigeren Furosemid-Spitzenkonzentrationen im Serum führt.
Methotrexat und andere Arzneimittel, die, wie LASIX, einer signifikanten renalen tubulären Sekretion unterliegen, können die Wirkung von LASIX verringern. Umgekehrt kann LASIX 100 mg die renale Ausscheidung anderer Arzneimittel, die einer tubulären Sekretion unterliegen, verringern. Eine hochdosierte Behandlung sowohl mit LASIX als auch mit diesen anderen Arzneimitteln kann zu erhöhten Serumspiegeln dieser Arzneimittel führen und ihre Toxizität sowie die Toxizität von LASIX verstärken.
LASIX kann das Risiko einer Cephalosporin-induzierten Nephrotoxizität selbst bei geringfügiger oder vorübergehender Nierenfunktionsstörung erhöhen.
Die gleichzeitige Anwendung von Ciclosporin und LASIX 40 mg ist mit einem erhöhten Risiko für Gichtarthritis als Folge einer LASIX-induzierten Hyperurämie und einer Beeinträchtigung der renalen Harnsäureausscheidung durch Ciclosporin verbunden.
Hohe Dosen (> 80 mg) Furosemid können die Bindung von Schilddrüsenhormonen an Trägerproteine hemmen und zu einem vorübergehenden Anstieg der freien Schilddrüsenhormone führen, gefolgt von einer allgemeinen Abnahme der Gesamtspiegel der Schilddrüsenhormone.
Eine Studie mit sechs Probanden zeigte, dass die Kombination von Furosemid und Acetylsalicylsäure die Kreatinin-Clearance bei Patienten mit chronischer Niereninsuffizienz vorübergehend verringerte. Es gibt Fallberichte von Patienten, bei denen erhöhte BUN-, Serum-Kreatinin- und Serum-Kaliumspiegel sowie Gewichtszunahme auftraten, wenn Furosemid in Verbindung mit NSAIDs angewendet wurde.
Literaturberichte weisen darauf hin, dass die gleichzeitige Verabreichung von Indomethacin die natriuretische und blutdrucksenkende Wirkung von LASIX (Furosemid) bei einigen Patienten durch Hemmung der Prostaglandinsynthese verringern kann. Indomethacin kann auch die Reninspiegel im Plasma, die Aldosteronausscheidung und die Beurteilung des Reninprofils beeinflussen. Patienten, die sowohl Indomethacin als auch LASIX erhalten, sollten engmaschig überwacht werden, um festzustellen, ob die gewünschte diuretische und/oder blutdrucksenkende Wirkung von LASIX 100 mg erreicht wird.
WARNUNGEN
Bei Patienten mit Leberzirrhose und Aszites wird die Therapie mit LASIX 100 mg am besten im Krankenhaus eingeleitet. Beim hepatischen Koma und bei Elektrolytmangelzuständen sollte eine Therapie erst nach Besserung des Grundzustandes eingeleitet werden. Plötzliche Veränderungen des Flüssigkeits- und Elektrolythaushalts bei Patienten mit Zirrhose können ein hepatisches Koma auslösen; daher ist während der Periode der Diurese eine strenge Überwachung erforderlich. Zusätzliches Kaliumchlorid und, falls erforderlich, ein Aldosteronantagonist sind hilfreich, um Hypokaliämie und metabolischer Alkalose vorzubeugen.
Wenn während der Behandlung einer schweren fortschreitenden Nierenerkrankung eine zunehmende Azotämie und Oligurie auftritt, sollte LASIX 100 mg abgesetzt werden.
Fälle von Tinnitus und reversibler oder irreversibler Schwerhörigkeit und Taubheit wurden berichtet. Berichte deuten normalerweise darauf hin, dass die Ototoxizität von LASIX mit einer schnellen Injektion, einer schweren Nierenfunktionsstörung, der Anwendung von höheren als den empfohlenen Dosen, einer Hypoproteinämie oder einer gleichzeitigen Therapie mit Aminoglykosid-Antibiotika, Ethacrynsäure oder anderen ototoxischen Arzneimitteln verbunden ist. Wenn sich der Arzt für eine hochdosierte parenterale Therapie entscheidet, ist eine kontrollierte intravenöse Infusion ratsam (bei Erwachsenen wurde eine Infusionsgeschwindigkeit von nicht mehr als 4 mg LASIX pro Minute verwendet). (Sehen VORSICHTSMASSNAHMEN : WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN )
VORSICHTSMASSNAHMEN
Allgemein
Übermäßige Diurese kann insbesondere bei älteren Patienten zu Dehydratation und Blutvolumenminderung mit Kreislaufkollaps und möglicherweise zu vaskulärer Thrombose und Embolie führen. Wie bei jedem wirksamen Diuretikum kann es während der Therapie mit LASIX 100 mg zu einem Elektrolytmangel kommen, insbesondere bei Patienten, die höhere Dosen und eine eingeschränkte Salzaufnahme erhalten. Unter LASIX kann sich eine Hypokaliämie entwickeln, insbesondere bei starker Diurese, unzureichender oraler Elektrolytzufuhr, bei bestehender Zirrhose oder bei gleichzeitiger Anwendung von Kortikosteroiden, ACTH, Süßholz in großen Mengen oder längerer Anwendung von Abführmitteln. Die Digitalis-Therapie kann die metabolischen Wirkungen einer Hypokaliämie verstärken, insbesondere myokardiale Wirkungen.
Alle Patienten, die eine LASIX-Therapie erhalten, sollten auf diese Anzeichen oder Symptome eines Flüssigkeits- oder Elektrolyt-Ungleichgewichts (Hyponatriämie, hypochlorämische Alkalose, Hypokaliämie, Hypomagnesiämie oder Hypokalzämie) überwacht werden: Mundtrockenheit, Durst, Schwäche, Lethargie, Schläfrigkeit, Ruhelosigkeit, Muskelschmerzen oder -krämpfe, Muskelermüdung, Hypotonie, Oligurie, Tachykardie, Arrhythmie oder gastrointestinale Störungen wie Übelkeit und Erbrechen. Anstiege des Blutzuckers und Veränderungen der Glukosetoleranztests (mit Anomalien des Nüchtern- und 2-Stunden-Postprandialzuckers) wurden beobachtet, und selten wurde über das Auftreten von Diabetes mellitus berichtet.
Bei Patienten mit schweren Symptomen eines Harnverhalts (aufgrund von Blasenentleerungsstörungen, Prostatahyperplasie, Harnröhrenverengung) kann die Verabreichung von Furosemid einen akuten Harnverhalt im Zusammenhang mit einer erhöhten Produktion und Retention von Urin verursachen. Daher erfordern diese Patienten eine sorgfältige Überwachung, insbesondere in den Anfangsstadien der Behandlung.
Bei Patienten mit hohem Risiko für eine Röntgenkontrast-Nephropathie kann LASIX 100 mg zu einer höheren Inzidenz einer Verschlechterung der Nierenfunktion nach einer Röntgenkontrastbehandlung führen als bei Hochrisikopatienten, die vor der Röntgenkontrastbehandlung nur eine intravenöse Flüssigkeitszufuhr erhalten haben.
Bei Patienten mit Hypoproteinämie (z. B. im Zusammenhang mit einem nephrotischen Syndrom) kann die Wirkung von LASIX 40 mg abgeschwächt und seine Ototoxizität potenziert werden.
Asymptomatische Hyperurikämie kann auftreten und Gicht kann selten ausgelöst werden.
Patienten, die gegen Sulfonamide allergisch sind, können auch gegen LASIX allergisch sein. Es besteht die Möglichkeit einer Exazerbation oder Aktivierung des systemischen Lupus erythematodes.
Wie bei vielen anderen Arzneimitteln sollten Patienten regelmäßig auf das mögliche Auftreten von Blutveränderungen, Leber- oder Nierenschäden oder anderen idiosynkratischen Reaktionen hin beobachtet werden.
Labortests
Serumelektrolyte (insbesondere Kalium), CO2, Kreatinin und BUN sollten während der ersten Monate der Therapie mit LASIX 100 mg und danach regelmäßig bestimmt werden. Serum- und Urinelektrolytbestimmungen sind besonders wichtig, wenn der Patient stark erbricht oder parenterale Flüssigkeiten erhält. Anomalien sollten korrigiert oder das Medikament vorübergehend abgesetzt werden. Auch andere Medikamente können die Serumelektrolyte beeinflussen.
Reversible Erhöhungen von BUN können auftreten und sind mit Dehydratation verbunden, die vermieden werden sollte, insbesondere bei Patienten mit Niereninsuffizienz.
Urin und Blutzucker sollten bei Diabetikern, die LASIX 100 mg erhalten, regelmäßig kontrolliert werden, selbst bei Patienten mit Verdacht auf latenten Diabetes.
LASIX 40 mg kann die Serumspiegel von Calcium (es wurden selten Fälle von Tetanie berichtet) und Magnesium senken. Dementsprechend sollten die Serumspiegel dieser Elektrolyte regelmäßig bestimmt werden.
Bei Frühgeborenen kann LASIX 100 mg eine Nephrokalzinose/Nephrolithiasis auslösen, daher muss die Nierenfunktion überwacht und eine Nierensonographie durchgeführt werden. (Sehen VORSICHTSMASSNAHMEN : Pädiatrische Verwendung )
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Furosemid wurde durch orale Verabreichung an einem Maus- und einem Rattenstamm auf Karzinogenität getestet. Eine geringe, aber signifikant erhöhte Inzidenz von Brustdrüsenkarzinomen trat bei weiblichen Mäusen bei einer Dosis auf, die dem 17,5-fachen der maximalen Humandosis von 600 mg entsprach. Bei männlichen Ratten kam es bei einer Dosis von 15 mg/kg (etwas höher als die maximale Humandosis), aber nicht bei 30 mg/kg zu einem geringfügigen Anstieg gelegentlicher Tumoren.
Furosemid zeigte keine mutagene Aktivität in verschiedenen Stämmen von Salmonella typhimurium, wenn es in Gegenwart oder Abwesenheit eines metabolischen In-vitro-Aktivierungssystems getestet wurde, und war in Maus-Lymphomzellen in Gegenwart von Rattenleber-S9 bei der höchsten getesteten Dosis fraglich positiv für Genmutationen. Furosemid induzierte in vitro keinen Schwesterchromatidaustausch in menschlichen Zellen, aber andere Studien zu Chromosomenaberrationen in menschlichen Zellen in vitro ergaben widersprüchliche Ergebnisse. In chinesischen Hamsterzellen induzierte es Chromosomenschäden, war aber fraglich positiv für den Austausch von Schwesterchromatiden. Studien zur Induktion von Chromosomenaberrationen durch Furosemid bei Mäusen waren nicht schlüssig. Der Urin von Ratten, die mit diesem Medikament behandelt wurden, induzierte keine Genumwandlung in Saccharomyces cerevisiae.
LASIX (Furosemid) verursachte keine Beeinträchtigung der Fertilität bei männlichen oder weiblichen Ratten bei 100 mg/kg/Tag (der maximalen wirksamen diuretischen Dosis bei der Ratte und dem Achtfachen der maximalen Humandosis von 600 mg/Tag).
Schwangerschaft
Schwangerschaft Kategorie C - Es wurde gezeigt, dass Furosemid beim 2-, 4- und 8-fachen der beim Menschen empfohlenen Höchstdosis bei Kaninchen ungeklärte Müttersterblichkeit und Aborte verursacht. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. LASIX sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Die Behandlung während der Schwangerschaft erfordert aufgrund des potenziell höheren Geburtsgewichts eine Überwachung des fötalen Wachstums.
Die Wirkungen von Furosemid auf die embryonale und fötale Entwicklung und auf trächtige Muttertiere wurden an Mäusen, Ratten und Kaninchen untersucht.
Furosemid verursachte bei Kaninchen in der niedrigsten Dosis von 25 mg/kg (dem 2-fachen der beim Menschen empfohlenen Höchstdosis von 600 mg/Tag) ungeklärte Müttersterblichkeit und Aborte. In einer anderen Studie verursachte eine Dosis von 50 mg/kg (das Vierfache der empfohlenen Höchstdosis von 600 mg/Tag beim Menschen) ebenfalls Müttersterblichkeit und Aborte, wenn sie Kaninchen zwischen dem 12. und 17. Trächtigkeitstag verabreicht wurde. In einer dritten Studie überlebte keines der trächtigen Kaninchen eine Dosis von 100 mg/kg. Daten aus den oben genannten Studien weisen auf eine fötale Letalität hin, die dem Tod der Mutter vorausgehen kann.
Die Ergebnisse der Mausstudie und einer der drei Kaninchenstudien zeigten auch eine erhöhte Inzidenz und Schwere von Hydronephrose (Ausdehnung des Nierenbeckens und in einigen Fällen der Harnleiter) bei Föten der behandelten Muttertiere im Vergleich zur Inzidenz bei Föten aus der Kontrollgruppe.
Stillende Mutter
Da es in die Muttermilch übergeht, ist Vorsicht geboten, wenn LASIX einer stillenden Mutter verabreicht wird.
LASIX 40 mg kann die Laktation hemmen.
Pädiatrische Verwendung
Bei Frühgeborenen kann LASIX eine Nephrokalzinose/Nephrolithiasis auslösen. Nephrokalzinose/Nephrolithiasis wurde auch bei Kindern unter 4 Jahren ohne Vorgeschichte von Frühgeburten beobachtet, die chronisch mit LASIX behandelt wurden. Bei pädiatrischen Patienten, die LASIX erhalten, sollte die Nierenfunktion überwacht und eine Nierensonographie in Betracht gezogen werden.
Wenn LASIX 40 mg Frühgeborenen in den ersten Lebenswochen verabreicht wird, kann dies das Risiko einer Persistenz eines persistierenden Ductus arteriosus erhöhen
Geriatrische Verwendung
Kontrollierte klinische Studien mit LASIX 100 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für ältere Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Es ist bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte die Dosis sorgfältig ausgewählt werden und es kann sinnvoll sein, die Nierenfunktion zu überwachen. (Sehen VORSICHTSMASSNAHMEN : Allgemein und DOSIERUNG UND ANWENDUNG .)
ÜBERDOSIS
Die wichtigsten Anzeichen und Symptome einer Überdosierung mit LASIX 40 mg sind Dehydratation, Verringerung des Blutvolumens, Hypotonie, Elektrolytstörungen, Hypokaliämie und hypochlorämische Alkalose und sind Erweiterungen seiner diuretischen Wirkung.
Die akute Toxizität von LASIX 100 mg wurde bei Mäusen, Ratten und Hunden bestimmt. Bei allen dreien überstieg die orale LD50 1000 mg/kg Körpergewicht, während die intravenöse LD50 im Bereich von 300 bis 680 mg/kg lag. Die akute intragastrische Toxizität bei neugeborenen Ratten ist 7- bis 10-mal höher als bei erwachsenen Ratten.
Die Konzentration von LASIX in biologischen Flüssigkeiten, die mit Toxizität oder Tod in Verbindung gebracht wird, ist nicht bekannt.
Die Behandlung einer Überdosierung ist unterstützend und besteht im Ersatz übermäßiger Flüssigkeits- und Elektrolytverluste. Serumelektrolyte, Kohlendioxidspiegel und Blutdruck sollten regelmäßig bestimmt werden. Bei Patienten mit Harnblasenauslassobstruktion (z. B. Prostatahypertrophie) muss eine ausreichende Drainage gewährleistet sein.
Die Hämodialyse beschleunigt die Elimination von Furosemid nicht.
KONTRAINDIKATIONEN
LASIX 40 mg ist kontraindiziert bei Patienten mit Anurie und bei Patienten mit bekannter Überempfindlichkeit gegenüber Furosemid.
KLINISCHE PHARMAKOLOGIE
Untersuchungen zur Wirkungsweise von LASIX haben Mikropunktionsstudien bei Ratten, Stop-Flow-Experimente bei Hunden und verschiedene Clearance-Studien sowohl bei Menschen als auch bei Versuchstieren verwendet. Es wurde gezeigt, dass LASIX hauptsächlich die Absorption von Natrium und Chlorid nicht nur in den proximalen und distalen Tubuli, sondern auch in der Henle-Schleife hemmt. Die hohe Wirksamkeit ist vor allem auf den einzigartigen Wirkort zurückzuführen. Die Wirkung auf den distalen Tubulus ist unabhängig von einer Hemmwirkung auf Carboanhydrase und Aldosteron.
Jüngste Erkenntnisse deuten darauf hin, dass Furosemidglucuronid das einzige oder zumindest das wichtigste Biotransformationsprodukt von Furosemid beim Menschen ist. Furosemid wird weitgehend an Plasmaproteine gebunden, hauptsächlich an Albumin. Plasmakonzentrationen im Bereich von 1 bis 400 μg/ml werden bei gesunden Personen zu 91 bis 99 % gebunden. Die ungebundene Fraktion beträgt bei therapeutischen Konzentrationen durchschnittlich 2,3 bis 4,1 %.
Der Beginn der Diurese nach oraler Verabreichung liegt innerhalb von 1 Stunde. Der Spitzeneffekt tritt innerhalb der ersten oder zweiten Stunde auf. Die Dauer der diuretischen Wirkung beträgt 6 bis 8 Stunden.
Bei nüchternen, normalen Männern beträgt die mittlere Bioverfügbarkeit von Furosemid aus LASIX-Tabletten und LASIX-Lösung zum Einnehmen 64 % bzw. 60 % der Bioverfügbarkeit einer intravenösen Injektion des Arzneimittels. Obwohl Furosemid aus der Lösung zum Einnehmen (50 Minuten) schneller resorbiert wird als aus der Tablette (87 Minuten), unterscheiden sich die maximalen Plasmaspiegel und die Fläche unter den Plasmakonzentrations-Zeit-Kurven nicht signifikant. Die Spitzenplasmakonzentrationen steigen mit zunehmender Dosis, aber die Zeiten bis zum Erreichen der Spitzenwerte unterscheiden sich nicht zwischen den Dosen. Die terminale Halbwertszeit von Furosemid beträgt etwa 2 Stunden.
Nach der intravenösen Injektion wird signifikant mehr Furosemid im Urin ausgeschieden als nach der Tablette oder Lösung zum Einnehmen. Es gibt keine signifikanten Unterschiede zwischen den beiden oralen Formulierungen in der Menge des unveränderten Arzneimittels, das im Urin ausgeschieden wird.
Geriatrische Bevölkerung
Die Bindung von Furosemid an Albumin kann bei älteren Patienten reduziert sein. Furosemid wird überwiegend unverändert im Urin ausgeschieden. Die renale Clearance von Furosemid nach intravenöser Verabreichung ist bei älteren gesunden männlichen Probanden (60-70 Jahre) statistisch signifikant geringer als bei jüngeren gesunden männlichen Probanden (20-35 Jahre). Die anfängliche diuretische Wirkung von Furosemid ist bei älteren Probanden im Vergleich zu jüngeren Probanden verringert. (Sehen VORSICHTSMASSNAHMEN : Geriatrische Verwendung .)
INFORMATIONEN ZUM PATIENTEN
Patienten, die mit LASIX behandelt werden, sollten darauf hingewiesen werden, dass bei ihnen Symptome durch übermäßigen Flüssigkeits- und/oder Elektrolytverlust auftreten können. Die manchmal auftretende orthostatische Hypotonie kann in der Regel durch langsames Aufstehen beherrscht werden. Kaliumergänzungen und/oder diätetische Maßnahmen können erforderlich sein, um eine Hypokaliämie zu kontrollieren oder zu vermeiden.
Patienten mit Diabetes mellitus sollten darüber informiert werden, dass Furosemid den Blutzuckerspiegel erhöhen und dadurch Urinzuckertests beeinflussen kann. Die Haut einiger Patienten kann während der Einnahme von Furosemid empfindlicher auf die Auswirkungen von Sonnenlicht reagieren.
Bluthochdruckpatienten sollten Medikamente vermeiden, die den Blutdruck erhöhen können, einschließlich rezeptfreier Produkte zur Unterdrückung des Appetits und Erkältungssymptomen.