Microzide 25mg Hydrochlorothiazide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Microzide 25 mg und wie wird es angewendet?
Microzide ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Bluthochdruck (Hypertonie) und Schwellungen (Ödeme). Microzide kann allein oder mit anderen Medikamenten verwendet werden.
Microzide gehört zu einer Klasse von Medikamenten namens Diuretika, Thiazide.
Es ist nicht bekannt, ob Microzide bei Kindern unter 6 Monaten sicher und wirksam ist.
Welche Nebenwirkungen kann Microzid haben?
Microzid kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Microzide gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Microzide. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
MICROZIDE® (Hydrochlorothiazid, USP 12,5 mg) ist das 3,4-Dihydro-Derivat von Chlorothiazid. Sein chemischer Name ist 6-Chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Seine Summenformel ist C7H8CIN304S2; sein Molekulargewicht beträgt 297,74; und seine Strukturformel lautet:
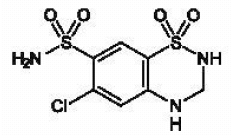
Es ist ein weißes oder praktisch weißes, kristallines Pulver, das in Wasser leicht löslich, aber in Natronlauge gut löslich ist.
MICROZIDE (Hydrochlorothiazid-Kapsel) wird als 12,5-mg-Kapsel zur oralen Anwendung geliefert.
Inaktive Zutaten : kolloidales Siliciumdioxid, Maisstärke, Lactose-Monohydrat, Magnesiumstearat. Gelatinekapseln enthalten D&C Rot Nr. 28, D&C Gelb Nr. 10, FD&C Blau Nr. 1, Gelatine, Titandioxid. Die Kapseln sind mit essbarer Tinte bedruckt, die schwarzes Eisenoxid, D&C Gelb Nr. 10, FD&C Blau Nr. 1, FD&C Blau Nr. 2, FD&C Rot Nr. 40 enthält.
INDIKATIONEN
MICROZIDE (Hydrochlorothiazid-Kapsel) ist zur Behandlung von Bluthochdruck entweder als alleiniges Therapeutikum oder in Kombination mit anderen Antihypertonika indiziert. Im Gegensatz zu kaliumsparenden diuretischen Kombinationsprodukten kann MICROZIDE (Hydrochlorothiazid-Kapsel) bei Patienten angewendet werden, bei denen kein Risiko für die Entwicklung einer Hyperkaliämie besteht, einschließlich Patienten, die ACE-Hemmer einnehmen.
Anwendung in der Schwangerschaft
Die routinemäßige Anwendung von Diuretika bei einer ansonsten gesunden Frau ist unangemessen und setzt Mutter und Fötus unnötigen Gefahren aus. Diuretika verhindern nicht die Entwicklung einer Schwangerschaftstoxämie, und es gibt keinen zufriedenstellenden Beweis dafür, dass sie bei der Behandlung einer entwickelten Toxämie nützlich sind.
Ödeme während der Schwangerschaft können durch pathologische Ursachen oder durch die physiologischen und mechanischen Folgen der Schwangerschaft entstehen. Diuretika sind in der Schwangerschaft angezeigt, wenn Ödeme auf pathologische Ursachen zurückzuführen sind, ebenso wie ohne Schwangerschaft. Abhängige Ödeme in der Schwangerschaft, die aus einer Einschränkung des venösen Rückflusses durch den erweiterten Uterus resultieren, werden durch Anheben der unteren Extremitäten und Verwendung eines Stützschlauchs richtig behandelt; Die Verwendung von Diuretika zur Verringerung des intravaskulären Volumens ist in diesem Fall unlogisch und unnötig. Es gibt eine Hypervolämie während einer normalen Schwangerschaft, die weder für den Fötus noch für die Mutter schädlich ist (in Abwesenheit einer kardiovaskulären Erkrankung), die jedoch mit Ödemen verbunden ist, einschließlich generalisierter Ödeme bei der Mehrzahl der schwangeren Frauen. Wenn dieses Ödem zu Beschwerden führt, wird häufig eine vermehrte Liegeposition Linderung verschaffen. In seltenen Fällen kann dieses Ödem extreme Beschwerden verursachen, die durch Ruhe nicht gelindert werden. In diesen Fällen kann eine kurze Behandlung mit Diuretika Linderung verschaffen und angemessen sein.
DOSIERUNG UND ANWENDUNG
Zur Kontrolle von Bluthochdruck : Die Anfangsdosis von MICROZIDE (Hydrochlorothiazid-Kapsel) für Erwachsene beträgt einmal täglich eine Kapsel, unabhängig davon, ob sie allein oder in Kombination mit anderen Antihypertonika gegeben wird. Gesamttagesdosen von mehr als 50 mg werden nicht empfohlen.
WIE GELIEFERT
MICROZIDE (Hydrochlorothiazid-Kapsel) Kapseln sind #4 Teal Opaque/Teal Opaque zweiteilige Hartgelatinekapseln mit dem Aufdruck MICROZIDE (Hydrochlorothiazid-Kapsel) und 12,5 mg in schwarzer Tinte. Sie werden in 100er Flaschen mit kindersicherem Verschluss ( NDC 52544-622-01).
In einem dichten, lichtbeständigen Behälter gemäß USP abgeben.
Außerhalb der Reichweite von Kindern aufbewahren.
Bei 20°-25°C (68°-77°F) lagern. [Siehe USP kontrollierte Raumtemperatur.] Vor Licht, Feuchtigkeit, Frost und -20 °C (-4 °F) schützen. Behälter dicht geschlossen halten.
Richten Sie medizinische Anfragen an: WATSON., Medical Communications PO Box 1953, Morristown, NJ 07962-1953. 800-272-5525. Hergestellt von: Watson Pharma Private Limited. Verna, Salcette, Goa 403 722 INDIEN. Verteilt durch: Watson Pharma, Inc. Morristown, NJ 07962 USA. Überarbeitet: Februar 2011
NEBENWIRKUNGEN
Es wurde gezeigt, dass die mit Hydrochlorothiazid verbundenen Nebenwirkungen dosisabhängig sind. In kontrollierten klinischen Studien waren die Nebenwirkungen, die bei Dosen von 12,5 mg Hydrochlorothiazid einmal täglich berichtet wurden, vergleichbar mit Placebo. Die folgenden Nebenwirkungen wurden für Hydrochlorothiazid-Dosen von 25 mg und mehr berichtet und sind innerhalb jeder Kategorie nach abnehmendem Schweregrad aufgeführt.
Körper als Ganzes : Die Schwäche.
Herz-Kreislauf : Hypotonie einschließlich orthostatischer Hypotonie (kann durch Alkohol, Barbiturate, Narkotika oder Antihypertensiva verschlimmert werden).
Verdauungs Pankreatitis, Gelbsucht (intrahepatischer cholestatischer Ikterus), Durchfall, Erbrechen, Sialadenitis, Krämpfe, Verstopfung, Magenreizung, Übelkeit, Anorexie.
Hämatologisch : Aplastische Anämie, Agranulozytose, Leukopenie, hämolytische Anämie, Thrombozytopenie.
Überempfindlichkeit : Anaphylaktische Reaktionen, nekrotisierende Angiitis (Vaskulitis und kutane Vaskulitis), Atemnot einschließlich Pneumonitis und Lungenödem, Lichtempfindlichkeit, Fieber, Urtikaria, Hautausschlag, Purpura.
Stoffwechsel : Elektrolytungleichgewicht (vgl VORSICHTSMASSNAHMEN ), Hyperglykämie, Glykosurie, Hyperurikämie.
Bewegungsapparat : Muskelkrampf.
Nervensystem/Psychiatrie : Schwindel, Parästhesien, Schwindel, Kopfschmerzen, Ruhelosigkeit.
Nieren : Nierenversagen, Nierenfunktionsstörung, interstitielle Nephritis (vgl WARNUNGEN ).
Haut : Erythema multiforme einschließlich Stevens-Johnson-Syndrom, exfoliative Dermatitis einschließlich toxischer epidermaler Nekrolyse, Alopezie.
Besondere Sinne Vorübergehendes verschwommenes Sehen, Xanthopsie.
Urogenital : Impotenz.
Bei mäßigen oder schweren Nebenwirkungen sollte die Thiazid-Dosierung reduziert oder die Therapie abgebrochen werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Bei gleichzeitiger Gabe können die folgenden Arzneimittel mit Thiaziddiuretika interagieren:
Alkohol, Barbiturate oder Betäubungsmittel - Es kann zu einer Verstärkung der orthostatischen Hypotonie kommen.
Antidiabetika - (orale Wirkstoffe und Insulin) Dosisanpassung des Antidiabetikums kann erforderlich sein.
Andere Antihypertensiva - additive Wirkung oder Potenzierung.
Cholestyramin- und Colestipolharze - Cholestyramin- und Colestipol-Harze binden das Hydrochlorothiazid und reduzieren dessen Aufnahme aus dem Magen-Darm-Trakt um bis zu 85 bzw. 43 Prozent.
Kortikosteroid, ACTH - verstärkter Elektrolytmangel, insbesondere Hypokaliämie.
Pressoramine (z. B. Norepinephrin) - möglicherweise verminderte Reaktion auf Pressoramine, aber nicht ausreichend, um ihre Verwendung auszuschließen.
Skelettmuskelrelaxanzien, nicht depolarisierend (z. B. Tubocurarin) mögliche erhöhte Ansprechbarkeit auf das Muskelrelaxans.
Lithium - sollte im Allgemeinen nicht zusammen mit Diuretika gegeben werden. Diuretika reduzieren die renale Clearance von Lithium und erhöhen das Risiko einer Lithiumtoxizität erheblich. Lesen Sie vor der Anwendung solcher Präparate mit MICROZIDE (Hydrochlorothiazid-Kapsel) die Packungsbeilage für Lithiumpräparate.
Nicht-steroidale entzündungshemmende Medikamente - Bei manchen Patienten kann die Verabreichung eines nichtsteroidalen Antirheumatikums die diuretische, natriuretische und blutdrucksenkende Wirkung von Schleifendiuretika, kaliumsparenden Diuretika und Thiaziddiuretika abschwächen. Bei gleichzeitiger Anwendung von MICROZIDE (Hydrochlorothiazid-Kapsel) und nichtsteroidalen Antirheumatika sollten die Patienten engmaschig überwacht werden, um festzustellen, ob die gewünschte Wirkung des Diuretikums eintritt.
Arzneimittel-/Labortest-Wechselwirkungen
Thiazide sollten abgesetzt werden, bevor Tests zur Nebenschilddrüsenfunktion durchgeführt werden (vgl VORSICHTSMASSNAHMEN, Allgemeines ).
WARNUNGEN
Diabetes und Hypoglykämie: Ein latenter Diabetes mellitus kann sich manifestieren und bei Diabetikern, denen Thiazide verabreicht werden, kann eine Anpassung ihrer Insulindosis erforderlich sein.
Nierenkrankheit: Bei Patienten mit eingeschränkter Nierenfunktion können sich kumulative Wirkungen der Thiazide entwickeln. Bei solchen Patienten können Thiazide eine Azotämie auslösen.
VORSICHTSMASSNAHMEN
Elektrolyt- und Flüssigkeitshaushaltsstatus
In veröffentlichten Studien trat eine klinisch signifikante Hypokaliämie bei Patienten, die 12,5 mg Hydrochlorothiazid erhielten, durchweg seltener auf als bei Patienten, die höhere Dosen erhielten. Dennoch sollte bei Patienten, bei denen ein Risiko für die Entwicklung einer Hypokaliämie besteht, eine regelmäßige Bestimmung der Serumelektrolyte durchgeführt werden. Die Patienten sollten auf Anzeichen von Flüssigkeits- oder Elektrolytstörungen, dh Hyponatriämie, hypochlorämische Alkalose, Hypokaliämie und Hypomagnesiämie, überwacht werden.
Warnzeichen oder Symptome eines Ungleichgewichts im Flüssigkeits- und Elektrolythaushalt sind Mundtrockenheit, Durst, Schwäche, Lethargie, Schläfrigkeit, Ruhelosigkeit, Muskelschmerzen oder -krämpfe, Muskelermüdung, Hypotonie, Oligurie, Tachykardie und gastrointestinale Störungen wie Übelkeit und Erbrechen.
Eine Hypokaliämie kann sich entwickeln, insbesondere bei lebhafter Diurese, wenn eine schwere Zirrhose vorliegt, während der gleichzeitigen Anwendung von Kortikosteroiden oder adrenocorticotropem Hormon (ACTH) oder nach längerer Therapie. Eine Beeinträchtigung einer ausreichenden oralen Elektrolytzufuhr trägt ebenfalls zur Hypokaliämie bei. Hypokaliämie und Hypomagnesiämie können ventrikuläre Arrhythmien hervorrufen oder die Reaktion des Herzens auf die toxischen Wirkungen von Digitalis sensibilisieren oder verstärken. Eine Hypokaliämie kann durch eine Kaliumergänzung oder eine erhöhte Aufnahme von kaliumreichen Lebensmitteln vermieden oder behandelt werden.
Verdünnungshyponatriämie ist lebensbedrohlich und kann bei ödematösen Patienten bei heißem Wetter auftreten; Eine geeignete Therapie ist Wasserrestriktion statt Salzgabe, außer in seltenen Fällen, wenn die Hyponatriämie lebensbedrohlich ist. Bei tatsächlichem Salzmangel ist ein angemessener Ersatz die Therapie der Wahl.
Hyperurikämie
Bei bestimmten Patienten, die Thiaziddiuretika erhalten, kann es zu Hyperurikämie oder akuter Gicht kommen.
Beeinträchtigte Leberfunktion
Thiazide sollten bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden. Sie können bei Patienten mit schwerer Lebererkrankung ein hepatisches Koma auslösen.
Nebenschilddrüsenerkrankung
Die Kalziumausscheidung wird durch Thiazide verringert, und bei einigen Patienten unter längerer Thiazidtherapie wurden pathologische Veränderungen in den Nebenschilddrüsen mit Hyperkalzämie und Hypophosphatämie beobachtet.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Zweijährige Fütterungsstudien an Mäusen und Ratten, die unter der Schirmherrschaft des National Toxicology Program (NTP) durchgeführt wurden, ergaben keine Hinweise auf ein karzinogenes Potenzial von Hydrochlorothiazid bei weiblichen Mäusen (bei Dosen von bis zu etwa 600 mg/kg/Tag) oder bei männlichen und weibliche Ratten (bei Dosen von etwa 100 mg/kg/Tag). Das NTP fand jedoch zweideutige Beweise für die Hepatokanzerogenität bei männlichen Mäusen. Hydrochlorothiazid war in vitro im Ames-Mutagenitätstest der Salmonella typhimurium-Stämme TA 98, TA 100, TA 1535, TA 1537 und TA 1538 und im Chinese Hamster Ovary (CHO)-Test auf Chromosomenaberrationen oder in vivo in Assays nicht genotoxisch Keimzellchromosomen der Maus, Knochenmarkchromosomen des chinesischen Hamsters und das geschlechtsgebundene rezessive letale Merkmalsgen von Drosophila. Positive Testergebnisse wurden nur in den In-vitro-Assays CHO Sister Chromatid Exchange (Klastogenität) und Maus-Lymphomzellen (Mutagenität) unter Verwendung von Hydrochlorothiazidkonzentrationen von 43 bis 1300 mcg/ml und im Aspergillus nidulans Non-Disjunction-Assay erhalten eine unbestimmte Konzentration.
Hydrochlorothiazid hatte keine nachteiligen Auswirkungen auf die Fertilität von Mäusen und Ratten beiderlei Geschlechts in Studien, in denen diese Spezies über ihre Ernährung Dosen von bis zu 100 bzw. 4 mg/kg vor der Empfängnis und während der gesamten Trächtigkeit ausgesetzt waren.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B: Studien, in denen Hydrochlorothiazid trächtigen Mäusen und Ratten während ihrer jeweiligen Phase der Hauptorganogenese in Dosen von bis zu 3000 bzw. 1000 mg Hydrochlorothiazid/kg oral verabreicht wurde, ergaben keine Hinweise auf eine Schädigung des Fötus.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Nicht teratogene Wirkungen
Thiazide passieren die Plazentaschranke und treten im Nabelschnurblut auf. Es besteht das Risiko von fötaler oder neonataler Gelbsucht, Thrombozytopenie und möglicherweise anderen Nebenwirkungen, die bei Erwachsenen aufgetreten sind.
Stillende Mutter
Thiazide werden in die Muttermilch ausgeschieden. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen oder Hydrochlorothiazid beendet werden sollen.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Nutzung durch ältere Menschen
Bei älteren Patienten (dh > 65 Jahre) können unter Hydrochlorothiazid eine stärkere Blutdrucksenkung und eine Zunahme der Nebenwirkungen beobachtet werden. Daher wird empfohlen, die Behandlung mit der niedrigsten verfügbaren Dosis von Hydrochlorothiazid (12,5 mg) zu beginnen. Wenn eine weitere Titration erforderlich ist, sollten 12,5-mg-Schritte verwendet werden.
ÜBERDOSIS
Die am häufigsten beobachteten Anzeichen und Symptome sind solche, die durch Elektrolytmangel (Hypokaliämie, Hypochlorämie, Hyponatriämie) und Dehydratation infolge übermäßiger Diurese verursacht werden. Wenn auch Digitalis verabreicht wurde, kann eine Hypokaliämie Herzrhythmusstörungen verstärken.
Im Falle einer Überdosierung sollten symptomatische und unterstützende Maßnahmen ergriffen werden. Erbrechen sollte herbeigeführt oder eine Magenspülung durchgeführt werden. Korrigieren Sie Dehydratation, Elektrolytstörungen, Leberkoma und Hypotonie durch etablierte Verfahren. Bei Atembeschwerden ggf. Sauerstoff oder künstliche Beatmung verabreichen. Das Ausmaß, in dem Hydrochlorothiazid durch Hämodialyse entfernt wird, wurde nicht ermittelt.
Die orale LD50 von Hydrochlorothiazid beträgt bei Maus und Ratte mehr als 10 g/kg.
KONTRAINDIKATIONEN
Hydrochlorothiazid ist bei Patienten mit Anurie kontraindiziert. Eine Überempfindlichkeit gegen dieses Produkt oder andere von Sulfonamiden abgeleitete Arzneimittel ist ebenfalls kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Hydrochlorothiazid blockiert die Reabsorption von Natrium- und Chloridionen und erhöht dadurch die Natriummenge, die den distalen Tubulus durchquert, und das ausgeschiedene Wasservolumen. Ein Teil des zusätzlichen Natriums, das dem distalen Tubulus zugeführt wird, wird dort gegen Kalium- und Wasserstoffionen ausgetauscht. Bei fortgesetzter Anwendung von Hydrochlorothiazid und Natriummangel neigen Kompensationsmechanismen dazu, diesen Austausch zu verstärken und können zu einem übermäßigen Verlust von Kalium-, Wasserstoff- und Chloridionen führen. Hydrochlorothiazid verringert auch die Ausscheidung von Calcium und Harnsäure, kann die Ausscheidung von Jodid erhöhen und die glomeruläre Filtrationsrate verringern. Es wurde gezeigt, dass Stoffwechseltoxizitäten im Zusammenhang mit übermäßigen Elektrolytveränderungen, die durch Hydrochlorothiazid verursacht werden, dosisabhängig sind.
Pharmakokinetik und Stoffwechsel
Hydrochlorothiazid wird nach oraler Gabe gut resorbiert (65 % bis 75 %). Die Resorption von Hydrochlorothiazid ist bei Patienten mit dekompensierter Herzinsuffizienz verringert.
Maximale Plasmakonzentrationen werden innerhalb von 1 bis 5 Stunden nach der Einnahme beobachtet und reichen von 70 bis 490 ng/ml nach oraler Gabe von 12,5 bis 100 mg. Die Plasmakonzentrationen stehen in linearem Zusammenhang mit der verabreichten Dosis. Die Konzentrationen von Hydrochlorothiazid sind im Vollblut 1,6- bis 1,8-mal höher als im Plasma. Es wurde berichtet, dass die Bindung an Serumproteine etwa 40 % bis 68 % beträgt. Die Plasmaeliminationshalbwertszeit wurde mit 6 bis 15 Stunden angegeben. Hydrochlorothiazid wird hauptsächlich über die Nieren ausgeschieden. Nach oraler Gabe von 12,5 bis 100 mg erscheinen 55 % bis 77 % der verabreichten Dosis im Urin und mehr als 95 % der resorbierten Dosis werden als unveränderter Wirkstoff im Urin ausgeschieden. Bei Patienten mit Nierenerkrankungen sind die Plasmakonzentrationen von Hydrochlorothiazid erhöht und die Eliminationshalbwertszeit verlängert.
Wenn MICROZIDE (Hydrochlorothiazid-Kapsel) zusammen mit Nahrung verabreicht wird, verringert sich seine Bioverfügbarkeit um 10 %, die maximale Plasmakonzentration um 20 % und die Zeit bis zur maximalen Konzentration verlängert sich von 1,6 auf 2,9 Stunden.
Pharmakodynamik
Es wird angenommen, dass akute blutdrucksenkende Wirkungen von Thiaziden aus einer Verringerung des Blutvolumens und des Herzzeitvolumens resultieren, sekundär zu einer natriuretischen Wirkung, obwohl auch ein direkter gefäßerweiternder Mechanismus vorgeschlagen wurde. Bei chronischer Verabreichung kehrt das Plasmavolumen zum Normalwert zurück, aber der periphere Gefäßwiderstand wird verringert. Der genaue Mechanismus der blutdrucksenkenden Wirkung von Hydrochlorothiazid ist nicht bekannt.
Thiazide beeinflussen den normalen Blutdruck nicht. Der Wirkungseintritt erfolgt innerhalb von 2 Stunden nach der Einnahme, die maximale Wirkung wird nach etwa 4 Stunden beobachtet und die Aktivität hält bis zu 24 Stunden an.
Klinische Studien
In einer 4-wöchigen, doppelblinden, placebokontrollierten Parallelgruppenstudie mit 87 Patienten zeigten Patienten, die MICROZIDE (Hydrochlorothiazid-Kapsel) erhielten, Senkungen des systolischen und diastolischen Blutdrucks im Sitzen, die signifikant stärker waren als bei Patienten, die Placebo erhielten. In veröffentlichten placebokontrollierten Studien, in denen 12,5 mg Hydrochlorothiazid mit 25 mg verglichen wurden, bewahrte die 12,5-mg-Dosis den größten Teil der Placebo-korrigierten Blutdrucksenkung, die bei 25 mg beobachtet wurde.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN und VORSICHTSMASSNAHMEN Abschnitte.