Mircette 0.15/0.02 mg Desogestrel Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Mircette 0,15 mg und wie wird es angewendet?
Mircette ist ein verschreibungspflichtiges Medikament zur Empfängnisverhütung zur Schwangerschaftsverhütung. Mircette kann allein oder mit anderen Medikamenten verwendet werden.
Mircette gehört zu einer Klasse von Arzneimitteln namens Östrogene/Gestagene; Kontrazeptiva, oral.
Es ist nicht bekannt, ob Mircette bei Kindern vor der Menarche sicher und wirksam ist.
Welche Nebenwirkungen kann Mircette haben?
Mircette kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Mircette sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Mircette. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Die Patienten sollten darauf hingewiesen werden, dass dieses Produkt nicht vor einer HIV-Infektion (AIDS) und anderen sexuell übertragbaren Krankheiten schützt.
BEZEICHNUNG
Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten bieten ein orales Kontrazeptivum mit 21 weißen runden Tabletten, die jeweils 0,15 mg Desogestrel (13-Ethyl11-Methylen-18,19-Dinor-17 Alpha-Pregn-4-en-20) enthalten -yn-17-ol), 0,02 mg Ethinylestradiol (19-nor17 alpha-pregna-1,3,5 (10)-trien-20-in-3,17-diol) und inaktive Bestandteile, die kolloidales Siliciumdioxid enthalten , Hypromellose, Lactose-Monohydrat, Polyethylenglycol, Povidon, vorverkleisterte Stärke, Stearinsäure und Vitamin E, gefolgt von 2 inerten hellgrünen runden Tabletten mit den folgenden inaktiven Bestandteilen: FD&C blue no. 1 Alulack, FD &C gelb Nr. 6 Alulack, D&C gelb Nr. 10 Aluminiumlack, Lactosemonohydrat, Magnesiumstearat, mikrokristalline Cellulose und Quellstärke. Mircette® enthält außerdem 5 gelbe runde Tabletten mit 0,01 mg Ethinylestradiol (19-nor-17 alpha-pregna-1,3,5(10)-trien-20-in3,17-diol) und inaktiven Bestandteilen, darunter kolloidales Siliciumdioxid , D&C gelb Nr. 10, Aluminiumlack, FD&C gelb Nr. 6 Aluminiumlack, Hypromellose, Lactosemonohydrat, Polyethylenglykol, Povidon, Polysorbat 80, vorgelatinierte Stärke, Stearinsäure, Titandioxid und Vitamin E. Die Molekulargewichte für Desogestrel und Ethinylestradiol betragen 310,48 bzw. 296,40. Die Strukturformeln lauten wie folgt:
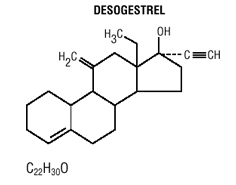
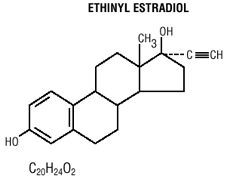
INDIKATIONEN
Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten sind angezeigt zur Verhütung einer Schwangerschaft bei Frauen, die sich dafür entscheiden, dieses Produkt als Verhütungsmethode anzuwenden.
Orale Kontrazeptiva sind hochwirksam. Tabelle II listet die typischen Raten ungewollter Schwangerschaften für Anwenderinnen von kombinierten oralen Kontrazeptiva und anderen Verhütungsmethoden auf. Die Wirksamkeit dieser Verhütungsmethoden, mit Ausnahme der Sterilisation, hängt von der Zuverlässigkeit ab, mit der sie angewendet werden. Die korrekte und konsistente Anwendung dieser Methoden kann zu niedrigeren Ausfallraten führen.
TABELLE II: Prozentsatz der Frauen, die während des ersten Jahres der typischen Anwendung und des ersten Jahres der perfekten Anwendung der Empfängnisverhütung eine ungewollte Schwangerschaft erleiden, und der Prozentsatz der fortgesetzten Anwendung am Ende des ersten Jahres, Vereinigte Staaten.
DOSIERUNG UND ANWENDUNG
Um eine maximale kontrazeptive Wirksamkeit zu erreichen, müssen Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten genau nach Anweisung und in Abständen von nicht mehr als 24 Stunden eingenommen werden. Mircette® kann entweder mit einem Start am Sonntag oder am Tag 1 begonnen werden.
HINWEIS: Jeder Zykluspackungsspender ist mit den Wochentagen, beginnend mit Sonntag, vorgedruckt, um einen Sonntagsstart zu erleichtern. Sechs verschiedene „Tagesetikettenstreifen“ werden mit jedem Zykluspackungsspender geliefert, um ein Tag-1-Startprogramm aufzunehmen. In diesem Fall sollte die Patientin den ihrem Starttag entsprechenden selbstklebenden „Tagesetikettenstreifen“ über die vorgedruckten Tage kleben.
WICHTIG: Die Möglichkeit eines Eisprungs und einer Empfängnis vor Beginn der Anwendung von Mircette® sollte in Betracht gezogen werden.
Mit der Anwendung von Mircette® zur Empfängnisverhütung kann 4 Wochen nach der Geburt bei Frauen begonnen werden, die sich dafür entscheiden, nicht zu stillen. Wenn die Tabletten während der Zeit nach der Geburt verabreicht werden, muss das erhöhte Risiko einer thromboembolischen Erkrankung im Zusammenhang mit der Zeit nach der Geburt berücksichtigt werden (siehe KONTRAINDIKATIONEN und WARNUNGEN über thromboembolische Erkrankungen. Siehe auch VORSICHTSMASSNAHMEN zum Stillende Mutter ).
Wenn die Patientin postpartal mit Mircette® beginnt und noch keine Periode hatte, sollte sie angewiesen werden, eine andere Verhütungsmethode anzuwenden, bis 7 Tage lang täglich eine weiße Tablette eingenommen wurde.
Sonntag Beginn
Bei Beginn eines sonntäglichen Behandlungsschemas sollte eine andere Verhütungsmethode bis nach den ersten 7 aufeinanderfolgenden Tagen der Anwendung angewendet werden.
Bei Sonntagsbeginn werden die Tabletten täglich ohne Unterbrechung wie folgt eingenommen: Die erste weiße Tablette sollte am ersten Sonntag nach Beginn der Menstruation eingenommen werden (bei Beginn der Menstruation am Sonntag wird die erste weiße Tablette an diesem Tag eingenommen). Eine weiße Tablette wird täglich für 21 Tage eingenommen, gefolgt von 1 hellgrünen (inaktiven) Tablette täglich für 2 Tage und 1 gelben (aktiven) Tablette täglich für 5 Tage. Für alle weiteren Zyklen beginnt der Patient dann am nächsten Tag (Sonntag) nach Einnahme der letzten gelben Tablette mit einem neuen 28-Tabletten-Regime. [Bei Umstellung von einem oralen Kontrazeptivum am Sonntag sollte die erste Tablette Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) am zweiten Sonntag nach der letzten Tablette einer 21-tägigen Behandlung oder am ersten Sonntag nach dem eingenommen werden letzte inaktive Tablette einer 28-tägigen Behandlung.]
Wenn eine Patientin 1 weiße Tablette auslässt, sollte sie die vergessene Tablette einnehmen, sobald sie sich daran erinnert. Wenn die Patientin 2 aufeinanderfolgende weiße Tabletten in Woche 1 oder Woche 2 auslässt, sollte die Patientin 2 Tabletten am Tag, an dem sie sich erinnert, und 2 Tabletten am nächsten Tag einnehmen; Danach sollte die Patientin mit der täglichen Einnahme von 1 Tablette fortfahren, bis sie die Zykluspackung beendet hat. Die Patientin sollte angewiesen werden, eine Ersatzmethode zur Empfängnisverhütung anzuwenden, wenn sie in den 7 Tagen nach dem Ausbleiben der Pillen Geschlechtsverkehr hat. Wenn der Patient 2 aufeinanderfolgende weiße Tabletten in der dritten Woche versäumt oder zu irgendeinem Zeitpunkt während des Zyklus 3 oder mehr weiße Tabletten hintereinander versäumt, sollte der Patient weiterhin täglich 1 weiße Tablette bis zum nächsten Sonntag einnehmen. Am Sonntag sollte der Patient den Rest dieser Zykluspackung entsorgen und am selben Tag mit einer neuen Zykluspackung beginnen. Die Patientin sollte angewiesen werden, eine Ersatzmethode zur Empfängnisverhütung anzuwenden, wenn sie in den 7 Tagen nach dem Ausbleiben der Pillen Geschlechtsverkehr hat.
Tag 1 Start
Wenn der erste Tag der Menstruation als „Tag 1“ gezählt wird, werden die Tabletten ohne Unterbrechung wie folgt eingenommen: Eine weiße Tablette täglich für 21 Tage, eine hellgrüne (inaktive) Tablette täglich für 2 Tage, gefolgt von 1 gelben (Ethinylestradiol) Tablette täglich Für 5 Tage. Für alle nachfolgenden Zyklen beginnt der Patient dann am nächsten Tag nach Einnahme der letzten gelben Tablette mit einer neuen 28-Tabletten-Therapie. [Wenn Sie direkt von einem anderen oralen Kontrazeptivum wechseln, sollte die erste weiße Tablette am ersten Tag der Menstruation eingenommen werden, die nach der letzten ACTIVE-Tablette des vorherigen Produkts beginnt.]
Wenn eine Patientin 1 weiße Tablette auslässt, sollte sie die vergessene Tablette einnehmen, sobald sie sich daran erinnert. Wenn die Patientin 2 aufeinanderfolgende weiße Tabletten in Woche 1 oder Woche 2 auslässt, sollte die Patientin 2 Tabletten am Tag, an dem sie sich erinnert, und 2 Tabletten am nächsten Tag einnehmen; Danach sollte die Patientin mit der täglichen Einnahme von 1 Tablette fortfahren, bis sie die Zykluspackung beendet hat. Die Patientin sollte angewiesen werden, eine Ersatzmethode zur Empfängnisverhütung anzuwenden, wenn sie in den 7 Tagen nach dem Ausbleiben der Pillen Geschlechtsverkehr hat. Wenn der Patient 2 aufeinanderfolgende weiße Tabletten in der dritten Woche auslässt oder wenn der Patient zu irgendeinem Zeitpunkt während des Zyklus 3 oder mehr weiße Tabletten hintereinander auslässt, sollte der Patient den Rest dieser Zykluspackung entsorgen und mit einer neuen Zykluspackung beginnen gleicher Tag. Die Patientin sollte angewiesen werden, eine Ersatzmethode zur Empfängnisverhütung anzuwenden, wenn sie in den 7 Tagen nach dem Ausbleiben der Pillen Geschlechtsverkehr hat.
Alle oralen Kontrazeptiva
Durchbruchblutungen, Schmierblutungen und Amenorrhoe sind häufige Gründe für das Absetzen von oralen Kontrazeptiva. Bei Durchbruchblutungen sollte wie bei allen unregelmäßigen Blutungen aus der Scheide an nicht funktionelle Ursachen gedacht werden. Bei nicht diagnostizierten anhaltenden oder wiederkehrenden abnormen Blutungen aus der Scheide sind adäquate diagnostische Maßnahmen angezeigt, um eine Schwangerschaft oder Malignität auszuschließen. Wenn sowohl eine Schwangerschaft als auch eine Pathologie ausgeschlossen wurden, kann die Zeit oder ein Wechsel zu einem anderen Präparat das Problem lösen. Die Umstellung auf ein orales Kontrazeptivum mit einem höheren Östrogengehalt ist zwar möglicherweise hilfreich zur Minimierung von Menstruationsstörungen, sollte aber nur bei Bedarf erfolgen, da dies das Risiko einer thromboembolischen Erkrankung erhöhen kann.
Anwendung von oralen Kontrazeptiva bei Ausbleiben der Monatsblutung:
WIE GELIEFERT
Mircette ® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten enthalten 21 runde weiße Tabletten, 2 runde grüne Tabletten und 5 runde gelbe Tabletten in einer Blisterkarte in einem recycelbaren Kunststoffspender. Jede weiße Tablette (geprägt mit „dp“ auf der einen Seite und „021“ auf der anderen Seite) enthält 0,15 mg Desogestrel und 0,02 mg Ethinylestradiol. Jede grüne Tablette (mit der Prägung „dp“ auf der einen Seite und „331“ auf der anderen Seite) enthält inerte Inhaltsstoffe. Jede gelbe Tablette (geprägt mit „dp“ auf der einen Seite und „457“ auf der anderen Seite) enthält 0,01 mg Ethinylestradiol.
Kisten mit 6 NDC 51285-114-58
Bei 20° bis 25°C (68° bis 77°F) lagern [Siehe USP kontrollierte Raumtemperatur ].
VERWEISE
1. Hatcher RA, Trussell J, Stewart F et al. Contraceptive Technology: Seventeenth Revised Edition, New York: Irvington Publishers, 1998, im Druck.
2. Stadel B.V. Orale Kontrazeptiva und Herz-Kreislauf-Erkrankungen. (Teil 1). N. Engl. J. Med. 1981; 305:612–618.
3. Stadel B.V. Orale Kontrazeptiva und Herz-Kreislauf-Erkrankungen. (Teil 2). N. Engl. J. Med. 1981; 305:672–677.
44. Shapiro S. Orale Kontrazeptiva – Zeit für eine Bestandsaufnahme. N. Engl. J. Med. 1987; 315:450–451.
73. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development: Orale Kontrazeptiva und das Risiko von Eierstockkrebs. JAMA 1983; 249: 1596–1599.
74. Die Krebs- und Steroidhormonstudie der Centers for Disease Control und des National Institute of Child Health and Human Development: Kombinationsgebrauch von oralen Kontrazeptiva und das Risiko von Endometriumkrebs. JAMA 1987; 257: 796–800.
75. Ory HW. Funktionelle Ovarialzysten und orale Kontrazeptiva: negative Assoziation chirurgisch bestätigt. JAMA 1974; 228:68–69.
76. Ory HW, Cole P, Macmahon B, Hoover R. Orale Kontrazeptiva und reduziertes Risiko gutartiger Brusterkrankungen. N. Engl. J. Med. 1976; 294:419–422.
77. Ory HW. Die nicht-empfängnisverhütende Gesundheit profitiert von oralen Kontrazeptiva. Fam Plann Perspect 1982; 14:182–184.
78. Ory HW, Forrest JD, Lincoln R. Entscheidungen treffen: Bewertung der gesundheitlichen Risiken und Vorteile von Verhütungsmethoden. New York, Alan Guttmacher Institut, 1983; p. 1.
90. Godsland, ich et al. Die Auswirkungen verschiedener Formulierungen oraler Kontrazeptiva auf den Fett- und Kohlenhydratstoffwechsel. N. Engl. J. Med. 1990; 323: 1375–81.
91. Kloosterboer, HJ et al. Selektivität bei der Progesteron- und Androgenrezeptorbindung von Gestagenen, die zur oralen Empfängnisverhütung verwendet werden. Empfängnisverhütung, 1988; 38:325–32.
92. Van der Vies, J. und de Visser, J. Endocrinological studies with desogestrel. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
93. Archivierte Daten, Organon Inc.
94. Fotherby, K. Orale Kontrazeptiva, Lipide und kardiovaskuläre Erkrankungen. Empfängnisverhütung, 1985; Vol. 31; 4:367–94.
95. Lawrence, DM et al. Verringerter Sexualhormon-bindender Globulinspiegel und abgeleiteter freier Testosteronspiegel bei Frauen mit schwerer Akne. Klinische Endokrinologie, 1981; 15:87–91.
96. Cullberg, G. et al. Auswirkungen einer niedrig dosierten Desogestrel-Ethinylestradiol-Kombination auf Hirsutismus, Androgene und Sexualhormon-bindendes Globulin bei Frauen mit einem polyzystischen Ovarialsyndrom. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C. und Kuhl, H. Unterschiedliche Wirkungen von zwei niedrig dosierten oralen Kontrazeptiva auf Sexualhormon-bindendes Globulin und freies Testosteron. AJOG, 1987; 156: 199–203.
98. Hammond, G. et al. Steroid-bindende Proteinkonzentrationen im Serum, Verteilung von Gestagenen und Bioverfügbarkeit von Testosteron während der Behandlung mit Verhütungsmitteln, die Desogestrel oder Levonorgestrel enthalten. Fruchtbar. Steril., 1984; 42:44–51.
99. Palatsi, R. et al. Gesamtes und ungebundenes Testosteron im Serum und Sexualhormon-bindendes Globulin (SHBG) bei weiblichen Aknepatientinnen, die mit zwei verschiedenen oralen Kontrazeptiva behandelt wurden. Acta Derm Venereol, 1984; 64:517–23.
Teva Women's Health, Inc., Tochtergesellschaft von Teva Pharmaceuticals USA, Inc. Sellersville, PA 18960. Rev. 06/2012
NEBENWIRKUNGEN
Ein erhöhtes Risiko für die folgenden schwerwiegenden Nebenwirkungen wurde mit der Anwendung oraler Kontrazeptiva in Verbindung gebracht (siehe WARNUNGEN Sektion):
Es gibt Hinweise auf einen Zusammenhang zwischen den folgenden Erkrankungen und der Anwendung oraler Kontrazeptiva:
Die folgenden Nebenwirkungen wurden bei Patienten berichtet, die orale Kontrazeptiva erhielten, und es wird angenommen, dass sie mit dem Arzneimittel in Zusammenhang stehen:
Die folgenden Nebenwirkungen wurden bei Anwenderinnen oraler Kontrazeptiva berichtet und der Zusammenhang wurde weder bestätigt noch widerlegt:
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Die gleichzeitige Anwendung von Rifampin wurde mit einer verminderten Wirksamkeit und einem erhöhten Auftreten von Durchbruchblutungen und Menstruationsunregelmäßigkeiten in Verbindung gebracht. Eine ähnliche Assoziation, wenn auch weniger ausgeprägt, wurde mit Barbituraten, Phenylbutazon, Phenytoin-Natrium, Carbamazepin und möglicherweise mit Griseofulvin, Ampicillin und Tetracyclinen vorgeschlagen (72).
Es hat sich gezeigt, dass kombinierte hormonelle Kontrazeptiva die Plasmakonzentrationen von Lamotrigin bei gleichzeitiger Anwendung signifikant verringern, wahrscheinlich aufgrund der Induktion der Lamotrigin-Glucuronidierung. Dies kann die Anfallskontrolle verringern; daher können Dosisanpassungen von Lamotrigin erforderlich sein.
Konsultieren Sie das Etikett des gleichzeitig angewendeten Arzneimittels, um weitere Informationen über Wechselwirkungen mit hormonellen Kontrazeptiva oder die Möglichkeit von Enzymveränderungen zu erhalten.
Wechselwirkungen mit Labortests
Bestimmte endokrine und Leberfunktionstests sowie Blutbestandteile können durch orale Kontrazeptiva beeinflusst werden:
WARNUNGEN
Das Rauchen von Zigaretten erhöht das Risiko schwerer kardiovaskulärer Nebenwirkungen durch die Einnahme oraler Kontrazeptiva. Dieses Risiko steigt mit dem Alter und bei starkem Rauchen (15 oder mehr Zigaretten pro Tag) und ist bei Frauen über 35 Jahren ziemlich ausgeprägt. Frauen, die orale Kontrazeptiva anwenden, sollte dringend geraten werden, nicht zu rauchen.
Die Anwendung oraler Kontrazeptiva ist mit einem erhöhten Risiko für mehrere schwerwiegende Erkrankungen verbunden, darunter Myokardinfarkt, Thromboembolie, Schlaganfall, Leberneoplasie und Gallenblasenerkrankung, obwohl das Risiko einer schweren Morbidität oder Mortalität bei gesunden Frauen ohne zugrunde liegende Risikofaktoren sehr gering ist. Das Morbiditäts- und Mortalitätsrisiko steigt signifikant in Gegenwart anderer zugrunde liegender Risikofaktoren wie Bluthochdruck, Hyperlipidämie, Fettleibigkeit und Diabetes.
Ärzte, die orale Kontrazeptiva verschreiben, sollten mit den folgenden Informationen zu diesen Risiken vertraut sein.
Die in dieser Packungsbeilage enthaltenen Informationen basieren hauptsächlich auf Studien, die an Patienten durchgeführt wurden, die orale Kontrazeptiva mit Formulierungen mit höheren Dosen von Östrogenen und Gestagenen als heute üblich angewendet haben. Die Wirkung einer Langzeitanwendung der oralen Kontrazeptiva mit Formulierungen mit niedrigeren Dosen sowohl von Östrogenen als auch von Gestagenen muss noch bestimmt werden.
In dieser Kennzeichnung gibt es zwei Arten epidemiologischer Studien: retrospektive oder Fall-Kontroll-Studien und prospektive oder Kohortenstudien. Fall-Kontroll-Studien liefern ein Maß für das relative Krankheitsrisiko, nämlich das Verhältnis der Inzidenz einer Krankheit bei Anwenderinnen oraler Kontrazeptiva zu denen bei Nichtanwenderinnen. Das relative Risiko gibt keine Auskunft über das tatsächliche klinische Auftreten einer Erkrankung. Kohortenstudien liefern ein Maß für das zurechenbare Risiko, d. h. den Unterschied in der Inzidenz von Krankheiten zwischen Anwenderinnen oraler Kontrazeptiva und Nichtanwenderinnen. Das zurechenbare Risiko gibt Auskunft über das tatsächliche Auftreten einer Krankheit in der Bevölkerung (mit Genehmigung des Autors aus Lit. 2 und 3 übernommen). Für weitere Informationen sei auf einen Text über epidemiologische Methoden verwiesen.
Thromboembolische Erkrankungen und andere Gefäßprobleme
Thromboembolie
Ein erhöhtes Risiko für thromboembolische und thrombotische Erkrankungen im Zusammenhang mit der Anwendung oraler Kontrazeptiva ist allgemein bekannt. Fall-Kontroll-Studien haben ergeben, dass das relative Risiko von Anwendern im Vergleich zu Nicht-Anwendern 3 für die erste Episode einer oberflächlichen venösen thromboembolischen Erkrankung, 4 bis 11 für tiefe Venenthrombose oder Lungenembolie und 1,5 bis 6 für Frauen mit prädisponierenden Erkrankungen für venöse Erkrankungen beträgt thromboembolische Erkrankung (2,3,19–24). Kohortenstudien haben gezeigt, dass das relative Risiko etwas geringer ist, etwa 3 für neue Fälle und etwa 4,5 für neue Fälle, die eine Krankenhauseinweisung erfordern (25). Das mit oralen Kontrazeptiva verbundene Risiko einer thromboembolischen Erkrankung hängt nicht mit der Anwendungsdauer zusammen und verschwindet, nachdem die Einnahme der Pille beendet wurde (2).
Mehrere epidemiologische Studien weisen darauf hin, dass orale Kontrazeptiva der dritten Generation, einschließlich solcher, die Desogestrel enthalten, mit einem höheren Risiko für venöse Thromboembolien verbunden sind als bestimmte orale Kontrazeptiva der zweiten Generation (102-104). Im Allgemeinen weisen diese Studien auf ein ungefähr zweifach erhöhtes Risiko hin, was 1 bis 2 zusätzlichen Fällen von venösen Thromboembolien pro 10.000 Anwendungsjahren bei Frauen entspricht. Daten aus zusätzlichen Studien haben diese zweifache Erhöhung des Risikos jedoch nicht gezeigt.
Bei der Anwendung oraler Kontrazeptiva wurde über eine zwei- bis vierfache Erhöhung des relativen Risikos postoperativer thromboembolischer Komplikationen berichtet (9,26). Das relative Risiko einer Venenthrombose bei Frauen mit prädisponierenden Erkrankungen ist doppelt so hoch wie bei Frauen ohne solche Erkrankungen (9,26). Wenn möglich, sollten orale Kontrazeptiva mindestens vier Wochen vor und zwei Wochen nach einer geplanten Operation, die mit einem erhöhten Thromboembolierisiko einhergeht, sowie während und nach längerer Ruhigstellung abgesetzt werden. Da auch das unmittelbare Wochenbett mit einem erhöhten Thromboembolierisiko einhergeht, sollte bei Frauen, die nicht stillen möchten, frühestens vier Wochen nach der Entbindung mit oralen Kontrazeptiva begonnen werden.
Herzinfarkt
Der Anwendung oraler Kontrazeptiva wurde ein erhöhtes Myokardinfarktrisiko zugeschrieben. Dieses Risiko besteht hauptsächlich bei Rauchern oder Frauen mit anderen zugrunde liegenden Risikofaktoren für koronare Herzkrankheiten wie Bluthochdruck, Hypercholesterinämie, krankhafte Fettleibigkeit und Diabetes. Das relative Herzinfarktrisiko für aktuelle Anwenderinnen oraler Kontrazeptiva wird auf zwei bis sechs geschätzt (4–10). Bei Frauen unter 30 Jahren ist das Risiko sehr gering.
Es hat sich gezeigt, dass Rauchen in Kombination mit oralen Kontrazeptiva wesentlich zur Inzidenz von Myokardinfarkten bei Frauen ab Mitte Dreißig beiträgt, wobei das Rauchen für die Mehrzahl der Überfälle verantwortlich ist (11). Es hat sich gezeigt, dass die Sterblichkeitsraten im Zusammenhang mit Kreislauferkrankungen bei Rauchern über 35 Jahren und Nichtrauchern über 40 Jahren (Tabelle III) unter Frauen, die orale Kontrazeptiva anwenden, erheblich ansteigen.
TABELLE III: MORTALITÄTSRATEN FÜR KREISLAUFKRANKHEITEN PRO 100.000 FRAUENJAHRE NACH ALTER, RAUCHERSTATUS UND VERWENDUNG VON ORALEN VERHÜTUNGSMITTELN
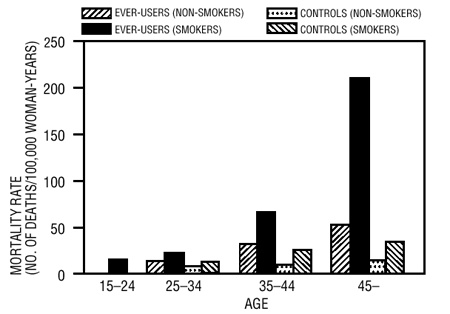
Adaptiert von PM Layde und V. Beral, ref. #12.
Orale Kontrazeptiva können die Auswirkungen bekannter Risikofaktoren wie Bluthochdruck, Diabetes, Hyperlipidämie, Alter und Fettleibigkeit verstärken (13). Insbesondere ist bekannt, dass einige Gestagene das HDL-Cholesterin senken und eine Glukoseintoleranz verursachen, während Östrogene einen Zustand des Hyperinsulinismus hervorrufen können (14–18). Es hat sich gezeigt, dass orale Kontrazeptiva den Blutdruck bei Anwenderinnen erhöhen (siehe WARNUNGEN ). Ähnliche Wirkungen auf Risikofaktoren wurden mit einem erhöhten Risiko für Herzerkrankungen in Verbindung gebracht. Orale Kontrazeptiva müssen bei Frauen mit Risikofaktoren für Herz-Kreislauf-Erkrankungen mit Vorsicht angewendet werden.
Zerebrovaskuläre Erkrankungen
Es hat sich gezeigt, dass orale Kontrazeptiva sowohl das relative als auch das zurechenbare Risiko für zerebrovaskuläre Ereignisse (thrombotische und hämorrhagische Schlaganfälle) erhöhen, obwohl das Risiko im Allgemeinen bei älteren (> 35 Jahre), hypertensiven Frauen, die auch rauchen, am größten ist. Es wurde festgestellt, dass Bluthochdruck sowohl für Benutzer als auch für Nichtbenutzer ein Risikofaktor für beide Arten von Schlaganfällen ist, während das Rauchen interagiert, um das Risiko für hämorrhagische Schlaganfälle zu erhöhen (27–29).
In einer großen Studie wurde gezeigt, dass das relative Risiko für thrombotische Schlaganfälle zwischen 3 für Benutzer mit normalem Blutdruck und 14 für Benutzer mit schwerem Bluthochdruck liegt (30). Das relative Risiko eines hämorrhagischen Schlaganfalls beträgt 1,2 für Nichtraucher, die orale Kontrazeptiva angewendet haben, 2,6 für Raucher, die keine oralen Kontrazeptiva angewendet haben, 7,6 für Raucher, die orale Kontrazeptiva angewendet haben, 1,8 für normotensive Anwenderinnen und 25,7 für Anwenderinnen mit schwerem Bluthochdruck ( 30). Auch das zurechenbare Risiko ist bei älteren Frauen größer (3).
Dosisabhängiges Risiko für Gefäßerkrankungen durch orale Kontrazeptiva
Es wurde ein positiver Zusammenhang zwischen der Östrogen- und Gestagenmenge in oralen Kontrazeptiva und dem Risiko für Gefäßerkrankungen beobachtet (31–33). Bei vielen gestagenen Mitteln wurde über eine Abnahme der High-Density-Lipoproteine (HDL) im Serum berichtet (14–16). Ein Rückgang der High-Density-Lipoproteine im Serum wurde mit einer erhöhten Inzidenz von ischämischen Herzerkrankungen in Verbindung gebracht. Da Östrogene das HDL-Cholesterin erhöhen, hängt die Nettowirkung eines oralen Kontrazeptivums von einem Gleichgewicht ab, das zwischen Östrogen- und Gestagendosen und der Art und absoluten Menge der in den Verhütungsmitteln verwendeten Gestagene erreicht wird. Die Menge beider Hormone sollte bei der Wahl eines oralen Kontrazeptivums berücksichtigt werden.
Die Minimierung der Exposition gegenüber Östrogen und Gestagen entspricht den guten Grundsätzen der Therapie. Für jede bestimmte Östrogen/Gestagen-Kombination sollte das vorgeschriebene Dosierungsschema eines sein, das die geringste Menge an Östrogen und Gestagen enthält, die mit einer niedrigen Ausfallrate und den Bedürfnissen des einzelnen Patienten vereinbar ist. Neue Akzeptoren von oralen Kontrazeptiva sollten mit Präparaten begonnen werden, die 0,035 mg oder weniger Östrogen enthalten.
Persistenz des Risikos einer Gefäßerkrankung
Es gibt zwei Studien, die ein anhaltendes Risiko für Gefäßerkrankungen bei Anwenderinnen oraler Kontrazeptiva gezeigt haben. In einer Studie in den Vereinigten Staaten besteht das Risiko, einen Myokardinfarkt zu entwickeln, nach Absetzen oraler Kontrazeptiva für mindestens 9 Jahre bei Frauen im Alter von 40 bis 49 Jahren, die fünf oder mehr Jahre lang orale Kontrazeptiva angewendet haben, aber dieses erhöhte Risiko wurde nicht nachgewiesen andere Altersgruppen (8). In einer anderen Studie in Großbritannien bestand das Risiko für die Entwicklung einer zerebrovaskulären Erkrankung mindestens 6 Jahre nach Absetzen oraler Kontrazeptiva, obwohl das Exzessrisiko sehr gering war (34). Beide Studien wurden jedoch mit Formulierungen von oralen Kontrazeptiva durchgeführt, die 50 Mikrogramm oder mehr Östrogen enthielten.
Schätzungen der Sterblichkeit durch die Verwendung von Verhütungsmitteln
Eine Studie sammelte Daten aus einer Vielzahl von Quellen, die die Sterblichkeitsrate im Zusammenhang mit verschiedenen Verhütungsmethoden in verschiedenen Altersstufen geschätzt haben (Tabelle IV). Diese Schätzungen umfassen das kombinierte Todesrisiko im Zusammenhang mit Verhütungsmethoden sowie das einer Schwangerschaft zuzurechnende Risiko im Falle eines Versagens der Methode. Jede Verhütungsmethode hat ihre spezifischen Vorteile und Risiken. Die Studie kam zu dem Schluss, dass mit Ausnahme von Anwenderinnen oraler Kontrazeptiva ab 35, die rauchen, und ab 40, die nicht rauchen, die Sterblichkeit im Zusammenhang mit allen Methoden der Empfängnisverhütung niedrig ist und unter der Geburtsrate liegt.
Die Beobachtung eines möglichen Anstiegs des Sterblichkeitsrisikos mit zunehmendem Alter für Anwenderinnen oraler Kontrazeptiva basiert auf Daten, die in den 1970er Jahren gesammelt wurden – aber erst 1983 berichtet wurden (35). Die derzeitige klinische Praxis beinhaltet jedoch die Verwendung von Formulierungen mit niedrigerem Östrogengehalt in Kombination mit einer sorgfältigen Berücksichtigung von Risikofaktoren.
Aufgrund dieser Änderungen in der Praxis und auch aufgrund einiger begrenzter neuer Daten, die darauf hindeuten, dass das Risiko von Herz-Kreislauf-Erkrankungen bei der Verwendung von oralen Kontrazeptiva jetzt geringer sein könnte als zuvor beobachtet (100,101), war das Fertility and Maternal Health Drugs Advisory Committee gebeten, das Thema 1989 zu überprüfen. Der Ausschuss kam zu dem Schluss, dass, obwohl die Risiken für Herz-Kreislauf-Erkrankungen bei der Einnahme von oralen Kontrazeptiva nach dem 40. Lebensjahr bei gesunden Nichtraucherinnen (selbst bei den neueren niedrig dosierten Formulierungen) erhöht sein können, auch größere potenzielle Gesundheitsrisiken bestehen im Zusammenhang mit einer Schwangerschaft bei älteren Frauen und mit alternativen chirurgischen und medizinischen Verfahren, die erforderlich sein können, wenn diese Frauen keinen Zugang zu wirksamen und akzeptablen Verhütungsmitteln haben.
Daher empfahl der Ausschuss, dass die Vorteile der Anwendung niedrig dosierter oraler Kontrazeptiva durch gesunde, nicht rauchende Frauen über 40 die möglichen Risiken überwiegen sollten. Natürlich sollten ältere Frauen, wie alle Frauen, die orale Kontrazeptiva einnehmen, die niedrigstmögliche Dosisformulierung einnehmen, die wirksam ist.
TABELLE IV: JÄHRLICHE ANZAHL GEBURTSBEDINGTER ODER METHODENBEZOGENER TODESFÄLLE IM ZUSAMMENHANG MIT DER KONTROLLE DER FRUCHTBARKEIT PRO 100.000 UNSTERILEN FRAUEN, NACH METHODE DER FERTILITÄTSKONTROLLE NACH ALTER
Karzinom der Fortpflanzungsorgane und der Brust
Es wurden zahlreiche epidemiologische Studien zur Inzidenz von Brust-, Gebärmutterschleimhaut-, Eierstock- und Gebärmutterhalskrebs bei Frauen durchgeführt, die orale Kontrazeptiva anwenden. Obwohl es widersprüchliche Berichte gibt, deuten die meisten Studien darauf hin, dass die Anwendung oraler Kontrazeptiva nicht mit einem allgemeinen Anstieg des Brustkrebsrisikos verbunden ist. Einige Studien haben ein erhöhtes relatives Risiko, an Brustkrebs zu erkranken, insbesondere in jüngeren Jahren, berichtet. Dieses erhöhte relative Risiko scheint mit der Anwendungsdauer zusammenzuhängen (36–43, 79–89).
Einige Studien deuten darauf hin, dass die Anwendung oraler Kontrazeptiva bei einigen Frauenpopulationen mit einem erhöhten Risiko für zervikale intraepitheliale Neoplasien verbunden ist (45–48). Es gibt jedoch weiterhin Kontroversen darüber, inwieweit solche Befunde auf Unterschiede im Sexualverhalten und andere Faktoren zurückzuführen sein könnten.
Leberneoplasie
Gutartige hepatische Adenome werden mit der Anwendung oraler Kontrazeptiva in Verbindung gebracht, obwohl die Inzidenz gutartiger Tumore in den Vereinigten Staaten selten ist. Indirekte Berechnungen haben das zurechenbare Risiko für Anwenderinnen auf 3,3 Fälle/100.000 geschätzt, ein Risiko, das nach vier oder mehr Jahren der Anwendung insbesondere bei höher dosierten oralen Kontrazeptiva zunimmt (49). Die Ruptur seltener gutartiger hepatischer Adenome kann durch intraabdominelle Blutungen zum Tod führen (50, 51).
Studien aus Großbritannien haben ein erhöhtes Risiko für die Entwicklung eines hepatozellulären Karzinoms (52–54) bei Langzeitanwenderinnen (> 8 Jahre) oraler Kontrazeptiva gezeigt. Diese Krebsarten sind jedoch in den USA äußerst selten, und das zurechenbare Risiko (die übermäßige Inzidenz) von Leberkrebs bei Anwenderinnen oraler Kontrazeptiva nähert sich weniger als einem pro Million Anwenderinnen.
Augenläsionen
Es liegen klinische Fallberichte über Netzhautthrombosen im Zusammenhang mit der Anwendung oraler Kontrazeptiva vor. Orale Kontrazeptiva sollten abgesetzt werden, wenn ein unerklärlicher teilweiser oder vollständiger Verlust des Sehvermögens auftritt; Beginn von Proptosis oder Diplopie; Papillenödem; oder Netzhautgefäßläsionen. Es sollten unverzüglich geeignete diagnostische und therapeutische Maßnahmen eingeleitet werden.
Orale Kontrazeptiva vor oder während der Frühschwangerschaft
Umfangreiche epidemiologische Studien haben kein erhöhtes Risiko für Geburtsfehler bei Frauen ergeben, die vor der Schwangerschaft orale Kontrazeptiva angewendet haben (55–57). Studien deuten auch nicht auf eine teratogene Wirkung hin, insbesondere in Bezug auf Herzanomalien und Gliedmaßenreduktionsdefekte (55, 56, 58, 59), wenn orale Kontrazeptiva versehentlich während der frühen Schwangerschaft eingenommen werden.
Die Verabreichung oraler Kontrazeptiva zur Auslösung einer Abbruchblutung sollte nicht als Schwangerschaftstest verwendet werden. Orale Kontrazeptiva sollten während der Schwangerschaft nicht zur Behandlung eines drohenden oder gewohnheitsmäßigen Schwangerschaftsabbruchs angewendet werden. Es wird empfohlen, dass bei jeder Patientin, bei der zwei aufeinanderfolgende Perioden ausgeblieben sind, eine Schwangerschaft ausgeschlossen werden sollte, bevor die orale Kontrazeption fortgesetzt wird. Wenn sich die Patientin nicht an den vorgeschriebenen Zeitplan gehalten hat, sollte die Möglichkeit einer Schwangerschaft beim ersten Ausbleiben der Periode in Betracht gezogen werden. Die Anwendung oraler Kontrazeptiva sollte unterbrochen werden, bis eine Schwangerschaft ausgeschlossen ist.
Erkrankung der Gallenblase
Frühere Studien haben ein erhöhtes lebenslanges relatives Risiko einer Gallenblasenoperation bei Anwenderinnen von oralen Kontrazeptiva und Östrogenen berichtet (60, 61). Neuere Studien haben jedoch gezeigt, dass das relative Risiko für die Entwicklung einer Gallenblasenerkrankung bei Anwenderinnen oraler Kontrazeptiva möglicherweise minimal ist (62–64). Die jüngsten Erkenntnisse über ein minimales Risiko können mit der Verwendung oraler Kontrazeptiva zusammenhängen, die niedrigere hormonelle Dosen von Östrogenen und Gestagenen enthalten.
Auswirkungen auf den Kohlenhydrat- und Fettstoffwechsel
Es hat sich gezeigt, dass orale Kontrazeptiva bei einem erheblichen Prozentsatz der Anwenderinnen zu einer Abnahme der Glukosetoleranz führen (17). Orale Kontrazeptiva, die mehr als 75 Mikrogramm Östrogen enthalten, verursachen Hyperinsulinismus, während niedrigere Östrogendosen weniger Glukoseintoleranz verursachen (65). Gestagene erhöhen die Insulinsekretion und erzeugen eine Insulinresistenz, wobei diese Wirkung bei verschiedenen gestagenen Mitteln variiert (17,66). Bei Frauen ohne Diabetes scheinen orale Kontrazeptiva jedoch keine Wirkung auf den Nüchternblutzucker zu haben (67). Aufgrund dieser nachgewiesenen Wirkungen sollten prädiabetische und diabetische Frauen während der Einnahme oraler Kontrazeptiva sorgfältig überwacht werden.
Ein kleiner Teil der Frauen wird während der Einnahme der Pille eine anhaltende Hypertriglyzeridämie haben. Wie bereits erwähnt (vgl WARNUNGEN ) wurden bei Anwenderinnen oraler Kontrazeptiva Veränderungen der Triglycerid- und Lipoproteinspiegel im Serum berichtet.
Erhöhter Blutdruck
Bei Frauen, die orale Kontrazeptiva einnehmen, wurde über einen Anstieg des Blutdrucks berichtet (68), und dieser Anstieg ist wahrscheinlicher bei älteren Anwenderinnen von oralen Kontrazeptiva (69) und bei fortgesetzter Anwendung (61). Daten des Royal College of General Practitioners (12) und anschließende randomisierte Studien haben gezeigt, dass die Inzidenz von Bluthochdruck mit steigenden Gestagenmengen zunimmt.
Frauen mit Hypertonie oder hypertoniebedingten Erkrankungen in der Vorgeschichte oder Nierenerkrankungen (70) sollten ermutigt werden, eine andere Verhütungsmethode anzuwenden. Wenn Frauen sich für die Anwendung oraler Kontrazeptiva entscheiden, sollten sie engmaschig überwacht werden, und wenn ein signifikanter Anstieg des Blutdrucks auftritt, sollten orale Kontrazeptiva abgesetzt werden. Bei den meisten Frauen normalisiert sich der erhöhte Blutdruck nach dem Absetzen oraler Kontrazeptiva (69), und es gibt keinen Unterschied im Auftreten von Bluthochdruck zwischen Immer- und Nie-Anwenderinnen (68, 70, 71).
Kopfschmerzen
Der Beginn oder die Verschlimmerung einer Migräne oder die Entwicklung von Kopfschmerzen mit einem neuen Muster, das rezidivierend, anhaltend oder schwerwiegend ist, erfordert das Absetzen von oralen Kontrazeptiva und die Abklärung der Ursache.
Blutungsunregelmäßigkeiten
Durchbruchblutungen und Schmierblutungen treten manchmal bei Patienten auf, die orale Kontrazeptiva einnehmen, insbesondere während der ersten drei Monate der Anwendung. Nicht-hormonelle Ursachen sollten in Betracht gezogen und geeignete diagnostische Maßnahmen ergriffen werden, um im Falle einer Durchbruchblutung, wie im Falle einer anormalen Vaginalblutung, eine Malignität oder Schwangerschaft auszuschließen. Wenn eine Pathologie ausgeschlossen wurde, kann das Problem mit der Zeit oder einem Wechsel zu einer anderen Formulierung gelöst werden. Bei Amenorrhoe sollte eine Schwangerschaft ausgeschlossen werden.
Bei einigen Frauen kann eine Amenorrhoe oder Oligomenorrhoe nach der Einnahme der Pille auftreten, insbesondere wenn eine solche Erkrankung bereits vorlag.
Eileiterschwangerschaft
Bei Versagen der Empfängnisverhütung kann es sowohl zu einer Eileiter- als auch zu einer intrauterinen Schwangerschaft kommen.
VORSICHTSMASSNAHMEN
Allgemein
Die Patienten sollten darauf hingewiesen werden, dass dieses Produkt nicht vor einer HIV-Infektion (AIDS) und anderen sexuell übertragbaren Krankheiten schützt.
Körperliche Untersuchung und Nachsorge
Es gehört zur guten medizinischen Praxis, dass sich alle Frauen einer jährlichen Anamnese und körperlichen Untersuchung unterziehen, einschließlich Frauen, die orale Kontrazeptiva anwenden. Die körperliche Untersuchung kann jedoch bis nach Beginn der oralen Kontrazeptiva verschoben werden, wenn die Frau dies wünscht und der Arzt dies für angemessen hält. Die körperliche Untersuchung sollte einen besonderen Hinweis auf Blutdruck, Brust, Bauch und Beckenorgane, einschließlich zervikaler Zytologie, und relevante Labortests beinhalten. Bei nicht diagnostizierten, anhaltenden oder wiederkehrenden abnormalen vaginalen Blutungen sollten geeignete Maßnahmen zum Ausschluss einer Malignität ergriffen werden. Frauen mit einer starken familiären Vorgeschichte von Brustkrebs oder mit Brustknoten sollten besonders sorgfältig überwacht werden.
Lipidstörungen
Frauen, die wegen Hyperlipidämie behandelt werden, sollten engmaschig überwacht werden, wenn sie sich für die Anwendung oraler Kontrazeptiva entscheiden. Einige Gestagene können den LDL-Spiegel erhöhen und die Kontrolle von Hyperlipidämien erschweren.
Leberfunktion
Wenn sich bei einer Frau, die solche Medikamente erhält, Gelbsucht entwickelt, sollte das Medikament abgesetzt werden. Steroidhormone können bei Patienten mit eingeschränkter Leberfunktion schlecht metabolisiert werden.
Flüssigkeitsretention
Orale Kontrazeptiva können zu einem gewissen Grad an Flüssigkeitsretention führen. Sie sollten Patienten mit Erkrankungen, die durch Flüssigkeitsretention verschlimmert werden können, mit Vorsicht und nur unter sorgfältiger Überwachung verschrieben werden.
Emotionale Störungen
Frauen mit Depressionen in der Vorgeschichte sollten sorgfältig überwacht und das Medikament abgesetzt werden, wenn die Depression in schwerwiegendem Ausmaß wiederkehrt.
Kontaktlinsen
Kontaktlinsenträger, die visuelle Veränderungen oder Veränderungen der Linsenverträglichkeit entwickeln, sollten von einem Augenarzt untersucht werden.
Karzinogenese
Sehen WARNUNGEN Sektion.
Schwangerschaft
Schwangerschaftskategorie X (vgl KONTRAINDIKATIONEN und WARNUNGEN Abschnitte).
Stillende Mutter
In der Milch stillender Mütter wurden geringe Mengen von Steroiden zur oralen Empfängnisverhütung festgestellt, und es wurde über einige unerwünschte Wirkungen auf das Kind berichtet, einschließlich Gelbsucht und Brustvergrößerung. Darüber hinaus können orale Kontrazeptiva, die nach der Geburt verabreicht werden, die Laktation beeinträchtigen, indem sie die Menge und Qualität der Muttermilch verringern. Wenn möglich, sollte der stillenden Mutter geraten werden, keine oralen Kontrazeptiva zu verwenden, sondern andere Formen der Empfängnisverhütung anzuwenden, bis sie ihr Kind vollständig abgestillt hat.
Verwendung in der Pädiatrie
Sicherheit und Wirksamkeit von Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten wurden bei Frauen im gebärfähigen Alter untersucht. Es wird erwartet, dass Sicherheit und Wirksamkeit für postpubertäre Jugendliche unter 16 Jahren und für Anwender ab 16 Jahren gleich sind. Die Anwendung dieses Produkts vor der Menarche ist nicht angezeigt.
Informationen für den Patienten
Sehen Patientenkennzeichnung
VERWEISE
1. Hatcher RA, Trussell J, Stewart F et al. Contraceptive Technology: Seventeenth Revised Edition, New York: Irvington Publishers, 1998, im Druck.
2. Stadel B.V. Orale Kontrazeptiva und Herz-Kreislauf-Erkrankungen. (Teil 1). N. Engl. J. Med. 1981; 305:612–618.
3. Stadel B.V. Orale Kontrazeptiva und Herz-Kreislauf-Erkrankungen. (Teil 2). N. Engl. J. Med. 1981; 305:672–677.
4. Adam SA, Thorogood M. Orale Kontrazeption und Myokardinfarkt revisited: die Auswirkungen neuer Präparate und Verschreibungsmuster. Br. J. Obstet und Gynecol 1981; 88:838–845.
5. Mann JI, Inman WH. Orale Kontrazeptiva und Tod durch Myokardinfarkt. Br Med J 1975; 2(5965):245–248.
6. Mann JI, Vessey MP, Thorogood M, Doll R. Myokardinfarkt bei jungen Frauen unter besonderer Berücksichtigung oraler Kontrazeptiva. Br Med J 1975; 2(5956):241–245.
7. Orale Kontrazeptionsstudie des Royal College of General Practitioners: Weitere Analysen der Sterblichkeit bei Anwenderinnen oraler Kontrazeptiva. Lancet 1981; 1:541–546.
8. D. Slone, S. Shapiro, D. W. Kaufman, L. Rosenberg, OS Miettinen, PD Stolley. Risiko eines Myokardinfarkts in Bezug auf die aktuelle und abgesetzte Anwendung von oralen Kontrazeptiva. N. Engl. J. Med. 1981; 305:420–424.
9. Vessey MP. Weibliche Hormone und Gefäßerkrankungen – ein epidemiologischer Überblick. Br J Fam. Plann 1980; 6:1–12.
10. Russell-Briefel RG, Ezzati TM, Fulwood R, Perlman JA, Murphy RS. Kardiovaskulärer Risikostatus und orale Kontrazeptiva, USA, 1976–80. Prevent Med 1986; 15:352–362.
11. Goldbaum GM, Kendrick JS, Hogelin GC, Gentry EM. Die relativen Auswirkungen des Rauchens und der Einnahme von oralen Kontrazeptiva auf Frauen in den Vereinigten Staaten. JAMA 1987; 258: 1339–1342.
12. Layde PM, Beral V. Weitere Analysen der Sterblichkeit bei Anwenderinnen oraler Kontrazeptiva: Royal College General Practitioners' Oral Contraception Study. (Tabelle 5) Lancet 1981; 1:541–546.
13. Knopp RH. Arteriosklerose-Risiko: Die Rolle von oralen Kontrazeptiva und postmenopausalen Östrogenen. J Reprod Med 1986; 31(9) (Ergänzung):913–921.
14. Krauss RM, Roy S, Mishell DR, Casagrande J, Pike MC. Auswirkungen von zwei niedrig dosierten oralen Kontrazeptiva auf Serumlipide und Lipoproteine: Unterschiedliche Veränderungen in Unterklassen von Lipoproteinen hoher Dichte. Am J Obstet 1983; 145:446–452.
15. P. Wahl, C. Walden, R. Knopp, J. Hoover, R. Wallace, G. Heiss, B. Rifkind. Wirkung der Östrogen-/Gestagenpotenz auf das Lipid-/Lipoproteincholesterin. N. Engl. J. Med. 1983; 308:862–867.
16. Wynn V, Niththyananthan R. Die Wirkung von Gestagen in kombinierten oralen Kontrazeptiva auf Serumlipide unter besonderer Berücksichtigung von Lipoproteinen hoher Dichte. Am J Obstet Gynecol 1982; 142: 766–771.
17. Wynn V, Godsland I. Auswirkungen von oralen Kontrazeptiva und Kohlenhydratstoffwechsel. J Reprod Med 1986; 31 (9) (Ergänzung):892–897.
18. LaRosa JC. Atherosklerotische Risikofaktoren bei Herz-Kreislauf-Erkrankungen. J Reprod Med 1986; 31 (9) (Ergänzung):906–912.
19. Inman WH, Vessey MP. Untersuchung des Todes durch pulmonale, koronare und zerebrale Thrombosen und Embolien bei Frauen im gebärfähigen Alter. Br Med J 1968; 2 (5599): 193–199.
20. Maguire MG, Tonascia J., Sartwell PE, Stolley PD, Tockman MS. Erhöhtes Thromboserisiko durch orale Kontrazeptiva: ein weiterer Bericht. Am J Epidemiol 1979; 110 (2): 188–195.
21. Pettiti DB, Wingerd J, Pellegrin F, Ramacharan S. Risiko von Gefäßerkrankungen bei Frauen: Rauchen, orale Kontrazeptiva, nicht empfängnisverhütende Östrogene und andere Faktoren. JAMA 1979; 242: 1150–1154.
22. Vessey MP, Doll R. Untersuchung der Beziehung zwischen der Verwendung von oralen Kontrazeptiva und thromboembolischen Erkrankungen. Br Med J 1968; 2 (5599): 199–205.
23. Vessey MP, Doll R. Untersuchung der Beziehung zwischen der Verwendung von oralen Kontrazeptiva und thromboembolischen Erkrankungen. Ein weiterer Bericht. Br Med J 1969; 2 (5658):651–657.
24. Porter JB, Hunter JR, Danielson DA, Jick H, Stergachis A. Orale Kontrazeptiva und nicht tödliche Gefäßerkrankungen – aktuelle Erfahrungen. Obstet Gynecol 1982; 59 (3): 299–302.
25. Vessey M, Doll R, Peto R, Johnson B, Wiggins P. Eine Langzeit-Follow-up-Studie von Frauen, die verschiedene Verhütungsmethoden anwenden: ein Zwischenbericht. Biosocial Science 1976; 8:375–427.
26. Royal College of General Practitioners: Orale Kontrazeptiva, Venenthrombose und Krampfadern. J Royal Coll Gen Pract 1978; 28:393–399.
27. Collaborative Group for the Study of Stroke in Young Women: Orale Kontrazeption und erhöhtes Risiko für zerebrale Ischämie oder Thrombose. N. Engl. J. Med. 1973; 288:871–878.
28. Petitti DB, Wingerd J. Verwendung von oralen Kontrazeptiva, Zigarettenrauchen und das Risiko einer Subarachnoidalblutung. Lancet 1978; 2:234–236.
29. Inman WH. Orale Kontrazeptiva und tödliche Subarachnoidalblutung. Br Med J 1979; 2 (6203): 1468–70.
30. Collaborative Group for the Study of Stroke in Young Women: Orale Kontrazeptiva und Schlaganfall bei jungen Frauen: assoziierte Risikofaktoren. JAMA 1975; 231: 718–722.
31. Inman WH, Vessey MP, Westerholm B, Engelund A. Thromboembolische Erkrankung und der Steroidgehalt oraler Kontrazeptiva. Ein Bericht an den Ausschuss für Arzneimittelsicherheit. Br Med J 1970; 2:203–209.
32. Meade TW, Greenberg G, Thompson SG. Gestagene und kardiovaskuläre Reaktionen im Zusammenhang mit oralen Kontrazeptiva und ein Vergleich der Sicherheit von 50- und 35-µg-Östrogenpräparaten. Br Med J 1980; 280 (6224): 1157–1161.
33. Kay CR. Gestagene und arterielle Erkrankungen – Beweise aus der Studie des Royal College of General Practitioners. Am J Obstet Gynecol 1982; 142: 762–765.
34. Royal College of General Practitioners: Inzidenz arterieller Erkrankungen bei Anwenderinnen oraler Kontrazeptiva. J Royal Coll Gen Pract 1983; 33:75–82.
35. Ory HW. Sterblichkeit im Zusammenhang mit Fertilität und Fertilitätskontrolle: 1983. Family Planning Perspectives 1983; 15:50–56.
36. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development: Oral-contraceptive use and the risk of breast cancer. N. Engl. J. Med. 1986; 315:405–411.
37. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Brustkrebsrisiko bei jungen Frauen und Anwendung oraler Kontrazeptiva: Mögliche modifizierende Wirkung der Formulierung und des Alters bei der Anwendung. Lancet 1983; 2:926–929.
38. Paul C, Skegg DG, Spears GFS, Kaldor JM. Orale Kontrazeptiva und Brustkrebs: Eine nationale Studie. Br Med J 1986; 293: 723–725.
39. Miller DR, Rosenberg L, Kaufman DW, Schottenfeld D, Stolley PD, Shapiro S. Brustkrebsrisiko in Bezug auf den frühen Einsatz oraler Kontrazeptiva. Obstet Gynecol 1986; 68:863–868.
40. Olson H, Olson KL, Moller TR, Ranstam J, Holm P. Orale Kontrazeptiva und Brustkrebs bei jungen Frauen in Schweden (Brief). Lancet 1985; 2:748–749.
41. McPherson K, Vessey M, Neil A, Doll R, Jones L, Roberts M. Früher Gebrauch von Kontrazeptiva und Brustkrebs: Ergebnisse einer weiteren Fall-Kontroll-Studie. Br. J. Cancer 1987; 56:653–660
42. Huggins GR, Zucker PF. Orale Kontrazeptiva und Neoplasien: Aktualisierung 1987. Fertil Steril 1987; 47:733–761.
43. McPherson K., Drife JO. Pille und Brustkrebs: Warum die Unsicherheit? Br Med J 1986; 293: 709–710.
45. Ory H, Naib Z, Conger SB, Hatcher RA, Tyler CW. Verhütungswahl und Prävalenz von zervikaler Dysplasie und Carcinoma in situ. Am J Obstet Gynecol 1976; 124:573–577.
46. Vessey MP, Lawless M, McPherson K, Yeates D. Neoplasie des Gebärmutterhalses und Empfängnisverhütung: eine mögliche Nebenwirkung der Pille. Lancet 1983; 2:930.
47. Brinton LA, Huggins GR, Lehman HF, Malli K, Savitz DA, Trapido E, Rosenthal J, Hoover R. Langfristige Anwendung oraler Kontrazeptiva und Risiko eines invasiven Gebärmutterhalskrebses. Int. J. Cancer 1986; 38:339–344.
48. WHO-Kollaborationsstudie zu Neoplasien und Steroid-Kontrazeptiva: Invasiver Gebärmutterhalskrebs und kombinierte orale Kontrazeptiva. Br Med J 1985; 209:961–965.
49. Rooks JB, Ory HW, Ishak KG, Strauss LT, Greenspan JR, Hill AP, Tyler CW. Epidemiologie des hepatozellulären Adenoms: die Rolle der oralen Kontrazeptiva. JAMA 1979; 242: 644–648.
50. Bein NN, Goldschmied HS. Wiederkehrende massive Blutungen aus gutartigen Lebertumoren infolge oraler Kontrazeptiva. Br. J. Surg. 1977; 64:433–435.
51. Klatskin G. Lebertumoren: mögliche Beziehung zur Verwendung von oralen Kontrazeptiva. Gastroenterologie 1977; 73:386–394.
52. Henderson BE, Preston-Martin S., Edmondson HA, Peters RL, Pike MC. Hepatozelluläres Karzinom und orale Kontrazeptiva. Br. J. Cancer 1983; 48:437–440.
53. Neuberger J, Forman D, Doll R, Williams R. Orale Kontrazeptiva und hepatozelluläres Karzinom. Br Med J 1986; 292: 1355–1357.
54. Forman D, Vincent TJ, Doll R. Leberkrebs und orale Kontrazeptiva. Br Med J 1986; 292:1357–1361.
55. Harlap S, Eldor J. Geburten nach Versagen oraler Kontrazeptiva. Obstet Gynecol 1980; 55:447–452.
56. Savolainen E, Saksela E, Saxen L. Teratogene Gefahren oraler Kontrazeptiva, analysiert in einem nationalen Fehlbildungsregister. Am J Obstet Gynecol 1981; 140:521–524.
57. Janerich DT, Piper JM, Glebatis DM. Orale Kontrazeptiva und Geburtsfehler. Am J Epidemiol 1980; 112:73–79.
58. Ferencz C, Matanoski GM, Wilson PD, Rubin JD, Neill CA, Gutberlet R. Mütterliche Hormontherapie und angeborene Herzfehler. Teratologie 1980; 21:225–239.
59. Rothman KJ, Fyler DC, Goldbatt A, Kreidberg MB. Exogene Hormone und andere Arzneimittelexpositionen von Kindern mit angeborenen Herzfehlern. Am J Epidemiol 1979; 109:433–439.
60. Boston Collaborative Drug Surveillance Program: Orale Kontrazeptiva und venöse thromboembolische Erkrankungen, chirurgisch bestätigte Erkrankungen der Gallenblase und Brusttumore. Lancet 1973; 1: 1399–1404.
61. Royal College of General Practitioners: Orale Kontrazeptiva und Gesundheit. New York, Pittmann, 1974.
62. Layde PM, Vessey MP, Yeates D. Risiko einer Gallenblasenerkrankung: eine Kohortenstudie mit jungen Frauen, die Kliniken für Familienplanung besuchten. J Epidemiol Community Health 1982; 36:274–278.
63. Rome Group for the Epidemiology and Prevention of Cholelithiasis (GREPCO): Prävalenz der Gallensteinerkrankung in einer italienischen erwachsenen weiblichen Bevölkerung. Am J Epidemiol 1984; 119: 796–805.
64. Strom BL, Tamragouri RT, Morse ML, Lazar EL, West SL, Stolley PD, Jones JK. Orale Kontrazeptiva und andere Risikofaktoren für Erkrankungen der Gallenblase. Clin Pharmacol. Ther 1986; 39:335–341.
65. Wynn V, Adams PW, Godsland IF, Melrose J, Niththyananthan R, Oakley NW, Seedj A. Vergleich der Wirkungen verschiedener kombinierter oraler Kontrazeptivum-Formulierungen auf den Kohlenhydrat- und Lipidstoffwechsel. Lancet 1979; 1:1045–1049.
66. Wynn V. Wirkung von Progesteron und Gestagenen auf den Kohlenhydratstoffwechsel. In Progesteron und Progestin. Herausgegeben von Bardin CW, Milgrom E, Mauvis-Jarvis P. New York, Raven Press, 1983, S. 395–410.
67. Perlman JA, Roussell-Briefel RG, Ezzati TM, Lieberknecht G. Orale Glukosetoleranz und die Potenz oraler kontrazeptiver Gestagene. J Chronic Dis 1985; 38:857–864.
68. Royal College of General Practitioners' Oral Contraception Study: Wirkung von Gestagenkomponenten in kombinierten oralen Kontrazeptiva auf Bluthochdruck und gutartige Brusterkrankungen. Lancet 1977;
69. Fisch IR, Frank J. Orale Kontrazeptiva und Blutdruck. JAMA 1977; 237:2499–2503.
70. Laragh AJ. Durch orale Kontrazeptiva induzierter Bluthochdruck – neun Jahre später. Am J Obstet Gynecol 1976; 126:141–147.
71. Ramcharan S, Peritz E, Pellegrin FA, Williams WT. Inzidenz von Bluthochdruck in der Kohorte der Walnut Creek Contraceptive Drug Study. In der Pharmakologie von Steroid-Kontrazeptiva. Garattini S, Berendes HW. Hrsg. New York, Raven Press, 1977, S. 277–288. (Monographien des Mario Negri Institute for Pharmacological Research, Mailand).
73. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development: Orale Kontrazeptiva und das Risiko von Eierstockkrebs. JAMA 1983; 249: 1596–1599.
79. Schlesselman J, Stadel BV, Murray P, Lai S. Breast Cancer in Relation to Early Use of Oral Contraceptives 1988; 259: 1828–1833.
80. Hennekens CH, Speizer FE, Lipnick RJ, Rosner B, Bain C, Belanger C, Stampfer MJ, Willett W, Peto R. Eine fallkontrollierte Studie zur Anwendung oraler Kontrazeptiva und Brustkrebs. JNCI 1984; 72:39–42.
81. LaVecchia C, Decarli A, Fasoli M, Franceschi S, Gentile A, Negri E, Parazzini F, Tognoni G. Orale Kontrazeptiva und Krebserkrankungen der Brust und des weiblichen Genitaltrakts. Zwischenergebnisse einer Fall-Kontroll-Studie. Br. J. Cancer 1986; 54:311–317.
82. Meirik O, Lund E, Adami H, Bergstrom R, Christoffersen T, Bergsjo P. Orale Kontrazeptiva bei Brustkrebs bei jungen Frauen. Eine gemeinsame nationale Fallkontrollstudie in Schweden und Norwegen. Lancet 1986; 11:650–654.
83. Kay CR, Hannaford PC. Brustkrebs und die Pille – Ein weiterer Bericht aus der Studie zur oralen Empfängnisverhütung des Royal College of General Practitioners. Br. J. Cancer 1988; 58:675–680.
84. Stadel BV, Lai S, Schlesselman JJ, Murray P. Orale Kontrazeptiva und prämenopausaler Brustkrebs bei Nulliparen. Empfängnisverhütung 1988; 38:287–299.
85. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Brustkrebs vor dem 45. Lebensjahr und orale Kontrazeptiva: Neue Erkenntnisse. Bin. J. Epidemiol 1989; 129:269–280.
86. The UK National Case-Control Study Group, Oral contraceptive use and breast cancer risk in young women. Lancet 1989; 1:973–982.
87. Schlesselman JJ. Krebs der Brust und der Fortpflanzungsorgane im Zusammenhang mit oralen Kontrazeptiva. Empfängnisverhütung 1989; 40:1–38.
88. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Orale Kontrazeptiva und Brustkrebs: neueste Ergebnisse einer großen Kohortenstudie. Br. J. Cancer 1989; 59:613–617.
89. Jick SS, Walker AM, Stergachis A, Jick H. Orale Kontrazeptiva und Brustkrebs. Br. J. Cancer 1989; 59:618–621.
100. Porter JB, Hunter J, Jick H et al. Orale Kontrazeptiva und nicht tödliche Gefäßerkrankungen. Obstet Gynecol 1985; 66:1–4.
101. Porter JB, Jick H, Walker AM. Sterblichkeit bei Anwenderinnen oraler Kontrazeptiva. Obstet Gynecol 1987; 7029–32.
102. Jick H, Jick SS, Gurewich V, Myers MW, Vasilakis C. Risiko eines idiopathischen kardiovaskulären Todes und einer nicht tödlichen venösen Thromboembolie bei Frauen, die orale Kontrazeptiva mit unterschiedlichen Gestagenkomponenten anwenden. Lancet, 1995; 346: 1589–93.
103. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Wirkung verschiedener Gestagene in oralen Kontrazeptiva mit niedrigem Östrogengehalt auf venöse thromboembolische Erkrankungen. Lancet, 1995; 346: 1582–88.
104. Spitzer WO, Lewis MA, Heinemann LAJ, Thorogood M, MacRae KD im Auftrag der Transnational Research Group on Oral Contraceptives and Health of Young Women. Orale Kontrazeptiva der dritten Generation und das Risiko venöser thromboembolischer Erkrankungen: Eine internationale Fall-Kontroll-Studie. Br Med J, 1996; 312:83–88.
105. Christensen J., Petrenaite V., Atterman J., et al. Orale Kontrazeptiva induzieren den Metabolismus von Lamotrigin: Beweise aus einer doppelblinden, Placebo-kontrollierten Studie. Epilepsie 2007;48(3):484-489.
ÜBERDOSIS
Nach akuter Einnahme hoher Dosen oraler Kontrazeptiva durch Kleinkinder wurden keine schwerwiegenden Nebenwirkungen berichtet. Eine Überdosierung kann Übelkeit verursachen und bei Frauen können Entzugsblutungen auftreten.
Nicht-empfängnisverhütende gesundheitliche Vorteile
Die folgenden nicht-empfängnisverhütenden gesundheitlichen Vorteile im Zusammenhang mit der Anwendung oraler Kontrazeptiva werden durch epidemiologische Studien gestützt, die weitgehend Formulierungen oraler Kontrazeptiva verwendeten, die Östrogendosen von mehr als 0,035 mg Ethinylestradiol oder 0,05 mg Mestranol enthielten (73–78).
Auswirkungen auf die Menstruation
Wirkungen im Zusammenhang mit der Hemmung des Eisprungs
Auswirkungen bei Langzeitanwendung
KONTRAINDIKATIONEN
Orale Kontrazeptiva sollten nicht bei Frauen angewendet werden, die derzeit folgende Erkrankungen haben:
KLINISCHE PHARMAKOLOGIE
Kombinierte orale Kontrazeptiva wirken durch Unterdrückung von Gonadotropinen. Obwohl der primäre Mechanismus dieser Wirkung die Hemmung des Eisprungs ist, umfassen andere Veränderungen Veränderungen des Zervixschleims (die den Eintritt der Spermien in die Gebärmutter erschweren) und des Endometriums (die die Wahrscheinlichkeit einer Einnistung verringern).
Rezeptorbindungsstudien sowie Studien an Tieren haben gezeigt, dass Etonogestrel, der biologisch aktive Metabolit von Desogestrel, eine hohe progestationale Aktivität mit minimaler intrinsischer Androgenität kombiniert (91,92). Die Relevanz dieses letztgenannten Befundes beim Menschen ist nicht bekannt.
Pharmakokinetik
Absorption
Desogestrel wird schnell und fast vollständig resorbiert und in Etonogestrel, seinen biologisch aktiven Metaboliten, umgewandelt. Nach oraler Verabreichung beträgt die relative Bioverfügbarkeit von Desogestrel im Vergleich zu einer Lösung, gemessen anhand der Etonogestrel-Serumspiegel, etwa 100 %. Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol)-Tabletten bieten zwei unterschiedliche Behandlungen mit Ethinylestradiol; 0,02 mg in der Kombinationstablette [weiß] sowie 0,01 mg in der gelben Tablette. Ethinylestradiol wird schnell und fast vollständig resorbiert. Nach einer Einzeldosis Mircette® Kombinationstablette [weiß] beträgt die relative Bioverfügbarkeit von Ethinylestradiol ungefähr 93 %, während die relative Bioverfügbarkeit der 0,01-mg-Tablette [gelb] 99 % beträgt. Die Wirkung von Nahrungsmitteln auf die Bioverfügbarkeit von Mircette®-Tabletten nach oraler Verabreichung wurde nicht untersucht.
Die Pharmakokinetik von Etonogestrel und Ethinylestradiol nach mehrfacher Gabe von Mircette®-Tabletten wurde während des dritten Zyklus bei 17 Probanden bestimmt. Die Plasmakonzentrationen von Etonogestrel und Ethinylestradiol erreichten an Tag 21 den Steady-State. Die AUC(0–24) für Etonogestrel im Steady-State an Tag 21 war etwa 2,2-mal höher als die AUC(0–24) an Tag 1 des dritten Zyklus . Die pharmakokinetischen Parameter von Etonogestrel und Ethinylestradiol während des dritten Zyklus nach Verabreichung mehrerer Dosen von Mircette®-Tabletten sind in Tabelle I zusammengefasst.
TABELLE I: MITTLERE (SD) PHARMAKOKINETISCHE PARAMETER VON Mircette® ÜBER EINEN 28-TÄGIGEN DOSIERUNGSZEITRAUM IM DRITTEN ZYKLUS (n=17).
Verteilung
Es wurde festgestellt, dass Etonogestrel, der aktive Metabolit von Desogestrel, zu 99 % an Protein gebunden ist, hauptsächlich an Sexualhormon-bindendes Globulin (SHBG). Ethinylestradiol ist zu etwa 98,3 % hauptsächlich an Plasmaalbumin gebunden. Ethinylestradiol bindet nicht an SHBG, induziert aber die SHBG-Synthese. Desogestrel in Kombination mit Ethinylestradiol wirkt dem Östrogen-induzierten Anstieg von SHBG nicht entgegen, was zu niedrigeren Serumspiegeln von freiem Testosteron führt (96–99).
Stoffwechsel
Desogestrel:
Desogestrel wird schnell und vollständig durch Hydroxylierung in der Darmschleimhaut und bei der ersten Passage durch die Leber zu Etonogestrel metabolisiert. Andere Metaboliten (dh 3α-OH-Desogestrel, 3β-OH-Desogestrel und 3α-OH-5α-H-Desogestrel) ohne pharmakologische Wirkungen wurden ebenfalls identifiziert und diese Metaboliten können einer Glucuronid- und Sulfat-Konjugation unterliegen.
Ethinylestradiol:
Ethinylestradiol unterliegt in erheblichem Maße einer präsystemischen Konjugation (Phase-II-Stoffwechsel). Ethinylestradiol, das aus der Darmwandkonjugation austritt, durchläuft einen Phase-I-Metabolismus und eine hepatische Konjugation (Phase-II-Metabolismus). Hauptmetaboliten der Phase I sind 2-OH-Ethinylestradiol und 2-Methoxyethinylestradiol. Sulfat- und Glucuronidkonjugate von Ethinylestradiol und Phase-I-Metaboliten, die in die Galle ausgeschieden werden, können einen enterohepatischen Kreislauf durchlaufen.
Ausscheidung
Etonogestrel und Ethinylestradiol werden im Urin, in der Galle und im Stuhl ausgeschieden. Im Steady State an Tag 21 beträgt die Eliminationshalbwertszeit von Etonogestrel 27,8 ± 7,2 Stunden und die Eliminationshalbwertszeit von Ethinylestradiol für die Kombinationstablette 23,9 ± 25,5 Stunden. Für die Ethinylestradiol-Tablette mit 0,01 mg [gelb] beträgt die Eliminationshalbwertszeit im Steady State an Tag 28 18,9 ± 8,3 Stunden.
Besondere Populationen
Wettrennen
Es liegen keine Informationen zur Bestimmung des Einflusses der ethnischen Zugehörigkeit auf die Pharmakokinetik von Mircette® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten vor.
Leberinsuffizienz
Es wurden keine formellen Studien durchgeführt, um die Wirkung einer Lebererkrankung auf die Disposition von Mircette® zu bewerten.
Niereninsuffizienz
Es wurden keine formellen Studien durchgeführt, um die Auswirkung einer Nierenerkrankung auf die Disposition von Mircette® zu bewerten.
Arzneimittelwechselwirkungen
Wechselwirkungen zwischen Desogestrel/Ethinylestradiol und anderen Arzneimitteln wurden in der Literatur beschrieben. Es wurden keine formellen Arzneimittelwechselwirkungsstudien durchgeführt (siehe VORSICHTSMASSNAHMEN Sektion).
VERWEISE
90. Godsland, ich et al. Die Auswirkungen verschiedener Formulierungen oraler Kontrazeptiva auf den Fett- und Kohlenhydratstoffwechsel. N. Engl. J. Med. 1990; 323: 1375–81.
91. Kloosterboer, HJ et al. Selektivität bei der Progesteron- und Androgenrezeptorbindung von Gestagenen, die zur oralen Empfängnisverhütung verwendet werden. Empfängnisverhütung, 1988; 38:325–32.
92. Van der Vies, J. und de Visser, J. Endocrinological studies with desogestrel. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
96. Cullberg, G. et al. Auswirkungen einer niedrig dosierten Desogestrel-Ethinylestradiol-Kombination auf Hirsutismus, Androgene und Sexualhormon-bindendes Globulin bei Frauen mit einem polyzystischen Ovarialsyndrom. Acta Obstet Gynecol Scand, 1985; 64:195–202.
97. Jung-Hoffmann, C. und Kuhl, H. Unterschiedliche Wirkungen von zwei niedrig dosierten oralen Kontrazeptiva auf Sexualhormon-bindendes Globulin und freies Testosteron. AJOG, 1987; 156: 199–203.
98. Hammond, G. et al. Steroid-bindende Proteinkonzentrationen im Serum, Verteilung von Gestagenen und Bioverfügbarkeit von Testosteron während der Behandlung mit Verhütungsmitteln, die Desogestrel oder Levonorgestrel enthalten. Fruchtbar. Steril., 1984; 42:44–51.
99. Palatsi, R. et al. Gesamtes und ungebundenes Testosteron im Serum und Sexualhormon-bindendes Globulin (SHBG) bei weiblichen Aknepatientinnen, die mit zwei verschiedenen oralen Kontrazeptiva behandelt wurden. Acta Derm Venereol, 1984; 64:517–23.
INFORMATIONEN ZUM PATIENTEN
Mircette ® (Desogestrel/Ethinylestradiol und Ethinylestradiol) Tabletten
Dieses Produkt soll (wie alle oralen Kontrazeptiva) eine Schwangerschaft verhindern. Es schützt nicht vor einer HIV-Infektion (AIDS) und anderen sexuell übertragbaren Krankheiten.
BITTE BEACHTEN SIE: Diese Kennzeichnung wird von Zeit zu Zeit überarbeitet, wenn wichtige neue medizinische Informationen verfügbar werden. Bitte prüfen Sie daher diese Kennzeichnung sorgfältig.
BEZEICHNUNG
Das folgende orale Kontrazeptivum enthält eine Kombination aus einem Gestagen und Östrogen, den beiden Arten weiblicher Hormone:
Jede weiße Tablette enthält 0,15 mg Desogestrel und 0,02 mg Ethinylestradiol. Jede hellgrüne Tablette enthält inerte Inhaltsstoffe und jede gelbe Tablette enthält 0,01 mg Ethinylestradiol.
EINLEITUNG
Jede Frau, die erwägt, orale Kontrazeptiva (die Antibabypille oder die Pille) zu verwenden, sollte die Vorteile und Risiken dieser Form der Empfängnisverhütung verstehen. Diese Packungsbeilage gibt Ihnen viele der Informationen, die Sie benötigen, um diese Entscheidung zu treffen, und hilft Ihnen auch dabei, festzustellen, ob bei Ihnen das Risiko besteht, eine der schwerwiegenden Nebenwirkungen der Pille zu entwickeln. Es wird Ihnen sagen, wie Sie die Pille richtig anwenden, damit sie so effektiv wie möglich ist. Diese Packungsbeilage ist jedoch kein Ersatz für ein sorgfältiges Gespräch zwischen Ihnen und Ihrem Arzt oder Gesundheitsdienstleister. Sie sollten die Informationen in dieser Packungsbeilage mit ihm oder ihr besprechen, sowohl wenn Sie mit der Einnahme der Pille beginnen, als auch während Ihrer erneuten Besuche. Befolgen Sie auch während der Einnahme der Pille den Rat Ihres Arztes oder Gesundheitsdienstleisters bezüglich regelmäßiger Kontrolluntersuchungen.
WIRKSAMKEIT VON ORALEN VERHÜTUNGSMITTELN
Orale Kontrazeptiva oder „Antibabypillen“ oder „die Pille“ werden verwendet, um eine Schwangerschaft zu verhindern, und sind wirksamer als andere nicht-chirurgische Methoden der Empfängnisverhütung. Bei richtiger Einnahme beträgt die Chance schwanger zu werden weniger als 1% (1 Schwangerschaft pro 100 Frauen pro Anwendungsjahr) bei perfekter Anwendung, ohne dass eine Tablette ausgelassen wird. Typische Ausfallraten liegen tatsächlich bei 5 % pro Jahr. Die Wahrscheinlichkeit, schwanger zu werden, steigt mit jeder vergessenen Pille während eines Menstruationszyklus.
Im Vergleich dazu sind typische Misserfolgsraten für andere Methoden der Empfängnisverhütung im ersten Jahr der Anwendung wie folgt:
WER SOLLTE KEINE ORALE VERHÜTUNGSMITTEL EINNEHMEN
Das Rauchen von Zigaretten erhöht das Risiko schwerer kardiovaskulärer Nebenwirkungen durch die Einnahme oraler Kontrazeptiva. Dieses Risiko steigt mit dem Alter und bei starkem Rauchen (15 oder mehr Zigaretten pro Tag) und ist bei Frauen über 35 Jahren ziemlich ausgeprägt. Frauen, die orale Kontrazeptiva anwenden, wird dringend empfohlen, nicht zu rauchen.
Manche Frauen sollten die Pille nicht nehmen. Beispielsweise sollten Sie die Pille nicht einnehmen, wenn Sie schwanger sind oder vermuten, schwanger zu sein. Sie sollten die Pille auch nicht verwenden, wenn Sie eine der folgenden Bedingungen haben:
Informieren Sie Ihren Arzt oder Gesundheitsdienstleister, wenn Sie jemals eine dieser Erkrankungen hatten. Ihr Arzt oder Gesundheitsdienstleister kann Ihnen eine andere Methode der Empfängnisverhütung empfehlen.
WEITERE ÜBERLEGUNGEN VOR DER EINNAHME VON ORALEN VERHÜTUNGSMITTELN
Informieren Sie Ihren Arzt oder Gesundheitsdienstleister, wenn Sie Folgendes haben:
Frauen mit einer dieser Erkrankungen sollten häufig von ihrem Arzt oder Gesundheitsdienstleister untersucht werden, wenn sie sich für die Anwendung oraler Kontrazeptiva entscheiden.
Informieren Sie auch Ihren Arzt oder Gesundheitsdienstleister, wenn Sie rauchen oder Medikamente einnehmen.
RISIKEN DER EINNAHME VON ORALEN VERHÜTUNGSMITTELN
1. Risiko der Bildung von Blutgerinnseln
Blutgerinnsel und Verstopfung von Blutgefäßen sind eine der schwerwiegendsten Nebenwirkungen bei der Einnahme oraler Kontrazeptiva und können zum Tod oder zu schweren Behinderungen führen. Insbesondere ein Gerinnsel im Bein kann eine Thrombophlebitis verursachen, und ein Gerinnsel, das in die Lunge gelangt, kann eine plötzliche Verstopfung des Blutgefäßes zur Lunge verursachen. Die Risiken dieser Nebenwirkungen können bei Desogestrel-haltigen oralen Kontrazeptiva wie Mircette® größer sein als bei bestimmten anderen niedrig dosierten Pillen. Selten treten Blutgerinnsel in den Blutgefäßen des Auges auf und können Blindheit, Doppeltsehen oder Sehstörungen verursachen.
Wenn Sie orale Kontrazeptiva einnehmen und eine elektive Operation benötigen, wegen einer längeren Krankheit bettlägerig sein müssen oder vor kurzem ein Kind entbunden haben, besteht möglicherweise das Risiko, dass Sie Blutgerinnsel entwickeln. Sie sollten Ihren Arzt oder Gesundheitsdienstleister fragen, ob Sie orale Kontrazeptiva drei bis vier Wochen vor der Operation absetzen und zwei Wochen nach der Operation oder während der Bettruhe keine oralen Kontrazeptiva einnehmen sollten. Sie sollten auch kurz nach der Geburt keine oralen Kontrazeptiva einnehmen. Es ist ratsam, mindestens vier Wochen nach der Entbindung zu warten, wenn Sie nicht stillen, oder vier Wochen nach einem Schwangerschaftsabbruch im zweiten Trimester. Wenn Sie stillen, sollten Sie mit der Einnahme der Pille warten, bis Sie Ihr Kind abgestillt haben (siehe Stillen in ALLGEMEINEN VORSICHTSMASSNAHMEN ).
Das Risiko einer Kreislauferkrankung bei Anwenderinnen von oralen Kontrazeptiva kann bei Anwenderinnen von hochdosierten Pillen höher sein und kann bei längerer Einnahmedauer von oralen Kontrazeptiva größer sein. Darüber hinaus können einige dieser erhöhten Risiken noch mehrere Jahre nach dem Absetzen oraler Kontrazeptiva bestehen bleiben. Das Risiko einer venösen thromboembolischen Erkrankung im Zusammenhang mit oralen Kontrazeptiva steigt nicht mit der Anwendungsdauer und verschwindet, nachdem die Einnahme der Pille beendet wurde. Das Risiko einer anormalen Blutgerinnung steigt mit dem Alter sowohl bei Anwenderinnen als auch bei Nichtanwenderinnen von oralen Kontrazeptiva, aber das erhöhte Risiko durch orale Kontrazeptiva scheint in jedem Alter vorhanden zu sein. Bei Frauen im Alter von 20 bis 44 Jahren wird geschätzt, dass etwa 1 von 2.000 Frauen, die orale Kontrazeptiva anwenden, jedes Jahr aufgrund einer abnormalen Gerinnung ins Krankenhaus eingeliefert werden. Unter den Nicht-Konsumenten derselben Altersgruppe würde jedes Jahr etwa 1 von 20.000 ins Krankenhaus eingeliefert werden. Für Anwenderinnen oraler Kontrazeptiva im Allgemeinen wurde geschätzt, dass bei Frauen im Alter zwischen 15 und 34 Jahren das Todesrisiko aufgrund einer Kreislaufstörung etwa 1 zu 12.000 pro Jahr beträgt, während die Rate bei Nichtanwenderinnen etwa 1 zu 50.000 beträgt pro Jahr. In der Altersgruppe der 35- bis 44-Jährigen wird das Risiko auf etwa 1 zu 2.500 pro Jahr für Anwenderinnen oraler Kontrazeptiva und etwa 1 zu 10.000 pro Jahr für Nichtanwenderinnen geschätzt.
2. Herzinfarkte und Schlaganfälle
Orale Kontrazeptiva können die Neigung zur Entwicklung von Schlaganfällen (Verstopfung oder Ruptur von Blutgefäßen im Gehirn) und Angina pectoris und Herzinfarkten (Verstopfung von Blutgefäßen im Herzen) erhöhen. Jeder dieser Zustände kann zum Tod oder zu einer schweren Behinderung führen.
Rauchen erhöht die Wahrscheinlichkeit, Herzinfarkte und Schlaganfälle zu erleiden, erheblich. Darüber hinaus erhöhen das Rauchen und die Einnahme oraler Kontrazeptiva die Wahrscheinlichkeit, an einer Herzkrankheit zu erkranken und daran zu sterben, erheblich.
3. Erkrankung der Gallenblase
Anwenderinnen oraler Kontrazeptiva haben wahrscheinlich ein größeres Risiko als Nicht-Anwenderinnen, an Gallenblasenerkrankungen zu erkranken, obwohl dieses Risiko mit Pillen zusammenhängen kann, die hohe Östrogendosen enthalten.
4. Lebertumoren
In seltenen Fällen können orale Kontrazeptiva gutartige, aber gefährliche Lebertumore verursachen. Diese gutartigen Lebertumoren können platzen und tödliche innere Blutungen verursachen. Darüber hinaus wurde in zwei Studien ein möglicher, aber nicht eindeutiger Zusammenhang zwischen der Pille und Leberkrebs festgestellt, in denen festgestellt wurde, dass einige Frauen, die diese sehr seltenen Krebserkrankungen entwickelten, über lange Zeiträume orale Kontrazeptiva verwendet haben. Leberkrebs ist jedoch äußerst selten. Die Chance, durch die Einnahme der Pille an Leberkrebs zu erkranken, ist somit noch geringer.
5. Krebs der Fortpflanzungsorgane und der Brust
Es gibt Konflikte zwischen Studien zu Brustkrebs und oralen Kontrazeptiva. Einige Studien haben ein erhöhtes Risiko, an Brustkrebs zu erkranken, insbesondere in jüngeren Jahren, berichtet. Dieses erhöhte Risiko scheint mit der Anwendungsdauer zusammenzuhängen. Die Mehrzahl der Studien hat insgesamt keine Erhöhung des Brustkrebsrisikos festgestellt.
Einige Studien haben eine erhöhte Inzidenz von Gebärmutterhalskrebs bei Frauen festgestellt, die orale Kontrazeptiva anwenden. Dieser Befund kann jedoch mit anderen Faktoren als der Anwendung oraler Kontrazeptiva zusammenhängen. Es gibt keine ausreichenden Beweise, um die Möglichkeit auszuschließen, dass Pillen solche Krebsarten verursachen können.
GESCHÄTZTES RISIKO DES TODES DURCH EINE GEBURTSKONTROLLMETHODE ODER SCHWANGERSCHAFT
Alle Methoden der Empfängnisverhütung und Schwangerschaft sind mit dem Risiko verbunden, bestimmte Krankheiten zu entwickeln, die zu einer Behinderung oder zum Tod führen können. Eine Schätzung der Zahl der Todesfälle im Zusammenhang mit verschiedenen Methoden der Empfängnisverhütung und Schwangerschaft wurde berechnet und ist in der folgenden Tabelle dargestellt.
JÄHRLICHE ANZAHL DER GEBURTSBEDINGTEN ODER METHODENBEZOGENEN TODESFÄLLE IM ZUSAMMENHANG MIT DER KONTROLLE DER FRUCHTBARKEIT PRO 100.000 UNSTERILEN FRAUEN, NACH METHODE DER FRUCHTBARKEITSKONTROLLE NACH ALTER
In der obigen Tabelle ist das Sterberisiko durch jede Verhütungsmethode geringer als das Geburtsrisiko, außer für Anwenderinnen oraler Kontrazeptiva über 35, die rauchen, und für Anwenderinnen von Pillen über 40, selbst wenn sie nicht rauchen. Aus der Tabelle ist ersichtlich, dass für Frauen im Alter von 15 bis 39 Jahren das Todesrisiko bei einer Schwangerschaft am höchsten war (7 bis 26 Todesfälle pro 100.000 Frauen, je nach Alter). Unter Pillenbenutzerinnen, die nicht rauchen, ist das Sterberisiko für alle Altersgruppen immer niedriger als das einer Schwangerschaft, obwohl das Risiko über 40 auf 32 Todesfälle pro 100.000 Frauen steigt, verglichen mit 28 Todesfällen im Zusammenhang mit einer Schwangerschaft das Alter. Bei rauchenden Pille-Anwendern über 35 Jahren übersteigt die geschätzte Zahl der Todesfälle jedoch die bei anderen Methoden der Empfängnisverhütung. Wenn eine Frau über 40 Jahre alt ist und raucht, ist ihr geschätztes Sterberisiko viermal höher (117/100.000 Frauen) als das geschätzte Risiko einer Schwangerschaft (28/100.000 Frauen) in dieser Altersgruppe.
Der Vorschlag, dass Frauen über 40, die nicht rauchen, keine oralen Kontrazeptiva nehmen sollten, basiert auf Informationen aus älteren, hochdosierten Pillen und auf einem weniger selektiven Gebrauch von Pillen als heute praktiziert wird. Ein beratender Ausschuss der FDA diskutierte dieses Problem 1989 und empfahl, dass die Vorteile der Einnahme oraler Kontrazeptiva durch gesunde, nicht rauchende Frauen über 40 die möglichen Risiken überwiegen sollten. Alle Frauen, insbesondere ältere Frauen, werden jedoch darauf hingewiesen, die niedrigste Dosis Pille zu verwenden, die wirksam ist.
WARNSIGNALE
Wenn eine dieser Nebenwirkungen während der Einnahme oraler Kontrazeptiva auftritt, wenden Sie sich sofort an Ihren Arzt oder das medizinische Fachpersonal:
NEBENWIRKUNGEN VON ORALEN VERHÜTUNGSMITTELN
1. Vaginale Blutungen
Unregelmäßige vaginale Blutungen oder Schmierblutungen können während der Einnahme der Pillen auftreten. Unregelmäßige Blutungen können von leichten Flecken zwischen den Menstruationsperioden bis hin zu Durchbruchblutungen reichen, die einer regelmäßigen Periode ähnlich sind. Unregelmäßige Blutungen treten am häufigsten in den ersten Monaten der Einnahme von oralen Kontrazeptiva auf, können aber auch nach längerer Einnahme der Pille auftreten. Solche Blutungen können vorübergehend sein und weisen normalerweise nicht auf ernsthafte Probleme hin. Es ist wichtig, dass Sie Ihre Pillen weiterhin planmäßig einnehmen. Wenn die Blutung in mehr als einem Zyklus auftritt oder länger als ein paar Tage anhält, sprechen Sie mit Ihrem Arzt oder Gesundheitsdienstleister.
2. Kontaktlinsen
Wenn Sie Kontaktlinsen tragen und eine Sehveränderung bemerken oder Ihre Linsen nicht mehr tragen können, wenden Sie sich an Ihren Arzt oder medizinischen Betreuer.
3. Flüssigkeitsretention
Orale Kontrazeptiva können Ödeme (Flüssigkeitsansammlungen) mit Schwellungen an den Fingern oder Knöcheln verursachen und Ihren Blutdruck erhöhen. Wenn Sie eine Flüssigkeitsretention bemerken, wenden Sie sich an Ihren Arzt oder Gesundheitsdienstleister.
4. Melasma
Eine fleckige Verdunkelung der Haut ist möglich, insbesondere im Gesicht.
5. Andere Nebenwirkungen
Andere Nebenwirkungen können Übelkeit und Erbrechen, Appetitlosigkeit, Kopfschmerzen, Nervosität, Depression, Schwindel, Haarausfall, Hautausschlag und Vaginalinfektionen sein.
Wenn eine dieser Nebenwirkungen Sie stört, wenden Sie sich an Ihren Arzt oder Gesundheitsdienstleister.
ALLGEMEINE VORSICHTSMASSNAHMEN
1. Ausbleiben der Periode und Einnahme von oralen Kontrazeptiva vor oder während der Frühschwangerschaft
Es kann vorkommen, dass Sie nach Abschluss einer Pillenkur keine regelmäßige Menstruation haben. Wenn Sie Ihre Pillen regelmäßig eingenommen haben und eine Monatsblutung ausbleibt, fahren Sie mit der Einnahme Ihrer Pillen für den nächsten Zyklus fort, aber informieren Sie vorher unbedingt Ihren Arzt oder Gesundheitsdienstleister. Wenn Sie die Pillen nicht wie verordnet täglich eingenommen haben und eine Monatsblutung ausblieb oder wenn Sie zwei aufeinanderfolgende Monatsblutungen ausblieben, könnten Sie schwanger sein. Wenden Sie sich sofort an Ihren Arzt oder Gesundheitsdienstleister, um festzustellen, ob Sie schwanger sind. Nehmen Sie orale Kontrazeptiva nicht weiter ein, bis Sie sicher sind, dass Sie nicht schwanger sind, sondern wenden Sie weiterhin eine andere Verhütungsmethode an.
Es gibt keine schlüssigen Beweise dafür, dass die Einnahme von oralen Kontrazeptiva mit einer Zunahme von Geburtsfehlern verbunden ist, wenn sie versehentlich während der frühen Schwangerschaft eingenommen werden. Zuvor hatten einige Studien berichtet, dass orale Kontrazeptiva mit Geburtsfehlern in Verbindung gebracht werden könnten, aber diese Studien wurden nicht bestätigt. Dennoch sollten orale Kontrazeptiva oder andere Arzneimittel während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich und wird von Ihrem Arzt oder Gesundheitsdienstleister verordnet. Sie sollten sich bei Ihrem Arzt oder Gesundheitsdienstleister über die Risiken von Medikamenten, die während der Schwangerschaft eingenommen werden, für Ihr ungeborenes Kind erkundigen.
2. Während des Stillens
Wenn Sie stillen, fragen Sie Ihren Arzt oder das medizinische Fachpersonal, bevor Sie mit der Einnahme oraler Kontrazeptiva beginnen. Ein Teil des Arzneimittels wird mit der Milch an das Kind weitergegeben. Es wurden einige Nebenwirkungen beim Kind berichtet, darunter Gelbfärbung der Haut (Gelbsucht) und Brustvergrößerung. Darüber hinaus können orale Kontrazeptiva die Menge und Qualität Ihrer Milch verringern. Verwenden Sie nach Möglichkeit keine oralen Kontrazeptiva während der Stillzeit. Sie sollten eine andere Verhütungsmethode anwenden, da das Stillen nur einen Teilschutz vor einer Schwangerschaft bietet und dieser Teilschutz bei längerem Stillen deutlich abnimmt.
Sie sollten erwägen, mit oralen Kontrazeptiva erst zu beginnen, nachdem Sie Ihr Kind vollständig abgestillt haben.
3. Labortests
Wenn bei Ihnen Laboruntersuchungen geplant sind, informieren Sie Ihren Arzt oder Gesundheitsdienstleister, dass Sie Antibabypillen einnehmen. Bestimmte Bluttests können durch Antibabypillen beeinflusst werden.
4. Arzneimittelwechselwirkungen
Bestimmte Medikamente können mit Antibabypillen interagieren, sodass sie weniger wirksam bei der Verhinderung einer Schwangerschaft sind oder eine Zunahme von Durchbruchblutungen verursachen. Zu diesen Medikamenten gehören Rifampin, Medikamente gegen Epilepsie wie Barbiturate (z. B. Phenobarbital), Phenytoin (Dilantin® ist eine Marke dieses Medikaments), Phenylbutazon (Butazolidin® ist eine Marke) und möglicherweise bestimmte Antibiotika. Möglicherweise müssen Sie zusätzliche Verhütungsmittel anwenden, wenn Sie Arzneimittel einnehmen, die die Wirksamkeit oraler Kontrazeptiva beeinträchtigen können.
Antibabypillen können mit Lamotrigin interagieren, einem Antikonvulsivum, das bei Epilepsie eingesetzt wird. Dies kann das Risiko von Krampfanfällen erhöhen, sodass Ihr Arzt möglicherweise die Dosis von Lamotrigin anpassen muss.
Einige Arzneimittel können die Antibabypille weniger wirksam machen, einschließlich:
Wie bei allen verschreibungspflichtigen Produkten sollten Sie Ihren Arzt über alle anderen Arzneimittel und pflanzlichen Produkte informieren, die Sie einnehmen. Möglicherweise müssen Sie ein Barriere-Verhütungsmittel verwenden, wenn Sie Arzneimittel oder Produkte einnehmen, die die Wirksamkeit der Antibabypille beeinträchtigen können.
5. Sexuell übertragbare Krankheiten
Dieses Produkt soll (wie alle oralen Kontrazeptiva) eine Schwangerschaft verhindern. Es schützt nicht vor der Übertragung von HIV (AIDS) und anderen sexuell übertragbaren Krankheiten wie Chlamydien, Herpes genitalis, Genitalwarzen, Tripper, Hepatitis B und Syphilis.
WIE IST DIE PILLE EINZUNEHMEN?
WICHTIGE PUNKTE ZU BEACHTEN
BEVOR SIE MIT DER EINNAHME IHRER PILLEN BEGINNEN:
1. LESEN SIE UNBEDINGT DIESE ANWEISUNGEN:
Bevor Sie mit der Einnahme Ihrer Pillen beginnen.
Immer wenn Sie sich nicht sicher sind, was Sie tun sollen.
2. DER RICHTIGE WEG ZUR EINNAHME DER PILLE IST, JEDEN TAG EINE PILLE ZUR GLEICHEN ZEIT EINZUNEHMEN.
Wenn Sie Pillen verpassen, könnten Sie schwanger werden. Dazu gehört auch das späte Starten des Pakets.
Je mehr Pillen Sie vergessen, desto wahrscheinlicher ist es, dass Sie schwanger werden.
3. VIELE FRAUEN HABEN WÄHREND DER ERSTEN 1 BIS 3 PILLENPACKUNGEN SPOTTING ODER LEICHTE BLUTUNGEN ODER KÖNNEN MAGENÜBERGEHEN FÜHLEN.
Wenn Sie sich unwohl fühlen, brechen Sie die Einnahme der Pille nicht ab. Das Problem wird normalerweise verschwinden. Wenn es nicht verschwindet, wenden Sie sich an Ihren Arzt oder Gesundheitsdienstleister.
4. FEHLENDE TABLETTEN KÖNNEN AUCH SPOTTING ODER LEICHTE BLUTUNGEN VERURSACHEN, selbst wenn Sie diese vergessenen Pillen nachholen.
An den Tagen, an denen Sie 2 Pillen einnehmen, um vergessene Pillen nachzuholen, könnte Ihnen auch etwas übel werden.
5. WENN SIE AUS IRGENDEINEM GRUND ERBRECHEN ODER DURCHFALL HABEN, ODER WENN SIE EINIGE ARZNEIMITTEL EINNEHMEN, einschließlich einiger Antibiotika, wirken Ihre Pillen möglicherweise nicht so gut.
Verwenden Sie eine Ersatzmethode (wie Kondome, Schaum oder Schwamm), bis Sie Ihren Arzt oder Gesundheitsdienstleister fragen.
6. WENN SIE SCHWIERIGKEITEN HABEN, SICH AN DIE PILLE ZU GEDENKEN, sprechen Sie mit Ihrem Arzt oder Gesundheitsdienstleister darüber, wie Sie die Einnahme der Pille erleichtern oder eine andere Methode der Empfängnisverhütung anwenden können.
7. WENN SIE FRAGEN HABEN ODER SICH ÜBER DIE INFORMATIONEN IN DIESER BROSCHÜRE NICHT SICHER SIND, wenden Sie sich an Ihren Arzt oder Gesundheitsdienstleister.
BEVOR SIE MIT DER EINNAHME IHRER PILLEN BEGINNEN
8. ENTSCHEIDEN SIE, ZU WELCHER TAGESZEIT SIE IHRE PILLE EINNEHMEN MÖCHTEN.
Es ist wichtig, es jeden Tag ungefähr zur gleichen Zeit einzunehmen.
8. SEHEN SIE SICH IHRE PILLENPACKUNG AN: SIE HAT 28 PILLEN:
Diese Packung mit 28 Pillen enthält 26 „aktive“ [weiße und gelbe] Pillen (mit Hormonen) und 2 „inaktive“ [hellgrüne] Pillen (ohne Hormone).
10. FINDEN SIE AUCH:
1) Wo auf der Packung, um mit der Einnahme der Pillen zu beginnen,
2) in welcher Reihenfolge die Pillen eingenommen werden (folgen Sie den Pfeilen) und
3) die Wochennummern wie im Bild unten gezeigt.
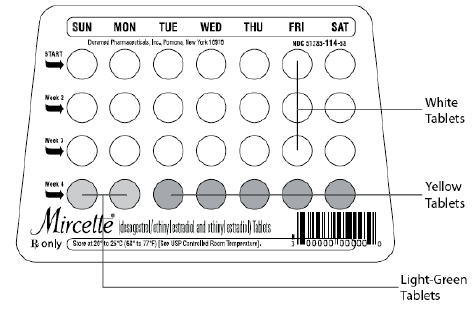
11. STELLEN SIE SICHER, DASS SIE JEDERZEIT BEREIT HABEN:
EINE ANDERE ART DER VERHINDERUNG (wie Kondome, Schaum oder Schwamm), die Sie als Ersatz verwenden können, falls Sie die Pillen vergessen.
EINE ZUSÄTZLICHE, VOLLSTÄNDIGE PILLENPACKUNG.
WANN MIT DER ERSTEN PILLENPACKUNG BEGINNEN
Sie haben die Wahl, an welchem Tag Sie mit der Einnahme Ihrer ersten Pillenpackung beginnen. Entscheiden Sie mit Ihrem Arzt oder Gesundheitsdienstleister, welcher der beste Tag für Sie ist. Wählen Sie eine Tageszeit, die Sie sich leicht merken können.
TAG 1 START
12. Wählen Sie den Tagesetikettenstreifen, der mit dem ersten Tag Ihrer Periode beginnt (das ist der Tag, an dem Sie Blutungen oder Schmierblutungen bekommen, auch wenn es fast Mitternacht ist, wenn die Blutung beginnt).
13. Legen Sie diesen Tagesetikettenstreifen in den Zyklustablettenspender über die Fläche, auf der die Wochentage (beginnend mit Sonntag) aufgedruckt sind.
Hinweis: Wenn der erste Tag Ihrer Periode ein Sonntag ist, können Sie die Schritte 1 und 2 überspringen.
14. Nehmen Sie die erste „aktive“ [weiße] Pille der ersten Packung während der ersten 24 Stunden Ihrer Periode ein.
15. Sie müssen keine zusätzliche Verhütungsmethode anwenden, da Sie mit der Pille zu Beginn Ihrer Periode beginnen.
SONNTAG START
16. Nehmen Sie die erste „aktive“ [weiße] Pille der ersten Packung am Sonntag nach Beginn Ihrer Periode ein, auch wenn Sie noch bluten. Wenn Ihre Periode am Sonntag beginnt, beginnen Sie noch am selben Tag mit der Packung.
17. Verwenden Sie eine andere Methode der Empfängnisverhütung als Backup-Methode, wenn Sie ab dem Sonntag, an dem Sie Ihre erste Packung beginnen, bis zum nächsten Sonntag (7 Tage) Geschlechtsverkehr haben. Kondome, Schaum oder der Schwamm sind gute Backup-Methoden zur Empfängnisverhütung.
WAS WÄHREND DES MONATS ZU TUN IST
18. NEHMEN SIE JEDEN TAG ZUR GLEICHEN ZEIT EINE PILLE EIN, BIS DIE PACKUNG LEER IST.
Lassen Sie die Pillen nicht aus, auch wenn Sie Schmierblutungen oder Blutungen zwischen den Monatsblutungen haben oder sich krank fühlen (Übelkeit).
Lassen Sie keine Pillen aus, auch wenn Sie nicht sehr oft Sex haben.
19. WENN SIE EINE PACKUNG FERTIGEN ODER IHRE PILLENMARKE WECHSELN:
21 Pillen : Warten Sie 7 Tage, um mit der nächsten Packung zu beginnen. Wahrscheinlich wirst du in dieser Woche deine Periode bekommen. Achten Sie darauf, dass zwischen 21-Tage-Packungen nicht mehr als 7 Tage vergehen.
28 Pillen : Beginnen Sie mit der nächsten Packung am Tag nach Ihrer letzten Pille. Warten Sie keine Tage zwischen den Packungen.
WAS TUN, WENN SIE PILLEN VERPASSEN
Wenn Sie 1 „aktive“ [weiße] Pille VERPASSEN:
20. Nehmen Sie es, sobald Sie sich daran erinnern. Nehmen Sie die nächste Pille zu Ihrer gewohnten Zeit ein. Das bedeutet, dass Sie 2 Pillen an einem Tag einnehmen.
21. Sie müssen keine alternative Verhütungsmethode anwenden, wenn Sie Sex haben. Wenn Sie in WOCHE 1 ODER WOCHE 2 Ihrer Packung 2 „aktive“ [weiße] Pillen hintereinander VERPASSEN:
22. Nehmen Sie 2 Pillen an dem Tag, an dem Sie sich erinnern, und 2 Pillen am nächsten Tag.
23. Nehmen Sie dann 1 Pille pro Tag, bis Sie die Packung aufgebraucht haben.
24. Sie KÖNNEN SCHWANGER WERDEN, wenn Sie in den 7 Tagen nach dem Ausbleiben der Pillen Sex haben. Sie MÜSSEN für diese 7 Tage eine andere Verhütungsmethode (wie Kondome, Schaum oder Schwamm) als Ersatzmethode verwenden.
Wenn Sie 2 „aktive“ [weiße] Pillen hintereinander in WOCHE 3 VERPASSEN:
25. Wenn Sie ein Tag-1-Starter sind:
WERFEN Sie den Rest der Pillenpackung weg und beginnen Sie noch am selben Tag mit einer neuen Packung.
Wenn Sie ein Sonntagsstarter sind:
Nehmen Sie bis Sonntag täglich 1 Tablette ein.
WERFEN Sie am Sonntag den Rest der Packung WEG und beginnen Sie noch am selben Tag mit einer neuen Pillenpackung.
26. Möglicherweise haben Sie diesen Monat keine Periode, aber dies wird erwartet. Wenn Ihre Periode jedoch 2 Monate hintereinander ausbleibt, rufen Sie Ihren Arzt oder Gesundheitsdienstleister an, da Sie möglicherweise schwanger sind.
27. Sie KÖNNEN SCHWANGER WERDEN, wenn Sie in den 7 Tagen nach dem Ausbleiben der Pillen Sex haben. Sie MÜSSEN für diese 7 Tage eine andere Verhütungsmethode (wie Kondome, Schaum oder Schwamm) als Backup-Methode verwenden.
Wenn du MISS 3 ODER MEHR „aktive“ [weiße] Pillen hintereinander (während der ersten 3 Wochen):
28. Wenn Sie ein Tag-1-Starter sind:
WERFEN Sie den Rest der Pillenpackung weg und beginnen Sie noch am selben Tag mit einer neuen Packung.
Wenn Sie ein Sonntagsstarter sind:
Nehmen Sie bis Sonntag täglich 1 Tablette ein.
WERFEN Sie am Sonntag den Rest der Packung WEG und beginnen Sie noch am selben Tag mit einer neuen Pillenpackung.
29. Möglicherweise haben Sie diesen Monat keine Periode, aber dies wird erwartet. Wenn Ihre Periode jedoch 2 Monate hintereinander ausbleibt, rufen Sie Ihren Arzt oder Gesundheitsdienstleister an, da Sie möglicherweise schwanger sind.
30. Sie KÖNNEN SCHWANGER WERDEN, wenn Sie in den 7 Tagen nach dem Ausbleiben der Pillen Sex haben. Sie MÜSSEN für diese 7 Tage eine andere Verhütungsmethode (wie Kondome, Schaum oder Schwamm) als Backup-Methode verwenden.
EINE ERINNERUNG FÜR DIE MIT 28-TAGE-PACKS
Wenn Sie eine der 2 [hellgrünen] oder 5 [gelben] Pillen in Woche 4 vergessen haben:
WERFEN Sie die Pillen weg, die Sie vergessen haben.
Nehmen Sie jeden Tag 1 Pille ein, bis die Packung leer ist.
Sie benötigen keine Backup-Methode.
ENDLICH, WENN SIE NOCH NICHT SICHER SIND, WAS SIE MIT DEN VERGESSENEN PILLEN TUN SOLLTEN
Verwenden Sie eine BACK-UP-METHODE, wann immer Sie Sex haben.
NEHMEN SIE JEDEN TAG EINE „AKTIVE“ [WEISSE] PILLE EIN, bis Sie Ihren Arzt oder Gesundheitsdienstleister erreichen können.
SCHWANGERSCHAFT DURCH PILLENVERsagen
Die Inzidenz eines Pillenversagens, das zu einer Schwangerschaft führt, beträgt ungefähr ein Prozent (dh eine Schwangerschaft pro 100 Frauen pro Jahr), wenn es täglich wie vorgeschrieben eingenommen wird, aber typischere Versagensraten liegen bei etwa 5%. Wenn es zu einem Versagen kommt, ist das Risiko für den Fötus minimal.
SCHWANGERSCHAFT NACH DEM ABSETZEN DER PILLE
Nach Absetzen der oralen Kontrazeptiva kann es zu einer gewissen Verzögerung der Schwangerschaft kommen, insbesondere wenn Sie vor der Anwendung der oralen Kontrazeptiva unregelmäßige Menstruationszyklen hatten. Es kann ratsam sein, die Empfängnis zu verschieben, bis Sie Ihre Menstruation regelmäßig beginnen, nachdem Sie die Einnahme der Pille beendet haben und eine Schwangerschaft wünschen.
Es scheint keine Zunahme von Geburtsfehlern bei Neugeborenen zu geben, wenn die Schwangerschaft bald nach Absetzen der Pille eintritt.
ÜBERDOSIERUNG
Nach Einnahme hoher Dosen oraler Kontrazeptiva durch Kleinkinder wurden keine schwerwiegenden Nebenwirkungen berichtet. Eine Überdosierung kann bei Frauen zu Übelkeit und Abbruchblutungen führen. Wenden Sie sich im Falle einer Überdosierung an Ihren Arzt, Gesundheitsdienstleister oder Apotheker.
ANDERE INFORMATIONEN
Ihr Arzt oder Gesundheitsdienstleister wird vor der Verschreibung oraler Kontrazeptiva eine Kranken- und Familienanamnese erheben und Sie untersuchen. Die körperliche Untersuchung kann auf einen anderen Zeitpunkt verschoben werden, wenn Sie dies wünschen und Ihr Arzt oder der Gesundheitsdienstleister der Ansicht ist, dass es eine gute medizinische Praxis ist, sie zu verschieben. Mindestens einmal im Jahr sollten Sie erneut untersucht werden. Informieren Sie unbedingt Ihren Arzt oder Gesundheitsdienstleister, wenn in der Familie eine der zuvor in dieser Packungsbeilage aufgeführten Erkrankungen aufgetreten ist. Achten Sie darauf, alle Termine mit Ihrem Arzt oder Gesundheitsdienstleister einzuhalten, da dies eine Zeit ist, um festzustellen, ob es frühe Anzeichen von Nebenwirkungen der oralen Kontrazeptiva gibt.
Verwenden Sie das Medikament nicht für andere als die, für die es verschrieben wurde. Dieses Medikament wurde speziell für Sie verschrieben; Geben Sie es nicht an andere weiter, die die Antibabypille möchten.
GESUNDHEIT VORTEILE VON ORALEN VERHÜTUNGSMITTELN
Zusätzlich zur Verhütung einer Schwangerschaft kann die Anwendung oraler Kombinationskontrazeptiva bestimmte Vorteile bieten. Sie sind:
Wenn Sie weitere Informationen über Antibabypillen wünschen, fragen Sie Ihren Arzt, Gesundheitsdienstleister oder Apotheker. Sie haben eine eher technische Broschüre namens Prescribing Information, die Sie vielleicht lesen möchten.