Zanaflex 2mg, 4mg Tizanidine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zanaflex 2 mg und wie wird es angewendet?
Zanaflex 2 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Muskelsteifheit (Spastik) im Zusammenhang mit Erkrankungen wie Zerebralparese oder anderen neurologischen Erkrankungen. Zanaflex 2 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Zanaflex 2 mg gehört zu einer Klasse von Arzneimitteln, die als zentraler Alpha-2-adrenerger Agonist bezeichnet werden.
Es ist nicht bekannt, ob Zanaflex bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Zanaflex haben?
Zanaflex 2 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zanaflex gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zanaflex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
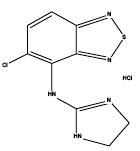
Zanaflex® (Tizanidinhydrochlorid) ist ein zentraler alpha2-adrenerger Agonist. Tizanidin-HCl ist ein weißes bis cremefarbenes, feinkristallines Pulver, das geruchlos ist oder einen schwachen charakteristischen Geruch aufweist. Tizanidin ist in Wasser und Methanol leicht löslich; Die Löslichkeit in Wasser nimmt mit steigendem pH-Wert ab. Sein chemischer Name ist 5-Chlor-4-(2-imidazolin-2-ylamino)-2,1,3-benzothiadiazolmonohydrochlorid. Die Molekularformel von Tizanidin ist C9H8ClN5S-HCl, sein Molekulargewicht beträgt 290,2 und seine Strukturformel lautet:
Zanaflex 4 mg Capsules® werden als 2-, 4- und 6-mg-Kapseln zur oralen Verabreichung geliefert. Zanaflex Capsules® enthalten den Wirkstoff Tizanidinhydrochlorid (2,29 mg entsprechend 2 mg Tizanidin-Base, 4,58 mg entsprechend 4 mg Tizanidin-Base und 6,87 mg entsprechend 6 mg Tizanidin-Base) und die Hilfsstoffe Hypromellose, Siliciumdioxid, Zuckerkügelchen, Titandioxid, Gelatine und Farbstoffe.
Zanaflex®-Tabletten werden als 4-mg-Tabletten zur oralen Verabreichung geliefert. Zanaflex®-Tabletten enthalten den Wirkstoff Tizanidinhydrochlorid (4,58 mg entsprechend 4 mg Tizanidin-Base) und die Hilfsstoffe kolloidales Siliciumdioxid, Stearinsäure, mikrokristalline Cellulose und wasserfreie Lactose.
INDIKATIONEN
Zanaflex ist zur Behandlung von Spastik indiziert. Aufgrund der kurzen Dauer der therapeutischen Wirkung sollte die Behandlung mit Zanaflex auf die täglichen Aktivitäten und Zeiten beschränkt werden, in denen die Linderung der Spastik am wichtigsten ist [siehe DOSIERUNG UND ANWENDUNG ].
DOSIERUNG UND ANWENDUNG
Dosierungsinformationen
Zanaflex 2 mg Kapseln® oder Zanaflex® Tabletten können mit oder ohne Nahrung verschrieben werden. Sobald die Formulierung ausgewählt und die Entscheidung zur Einnahme mit oder ohne Nahrung getroffen wurde, sollte dieses Schema nicht geändert werden.
Nahrungsmittel haben komplexe Auswirkungen auf die Pharmakokinetik von Tizanidin, die sich je nach Formulierung unterscheiden. Zanaflex-Kapseln und Zanaflex-Tabletten sind unter nüchternen Bedingungen (mehr als 3 Stunden nach einer Mahlzeit), jedoch nicht nach Nahrungsaufnahme (innerhalb von 30 Minuten nach einer Mahlzeit) bioäquivalent. Diese pharmakokinetischen Unterschiede können zu klinisch signifikanten Unterschieden führen, wenn die Einnahme von Tabletten und Kapseln umgestellt wird und wenn die Einnahme zwischen Nahrungsaufnahme und nüchternem Zustand umgestellt wird. Diese Änderungen können je nach Art des Wechsels zu vermehrten unerwünschten Ereignissen oder einem verzögerten oder schnelleren Wirkungseintritt führen. Aus diesem Grund sollte der verschreibende Arzt gründlich mit den Veränderungen der Kinetik vertraut sein, die mit diesen unterschiedlichen Erkrankungen einhergehen [siehe KLINISCHE PHARMAKOLOGIE ].
Die empfohlene Anfangsdosis beträgt 2 mg. Da die Wirkung von Zanaflex etwa 1 bis 2 Stunden nach der Einnahme ihren Höhepunkt erreicht und zwischen 3 und 6 Stunden nach der Einnahme abklingt, kann die Behandlung je nach Bedarf in Abständen von 6 bis 8 Stunden bis zu maximal drei Dosen innerhalb von 24 Stunden wiederholt werden.
Die Dosierung kann schrittweise um 2 mg bis 4 mg bei jeder Dosis erhöht werden, mit 1 bis 4 Tagen zwischen den Dosiserhöhungen, bis eine zufriedenstellende Verringerung des Muskeltonus erreicht ist. Die tägliche Gesamtdosis sollte 36 mg nicht überschreiten. Einzeldosen von mehr als 16 mg wurden nicht untersucht.
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
Zanaflex sollte bei Patienten mit Niereninsuffizienz (Kreatinin-Clearance WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Dosierung bei Patienten mit eingeschränkter Leberfunktion
Zanaflex 4 mg sollte bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden. Bei diesen Patienten sollten während der Titration die Einzeldosen reduziert werden. Wenn höhere Dosen erforderlich sind, sollten eher die Einzeldosen als die Dosierungshäufigkeit erhöht werden. Eine Überwachung der Aminotransferasespiegel wird zu Studienbeginn und 1 Monat nach Erreichen der Höchstdosis oder bei Verdacht auf Leberschädigung empfohlen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Absetzen von Medikamenten
Wenn die Therapie abgebrochen werden muss, insbesondere bei Patienten, die hohe Dosen (20 mg bis 36 mg täglich) über einen längeren Zeitraum (9 Wochen oder länger) erhalten haben oder möglicherweise gleichzeitig mit Betäubungsmitteln behandelt werden, sollte die Dosis langsam verringert werden ( 2 mg bis 4 mg pro Tag), um das Risiko von Absetz- und Rebound-Hypertonie, Tachykardie und Hypertonie zu minimieren [siehe Drogenmissbrauch und -abhängigkeit ].
WIE GELIEFERT
Darreichungsformen und Stärken
Kapseln
mg: Hellblaues, undurchsichtiges Unterteil mit hellblauem, undurchsichtigem Oberteil mit dem Aufdruck „2 MG“ auf dem Oberteil 4 mg: Weißes, undurchsichtiges Unterteil mit blauem, undurchsichtigem Oberteil mit dem Aufdruck „4 MG“ auf dem Oberteil 6 mg: Blaues, undurchsichtiges Unterteil mit a weißer Streifen und blaue undurchsichtige Kappe mit Aufdruck „6 MG“ auf der Kappe
Tablets
4 mg weiße, unbeschichtete Tabletten mit einer viergeteilten Bruchkerbe auf einer Seite und der Prägung „A594“ auf der anderen Seite
Lagerung und Handhabung
Zanaflex-Kapseln®
Zanaflex Capsules® (Tizanidinhydrochlorid) Kapseln sind in drei Stärken als zweiteilige Hartgelatinekapseln mit 2,29 mg, 4,58 mg und 6,87 mg Tizanidinhydrochlorid erhältlich, entsprechend 2 mg, 4 mg und 6 mg Tizanidinbase.
Die 2-mg-Kapseln haben ein hellblaues, undurchsichtiges Unterteil mit einem hellblauen, undurchsichtigen Oberteil mit dem Aufdruck „2 MG“ auf dem Oberteil: Flaschen mit 150 Kapseln ( NDC 70515-602-15)
Die 4-mg-Kapseln haben ein weißes, undurchsichtiges Unterteil mit einem blauen, undurchsichtigen Oberteil mit dem Aufdruck „4 MG“ auf dem Oberteil: Flaschen mit 150 Kapseln ( NDC 70515-604-15)
Die 6-mg-Kapseln haben ein blaues, undurchsichtiges Unterteil mit einem weißen Streifen und ein blaues, undurchsichtiges Oberteil mit dem Aufdruck „6 MG“ auf den Kapseln: Flaschen mit 150 Kapseln ( NDC 70515-606-15)
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15°C bis 30°C (59°F bis 86°F) [siehe USP kontrollierte Raumtemperatur ]. In Behältern mit kindersicherem Verschluss abgeben.
Zanaflex® Tabletten
Zanaflex® (Tizanidinhydrochlorid) Tabletten sind als 4 mg weiße, unbeschichtete Tabletten erhältlich, die 4,58 mg Tizanidinhydrochlorid enthalten, entsprechend 4 mg Tizanidinbase. Die Tabletten haben auf einer Seite eine viergeteilte Bruchkerbe und auf der anderen Seite die Prägung „A594“. Tabletten werden wie folgt bereitgestellt: Flaschen mit 150 Tabletten (NDC 70515-594-15).
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 15°C bis 30°C (59°F bis 86°F) [siehe USP kontrollierte Raumtemperatur ].
In Behältern mit kindersicherem Verschluss abgeben.
Hergestellt für: Covis Pharma Zug, 6300 Schweiz. Überarbeitet: Dezember 2020
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden an anderer Stelle in anderen Abschnitten der Verschreibungsinformationen beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Drei doppelblinde, randomisierte, placebokontrollierte klinische Studien wurden durchgeführt, um die Wirkung von Tizanidin auf die Spastikkontrolle zu bewerten. Zwei Studien wurden bei Patienten mit Multipler Sklerose und eine bei Patienten mit Rückenmarksverletzungen durchgeführt. Jede Studie hatte eine 13-wöchige aktive Behandlungsphase, die eine 3-wöchige Titrationsphase bis zur maximal tolerierten Dosis von bis zu 36 mg/Tag in drei getrennten Dosen, eine 9-wöchige Plateauphase, in der die Tizanidin-Dosis konstant gehalten wurde, und a 1-wöchige Dosisreduzierung. Insgesamt erhielten 264 Patienten Tizanidin und 261 Patienten Placebo. In allen drei Studien lag das Patientenalter zwischen 15 und 69 Jahren, und 51,4 Prozent waren Frauen. Die mittlere Dosis während der Plateauphase lag zwischen 20 und 28 mg/Tag.
Die häufigsten Nebenwirkungen, die in Placebo-kontrollierten klinischen Mehrfachdosis-Studien mit 264 Patienten mit Spastik berichtet wurden, waren Mundtrockenheit, Somnolenz/Sedierung, Asthenie (Schwäche, Erschöpfung und/oder Müdigkeit) und Schwindel. Drei Viertel der Patienten bewerteten die Ereignisse als leicht bis mittelschwer und ein Viertel der Patienten bewerteten die Ereignisse als schwerwiegend. Diese Ereignisse schienen dosisabhängig zu sein.
Tabelle 1 listet Anzeichen und Symptome auf, die bei mehr als 2 % der Patienten in drei placebokontrollierten Mehrfachdosisstudien berichtet wurden, die Zanaflex erhielten, wobei die Häufigkeit in der Zanaflex-Gruppe größer war als in der Placebo-Gruppe. Zu Vergleichszwecken ist auch die entsprechende Häufigkeit des Ereignisses (pro 100 Patienten) bei den mit Placebo behandelten Patienten angegeben.
In der placebokontrollierten Einzeldosisstudie mit 142 Patienten mit Spastik aufgrund von Multipler Sklerose (Studie 1) [vgl Klinische Studien wurden die Patienten speziell gefragt, ob bei ihnen eine der vier häufigsten Nebenwirkungen aufgetreten war: Mundtrockenheit, Somnolenz (Schläfrigkeit), Asthenie (Schwäche, Erschöpfung und/oder Müdigkeit) und Schwindel. Außerdem wurden Hypotonie und Bradykardie beobachtet. Das Auftreten dieser Reaktionen ist in Tabelle 2 zusammengefasst. Andere Ereignisse wurden im Allgemeinen mit einer Rate von 2 % oder weniger gemeldet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Zanaflex nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Bestimmte Nebenwirkungen wie Somnolenz, Mundtrockenheit, Hypotonie, Blutdruckabfall, Bradykardie, Schwindel, Schwäche oder Asthenie, Muskelkrämpfe, Halluzinationen, Müdigkeit, Leberfunktionstests und Hepatotoxizität wurden nach der Markteinführung und in klinischen Studien beobachtet und werden diskutiert in den vorherigen Abschnitten dieses Dokuments.
Die folgenden Nebenwirkungen wurden nach der Markteinführung von Zanaflex identifiziert. Aufgrund der bereitgestellten Informationen zu diesen Reaktionen kann ein Kausalzusammenhang mit Zanaflex nicht vollständig ausgeschlossen werden. Die Ereignisse sind nach abnehmender klinischer Bedeutung aufgelistet; Der Schweregrad in der Post-Marketing-Einstellung wird nicht gemeldet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Fluvoxamin
Die gleichzeitige Anwendung von Fluvoxamin und Zanaflex 4 mg ist kontraindiziert. Veränderungen der Pharmakokinetik von Tizanidin bei Verabreichung mit Fluvoxamin führten zu einem signifikant verringerten Blutdruck, erhöhter Schläfrigkeit und erhöhter psychomotorischer Beeinträchtigung [siehe KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
Ciprofloxacin
Die gleichzeitige Anwendung von Ciprofloxacin und Zanaflex ist kontraindiziert. Veränderungen der Pharmakokinetik von Tizanidin bei gleichzeitiger Verabreichung mit Ciprofloxacin führten zu einem signifikant verringerten Blutdruck, erhöhter Schläfrigkeit und verstärkter psychomotorischer Beeinträchtigung [siehe KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
Andere CYP1A2-Inhibitoren als Fluvoxamin und Ciprofloxacin
Aufgrund möglicher Arzneimittelwechselwirkungen ist die gleichzeitige Anwendung von Zanaflex mit anderen CYP1A2-Hemmern wie Zileuton, anderen Fluorchinolonen als starken CYP1A2-Hemmern (die kontraindiziert sind), Antiarrhythmika (Amiodaron, Mexiletin, Propafenon und Verapamil), Cimetidin, Famotidin, oralen Kontrazeptiva, Aciclovir und Ticlopidin) sollten vermieden werden. Wenn ihre Anwendung klinisch notwendig ist, sollte die Therapie mit einer 2-mg-Dosis begonnen und je nach Ansprechen des Patienten auf die Therapie in 2-4-mg-Schritten täglich gesteigert werden. Wenn Nebenwirkungen wie Hypotonie, Bradykardie oder übermäßige Schläfrigkeit auftreten, reduzieren oder beenden Sie die Zanaflex-Therapie [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Orale Kontrazeptiva
Die gleichzeitige Anwendung von Zanaflex 2 mg mit oralen Kontrazeptiva wird nicht empfohlen. Wenn jedoch eine gleichzeitige Anwendung klinisch notwendig ist, beginnen Sie mit einer Einzeldosis von 2 mg Zanaflex 4 mg und erhöhen Sie die Dosis in Schritten von 2-4 mg täglich, je nach Ansprechen des Patienten auf die Therapie. Wenn Nebenwirkungen wie Hypotonie, Bradykardie oder übermäßige Schläfrigkeit auftreten, reduzieren oder beenden Sie die Zanaflex-Therapie [siehe KLINISCHE PHARMAKOLOGIE ].
Alkohol
Alkohol erhöht die Gesamtmenge des Arzneimittels im Blutkreislauf nach einer Dosis Zanaflex. Dies war mit einer Zunahme von Nebenwirkungen von Zanaflex verbunden. Die ZNS-dämpfende Wirkung von Zanaflex und Alkohol ist additiv [vgl KLINISCHE PHARMAKOLOGIE ].
Andere ZNS-Depressiva
Die sedierende Wirkung von Zanaflex mit ZNS-dämpfenden Mitteln (z. B. Benzodiazepinen, Opioiden, trizyklischen Antidepressiva) kann sich addieren. Überwachen Sie Patienten, die Zanaflex 2 mg mit einem anderen ZNS-dämpfenden Mittel einnehmen, auf Symptome übermäßiger Sedierung [siehe KLINISCHE PHARMAKOLOGIE ].
α2-adrenerge Agonisten
Da blutdrucksenkende Wirkungen kumulativ sein können, wird die Anwendung von Zanaflex 4 mg mit anderen α2-adrenergen Agonisten nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Drogenmissbrauch und -abhängigkeit
Missbrauch
Das Missbrauchspotential wurde in Studien am Menschen nicht bewertet. Ratten waren nach dem Training in der Lage, Tizanidin von Kochsalzlösung in einem Standardunterscheidungsparadigma zu unterscheiden, konnten jedoch die Wirkungen von Morphin, Kokain, Diazepam oder Phenobarbital nicht auf Tizanidin verallgemeinern.
Abhängigkeit
Tizanidin ist eng mit Clonidin verwandt, das häufig in Kombination mit Betäubungsmitteln missbraucht wird und bekanntermaßen bei abruptem Absetzen Rebound-Symptome verursacht. Drei Fälle von Rebound-Symptomen nach plötzlichem Absetzen von Tizanidin wurden berichtet. Die Fallberichte deuten darauf hin, dass diese Patienten auch Betäubungsmittel missbrauchten. Zu den Entzugssymptomen gehörten Hypertonie, Tachykardie, Hypertonie, Tremor und Angstzustände. Entzugssymptome treten eher in Fällen auf, in denen hohe Dosen angewendet werden, insbesondere über längere Zeiträume, oder bei gleichzeitiger Anwendung von Betäubungsmitteln. Wenn die Therapie abgebrochen werden muss, sollte die Dosis langsam verringert werden, um das Risiko von Entzugserscheinungen zu minimieren [siehe DOSIERUNG UND ANWENDUNG ].
Es wurde gezeigt, dass Affen sich Tizanidin dosisabhängig selbst verabreichen, und ein abruptes Absetzen von Tizanidin führte zu vorübergehenden Entzugserscheinungen bei Dosen, die > dem 35-Fachen der maximal empfohlenen Dosis für Menschen auf mg/m²-Basis entsprachen. Diese vorübergehenden Entzugserscheinungen (erhöhte Fortbewegung, Körperzuckungen und aversives Verhalten gegenüber dem Beobachter) wurden durch die Naloxon-Verabreichung nicht rückgängig gemacht.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Hypotonie
Tizanidin ist ein α2-adrenerger Agonist, der Hypotonie hervorrufen kann. In der Post-Marketing-Einstellung wurde über Synkopen berichtet. Die Wahrscheinlichkeit einer signifikanten Hypotonie kann möglicherweise minimiert werden, indem die Dosis titriert wird und die Aufmerksamkeit auf Anzeichen und Symptome einer Hypotonie gerichtet wird, bevor die Dosis erhöht wird. Darüber hinaus besteht bei Patienten, die sich von einer liegenden in eine fixierte aufrechte Position bewegen, möglicherweise ein erhöhtes Risiko für Hypotonie und orthostatische Wirkungen.
Achten Sie auf Hypotonie, wenn Zanaflex bei Patienten angewendet wird, die gleichzeitig eine antihypertensive Therapie erhalten. Es wird nicht empfohlen, Zanaflex 2 mg zusammen mit anderen α2-adrenergen Agonisten zu verwenden. Bei gleichzeitiger Gabe von entweder Fluvoxamin oder Ciprofloxacin und Einzeldosen von 4 mg Zanaflex wurde über klinisch signifikante Hypotonie (Abnahme sowohl des systolischen als auch des diastolischen Drucks) berichtet. Daher ist die gleichzeitige Anwendung von Zanaflex mit Fluvoxamin oder mit Ciprofloxacin, starken Inhibitoren von CYP1A2, kontraindiziert [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Risiko einer Leberschädigung
Zanaflex kann hepatozelluläre Leberschäden verursachen. Zanaflex 4 mg sollte bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden. Eine Überwachung der Aminotransferasespiegel wird zu Studienbeginn und 1 Monat nach Erreichen der Höchstdosis oder bei Verdacht auf Leberschädigung empfohlen [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Sedierung
Zanaflex kann eine Sedierung verursachen, die die alltäglichen Aktivitäten beeinträchtigen kann. In den Mehrfachdosisstudien erreichte die Prävalenz von Patienten mit Sedierung nach der ersten Woche der Titration ihren Höhepunkt und blieb dann für die Dauer der Erhaltungsphase der Studie stabil. Die ZNS-dämpfende Wirkung von Zanaflex mit Alkohol und anderen ZNS-dämpfenden Mitteln (z. B. Benzodiazepinen, Opioiden, trizyklischen Antidepressiva) kann sich addieren. Überwachen Sie Patienten, die Zanaflex 4 mg mit einem anderen ZNS-dämpfenden Mittel einnehmen, auf Symptome übermäßiger Sedierung [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].

Halluzinose/psychoseähnliche Symptome
Die Anwendung von Zanaflex 4 mg wurde mit Halluzinationen in Verbindung gebracht. In zwei nordamerikanischen kontrollierten klinischen Studien wurde bei 5 von 170 Patienten (3 %) über gebildete visuelle Halluzinationen oder Wahnvorstellungen berichtet. Die meisten Patienten waren sich bewusst, dass die Ereignisse unwirklich waren. Ein Patient entwickelte eine Psychose in Verbindung mit den Halluzinationen. Ein Patient unter diesen 5 hatte noch mindestens 2 Wochen nach Absetzen von Tizanidin Probleme. Erwägen Sie das Absetzen von Zanaflex bei Patienten, die Halluzinationen entwickeln.
Wechselwirkung mit CYP1A2-Inhibitoren
Aufgrund möglicher Arzneimittelwechselwirkungen ist Zanaflex 4 mg bei Patienten kontraindiziert, die starke CYP1A2-Hemmer wie Fluvoxamin oder Ciprofloxacin einnehmen. Nebenwirkungen wie Hypotonie, Bradykardie oder übermäßige Schläfrigkeit können auftreten, wenn Zanaflex zusammen mit anderen CYP1A2-Hemmern eingenommen wird, wie Zileuton, anderen Fluorchinolonen als Ciprofloxacin (das kontraindiziert ist), Antiarrhythmika (Amiodaron, Mexiletin, Propafenon), Cimetidin, Famotidin, oral Verhütungsmittel, Aciclovir und Ticlopidin). Die gleichzeitige Anwendung sollte vermieden werden, es sei denn, die Notwendigkeit einer Therapie mit Zanaflex 2 mg ist klinisch offensichtlich. Verwenden Sie in einem solchen Fall mit Vorsicht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Überempfindlichkeitsreaktionen
Zanaflex kann Anaphylaxie verursachen. Es wurde über Anzeichen und Symptome wie Beeinträchtigung der Atemwege, Urtikaria und Angioödem des Rachens und der Zunge berichtet. Die Patienten sollten über die Anzeichen und Symptome schwerer allergischer Reaktionen informiert und angewiesen werden, Zanaflex abzusetzen und unverzüglich einen Arzt aufzusuchen, falls diese Anzeichen und Symptome auftreten [siehe KONTRAINDIKATIONEN ].
Erhöhtes Risiko von Nebenwirkungen bei Patienten mit eingeschränkter Nierenfunktion
Zanaflex sollte bei Patienten mit Niereninsuffizienz (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Nebenwirkungen beim Absetzen
Absetz-Nebenwirkungen umfassen Rebound-Hypertonie, Tachykardie und Hypertonie. Um das Risiko dieser Reaktionen zu minimieren, insbesondere bei Patienten, die hohe Dosen (20 bis 28 mg täglich) über einen langen Zeitraum (9 Wochen oder länger) erhalten haben oder möglicherweise gleichzeitig mit Betäubungsmitteln behandelt werden, sollte die Dosis verringert werden langsam (2 bis 4 mg pro Tag) [vgl DOSIERUNG UND ANWENDUNG ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Tizanidin wurde Mäusen 78 Wochen lang in oralen Dosen von bis zu 16 mg/kg/Tag verabreicht, was dem Zweifachen der maximal empfohlenen Humandosis (MRHD) von 36 mg/Tag auf Basis der Körperoberfläche (mg/m²) entspricht. Tizanidin wurde Ratten 104 Wochen lang in oralen Dosen von bis zu 9 mg/kg/Tag verabreicht, was dem 2,5-fachen der MRHD auf mg/m²-Basis entspricht. Bei beiden Arten gab es keine Zunahme von Tumoren.
Mutagenese
Tizanidin war in In-vitro-Tests (bakterielle Rückmutation [Ames], Säuger-Genmutation und Chromosomenaberrationstest in Säugerzellen) und In-vivo-Tests (Knochenmark-Mikronukleus und Zytogenetik) negativ.
Beeinträchtigung der Fruchtbarkeit
Die orale Verabreichung von Tizanidin an Ratten vor und während der Paarung und während der frühen Trächtigkeit bei Weibchen führte zu einer verminderten Fertilität bei männlichen und weiblichen Ratten bei Dosen von 30 bzw. 10 mg/kg/Tag. Bei Dosierungen von 10 (männlich) und 3 (weiblich) mg/kg/Tag, was etwa dem Dreifachen bzw. ähnlich der MRHD auf mg/m²-Basis entspricht, wurde keine Auswirkung auf die Fertilität beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Es liegen keine hinreichenden Daten zum Entwicklungsrisiko im Zusammenhang mit der Anwendung von Zanaflex 2 mg bei Schwangeren vor. In Tierstudien führte die Verabreichung von Tizanidin während der Schwangerschaft zu Entwicklungstoxizität (embryofetale und postnatale Mortalität der Nachkommen und Wachstumsdefizite) bei Dosen, die geringer waren als die klinisch verwendeten, die nicht mit Toxizität für das Muttertier in Verbindung gebracht wurden (siehe Tierdaten ).
In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwerwiegende Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften 2 % bis 4 % bzw. 15 % bis 20 %. Das Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt.
Daten
Tierdaten
Die orale Verabreichung von Tizanidin (0,3 bis 100 mg/kg/Tag) an trächtige Ratten während der Organogenese führte bei Dosen von 30 mg/kg/Tag und darüber zu embryofötaler und postnataler Mortalität der Nachkommen und zu einer Verringerung des Körpergewichts. Bei der höchsten getesteten Dosis wurde maternale Toxizität beobachtet. Die No-Effect-Dosis für embryofetale Entwicklungstoxizität bei Ratten (3 mg/kg/Tag) ist ähnlich der maximal empfohlenen Dosis beim Menschen (MRHD) von 36 mg/Tag auf Basis der Körperoberfläche (mg/m²).
Die orale Verabreichung von Tizanidin (1 bis 100 mg/kg/Tag) an trächtige Kaninchen während der Organogenese führte bei allen Dosierungen zu embryofetaler und postnataler Mortalität der Nachkommen. Bei der höchsten getesteten Dosis wurde maternale Toxizität beobachtet. Die orale Verabreichung von Tizanidin (10 und 30 mg/kg/Tag) während der perinatalen Phase der Schwangerschaft (2-6 Tage vor der Entbindung) führte bei beiden Dosierungen zu einer erhöhten postnatalen Sterblichkeit der Nachkommen. Eine No-Effect-Dosierung für embryofetale Entwicklungstoxizität bei Kaninchen wurde nicht ermittelt. Die niedrigste getestete Dosis (1 mg/kg/Tag) liegt unter der MRHD auf mg/m²-Basis.
In einer prä- und postnatalen Entwicklungsstudie an Ratten führte die orale Verabreichung von Tizanidin (3 bis 30 mg/kg/Tag) zu einer erhöhten postnatalen Sterblichkeit der Nachkommen. Eine No-Effect-Dosierung für prä- und postnatale Entwicklungstoxizität wurde nicht ermittelt. Die niedrigste getestete Dosis (3 mg/kg/Tag) entspricht der MRHD auf mg/m²-Basis.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Daten über das Vorhandensein von Tizanidin in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Muttermilchproduktion vor. Tierstudien haben über das Vorhandensein von Tizanidin in der Milch von laktierenden Tieren berichtet.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Zanaflex 4 mg und möglichen Nebenwirkungen von Zanaflex auf den gestillten Säugling oder von der zugrunde liegenden Erkrankung der Mutter berücksichtigt werden.
Weibchen und Männchen mit reproduktivem Potenzial
Es gibt keine ausreichenden und gut kontrollierten Studien am Menschen zur Wirkung von Zanaflex 4 mg auf das weibliche oder männliche Fortpflanzungspotenzial. Die orale Verabreichung von Tizanidin an männliche und weibliche Ratten führte zu nachteiligen Wirkungen auf die Fertilität [vgl Nichtklinische Toxikologie ].
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Es ist bekannt, dass Zanaflex 2 mg im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen dieses Arzneimittels kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
Klinische Studien mit Zanaflex 2 mg schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Ein studienübergreifender Vergleich der pharmakokinetischen Daten nach Verabreichung einer Einzeldosis von 6 mg Zanaflex 2 mg zeigte, dass jüngere Probanden das Medikament viermal schneller abbauten als ältere Probanden. Bei älteren Patienten mit Niereninsuffizienz (Kreatinin-Clearance
Beeinträchtigte Nierenfunktion
Es ist bekannt, dass Zanaflex im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen dieses Arzneimittels kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Bei Patienten mit Niereninsuffizienz (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Beeinträchtigte Leberfunktion
Der Einfluss einer Leberfunktionsstörung auf die Pharmakokinetik von Tizanidin wurde nicht untersucht. Da Tizanidin extensiv in der Leber metabolisiert wird, ist zu erwarten, dass eine Leberfunktionsstörung signifikante Auswirkungen auf die Pharmakokinetik von Tizanidin hat [siehe DOSIERUNG UND VERABREICHUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN , und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Eine Überprüfung der Sicherheitsüberwachungsdatenbank ergab Fälle von absichtlicher und versehentlicher Überdosierung von Zanaflex. Einige der Fälle führten zum Tod, und viele der absichtlichen Überdosierungen erfolgten mit mehreren Arzneimitteln, einschließlich ZNS-Depressiva. Die klinischen Manifestationen einer Tizanidin-Überdosierung stimmten mit der bekannten Pharmakologie überein. In den meisten Fällen wurde eine Abnahme des Sensoriums beobachtet, einschließlich Lethargie, Somnolenz, Verwirrtheit und Koma. Eine verminderte Herzfunktion wird ebenfalls beobachtet, einschließlich am häufigsten Bradykardie und Hypotonie. Atemdepression ist ein weiteres häufiges Merkmal einer Tizanidin-Überdosierung.
Im Falle einer Überdosierung sollten grundlegende Maßnahmen ergriffen werden, um sicherzustellen, dass die Atemwege ausreichend sind, und die Überwachung des Herz-Kreislauf- und Atmungssystems. Tizanidin ist ein fettlöslicher Wirkstoff, der in Wasser und Methanol nur wenig löslich ist. Daher ist die Dialyse wahrscheinlich kein wirksames Verfahren zur Entfernung von Arzneimitteln aus dem Körper. Im Allgemeinen klingen die Symptome innerhalb von ein bis drei Tagen nach Absetzen von Tizanidin und Verabreichung einer geeigneten Therapie ab. Aufgrund des ähnlichen Wirkmechanismus ähneln Symptome und Behandlung einer Tizanidin-Überdosierung denen nach einer Clonidin-Überdosierung. Wenden Sie sich für die neuesten Informationen zum Umgang mit einer Überdosierung an eine Giftnotrufzentrale.
KONTRAINDIKATIONEN
Zanaflex ist kontraindiziert bei Patienten, die starke CYP1A2-Inhibitoren wie Fluvoxamin oder Ciprofloxacin einnehmen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Tizanidin ist ein zentraler alpha-2-adrenerger Rezeptoragonist und reduziert vermutlich die Spastik, indem es die präsynaptische Hemmung von Motoneuronen verstärkt. Die Wirkung von Tizanidin ist am größten auf polysynaptischen Signalwegen. Es wird angenommen, dass der Gesamteffekt dieser Maßnahmen die Fazilitation spinaler Motoneuronen verringert.
Pharmakokinetik
Absorption und Verteilung
Nach oraler Gabe wird Tizanidin im Wesentlichen vollständig resorbiert. Die absolute orale Bioverfügbarkeit von Tizanidin beträgt etwa 40 % (CV = 24 %), was auf einen ausgedehnten hepatischen First-Pass-Metabolismus zurückzuführen ist. Tizanidin wird nach intravenöser Verabreichung bei gesunden erwachsenen Probanden mit einem mittleren Steady-State-Verteilungsvolumen von 2,4 l/kg (CV = 21 %) weitgehend im ganzen Körper verteilt. Tizanidin wird zu etwa 30 % an Plasmaproteine gebunden.
Unterschiede zwischen Zanaflex 4 mg Kapseln® und Zanaflex® Tabletten
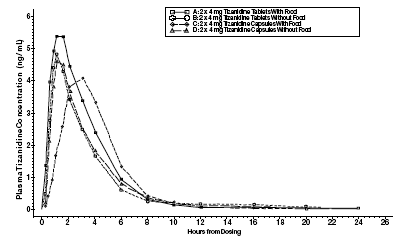
Zanaflex 2 mg Kapseln® und Zanaflex® Tabletten sind unter nüchternen Bedingungen bioäquivalent, jedoch nicht unter Nahrungsaufnahme. Eine Einzeldosis von entweder zwei 4-mg-Tabletten oder zwei 4-mg-Kapseln wurde nach Nahrungsaufnahme und nüchternen Bedingungen in einer offenen, randomisierten Crossover-Studie über vier Perioden an 96 freiwilligen Menschen verabreicht, von denen 81 für die statistische Analyse geeignet waren. Nach oraler Verabreichung entweder der Tablette oder der Kapsel (im nüchternen Zustand) traten maximale Plasmakonzentrationen von Tizanidin 1,0 Stunden nach der Einnahme mit einer Halbwertszeit von etwa 2 Stunden auf. Wenn zwei 4-mg-Tabletten zusammen mit einer Mahlzeit eingenommen wurden, stieg die mittlere maximale Plasmakonzentration um etwa 30 % und die mediane Zeit bis zum Erreichen der maximalen Plasmakonzentration um 25 Minuten auf 1 Stunde und 25 Minuten. Wenn im Gegensatz dazu zwei 4-mg-Kapseln zusammen mit einer Mahlzeit eingenommen wurden, verringerte sich die mittlere maximale Plasmakonzentration um 20 %, die mediane Zeit bis zum Erreichen der maximalen Plasmakonzentration verlängerte sich um 2 bis 3 Stunden. Folglich beträgt die mittlere Cmax für die Kapsel bei Einnahme mit Nahrung etwa 66 % der Cmax für die Tablette bei Einnahme mit Nahrung. Nahrung erhöhte auch das Ausmaß der Resorption sowohl für die Tabletten als auch für die Kapseln. Der Anstieg mit der Tablette (~30%) war deutlich größer als mit der Kapsel (~10%). Folglich betrug die von der Kapsel absorbierte Menge bei Verabreichung jeweils mit Nahrung etwa 80 % der von der Tablette absorbierten Menge. Die Verabreichung des auf Apfelmus gestreuten Kapselinhalts war nicht bioäquivalent zur Verabreichung einer intakten Kapsel unter nüchternen Bedingungen. Die Verabreichung des Kapselinhalts auf Apfelmus führte im Vergleich zur Verabreichung einer intakten Kapsel auf nüchternen Magen zu einem Anstieg der Cmax und AUC von Tizanidin um 15 % bis 20 % und zu einer Verringerung der mittleren Verzögerungszeit und der Zeit bis zur maximalen Konzentration um 15 Minuten.
Abbildung 1: Mittlere Tizanidin-Konzentration vs. Zeitprofile für Zanaflex-Tabletten und -Kapseln (2 × 4 mg) unter nüchternen und ernährten Bedingungen
Stoffwechsel und Ausscheidung
Tizanidin hat eine lineare Pharmakokinetik über die in der klinischen Entwicklung untersuchten Dosen (1-20 mg). Tizanidin hat eine Halbwertszeit von etwa 2,5 Stunden (CV = 33 %). Ungefähr 95 % einer verabreichten Dosis werden metabolisiert. Das primäre Cytochrom-P450-Isoenzym, das am Metabolismus von Tizanidin beteiligt ist, ist CYP1A2. Es ist nicht bekannt, dass Tizanidin-Metabolite aktiv sind; ihre Halbwertszeit liegt zwischen 20 und 40 Stunden.
Nach einmaliger und mehrfacher oraler Gabe von 14C-Tizanidin wurden durchschnittlich 60 % bzw. 20 % der Gesamtradioaktivität im Urin bzw. im Stuhl wiedergefunden.
Spezifische Populationen
Alterseffekte
Es wurde keine spezifische pharmakokinetische Studie zur Untersuchung von Alterseffekten durchgeführt. Ein studienübergreifender Vergleich der pharmakokinetischen Daten nach Verabreichung einer Einzeldosis von 6 mg Zanaflex 2 mg zeigte, dass jüngere Probanden das Medikament viermal schneller abbauten als ältere Probanden. Zanaflex 4 mg wurde bei Kindern nicht untersucht [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Leberfunktionsstörung
Der Einfluss einer Leberfunktionsstörung auf die Pharmakokinetik von Tizanidin wurde nicht untersucht. Da Tizanidin extensiv in der Leber metabolisiert wird, ist zu erwarten, dass eine Leberfunktionsstörung signifikante Auswirkungen auf die Pharmakokinetik von Tizanidin hat. Zanaflex wird für diese Patientengruppe nicht empfohlen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Nierenfunktionsstörung
Die Tizanidin-Clearance ist bei älteren Patienten mit Niereninsuffizienz (Kreatinin-Clearance WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlechtsspezifische Auswirkungen
Es wurde keine spezifische pharmakokinetische Studie zur Untersuchung geschlechtsspezifischer Auswirkungen durchgeführt. Die retrospektive Analyse der pharmakokinetischen Daten nach Einzel- und Mehrfachgabe von 4 mg Zanaflex 2 mg zeigte jedoch, dass das Geschlecht keinen Einfluss auf die Pharmakokinetik von Tizanidin hatte.
Renneffekte
Unterschiede in der Pharmakokinetik aufgrund der Rasse wurden nicht untersucht.
Wechselwirkungen mit anderen Medikamenten
CYP1A2-Inhibitoren
Die Wechselwirkung zwischen Zanaflex und entweder Fluvoxamin oder Ciprofloxacin beruht höchstwahrscheinlich auf der Hemmung von CYP1A2 durch Fluvoxamin oder Ciprofloxacin. Die Wirkung von Fluvoxamin auf die Pharmakokinetik einer Einzeldosis von 4 mg Zanaflex wurde an 10 gesunden Probanden untersucht. Cmax, AUC und Halbwertszeit von Tizanidin erhöhten sich um das 12-Fache, 33-Fache bzw. 3-Fache. Die Wirkung von Ciprofloxacin auf die Pharmakokinetik einer Einzeldosis von 4 mg Zanaflex 4 mg wurde an 10 gesunden Probanden untersucht. Cmax und AUC von Tizanidin stiegen um das 7-Fache bzw. 10-Fache an [vgl KONTRAINDIKATIONEN ].
Obwohl keine klinischen Studien zur Bewertung der Wirkung anderer CYP1A2-Hemmer auf Tizanidin durchgeführt wurden, können andere CYP1A2-Hemmer wie Zileuton, andere Fluorchinolone, Antiarrhythmika (Amiodaron, Mexiletin, Propafenon und Verapamil), Cimetidin, Famotidin, orale Kontrazeptiva, Aciclovir und Ticlopidin, kann auch zu einem erheblichen Anstieg der Tizanidin-Blutkonzentrationen führen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In-vitro-Studien zu Cytochrom-P450-Isoenzymen mit menschlichen Lebermikrosomen weisen darauf hin, dass wahrscheinlich weder Tizanidin noch die Hauptmetaboliten den Metabolismus anderer Arzneimittel beeinflussen, die durch Cytochrom-P450-Isoenzyme metabolisiert werden.
Orale Kontrazeptiva
Es wurde keine spezifische pharmakokinetische Studie durchgeführt, um die Wechselwirkung zwischen oralen Kontrazeptiva und Zanaflex zu untersuchen. Eine retrospektive Analyse von populationspharmakokinetischen Daten nach Einzel- und Mehrfachgabe von 4 mg Zanaflex zeigte jedoch, dass Frauen, die gleichzeitig orale Kontrazeptiva einnahmen, eine um 50 % geringere Clearance von Tizanidin aufwiesen als Frauen, die keine oralen Kontrazeptiva einnahmen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Paracetamol
Tizanidin verzögerte die Tmax von Paracetamol um 16 Minuten. Acetaminophen beeinflusste die Pharmakokinetik von Tizanidin nicht.
Alkohol
Alkohol erhöhte die AUC von Tizanidin um etwa 20 % und gleichzeitig seine Cmax um etwa 15 %. Dies war mit einer Zunahme der Nebenwirkungen von Tizanidin verbunden. Die ZNS-dämpfende Wirkung von Tizanidin und Alkohol ist additiv.
Klinische Studien
Die Fähigkeit von Tizanidin, den mit Spastik verbundenen erhöhten Muskeltonus zu reduzieren, wurde in zwei angemessenen und gut kontrollierten Studien bei Patienten mit Multipler Sklerose oder Rückenmarksverletzung nachgewiesen (Studien 1 und 2).
Einzeldosisstudie bei Patienten mit Multipler Sklerose mit Spastik
In Studie 1 wurden Patienten mit Multipler Sklerose randomisiert, um orale Einzeldosen des Medikaments oder Placebos zu erhalten. Patienten und Gutachter waren gegenüber der Behandlungszuweisung blind und es wurden Anstrengungen unternommen, um die Wahrscheinlichkeit zu verringern, dass die Gutachter indirekt von der Behandlungszuweisung erfahren würden (z. B. versorgten sie die Patienten nicht direkt und es war ihnen untersagt, Fragen zu Nebenwirkungen zu stellen). Insgesamt erhielten 140 Patienten Placebo, 8 mg oder 16 mg Zanaflex.
Das Ansprechen wurde durch körperliche Untersuchung beurteilt; Der Muskeltonus wurde auf einer 5-Punkte-Skala (Ashworth-Score) bewertet, wobei ein Wert von 0 verwendet wurde, um einen normalen Muskeltonus zu beschreiben. Eine Punktzahl von 1 zeigte einen leichten spastischen Fang an, während eine Punktzahl von 2 einen ausgeprägteren Muskelwiderstand anzeigte. Eine Punktzahl von 3 wurde verwendet, um eine beträchtliche Tonuszunahme zu beschreiben, die eine passive Bewegung erschwert. Einem Muskel, der durch Spastizität immobilisiert war, wurde eine Punktzahl von 4 gegeben. Es wurden auch Krampfzahlen gesammelt.
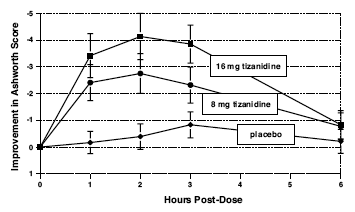
Die Bewertungen erfolgten 1, 2, 3 und 6 Stunden nach der Behandlung. Eine statistisch signifikante Verringerung des Ashworth-Scores für Zanaflex 2 mg im Vergleich zu Placebo wurde 1, 2 und 3 Stunden nach der Behandlung festgestellt. Abbildung 2 unten zeigt einen Vergleich der mittleren Veränderung des Muskeltonus gegenüber dem Ausgangswert, gemessen anhand der Ashworth-Skala. Die größte Verringerung des Muskeltonus trat 1 bis 2 Stunden nach der Behandlung auf. 6 Stunden nach der Behandlung war der Muskeltonus in den Gruppen mit 8 und 16 mg Zanaflex 2 mg nicht mehr vom Muskeltonus der mit Placebo behandelten Patienten zu unterscheiden. Bei einem bestimmten Patienten wurde die Verbesserung des Muskeltonus mit der Plasmakonzentration korreliert. Die Plasmakonzentrationen waren bei einer gegebenen Dosis von Patient zu Patient unterschiedlich. Obwohl 16 mg eine stärkere Wirkung hervorriefen, traten Nebenwirkungen, einschließlich Hypotonie, häufiger und schwerer auf als in der 8-mg-Gruppe. Es gab keine Unterschiede in der Anzahl der auftretenden Spasmen in jeder Gruppe.
Abbildung 2: Einzeldosisstudie – mittlere Veränderung des Muskeltonus gegenüber dem Ausgangswert, gemessen anhand der Ashworth-Skala ± 95 % Konfidenzintervall (ein negativer Ashworth-Score bedeutet eine Verbesserung des Muskeltonus gegenüber dem Ausgangswert)
Sieben-Wochen-Studie bei Patienten mit Rückenmarksverletzung mit Spastik
In einer 7-wöchigen Studie (Studie 2) wurden 118 Patienten mit Spastik infolge einer Rückenmarksverletzung randomisiert entweder Placebo oder Zanaflex zugeteilt. Es wurden ähnliche Schritte wie in der ersten Studie unternommen, um die Integrität der Verblindung sicherzustellen.
Die Patienten wurden über 3 Wochen bis zu einer maximal tolerierten Dosis oder 36 mg täglich in drei ungleichen Dosen (z. B. 10 mg morgens und nachmittags und 16 mg abends) titriert. Die Patienten wurden dann weitere 4 Wochen lang auf ihrer maximal verträglichen Dosis gehalten (dh Erhaltungsphase). Während der Erhaltungsphase wurde der Muskeltonus auf der Ashworth-Skala innerhalb eines Zeitraums von 2,5 Stunden entweder nach der morgendlichen oder nachmittäglichen Dosis beurteilt. Die Anzahl der Tageskrämpfe wurde täglich von den Patienten aufgezeichnet.
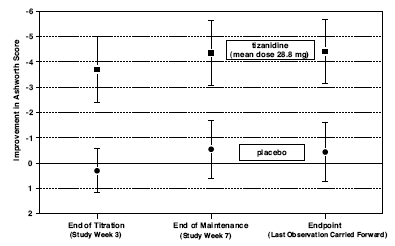
Am Endpunkt (dem im Protokoll festgelegten Zeitpunkt der Ergebnisbewertung) gab es eine statistisch signifikante Verringerung des Muskeltonus und der Häufigkeit von Spasmen in der mit Zanaflex behandelten Gruppe im Vergleich zu Placebo. Die Verringerung des Muskeltonus war nicht mit einer Verringerung der Muskelkraft verbunden (ein wünschenswertes Ergebnis), führte aber auch nicht zu einem dauerhaften Vorteil der mit Zanaflex behandelten Patienten bei Messungen der Aktivitäten des täglichen Lebens. Abbildung 3 unten zeigt einen Vergleich der mittleren Veränderung des Muskeltonus gegenüber dem Ausgangswert, gemessen anhand der Ashworth-Skala.
Abbildung 3: Sieben-Wochen-Studie – Mittlere Veränderung des Muskeltonus 0,5–2,5 Stunden nach der Einnahme, gemessen anhand der Ashworth-Skala ± 95 % Konfidenzintervall (ein negativer Ashworth-Score weist auf eine Verbesserung des Muskeltonus gegenüber dem Ausgangswert hin)
INFORMATIONEN ZUM PATIENTEN
Schwerwiegende Arzneimittelwechselwirkungen
Weisen Sie Patienten darauf hin, dass sie Zanaflex nicht einnehmen sollten, wenn sie Fluvoxamin oder Ciprofloxacin einnehmen, da das Risiko schwerwiegender Nebenwirkungen, einschließlich starker Blutdrucksenkung und Sedierung, erhöht ist. Weisen Sie die Patienten an, ihren Arzt oder Apotheker zu informieren, wenn sie mit der Einnahme von Medikamenten beginnen oder aufhören, da mit Wechselwirkungen zwischen Zanaflex und anderen Arzneimitteln Risiken verbunden sind.
Zanaflex-Dosierung
Weisen Sie die Patienten an, Zanaflex 2 mg genau wie vorgeschrieben einzunehmen (entweder mit oder ohne Nahrung) und nicht zwischen Tabletten und Kapseln zu wechseln. Informieren Sie die Patienten darüber, dass sie aufgrund des Risikos unerwünschter Ereignisse bei Einzeldosen von mehr als 8 mg oder Tagesgesamtdosen von mehr als 36 mg nicht mehr Zanaflex 2 mg als verschrieben einnehmen sollten. Sagen Sie den Patienten, dass sie Zanaflex 4 mg nicht plötzlich absetzen sollten, da Rebound-Hypertonie und Tachykardie auftreten können.
Auswirkungen von Zanaflex
Weisen Sie die Patienten darauf hin, dass bei ihnen eine Hypotonie auftreten kann, und seien Sie vorsichtig, wenn Sie von einer liegenden oder sitzenden in eine stehende Position wechseln. Informieren Sie die Patienten darüber, dass Zanaflex sie sedieren oder schläfrig machen kann und dass sie vorsichtig sein sollten, wenn sie Aktivitäten ausführen, die Aufmerksamkeit erfordern, wie z. B. das Führen eines Fahrzeugs oder das Bedienen von Maschinen. Informieren Sie die Patienten darüber, dass die Sedierung additiv sein kann, wenn Zanaflex 4 mg zusammen mit Arzneimitteln (Baclofen, Benzodiazepinen) oder Substanzen (z. B. Alkohol) eingenommen wird, die als ZNS-Depressiva wirken. Erinnern Sie die Patienten daran, dass, wenn sie auf ihre Spastik angewiesen sind, um Haltung und Gleichgewicht bei der Fortbewegung aufrechtzuerhalten, oder wann immer Spastik genutzt wird, um eine verbesserte Funktion zu erreichen, Zanaflex die Spastik verringert und Vorsicht geboten ist.