Brand Temovate 15g Clobetasol Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Temovate und wie wird es angewendet?
Temovate ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Plaque- und Kopfhaut-Psoriasis und Kortikosteroid-responsiven Dermatosen. Temovate kann allein oder mit anderen Medikamenten verwendet werden.
Temovate gehört zu einer Klasse von Arzneimitteln, die Kortikosteroide, topisch genannt werden.
Es ist nicht bekannt, ob Temovate bei Kindern unter 12 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Temovate haben?
Temovate kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Temovate gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Temovate. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
TEMOVATE® (Clobetasolpropionat-Creme und -Salbe) Creme und Salbe, 0,05 % enthalten den Wirkstoff Clobetasolpropionat, ein synthetisches Kortikosteroid, zur topischen dermatologischen Anwendung. Clobetasol, ein Analogon von Prednisolon, hat einen hohen Grad an Glucocorticoid-Aktivität und einen geringen Grad an Mineralocorticoid-Aktivität.
Chemisch gesehen ist Clobetasolpropionat (11ß,16ß)-21-Chlor-9-fluor-11-hydroxy-16-methyl-17-(1-oxopropoxy)-pregna-1,4-dien-3,20-dion und es hat die folgende Strukturformel:
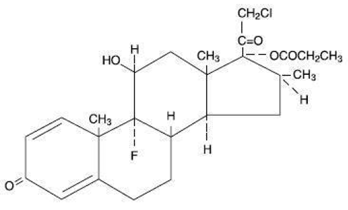
Clobetasolpropionat hat die Summenformel C25H32CIFO5 und ein Molekulargewicht von 467. Es ist ein weißes bis cremefarbenes kristallines Pulver, das in Wasser unlöslich ist.
TEMOVATE® Creme enthält 0,5 mg/g Clobetasolpropionat in einer Cremebasis aus Propylenglycol, Glycerylmonostearat, Cetostearylalkohol, Glycerylstearat, PEG 100-Stearat, weißem Wachs, Chlorcresol, Natriumcitrat, Zitronensäuremonohydrat und gereinigtem Wasser.
TEMOVATE® Salbe enthält 0,5 mg/g Clobetasolpropionat in einer Basis aus Propylenglykol, Sorbitansesquioleat und weißer Vaseline.
INDIKATIONEN
TEMOVATE® Creme und Salbe sind hochwirksame Kortikosteroid-Formulierungen, die zur Linderung der entzündlichen und juckreizartigen Manifestationen von Kortikosteroid-responsiven Dermatosen indiziert sind. Eine Behandlung über 2 aufeinanderfolgende Wochen hinaus wird nicht empfohlen, und die Gesamtdosis sollte 50 g/Woche nicht überschreiten, da das Arzneimittel möglicherweise die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) unterdrückt. Die Anwendung bei pädiatrischen Patienten unter 12 Jahren wird nicht empfohlen.
Wie bei anderen hochaktiven Kortikosteroiden sollte die Therapie abgebrochen werden, wenn die Kontrolle erreicht ist. Wenn innerhalb von 2 Wochen keine Besserung eintritt, kann eine Neubewertung der Diagnose erforderlich sein.
DOSIERUNG UND ANWENDUNG
TEMOVATE® Creme oder Salbe zweimal täglich dünn auf die betroffenen Hautpartien auftragen und sanft und vollständig einmassieren (s INDIKATIONEN UND VERWENDUNG ).
TEMOVATE® Creme und Salbe sind superhochwirksame topische Corti-Costeroide; deshalb, Die Behandlung sollte auf 2 aufeinanderfolgende Wochen begrenzt werden und Mengen über 50 g/Woche sollten nicht angewendet werden.
Wie bei anderen hochaktiven Kortikosteroiden sollte die Therapie abgebrochen werden, wenn die Kontrolle erreicht ist. Wenn innerhalb von 2 Wochen keine Besserung eintritt, kann eine Neubewertung der Diagnose erforderlich sein.
TEMOVATE® Creme und Salbe sollte nicht mit Okklusivverbänden verwendet werden.
Geriatrische Verwendung
In Studien, in denen geriatrische Patienten (65 Jahre oder älter, s VORSICHTSMASSNAHMEN mit TEMOVATE® Creme oder Salbe behandelt wurden, unterschied sich die Sicherheit nicht von der bei jüngeren Patienten; daher wird keine Dosisanpassung empfohlen.
WIE GELIEFERT
TEMOVATE® (Clobetasolpropionat-Creme) Creme, 0,05 % wird geliefert in:
30-g-Tuben ( NDC 10337-163-30) und 60-g-Tuben ( NDC 10337-163-60).
TEMOVATE® (Clobetasolpropionat-Salbe) Salbe, 0,05 % wird geliefert in:
15-g-Tuben ( NDC 10337-162-15) und 30-g-Tuben ( NDC 10337-162-30).
Zwischen 15° und 30°C (59° und 86°F) lagern. TEMOVATE® Creme sollte nicht gekühlt werden. PharmaDerm
Ein Geschäftsbereich von Fougera Pharmaceuticals Inc., Melville, NY 11747 USA. Überarbeitet: Januar 2012
NEBENWIRKUNGEN
In kontrollierten klinischen Studien waren die am häufigsten berichteten Nebenwirkungen von TEMOVATE® Creme Brennen und Stechen bei 1 % der behandelten Patienten. Weniger häufige Nebenwirkungen waren Juckreiz, Hautatrophie sowie Rissbildung und Fissurenbildung der Haut.
In kontrollierten klinischen Studien waren die häufigsten unerwünschten Ereignisse, die für TEMOVATE® Salbe berichtet wurden, Brennen, Reizung und Juckreiz bei 0,5 % der behandelten Patienten. Weniger häufige Nebenwirkungen waren Stechen, Reißen, Erythem, Follikulitis, Taubheit der Finger, Hautatrophie und Teleangiektasien.
Das Cushing-Syndrom wurde bei Säuglingen und Erwachsenen als Folge einer längeren Anwendung von topischen Formulierungen von Clobetasolpropionat berichtet.
Die folgenden zusätzlichen lokalen Nebenwirkungen wurden bei topischen Kortikosteroiden berichtet und können häufiger bei der Anwendung von Okklusivverbänden und Kortikosteroiden mit höherer Potenz auftreten. Diese Reaktionen sind in ungefähr absteigender Reihenfolge ihres Auftretens aufgelistet: Trockenheit, akneiforme Eruptionen, Hypopigmentierung, periorale Dermatitis, allergische Kontaktdermatitis, Sekundärinfektion, Reizung, Striae und Miliaria.

WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Keine Informationen bereitgestellt.
WARNUNGEN
Keine Informationen bereitgestellt. Bitte sehen VORSCHRIFTEN Abschnitt unten.
VORSICHTSMASSNAHMEN
Allgemein
TEMOVATE® Creme und Salbe sollte nicht zur Behandlung von Rosazea oder perioraler Dermatitis und nicht im Gesicht, in der Leiste oder in den Achselhöhlen angewendet werden.
Die systemische Resorption von topischen Kortikosteroiden kann zu einer reversiblen Unterdrückung der HPA-Achse mit der Möglichkeit einer Glukokortikosteroid-Insuffizienz nach Absetzen der Behandlung führen. Manifestationen des Cushing-Syndroms, Hyperglykämie und Glukosurie können bei einigen Patienten auch durch systemische Absorption von topischen Kortikosteroiden während der Therapie hervorgerufen werden.
Patienten, die ein topisches Steroid auf eine große Oberfläche oder auf Bereiche unter Okklusion anwenden, sollten regelmäßig auf Anzeichen einer Unterdrückung der HPA-Achse untersucht werden. Dies kann durch ACTH-Stimulation, AM-Plasmakortisol und freies Kortisol im Urin erfolgen. Patienten, die superpotente Kortikosteroide erhalten, sollten nicht länger als 2 Wochen am Stück behandelt werden, und aufgrund des erhöhten Risikos einer HPA-Suppression sollten immer nur kleine Bereiche gleichzeitig behandelt werden.
TEMOVATE® Creme und Salbe bewirkte eine Unterdrückung der HPA-Achse, wenn sie bei Patienten mit Ekzemen 1 Woche lang in Dosen von nur 2 g/Tag angewendet wurde.
Wenn eine Unterdrückung der HPA-Achse festgestellt wird, sollte versucht werden, das Medikament abzusetzen, die Anwendungshäufigkeit zu reduzieren oder ein weniger wirksames Kortikosteroid zu ersetzen. Die Wiederherstellung der HPA-Achsenfunktion erfolgt im Allgemeinen sofort nach Absetzen topischer Kortikosteroide. Gelegentlich können Anzeichen und Symptome einer Glukokortikosteroidinsuffizienz auftreten, die eine zusätzliche systemische Kortikosteroidgabe erforderlich machen. Informationen zur systemischen Supplementierung finden Sie in den Verschreibungsinformationen für diese Produkte.
Pädiatrische Patienten können aufgrund ihres größeren Verhältnisses von Hautoberfläche zu Körpermasse anfälliger für systemische Toxizität von äquivalenten Dosen sein (siehe VORSICHTSMASSNAHMEN : Pädiatrische Verwendung ).
Wenn eine Reizung auftritt, sollte TEMOVATE® Creme und Salbe abgesetzt und eine geeignete Therapie eingeleitet werden. Allergische Kontaktdermatitis mit Kortikosteroiden wird normalerweise diagnostiziert, indem ein Heilungsversagen beobachtet wird, anstatt eine klinische Exazerbation zu bemerken, wie bei den meisten topischen Produkten, die keine Kortikosteroide enthalten. Eine solche Beobachtung sollte durch geeignete diagnostische Patch-Tests bestätigt werden.
Wenn gleichzeitig Hautinfektionen vorhanden sind oder sich entwickeln, sollte ein geeignetes Antimykotikum oder antibakterielles Mittel verwendet werden. Wenn nicht sofort eine positive Reaktion eintritt, sollte die Anwendung von TEMOVATE® Creme und Salbe unterbrochen werden, bis die Infektion angemessen kontrolliert wurde.
Labortests
Die folgenden Tests können bei der Beurteilung von Patienten auf HPA-Achsenunterdrückung hilfreich sein:
ACTH-Stimulationstest AM-Plasma-Cortisol-Test Test auf freies Cortisol im Urin
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeit-Tierstudien durchgeführt, um das karzinogene Potenzial von Clobetasolpropionat zu bewerten.
Studien an Ratten nach subkutaner Verabreichung von Dosierungen bis zu 50 mcg/kg/Tag zeigten, dass die Weibchen bei der höchsten Dosis eine Zunahme der Anzahl resorbierter Embryonen und eine Abnahme der Anzahl lebender Föten aufwiesen.
Clobetasolpropionat war in 3 verschiedenen Testsystemen nicht mutagen: dem Ames-Test, dem Saccharomyces cerevisiae-Genumwandlungstest und dem E. coli B WP2-Fluktuationstest.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C. Corticosteroide haben sich bei Labortieren als teratogen erwiesen, wenn sie systemisch in relativ niedrigen Dosierungen verabreicht wurden. Einige Kortikosteroide haben sich nach dermaler Anwendung bei Labortieren als teratogen erwiesen.
Clobetasolpropionat wurde bei topischer Anwendung nicht auf Teratogenität getestet; es wird jedoch perkutan absorbiert und war bei subkutaner Verabreichung sowohl bei Kaninchen als auch bei Mäusen ein signifikantes Teratogen. Clobetasolpropionat hat ein größeres teratogenes Potenzial als weniger wirksame Steroide.
Teratogenitätsstudien an Mäusen bei subkutaner Verabreichung ergaben Fetotoxizität bei der höchsten getesteten Dosis (1 mg/kg) und Teratogenität bei allen getesteten Dosierungen bis hinab zu 0,03 mg/kg. Diese Dosen entsprechen etwa dem 1,4- bzw. 0,04-fachen der topischen Humandosis von TEMOVATE® Creme und Salbe. Zu den beobachteten Anomalien gehörten Gaumenspalten und Skelettanomalien.
Bei Kaninchen war Clobetasolpropionat in Dosen von 3 und 10 µg/kg teratogen. Diese Dosen entsprechen etwa dem 0,02- bzw. 0,05-fachen der topischen Dosis von TEMOVATE® Creme und Salbe beim Menschen. Zu den beobachteten Anomalien gehörten Gaumenspalten, Cranioschisis und andere Skelettanomalien.
Es liegen keine ausreichenden und gut kontrollierten Studien zum teratogenen Potenzial von Clobetasolpropionat bei Schwangeren vor. TEMOVATE® Creme und Salbe sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Systemisch verabreichte Kortikosteroide treten in der Muttermilch auf und können das Wachstum unterdrücken, die endogene Kortikosteroidproduktion beeinträchtigen oder andere unerwünschte Wirkungen hervorrufen. Es ist nicht bekannt, ob die topische Verabreichung von Kortikosteroiden zu einer ausreichenden systemischen Resorption führen könnte, um nachweisbare Mengen in der Muttermilch zu produzieren. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn TEMOVATE® Creme oder Salbe einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von TEMOVATE® Creme und Salbe bei pädiatrischen Patienten wurde nicht nachgewiesen. Die Anwendung bei pädiatrischen Patienten unter 12 Jahren wird nicht empfohlen. Aufgrund eines höheren Verhältnisses von Hautoberfläche zu Körpermasse besteht bei pädiatrischen Patienten ein größeres Risiko als bei Erwachsenen für HPA-Achsenunterdrückung und Cushing-Syndrom, wenn sie mit topischen Kortikosteroiden behandelt werden. Sie haben daher auch ein erhöhtes Risiko einer Nebenniereninsuffizienz während oder nach Absetzen der Behandlung. Bei unsachgemäßer Anwendung von topischen Kortikosteroiden bei Säuglingen und Kindern wurden Nebenwirkungen einschließlich Striae berichtet.
Unterdrückung der HPA-Achse, Cushing-Syndrom, lineare Wachstumsverzögerung, verzögerte Gewichtszunahme und intrakranielle Hypertonie wurden bei Kindern berichtet, die topische Kortikosteroide erhielten. Zu den Manifestationen der Nebennierensuppression bei Kindern gehören niedrige Cortisolspiegel im Plasma und eine fehlende Reaktion auf eine ACTH-Stimulation. Zu den Manifestationen der intrakraniellen Hypertonie gehören vorgewölbte Fontanellen, Kopfschmerzen und beidseitiges Papillenödem.
Geriatrische Verwendung
Eine begrenzte Anzahl von Patienten ab 65 Jahren wurde in klinischen Studien in den USA und außerhalb der USA mit TEMOVATE® Creme (n = 231) und mit TEMOVATE® Salbe (n = 101) behandelt. Obwohl die Anzahl der Patienten zu klein ist, um eine getrennte Analyse der Wirksamkeit und Sicherheit zu ermöglichen, waren die Nebenwirkungen, die in dieser Population berichtet wurden, denen ähnlich, die von jüngeren Patienten berichtet wurden. Basierend auf den verfügbaren Daten ist keine Anpassung der Dosierung von TEMOVATE® Creme und Salbe bei geriatrischen Patienten gerechtfertigt.
ÜBERDOSIS
Topisch angewendete TEMOVATE® Creme und Salbe können in ausreichenden Mengen absorbiert werden, um systemische Wirkungen zu erzielen (siehe VORSICHTSMASSNAHMEN ).
KONTRAINDIKATIONEN
TEMOVATE® (Clobetasol-Propionat-Creme und -Salbe) Creme und Salbe, 0,05 %, sind bei Patienten mit bekannter Überempfindlichkeit gegen einen der Bestandteile der Präparate kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wie andere topische Kortikosteroide hat Clobetasolpropionat entzündungshemmende, juckreizstillende und vasokonstriktive Eigenschaften. Der Mechanismus der entzündungshemmenden Aktivität der topischen Steroide ist im Allgemeinen unklar. Es wird jedoch angenommen, dass Kortikosteroide durch die Induktion von Phospholipase A2-hemmenden Proteinen wirken, die gemeinsam als Lipocortine bezeichnet werden. Es wird postuliert, dass diese Proteine die Biosynthese potenter Entzündungsmediatoren wie Prostaglandine und Leukotriene kontrollieren, indem sie die Freisetzung ihres gemeinsamen Vorläufers Arachidonsäure hemmen. Arachidonsäure wird durch Phospholipase A2 aus Membran-Phospholipiden freigesetzt.
Pharmakokinetik
Das Ausmaß der perkutanen Resorption topischer Kortikosteroide wird durch viele Faktoren bestimmt, einschließlich des Vehikels und der Integrität der epidermalen Barriere. Es wurde nicht nachgewiesen, dass ein Okklusivverband mit Hydrocortison für bis zu 24 Stunden die Penetration erhöht; jedoch verbessert die Okklusion von Hydrocortison für 96 Stunden die Penetration deutlich. Topische Kortikosteroide können von normaler intakter Haut resorbiert werden. Entzündungen und/oder andere Krankheitsprozesse in der Haut können die perkutane Resorption erhöhen.
Studien, die mit TEMOVATE® Creme und Salbe durchgeführt wurden, weisen darauf hin, dass sie im Vergleich zu anderen topischen Kortikosteroiden im sehr hohen Potenzbereich liegen.
INFORMATIONEN ZUM PATIENTEN
Patienten, die topische Kortikosteroide anwenden, sollten die folgenden Informationen und Anweisungen erhalten: