Elocon 5g Mometasone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Elocon 5g und wie wird es angewendet?
Elocon (Mometasonfuroat) Creme, 0,1 % ist eine Kortikosteroid-Creme, -Lotion oder -Salbe zur lokalen Anwendung zur Linderung der entzündlichen und juckenden Manifestationen von Kortikosteroid-empfindlichen Dermatosen bei Patienten ab 2 Jahren.
Welche Nebenwirkungen hat Elocon 5g?
Häufige Nebenwirkungen von Elocon sind:
BEZEICHNUNG
ELOCON (Mometasonfuroat) Creme, 0,1 % enthält Mometasonfuroat zur topischen Anwendung. Mometasonfuroat ist ein synthetisches Kortikosteroid mit entzündungshemmender Wirkung.
Chemisch gesehen ist Mometasonfuroat 9α,21-Dichlor-11β,17-dihydroxy-16α-methylpregna-1,4-diene3,20-dion 17-(2-furoate) mit der empirischen Formel C27 H30CI2O6, einem Molekulargewicht von 521,4 und die folgende Strukturformel:
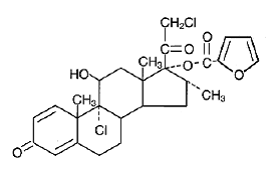
Mometasonfuroat ist ein weißes bis cremefarbenes Pulver, praktisch unlöslich in Wasser, schwach löslich in Octanol und mäßig löslich in Ethylalkohol.
Jedes Gramm ELOCON 5 g Creme, 0,1 % enthält 1 mg Mometasonfuroat in einer weißen bis cremefarbenen Cremebasis aus Aluminiumstärkeoctenylsuccinat (gammabestrahlt), Hexylenglykol, hydriertem Sojalecithin, Phosphorsäure, gereinigtem Wasser, Titandioxid, weiß weich Paraffin und weißes Wachs.
INDIKATIONEN
ELOCON® Cream ist ein Corticosteroid, das zur Linderung der entzündlichen und juckenden Manifestationen von Corticosteroid-responsiven Dermatosen bei Patienten ab 2 Jahren indiziert ist.
DOSIERUNG UND ANWENDUNG
ELOCON Creme einmal täglich dünn auf die betroffenen Hautstellen auftragen. ELOCON Creme kann bei pädiatrischen Patienten ab 2 Jahren angewendet werden. Da Sicherheit und Wirksamkeit von ELOCON Cream bei pädiatrischen Patienten unter 2 Jahren nicht nachgewiesen wurden; Die Anwendung in dieser Altersgruppe wird nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Populationen ].
Die Therapie sollte abgebrochen werden, wenn die Kontrolle erreicht ist. Wenn innerhalb von 2 Wochen keine Besserung eintritt, kann eine Neubewertung der Diagnose erforderlich sein. Die Sicherheit und Wirksamkeit von ELOCON Cream bei pädiatrischen Patienten bei einer Anwendung von mehr als 3 Wochen wurde nicht nachgewiesen.
ELOCON Creme sollte nicht mit Okklusivverbänden verwendet werden, es sei denn, es wurde von einem Arzt verordnet. ELOCON 5g Creme sollte nicht im Windelbereich aufgetragen werden, wenn das Kind noch Windeln oder Plastikhöschen benötigt, da diese Kleidungsstücke einen Okklusivverband darstellen können.
ELOCON Creme ist nur zur topischen Anwendung bestimmt. Es ist nicht zur oralen, ophthalmischen oder intravaginalen Anwendung bestimmt.
Vermeiden Sie die Anwendung im Gesicht, in der Leiste oder in den Achselhöhlen.
WIE GELIEFERT
Darreichungsformen und Stärken
Sahne, 0,1 %. Jedes Gramm ELOCON Cream enthält 1 mg Mometasonfuroat in einer weißen bis cremefarbenen glatten und homogenen Cremebasis.
Lagerung und Handhabung
ELOCON-Creme ist weiß bis cremefarben und wird in 15 g (NDC 0085-3149-01) und 50 g ( NDC 0085-3149-03) Rohre.
Bei 25 °C (77 °F) lagern; Exkursionen bis 15-30°C (59-86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Vermeiden Sie übermäßige Hitze.
Hergestellt für: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Hergestellt von: Schering-Plough Labo NV Heist-op-den-Berg, Belgien. Überarbeitet: April 2013
NEBENWIRKUNGEN
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
In kontrollierten klinischen Studien mit 319 Probanden betrug die Häufigkeit von Nebenwirkungen im Zusammenhang mit der Anwendung von ELOCON 5g Creme 1,6 %. Berichtete Reaktionen waren Brennen, Pruritus und Hautatrophie. Es sind auch Berichte über Rosazea im Zusammenhang mit der Anwendung von ELOCON 5g Creme eingegangen. In kontrollierten klinischen Studien (n=74) mit pädiatrischen Probanden im Alter von 2 bis 12 Jahren betrug die Inzidenz von Nebenwirkungen im Zusammenhang mit der Anwendung von ELOCON 5g Creme etwa 7 %. Berichtete Reaktionen waren Stechen, Pruritus und Furunkulose.
Die folgenden Nebenwirkungen wurden in klinischen Studien bei 4 % von 182 pädiatrischen Probanden im Alter von 6 Monaten bis 2 Jahren als möglicherweise oder wahrscheinlich im Zusammenhang mit der Behandlung mit ELOCON 5 g Creme beschrieben: verringerte Glukokortikoidspiegel, 2; Parästhesie, 2; Follikulitis, 1; Moniliasis, 1; bakterielle Infektion, 1; Hautdepigmentierung, 1. Die folgenden Anzeichen von Hautatrophie wurden auch bei 97 Probanden beobachtet, die in einer klinischen Studie mit ELOCON Cream behandelt wurden: Glanz, 4; Teleangiektasie, 1; Elastizitätsverlust, 4; Verlust normaler Hautmarkierungen, 4; Dünnheit, 1; und Blutergüsse, 1.
Die folgenden zusätzlichen lokalen Nebenwirkungen wurden bei topischen Kortikosteroiden berichtet, können aber bei der Verwendung von Okklusivverbänden häufiger auftreten. Diese Reaktionen sind: Reizung, Trockenheit, Follikulitis, Hypertrichose, akneiforme Eruptionen, Hypopigmentierung, periorale Dermatitis, allergische Kontaktdermatitis, Sekundärinfektion, Striae und Miliaria.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Mit ELOCON Creme wurden keine Arzneimittelwechselwirkungsstudien durchgeführt.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Auswirkungen auf das endokrine System
Die systemische Resorption von topischen Kortikosteroiden kann eine reversible Unterdrückung der Hypothalamus-Hypophysen-Nebennierenrindenachse (HPA) mit der Möglichkeit einer Glukokortikosteroid-Insuffizienz hervorrufen. Dies kann während der Behandlung oder nach Absetzen der Behandlung auftreten. Manifestationen des Cushing-Syndroms, Hyperglykämie und Glukosurie können bei einigen Patienten auch durch systemische Absorption von topischen Kortikosteroiden während der Behandlung hervorgerufen werden. Zu den Faktoren, die einen Patienten, der ein topisches Kortikosteroid anwendet, für eine Unterdrückung der HPA-Achse prädisponieren, sind die Verwendung von hochwirksamen Steroiden, große Behandlungsflächen, längere Anwendung, die Verwendung von Okklusivverbänden, veränderte Hautbarriere, Leberversagen und junges Alter.
Aufgrund der Möglichkeit einer systemischen Resorption kann die Anwendung von topischen Kortikosteroiden erfordern, dass Patienten regelmäßig auf Unterdrückung der HPA-Achse untersucht werden. Dies kann mit dem Stimulationstest des adrenocorticotropen Hormons (ACTH) erfolgen.
In einer Studie zur Bewertung der Wirkungen von Mometasonfuroat-Creme auf die HPA-Achse wurden 15 Gramm zweimal täglich für 7 Tage an sechs erwachsene Probanden mit Psoriasis oder atopischer Dermatitis aufgetragen. Die Ergebnisse zeigen, dass das Medikament eine leichte Senkung der adrenalen Corticosteroid-Sekretion verursachte.
Wenn eine Unterdrückung der HPA-Achse festgestellt wird, sollte versucht werden, das Medikament schrittweise abzusetzen, die Anwendungshäufigkeit zu reduzieren oder ein weniger wirksames Kortikosteroid zu ersetzen. Die Wiederherstellung der HPA-Achsenfunktion erfolgt im Allgemeinen sofort nach Absetzen topischer Kortikosteroide. Gelegentlich können Anzeichen und Symptome einer Glukokortikosteroidinsuffizienz auftreten, die eine zusätzliche systemische Kortikosteroidgabe erfordern.
Pädiatrische Patienten können aufgrund ihres größeren Verhältnisses von Hautoberfläche zu Körpermasse anfälliger für systemische Toxizität von äquivalenten Dosen sein [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Allergische Kontaktdermatitis
Wenn eine Reizung auftritt, sollte ELOCON Cream abgesetzt und eine geeignete Therapie eingeleitet werden. Allergische Kontaktdermatitis mit Kortikosteroiden wird normalerweise diagnostiziert, indem ein Heilungsversagen beobachtet wird, anstatt eine klinische Exazerbation zu bemerken, wie bei den meisten topischen Produkten, die keine Kortikosteroide enthalten. Eine solche Beobachtung sollte durch geeignete diagnostische Patch-Tests bestätigt werden.
Begleitende Hautinfektionen
Wenn gleichzeitig Hautinfektionen vorhanden sind oder sich entwickeln, sollte ein geeignetes Antimykotikum oder antibakterielles Mittel verwendet werden. Wenn nicht sofort eine positive Reaktion eintritt, sollte die Anwendung von ELOCON 5g Creme unterbrochen werden, bis die Infektion ausreichend unter Kontrolle ist.

Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien an Tieren durchgeführt, um das krebserzeugende Potenzial von ELOCON 5g Creme zu bewerten. Langzeitstudien zur Karzinogenität von Mometasonfuroat wurden durch Inhalation an Ratten und Mäusen durchgeführt. In einer 2-jährigen Kanzerogenitätsstudie an Sprague-Dawley-Ratten zeigte Mometasonfuroat bei Inhalationsdosen von bis zu 67 µg/kg (etwa das 0,04-Fache der geschätzten maximalen klinischen topischen Dosis von ELOCON 5 g Creme auf µg/m²-Basis) keine statistisch signifikante Zunahme von Tumoren ). In einer 19-monatigen Karzinogenitätsstudie an Schweizer CD-1-Mäusen zeigte Mometasonfuroat keinen statistisch signifikanten Anstieg der Tumorinzidenz bei Inhalationsdosen von bis zu 160 mcg/kg (etwa das 0,05-fache der geschätzten maximalen klinischen topischen Dosis von ELOCON Cream auf a mcg/m²-Basis).
Mometasonfuroat erhöhte die Chromosomenaberrationen in einem In-vitro-Assay mit Eierstockzellen des chinesischen Hamsters, erhöhte jedoch nicht die Chromosomenaberrationen in einem In-vitro-Assay mit Lungenzellen des chinesischen Hamsters. Mometasonfuroat war im Ames-Test oder Maus-Lymphom-Assay nicht mutagen und in einem In-vivo-Maus-Mikronukleus-Assay, einem Ratten-Knochenmark-Chromosomenaberrations-Assay oder einem männlichen Keimzellen-Chromosomenaberrations-Assay der Maus nicht klastogen. Mometasonfuroat induzierte in vivo in Rattenhepatozyten auch keine außerplanmäßige DNA-Synthese.
In Reproduktionsstudien an Ratten wurde bei männlichen oder weiblichen Ratten durch subkutane Dosen von bis zu 15 µg/kg (ungefähr das 0,01-fache der geschätzten maximalen klinischen topischen Dosis von ELOCON 5 g Creme, auf µg/m²-Basis) keine Beeinträchtigung der Fertilität hervorgerufen.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen – Schwangerschaftskategorie C
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Daher sollte ELOCON 5g Creme während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Kortikosteroide haben sich bei Labortieren als teratogen erwiesen, wenn sie systemisch in relativ niedrigen Dosierungen verabreicht wurden. Einige Kortikosteroide haben sich nach dermaler Anwendung bei Labortieren als teratogen erwiesen.
Bei Verabreichung an trächtige Ratten, Kaninchen und Mäuse verstärkte Mometasonfuroat fötale Missbildungen. Die Dosen, die zu Missbildungen führten, verringerten auch das fötale Wachstum, gemessen an einem niedrigeren fötalen Gewicht und/oder einer verzögerten Ossifikation. Mometasonfuroat verursachte auch Dystokie und damit verbundene Komplikationen, wenn es Ratten am Ende der Trächtigkeit verabreicht wurde.
Bei Mäusen verursachte Mometasonfuroat bei subkutanen Dosen von 60 mcg/kg und mehr eine Gaumenspalte. Das fötale Überleben war bei 180 mcg/kg reduziert. Bei 20 mcg/kg wurde keine Toxizität beobachtet. (Dosen von 20, 60 und 180 mcg/kg bei der Maus sind ungefähr das 0,01-, 0,02- und 0,05-fache der geschätzten maximalen klinischen topischen Dosis von ELOCON Cream auf einer mcg/m²-Basis.)
Bei Ratten führte Mometasonfuroat bei topischen Dosen von 600 mcg/kg und darüber zu Nabelbrüchen. Eine Dosis von 300 mcg/kg führte zu Verzögerungen der Ossifikation, aber zu keinen Missbildungen. (Dosen von 300 und 600 µg/kg bei der Ratte entsprechen etwa dem 0,2- bis 0,4-fachen der geschätzten maximalen klinischen topischen Dosis von ELOCON 5 g Creme auf µg/m²-Basis.)
Bei Kaninchen verursachte Mometasonfuroat multiple Missbildungen (z. B. gebeugte Vorderpfoten, Agenesie der Gallenblase, Nabelbruch, Hydrozephalie) bei topischen Dosen von 150 µg/kg und darüber (ungefähr das 0,2-fache der geschätzten maximalen klinischen topischen Dosis von ELOCON Cream auf einem µg/ m² Basis). In einer oralen Studie erhöhte Mometasonfuroat bei 700 µg/kg die Resorptionen und verursachte Gaumenspalten und/oder Fehlbildungen des Kopfes (Hydrozephalie und Kuppelkopf). Bei 2800 mcg/kg wurden die meisten Würfe abgebrochen oder resorbiert. Bei 140 mcg/kg wurde keine Toxizität beobachtet. (Dosen von 140, 700 und 2800 mcg/kg beim Kaninchen sind ungefähr das 0,2-, 0,9- und 3,6-fache der geschätzten maximalen klinischen topischen Dosis von ELOCON 5 g Creme auf einer mcg/m²-Basis.)
Wenn Ratten subkutane Dosen von Mometasonfuroat während der Trächtigkeit oder während der späteren Stadien der Trächtigkeit erhielten, verursachten 15 mcg/kg verlängerte und erschwerte Wehen und verringerten die Zahl der Lebendgeburten, das Geburtsgewicht und das frühe Überleben der Jungtiere. Ähnliche Wirkungen wurden bei 7,5 mcg/kg nicht beobachtet. (Dosen von 7,5 und 15 µg/kg bei der Ratte entsprechen etwa dem 0,005- bis 0,01-fachen der geschätzten maximalen klinischen topischen Dosis von ELOCON Cream auf µg/m²-Basis.)
Stillende Mutter
Systemisch verabreichte Kortikosteroide treten in der Muttermilch auf und können das Wachstum unterdrücken, die endogene Kortikosteroidproduktion beeinträchtigen oder andere unerwünschte Wirkungen hervorrufen. Es ist nicht bekannt, ob die topische Verabreichung von Kortikosteroiden zu einer ausreichenden systemischen Resorption führen könnte, um nachweisbare Mengen in der Muttermilch zu produzieren. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn ELOCON 5 g Creme einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
ELOCON Creme kann bei pädiatrischen Patienten ab 2 Jahren mit Vorsicht angewendet werden, obwohl die Sicherheit und Wirksamkeit einer Arzneimittelanwendung über mehr als 3 Wochen nicht erwiesen ist. Da die Sicherheit und Wirksamkeit von ELOCON 5g Creme bei pädiatrischen Patienten unter 2 Jahren nicht erwiesen ist, wird die Anwendung in dieser Altersgruppe nicht empfohlen.
In einer pädiatrischen Studie wurden 24 Probanden mit atopischer Dermatitis, davon 19 Probanden im Alter von 2 bis 12 Jahren, einmal täglich mit ELOCON Creme behandelt. Die Mehrheit der Probanden erholte sich innerhalb von 3 Wochen. ELOCON 5 g Creme verursachte eine Unterdrückung der HPA-Achse bei etwa 16 % der pädiatrischen Probanden im Alter von 6 bis 23 Monaten, die vor Beginn der Behandlung eine normale Nebennierenfunktion im Cortrosyn-Test zeigten und über einen Zeitraum von etwa 3 Wochen behandelt wurden mittlere Körperoberfläche von 41 % (Bereich 15 %–94 %). Die Kriterien für die Unterdrückung waren: basaler Cortisolspiegel von ≤ 5 µg/dl, 30-minütiger Poststimulationsspiegel von ≤ 18 µg/dl oder ein Anstieg von KLINISCHE PHARMAKOLOGIE ].
Aufgrund eines höheren Verhältnisses von Hautoberfläche zu Körpermasse besteht bei pädiatrischen Patienten ein größeres Risiko als bei Erwachsenen für eine Unterdrückung der HPA-Achse und ein Cushing-Syndrom, wenn sie mit topischen Kortikosteroiden behandelt werden. Sie haben daher auch ein erhöhtes Risiko einer Nebenniereninsuffizienz während und/oder nach Absetzen der Behandlung. Pädiatrische Patienten können anfälliger für Hautatrophie, einschließlich Striae, sein als Erwachsene, wenn sie mit topischen Kortikosteroiden behandelt werden. Pädiatrische Patienten, die topische Kortikosteroide auf mehr als 20 % der Körperoberfläche anwenden, haben ein höheres Risiko einer Unterdrückung der HPA-Achse.
Unterdrückung der HPA-Achse, Cushing-Syndrom, lineare Wachstumsverzögerung, verzögerte Gewichtszunahme und intrakranielle Hypertonie wurden bei pädiatrischen Patienten berichtet, die topische Kortikosteroide erhielten. Zu den Manifestationen der Nebennierensuppression bei Kindern gehören niedrige Cortisolspiegel im Plasma und eine fehlende Reaktion auf eine ACTH-Stimulation. Zu den Manifestationen der intrakraniellen Hypertonie gehören vorgewölbte Fontanellen, Kopfschmerzen und beidseitiges Papillenödem.
ELOCON Creme sollte nicht zur Behandlung von Windeldermatitis verwendet werden.
Geriatrische Verwendung
An klinischen Studien mit ELOCON 5g Creme nahmen 190 Probanden ab 65 Jahren und 39 Probanden ab 75 Jahren teil. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Eine erhöhte Empfindlichkeit einiger älterer Personen kann jedoch nicht ausgeschlossen werden.
ÜBERDOSIS
Topisch angewendete ELOCON-Creme kann in ausreichenden Mengen absorbiert werden, um systemische Wirkungen hervorzurufen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KONTRAINDIKATIONEN
Keiner.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Wie andere topische Kortikosteroide hat Mometasonfuroat entzündungshemmende, juckreizstillende und vasokonstriktive Eigenschaften. Der Mechanismus der entzündungshemmenden Aktivität der topischen Steroide ist im Allgemeinen unklar. Es wird jedoch angenommen, dass Kortikosteroide durch die Induktion von Phospholipase A2-hemmenden Proteinen wirken, die gemeinsam als Lipocortine bezeichnet werden. Es wird postuliert, dass diese Proteine die Biosynthese potenter Entzündungsmediatoren wie Prostaglandine und Leukotriene kontrollieren, indem sie die Freisetzung ihrer gemeinsamen Vorstufe Arachidonsäure hemmen. Arachidonsäure wird durch Phospholipase A2 aus Membran-Phospholipiden freigesetzt.
Pharmakodynamik
Mit ELOCON 5g Creme durchgeführte Studien weisen darauf hin, dass es im Vergleich zu anderen topischen Kortikosteroiden im mittleren Potenzbereich liegt.
In einer Studie zur Bewertung der Wirkungen von Mometasonfuroat-Creme auf die HPA-Achse wurden 15 Gramm zweimal täglich für 7 Tage an sechs erwachsene Probanden mit Psoriasis oder atopischer Dermatitis aufgetragen. Die Creme wurde ohne Okklusion auf mindestens 30 % der Körperoberfläche aufgetragen. Die Ergebnisse zeigten, dass das Medikament eine leichte Senkung der adrenalen Corticosteroid-Sekretion verursachte [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Siebenundneunzig pädiatrische Probanden im Alter von 6 bis 23 Monaten mit atopischer Dermatitis wurden in eine offene HPA-Achsen-Sicherheitsstudie aufgenommen. ELOCON Cream wurde etwa 3 Wochen lang einmal täglich auf eine mittlere Körperoberfläche von 41 % (Bereich 15 %–94 %) aufgetragen. Bei etwa 16 % der Probanden, die vor Beginn der Behandlung im Cortrosyn-Test eine normale Nebennierenfunktion zeigten, wurde am Ende der Behandlung mit ELOCON 5 g Creme eine Nebennierensuppression beobachtet. Die Kriterien für die Unterdrückung waren: basaler Cortisolspiegel von ≤ 5 µg/dl, 30-minütiger Poststimulationsspiegel von ≤ 18 µg/dl oder ein Anstieg von Verwendung in bestimmten Populationen ].
Pharmakokinetik
Das Ausmaß der perkutanen Resorption von topischen Kortikosteroiden wird durch viele Faktoren bestimmt, einschließlich des Vehikels und der Integrität der epidermalen Barriere. Studien am Menschen zeigen, dass etwa 0,4 % der aufgetragenen Dosis von ELOCON 5 g Creme nach 8 Stunden Kontakt auf normaler Haut ohne Okklusion in den Kreislauf gelangen. Entzündungen und/oder andere Krankheitsprozesse in der Haut können die perkutane Resorption erhöhen.
Klinische Studien
Die Sicherheit und Wirksamkeit der ELOCON 5g-Creme zur Behandlung von auf Kortikosteroide ansprechenden Dermatosen wurden in zwei randomisierten, doppelblinden, Vehikel-kontrollierten klinischen Studien bewertet, eine bei Psoriasis und eine bei atopischer Dermatitis. Insgesamt 366 Probanden (12-81 Jahre alt), von denen 177 ELOCON Creme und 181 Probanden Vehikelcreme erhielten, wurden in diesen Studien untersucht. ELOCON Creme bzw. die Vehikelcreme wurden einmal täglich über 21 Tage aufgetragen.
Die beiden Studien zeigten, dass ELOCON 5g Creme bei der Behandlung von Psoriasis und atopischer Dermatitis wirksam ist.
INFORMATIONEN ZUM PATIENTEN
Patienten über Folgendes informieren: