Crestor 10mg, 20mg, 5mg Rosuvastatin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Crestor und wie wird es angewendet?
Crestor ist ein verschreibungspflichtiges Arzneimittel, das zur Senkung des LDL-Cholesterins (Lipoprotein niedriger Dichte) und der Triglyceride im Blut, zur Verlangsamung des Fortschreitens von Plaque in den Blutgefäßen und zur Verringerung des Schlaganfall- und Herzinfarktrisikos angewendet wird. Crestor 20 mg kann allein oder mit anderen Medikamenten verwendet werden.
Crestor ist ein Lipidsenker, Statine, HMG-CoA-Reduktase-Hemmer.
Es ist nicht bekannt, ob Crestor bei Kindern unter 8 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Crestor haben?
Crestor kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Crestor sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Crestor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
CRESTOR (Rosuvastatin-Calcium) ist ein synthetischer Lipidsenker zur oralen Verabreichung.
Der chemische Name für Rosuvastatin-Calcium lautet Bis[(E)-7-[4-(4-Fluorphenyl)-6-isopropyl-2-[methyl(methylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 ,5-Dihydroxyhept-6-ensäure]-Calciumsalz mit der folgenden Strukturformel:
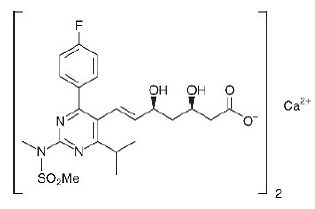
Die empirische Formel für Rosuvastatin-Calcium lautet (C22H27FN3O6S)2Ca und das Molekulargewicht beträgt 1001,14. Rosuvastatin-Calcium ist ein weißes, amorphes Pulver, das in Wasser und Methanol schwer löslich und in Ethanol geringfügig löslich ist. Rosuvastatin-Calcium ist eine hydrophile Verbindung mit einem Verteilungskoeffizienten (Octanol/Wasser) von 0,13 bei einem pH-Wert von 7,0.
CRESTOR Tabletten zur oralen Verabreichung enthalten 5, 10, 20 oder 40 mg Rosuvastatin und die folgenden Hilfsstoffe: Jede Tablette enthält: mikrokristalline Cellulose NF, Lactose-Monohydrat NF, tribasisches Calciumphosphat NF, Crospovidon NF, Magnesiumstearat NF, Hypromellose NF, Triacetin NF, Titandioxid USP, gelbes Eisenoxid und rotes Eisenoxid NF.
INDIKATIONEN
Hyperlipidämie und gemischte Dyslipidämie
CRESTOR ist indiziert als Begleittherapie zu einer Diät zur Senkung erhöhter Werte für Gesamt-C, LDL-C, ApoB, Non-HDL-C und Triglyceride sowie zur Erhöhung von HDL-C bei erwachsenen Patienten mit primärer Hyperlipidämie oder gemischter Dyslipidämie. Lipidverändernde Wirkstoffe sollten zusätzlich zu einer auf gesättigte Fettsäuren und Cholesterin beschränkten Ernährung eingesetzt werden, wenn das Ansprechen auf eine Diät und nichtpharmakologische Interventionen allein unzureichend war.
Pädiatrische Patienten mit familiärer Hypercholesterinämie
CRESTOR 10 mg ist als Ergänzung zu einer Diät indiziert bei:
Hypertriglyzeridämie
CRESTOR ist als Begleittherapie zu einer Diät zur Behandlung von erwachsenen Patienten mit Hypertriglyzeridämie indiziert.
Primäre Dysbetalipoproteinämie (Hyperlipoproteinämie Typ III)
CRESTOR ist zusätzlich zu einer Diät zur Behandlung von erwachsenen Patienten mit primärer Dysbetalipoproteinämie (Hyperlipoproteinämie Typ III) indiziert.
Erwachsene Patienten mit homozygoter familiärer Hypercholesterinämie
CRESTOR ist indiziert als Zusatztherapie zu anderen lipidsenkenden Behandlungen (z. B. LDL-Apherese) oder allein, wenn solche Behandlungen nicht verfügbar sind, um LDL-C, Gesamt-C und ApoB bei erwachsenen Patienten mit homozygoter familiärer Hypercholesterinämie zu senken.
Verlangsamung des Fortschreitens der Arteriosklerose
CRESTOR 5 mg ist als Zusatztherapie zu einer Diät zur Verlangsamung des Fortschreitens der Atherosklerose bei erwachsenen Patienten als Teil einer Behandlungsstrategie zur Senkung von Gesamt-C und LDL-C auf Zielwerte indiziert.
Primärprävention von Herz-Kreislauf-Erkrankungen
Bei Personen ohne klinisch offensichtliche koronare Herzkrankheit, aber mit erhöhtem Risiko für kardiovaskuläre Erkrankungen basierend auf einem Alter von ≥ 50 Jahren bei Männern und ≥ 60 Jahren bei Frauen, hsCRP ≥ 2 mg/l und dem Vorhandensein von mindestens einer weiteren kardiovaskulären Erkrankung Risikofaktor wie Bluthochdruck, niedriges HDL-C, Rauchen oder eine Familienanamnese mit vorzeitiger koronarer Herzkrankheit, ist CRESTOR indiziert für:
Nutzungsbeschränkungen
CRESTOR wurde bei Fredrickson-Typ-I- und -V-Dyslipidämien nicht untersucht.
DOSIERUNG UND ANWENDUNG
Allgemeine Dosierungsinformationen
Der Dosisbereich für CRESTOR 5 mg bei Erwachsenen beträgt 5 bis 40 mg oral einmal täglich. Die übliche Anfangsdosis beträgt 10 bis 20 mg einmal täglich. Die übliche Anfangsdosis bei erwachsenen Patienten mit homozygoter familiärer Hypercholesterinämie beträgt 20 mg einmal täglich.
Die maximale CRESTOR-20-mg-Dosis von 40 mg sollte nur bei Patienten angewendet werden, die ihr LDL-C-Ziel unter Verwendung der 20-mg-Dosis nicht erreicht haben [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
CRESTOR 5 mg kann als Einzeldosis zu jeder Tageszeit mit oder ohne Nahrung verabreicht werden. Die Tablette sollte unzerkaut geschluckt werden.
Beim Beginn einer CRESTOR-Therapie oder beim Wechsel von einer anderen HMG-CoA-Reduktase-Hemmer-Therapie sollte zunächst die geeignete Anfangsdosis von CRESTOR 10 mg verwendet und erst dann entsprechend dem Ansprechen des Patienten und dem individuellen Therapieziel titriert werden.
Nach Beginn oder Titration von CRESTOR sollten die Lipidspiegel innerhalb von 2 bis 4 Wochen analysiert und die Dosierung entsprechend angepasst werden.
Pädiatrische Dosierung
Bei heterozygoter familiärer Hypercholesterinämie beträgt der empfohlene Dosisbereich 5 bis 10 mg p.o. einmal täglich bei Patienten im Alter von 8 bis unter 10 Jahren und 5 bis 20 mg p.o. einmal täglich bei Patienten im Alter von 10 bis 17 Jahren.
Bei homozygoter familiärer Hypercholesterinämie beträgt die empfohlene Dosis 20 mg p.o. einmal täglich bei Patienten im Alter von 7 bis 17 Jahren.
Dosierung bei asiatischen Patienten
Bei asiatischen Patienten ist aufgrund erhöhter Rosuvastatin-Plasmakonzentrationen der Beginn einer Therapie mit CRESTOR 20 mg mit 5 mg einmal täglich zu erwägen. Die erhöhte systemische Exposition sollte berücksichtigt werden, wenn asiatische Patienten mit Dosen bis zu 20 mg/Tag behandelt werden, die nicht ausreichend kontrolliert werden können [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
Verwendung mit begleitender Therapie
Patienten, die Cyclosporin einnehmen
Die Dosis von CRESTOR 20 mg sollte 5 mg einmal täglich nicht überschreiten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Patienten, die Gemfibrozil einnehmen
Vermeiden Sie die gleichzeitige Anwendung von CRESTOR mit Gemfibrozil. Wenn eine gleichzeitige Anwendung nicht vermieden werden kann, beginnen Sie mit CRESTOR mit 5 mg einmal täglich. Die Dosis von CRESTOR sollte 10 mg einmal täglich nicht überschreiten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Patienten, die Atazanavir und Ritonavir, Lopinavir und Ritonavir oder Simeprevir einnehmen
Beginnen Sie die Therapie mit CRESTOR 10 mg mit 5 mg einmal täglich. Die Dosis von CRESTOR sollte 10 mg einmal täglich nicht überschreiten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
Dosierung bei Patienten mit schwerer Nierenfunktionsstörung
Bei Patienten mit schwerer Nierenfunktionsstörung (CLcr Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
5 mg: Gelbe, runde, bikonvexe Dragees. Prägung „CRESTOR“ und „5“ auf einer Seite der Tablette.
10 mg: Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „10“ auf einer Seite der Tablette.
20 mg: Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „20“ auf einer Seite der Tablette.
40 mg: Rosafarbene, ovale, bikonvexe Dragees. Prägung „CRESTOR“ auf einer Seite und „40“ auf der anderen Seite der Tablette.
Lagerung und Handhabung
CRESTOR® (Rosuvastatin-Calcium) Tabletten werden geliefert als:
NDC 0310-0755-90: 5 mg. Gelbe, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „5“ auf einer Seite; Flasche mit 90 Tabletten
NDC 0310-0751-90: 10 mg. Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „10“ auf einer Seite; Flasche mit 90 Tabletten
NDC 0310-0751-39: 10 mg. Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „10“ auf einer Seite; Einheitsdosispackungen mit 100
NDC 0310-0752-90: 20 mg. Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „20“ auf einer Seite; Flaschen zu 90
NDC 0310-0752-39: 20 mg. Rosafarbene, runde, bikonvexe, überzogene Tabletten. Prägung „CRESTOR“ und „20“ auf einer Seite; Einheitsdosispackungen mit 100
NDC 0310-0754-30: 40 mg. Rosafarbene, ovale, bikonvexe Dragees. Prägung „CRESTOR“ auf der einen Seite und „40“ auf der anderen Seite; Flaschen zu 30
Lagerung
Bei kontrollierter Raumtemperatur lagern, 20-25°C (68-77°F) [siehe USP kontrollierte Raumtemperatur ]. Vor Feuchtigkeit schützen.
Vertrieb durch: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Überarbeitet: Sep 2018
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher besprochen:
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
In der CRESTOR-Datenbank für kontrollierte klinische Studien (Placebo oder aktiv kontrolliert) mit 5394 Patienten mit einer mittleren Behandlungsdauer von 15 Wochen brachen 1,4 % der Patienten die Behandlung aufgrund von Nebenwirkungen ab. Die häufigsten Nebenwirkungen, die zu einem Behandlungsabbruch führten, waren:
Die am häufigsten berichteten Nebenwirkungen (Inzidenz ≥ 2 %) in der CRESTOR 5 mg-Datenbank für kontrollierte klinische Studien mit 5394 Patienten waren:
Nebenwirkungen, die bei ≥ 2 % der Patienten in placebokontrollierten klinischen Studien und mit einer höheren Häufigkeit als bei Placebo berichtet wurden, sind in Tabelle 1 aufgeführt. Diese Studien hatten eine Behandlungsdauer von bis zu 12 Wochen.
Andere in klinischen Studien berichtete Nebenwirkungen waren Bauchschmerzen, Schwindel, Überempfindlichkeit (einschließlich Hautausschlag, Pruritus, Urtikaria und Angioödem) und Pankreatitis. Die folgenden Laboranomalien wurden ebenfalls berichtet: Teststäbchen-positive Proteinurie und mikroskopische Hämaturie [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]; erhöhte Kreatinphosphokinase, Transaminasen, Glucose, Glutamyltranspeptidase, alkalische Phosphatase und Bilirubin; und Schilddrüsenfunktionsstörungen.
In der METEOR-Studie mit 981 Teilnehmern, die mit Rosuvastatin 40 mg (n = 700) oder Placebo (n = 281) mit einer mittleren Behandlungsdauer von 1,7 Jahren behandelt wurden, behandelten 5,6 % der mit CRESTOR 5 mg behandelten Probanden gegenüber 2,8 % der mit Placebo behandelten Probanden wegen Nebenwirkungen abgebrochen. Die häufigsten Nebenwirkungen, die zu einem Behandlungsabbruch führten, waren: Myalgie, erhöhte Leberenzyme, Kopfschmerzen und Übelkeit [siehe Klinische Studien ].
Nebenwirkungen, die bei ≥ 2 % der Patienten und mit einer größeren Häufigkeit als unter Placebo berichtet wurden, sind in Tabelle 2 aufgeführt.
In der JUPITER-Studie wurden 17.802 Teilnehmer mit Rosuvastatin 20 mg (n = 8.901) oder Placebo (n = 8.901) über eine mittlere Dauer von 2 Jahren behandelt. Ein höherer Prozentsatz der mit Rosuvastatin behandelten Patienten im Vergleich zu den mit Placebo behandelten Patienten, 6,6 % bzw. 6,2 %, brach die Studienmedikation aufgrund eines unerwünschten Ereignisses ab, unabhängig von der Kausalität der Behandlung. Myalgie war die häufigste Nebenwirkung, die zum Abbruch der Behandlung führte.
In JUPITER wurde bei Patienten, die Rosuvastatin einnahmen (2,8 %), eine signifikant höhere Häufigkeit von Diabetes mellitus berichtet als bei Patienten, die Placebo einnahmen (2,3 %). Der mittlere HbA1c-Wert war bei den mit Rosuvastatin behandelten Patienten im Vergleich zu den mit Placebo behandelten Patienten signifikant um 0,1 % erhöht. Die Anzahl der Patienten mit einem HbA1c > 6,5 % am Ende der Studie war bei den mit Rosuvastatin behandelten Patienten signifikant höher als bei den mit Placebo behandelten Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Klinische Studien ].
Nebenwirkungen, die bei ≥ 2 % der Patienten und mit einer größeren Häufigkeit als unter Placebo berichtet wurden, sind in Tabelle 3 aufgeführt.
Pädiatrische Patienten mit heterozygoter familiärer Hypercholesterinämie
In einer 12-wöchigen kontrollierten Studie mit Jungen und postmenarchealen Mädchen im Alter von 10 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie mit CRESTOR 5 bis 20 mg täglich [siehe Verwendung in bestimmten Bevölkerungsgruppen und Klinische Studien wurden unter Rosuvastatin im Vergleich zu mit Placebo behandelten Kindern häufiger Erhöhungen der Serum-Kreatin-Phosphokinase (CK) > 10 x ULN beobachtet. Vier von 130 (3 %) mit Rosuvastatin behandelten Kindern (2 behandelt mit 10 mg und 2 behandelt mit 20 mg) hatten eine erhöhte CK > 10 x ULN, verglichen mit 0 von 46 Kindern unter Placebo.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CRESTOR nach der Zulassung festgestellt: Arthralgie, tödliches und nicht tödliches Leberversagen, Hepatitis, Gelbsucht, Thrombozytopenie, Depression, Schlafstörungen (einschließlich Schlaflosigkeit und Albträume), periphere Neuropathie, interstitielle Lungenerkrankung und Gynäkomastie. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Es gab seltene Berichte über eine immunvermittelte nekrotisierende Myopathie im Zusammenhang mit der Anwendung von Statinen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nach der Markteinführung gab es seltene Berichte über kognitive Beeinträchtigungen (z. B. Gedächtnisverlust, Vergesslichkeit, Amnesie, Gedächtnisstörungen und Verwirrtheit) im Zusammenhang mit der Anwendung von Statinen. Diese kognitiven Probleme wurden für alle Statine berichtet. Die Berichte sind im Allgemeinen nicht schwerwiegend und nach Absetzen des Statins reversibel, mit unterschiedlichen Zeiten bis zum Auftreten der Symptome (1 Tag bis Jahre) und zum Abklingen der Symptome (Median von 3 Wochen).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Cyclosporin
Cyclosporin erhöhte die Rosuvastatin-Exposition und kann zu einem erhöhten Myopathierisiko führen. Daher sollte bei Patienten, die Ciclosporin einnehmen, die Dosis von CRESTOR 10 mg 5 mg einmal täglich nicht überschreiten [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Gemfibrozil
Gemfibrozil erhöhte die Rosuvastatin-Exposition signifikant. Aufgrund eines beobachteten erhöhten Risikos einer Myopathie/Rhabdomyolyse sollte eine Kombinationstherapie mit CRESTOR und Gemfibrozil vermieden werden. Bei gleichzeitiger Anwendung sollte die Dosis von CRESTOR 10 mg 10 mg einmal täglich nicht überschreiten [siehe KLINISCHE PHARMAKOLOGIE ].
Protease-Inhibitoren
Die gleichzeitige Anwendung von Rosuvastatin mit bestimmten Proteasehemmern hat unterschiedliche Auswirkungen auf die Rosuvastatin-Exposition und kann das Risiko einer Myopathie erhöhen. Simeprevir, ein Hepatitis-C-Virus (HCV)-Proteasehemmer, oder Kombinationen von Atazanavir/Ritonavir oder Lopinavir/Ritonavir, die HIV-1-Proteasehemmer sind, erhöhen die Rosuvastatin-Exposition [siehe Tabelle 4 – KLINISCHE PHARMAKOLOGIE ]. Für diese Proteasehemmer sollte die Dosis von CRESTOR 5 mg 10 mg einmal täglich nicht überschreiten. Die Kombinationen von Fosamprenavir/Ritonavir oder Tipranavir/Ritonavir, die HIV-1-Protease-Inhibitoren sind, bewirken wenig oder keine Veränderung der Rosuvastatin-Exposition. Vorsicht ist geboten, wenn Rosuvastatin zusammen mit Proteasehemmern verabreicht wird [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Cumarin-Antikoagulanzien
CRESTOR 20 mg erhöhte die INR bei Patienten, die Cumarin-Antikoagulanzien erhielten, signifikant. Daher ist Vorsicht geboten, wenn Cumarin-Antikoagulanzien zusammen mit CRESTOR verabreicht werden. Bei Patienten, die gleichzeitig Cumarin-Antikoagulanzien und CRESTOR einnehmen, sollte die INR vor Beginn der CRESTOR-Behandlung und häufig genug während der frühen Therapie bestimmt werden, um sicherzustellen, dass keine signifikante Veränderung der INR auftritt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Niacin
Das Risiko von Auswirkungen auf die Skelettmuskulatur kann erhöht sein, wenn CRESTOR 5 mg in Kombination mit lipidmodifizierenden Dosen (≥ 1 g/Tag) von Niacin angewendet wird; bei der Verschreibung von CRESTOR ist Vorsicht geboten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Fenofibrat
Bei gleichzeitiger Anwendung von CRESTOR 20 mg mit Fenofibrat wurde kein klinisch signifikanter Anstieg der AUC von Rosuvastatin oder Fenofibrat beobachtet. Da bekannt ist, dass das Risiko einer Myopathie während der Behandlung mit HMG-CoA-Reduktase-Hemmern bei gleichzeitiger Anwendung von Fenofibraten erhöht ist, ist bei der Verschreibung von Fenofibraten mit CRESTOR Vorsicht geboten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Colchicin
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden mit HMG-CoA-Reduktase-Hemmern, einschließlich Rosuvastatin, bei gleichzeitiger Verabreichung mit Colchicin berichtet, und bei der Verschreibung von CRESTOR mit Colchicin ist Vorsicht geboten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Auswirkungen auf die Skelettmuskulatur
Unter HMG-CoA-Reduktase-Hemmern, einschließlich CRESTOR, wurden Fälle von Myopathie und Rhabdomyolyse mit akutem Nierenversagen als Folge einer Myoglobinurie berichtet. Diese Risiken können bei jeder Dosisstufe auftreten, sind aber bei der höchsten Dosis (40 mg) erhöht.
CRESTOR 5 mg sollte bei Patienten mit prädisponierenden Faktoren für eine Myopathie (z. B. Alter ≥ 65 Jahre, unzureichend behandelte Hypothyreose, Nierenfunktionsstörung) mit Vorsicht verschrieben werden. Das Risiko einer Myopathie während der Behandlung mit CRESTOR 5 mg kann bei gleichzeitiger Anwendung einiger anderer lipidsenkender Therapien (Fibrate oder Niacin), Gemfibrozil, Ciclosporin, Atazanavir/Ritonavir, Lopinavir/Ritonavir oder Simeprevir erhöht sein [siehe DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden mit HMG-CoA-Reduktase-Hemmern, einschließlich Rosuvastatin, bei gleichzeitiger Verabreichung mit Colchicin berichtet, und bei der Verschreibung von CRESTOR mit Colchicin ist Vorsicht geboten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die CRESTOR-Therapie sollte abgebrochen werden, wenn deutlich erhöhte Kreatinkinase-Spiegel auftreten oder eine Myopathie diagnostiziert oder vermutet wird. Die Therapie mit CRESTOR 5 mg sollte auch vorübergehend bei jedem Patienten mit einem akuten, schweren Zustand ausgesetzt werden, der auf eine Myopathie hindeutet oder für die Entwicklung eines Nierenversagens als Folge einer Rhabdomyolyse prädisponiert (z. B. Sepsis, Hypotonie, Dehydratation, größere Operation, Trauma, schwere metabolische, und Elektrolytstörungen oder unkontrollierte Krampfanfälle).
Es gab seltene Berichte über immunvermittelte nekrotisierende Myopathie (IMNM), eine Autoimmunmyopathie, die mit der Anwendung von Statinen in Verbindung gebracht wurde. IMNM ist gekennzeichnet durch: proximale Muskelschwäche und erhöhte Serum-Kreatinkinase, die trotz Absetzen der Statinbehandlung bestehen bleiben; Muskelbiopsie, die eine nekrotisierende Myopathie ohne signifikante Entzündung zeigt; Besserung durch Immunsuppressiva.
Allen Patienten sollte geraten werden, unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich ihrem Arzt zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden oder wenn Muskelzeichen und -symptome nach Absetzen von CRESTOR anhalten.
Anomalien der Leberenzyme
Es wird empfohlen, vor Beginn der Behandlung mit CRESTOR 10 mg Leberenzymtests durchzuführen und wenn Anzeichen oder Symptome einer Leberschädigung auftreten.
Bei HMG-CoA-Reduktase-Hemmern, einschließlich CRESTOR, wurde über Anstiege der Serumtransaminasen [AST (SGOT) oder ALT (SGPT)] berichtet. In den meisten Fällen waren die Erhöhungen vorübergehend und verschwanden oder verbesserten sich bei fortgesetzter Therapie oder nach einer kurzen Unterbrechung der Therapie. Es gab zwei Fälle von Gelbsucht, bei denen kein Zusammenhang mit der CRESTOR-Therapie festgestellt werden konnte, die nach Absetzen der Therapie zurückgingen. In diesen Studien traten keine Fälle von Leberversagen oder irreversibler Lebererkrankung auf. In einer gepoolten Analyse von placebokontrollierten Studien kam es bei 1,1 % der Patienten, die CRESTOR 5 mg einnahmen, zu einem Anstieg der Serumtransaminasen auf > das 3-fache der oberen Normgrenze im Vergleich zu 0,5 % der mit Placebo behandelten Patienten.
Es gab seltene Postmarketing-Berichte über tödliches und nicht tödliches Leberversagen bei Patienten, die Statine, einschließlich Rosuvastatin, einnahmen. Wenn während der Behandlung mit CRESTOR 20 mg eine schwere Leberschädigung mit klinischen Symptomen und/oder Hyperbilirubinämie oder Gelbsucht auftritt, ist die Behandlung unverzüglich zu unterbrechen. Wenn keine alternative Ätiologie gefunden wird, starten Sie CRESTOR nicht neu.
CRESTOR 5 mg sollte bei Patienten, die erhebliche Mengen Alkohol konsumieren und/oder an einer chronischen Lebererkrankung in der Vorgeschichte leiden, mit Vorsicht angewendet werden [siehe KLINISCHE PHARMAKOLOGIE ]. Eine aktive Lebererkrankung, die ungeklärte anhaltende Transaminasenerhöhungen beinhalten kann, ist eine Kontraindikation für die Anwendung von CRESTOR [siehe KONTRAINDIKATIONEN ].
Begleitende Cumarin-Antikoagulantien
Vorsicht ist geboten, wenn Antikoagulanzien zusammen mit CRESTOR gegeben werden, da CRESTOR die Wirkung von Antikoagulanzien vom Cumarin-Typ bei der Verlängerung der Prothrombinzeit/INR verstärkt. Bei Patienten, die gleichzeitig Cumarin-Antikoagulanzien und CRESTOR einnehmen, sollte die INR vor Beginn der Behandlung mit CRESTOR 10 mg und während der frühen Therapie häufig genug bestimmt werden, um sicherzustellen, dass keine signifikante Veränderung der INR auftritt [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Proteinurie und Hämaturie
Im Rahmen des klinischen CRESTOR-Studienprogramms wurden bei mit CRESTOR behandelten Patienten Teststreifen-positive Proteinurie und mikroskopische Hämaturie beobachtet. Diese Befunde traten häufiger bei Patienten auf, die CRESTOR 40 mg einnahmen, im Vergleich zu niedrigeren Dosen von CRESTOR 20 mg oder Vergleichs-HMG-CoA-Reduktase-Inhibitoren, obwohl sie im Allgemeinen vorübergehend waren und nicht mit einer Verschlechterung der Nierenfunktion einhergingen. Obwohl die klinische Bedeutung dieses Befunds nicht bekannt ist, sollte bei Patienten unter CRESTOR-Therapie mit ungeklärter persistierender Proteinurie und/oder Hämaturie während routinemäßiger Urinanalysetests eine Dosisreduktion in Erwägung gezogen werden.
Endokrine Wirkungen
Bei HMG-CoA-Reduktase-Hemmern, einschließlich CRESTOR, wurde über einen Anstieg des HbA1c und des Nüchtern-Serumglukosespiegels berichtet. Basierend auf klinischen Studiendaten mit CRESTOR können diese Anstiege in einigen Fällen die Schwelle für die Diagnose von Diabetes mellitus überschreiten [siehe NEBENWIRKUNGEN ].
Obwohl klinische Studien gezeigt haben, dass CRESTOR 10 mg allein die basale Cortisolkonzentration im Plasma nicht senkt oder die Nebennierenreserve beeinträchtigt, ist Vorsicht geboten, wenn CRESTOR gleichzeitig mit Arzneimitteln verabreicht wird, die die Konzentration oder Aktivität von endogenen Steroidhormonen wie Ketoconazol, Spironolacton und Cimetidin.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Die Patienten sollten angewiesen werden, 2 Dosen CRESTOR nicht innerhalb von 12 Stunden nacheinander einzunehmen.
Auswirkungen auf die Skelettmuskulatur
Patienten sollten angewiesen werden, ungeklärte Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden oder wenn diese Muskelzeichen oder -symptome nach Absetzen von CRESTOR anhalten.
Gleichzeitige Anwendung von Antazida
Bei der Einnahme von CRESTOR 5 mg mit einem kombinierten Antazida aus Aluminium und Magnesiumhydroxid sollte das Antazida mindestens 2 Stunden nach der Verabreichung von CRESTOR 10 mg eingenommen werden.
Embryofetale Toxizität
Weisen Sie gebärfähige Frauen auf das Risiko für einen Fötus hin, während der Behandlung eine wirksame Verhütungsmethode anzuwenden und ihren Arzt über eine bekannte oder vermutete Schwangerschaft zu informieren. [sehen KONTRAINDIKATIONEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie Frauen, während der Behandlung mit CRESTOR nicht zu stillen [siehe KONTRAINDIKATIONEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Leberenzyme
Es wird empfohlen, vor Beginn der Behandlung mit CRESTOR und wenn Anzeichen oder Symptome einer Leberschädigung auftreten, Leberenzymtests durchzuführen. Allen mit CRESTOR behandelten Patienten sollte geraten werden, unverzüglich alle Symptome zu melden, die auf eine Leberschädigung hindeuten könnten, einschließlich Müdigkeit, Anorexie, Beschwerden im rechten Oberbauch, dunkler Urin oder Gelbsucht.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen Karzinogenitätsstudie an Ratten mit Dosierungen von 2, 20, 60 oder 80 mg/kg/Tag per Schlundsonde war die Inzidenz von uterinen Stromapolypen bei Frauen bei systemischer Gabe von 80 mg/kg/Tag signifikant erhöht Exposition das 20-fache der menschlichen Exposition bei 40 mg/Tag, basierend auf der AUC. Bei niedrigeren Dosen wurde kein vermehrtes Auftreten von Polypen beobachtet.
In einer 107-wöchigen Karzinogenitätsstudie an Mäusen, denen 10, 60 oder 200 mg/kg/Tag per Schlundsonde verabreicht wurde, wurde bei 200 mg/kg/Tag bei systemischer Exposition, die dem 20-fachen der Exposition beim Menschen entspricht, eine erhöhte Inzidenz von hepatozellulären Adenomen/Karzinomen beobachtet bei 40 mg/Tag, basierend auf der AUC. Eine erhöhte Inzidenz von hepatozellulären Tumoren wurde bei niedrigeren Dosen nicht beobachtet.
Rosuvastatin war mit oder ohne metabolische Aktivierung im Ames-Test mit Salmonella typhimurium und Escherichia coli, im Maus-Lymphom-Assay und im Chromosomenaberrations-Assay an Lungenzellen des chinesischen Hamsters nicht mutagen oder klastogen. Rosuvastatin war im In-vivo-Maus-Mikrokerntest negativ.
In Fertilitätsstudien an Ratten mit oralen Sondendosen von 5, 15, 50 mg/kg/Tag wurden Männchen 9 Wochen vor und während der Verpaarung und Weibchen 2 Wochen vor der Verpaarung und während der Verpaarung bis zum 7. Trächtigkeitstag behandelt. Keine Nebenwirkungen Auswirkungen auf die Fertilität wurden bei 50 mg/kg/Tag beobachtet (systemische Exposition bis zum 10-fachen der humanen Exposition bei 40 mg/Tag, basierend auf der AUC). In Hoden von Hunden, die einen Monat lang mit 30 mg/kg/Tag Rosuvastatin behandelt wurden, wurden spermatidische Riesenzellen beobachtet. Bei Affen wurden nach 6-monatiger Behandlung mit 30 mg/kg/Tag zusätzlich zur Vakuolisierung des seminiferen tubulären Epithels spermatidische Riesenzellen beobachtet. Die Exposition beim Hund betrug das 20-fache und beim Affen das 10-fache der menschlichen Exposition bei 40 mg/Tag, bezogen auf die Körperoberfläche. Ähnliche Ergebnisse wurden bei anderen Arzneimitteln dieser Klasse beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
CRESTOR 5 mg ist für die Anwendung bei Schwangeren kontraindiziert, da die Unbedenklichkeit bei Schwangeren nicht erwiesen ist und es keinen offensichtlichen Nutzen einer Therapie mit CRESTOR 20 mg während der Schwangerschaft gibt. Da HMG-CoA-Reduktase-Hemmer die Cholesterinsynthese und möglicherweise die Synthese anderer aus Cholesterin gewonnener biologisch aktiver Substanzen verringern, kann CRESTOR bei Verabreichung an Schwangere den Fötus schädigen. CRESTOR 5 mg sollte abgesetzt werden, sobald eine Schwangerschaft erkannt wird [siehe KONTRAINDIKATIONEN ]. Begrenzte veröffentlichte Daten zur Anwendung von Rosuvastatin reichen nicht aus, um ein arzneimittelbedingtes Risiko schwerer angeborener Fehlbildungen oder Fehlgeburten zu bestimmen. In Reproduktionsstudien an Tieren traten bei oraler Verabreichung von Rosuvastatin während der Organogenese bei systemischen Expositionen entsprechend einer maximal empfohlenen Humandosis (MRHD) von 40 mg/Tag bei Ratten oder Kaninchen (basierend auf AUC bzw. Körperoberfläche) keine nachteiligen Auswirkungen auf die Entwicklung auf ). Bei Ratten und Kaninchen trat ein verringertes Überleben der Jungtiere/Föten um das 12-Fache bzw. Äquivalent zu einer MRHD von 40 mg/Tag auf [vgl Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Daten
Menschliche Daten
Begrenzte veröffentlichte Daten zu Rosuvastatin haben kein erhöhtes Risiko für schwere angeborene Fehlbildungen oder Fehlgeburten gezeigt. Seltene Berichte über angeborene Anomalien wurden nach intrauteriner Exposition gegenüber anderen Statinen erhalten. In einer Überprüfung von etwa 100 prospektiv verfolgten Schwangerschaften bei Frauen, die Simvastatin oder Lovastatin ausgesetzt waren, überstieg die Inzidenz angeborener Anomalien, spontaner Aborte und fötaler Todesfälle/Totgeburten nicht das, was in der Allgemeinbevölkerung zu erwarten wäre. Die Anzahl der Fälle ist ausreichend, um eine ≥ 3- bis 4-fache Zunahme angeborener Anomalien gegenüber der Hintergrundinzidenz auszuschließen. Bei 89 % der prospektiv verfolgten Schwangerschaften wurde die medikamentöse Behandlung vor der Schwangerschaft begonnen und irgendwann im ersten Trimester bei Feststellung einer Schwangerschaft abgebrochen.
Tierdaten
Rosuvastatin passiert bei Ratten und Kaninchen die Plazentaschranke und wird in fötalem Gewebe und Fruchtwasser zu 3 % bzw. 20 % der mütterlichen Plasmakonzentration nach einer oralen Einzeldosis von 25 mg/kg per Schlundsonde am 16. Tag der Trächtigkeit bei Ratten gefunden. Eine höhere Verteilung im fötalen Gewebe (25 % maternale Plasmakonzentration) wurde bei Kaninchen nach einer oralen Einzeldosis von 1 mg/kg per Schlundsonde am 18. Trächtigkeitstag beobachtet.
Die Verabreichung von Rosuvastatin zeigte keine teratogene Wirkung bei Ratten bei ≤ 25 mg/kg/Tag oder bei Kaninchen bei ≤ 3 mg/kg/Tag (Dosen, die einer MRHD von 40 mg/Tag entsprechen, basierend auf AUC bzw. Körperoberfläche).
Bei weiblichen Ratten, die 5, 15 und 50 mg/kg/Tag vor der Paarung und bis zum 7. Trächtigkeitstag erhielten, führte dies zu einem verringerten fötalen Körpergewicht (weibliche Jungtiere) und einer verzögerten Ossifikation bei 50 mg/kg/Tag (das 10-fache der menschlichen Exposition bei die MRHD-Dosis von 40 mg/Tag basierend auf der AUC).
Bei trächtigen Ratten, die 2, 10 und 50 mg/kg/Tag Rosuvastatin vom 7. Trächtigkeitstag bis zum 21. Laktationstag (Absetzen) erhielten, trat bei 50 mg/kg/Tag (Dosis entsprechend dem 12-fachen der MRHD von 40 mg) eine verringerte Überlebensrate der Jungtiere auf /Tag basierend auf der Körperoberfläche).
Bei trächtigen Kaninchen, die vom 6. bis 18. Tag der Trächtigkeit 0,3, 1 und 3 mg/kg/Tag Rosuvastatin erhielten, wurde bei 3 mg/kg/Tag (Dosis entsprechend der MRHD von 40 mg/Tag) eine verringerte fetale Lebensfähigkeit und mütterliche Mortalität beobachtet. Tag basierend auf der Körperoberfläche).
Stillzeit
Zusammenfassung der Risiken
Die Anwendung von Rosuvastatin ist während der Stillzeit kontraindiziert [siehe KONTRAINDIKATIONEN ]. Begrenzte Daten weisen darauf hin, dass CRESTOR in der Muttermilch vorhanden ist. Es liegen keine Informationen über die Auswirkungen des Arzneimittels auf den gestillten Säugling oder die Auswirkungen des Arzneimittels auf die Milchproduktion vor. Wegen der Möglichkeit schwerwiegender Nebenwirkungen bei einem gestillten Säugling weisen Sie die Patientinnen darauf hin, dass das Stillen während der Behandlung mit CRESTOR nicht empfohlen wird.
Weibchen und Männchen mit reproduktivem Potenzial
Empfängnisverhütung
CRESTOR kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird [siehe Verwendung in bestimmten Bevölkerungsgruppen ]. Raten Sie Frauen im gebärfähigen Alter, während der Behandlung mit CRESTOR eine wirksame Empfängnisverhütung anzuwenden.
Pädiatrische Verwendung
Bei Kindern und Jugendlichen im Alter von 8 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie wird die Sicherheit und Wirksamkeit von CRESTOR 10 mg als Ergänzung zu einer Diät zur Senkung des Gesamtcholesterin-, LDL-C- und ApoB-Spiegels, wenn nach einem angemessenen Versuch einer Diättherapie, LDL -C 190 mg/dL übersteigt oder wenn LDL-C 160 mg/dL übersteigt und es eine positive Familienanamnese für vorzeitige kardiovaskuläre Erkrankungen oder zwei oder mehr andere kardiovaskuläre Risikofaktoren gibt, wurden in einer kontrollierten Studie und in einer offenen, unkontrollierten Studie festgestellt Versuch [vgl Klinische Studien ]. Die langfristige Wirksamkeit einer im Kindesalter eingeleiteten CRESTOR-Therapie zur Verringerung der Morbidität und Mortalität im Erwachsenenalter ist nicht erwiesen.
Die Sicherheit und Wirksamkeit von CRESTOR 5 mg bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie wurden in einer kontrollierten klinischen Studie mit einer Dauer von 12 Wochen, gefolgt von einer 40-wöchigen unverblindeten Exposition, untersucht. Patienten, die mit 5 mg, 10 mg und 20 mg täglich CRESTOR 10 mg behandelt wurden, hatten ein Nebenwirkungsprofil, das im Allgemeinen dem von Patienten ähnelte, die mit Placebo behandelt wurden. Es gab keine nachweisbare Wirkung von CRESTOR auf Wachstum, Gewicht, BMI (Body-Mass-Index) oder sexuelle Reifung [vgl Klinische Studien ] bei Kindern und Jugendlichen (10 bis 17 Jahre).
CRESTOR wurde nicht in kontrollierten klinischen Studien mit präpubertären Patienten oder Patienten unter 10 Jahren mit heterozygoter familiärer Hypercholesterinämie untersucht. Die Sicherheit und Wirksamkeit von CRESTOR wurden jedoch in einer zweijährigen offenen, unkontrollierten Studie untersucht, an der Kinder und Jugendliche im Alter von 8 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie teilnahmen [siehe Klinische Studien ]. Die Sicherheit und Wirksamkeit von CRESTOR 5 mg bei der Senkung von LDL-C schienen im Allgemeinen mit denen übereinzustimmen, die bei erwachsenen Patienten beobachtet wurden, trotz der Einschränkungen des unkontrollierten Studiendesigns.
Kinder und Jugendliche im Alter von 7 bis 15 Jahren mit homozygoter familiärer Hypercholesterinämie wurden in einer 6-wöchigen randomisierten, placebokontrollierten Crossover-Studie mit CRESTOR 20 mg einmal täglich, gefolgt von einer 12-wöchigen unverblindeten Behandlung untersucht [siehe Klinische Studien ]. Im Allgemeinen stimmte das Sicherheitsprofil in dieser Studie mit dem zuvor erstellten Sicherheitsprofil bei Erwachsenen überein.
Obwohl nicht alle bei Erwachsenen festgestellten Nebenwirkungen in klinischen Studien mit Kindern und Jugendlichen beobachtet wurden, sollten bei Kindern und Jugendlichen die gleichen Warnhinweise und Vorsichtsmaßnahmen wie bei Erwachsenen beachtet werden. Heranwachsende Frauen sollten während der Behandlung mit CRESTOR 5 mg über geeignete Verhütungsmethoden beraten werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Geriatrische Verwendung
Von den 10.275 Patienten in klinischen Studien mit CRESTOR waren 3.159 (31 %) 65 Jahre und älter und 698 (6,8 %) waren 75 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Ältere Patienten haben ein höheres Myopathierisiko und CRESTOR sollte bei älteren Patienten mit Vorsicht verschrieben werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Die Rosuvastatin-Exposition wird durch eine leichte bis mäßige Nierenfunktionsstörung (CLcr ≥ 30 ml/min/1,73 m²) nicht beeinflusst. Die Rosuvastatin-Exposition ist bei Patienten mit schwerer Nierenfunktionsstörung (CLcr DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
CRESTOR ist kontraindiziert bei Patienten mit aktiver Lebererkrankung, die unerklärliche anhaltende Erhöhungen der hepatischen Transaminasenwerte beinhalten kann. Es ist bekannt, dass eine chronische alkoholbedingte Lebererkrankung die Rosuvastatin-Exposition erhöht; CRESTOR 20 mg sollte bei diesen Patienten mit Vorsicht angewendet werden [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Asiatische Patienten
Pharmakokinetische Studien haben eine ungefähr 2-fache Erhöhung der medianen Rosuvastatin-Exposition bei asiatischen Probanden im Vergleich zu kaukasischen Kontrollpersonen gezeigt. Die Dosierung von CRESTOR sollte bei asiatischen Patienten angepasst werden [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es gibt keine spezifische Behandlung im Falle einer Überdosierung. Im Falle einer Überdosierung sollte der Patient symptomatisch behandelt und erforderlichenfalls unterstützende Maßnahmen eingeleitet werden. Die Hämodialyse erhöht die Clearance von Rosuvastatin nicht signifikant.
KONTRAINDIKATIONEN
CRESTOR 20 mg ist unter folgenden Bedingungen kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
CRESTOR 10 mg ist ein selektiver und kompetitiver Hemmer der HMG-CoA-Reduktase, des geschwindigkeitsbestimmenden Enzyms, das 3-Hydroxy-3-methylglutaryl-Coenzym A in Mevalonat, eine Vorstufe von Cholesterin, umwandelt. In-vivo-Studien an Tieren und In-vitro-Studien an kultivierten tierischen und menschlichen Zellen haben gezeigt, dass Rosuvastatin in hohem Maße in die Leber, das Zielorgan der Cholesterinsenkung, aufgenommen wird und dort selektiv wirkt. In In-vivo- und In-vitro-Studien entfaltet Rosuvastatin seine lipidmodifizierende Wirkung auf zwei Arten. Erstens erhöht es die Anzahl der hepatischen LDL-Rezeptoren auf der Zelloberfläche, um die Aufnahme und den Abbau von LDL zu verbessern. Zweitens hemmt Rosuvastatin die hepatische Synthese von VLDL, was die Gesamtzahl von VLDL- und LDL-Partikeln reduziert.
Pharmakodynamik
CRESTOR 5 mg senkt dosisabhängig erhöhtes LDL-Cholesterin und senkt Gesamtcholesterin und Triglyzeride und erhöht HDL-Cholesterin [vgl Klinische Studien ]. Ein therapeutisches Ansprechen auf CRESTOR 5 mg ist innerhalb von 1 Woche nach Beginn der Therapie offensichtlich und 90 % des maximalen Ansprechens werden normalerweise in 2 Wochen erreicht. Das maximale Ansprechen wird in der Regel nach 4 Wochen erreicht und hält danach an. Die Individualisierung der Arzneimitteldosierung sollte auf dem therapeutischen Ansprechen basieren [vgl DOSIERUNG UND ANWENDUNG ].
Pharmakokinetik
Absorption
In klinisch-pharmakologischen Studien beim Menschen wurden maximale Plasmakonzentrationen von Rosuvastatin 3 bis 5 Stunden nach oraler Gabe erreicht. Sowohl Cmax als auch AUC stiegen ungefähr proportional zur CRESTOR-Dosis von 10 mg an. Die absolute Bioverfügbarkeit von Rosuvastatin beträgt etwa 20 %.
Die Einnahme von CRESTOR mit Nahrung hatte keinen Einfluss auf die AUC von Rosuvastatin.
Die AUC von Rosuvastatin unterscheidet sich nach abendlicher oder morgendlicher Verabreichung des Arzneimittels nicht.
Verteilung
Das mittlere Verteilungsvolumen von Rosuvastatin im Steady State beträgt etwa 134 Liter. Rosuvastatin wird zu 88 % an Plasmaproteine, hauptsächlich Albumin, gebunden. Diese Bindung ist reversibel und unabhängig von Plasmakonzentrationen.
Beseitigung
Rosuvastatin wird hauptsächlich über die Fäzes ausgeschieden. Die Eliminationshalbwertszeit von Rosuvastatin beträgt etwa 19 Stunden.
Stoffwechsel
Rosuvastatin wird nicht extensiv metabolisiert; etwa 10 % einer radioaktiv markierten Dosis werden als Metabolit wiedergefunden. Der Hauptmetabolit ist N-Desmethyl-Rosuvastatin, das hauptsächlich aus Cytochrom P450 \ 2C9 gebildet wird, und In-vitro-Studien haben gezeigt, dass N-Desmethyl-Rosuvastatin etwa ein Sechstel bis die Hälfte der HMG-CoA-Reduktase-Hemmaktivität der Ausgangsverbindung aufweist . Insgesamt entfallen mehr als 90 % der aktiven Hemmaktivität der HMG-CoA-Reduktase im Plasma auf die Muttersubstanz.
Ausscheidung
Nach oraler Verabreichung werden Rosuvastatin und seine Metaboliten hauptsächlich mit dem Stuhl ausgeschieden (90 %). Nach einer intravenösen Dosis erfolgten etwa 28 % der Gesamtkörperclearance renal und 72 % hepatisch.
Spezifische Populationen
Rassen- oder ethnische Gruppen
Eine populationspharmakokinetische Analyse ergab keine klinisch relevanten Unterschiede in der Pharmakokinetik zwischen kaukasischen, hispanischen und schwarzen oder afrokaribischen Gruppen. Allerdings haben pharmakokinetische Studien, einschließlich einer in den USA durchgeführten, eine etwa 2-fache Erhöhung der medianen Exposition (AUC und Cmax) bei asiatischen Probanden im Vergleich zu einer kaukasischen Kontrollgruppe gezeigt.
Männliche und weibliche Patienten
Es gab keine Unterschiede in den Plasmakonzentrationen von Rosuvastatin zwischen Männern und Frauen.
Pädiatrische Patienten
In einer populationspharmakokinetischen Analyse von zwei pädiatrischen Studien mit Patienten mit heterozygoter familiärer Hypercholesterinämie im Alter von 10 bis 17 Jahren bzw. 8 bis 17 Jahren schien die Rosuvastatin-Exposition vergleichbar oder geringer als die Rosuvastatin-Exposition bei erwachsenen Patienten zu sein.
Geriatrische Patienten
Es gab keine Unterschiede in den Plasmakonzentrationen von Rosuvastatin zwischen jüngeren und älteren Patienten (Alter ≥ 65 Jahre).
Patienten mit eingeschränkter Nierenfunktion
Eine leichte bis mäßige Nierenfunktionsstörung (CLcr ≥ 30 ml/min/1,73 m²) hatte keinen Einfluss auf die Plasmakonzentrationen von Rosuvastatin. Allerdings stiegen die Plasmakonzentrationen von Rosuvastatin bei Patienten mit schwerer Nierenfunktionsstörung (CLcr 80 ml/min/ 1,73 m²).
Hämodialyse
Die Steady-State-Plasmakonzentrationen von Rosuvastatin waren bei Patienten unter chronischer Hämodialyse etwa 50 % höher als bei gesunden Probanden mit normaler Nierenfunktion.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit chronischer alkoholbedingter Lebererkrankung waren die Plasmakonzentrationen von Rosuvastatin leicht erhöht.
Bei Patienten mit Child-Pugh-A-Krankheit waren Cmax und AUC im Vergleich zu Patienten mit normaler Leberfunktion um 60 % bzw. 5 % erhöht. Bei Patienten mit der Child-Pugh-B-Krankheit waren Cmax und AUC im Vergleich zu Patienten mit normaler Leberfunktion um 100 % bzw. 21 % erhöht.
Studien zu Arzneimittelwechselwirkungen
Die Clearance von Rosuvastatin ist nicht in einem klinisch signifikanten Ausmaß von der Metabolisierung durch Cytochrom P450 3A4 abhängig.
Rosuvastatin ist ein Substrat für bestimmte Transporterproteine, einschließlich des hepatic uptake transporter organic anion-transporting polyprotein 1B1 (OATP1B1) und des Efflux-Transporter-Brustkrebsresistenzproteins (BCRP). Die gleichzeitige Verabreichung von CRESTOR 10 mg mit Arzneimitteln, die Inhibitoren dieser Transportproteine sind (z. B. Cyclosporin, bestimmte HIV-Protease-Inhibitoren), kann zu erhöhten Plasmakonzentrationen von Rosuvastatin führen [siehe DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pharmakogenomik
An der Disposition von HMG-CoA-Reduktase-Inhibitoren, einschließlich Rosuvastatin, sind OATP1B1 und andere Transportproteine beteiligt. Höhere Plasmakonzentrationen von Rosuvastatin wurden bei sehr kleinen Patientengruppen (n = 3 bis 5) berichtet, die zwei Allele mit reduzierter Funktion des Gens aufweisen, das für OATP1B1 kodiert (SLCO1B1 521T > C). Die Häufigkeit dieses Genotyps (dh SLCO1B1 521 C/C) liegt in den meisten rassischen/ethnischen Gruppen im Allgemeinen unter 5 %. Die Auswirkung dieses Polymorphismus auf die Wirksamkeit und/oder Sicherheit von Rosuvastatin wurde nicht eindeutig nachgewiesen.
Tiertoxikologie und/oder Pharmakologie
Toxizität des zentralen Nervensystems
ZNS-Gefäßläsionen, gekennzeichnet durch perivaskuläre Blutungen, Ödeme und mononukleäre Zellinfiltration perivaskulärer Räume, wurden bei Hunden beobachtet, die mit mehreren anderen Vertretern dieser Arzneimittelklasse behandelt wurden. Ein chemisch ähnliches Medikament dieser Klasse führte bei Hunden zu einer dosisabhängigen Degeneration des Sehnervs (Wallesche Degeneration der Retinogenulatfasern) bei einer Dosis, die bei Menschen, die die höchste empfohlene Dosis einnahmen, zu Plasmaspiegeln führte, die etwa 30-mal höher waren als die mittleren Wirkstoffspiegel. Ödeme, Blutungen und partielle Nekrosen im Interstitium des Plexus choroideus wurden bei einer Hündin beobachtet, die am Tag 24 bei 90 mg/kg/Tag durch orale Sondenfütterung im Sterben gelassen wurde (systemische Exposition 100-mal höher als die menschliche Exposition bei 40 mg/Tag, basierend auf AUK). Hornhauttrübung wurde bei Hunden beobachtet, die 52 Wochen lang mit 6 mg/kg/Tag per Schlundsonde behandelt wurden (systemische Exposition 20-mal höher als die humane Exposition bei 40 mg/Tag, basierend auf der AUC). Katarakte wurden bei Hunden beobachtet, die 12 Wochen lang mit einer Schlundsonde von 30 mg/kg/Tag behandelt wurden (systemische Exposition 60-mal höher als die Exposition beim Menschen bei 40 mg/Tag, basierend auf der AUC). Netzhautdysplasie und Netzhautverlust wurden bei Hunden beobachtet, die 4 Wochen lang mit einer oralen Schlundsonde von 90 mg/kg/Tag behandelt wurden (systemische Exposition 100-mal höher als die humane Exposition von 40 mg/Tag, basierend auf der AUC). Dosen ≤ 30 mg/kg/Tag (systemische Expositionen ≤ 60-fache Exposition beim Menschen bei 40 mg/Tag, basierend auf der AUC) zeigten während der Behandlung über einen Zeitraum von bis zu einem Jahr keine Netzhautbefunde.
Studie zur Jugendtoxikologie
In einer Jugendstudie erhielten Ratten 10 oder 50 mg/kg/Tag per Schlundsonde ab dem Absetzen für 9 Wochen vor der Paarung, während der Paarung und bis zum Tag vor der Nekropsie bei Männchen oder bis zum 7. Trächtigkeitstag bei Weibchen. Bei beiden Dosierungen (2-fache oder bis zu 24-fache Exposition beim Menschen (AUC) bei der maximalen pädiatrischen Dosis von 20 mg/Tag) wurden keine Auswirkungen auf die sexuelle Entwicklung, das Aussehen der Hoden und Nebenhoden oder die Fertilität beobachtet.
Klinische Studien
Hyperlipidämie und gemischte Dyslipidämie
CRESTOR 5 mg reduziert Gesamt-C, LDL-C, ApoB, Non-HDL-C und TG und erhöht HDL-C bei erwachsenen Patienten mit Hyperlipidämie und gemischter Dyslipidämie.
Dosisfindungsstudie
In einer multizentrischen, doppelblinden, placebokontrollierten Dosisfindungsstudie bei Patienten mit Hyperlipidämie führte CRESTOR, verabreicht als tägliche Einzeldosis über 6 Wochen, zu einer signifikanten Reduktion von Gesamt-C, LDL-C, Non-HDL-C und ApoB über die Dosis hinweg Bereich (Tabelle 6).
Aktiv-kontrollierte Studie
CRESTOR 5 mg wurde mit den HMG-CoA-Reduktase-Inhibitoren Atorvastatin, Simvastatin und Pravastatin in einer multizentrischen, unverblindeten Dosisfindungsstudie mit 2240 Patienten mit Hyperlipidämie oder gemischter Dyslipidämie verglichen. Nach der Randomisierung wurden die Patienten 6 Wochen lang mit einer täglichen Einzeldosis von entweder CRESTOR 20 mg, Atorvastatin, Simvastatin oder Pravastatin behandelt (Abbildung 1 und Tabelle 7).
Abbildung 1: Prozentuale LDL-C-Veränderung nach Dosis von CRESTOR 20 mg, Atorvastatin, Simvastatin und Pravastatin in Woche 6 bei Patienten mit Hyperlipidämie oder gemischter Dyslipidämie 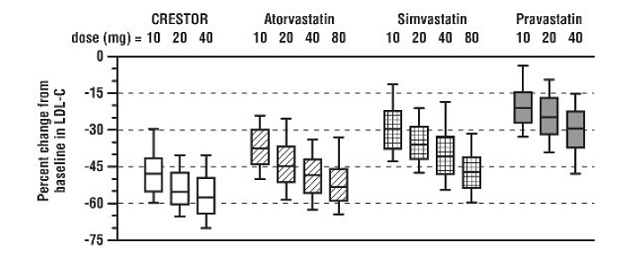
Boxplots sind eine Darstellung der 25., 50. und 75. Perzentilwerte, wobei Whisker die 10. und 90. Perzentilwerte darstellen. Mittlerer Ausgangswert von LDL-C: 189 mg/dl
Heterozygote familiäre Hypercholesterinämie
Aktiv-kontrollierte Studie
In einer Studie mit Patienten mit heterozygoter FH (mittlerer LDL-Ausgangswert von 291) wurden die Patienten randomisiert entweder CRESTOR 20 mg oder Atorvastatin 20 mg zugeteilt. Die Dosis wurde in 6-wöchigen Abständen erhöht. Signifikante LDL-C-Reduktionen gegenüber dem Ausgangswert wurden bei jeder Dosis in beiden Behandlungsgruppen beobachtet (Tabelle 8).
Hypertriglyzeridämie
Dosis-Wirkungs-Studie
In einer doppelblinden, placebokontrollierten Dosis-Wirkungs-Studie bei Patienten mit TG-Ausgangswerten von 273 bis 817 mg/dl führte CRESTOR 10 mg als tägliche Einzeldosis (5 bis 40 mg) über 6 Wochen zu einer signifikanten Senkung der Serum-TG-Spiegel ( Tabelle 9).
Primäre Dysbetalipoproteinämie (Hyperlipoproteinämie Typ III)
In einer randomisierten, multizentrischen, doppelblinden Crossover-Studie begannen 32 Patienten (27 mit ε2/ε2 und 4 mit Apo-E-Mutation [Arg145Cys] mit primärer Dysbetalipoproteinämie (Typ-III-Hyperlipoproteinämie) mit einer 6-wöchigen diätetischen Lead-in-Periode zum NCEP Therapeutic Lifestyle Change (TLC)-Diät Nach diätetischer Einleitung wurden die Patienten randomisiert einer Reihe von Behandlungen in Verbindung mit der TLC-Diät für jeweils 6 Wochen zugeteilt: Rosuvastatin 10 mg, gefolgt von Rosuvastatin 20 mg oder Rosuvastatin 20 mg, gefolgt von Rosuvastatin 10 mg CRESTOR senkte die Spiegel von Non-HDL-C (primärer Endpunkt) und zirkulierendem Rest-Lipoprotein Die Ergebnisse sind in der nachstehenden Tabelle aufgeführt.
Homozygote familiäre Hypercholesterinämie
Dosistitrationsstudie
In einer offenen Studie mit erzwungener Titration wurden homozygote FH-Patienten (n = 40, 8-63 Jahre) auf ihr Ansprechen auf CRESTOR 20 bis 40 mg, titriert in 6-Wochen-Intervallen, untersucht. In der Gesamtpopulation betrug die mittlere LDL-C-Reduktion gegenüber dem Ausgangswert 22 %. Etwa ein Drittel der Patienten profitierte von einer Dosiserhöhung von 20 mg auf 40 mg bei einer weiteren LDL-Senkung um mehr als 6 %. Bei den 27 Patienten mit einer LDL-C-Reduktion von mindestens 15 % betrug die mittlere LDL-C-Reduktion 30 % (Median 28 % Reduktion). Von 13 Patienten mit einer LDL-C-Reduktion von
Pädiatrische Patienten mit homozygoter familiärer Hypercholesterinämie
CRESTOR wurde in einer randomisierten, doppelblinden, placebokontrollierten, multizentrischen Crossover-Studie bei 14 Kindern und Jugendlichen mit homozygoter familiärer Hypercholesterinämie untersucht. Die Studie umfasste eine 4-wöchige diätetische Einführungsphase, während der die Patienten täglich 10 mg CRESTOR erhielten, eine Übergangsphase, die zwei 6-wöchige Behandlungsperioden mit entweder 20 mg CRESTOR oder Placebo in zufälliger Reihenfolge umfasste, gefolgt von einer 12-wöchigen einwöchige offene Phase, in der alle Patienten CRESTOR 20 mg erhielten. Das Alter der Patienten lag zwischen 7 und 15 Jahren (Median 11 Jahre), 50 % waren männlich, 71 % waren Kaukasier, 21 % Asiaten, 7 % waren Schwarze und kein Patient war hispanischer Abstammung. 50 % erhielten eine Apheresetherapie und 57 % nahmen Ezetimib ein. Patienten, die mit Apheresetherapie oder Ezetimib in die Studie aufgenommen wurden, setzten die Behandlung während der gesamten Studie fort. Der mittlere LDL-C-Wert zu Studienbeginn betrug 416 mg/dl (Bereich 152 bis 716 mg/dl). Insgesamt 13 Patienten absolvierten beide Behandlungsperioden der randomisierten Cross-over-Phase; Ein Patient widerrief seine Einwilligung, weil er während der Crossover-Phase keine Blutentnahme durchführen konnte.
CRESTOR 20 mg reduzierte LDL-C, Gesamtcholesterin, ApoB und Non-HDL-C signifikant im Vergleich zu Placebo (Tabelle 11).
Pädiatrische Patienten mit heterozygoter familiärer Hypercholesterinämie
In einer doppelblinden, randomisierten, multizentrischen, placebokontrollierten, 12-wöchigen Studie wurden 176 (97 männliche und 79 weibliche) Kinder und Jugendliche mit heterozygoter familiärer Hypercholesterinämie randomisiert entweder täglich mit 5, 10 oder 20 mg Rosuvastatin oder Placebo behandelt. Das Alter der Patienten lag zwischen 10 und 17 Jahren (Durchschnittsalter 14 Jahre), wobei ungefähr 30 % der Patienten zwischen 10 und 13 Jahren und ungefähr 17 %, 18 %, 40 % und 25 % in den Tanner-Stadien II, III, IV, bzw. V. Frauen waren mindestens 1 Jahr nach der Menarche. Der mittlere LDL-C-Wert zu Studienbeginn betrug 233 mg/dl (Bereich von 129 bis 399). Auf die 12-wöchige doppelblinde Phase folgte eine 40-wöchige offene Dosistitrationsphase, in der alle Patienten (n = 173) täglich 5 mg, 10 mg oder 20 mg Rosuvastatin erhielten.
Rosuvastatin senkte bei jeder Dosis im Vergleich zu Placebo signifikant die LDL-C- (primärer Endpunkt), Gesamtcholesterin- und ApoB-Spiegel. Die Ergebnisse sind in Tabelle 12 unten gezeigt.
Am Ende des 12-wöchigen, doppelblinden Behandlungszeitraums betrug der Prozentsatz der Patienten, die das LDL-C-Ziel von weniger als 110 mg/dl (2,8 mmol/l) erreichten, 0 % für Placebo und 12 % für Rosuvastatin 5 mg , 41 % für Rosuvastatin 10 mg und 41 % für Rosuvastatin 20 mg. In der 40-wöchigen Open-Label-Phase wurden 71 % der Patienten auf die maximale Dosis von 20 mg titriert und 41 % der Patienten erreichten das LDL-C-Ziel von 110 mg/dl.
Rosuvastatin wurde auch in einer zweijährigen offenen, unkontrollierten Titration-to-Goal-Studie untersucht, an der 175 Kinder und Jugendliche mit heterozygoter familiärer Hypercholesterinämie im Alter von 8 bis 17 Jahren (79 Jungen und 96 Mädchen) teilnahmen. Alle Patienten hatten einen dokumentierten Gendefekt im LDL-Rezeptor oder in ApoB. Ungefähr 89 % waren Kaukasier, 7 % Asiaten, 1 % Schwarze und weniger als 1 % Hispanoamerikaner. Der mittlere LDL-C-Wert zu Studienbeginn betrug 236 mg/dl. Achtundfünfzig (33 %) Patienten waren zu Studienbeginn präpubertär. Die Anfangsdosis von Rosuvastatin für alle Kinder und Jugendlichen betrug 5 mg einmal täglich. Kinder im Alter von 8 bis unter 10 Jahren (n = 41 zu Studienbeginn) konnten auf eine Höchstdosis von 10 mg einmal täglich titrieren, und Kinder und Jugendliche im Alter von 10 bis 17 Jahren konnten auf eine Höchstdosis von 20 mg einmal täglich titrieren.
Die Senkungen des LDL-C gegenüber dem Ausgangswert waren im Allgemeinen über die Altersgruppen hinweg innerhalb der Studie sowie mit früheren Erfahrungen sowohl in kontrollierten Studien mit Erwachsenen als auch mit Kindern konsistent.
Die langfristige Wirksamkeit einer im Kindesalter begonnenen Therapie mit Rosuvastatin zur Verringerung der Morbidität und Mortalität im Erwachsenenalter wurde nicht nachgewiesen.
Verlangsamung des Fortschreitens der Arteriosklerose
In der Studie „Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg“ (METEOR) wurde die Wirkung einer Therapie mit CRESTOR auf Atherosklerose der Halsschlagader bei Patienten mit erhöhtem LDL-C-Wert (Framingham-Risiko) mittels B-Mode-Ultraschall untersucht
Die annualisierte Änderungsrate gegenüber dem Ausgangswert für die Placebogruppe betrug +0,0131 mm/Jahr (p
Auf individueller Patientenebene in der mit CRESTOR behandelten Gruppe zeigten 52,1 % der Patienten keine Krankheitsprogression (definiert als negative annualisierte Veränderungsrate), verglichen mit 37,7 % der Patienten in der Placebogruppe.
Primärprävention von Herz-Kreislauf-Erkrankungen
In der Studie „Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin“ (JUPITER) wurde die Wirkung von CRESTOR (Rosuvastatin-Calcium) auf das Auftreten schwerer kardiovaskulärer (CV) Krankheitsereignisse bei 17.802 Männern (≥ 50 Jahre) untersucht ) und Frauen (≥ 60 Jahre) ohne klinisch erkennbare kardiovaskuläre Erkrankung, LDL-C-Spiegel
Der primäre Endpunkt war ein zusammengesetzter Endpunkt, bestehend aus der Zeit bis zum ersten Auftreten eines der folgenden schwerwiegenden kardiovaskulären Ereignisse: kardiovaskulärer Tod, nicht tödlicher Myokardinfarkt, nicht tödlicher Schlaganfall, Krankenhausaufenthalt wegen instabiler Angina pectoris oder ein arterielles Revaskularisierungsverfahren.
Rosuvastatin reduzierte signifikant das Risiko schwerer kardiovaskulärer Ereignisse (252 Ereignisse in der Placebo-Gruppe vs. 142 Ereignisse in der Rosuvastatin-Gruppe) mit einer statistisch signifikanten (p
Abbildung 2: Zeit bis zum ersten Auftreten schwerer kardiovaskulärer Ereignisse in JUPITER 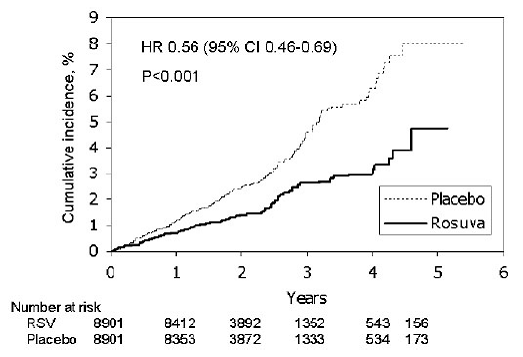
Die einzelnen Komponenten des primären Endpunkts sind in Abbildung 3 dargestellt. Rosuvastatin reduzierte signifikant das Risiko für nicht tödlichen Myokardinfarkt, nicht tödlichen Schlaganfall und arterielle Revaskularisationsverfahren. Es gab keine signifikanten Behandlungsunterschiede zwischen der Rosuvastatin- und der Placebo-Gruppe für Todesfälle aufgrund kardiovaskulärer Ursachen oder Krankenhauseinweisungen wegen instabiler Angina pectoris.
Rosuvastatin reduzierte signifikant das Myokardinfarktrisiko (6 tödliche Ereignisse und 62 nicht tödliche Ereignisse bei den mit Placebo behandelten Patienten gegenüber 9 tödlichen Ereignissen und 22 nicht tödlichen Ereignissen bei den mit Rosuvastatin behandelten Patienten) und das Schlaganfallrisiko (6 tödliche Ereignisse und 58 nicht tödliche Ereignisse bei den mit Placebo behandelten Patienten). Placebo-behandelten Probanden gegenüber 3 tödlichen Ereignissen und 30 nicht tödlichen Ereignissen bei mit Rosuvastatin behandelten Probanden).
In einer Post-hoc-Untergruppenanalyse von JUPITER-Patienten (n = 1405; Rosuvastatin = 725, Placebo = 680) mit einem hsCRP ≥ 2 mg/l und ohne andere traditionelle Risikofaktoren (Rauchen, BD ≥ 140/90 oder Einnahme von Antihypertensiva, niedrig HDL-C) außer dem Alter gab es nach Anpassung für hohes HDL-C keinen signifikanten Behandlungsnutzen bei der Behandlung mit Rosuvastatin.
Abbildung 3: Wichtige kardiovaskuläre Ereignisse nach Behandlungsgruppe in JUPITER 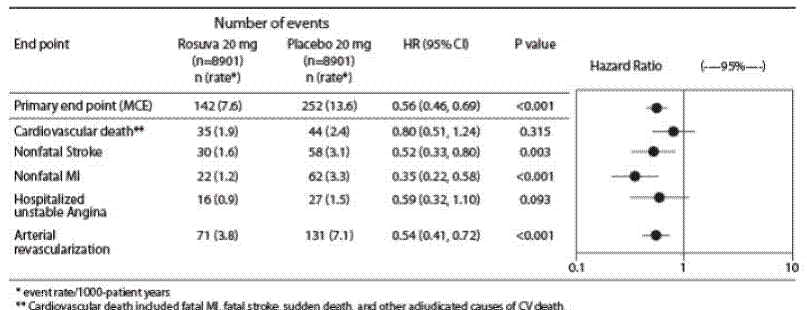
Nach einem Jahr erhöhte Rosuvastatin das HDL-C und senkte die LDL-C-, hsCRP-, Gesamtcholesterin- und Serumtriglyceridspiegel (p
INFORMATIONEN ZUM PATIENTEN
CRESTOR® (Kres-tor) Rosuvastatin-Calcium-Tabletten
Lesen Sie diese Patienteninformation sorgfältig durch, bevor Sie mit der Einnahme von CRESTOR 20 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Wenn Sie Fragen zu CRESTOR haben, wenden Sie sich an Ihren Arzt. Nur Ihr Arzt kann entscheiden, ob CRESTOR für Sie geeignet ist.
Was ist CRESTOR?
CRESTOR 20 mg ist ein verschreibungspflichtiges Arzneimittel, das ein cholesterinsenkendes Arzneimittel namens Rosuvastatin-Calcium enthält. Der größte Teil des Cholesterins in Ihrem Blut wird in der Leber hergestellt. CRESTOR 20 mg wirkt, indem es den Cholesterinspiegel auf zwei Arten senkt: CRESTOR 5 mg blockiert ein Enzym in der Leber, wodurch die Leber weniger Cholesterin bildet, und CRESTOR 20 mg erhöht die Aufnahme und den Abbau von bereits im Blut befindlichem Cholesterin durch die Leber.
CRESTOR 20 mg ist nicht für die Anwendung bei Kindern mit heterozygoter familiärer Hypercholesterinämie unter 8 Jahren oder für die Anwendung bei Kindern mit homozygoter familiärer Hypercholesterinämie unter 7 Jahren zugelassen.
CRESTOR 5 mg wird angewendet, um das Risiko von Herzinfarkten und Schlaganfällen bei Männern ab 50 Jahren und Frauen ab 60 Jahren zu verringern, die keine bekannte Herzerkrankung, aber bestimmte zusätzliche Risikofaktoren haben.
Es ist nicht bekannt, ob CRESTOR 10 mg bei Patienten mit Fredrickson-Typ-I- und -V-Dyslipidämie sicher und wirksam ist.
Wer sollte CRESTOR nicht einnehmen?
Nehmen Sie CRESTOR nicht ein, wenn Sie:
Was muss ich meinem Arzt vor und während der Einnahme von CRESTOR mitteilen?
Informieren Sie Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
Sprechen Sie mit Ihrem Arzt, bevor Sie mit der Einnahme neuer Arzneimittel beginnen.
Die Einnahme von CRESTOR 20 mg mit bestimmten anderen Arzneimitteln kann sich gegenseitig beeinflussen und Nebenwirkungen verursachen. CRESTOR kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von CRESTOR beeinflussen.
Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Fragen Sie Ihren Arzt oder Apotheker nach einer Liste dieser Arzneimittel, wenn Sie sich nicht sicher sind.
Kennen Sie alle Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich CRESTOR 10 mg einnehmen?
Was sind die möglichen Nebenwirkungen von CRESTOR 20mg?
CRESTOR 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Ihre Chancen auf Muskelprobleme sind höher, wenn Sie:
Die häufigsten Nebenwirkungen können sein: Kopfschmerzen, Muskelschmerzen und Schmerzen, Bauchschmerzen, Schwäche und Übelkeit.
Weitere Nebenwirkungen, die bei CRESTOR berichtet wurden, sind Gedächtnisverlust und Verwirrtheit.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von CRESTOR. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist CRESTOR 20 mg aufzubewahren?
Bewahren Sie CRESTOR 10 mg und alle Arzneimittel für Kinder unzugänglich auf.
Was sind die Zutaten in CRESTOR?
Wirkstoff: Rosuvastatin als Rosuvastatin-Calcium
Inaktive Zutaten: mikrokristalline Cellulose NF, Lactosemonohydrat NF, tribasisches Calciumphosphat NF, Crospovidon NF, Magnesiumstearat NF, Hypromellose NF, Triacetin NF, Titandioxid USP, gelbes Eisenoxid und rotes Eisenoxid NF.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von CRESTOR
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie CRESTOR 10 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie CRESTOR 20 mg nicht an andere Personen weiter, selbst wenn sie unter der gleichen Krankheit leiden wie Sie. Es kann ihnen schaden.
Sie können Ihren Apotheker oder Arzt um Informationen zu CRESTOR 5 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Diese Patienteninformation wurde von der US Food and Drug Administration Revised 9/2018 genehmigt