Tricor 160mg, 200mg Fenofibrate Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Tricor und wie wird es angewendet?
Tricor ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Cholesterin und Triglyceriden (Fettsäuren) im Blut. Tricor kann allein oder mit anderen Medikamenten verwendet werden.
Welche Nebenwirkungen kann Tricor haben?
Tricor 200 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Tricor gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Tricor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
TRICOR (Fenofibrat-Tabletten) ist ein lipidregulierendes Mittel, das als Tabletten zur oralen Verabreichung erhältlich ist. Jede Tablette enthält 54 mg oder 160 mg Fenofibrat. Der chemische Name für Fenofibrat ist 2-[4-(4-Chlorbenzoyl)phenoxy]-2-methyl-propansäure, 1-Methylethylester mit der folgenden Strukturformel:
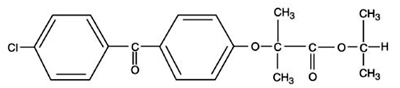
Die empirische Formel ist C20H21O4Cl und das Molekulargewicht ist 360,83; Fenofibrat ist in Wasser unlöslich. Der Schmelzpunkt liegt bei 79-82°C. Fenofibrat ist ein weißer Feststoff, der unter normalen Bedingungen stabil ist.
Inaktive Zutaten
Jede Tablette enthält kolloidales Siliciumdioxid, Crospovidon, Lactose-Monohydrat, Lecithin, mikrokristalline Cellulose, Polyvinylalkohol, Povidon, Natriumlaurylsulfat, Natriumstearylfumarat, Talk, Titandioxid und Xanthangummi. Zusätzlich enthalten 54 mg Einzeltabletten D&C Yellow Nr. 10, FD&C Yellow Nr. 6, FD&C Blue Nr. 2.
INDIKATIONEN
Primäre Hypercholesterinämie oder gemischte Dyslipidämie
TRICOR ist indiziert als Begleittherapie zu einer Diät zur Senkung von erhöhtem Low-Density-Lipoprotein-Cholesterin (LDL-C), Gesamtcholesterin (Total-C), Triglyceriden und Apolipoprotein B (Apo B) und zur Erhöhung von High-Density-Lipoprotein-Cholesterin (HDL-C). C) bei erwachsenen Patienten mit primärer Hypercholesterinämie oder gemischter Dyslipidämie.
Schwere Hypertriglyzeridämie
TRICOR 200 mg ist auch angezeigt als Zusatztherapie zu einer Diät zur Behandlung von erwachsenen Patienten mit schwerer Hypertriglyzeridämie. Die Verbesserung der glykämischen Kontrolle bei Diabetikern mit Nüchtern-Chylomikronämie wird in der Regel die Notwendigkeit einer pharmakologischen Intervention vermeiden.
Deutlich erhöhte Serumtriglyceridspiegel (z. B. > 2.000 mg/dl) können das Risiko einer Pankreatitis erhöhen. Die Wirkung einer Fenofibrat-Therapie auf die Verringerung dieses Risikos wurde nicht ausreichend untersucht.
Wichtige Nutzungsbeschränkungen
In einer großen, randomisierten, kontrollierten Studie mit Patienten mit Typ-2-Diabetes mellitus wurde nicht gezeigt, dass Fenofibrat in einer Dosis, die 145 mg TRICOR entspricht, die Morbidität und Mortalität der koronaren Herzkrankheit reduziert [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
DOSIERUNG UND ANWENDUNG
allgemeine Überlegungen
Die Patienten sollten vor der Einnahme von TRICOR 160 mg auf eine geeignete lipidsenkende Diät umgestellt werden und diese Diät während der Behandlung mit TRICOR fortsetzen. TRICOR-Tabletten können unabhängig von den Mahlzeiten verabreicht werden.
Die anfängliche Behandlung von Dyslipidämie ist eine Ernährungstherapie, die für die Art der Lipoproteinanomalie spezifisch ist. Übermäßiges Körpergewicht und übermäßiger Alkoholkonsum können wichtige Faktoren bei Hypertriglyzeridämie sein und sollten vor jeder medikamentösen Therapie behandelt werden. Körperliche Bewegung kann eine wichtige Begleitmaßnahme sein. Erkrankungen, die zur Hyperlipidämie beitragen, wie Hypothyreose oder Diabetes mellitus, sollten gesucht und angemessen behandelt werden. Östrogentherapie, Thiaziddiuretika und Betablocker sind manchmal mit einem massiven Anstieg der Plasmatriglyceride verbunden, insbesondere bei Patienten mit familiärer Hypertriglyceridämie. In solchen Fällen kann das Absetzen des spezifischen ätiologischen Mittels die Notwendigkeit einer spezifischen medikamentösen Therapie der Hypertriglyceridämie vermeiden.
Die Lipidspiegel sollten regelmäßig überwacht werden und es sollte erwogen werden, die Dosierung von TRICOR zu reduzieren, wenn die Lipidspiegel deutlich unter den Zielbereich fallen.
Die Therapie sollte bei Patienten, die nach zwei Monaten Behandlung mit der maximal empfohlenen Dosis von 145 mg einmal täglich nicht ausreichend ansprechen, abgesetzt werden.
Primäre Hypercholesterinämie oder gemischte Dyslipidämie
Die Anfangsdosis von TRICOR 200 mg beträgt 145 mg einmal täglich.
Schwere Hypertriglyzeridämie
Die Anfangsdosis beträgt 48 bis 145 mg pro Tag. Die Dosierung sollte entsprechend dem Ansprechen des Patienten individuell angepasst und bei Bedarf nach wiederholten Lipidbestimmungen in Abständen von 4 bis 8 Wochen angepasst werden. Die Höchstdosis beträgt 145 mg einmal täglich.
Beeinträchtigte Nierenfunktion
Die Behandlung mit TRICOR 200 mg sollte bei Patienten mit leicht bis mäßig eingeschränkter Nierenfunktion mit einer Dosis von 48 mg pro Tag begonnen und erst nach Bewertung der Auswirkungen auf die Nierenfunktion und die Lipidspiegel bei dieser Dosis gesteigert werden. Die Anwendung von TRICOR sollte bei Patienten mit schwerer Nierenfunktionsstörung vermieden werden [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
Geriatrische Patienten
Die Dosisauswahl für ältere Menschen sollte auf der Grundlage der Nierenfunktion erfolgen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
TRICOR® (Fenofibrat-Tabletten) ist in zwei Stärken erhältlich:
48mg
Gelbe Tabletten mit dem Code-Identifikationsbuchstaben „FI“, erhältlich in Flaschen mit 90 ( NDC 0074-3173-90).
Gelbe Tabletten, bedruckt mit dem „a“-Logo und den Kennbuchstaben „FI“, erhältlich in Flaschen mit 90 ( NDC 0074-6122-90).
145mg
Weiße Tabletten mit dem Code-Identifikationsbuchstaben „FO“, erhältlich in Flaschen mit 90 ( NDC 0074-3189-90).
Weiße Tabletten, bedruckt mit dem „a“-Logo und den Kennbuchstaben „FO“, erhältlich in Flaschen mit 90 ( NDC 0074-6123-90).
Lagerung
Bei 25 °C (77 °F) lagern; Ausflüge erlaubt bis 15-30°C (59-86°F).
[Siehe USP Kontrollierte Raumtemperatur]. Von Kindern fern halten. Vor Feuchtigkeit schützen.
Hergestellt für AbbVie Inc., North Chicago, IL 60064, USA von Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irland. Überarbeitet: März 2021
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden unten und an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Unerwünschte Ereignisse, die von 2 % oder mehr der mit Fenofibrat (und mehr als Placebo) behandelten Patienten während der doppelblinden, placebokontrollierten Studien unabhängig von der Kausalität berichtet wurden, sind in Tabelle 1 unten aufgeführt. Unerwünschte Ereignisse führten bei 5,0 % der mit Fenofibrat behandelten Patienten und bei 3,0 % der mit Placebo behandelten Patienten zum Abbruch der Behandlung. Anstiege der Leberfunktionswerte waren die häufigsten Ereignisse und führten in doppelblinden Studien bei 1,6 % der Patienten zum Abbruch der Behandlung mit Fenofibrat.
Urtikaria wurde in kontrollierten Studien bei 1,1 % vs. 0 % und Hautausschlag bei 1,4 % vs. 0,8 % der Fenofibrat- bzw. Placebo-Patienten beobachtet.
Anstieg der Leberenzyme
In einer gepoolten Analyse von 10 placebokontrollierten Studien kam es bei 5,3 % der Patienten, die Fenofibrat in Dosen entsprechend 96 mg bis 145 mg TRICOR täglich einnahmen, zu einem Anstieg auf das > 3-fache der oberen Normgrenze der ALT im Vergleich zu 1,1 % der mit Placebo behandelten Patienten [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]. In einer 8-wöchigen Studie betrug die Inzidenz von ALT- oder AST-Erhöhungen um das ≥ 3-fache der oberen Normgrenze 13 % bei Patienten, die Dosierungen von 96 mg bis 145 mg TRICOR täglich erhielten, und 0 % bei Patienten, die Dosierungen von 48 mg erhielten oder weniger TRICOR täglich oder Placebo.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Fenofibrat nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen: Myalgie, Rhabdomyolyse, Pankreatitis, akutes Nierenversagen, Muskelkrämpfe, Hepatitis, Zirrhose, erhöht Gesamtbilirubin, Anämie, Arthralgie, Abnahme des Hämoglobins, Abnahme des Hämatokrits, Abnahme der weißen Blutkörperchen, Asthenie, stark erniedrigter HDL-Cholesterinspiegel und interstitielle Lungenerkrankung. Lichtempfindlichkeitsreaktionen sind Tage bis Monate nach Beginn aufgetreten; In einigen dieser Fälle berichteten die Patienten über eine frühere Lichtempfindlichkeitsreaktion auf Ketoprofen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Cumarin-Antikoagulanzien
Bei Verlängerung der PT/INR wurde eine Verstärkung der gerinnungshemmenden Wirkung vom Cumarin-Typ beobachtet.
Vorsicht ist geboten, wenn Cumarin-Antikoagulantien zusammen mit TRICOR gegeben werden. Die Dosierung der Antikoagulanzien sollte reduziert werden, um die PT/INR auf dem gewünschten Niveau zu halten und Blutungskomplikationen zu vermeiden. Häufige PT/INR-Bestimmungen sind ratsam, bis sicher festgestellt wurde, dass sich die PT/INR stabilisiert hat [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Immunsuppressiva
Immunsuppressiva wie Cyclosporin und Tacrolimus können Nephrotoxizität mit Abnahme der Kreatinin-Clearance und Anstieg des Serumkreatinins hervorrufen, und da die renale Ausscheidung der primäre Eliminationsweg von Fibratmitteln einschließlich TRICOR ist, besteht das Risiko, dass eine Wechselwirkung zu einer Verschlechterung der Nierenfunktion führt. Die Vorteile und Risiken der Anwendung von TRICOR (Fenofibrat-Tabletten) mit Immunsuppressiva und anderen potenziell nephrotoxischen Wirkstoffen sollten sorgfältig abgewogen und die niedrigste wirksame Dosis angewendet und die Nierenfunktion überwacht werden.
Gallensäurebindende Harze
Da gallensäurebindende Harze andere gleichzeitig verabreichte Arzneimittel binden können, sollten Patienten TRICOR 200 mg mindestens 1 Stunde vor oder 4 bis 6 Stunden nach einem gallensäurebindenden Harz einnehmen, um dessen Resorption nicht zu behindern.
Colchicin
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden bei gleichzeitiger Anwendung von Fenofibraten mit Colchicin berichtet, und bei der Verschreibung von Fenofibrat mit Colchicin ist Vorsicht geboten.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Sterblichkeit und koronare Herzkrankheit Morbidität
Die Wirkung von TRICOR 160 mg auf die Morbidität und Mortalität bei koronarer Herzkrankheit und die nicht-kardiovaskuläre Mortalität wurde nicht nachgewiesen.
Die Studie „Action to Control Cardiovascular Risk in Diabetes Lipid“ (ACCORD Lipid) war eine randomisierte, placebokontrollierte Studie mit 5.518 Patienten mit Typ-2-Diabetes mellitus, die eine Hintergrundtherapie mit Statinen erhielten und mit Fenofibrat behandelt wurden. Die mittlere Nachbeobachtungszeit betrug 4,7 Jahre. Die Kombinationstherapie mit Fenofibrat plus Statin zeigte eine nicht signifikante relative Risikoreduktion von 8 % beim primären Endpunkt schwerwiegender unerwünschter kardiovaskulärer Ereignisse (MACE), einer Kombination aus nicht tödlichem Myokardinfarkt, nicht tödlichem Schlaganfall und Tod durch kardiovaskuläre Erkrankung (Hazard Ratio [ HR] 0,92, 95 % KI 0,79-1,08) (p = 0,32) im Vergleich zur Statin-Monotherapie. In einer geschlechtsspezifischen Subgruppenanalyse betrug die Hazard Ratio für MACE bei Männern unter Kombinationstherapie versus Statin-Monotherapie 0,82 (95 % KI 0,69-0,99) und die Hazard Ratio für MACE bei Frauen unter Kombinationstherapie versus Statin-Monotherapie 1,38 (95 % KI 0,98-1,94) (Wechselwirkung p=0,01). Die klinische Bedeutung dieses Subgruppenbefunds ist unklar.
Die Fenofibrate Intervention and Event Lowering in Diabetes (FIELD)-Studie war eine 5-jährige randomisierte, placebokontrollierte Studie mit 9795 Patienten mit Typ-2-Diabetes mellitus, die mit Fenofibrat behandelt wurden. Fenofibrat zeigte eine nicht signifikante relative Reduktion um 11 % beim primären Outcome von Ereignissen der koronaren Herzkrankheit (Hazard Ratio [HR] 0,89, 95 % CI 0,75-1,05, p = 0,16) und eine signifikante Reduktion um 11 % beim sekundären Outcome insgesamt kardiovaskuläre Krankheitsereignisse (HR 0,89 [0,80-0,99], p=0,04). Unter Fenofibrat gab es einen nicht signifikanten Anstieg von 11 % (HR 1,11 [0,95; 1,29], p = 0,18) bzw. 19 % (HR 1,19 [0,90; 1,57], p = 0,22) bei der Gesamtsterblichkeit und der Sterblichkeit bei koronarer Herzkrankheit im Vergleich zu Placebo.
Aufgrund chemischer, pharmakologischer und klinischer Ähnlichkeiten zwischen TRICOR (Fenofibrat-Tabletten), Clofibrat und Gemfibrozil können die unerwünschten Ergebnisse in 4 großen randomisierten, placebokontrollierten klinischen Studien mit diesen anderen Fibrat-Medikamenten auch für TRICOR gelten.
Im Coronary Drug Project, einer großen Studie über Post-Myokardinfarkt bei Patienten, die 5 Jahre lang mit Clofibrat behandelt wurden, wurde kein Unterschied in der Sterblichkeit zwischen der Clofibrat-Gruppe und der Placebo-Gruppe festgestellt. Es gab jedoch einen Unterschied in der Rate von Cholelithiasis und Cholezystitis, die eine Operation erforderten, zwischen den beiden Gruppen (3,0 % vs. 1,8 %).
In einer von der Weltgesundheitsorganisation (WHO) durchgeführten Studie wurden 5000 Probanden ohne bekannte koronare Herzkrankheit 5 Jahre lang mit Placebo oder Clofibrat behandelt und für ein weiteres Jahr nachbeobachtet. Es gab eine statistisch signifikant höhere altersbereinigte Gesamtmortalität in der Clofibrat-Gruppe im Vergleich zur Placebo-Gruppe (5,70 % vs. 3,96 %, p =
Die Helsinki Heart Study war eine große (n=4081) Studie an Männern mittleren Alters ohne koronare Herzkrankheit in der Vorgeschichte. Die Probanden erhielten 5 Jahre lang entweder Placebo oder Gemfibrozil, mit einer offenen Verlängerung um 3,5 Jahre danach. Die Gesamtmortalität war in der Gemfibrozil-Randomisierungsgruppe numerisch höher, erreichte jedoch keine statistische Signifikanz (p = 0,19, 95 % Konfidenzintervall für relatives Risiko G:P = 0,91-1,64). Obwohl Krebstodesfälle in der Gemfibrozil-Gruppe tendenziell höher waren (p = 0,11), wurden Krebserkrankungen (ausgenommen Basalzellkarzinom) in beiden Studiengruppen mit gleicher Häufigkeit diagnostiziert. Aufgrund des begrenzten Umfangs der Studie wurde nicht gezeigt, dass sich das relative Risiko für Tod aus irgendeinem Grund von dem unterscheidet, das in den 9-Jahres-Follow-up-Daten der Studie der Weltgesundheitsorganisation (RR = 1,29) festgestellt wurde.
In eine Sekundärpräventionskomponente der Helsinki Heart Study wurden Männer mittleren Alters aufgenommen, die aufgrund einer bekannten oder vermuteten koronaren Herzkrankheit von der Primärpräventionsstudie ausgeschlossen wurden. Die Probanden erhielten 5 Jahre lang Gemfibrozil oder Placebo. Obwohl die Herztodesfälle in der Gemfibrozil-Gruppe tendenziell höher waren, war dies statistisch nicht signifikant (Hazard Ratio 2,2, 95 % Konfidenzintervall: 0,94–5,05). Die Rate an Gallenblasenoperationen war zwischen den Studiengruppen statistisch nicht signifikant, tendierte jedoch in der Gemfibrozil-Gruppe höher (1,9 % vs. 0,3 %, p = 0,07).
Hepatotoxizität
Nach der Markteinführung von TRICOR wurde über schwerwiegende arzneimittelinduzierte Leberschäden (DILI), einschließlich Lebertransplantation und Tod, berichtet. DILI wurde innerhalb der ersten Behandlungswochen oder nach mehreren Behandlungsmonaten berichtet und bildete sich in einigen Fällen nach Absetzen der Behandlung mit TRICOR 200 mg zurück. Bei Patienten mit DILI traten Anzeichen und Symptome auf, darunter dunkler Urin, abnormaler Stuhlgang, Gelbsucht, Unwohlsein, Bauchschmerzen, Myalgie, Gewichtsverlust, Juckreiz und Übelkeit. Viele Patienten hatten gleichzeitige Erhöhungen von Gesamtbilirubin, Serum-Alanin-Transaminase (ALT) und Aspartat-Transaminase (AST). DILI wurde als hepatozelluläre, chronisch aktive und cholestatische Hepatitis charakterisiert, und Zirrhose ist in Verbindung mit chronisch aktiver Hepatitis aufgetreten.
In klinischen Studien wurde Fenofibrat in Dosen, die 96 mg bis 145 mg TRICOR 160 mg täglich entsprechen, mit einem Anstieg der AST- oder ALT-Werte im Serum in Verbindung gebracht. Die Inzidenz von Transaminasenerhöhungen kann dosisabhängig sein [vgl NEBENWIRKUNGEN ].
TRICOR 160 mg ist kontraindiziert bei Patienten mit aktiver Lebererkrankung, einschließlich Patienten mit primärer biliärer Zirrhose und ungeklärten persistierenden Leberfunktionsstörungen [siehe KONTRAINDIKATIONEN ]. Überwachen Sie die Leberfunktion des Patienten, einschließlich Serum-ALT, AST und Gesamtbilirubin, zu Studienbeginn und in regelmäßigen Abständen für die Dauer der Therapie mit TRICOR. Setzen Sie TRICOR 200 mg ab, wenn sich Anzeichen oder Symptome einer Leberschädigung entwickeln oder wenn erhöhte Enzymspiegel anhalten (ALT oder AST > 3-mal die obere Grenze des Normalwerts oder wenn sie von einer Erhöhung des Bilirubins begleitet werden). Beginnen Sie die Behandlung mit TRICOR 160 mg bei diesen Patienten nicht erneut, wenn es keine alternative Erklärung für die Leberschädigung gibt.
Myopathie und Rhabdomyolyse
Fibrate erhöhen das Risiko für Myopathie und wurden mit Rhabdomyolyse in Verbindung gebracht. Das Risiko einer schweren Muskeltoxizität scheint bei älteren Patienten und bei Patienten mit Diabetes, Niereninsuffizienz oder Hypothyreose erhöht zu sein.
Eine Myopathie sollte bei jedem Patienten mit diffusen Myalgien, Muskelempfindlichkeit oder -schwäche und/oder deutlich erhöhten Kreatinphosphokinase (CPK)-Spiegeln in Betracht gezogen werden.
Patienten sollten angewiesen werden, ungeklärte Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden. Bei Patienten, die über diese Symptome berichten, sollten die CPK-Spiegel bestimmt werden, und die Behandlung mit TRICOR 200 mg sollte abgebrochen werden, wenn deutlich erhöhte CPK-Spiegel auftreten oder eine Myopathie/Myositis vermutet oder diagnostiziert wird.
Daten aus Beobachtungsstudien weisen darauf hin, dass das Risiko einer Rhabdomyolyse erhöht ist, wenn Fibrate, insbesondere Gemfibrozil, zusammen mit einem Statin verabreicht werden. Die Kombination sollte vermieden werden, es sei denn, der Nutzen weiterer Änderungen der Lipidspiegel überwiegt wahrscheinlich das erhöhte Risiko dieser Arzneimittelkombination [siehe KLINISCHE PHARMAKOLOGIE ].
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden bei gleichzeitiger Anwendung von Fenofibraten mit Colchicin berichtet, und bei der Verschreibung von Fenofibrat mit Colchicin ist Vorsicht geboten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Serumkreatinin
Bei Patienten unter Fenofibrat wurde über Erhöhungen des Serumkreatinins berichtet. Diese Anstiege neigen dazu, nach Absetzen von Fenofibrat auf den Ausgangswert zurückzukehren. Die klinische Bedeutung dieser Beobachtungen ist unbekannt. Überwachen Sie die Nierenfunktion bei Patienten mit eingeschränkter Nierenfunktion, die TRICOR einnehmen. Eine Überwachung der Nierenfunktion sollte auch bei Patienten in Betracht gezogen werden, die TRICOR mit einem Risiko für Niereninsuffizienz einnehmen, wie z. B. ältere Menschen und Patienten mit Diabetes.
Cholelithiasis
Fenofibrat kann wie Clofibrat und Gemfibrozil die Cholesterinausscheidung in die Galle erhöhen und zu Cholelithiasis führen. Bei Verdacht auf Cholelithiasis sind Untersuchungen der Gallenblase angezeigt. Die Behandlung mit TRICOR 160 mg sollte abgebrochen werden, wenn Gallensteine gefunden werden.

Cumarin-Antikoagulanzien
Vorsicht ist geboten, wenn Cumarin-Antikoagulanzien zusammen mit TRICOR 160 mg verabreicht werden, da die Wirkung von Cumarin-Antikoagulanzien durch die Verlängerung der Prothrombinzeit/International Normalized Ratio (PT/INR) verstärkt wird. Um Blutungskomplikationen vorzubeugen, werden eine häufige Überwachung der PT/INR und eine Dosisanpassung des Antikoagulans empfohlen, bis sich die PT/INR stabilisiert hat [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pankreatitis
Pankreatitis wurde bei Patienten berichtet, die Fenofibrat, Gemfibrozil und Clofibrat einnahmen. Dieses Auftreten kann bei Patienten mit schwerer Hypertriglyzeridämie auf ein Versagen der Wirksamkeit, eine direkte Arzneimittelwirkung oder ein sekundäres Phänomen hinweisen, das durch Gallengangssteine oder Schlammbildung mit Verstopfung des gemeinsamen Gallengangs vermittelt wird.
Hämatologische Veränderungen
Bei Patienten nach Beginn einer Fenofibrat-Therapie wurde eine leichte bis mäßige Abnahme von Hämoglobin, Hämatokrit und weißen Blutkörperchen beobachtet. Diese Spiegel stabilisieren sich jedoch während einer Langzeitverabreichung. Bei mit Fenofibrat behandelten Personen wurde über Thrombozytopenie und Agranulozytose berichtet. Während der ersten 12 Monate der TRICOR-Verabreichung wird eine regelmäßige Überwachung der Anzahl der roten und weißen Blutkörperchen empfohlen.
Überempfindlichkeitsreaktionen
Akute Überempfindlichkeit
Nach Markteinführung von Fenofibrat wurde über Anaphylaxie und Angioödem berichtet. In einigen Fällen waren die Reaktionen lebensbedrohlich und erforderten eine Notfallbehandlung. Wenn ein Patient Anzeichen oder Symptome einer akuten Überempfindlichkeitsreaktion entwickelt, raten Sie ihm, sofort einen Arzt aufzusuchen und Fenofibrat abzusetzen.
Verzögerte Überempfindlichkeit
Schwere kutane unerwünschte Arzneimittelwirkungen (SCAR), einschließlich Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse und Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), wurden nach Markteinführung berichtet und traten Tage bis Wochen nach Beginn der Behandlung mit Fenofibrat auf. Die DRESS-Fälle waren mit Hautreaktionen (wie Hautausschlag oder exfoliativer Dermatitis) und einer Kombination aus Eosinophilie, Fieber, Beteiligung systemischer Organe (Niere, Leber oder Atemwege) verbunden. Bei Verdacht auf SCAR Fenofibrat absetzen und Patienten entsprechend behandeln.
Venothromboembolische Erkrankung
In der FIELD-Studie wurden Lungenembolien (PE) und tiefe Venenthrombosen (TVT) in der mit Fenofibrat behandelten Gruppe häufiger beobachtet als in der mit Placebo behandelten Gruppe. Von 9.795 in FIELD aufgenommenen Patienten befanden sich 4.900 in der Placebogruppe und 4.895 in der Fenofibratgruppe. Für TVT gab es 48 Ereignisse (1 %) in der Placebo-Gruppe und 67 (1 %) in der Fenofibrat-Gruppe (p = 0,074); und für PE gab es 32 (0,7 %) Ereignisse in der Placebo-Gruppe und 53 (1 %) in der Fenofibrat-Gruppe (p = 0,022).
Im Coronary Drug Project erlitt ein höherer Anteil der Clofibrat-Gruppe eine definitive oder vermutete tödliche oder nicht tödliche Lungenembolie oder Thrombophlebitis als die Placebo-Gruppe (5,2 % vs. 3,3 % nach fünf Jahren; p
Paradoxe Abnahme des HDL-Cholesterinspiegels
Nach der Markteinführung und aus klinischen Studien liegen Berichte über schwere Senkungen des HDL-Cholesterinspiegels (so niedrig wie 2 mg/dl) vor, die bei Diabetikern und Nicht-Diabetikern auftraten, die mit einer Fibrattherapie begonnen wurden. Die Abnahme von HDL-C spiegelt sich in einer Abnahme von Apolipoprotein A1 wider. Es wurde berichtet, dass diese Abnahme innerhalb von 2 Wochen bis Jahren nach Beginn der Fibrattherapie auftritt. Die HDL-C-Spiegel bleiben erniedrigt, bis die Fibrattherapie abgesetzt wird; das Ansprechen auf das Absetzen der Fibrattherapie ist schnell und nachhaltig. Die klinische Bedeutung dieser HDL-C-Abnahme ist nicht bekannt. Es wird empfohlen, die HDL-C-Spiegel innerhalb der ersten Monate nach Beginn der Fibrattherapie zu kontrollieren. Wenn ein stark erniedrigter HDL-C-Spiegel festgestellt wird, sollte die Fibrattherapie abgesetzt und der HDL-C-Spiegel überwacht werden, bis er auf den Ausgangswert zurückgekehrt ist, und die Fibrattherapie sollte nicht wieder aufgenommen werden.
Nichtklinische Toxikologie
Karzinogenese und Mutagenese und Beeinträchtigung der Fruchtbarkeit
Mit Fenofibrat wurden zwei Kanzerogenitätsstudien an Ratten durchgeführt. In der ersten 24-monatigen Studie erhielten Wistar-Ratten Fenofibrat in einer Dosis von 10, 45 und 200 mg/kg/Tag, etwa das 0,3-, 1- und 6-fache der maximal empfohlenen Humandosis (MRHD) von 300 mg Fenofibrat täglich, entsprechend 145 mg TRICOR 160 mg täglich, basierend auf Vergleichen der Körperoberfläche. Bei einer Dosis von 200 mg/kg/Tag (bei 6-facher MRHD) war die Inzidenz von Leberkarzinomen bei beiden Geschlechtern signifikant erhöht. Eine statistisch signifikante Zunahme von Pankreaskarzinomen wurde bei Männern beim 1- und 6-fachen der MRHD beobachtet; eine Zunahme von Pankreasadenomen und gutartigen testikulären interstitiellen Zelltumoren wurde beim 6-fachen der MRHD bei Männern beobachtet. In einer zweiten 24-monatigen Karzinogenitätsstudie an Ratten mit einem anderen Rattenstamm (Sprague-Dawley) führten Dosen von 10 und 60 mg/kg/Tag (das 0,3- und 2-fache der MRHD) zu einem signifikanten Anstieg der Inzidenz von Azinusadenomen der Bauchspeicheldrüse bei beiden Geschlechtern und Zunahmen von testikulären interstitiellen Zelltumoren bei Männern bei 2-facher MRHD.
Eine 117-wöchige Karzinogenitätsstudie wurde an Ratten durchgeführt, in der drei Medikamente verglichen wurden: Fenofibrat 10 und 60 mg/kg/Tag (das 0,3- und 2-fache der MRHD, basierend auf Vergleichen der Körperoberfläche), Clofibrat (400 mg/kg/Tag; 2-mal der Humandosis) und Gemfibrozil (250 mg/kg/Tag; 2-fache Humandosis, basierend auf mg/m² Oberfläche). Fenofibrat vermehrte Azinusadenome des Pankreas bei beiden Geschlechtern. Clofibrat verstärkte das hepatozelluläre Karzinom und die azinären Adenome des Pankreas bei Männern und die neoplastischen Knoten der Leber bei Frauen. Gemfibrozil erhöhte die Zahl der hepatischen neoplastischen Knötchen bei Männern und Frauen, während alle drei Medikamente die Hoden-Interstitialzelltumoren bei Männern erhöhten.
In einer 21-monatigen Studie an CF-1-Mäusen führten 10, 45 und 200 mg/kg/Tag Fenofibrat (etwa das 0,2-, 1- und 3-fache der MRHD, basierend auf Vergleichen der Körperoberfläche) zu einer signifikanten Zunahme der Leberkarzinome bei beiden Geschlechter beim 3-fachen der MRHD. In einer zweiten 18-monatigen Studie mit 10, 60 und 200 mg/kg/Tag erhöhte Fenofibrat signifikant die Leberkarzinome bei männlichen Mäusen und Leberadenome bei weiblichen Mäusen bei einer 3-fachen MRHD.
Elektronenmikroskopische Studien haben eine peroxisomale Proliferation nach Verabreichung von Fenofibrat an Ratten gezeigt. Eine angemessene Studie zum Testen der Peroxisomenproliferation beim Menschen wurde nicht durchgeführt, aber Veränderungen der Peroxisomenmorphologie und -anzahl wurden beim Menschen nach der Behandlung mit anderen Mitgliedern der Fibrate-Klasse beobachtet, wenn Leberbiopsien vor und nach der Behandlung bei demselben Individuum verglichen wurden.
In den folgenden Tests wurde gezeigt, dass Fenofibrat kein mutagenes Potenzial aufweist: Ames, Maus-Lymphom, Chromosomenaberration und außerplanmäßige DNA-Synthese in primären Rattenhepatozyten.
In Fertilitätsstudien erhielten Ratten orale Nahrungsdosen von Fenofibrat, Männchen 61 Tage vor der Paarung und Weibchen 15 Tage vor der Paarung bis zum Absetzen, was zu keiner nachteiligen Wirkung auf die Fruchtbarkeit bei Dosen bis zu 300 mg/kg/Tag (das 10-fache der MRHD, basierend auf Vergleichen der Körperoberfläche).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die begrenzten verfügbaren Daten zur Anwendung von Fenofibrat bei Schwangeren reichen nicht aus, um ein arzneimittelbedingtes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder unerwünschte mütterliche oder fetale Folgen zu bestimmen. In Reproduktionsstudien an Tieren wurden keine Hinweise auf embryofetale Toxizität bei oraler Verabreichung von Fenofibrat an Ratten und Kaninchen während der Organogenese in Dosen von weniger als oder entsprechend der maximal empfohlenen klinischen Dosis von 145 mg täglich, basierend auf der Körperoberfläche (mg/ m²). Unerwünschte reproduktive Ergebnisse traten bei höheren Dosen in Gegenwart maternaler Toxizität auf (siehe Daten ). TRICOR 200 mg sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Daten
Tierdaten
Bei trächtigen Ratten, denen orale Nahrungsdosen von 14, 127 und 361 mg/kg/Tag vom 6. bis 15. Trächtigkeitstag während der Organogenese verabreicht wurden, wurden bei 14 mg/kg/Tag (weniger als die klinische Exposition) keine nachteiligen Entwicklungsbefunde beobachtet bei der maximal empfohlenen Humandosis [MRHD] von 300 mg Fenofibrat täglich, entsprechend 145 mg TRICOR täglich, basierend auf Vergleichen der Körperoberfläche). Bei maternaltoxischen Dosen (361 mg/kg/Tag, entsprechend der 12-fachen klinischen Exposition bei der MRHD), die die Körpergewichtszunahme der Mutter signifikant unterdrückten, wurden vermehrt fötale Skelettmissbildungen beobachtet.
Bei trächtigen Kaninchen, denen ab dem 618. Trächtigkeitstag während der Organogenese Dosen von 15, 150 und 300 mg/kg/Tag per Schlundsonde verabreicht wurden, wurden bei 15 mg/kg/Tag (einer Dosis, die nähert sich der klinischen Exposition bei der MRHD, basierend auf Vergleichen der Körperoberfläche). Bei für das Muttertier toxischen Dosen (≥ 150 mg/kg/Tag, entsprechend dem ≥ 10-fachen der klinischen Exposition bei der MRHD) wurden abgebrochene Würfe beobachtet, die die Körpergewichtszunahme des Muttertiers unterdrückten.
Bei trächtigen Ratten, denen vom 15. Tag der Trächtigkeit bis zum 21. Tag der Laktation (Absetzen) orale Nahrungsdosen von 15, 75 und 300 mg/kg/Tag verabreicht wurden, wurden bei 15 mg/kg/Tag (weniger als die klinische Exposition) keine nachteiligen Auswirkungen auf die Entwicklung beobachtet bei der MRHD, basierend auf Vergleichen der Körperoberfläche), trotz maternaler Toxizität (verringerte Gewichtszunahme). Postimplantationsverluste wurden bei ≥ 75 mg/kg/Tag (≥ 2-fache der klinischen Exposition bei der MRHD) bei Vorliegen maternaler Toxizität (verringerte Gewichtszunahme) beobachtet. Bei 300 mg/kg/Tag (das Zehnfache der klinischen Exposition bei der MRHD) wurde eine verringerte Überlebensrate der Jungtiere festgestellt, was mit einer verringerten Körpergewichtszunahme der Mutter/mütterliche Vernachlässigung einherging.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von Fenofibrat in der Muttermilch, die Auswirkungen des Arzneimittels auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Fenofibrat kommt in der Milch von Ratten vor und ist daher wahrscheinlich auch in der Muttermilch vorhanden. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen, wie z. B. einer Störung des kindlichen Fettstoffwechsels, sollten Frauen während der Behandlung mit TRICOR 200 mg und für 5 Tage nach der letzten Dosis nicht stillen [siehe KONTRAINDIKATIONEN ].
Pädiatrische Verwendung
Sicherheit und Wirksamkeit wurden bei pädiatrischen Patienten nicht nachgewiesen.
Geriatrische Verwendung
Es ist bekannt, dass Fenofibrinsäure im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko von Nebenwirkungen dieses Arzneimittels kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Die Fenofibrinsäure-Exposition wird nicht durch das Alter beeinflusst. Da bei älteren Patienten häufiger Nierenfunktionsstörungen auftreten, sollte die Dosisauswahl für ältere Patienten auf der Grundlage der Nierenfunktion erfolgen [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ]. Ältere Patienten mit normaler Nierenfunktion sollten keine Dosisanpassungen benötigen. Erwägen Sie die Überwachung der Nierenfunktion bei älteren Patienten, die TRICOR einnehmen.
Nierenfunktionsstörung
Die Anwendung von TRICOR 160 mg sollte bei Patienten mit schwerer Nierenfunktionsstörung vermieden werden [siehe KONTRAINDIKATIONEN ]. Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung ist eine Dosisreduktion erforderlich [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ]. Eine Überwachung der Nierenfunktion bei Patienten mit eingeschränkter Nierenfunktion wird empfohlen.
Leberfunktionsstörung
Die Anwendung von TRICOR 200 mg wurde bei Patienten mit eingeschränkter Leberfunktion nicht untersucht [siehe KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es gibt keine spezifische Behandlung für eine Überdosierung mit TRICOR. Im Falle einer Überdosierung ist eine allgemeine unterstützende Behandlung des Patienten angezeigt, einschließlich Überwachung der Vitalzeichen und Beobachtung des klinischen Zustands. Falls angezeigt, sollte nicht resorbiertes Arzneimittel durch Erbrechen oder Magenspülung eliminiert werden; Zur Aufrechterhaltung der Atemwege sind die üblichen Vorsichtsmaßnahmen zu beachten. Da Fenofibrinsäure stark an Plasmaproteine gebunden ist, sollte eine Hämodialyse nicht in Betracht gezogen werden.
KONTRAINDIKATIONEN
TRICOR 200 mg ist kontraindiziert bei:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Die aktive Einheit von TRICOR ist Fenofibrinsäure. Die pharmakologischen Wirkungen von Fenofibrinsäure bei Tieren und Menschen wurden ausgiebig durch orale Verabreichung von Fenofibrat untersucht.
Die in der klinischen Praxis beobachteten lipidmodifizierenden Wirkungen von Fenofibrinsäure wurden in vivo in transgenen Mäusen und in vitro in menschlichen Hepatozytenkulturen durch die Aktivierung des Peroxisom-Proliferator-aktivierten Rezeptors α (PPARα) erklärt. Durch diesen Mechanismus erhöht Fenofibrat die Lipolyse und die Elimination triglyceridreicher Partikel aus dem Plasma, indem es die Lipoproteinlipase aktiviert und die Produktion von Apoprotein C-III (einem Inhibitor der Lipoproteinlipaseaktivität) verringert.
Die daraus resultierende Abnahme der TG führt zu einer Veränderung der Größe und Zusammensetzung von LDL von kleinen, dichten Partikeln (von denen aufgrund ihrer Oxidationsanfälligkeit angenommen wird, dass sie atherogen sind) zu großen schwimmenden Partikeln. Diese größeren Partikel haben eine größere Affinität zu Cholesterinrezeptoren und werden schnell abgebaut. Die Aktivierung von PPARα induziert auch eine Erhöhung der Synthese von Apolipoproteinen AI, A-II und HDL-Cholesterin.
Fenofibrat senkt auch die Harnsäurespiegel im Serum bei hyperurikämischen und gesunden Personen, indem es die Ausscheidung von Harnsäure über den Urin erhöht.
Pharmakodynamik
Eine Vielzahl klinischer Studien hat gezeigt, dass erhöhte Spiegel von Gesamt-C, LDL-C und Apo B, einem LDL-Membrankomplex, mit Atherosklerose beim Menschen in Verbindung stehen. In ähnlicher Weise sind verringerte Spiegel von HDL-C und seinem Transportkomplex Apolipoprotein A (Apo AI und Apo AII) mit der Entwicklung von Atherosklerose verbunden. Epidemiologische Untersuchungen haben festgestellt, dass die kardiovaskuläre Morbidität und Mortalität direkt mit dem Gesamt-C-, LDL-C- und TG-Spiegel und umgekehrt mit dem HDL-C-Spiegel variieren. Die unabhängige Wirkung einer Erhöhung des HDL-C oder einer Senkung der Triglyceride (TG) auf das Risiko für kardiovaskuläre Morbidität und Mortalität wurde nicht bestimmt.
Fenofibrinsäure, der aktive Metabolit von Fenofibrat, führt bei behandelten Patienten zu einer Senkung des Gesamtcholesterins, des LDL-Cholesterins, des Apolipoprotein B, der Gesamttriglyceride und des triglyceridreichen Lipoproteins (VLDL). Darüber hinaus führt die Behandlung mit Fenofibrat zu einem Anstieg des Lipoproteins hoher Dichte (HDL) und der Apolipoproteine ApoAI und ApoAII.
Pharmakokinetik
Die Plasmakonzentrationen von Fenofibrinsäure nach Gabe von drei 48-mg- oder einer 145-mg-Tablette entsprechen unter Nahrungsaufnahme einer 200-mg-Kapsel mikronisiertem Fenofibrat.
Fenofibrat ist ein Prodrug der aktiven chemischen Einheit Fenofibrinsäure. Fenofibrat wird im Körper durch Esterhydrolyse in Fenofibrinsäure umgewandelt, die der im Kreislauf messbare aktive Bestandteil ist.
Absorption
Die absolute Bioverfügbarkeit von Fenofibrat kann nicht bestimmt werden, da die Verbindung in wässrigen Medien, die zur Injektion geeignet sind, praktisch unlöslich ist. Fenofibrat wird jedoch gut aus dem Gastrointestinaltrakt resorbiert. Nach oraler Verabreichung an gesunde Freiwillige erschienen etwa 60 % einer Einzeldosis radioaktiv markierten Fenofibrats im Urin, hauptsächlich als Fenofibrinsäure und ihr Glucuronat-Konjugat, und 25 % wurden mit dem Stuhl ausgeschieden. Maximale Plasmaspiegel von Fenofibrinsäure treten innerhalb von 6 bis 8 Stunden nach der Verabreichung auf.
Die Exposition gegenüber Fenofibrinsäure im Plasma, gemessen als Cmax und AUC, unterscheidet sich nicht signifikant, wenn eine Einzeldosis von 145 mg Fenofibrat unter nüchternen oder nicht nüchternen Bedingungen verabreicht wird.
Verteilung
Nach mehrfacher Gabe von Fenofibrat wird der Steady State von Fenofibrinsäure innerhalb von 9 Tagen erreicht. Die Plasmakonzentrationen von Fenofibrinsäure im Steady State sind etwa doppelt so hoch wie nach einer Einzeldosis. Die Serumproteinbindung betrug bei normalen und hyperlipidämischen Probanden etwa 99 %.
Stoffwechsel
Nach oraler Verabreichung wird Fenofibrat schnell durch Esterasen zum aktiven Metaboliten Fenofibrinsäure hydrolysiert; im Plasma wird kein unverändertes Fenofibrat nachgewiesen.
Fenofibrinsäure wird hauptsächlich mit Glucuronsäure konjugiert und dann mit dem Urin ausgeschieden. Eine kleine Menge Fenofibrinsäure wird an der Carbonyleinheit zu einem Benzhydrol-Metaboliten reduziert, der wiederum mit Glucuronsäure konjugiert und im Urin ausgeschieden wird.
Daten zum In-vivo-Stoffwechsel weisen darauf hin, dass weder Fenofibrat noch Fenofibrinsäure einem signifikanten oxidativen Stoffwechsel (z. B. Cytochrom P450) unterliegen.
Beseitigung
Nach Resorption wird Fenofibrat hauptsächlich in Form von Metaboliten, hauptsächlich Fenofibrinsäure und Fenofibrinsäureglucuronid, im Urin ausgeschieden. Nach Verabreichung von radioaktiv markiertem Fenofibrat wurden etwa 60 % der Dosis im Urin ausgeschieden und 25 % mit dem Stuhl ausgeschieden.
Fenofibrinsäure wird mit einer Halbwertszeit von 20 Stunden eliminiert, was eine einmal tägliche Gabe ermöglicht.
Besondere Populationen
Geriatrie
Bei älteren Probanden im Alter von 77 bis 87 Jahren betrug die orale Clearance von Fenofibrinsäure nach einer oralen Einzeldosis Fenofibrat 1,2 l/h, im Vergleich zu 1,1 l/h bei jungen Erwachsenen. Dies weist darauf hin, dass ein ähnliches Dosierungsschema bei älteren Menschen mit normaler Nierenfunktion angewendet werden kann, ohne die Akkumulation des Arzneimittels oder seiner Metaboliten zu erhöhen [siehe DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrie
Die Pharmakokinetik von TRICOR 160 mg wurde bei Kindern und Jugendlichen nicht untersucht.
Geschlecht
Für Fenofibrat wurde kein pharmakokinetischer Unterschied zwischen Männern und Frauen beobachtet.
Wettrennen
Der Einfluss der ethnischen Zugehörigkeit auf die Pharmakokinetik von Fenofibrat wurde nicht untersucht, jedoch wird Fenofibrat nicht durch Enzyme metabolisiert, die für ihre interethnische Variabilität bekannt sind.
Nierenfunktionsstörung
Die Pharmakokinetik von Fenofibrinsäure wurde bei Patienten mit leichter, mäßiger und schwerer Nierenfunktionsstörung untersucht. Patienten mit schwerer Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate [eGFR] DOSIERUNG UND ANWENDUNG ].
Leberfunktionsstörung
Bei Patienten mit eingeschränkter Leberfunktion wurden keine pharmakokinetischen Studien durchgeführt.
Arzneimittelwechselwirkungen
In-vitro-Studien mit menschlichen Lebermikrosomen weisen darauf hin, dass Fenofibrat und Fenofibrinsäure keine Inhibitoren der Cytochrom (CYP) P450-Isoformen CYP3A4, CYP2D6, CYP2E1 oder CYP1A2 sind. Sie sind schwache Inhibitoren von CYP2C8, CYP2C19 und CYP2A6 und leichte bis mäßige Inhibitoren von CYP2C9 in therapeutischen Konzentrationen.
Tabelle 2 beschreibt die Wirkungen von gleichzeitig verabreichten Arzneimitteln auf die systemische Exposition von Fenofibrinsäure. Tabelle 3 beschreibt die Wirkungen von gleichzeitig verabreichtem Fenofibrat oder Fenofibrinsäure auf andere Arzneimittel.
Klinische Studien
Primäre Hypercholesterinämie (heterozygot familiär und nicht familiär) und gemischte Dyslipidämie
Die Wirkungen von Fenofibrat in einer Tagesdosis von 145 mg TRICOR (Fenofibrat-Tabletten) wurden in vier randomisierten, placebokontrollierten, doppelblinden Studien mit parallelen Gruppen untersucht, an denen Patienten mit den folgenden mittleren Ausgangs-Lipidwerten teilnahmen: Gesamt-C 306,9 mg/dl; LDL-C 213,8 mg/dl; HDL-C 52,3 mg/dl; und Triglyceride 191,0 mg/dL. Die TRICOR 200 mg-Therapie senkte LDL-C, Gesamt-C und das LDL-C/HDL-C-Verhältnis. Die TRICOR-Therapie senkte auch Triglyceride und erhöhte HDL-C (siehe Tabelle 4).
Bei einer Untergruppe der Probanden wurden Messungen von Apo B durchgeführt. Die Behandlung mit TRICOR 200 mg reduzierte Apo B signifikant vom Ausgangswert bis zum Endpunkt im Vergleich zu Placebo (-25,1 % vs. 2,4 %, p
Schwere Hypertriglyzeridämie
Die Wirkungen von Fenofibrat auf die Serumtriglyceride wurden in zwei randomisierten, doppelblinden, placebokontrollierten klinischen Studien mit 147 Patienten mit Hypertriglyceridämie untersucht. Die Patienten wurden acht Wochen lang nach Protokollen behandelt, die sich nur darin unterschieden, dass eines Patienten mit TG-Ausgangswerten von 500 bis 1500 mg/dL und das andere TG-Werte von 350 bis 500 mg/dL aufwies. Bei Patienten mit Hypertriglyzeridämie und normaler Cholesterinämie mit oder ohne Hyperchylomikronämie senkte die Behandlung mit Fenofibrat in Dosierungen, die 145 mg TRICOR pro Tag entsprachen, hauptsächlich die Triglyceride der Lipoproteine sehr niedriger Dichte (VLDL) und das VLDL-Cholesterin. Die Behandlung von Patienten mit erhöhten Triglyceriden führt oft zu einem Anstieg von LDL-C (siehe Tabelle 5).
Die Wirkung von TRICOR 160 mg auf die kardiovaskuläre Morbidität und Mortalität wurde nicht bestimmt.
INFORMATIONEN ZUM PATIENTEN
Patienten sollten beraten werden: