Zetia 10mg Ezetimibe Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zetia und wie wird es angewendet?
Zetia ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome eines hohen Cholesterinspiegels und zur Senkung des Cholesterinspiegels. Zetia kann allein oder mit anderen Medikamenten verwendet werden.
Zetia gehört zu einer Klasse von Arzneimitteln, die Lipidsenker, 2-Azetidinone, genannt werden.
Es ist nicht bekannt, ob Zetia 10 mg bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Zetia haben?
Zetia kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zetia 10 mg gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zetia. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
ZETIA (Ezetimib) gehört zu einer Klasse von lipidsenkenden Verbindungen, die selektiv die intestinale Resorption von Cholesterin und verwandten Phytosterolen hemmen. Der chemische Name von Ezetimib lautet 1-(4-Fluorphenyl)-3(R)-[3-(4-Fluorphenyl)-3(S)-Hydroxypropyl]-4(S)-(4-Hydroxyphenyl)-2-Azetidinon . Die Summenformel lautet C24H21F2NO3. Sein Molekulargewicht beträgt 409,4 und seine Strukturformel lautet:
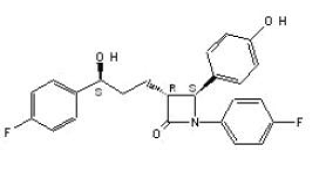
Ezetimib ist ein weißes, kristallines Pulver, das in Ethanol, Methanol und Aceton leicht bis sehr gut löslich und in Wasser praktisch unlöslich ist. Ezetimib hat einen Schmelzpunkt von etwa 163 °C und ist bei Umgebungstemperatur stabil. ZETIA 10 mg ist als Tablette zur oralen Verabreichung mit 10 mg Ezetimib und den folgenden Hilfsstoffen erhältlich: Croscarmellose-Natrium NF, Lactose-Monohydrat NF, Magnesiumstearat NF, mikrokristalline Cellulose NF, Povidon USP und Natriumlaurylsulfat NF.
INDIKATIONEN
Die Therapie mit lipidverändernden Wirkstoffen sollte nur ein Bestandteil einer Intervention mit mehreren Risikofaktoren bei Personen mit einem signifikant erhöhten Risiko für atherosklerotische Gefäßerkrankungen aufgrund von Hypercholesterinämie sein. Eine medikamentöse Therapie ist zusätzlich zur Diät indiziert, wenn das Ansprechen auf eine auf gesättigte Fettsäuren und Cholesterin beschränkte Diät und andere nicht-pharmakologische Maßnahmen allein unzureichend war.
Primäre Hyperlipidämie
Monotherapie
ZETIA®, allein verabreicht, ist als Zusatztherapie zu einer Diät zur Senkung von erhöhtem Gesamtcholesterin (Gesamt-C), Low-Density-Lipoprotein-Cholesterin (LDL-C), Apolipoprotein B (Apo B) und Non-High-Density-Lipoprotein-Cholesterin indiziert (Nicht-HDL-C) bei Patienten mit primärer (heterozygoter familiärer und nicht-familiärer) Hyperlipidämie.
Kombinationstherapie mit HMG-CoA-Reduktase-Hemmern (Statinen)
ZETIA 10 mg, verabreicht in Kombination mit einem 3-Hydroxy-3-methylglutaryl-Coenzym A (HMG-CoA)-Reduktase-Hemmer (Statin), ist als Begleittherapie zu einer Diät zur Senkung erhöhter Gesamt-C, LDL-C, Apo angezeigt B und nicht-HDL-C bei Patienten mit primärer (heterozygoter familiärer und nicht-familiärer) Hyperlipidämie.
Kombinationstherapie mit Fenofibrat
ZETIA 10 mg, verabreicht in Kombination mit Fenofibrat, ist als Zusatztherapie zu einer Diät zur Senkung erhöhter Gesamt-C-, LDL-C-, Apo B- und Non-HDL-C-Werte bei erwachsenen Patienten mit gemischter Hyperlipidämie indiziert.
Homozygote Familiäre Hypercholesterinämie (HoFH)
Die Kombination von ZETIA 10 mg und Atorvastatin oder Simvastatin ist indiziert zur Senkung erhöhter Gesamt-C- und LDL-C-Spiegel bei Patienten mit HoFH, als Ergänzung zu anderen lipidsenkenden Behandlungen (z. B. LDL-Apherese) oder wenn solche Behandlungen nicht verfügbar sind .
Homozygote Sitosterolämie
ZETIA 10 mg ist als Zusatztherapie zu einer Diät zur Senkung erhöhter Sitosterol- und Campesterolspiegel bei Patienten mit homozygoter familiärer Sitosterolämie indiziert.
Nutzungsbeschränkungen
Die Wirkung von ZETIA auf die kardiovaskuläre Morbidität und Mortalität wurde nicht bestimmt.
ZETIA wurde bei Dyslipidämien vom Fredrickson-Typ I, III, IV und V nicht untersucht.
DOSIERUNG UND ANWENDUNG
Allgemeine Dosierungsinformationen
Die empfohlene Dosis von ZETIA beträgt 10 mg einmal täglich.
ZETIA 10 mg kann mit oder ohne Nahrung verabreicht werden.
Begleitende lipidsenkende Therapie
ZETIA 10 mg kann mit einem Statin (bei Patienten mit primärer Hyperlipidämie) oder mit Fenofibrat (bei Patienten mit gemischter Hyperlipidämie) für eine inkrementelle Wirkung verabreicht werden. Der Einfachheit halber kann die Tagesdosis von ZETIA gemäß den Dosierungsempfehlungen für die jeweiligen Medikamente gleichzeitig mit dem Statin oder Fenofibrat eingenommen werden.
Coadminis mit Gallensäure-Sequestranten
Die Dosierung von ZETIA sollte entweder ≥ 2 Stunden vor oder ≥ 4 Stunden nach der Verabreichung eines Gallensäure-Sequestriermittels erfolgen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ]. Bei gleichzeitiger Gabe von Simvastatin bei Patienten mit mittelschwerer bis schwerer Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate Verwendung in bestimmten Populationen ].
Geriatrische Patienten
Bei geriatrischen Patienten ist keine Dosisanpassung erforderlich [siehe KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
10-mg-Tabletten sind weiße bis cremefarbene, kapselförmige Tabletten mit der Prägung „414“ auf einer Seite.
Lagerung und Handhabung
Nr. 3861 - Tabletten ZETIA, 10 mg , sind weiße bis cremefarbene, kapselförmige Tabletten mit der Prägung „414“ auf einer Seite. Sie werden wie folgt geliefert:
NDC 66582-414-31 Flaschen zu 30 NDC 66582-414-54 Flaschen zu 90 NDC 66582-414-74 Flaschen zu 500 NDC 66582-414-76 Flaschen zu 5000 NDC 66582-414-28 Einzeldosispackungen mit 100 Stück.
Lagerung
Bei 25 °C (77 °F) lagern; Ausflüge erlaubt bis 15-30°C (59-86°F). [Sehen USP kontrollierte Raumtemperatur .] Vor Feuchtigkeit schützen.
Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: August 2013
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher besprochen:
Monotherapie-Studien
In der Datenbank für kontrollierte klinische Studien zu ZETIA 10 mg (placebokontrolliert) mit 2396 Patienten mit einer medianen Behandlungsdauer von 12 Wochen (Bereich 0 bis 39 Wochen) brachen 3,3 % der Patienten unter ZETIA 10 mg und 2,9 % der Patienten unter Placebo die Behandlung aufgrund von Nebenwirkungen ab Reaktionen. Die häufigsten Nebenwirkungen in der mit ZETIA 10 mg behandelten Patientengruppe, die zu einem Behandlungsabbruch führten und häufiger auftraten als Placebo, waren:
Die am häufigsten berichteten Nebenwirkungen (Inzidenz ≥ 2 % und mehr als Placebo) in der ZETIA-Datenbank für kontrollierte klinische Studien zur Monotherapie mit 2396 Patienten waren: Infektion der oberen Atemwege (4,3 %), Durchfall (4,1 %), Arthralgie (3,0 %), Sinusitis (2,8 %) und Schmerzen in den Extremitäten (2,7 %).
Studien zur Koadministration von Statinen
In der Datenbank für kontrollierte klinische Studien mit ZETIA + Statin von 11.308 Patienten mit einer medianen Behandlungsdauer von 8 Wochen (Bereich 0 bis 112 Wochen) brachen 4,0 % der Patienten unter ZETIA + Statin und 3,3 % der Patienten unter Statin allein die Behandlung aufgrund von Nebenwirkungen ab. Die häufigsten Nebenwirkungen in der mit ZETIA + Statin behandelten Patientengruppe, die zu einem Behandlungsabbruch führten und häufiger auftraten als bei Statin allein, waren:
Die am häufigsten gemeldeten Nebenwirkungen (Inzidenz ≥2 % und mehr als bei Statin allein) in der ZETIA + Statin-kontrollierten klinischen Studiendatenbank mit 11.308 Patienten waren: Nasopharyngitis (3,7 %), Myalgie (3,2 %), Infektion der oberen Atemwege (2,9 % ), Arthralgie (2,6 %) und Durchfall (2,5 %).
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Monotherapie
In 10 doppelblinden, placebokontrollierten klinischen Studien wurden 2396 Patienten mit primärer Hyperlipidämie (Altersspanne 9-86 Jahre, 50 % Frauen, 90 % Kaukasier, 5 % Schwarze, 3 % Hispanics, 2 % Asiaten) und erhöhtem LDL-C untersucht wurden mit ZETIA 10 mg/Tag über eine mediane Behandlungsdauer von 12 Wochen (Bereich 0 bis 39 Wochen) behandelt.
Die Nebenwirkungen, die in placebokontrollierten Studien mit ZETIA 10 mg bei ≥ 2 % der mit ZETIA behandelten Patienten und mit einer höheren Inzidenz als Placebo berichtet wurden, sind unabhängig von der Bewertung der Kausalität in Tabelle 1 aufgeführt.
TABELLE 1: Klinische Nebenwirkungen, die bei ≥ 2 % der mit ZETIA 10 mg behandelten Patienten und mit einer höheren Inzidenz als Placebo auftraten, unabhängig von der Kausalität
Die Häufigkeit weniger häufiger Nebenwirkungen war zwischen ZETIA 10 mg und Placebo vergleichbar.
Kombination mit einem Statin
In 28 doppelblinden, kontrollierten (Placebo- oder aktiv kontrollierten) klinischen Studien wurden 11.308 Patienten mit primärer Hyperlipidämie (Altersspanne 10–93 Jahre, 48 % Frauen, 85 % Kaukasier, 7 % Schwarze, 4 % Hispanics, 3 % Asiaten) und erhöhtes LDL-C wurden mit ZETIA 10 mg/Tag gleichzeitig mit oder zusätzlich zu einer laufenden Statintherapie für eine mediane Behandlungsdauer von 8 Wochen (Bereich 0 bis 112 Wochen) behandelt.
Die Inzidenz konsekutiv erhöhter Transaminasen (≥ 3 × ULN) war bei Patienten, die ZETIA 10 mg zusammen mit Statinen erhielten, höher (1,3 %) als bei Patienten, die nur mit Statinen behandelt wurden (0,4 %). [Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Klinische Nebenwirkungen, die bei ≥ 2 % der mit ZETIA + Statin behandelten Patienten und mit einer höheren Inzidenz als bei Statin berichtet wurden, sind unabhängig von der Bewertung der Kausalität in Tabelle 2 aufgeführt.
TABELLE 2: Klinische Nebenwirkungen, die bei ≥ 2 % der Patienten auftraten, die mit ZETIA 10 mg zusammen mit einem Statin und mit einer höheren Inzidenz als Statin behandelt wurden, unabhängig von der Kausalität
Kombination mit Fenofibrat
Diese klinische Studie umfasste 625 Patienten mit gemischter Dyslipidämie (Altersgruppe 20–76 Jahre, 44 % Frauen, 79 % Kaukasier, 0,1 % Schwarze, 11 % Hispanoamerikaner, 5 % Asiaten), die bis zu 12 Wochen und 576 Patienten bis zu behandelt wurden weitere 48 Wochen untersuchten die gleichzeitige Verabreichung von ZETIA und Fenofibrat. Diese Studie war nicht darauf ausgelegt, Behandlungsgruppen für seltene Ereignisse zu vergleichen. Die Inzidenzraten (95 %-KI) für klinisch relevante Erhöhungen (≥ 3 – ULN, konsekutiv) der hepatischen Transaminasenwerte betrugen 4,5 % (1,9; 8,8) und 2,7 % (1,2; 5,4) für die Fenofibrat-Monotherapie (n = 188) und die gleichzeitige Gabe von ZETIA mit Fenofibrat (n = 183), adjustiert für die Behandlungsexposition. Die entsprechenden Inzidenzraten für Cholezystektomie waren 0,6 % (95 % KI: 0,0 %, 3,1 %) und 1,7 % (95 % KI: 0,6 %, 4,0 %) für Fenofibrat-Monotherapie bzw. ZETIA 10 mg zusammen mit Fenofibrat [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Die Anzahl der Patienten, die einer Koadministrationstherapie sowie einer Monotherapie mit Fenofibrat und Ezetimib ausgesetzt waren, reichte nicht aus, um das Risiko einer Gallenblasenerkrankung einzuschätzen. In keiner der Behandlungsgruppen gab es CPK-Erhöhungen > 10 – ULN.
Post-Marketing-Erfahrung
Da die nachstehenden Reaktionen freiwillig aus einer Bevölkerungsgruppe unbekannter Größe gemeldet wurden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Die folgenden zusätzlichen Nebenwirkungen wurden während der Anwendung von ZETIA nach der Zulassung festgestellt:
Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie, Angioödem, Hautausschlag und Urtikaria; Erythema multiforme; Arthralgie; Myalgie; erhöhte Kreatinphosphokinase; Myopathie/Rhabdomyolyse [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]; Erhöhungen der Lebertransaminasen; Hepatitis; Bauchschmerzen; Thrombozytopenie; Pankreatitis; Brechreiz; Schwindel; Parästhesien; Depression; Kopfschmerzen; Cholelithiasis; Cholezystitis.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
[Sehen KLINISCHE PHARMAKOLOGIE ]
Cyclosporin
Bei gleichzeitiger Anwendung von ZETIA 10 mg und Ciclosporin ist aufgrund der erhöhten Exposition gegenüber Ezetimib und Ciclosporin Vorsicht geboten. Bei Patienten, die ZETIA und Cyclosporin erhalten, sollten die Cyclosporin-Konzentrationen überwacht werden.
Der Grad des Anstiegs der Ezetimib-Exposition kann bei Patienten mit schwerer Niereninsuffizienz größer sein. Bei Patienten, die mit Ciclosporin behandelt werden, sollten die potenziellen Auswirkungen einer erhöhten Ezetimib-Exposition bei gleichzeitiger Anwendung sorgfältig gegen die Vorteile von Veränderungen der Lipidspiegel durch Ezetimib abgewogen werden.
Fibrate
Die Wirksamkeit und Sicherheit der gleichzeitigen Anwendung von Ezetimib mit anderen Fibraten als Fenofibrat wurde nicht untersucht.
Fibrate können die Cholesterinausscheidung in die Galle erhöhen und zu Cholelithiasis führen. In einer präklinischen Studie an Hunden erhöhte Ezetimib den Cholesterinspiegel in der Gallenblase [siehe Nichtklinische Toxikologie ]. Die gleichzeitige Verabreichung von ZETIA mit anderen Fibraten als Fenofibrat wird nicht empfohlen, bis die Anwendung bei Patienten ausreichend untersucht wurde.
Fenofibrat
Wenn bei einem Patienten, der ZETIA 10 mg und Fenofibrat erhält, der Verdacht auf Cholelithiasis besteht, sind Studien zur Gallenblase angezeigt und eine alternative lipidsenkende Therapie sollte in Erwägung gezogen werden [siehe NEBENWIRKUNGEN und die Produktkennzeichnung für Fenofibrat].
Cholestyramin
Die gleichzeitige Gabe von Cholestyramin verringerte die mittlere Fläche unter der Kurve (AUC) von Gesamt-Ezetimib um etwa 55 %. Die inkrementelle Senkung des LDL-Cholesterinspiegels aufgrund der Zugabe von Ezetimib zu Cholestyramin kann durch diese Wechselwirkung verringert werden.
Cumarin-Antikoagulanzien
Wenn Ezetimib zu Warfarin, einem Cumarin-Antikoagulans, hinzugefügt wird, sollte die International Normalized Ratio (INR) angemessen überwacht werden.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Verwendung mit Statinen oder Fenofibrat
Die gleichzeitige Verabreichung von ZETIA mit einem bestimmten Statin oder Fenofibrat sollte in Übereinstimmung mit der Produktkennzeichnung für dieses Medikament erfolgen.
Leberenzyme
In kontrollierten klinischen Studien zur Monotherapie war die Inzidenz aufeinanderfolgender Erhöhungen (≥ 3 x die Obergrenze des Normalwerts [ULN]) der hepatischen Transaminasespiegel zwischen ZETIA (0,5 %) und Placebo (0,3 %) ähnlich.
In kontrollierten klinischen Kombinationsstudien mit ZETIA 10 mg, die gleichzeitig mit einem Statin begonnen wurden, betrug die Inzidenz aufeinanderfolgender Erhöhungen (≥ 3 x ULN) der hepatischen Transaminasenspiegel 1,3 % bei Patienten, die mit ZETIA in Kombination mit Statinen behandelt wurden, und 0,4 % bei Patienten, die nur mit Statinen behandelt wurden. Diese Erhöhungen der Transaminasen waren im Allgemeinen asymptomatisch, nicht mit Cholestase verbunden und kehrten nach Absetzen der Therapie oder bei Fortführung der Behandlung auf den Ausgangswert zurück. Wenn ZETIA zusammen mit einem Statin verabreicht wird, sollten zu Beginn der Therapie und gemäß den Empfehlungen des Statins Lebertests durchgeführt werden. Sollte ein Anstieg von ALT oder AST auf ≥ 3 x ULN bestehen bleiben, ziehen Sie das Absetzen von ZETIA 10 mg und/oder dem Statin in Betracht.
Myopathie/Rhabdomyolyse
In klinischen Studien wurde im Vergleich zum relevanten Kontrollarm (Placebo oder Statin allein) kein Übermaß an Myopathie oder Rhabdomyolyse im Zusammenhang mit ZETIA 10 mg festgestellt. Myopathie und Rhabdomyolyse sind jedoch bekannte Nebenwirkungen von Statinen und anderen lipidsenkenden Arzneimitteln. In klinischen Studien betrug die Inzidenz von Kreatinphosphokinase (CPK) > 10 x ULN 0,2 % für ZETIA vs. 0,1 % für Placebo und 0,1 % für ZETIA zusammen mit einem Statin vs. 0,4 % für Statine allein. Das Risiko einer Skelettmuskeltoxizität steigt mit höheren Statindosen, fortgeschrittenem Alter (> 65), Hypothyreose, eingeschränkter Nierenfunktion und je nach verwendetem Statin bei gleichzeitiger Anwendung anderer Arzneimittel.
Aus Erfahrungen nach Markteinführung mit ZETIA wurden Fälle von Myopathie und Rhabdomyolyse berichtet. Die meisten Patienten, die eine Rhabdomyolyse entwickelten, nahmen vor Beginn der Behandlung mit ZETIA ein Statin ein. Es wurde jedoch über Rhabdomyolyse bei der Monotherapie mit ZETIA 10 mg und bei der Zugabe von ZETIA 10 mg zu Wirkstoffen berichtet, die bekanntermaßen mit einem erhöhten Rhabdomyolyse-Risiko verbunden sind, wie z. B. Fibrate. ZETIA und jedes Statin oder Fibrat, das der Patient gleichzeitig einnimmt, sollte sofort abgesetzt werden, wenn eine Myopathie diagnostiziert oder vermutet wird. Das Vorhandensein von Muskelsymptomen und ein CPK-Wert > 10 x ULN weist auf eine Myopathie hin.
Leberfunktionsstörung
Aufgrund der unbekannten Auswirkungen einer erhöhten Ezetimib-Exposition bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung wird ZETIA bei diesen Patienten nicht empfohlen. [Sehen KLINISCHE PHARMAKOLOGIE ]
Informationen zur Patientenberatung
Sehen FDA-zugelassene Patientenkennzeichnung (PATIENTENINFORMATION).
Den Patienten sollte geraten werden, sich an die vom National Cholesterol Education Program (NCEP) empfohlene Diät, ein regelmäßiges Trainingsprogramm und regelmäßige Tests eines Nüchtern-Lipid-Panels zu halten.
Muskelschmerzen
Alle Patienten, die eine Therapie mit Ezetimib beginnen, sollten auf das Risiko einer Myopathie hingewiesen und aufgefordert werden, ungeklärte Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden. Das Risiko dafür ist erhöht, wenn bestimmte Arten von Medikamenten eingenommen werden. Patienten sollten alle Medikamente, sowohl verschreibungspflichtige als auch rezeptfreie, mit ihrem Arzt besprechen.
Leberenzyme
Lebertests sollten durchgeführt werden, wenn ZETIA 10 mg zu einer Statintherapie hinzugefügt wird, und gemäß den Statinempfehlungen.
Schwangerschaft
Frauen im gebärfähigen Alter sollte geraten werden, eine wirksame Methode der Empfängnisverhütung anzuwenden, um eine Schwangerschaft zu verhindern, während sie ZETIA zusätzlich zu einer Statintherapie anwenden. Besprechen Sie zukünftige Schwangerschaftspläne mit Ihren Patientinnen und besprechen Sie, wann die Kombinationstherapie mit ZETIA 10 mg und Statinen beendet werden sollte, wenn sie versuchen, schwanger zu werden. Patientinnen sollten darauf hingewiesen werden, dass sie im Falle einer Schwangerschaft die Kombinationstherapie mit ZETIA 10 mg und Statinen abbrechen und ihren Arzt verständigen sollten.
Stillen
Stillenden Frauen sollte geraten werden, ZETIA nicht zusätzlich zu einer Statintherapie anzuwenden. Patientinnen, die an einer Lipidstörung leiden und stillen, sollte geraten werden, die Optionen mit ihrem medizinischen Fachpersonal zu besprechen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Eine 104-wöchige Kanzerogenitätsstudie mit Ezetimib in der Nahrung wurde an Ratten in Dosen von bis zu 1500 mg/kg/Tag (Männer) und 500 mg/kg/Tag (Weibchen) durchgeführt (~20-fache Exposition beim Menschen bei 10 mg täglich, basierend auf der AUC0 -24 Std. für Gesamt-Ezetimib). Eine 104-wöchige Kanzerogenitätsstudie mit Ezetimib in der Nahrung wurde auch an Mäusen in Dosen von bis zu 500 mg/kg/Tag durchgeführt (> 150-fache Exposition beim Menschen bei 10 mg täglich, basierend auf AUC0-24h für Gesamt-Ezetimib). Bei mit Arzneimittel behandelten Ratten oder Mäusen gab es keine statistisch signifikanten Erhöhungen der Tumorinzidenzen.
In einem mikrobiellen Mutagenitätstest (Ames) mit Salmonella typhimurium und Escherichia coli mit oder ohne metabolischer Aktivierung wurden in vitro keine Hinweise auf Mutagenität beobachtet. In einem Chromosomenaberrationsassay in humanen peripheren Blutlymphozyten mit oder ohne metabolischer Aktivierung wurden in vitro keine Hinweise auf Klastogenität beobachtet. Darüber hinaus gab es im In-vivo-Maus-Mikrokerntest keine Hinweise auf Genotoxizität.
In oralen Fertilitätsstudien (Schlundsonde) mit Ezetimib, die an Ratten durchgeführt wurden, gab es keine Hinweise auf Reproduktionstoxizität bei Dosen von bis zu 1000 mg/kg/Tag bei männlichen oder weiblichen Ratten (ca. 24 Stunden für Gesamt-Ezetimib).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Es liegen keine adäquaten und gut kontrollierten Studien zu Ezetimib bei Schwangeren vor. Ezetimib sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das Risiko für den Fötus rechtfertigt.
In oralen (Schlundsonde) Studien zur embryofetalen Entwicklung von Ezetimib, die an Ratten und Kaninchen während der Organogenese durchgeführt wurden, gab es keine Hinweise auf embryoletale Wirkungen bei den getesteten Dosen (250, 500, 1000 mg/kg/Tag). Bei Ratten wurde bei einer Dosis von 1000 mg/kg/Tag (ca. das 10-fache der Exposition beim Menschen bei 10 mg täglich, basierend auf der AUC0-24h) eine erhöhte Inzidenz häufiger fötaler Skelettbefunde (zusätzliches Brustrippenpaar, unverknöcherte Halswirbelkörper, verkürzte Rippen) beobachtet für Gesamt-Ezetimib). Bei Kaninchen, die mit Ezetimib behandelt wurden, wurde bei einer Dosis von 1000 mg/kg/Tag (dem 150-fachen der menschlichen Exposition bei 10 mg täglich, basierend auf der AUC0-24h für Gesamt-Ezetimib) eine erhöhte Inzidenz extrathorakaler Rippen beobachtet. Ezetimib passierte die Plazentaschranke, wenn trächtige Ratten und Kaninchen mehrere orale Dosen erhielten.
Studien mit Mehrfachgabe von Ezetimib in Kombination mit Statinen bei Ratten und Kaninchen während der Organogenese führten zu höheren Ezetimib- und Statin-Expositionen. Reproduktionsbefunde treten bei niedrigeren Dosen in der Kombinationstherapie im Vergleich zur Monotherapie auf.
Alle Statine sind bei schwangeren und stillenden Frauen kontraindiziert. Wenn ZETIA 10 mg zusammen mit einem Statin bei einer Frau im gebärfähigen Alter angewendet wird, beachten Sie die Schwangerschaftskategorie und die Produktkennzeichnung für das Statin. [Siehe KONTRAINDIKATIONEN]
Stillende Mutter
Es ist nicht bekannt, ob Ezetimib in die Muttermilch übergeht. In Studien an Ratten betrug die Gesamt-Ezetimib-Exposition bei säugenden Welpen bis zu der Hälfte derjenigen, die im mütterlichen Plasma beobachtet wurde. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn ZETIA 10 mg einer stillenden Frau verabreicht wird. ZETIA sollte nicht bei stillenden Müttern angewendet werden, es sei denn, der potentielle Nutzen rechtfertigt das potentielle Risiko für den Säugling.
Pädiatrische Verwendung
Die Wirkungen von ZETIA zusammen mit Simvastatin (n = 126) im Vergleich zu einer Simvastatin-Monotherapie (n = 122) wurden bei heranwachsenden Jungen und Mädchen mit heterozygoter familiärer Hypercholesterinämie (HeFH) untersucht. In einer multizentrischen, doppelblinden, kontrollierten Studie, gefolgt von einer offenen Phase, wurden 142 Jungen und 106 postmenarchale Mädchen im Alter von 10 bis 17 Jahren (Durchschnittsalter 14,2 Jahre, 43 % Frauen, 82 % Kaukasier, 4 % Asiaten, 2 % Schwarze , 13 % gemischtrassig) mit HeFH wurden randomisiert, um entweder ZETIA 10 mg zusammen mit Simvastatin oder eine Simvastatin-Monotherapie zu erhalten. Die Aufnahme in die Studie erforderte 1) einen LDL-C-Ausgangswert zwischen 160 und 400 mg/dL und 2) eine Anamnese und ein klinisches Erscheinungsbild, die mit HeFH übereinstimmen. Der mittlere LDL-C-Ausgangswert betrug 225 mg/dl (Bereich: 161–351 mg/dl) in der Gruppe mit ZETIA 10 mg zusammen mit Simvastatin, verglichen mit 219 mg/dl (Bereich: 149–336 mg/dl) in der Simvastatin-Monotherapie Gruppe. Die Patienten erhielten 6 Wochen lang gleichzeitig ZETIA und Simvastatin (10 mg, 20 mg oder 40 mg) oder Simvastatin-Monotherapie (10 mg, 20 mg oder 40 mg), gleichzeitig ZETIA und 40 mg Simvastatin oder 40 mg Simvastatin-Monotherapie in den nächsten 27 Wochen und unverblindeter gleichzeitiger Verabreichung von ZETIA und Simvastatin (10 mg, 20 mg oder 40 mg) für 20 Wochen danach.
Die Ergebnisse der Studie in Woche 6 sind in Tabelle 3 zusammengefasst. Die Ergebnisse in Woche 33 stimmten mit denen in Woche 6 überein.
TABELLE 3: Mittlerer prozentualer Unterschied in Woche 6 zwischen der Gruppe mit gepooltem ZETIA 10 mg zusammen mit Simvastatin und der Gruppe mit gepoolter Simvastatin-Monotherapie bei jugendlichen Patienten mit heterozygoter familiärer Hypercholesterinämie
Vom Beginn der Studie bis zum Ende von Woche 33 kam es bei 7 (6 %) Patienten in der Gruppe mit ZETIA zusammen mit Simvastatin und bei 2 (2 %) Patienten in der Gruppe mit Simvastatin-Monotherapie zu Behandlungsabbrüchen aufgrund einer Nebenwirkung.
Während der Studie traten Lebertransaminasenerhöhungen (zwei aufeinanderfolgende Messungen für ALT und/oder AST ≥ 3 x ULN) bei vier (3 %) Personen in der Gruppe mit ZETIA 10 mg zusammen mit Simvastatin und bei zwei (2 %) Personen in der Simvastatin-Monotherapie auf Gruppe. Erhöhungen der CPK (≥ 10 x ULN) traten bei zwei (2 %) Personen in der Gruppe mit ZETIA zusammen mit Simvastatin und bei null Personen in der Gruppe mit Simvastatin-Monotherapie auf.
In dieser begrenzt kontrollierten Studie gab es keine signifikante Wirkung auf das Wachstum oder die sexuelle Reifung bei heranwachsenden Jungen oder Mädchen oder auf die Länge des Menstruationszyklus bei Mädchen.
Die gleichzeitige Anwendung von ZETIA 10 mg mit Simvastatin in Dosen von mehr als 40 mg/Tag wurde bei Jugendlichen nicht untersucht. Außerdem wurde ZETIA 10 mg nicht bei Patienten unter 10 Jahren oder bei prämenarchalen Mädchen untersucht.
Basierend auf Gesamt-Ezetimib (Ezetimib + Ezetimib-Glucuronid) gibt es keine pharmakokinetischen Unterschiede zwischen Jugendlichen und Erwachsenen. Pharmakokinetische Daten in der pädiatrischen Population
Geriatrische Verwendung
Monotherapie-Studien
Von den 2396 Patienten, die ZETIA 10 mg in klinischen Studien erhielten, waren 669 (28 %) 65 Jahre und älter und 111 (5 %) 75 Jahre und älter.
Studien zur Koadministration von Statinen
Von den 11.308 Patienten, die ZETIA + Statin in klinischen Studien erhielten, waren 3587 (32 %) 65 Jahre und älter und 924 (8 %) 75 Jahre und älter.
Insgesamt wurden keine Unterschiede in der Sicherheit und Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden [siehe KLINISCHE PHARMAKOLOGIE ].
Nierenfunktionsstörung
Bei Anwendung als Monotherapie ist keine Dosisanpassung von ZETIA 10 mg erforderlich.
In der Study of Heart and Renal Protection (SHARP)-Studie mit 9270 Patienten mit mäßiger bis schwerer Nierenfunktionsstörung (6247 Nicht-Dialysepatienten mit einem medianen Serumkreatinin von 2,5 mg/dl und einer medianen geschätzten glomerulären Filtrationsrate von 25,6 ml/min/1,73 m² und 3023 Dialysepatienten) war die Inzidenz schwerwiegender unerwünschter Ereignisse, unerwünschter Ereignisse, die zum Abbruch der Studienbehandlung führten, oder unerwünschter Ereignisse von besonderem Interesse (unerwünschte Ereignisse des Bewegungsapparats, Leberenzymanomalien, Zwischenfälle von Krebs) bei Patienten, denen jemals Ezetimib 10 mg plus verabreicht wurde, ähnlich Simvastatin 20 mg (n = 4650) oder Placebo (n = 4620) während einer mittleren Nachbeobachtungszeit von 4,9 Jahren. Da jedoch eine Nierenfunktionsstörung ein Risikofaktor für eine Statin-assoziierte Myopathie ist, sollten Simvastatin-Dosen von mehr als 20 mg mit Vorsicht und engmaschiger Überwachung angewendet werden, wenn sie gleichzeitig mit ZETIA bei Patienten mit mittelschwerer bis schwerer Nierenfunktionsstörung verabreicht werden.
Leberfunktionsstörung
ZETIA wird bei Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Die gleichzeitige Gabe von ZETIA 10 mg mit einem Statin ist kontraindiziert bei Patienten mit aktiver Lebererkrankung oder ungeklärter anhaltender Erhöhung der hepatischen Transaminasenwerte [siehe KONTRAINDIKATIONEN ; WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
In klinischen Studien Verabreichung von Ezetimib, 50 mg/Tag an 15 gesunde Probanden für bis zu 14 Tage, 40 mg/Tag an 18 Patienten mit primärer Hyperlipidämie für bis zu 56 Tage und 40 mg/Tag an 27 Patienten mit homozygoter Sitosterolämie 26 Wochen wurde im Allgemeinen gut vertragen. Eine Patientin mit homozygoter Sitosterolämie nahm 28 Tage lang versehentlich eine Überdosis von 120 mg Ezetimib pro Tag ein, ohne dass klinische oder Labor-Nebenwirkungen berichtet wurden.
Im Falle einer Überdosierung sollten symptomatische und unterstützende Maßnahmen ergriffen werden.
KONTRAINDIKATIONEN
ZETIA ist unter folgenden Bedingungen kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Ezetimib senkt den Cholesterinspiegel im Blut, indem es die Aufnahme von Cholesterin durch den Dünndarm hemmt. In einer 2-wöchigen klinischen Studie mit 18 Patienten mit Hypercholesterinämie hemmte ZETIA 10 mg die intestinale Cholesterinresorption im Vergleich zu Placebo um 54 %. ZETIA hatte keine klinisch bedeutsame Wirkung auf die Plasmakonzentrationen der fettlöslichen Vitamine A, D und E (in einer Studie mit 113 Patienten) und beeinträchtigte nicht die Nebennierenrinden-Steroidhormonproduktion (in einer Studie mit 118 Patienten).
Der Cholesteringehalt der Leber stammt überwiegend aus drei Quellen. Die Leber kann Cholesterin synthetisieren, Cholesterin aus dem Blut aus zirkulierenden Lipoproteinen aufnehmen oder vom Dünndarm absorbiertes Cholesterin aufnehmen. Darmcholesterin stammt hauptsächlich aus Cholesterin, das in die Galle ausgeschieden wird, und aus Nahrungscholesterin.
Ezetimib hat einen anderen Wirkmechanismus als andere Klassen cholesterinsenkender Verbindungen (Statine, Gallensäure-Sequestriermittel [Harze], Fibrinsäurederivate und Pflanzenstanole). Das molekulare Ziel von Ezetimib ist der Steroltransporter Niemann-Pick C1-Like 1 (NPC1L1), der an der intestinalen Aufnahme von Cholesterin und Phytosterolen beteiligt ist.
Ezetimib hemmt weder die Cholesterinsynthese in der Leber noch erhöht es die Gallensäureausscheidung. Stattdessen lokalisiert sich Ezetimib am Bürstensaum des Dünndarms und hemmt die Absorption von Cholesterin, was zu einer Verringerung der Abgabe von intestinalem Cholesterin an die Leber führt. Dies bewirkt eine Verringerung der hepatischen Cholesterinspeicher und eine Erhöhung der Cholesterinausscheidung aus dem Blut; dieser unterschiedliche Mechanismus ist komplementär zu dem von Statinen und Fenofibrat [siehe Klinische Studien ].
Pharmakodynamik
Klinische Studien haben gezeigt, dass erhöhte Spiegel von Gesamt-C, LDL-C und Apo B, dem Hauptproteinbestandteil von LDL, menschliche Atherosklerose fördern. Darüber hinaus werden verringerte HDL-C-Spiegel mit der Entwicklung von Atherosklerose in Verbindung gebracht. Epidemiologische Studien haben festgestellt, dass kardiovaskuläre Morbidität und Mortalität direkt mit dem Gesamt-C- und LDL-C-Spiegel und umgekehrt mit dem HDL-C-Spiegel variieren. Wie LDL können auch mit Cholesterin angereicherte triglyceridreiche Lipoproteine, einschließlich Lipoproteine mit sehr niedriger Dichte (VLDL), Lipoproteine mit mittlerer Dichte (IDL) und Reste, Atherosklerose fördern. Die unabhängige Wirkung einer Erhöhung von HDL-C oder einer Senkung von TG auf das Risiko einer koronaren und kardiovaskulären Morbidität und Mortalität wurde nicht bestimmt.
ZETIA reduziert Gesamt-C, LDL-C, Apo B, Non-HDL-C und TG und erhöht HDL-C bei Patienten mit Hyperlipidämie. Die Verabreichung von ZETIA 10 mg zusammen mit einem Statin ist wirksam bei der Verbesserung von Gesamt-C, LDL-C, Apo B, Non-HDL-C, TG und HDL-C im Serum über eine Behandlung allein hinaus. Die Verabreichung von ZETIA 10 mg mit Fenofibrat verbessert bei Patienten mit gemischter Hyperlipidämie wirksam das Gesamt-C, LDL-C, Apo B und Nicht-HDL-C im Serum im Vergleich zu einer der beiden Behandlungen allein. Die Auswirkungen von Ezetimib, entweder allein oder zusätzlich zu einem Statin oder Fenofibrat, auf die kardiovaskuläre Morbidität und Mortalität wurden nicht nachgewiesen.
Pharmakokinetik
Absorption
Nach oraler Verabreichung wird Ezetimib resorbiert und weitgehend an ein pharmakologisch aktives phenolisches Glucuronid (Ezetimib-Glucuronid) konjugiert. Nach einer Einzeldosis von 10 mg ZETIA 10 mg bei nüchternen Erwachsenen wurden innerhalb von 4 bis 12 Stunden (Tmax) mittlere Ezetimib-Spitzenplasmakonzentrationen (Cmax) von 3,4 bis 5,5 ng/ml erreicht. Zwischen 1 und 2 Stunden (Tmax) wurden mittlere Cmax-Werte von Ezetimib-Glucuronid von 45 bis 71 ng/ml erreicht. Es gab keine wesentliche Abweichung von der Dosisproportionalität zwischen 5 und 20 mg. Die absolute Bioverfügbarkeit von Ezetimib kann nicht bestimmt werden, da die Verbindung in wässrigen Medien, die zur Injektion geeignet sind, praktisch unlöslich ist.
Wirkung von Lebensmitteln auf die orale Absorption
Die gleichzeitige Einnahme von Nahrungsmitteln (fettreiche oder fettfreie Mahlzeiten) hatte keinen Einfluss auf das Ausmaß der Resorption von Ezetimib, wenn es als ZETIA 10-mg-Tabletten verabreicht wurde. Der C-Wert von Ezetimib war bei Verzehr von fettreichen Mahlzeiten um 38 % erhöht. ZETIA kann mit oder ohne Nahrung verabreicht werden.
Verteilung
Ezetimib und Ezetimib-Glucuronid werden in hohem Maße (> 90 %) an menschliche Plasmaproteine gebunden.
Stoffwechsel und Ausscheidung
Ezetimib wird hauptsächlich im Dünndarm und in der Leber über Glucuronid-Konjugation (eine Phase-II-Reaktion) mit anschließender biliärer und renaler Ausscheidung metabolisiert. Bei allen untersuchten Arten wurde ein minimaler oxidativer Metabolismus (eine Phase-I-Reaktion) beobachtet.
Beim Menschen wird Ezetimib schnell zu Ezetimib-Glucuronid metabolisiert. Ezetimib und Ezetimibglucuronid sind die wichtigsten von Arzneimitteln abgeleiteten Verbindungen, die im Plasma nachgewiesen werden und etwa 10 bis 20 % bzw. 80 bis 90 % des gesamten Arzneimittels im Plasma ausmachen. Sowohl Ezetimib als auch Ezetimib-Glucuronid werden mit einer Halbwertszeit von etwa 22 Stunden sowohl für Ezetimib als auch für Ezetimib-Glucuronid aus dem Plasma eliminiert. Plasmakonzentrations-Zeit-Profile weisen mehrere Peaks auf, was auf ein enterohepatisches Recycling hindeutet.
Nach oraler Verabreichung von 14C-Ezetimib (20 mg) an Probanden machte Gesamt-Ezetimib (Ezetimib + Ezetimib-Glucuronid) etwa 93 % der gesamten Radioaktivität im Plasma aus. Nach 48 Stunden gab es keine nachweisbaren Radioaktivitätswerte im Plasma.
Etwa 78 % bzw. 11 % der verabreichten Radioaktivität wurden über einen 10-tägigen Sammelzeitraum im Stuhl bzw. im Urin wiedergefunden. Ezetimib war der Hauptbestandteil im Stuhl und machte 69 % der verabreichten Dosis aus, während Ezetimib-Glucuronid der Hauptbestandteil im Urin war und 9 % der verabreichten Dosis ausmachte.
Spezifische Populationen
Geriatrische Patienten: In einer Mehrfachdosisstudie mit 10 mg Ezetimib einmal täglich über 10 Tage waren die Plasmakonzentrationen von Gesamt-Ezetimib bei älteren (≥65 Jahre) gesunden Probanden etwa 2-fach höher als bei jüngeren Probanden.
Pädiatrische Patienten: [Sehen Verwendung in bestimmten Populationen ]
Geschlecht: In einer Mehrfachdosisstudie mit 10 mg Ezetimib einmal täglich über 10 Tage waren die Plasmakonzentrationen von Gesamt-Ezetimib bei Frauen etwas höher (
Wettrennen: Basierend auf einer Metaanalyse von pharmakokinetischen Studien zur Mehrfachdosis gab es keine pharmakokinetischen Unterschiede zwischen dunkelhäutigen und kaukasischen Probanden. Studien an asiatischen Probanden zeigten, dass die Pharmakokinetik von Ezetimib ähnlich war wie bei kaukasischen Probanden.
Leberfunktionsstörung: Nach einer Einzeldosis von 10 mg Ezetimib war die mittlere AUC für Gesamt-Ezetimib bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Score 5 bis 6) im Vergleich zu gesunden Probanden etwa um das 1,7-Fache erhöht. Die mittleren AUC-Werte für Gesamt-Ezetimib und Ezetimib waren bei Patienten mit mäßiger (Child-Pugh-Score 7 bis 9) oder schwerer Leberfunktionsstörung (Child-Pugh-Score) etwa um das 3- bis 4-Fache bzw. 5- bis 6-Fache erhöht 10 bis 15). In einer 14-tägigen Mehrfachdosisstudie (10 mg täglich) bei Patienten mit mittelgradiger Leberfunktionsstörung waren die mittleren AUC-Werte für Gesamt-Ezetimib und Ezetimib an Tag 1 und Tag 14 etwa 4-fach erhöht im Vergleich zu gesunden Probanden. Aufgrund der unbekannten Auswirkungen einer erhöhten Ezetimib-Exposition bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung wird ZETIA bei diesen Patienten nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nierenfunktionsstörung: Nach einer Einzeldosis von 10 mg Ezetimib bei Patienten mit schwerer Nierenerkrankung (n = 8; mittlere CrCl ≥ 30 ml/min/1,73 m²) waren die mittleren AUC-Werte für Gesamt-Ezetimib, Ezetimib-Glucuronid und Ezetimib um etwa 1,5 erhöht -fach, im Vergleich zu gesunden Probanden (n=9).
Wechselwirkungen mit anderen Medikamenten
[Siehe auch WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]
ZETIA 10 mg hatte in einer „Cocktail“-Studie mit zwölf gesunden Personen keine signifikante Wirkung auf eine Reihe von Sondenmedikamenten (Koffein, Dextromethorphan, Tolbutamid und i.v. Midazolam), von denen bekannt ist, dass sie durch Cytochrom P450 (1A2, 2D6, 2C8/9 und 3A4) metabolisiert werden erwachsene Männchen. Dies weist darauf hin, dass Ezetimib weder ein Inhibitor noch ein Induktor dieser Cytochrom-P450-Isozyme ist, und es ist unwahrscheinlich, dass Ezetimib den Metabolismus von Arzneimitteln beeinflusst, die durch diese Enzyme metabolisiert werden.
TABELLE 4: Wirkung gleichzeitig verabreichter Arzneimittel auf Gesamt-Ezetimib
TABELLE 5: Wirkung der gleichzeitigen Verabreichung von Ezetimib auf die systemische Exposition gegenüber anderen Arzneimitteln
Tiertoxikologie und/oder Pharmakologie
Die hypocholesterinämische Wirkung von Ezetimib wurde an mit Cholesterin gefütterten Rhesusaffen, Hunden, Ratten und Mausmodellen des menschlichen Cholesterinstoffwechsels untersucht. Es wurde festgestellt, dass Ezetimib einen ED50-Wert von 0,5 μg/kg/Tag zur Hemmung des Anstiegs des Plasmacholesterinspiegels bei Affen hat. Die ED50-Werte bei Hunden, Ratten und Mäusen betrugen 7, 30 bzw. 700 μg/kg/Tag. Diese Ergebnisse stimmen damit überein, dass ZETIA ein potenter Hemmer der Cholesterinabsorption ist.
In einem Rattenmodell, in dem der Glucuronid-Metabolit von Ezetimib (SCH 60663) intraduodenal verabreicht wurde, war der Metabolit bei der Hemmung der Cholesterinresorption genauso wirksam wie die Ausgangssubstanz (SCH 58235), was darauf hindeutet, dass der Glucuronid-Metabolit eine ähnliche Aktivität wie die Ausgangssubstanz hatte Arzneimittel.
In 1-monatigen Studien an Hunden, denen Ezetimib (0,03 bis 300 mg/kg/Tag) verabreicht wurde, stieg die Konzentration von Cholesterin in der Gallenblase um das etwa 2- bis 4-Fache an. Eine Dosis von 300 mg/kg/Tag, die Hunden ein Jahr lang verabreicht wurde, führte jedoch nicht zur Bildung von Gallensteinen oder anderen hepatobiliären Wirkungen. In einer 14-tägigen Studie an Mäusen, denen Ezetimib (0,3 bis 5 mg/kg/Tag) verabreicht wurde und die mit einer fettarmen oder cholesterinreichen Diät gefüttert wurden, blieb die Cholesterinkonzentration in der Gallenblase entweder unbeeinflusst oder auf normale Werte reduziert.
Eine Reihe akuter präklinischer Studien wurde durchgeführt, um die Selektivität von ZETIA zur Hemmung der Cholesterinabsorption zu bestimmen. Ezetimib hemmte die Resorption von 14C-Cholesterin ohne Auswirkung auf die Resorption von Triglyceriden, Fettsäuren, Gallensäuren, Progesteron, Ethinylestradiol oder den fettlöslichen Vitaminen A und D.
In 4- bis 12-wöchigen Toxizitätsstudien an Mäusen induzierte Ezetimib keine Enzyme, die Cytochrom P450 metabolisieren. In Toxizitätsstudien wurde bei Ratten, Hunden und Kaninchen eine pharmakokinetische Wechselwirkung von Ezetimib mit Statinen (Eltern oder ihren aktiven Hydroxysäure-Metaboliten) beobachtet.
Klinische Studien
Primäre Hyperlipidämie
ZETIA 10 mg reduziert Gesamt-C, LDL-C, Apo B, Non-HDL-C und TG und erhöht HDL-C bei Patienten mit Hyperlipidämie. Das maximale bis nahezu maximale Ansprechen wird im Allgemeinen innerhalb von 2 Wochen erreicht und während der Dauertherapie aufrechterhalten.
Monotherapie
In zwei multizentrischen, doppelblinden, placebokontrollierten 12-wöchigen Studien an 1719 Patienten mit primärer Hyperlipidämie senkte ZETIA signifikant Gesamt-C, LDL-C, Apo B, Non-HDL-C und TG und erhöhte HDL- C im Vergleich zu Placebo (siehe Tabelle 6). Die Senkung des LDL-C war über Alter, Geschlecht und LDL-C-Ausgangswert hinweg konsistent.
TABELLE 6: Ansprechen auf ZETIA 10 mg bei Patienten mit primärer Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert†)
Kombination mit Statinen
ZETIA 10 mg wird zu einer laufenden Statintherapie hinzugefügt
In einer multizentrischen, doppelblinden, placebokontrollierten, 8-wöchigen Studie wurden 769 Patienten mit primärer Hyperlipidämie, bekannter koronarer Herzkrankheit oder mehreren kardiovaskulären Risikofaktoren, die bereits eine Statin-Monotherapie erhielten, aber ihr NCEP ATP II-Ziel-LDL nicht erreicht hatten -C Ziel wurden randomisiert, um zusätzlich zu ihrem laufenden Statin entweder ZETIA 10 mg oder Placebo zu erhalten.
ZETIA 10 mg, zusätzlich zu einer laufenden Statintherapie, senkte signifikant das Gesamt-C, LDL-C, Apo B, Nicht-HDL-C und TG und erhöhte HDL-C im Vergleich zu einem allein verabreichten Statin (siehe Tabelle 7). Die durch ZETIA 10 mg induzierte LDL-C-Senkung war im Allgemeinen bei allen Statinen konsistent.
TABELLE 7: Ansprechen auf die Zugabe von ZETIA 10 mg zu einer laufenden Statintherapie bei Patienten mit Hyperlipidämie (mittlere prozentuale Veränderung gegenüber dem behandelten Ausgangswert‡)
ZETIA wurde gleichzeitig mit einem Statin eingeleitet
In vier multizentrischen, doppelblinden, placebokontrollierten 12-wöchigen Studien an 2382 Patienten mit Hyperlipidämie wurde ZETIA oder Placebo allein oder mit verschiedenen Dosen von Atorvastatin, Simvastatin, Pravastatin oder Lovastatin verabreicht.
Als alle Patienten, die ZETIA mit einem Statin erhielten, mit allen verglichen wurden, die das entsprechende Statin allein erhielten, senkte ZETIA 10 mg signifikant Gesamt-C, LDL-C, Apo B, Non-HDL-C und TG, und zwar mit Ausnahme von Pravastatin , erhöhtes HDL-C im Vergleich zum allein verabreichten Statin. Die durch ZETIA 10 mg induzierte LDL-C-Senkung war im Allgemeinen bei allen Statinen konsistent. (Siehe Fußnote, Tabellen 8 bis 11.)
TABELLE 8: Ansprechen auf ZETIA 10 mg und gleichzeitig eingeleitetes Atorvastatin bei Patienten mit primärer Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert†)
TABELLE 9: Ansprechen auf ZETIA 10 mg und Simvastatin, gleichzeitig eingeleitet bei Patienten mit primärer Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert†)
TABELLE 10: Ansprechen auf gleichzeitig begonnenes ZETIA und Pravastatin bei Patienten mit primärer Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert†)
TABELLE 11: Ansprechen auf ZETIA und Lovastatin gleichzeitig eingeleitet bei Patienten mit primärer Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert†)
Kombination mit Fenofibrat
In einer multizentrischen, doppelblinden, placebokontrollierten klinischen Studie bei Patienten mit gemischter Hyperlipidämie wurden 625 Patienten bis zu 12 Wochen und 576 bis zu weitere 48 Wochen behandelt. Die Patienten wurden randomisiert und erhielten in der 12-wöchigen Studie Placebo, ZETIA allein, 160 mg Fenofibrat allein oder ZETIA 10 mg und 160 mg Fenofibrat. Nach Abschluss der 12-wöchigen Studie wurden geeignete Patienten ZETIA in Kombination mit Fenofibrat oder einer Fenofibrat-Monotherapie für weitere 48 Wochen zugewiesen.
ZETIA 10 mg zusammen mit Fenofibrat senkte signifikant das Gesamt-C, LDL-C, Apo B und Non-HDL-C im Vergleich zur alleinigen Gabe von Fenofibrat. Die prozentuale Abnahme der TG und die prozentuale Zunahme des HDLC für ZETIA, das zusammen mit Fenofibrat verabreicht wurde, waren vergleichbar mit denen für Fenofibrat, das allein verabreicht wurde (siehe Tabelle 12).
TABELLE 12: Ansprechen auf ZETIA 10 mg und gleichzeitig eingeleitetes Fenofibrat bei Patienten mit gemischter Hyperlipidämie (mittlere prozentuale Veränderung gegenüber unbehandeltem Ausgangswert† nach 12 Wochen†)
Die Veränderungen der Lipid-Endpunkte nach weiteren 48 Wochen Behandlung mit ZETIA zusammen mit Fenofibrat oder mit Fenofibrat allein stimmten mit den oben gezeigten 12-Wochen-Daten überein.
Homozygote Familiäre Hypercholesterinämie (HoFH)
Es wurde eine Studie durchgeführt, um die Wirksamkeit von ZETIA bei der Behandlung von HoFH zu bewerten. In diese doppelblinde, randomisierte, 12-wöchige Studie wurden 50 Patienten mit einer klinischen und/oder genotypischen HoFH-Diagnose mit oder ohne begleitende LDL-Apherese aufgenommen, die bereits Atorvastatin oder Simvastatin (40 mg) erhielten. Die Patienten wurden randomisiert einer von drei Behandlungsgruppen zugeteilt: Atorvastatin oder Simvastatin (80 mg), ZETIA 10 mg verabreicht mit Atorvastatin oder Simvastatin (40 mg) oder ZETIA verabreicht mit Atorvastatin oder Simvastatin (80 mg). Aufgrund der verminderten Bioverfügbarkeit von Ezetimib bei Patienten, die gleichzeitig Cholestyramin erhalten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN wurde Ezetimib mindestens 4 Stunden vor oder nach der Gabe von Harzen verabreicht. Der mittlere LDL-C-Ausgangswert betrug 341 mg/dl bei den Patienten, die randomisiert Atorvastatin 80 mg oder Simvastatin 80 mg allein erhielten, und 316 mg/dl in der Gruppe, die randomisiert ZETIA 10 mg plus Atorvastatin 40 oder 80 mg oder Simvastatin 40 oder 80 mg erhielten. ZETIA 10 mg, verabreicht mit Atorvastatin oder Simvastatin (40- und 80-mg-Statin-Gruppen, gepoolt), reduzierte LDL-Cholesterin signifikant (21 %) im Vergleich zu einer Erhöhung der Dosis von Simvastatin oder Atorvastatin-Monotherapie von 40 auf 80 mg (7 %). Bei denjenigen, die mit ZETIA 10 mg plus 80 mg Atorvastatin oder mit ZETIA 10 mg plus 80 mg Simvastatin behandelt wurden, wurde LDL-C um 27 % gesenkt.
Homozygote Sitosterinämie (Phytosterinämie)
Es wurde eine Studie durchgeführt, um die Wirksamkeit von ZETIA bei der Behandlung von homozygoter Sitosterolämie zu beurteilen. In dieser multizentrischen, doppelblinden, placebokontrollierten, 8-wöchigen Studie wurden 37 Patienten mit Homozygotosterinämie mit erhöhten Plasma-Sitosterolspiegeln (> 5 mg/dl) unter ihrem aktuellen Therapieschema (Diät, gallensäurebindende Harze, Statine, Ileum-Bypassoperation und/oder LDL-Apherese), wurden randomisiert und erhielten ZETIA (n=30) oder Placebo (n=7). Aufgrund der verminderten Bioverfügbarkeit von Ezetimib bei Patienten, die gleichzeitig Cholestyramin erhalten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN wurde Ezetimib mindestens 2 Stunden vor oder 4 Stunden nach der Harzgabe verabreicht. Mit Ausnahme des einen Probanden, der eine LDL-Apherese erhielt, senkte ZETIA Plasma-Sitosterol und Campesterol signifikant um 21 % bzw. 24 % gegenüber dem Ausgangswert. Im Gegensatz dazu zeigten Patienten, die Placebo erhielten, Anstiege von Sitosterol und Campesterol von 4 % bzw. 3 % gegenüber dem Ausgangswert. Bei Patienten, die mit ZETIA 10 mg behandelt wurden, wurden die mittleren Plasmaspiegel von Pflanzensterinen im Verlauf der Studie schrittweise reduziert. Die Auswirkungen einer Verringerung von Sitosterol und Campesterol im Plasma auf die Verringerung des Risikos einer kardiovaskulären Morbidität und Mortalität wurden nicht nachgewiesen.
Die Reduktionen von Sitosterol und Campesterol waren bei Patienten, die ZETIA 10 mg gleichzeitig mit Gallensäure-Sequestriermitteln einnahmen (n = 8) und Patienten, die keine gleichzeitige Therapie mit Gallensäure-Sequestriermitteln erhielten (n = 21), konsistent.
Nutzungsbeschränkungen
Die Wirkung von ZETIA 10 mg auf die kardiovaskuläre Morbidität und Mortalität wurde nicht bestimmt.
INFORMATIONEN ZUM PATIENTEN
ZETIA® (Ezetimib) Tabletten
Patienteninformationen zu ZETIA (zet´-ea)
Generischer Name: Ezetimib (e-zet´-e-mib)
Lesen Sie diese Informationen sorgfältig durch, bevor Sie mit der Einnahme von ZETIA® beginnen und jedes Mal, wenn Sie mehr ZETIA erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung. Wenn Sie Fragen zu ZETIA haben, wenden Sie sich an Ihren Arzt. Nur Ihr Arzt kann entscheiden, ob ZETIA für Sie geeignet ist.
Was ist ZETIA?
ZETIA ist ein Arzneimittel, das zur Senkung des Gesamtcholesterinspiegels und des LDL-Cholesterins (schlechtes Cholesterin) im Blut angewendet wird. ZETIA ist für Patienten bestimmt, die ihren Cholesterinspiegel nicht allein durch Ernährung und Bewegung kontrollieren können. Es kann allein oder zusammen mit anderen Arzneimitteln zur Behandlung eines hohen Cholesterinspiegels angewendet werden. Sie sollten während der Einnahme dieses Arzneimittels eine cholesterinsenkende Diät einhalten.
ZETIA reduziert die Menge an Cholesterin, die Ihr Körper aufnimmt. ZETIA 10mg hilft Ihnen nicht beim Abnehmen. Es wurde nicht gezeigt, dass ZETIA 10 mg Herzkrankheiten oder Herzinfarkten vorbeugt.
Weitere Informationen zu Cholesterin finden Sie unter „Was sollte ich über einen hohen Cholesterinspiegel wissen?“. folgenden Abschnitt.
Wer sollte ZETIA 10 mg nicht einnehmen?
ZETIA wurde bei Kindern unter 10 Jahren nicht untersucht.
Was sollte ich meinem Arzt vor und während der Einnahme von ZETIA 10 mg mitteilen?
Informieren Sie Ihren Arzt über alle verschreibungspflichtigen und nicht verschreibungspflichtigen Arzneimittel, die Sie einnehmen oder einnehmen möchten, einschließlich natürlicher oder pflanzlicher Heilmittel.
Informieren Sie Ihren Arzt über alle Ihre Erkrankungen, einschließlich Allergien.
Informieren Sie Ihren Arzt, wenn Sie:
Wie sollte ich ZETIA 10 mg einnehmen?
Welche Nebenwirkungen kann ZETIA haben?
In klinischen Studien berichteten Patienten während der Einnahme von ZETIA über wenige Nebenwirkungen. Dazu gehörten Durchfall, Gelenkschmerzen und Müdigkeit.
Bei Patienten kam es während der Einnahme von ZETIA 10 mg zu schweren Muskelproblemen, in der Regel, wenn ZETIA 10 mg zu einem Statin hinzugefügt wurde. Wenn Sie während der Einnahme von ZETIA unerklärliche Muskelschmerzen, Empfindlichkeit oder Schwäche verspüren, wenden Sie sich sofort an Ihren Arzt. Sie müssen dies umgehend tun, da diese Muskelprobleme in seltenen Fällen schwerwiegend sein können, wobei der Muskelabbau zu Nierenschäden führt.
Darüber hinaus wurden die folgenden Nebenwirkungen bei der allgemeinen Anwendung berichtet: allergische Reaktionen (die möglicherweise sofort behandelt werden müssen) einschließlich Schwellungen von Gesicht, Lippen, Zunge und/oder Rachen, die Atem- oder Schluckbeschwerden verursachen können, Hautausschlag und Nesselsucht ; erhabener roter Ausschlag, manchmal mit zielförmigen Läsionen; Gelenkschmerzen; Muskelkater; Veränderungen bei einigen Laborbluttests; Leberprobleme; Magenschmerzen; Entzündung der Bauchspeicheldrüse; Brechreiz; Schwindel; Kribbeln; Depression; Kopfschmerzen; Gallensteine; Entzündung der Gallenblase.
Informieren Sie Ihren Arzt, wenn Sie diese oder andere medizinische Probleme während der Behandlung mit ZETIA haben. Eine vollständige Liste der Nebenwirkungen erhalten Sie von Ihrem Arzt oder Apotheker.
Was sollte ich über hohe Cholesterinwerte wissen?
Cholesterin ist eine Art von Fett, das in Ihrem Blut vorkommt. Ihr Gesamtcholesterin setzt sich aus LDL- und HDL-Cholesterin zusammen.
LDL-Cholesterin wird als „schlechtes“ Cholesterin bezeichnet, weil es sich in der Arterienwand ansammeln und Plaque bilden kann. Im Laufe der Zeit kann die Ansammlung von Plaque zu einer Verengung der Arterien führen. Diese Verengung kann den Blutfluss zu Ihrem Herzen, Gehirn und anderen Organen verlangsamen oder blockieren. Hohes LDL-Cholesterin ist eine der Hauptursachen für Herzerkrankungen und eine der Ursachen für Schlaganfälle.
HDL-Cholesterin wird als „gutes“ Cholesterin bezeichnet, weil es verhindert, dass sich das schlechte Cholesterin in den Arterien ansammelt.
Triglyceride sind auch Fette, die in Ihrem Blut gefunden werden.
Allgemeine Informationen zu ZETIA
Medikamente werden manchmal für Erkrankungen verschrieben, die nicht in der Packungsbeilage erwähnt sind. Verwenden Sie ZETIA 10 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie ZETIA nicht an andere Personen weiter, selbst wenn sie die gleiche Erkrankung wie Sie haben. Es kann ihnen schaden.
Hier sind die wichtigsten Informationen zu ZETIA zusammengefasst. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen zu ZETIA 10 mg bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Inaktive Zutaten :
Croscarmellose-Natrium, Lactose-Monohydrat, Magnesiumstearat, mikrokristalline Cellulose, Povidon und Natriumlaurylsulfat.