Lopid 300mg Gemfibrozil Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lopid 300 mg und wie wird es angewendet?
Lopid (Gemfibrozil) ist ein lipidregulierendes Mittel, das zur Behandlung sehr hoher Cholesterin- und Triglyceridspiegel bei Menschen mit Pankreatitis verwendet wird, und wird auch verwendet, um das Risiko von Schlaganfall, Herzinfarkt oder anderen Herzkomplikationen bei Menschen mit hohem Cholesterin- und Triglyceridspiegel zu senken nicht durch andere Behandlungen geholfen. Lopid ist in generischer Form erhältlich.
Welche Nebenwirkungen hat Lopid 300mg?
Häufige Nebenwirkungen von Lopid 300 mg sind:
Lopid 300 mg kann selten Gallensteine und Leberprobleme verursachen.
Informieren Sie Ihren Arzt, wenn Sie eine der folgenden unwahrscheinlichen, aber schwerwiegenden Nebenwirkungen von Lopid 300 mg bemerken, einschließlich:
BEZEICHNUNG
LOPID® (Gemfibrozil-Tabletten, USP) ist ein Lipidregulierungsmittel. Es ist als Tablette zur oralen Verabreichung erhältlich. Jede Tablette enthält 600 mg Gemfibrozil. Jede Tablette enthält auch Calciumstearat, NF; Candelillawachs, FCC; mikrokristalline Zellulose, NF; Hydroxypropylcellulose, NF; Hypromellose, USP; Methylparaben, NF; Opaspray weiß; Polyethylenglykol, NF; Polysorbat 80, NF; Propylparaben, NF; kolloidales Siliziumdioxid, NF; Quellstärke, NF. Der chemische Name lautet 5-(2,5-Dimethylphenoxy)-2,2-Dimethylpentansäure mit der folgenden Strukturformel:
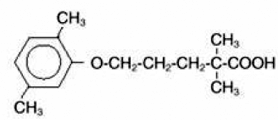
Die empirische Formel ist C15H22O3 und das Molekulargewicht ist 250,35; die Löslichkeit in Wasser und Säure beträgt 0,0019 % und in verdünnter Base mehr als 1 %. Der Schmelzpunkt liegt bei 58° –61°C. Gemfibrozil ist ein weißer Feststoff, der unter normalen Bedingungen stabil ist.
INDIKATIONEN
LOPID (Gemfibrozil-Tabletten, USP) ist angezeigt als Zusatztherapie zu einer Diät bei:
In einer Untergruppenanalyse von Patienten in der Helsinki Heart Study mit überdurchschnittlichen HDL-Cholesterinwerten zu Studienbeginn (über 46,4 mg/dl) war die Inzidenz schwerwiegender koronarer Ereignisse in den Gemfibrozil- und Placebo-Untergruppen ähnlich (siehe Tabelle I).
Die anfängliche Behandlung von Dyslipidämie ist eine Ernährungstherapie, die für die Art der Lipoproteinanomalie spezifisch ist. Übermäßiges Körpergewicht und übermäßiger Alkoholkonsum können wichtige Faktoren bei Hypertriglyzeridämie sein und sollten vor jeder medikamentösen Therapie behandelt werden. Körperliche Bewegung kann eine wichtige ergänzende Maßnahme sein und wurde mit einem Anstieg des HDL-Cholesterins in Verbindung gebracht. Erkrankungen, die zur Hyperlipidämie beitragen, wie Hypothyreose oder Diabetes mellitus, sollten gesucht und angemessen behandelt werden. Die Östrogentherapie ist manchmal mit einem massiven Anstieg der Plasmatriglyceride verbunden, insbesondere bei Patienten mit familiärer Hypertriglyceridämie. In solchen Fällen kann das Absetzen der Östrogentherapie die Notwendigkeit einer spezifischen medikamentösen Therapie der Hypertriglyceridämie überflüssig machen. Der Einsatz von Medikamenten sollte nur in Betracht gezogen werden, wenn angemessene Versuche unternommen wurden, mit nichtmedikamentösen Methoden zufriedenstellende Ergebnisse zu erzielen. Wenn die Entscheidung zum Einsatz von Medikamenten getroffen wird, sollte der Patient darüber aufgeklärt werden, dass dies die Bedeutung der Einhaltung einer Diät nicht mindert.
DOSIERUNG UND ANWENDUNG
Die empfohlene Dosis für Erwachsene beträgt 1200 mg, verabreicht in zwei Einzeldosen 30 Minuten vor dem Morgen- und Abendessen (siehe KLINISCHE PHARMAKOLOGIE ).
WIE GELIEFERT
LOPID (Tablette 737), weiße, elliptische Filmtabletten mit Bruchrille, die jeweils 600 mg Gemfibrozil enthalten, sind wie folgt erhältlich:
NDC 0071-0737-20: Flaschen zu 60 NDC 0071-0737-30: Flaschen zu 500
Bei kontrollierter Raumtemperatur von 20° – 25°C (68° – 77°F) lagern [siehe USP]. Vor Licht und Feuchtigkeit schützen.
Verteilt von Parke-Davis Division of Pfizer Inc, NY, NY 10017. Überarbeitet: Dez 2020
NEBENWIRKUNGEN
In der doppelblinden, kontrollierten Phase der Primärpräventionskomponente der Helsinki Heart Study erhielten 2046 Patienten LOPID für bis zu fünf Jahre. In dieser Studie traten die folgenden Nebenwirkungen bei Patienten in der LOPID-Gruppe statistisch häufiger auf:
Gallenblase Chirurgie wurde bei 0,9 % der LOPID 300 mg- und 0,5 % der Placebo-Patienten in der primären Präventionskomponente durchgeführt, eine 64 %ige Überschreitung, die sich statistisch nicht von der Überschreitung der Gallenblasenoperation unterscheidet, die in der Clofibrat-Gruppe im Vergleich zur Placebo-Gruppe der WHO-Studie beobachtet wurde . Gallenblasenoperationen wurden in der Sekundärpräventionskomponente in der LOPID-Gruppe im Vergleich zur Placebogruppe ebenfalls häufiger durchgeführt (1,9 % versus 0,3 %, p = 0,07). Ein statistisch signifikanter Anstieg der Appendektomie in der Gemfibrozil-Gruppe wurde auch in der sekundären Präventionskomponente beobachtet (6 unter Gemfibrozil versus 0 unter Placebo, p = 0,014).
Nebenwirkungen des Nervensystems und der besonderen Sinne traten häufiger in der Gruppe mit LOPID 300 mg auf. Dazu gehörten Hypästhesie, Parästhesien und Geschmacksperversion. Andere Nebenwirkungen, die häufiger bei Probanden der LOPID 300 mg-Behandlungsgruppe auftraten, bei denen jedoch kein kausaler Zusammenhang festgestellt wurde, umfassen Katarakte, periphere Gefäßerkrankungen und intrazerebrale Blutungen.
Aus anderen Studien scheint es wahrscheinlich, dass LOPID 300mg in ursächlichem Zusammenhang mit dem Auftreten von MUSKULOSKELETALEN SYMPTOME steht (vgl WARNUNGEN ) und auf ANORMALE LEBERFUNKTIONSTESTS und HÄMATOLOGISCHE VERÄNDERUNGEN (siehe VORSICHTSMASSNAHMEN ).
Berichte über virale und bakterielle Infektionen (Erkältung, Husten, Harnwegsinfektionen) traten bei mit Gemfibrozil behandelten Patienten in anderen kontrollierten klinischen Studien mit 805 Patienten häufiger auf. Weitere Nebenwirkungen, die für Gemfibrozil berichtet wurden, sind unten nach Systemen aufgelistet. Diese werden danach kategorisiert, ob ein kausaler Zusammenhang mit der Behandlung mit LOPID wahrscheinlich ist oder nicht:
Weitere berichtete Nebenwirkungen sind Cholezystitis und Cholelithiasis (sehen WARNUNGEN ).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
HMG-CoA-Reduktase-Inhibitoren
Die gleichzeitige Verabreichung von LOPID 300 mg mit Simvastatin ist kontraindiziert (siehe KONTRAINDIKATIONEN und WARNUNGEN ). Vermeiden Sie die gleichzeitige Anwendung von LOPID mit Rosuvastatin. Wenn eine gleichzeitige Anwendung nicht vermieden werden kann, beginnen Sie mit Rosuvastatin mit 5 mg einmal täglich. Die Rosuvastatin-Dosis sollte 10 mg einmal täglich nicht überschreiten. Das Risiko einer Myopathie und Rhabdomyolyse ist bei einer Kombinationstherapie aus Gemfibrozil und HMG-CoA-Reduktase-Inhibitoren erhöht. Myopathie oder Rhabdomyolyse mit oder ohne akutem Nierenversagen wurden bereits drei Wochen nach Beginn einer Kombinationstherapie oder nach mehreren Monaten berichtet (siehe WARNUNGEN ). Es gibt keine Garantie dafür, dass eine regelmäßige Überwachung der Kreatinkinase das Auftreten schwerer Myopathien und Nierenschäden verhindert.
Antikoagulanzien
VORSICHT IST GEBRAUCHT, WENN WARFARIN IN VERBINDUNG MIT LOPID GEGEBEN WIRD. DIE DOSIERUNG VON WARFARIN SOLLTE REDUZIERT WERDEN, UM DIE PROTHROMBIN-ZEIT AUF DEM GEWÜNSCHTEN NIVEAU ZU HALTEN, UM BLUTUNGSKOMPLIKATIONEN ZU VERMEIDEN. HÄUFIGE PROTHROMBIN-BESTIMMUNGEN SIND BIS ZUR STABILISIERUNG DES PROTHROMBIN-Spiegels EMPFOHLEN.
CYP2C8-Substrate
Gemfibrozil ist ein starker Inhibitor von CYP2C8 und kann die Exposition gegenüber Arzneimitteln erhöhen, die hauptsächlich durch CYP2C8 metabolisiert werden (z. B. Dabrafenib, Enzalutamid, Loperamid, Montelukast, Paclitaxel, Pioglitazon, Rosiglitazon). Daher kann eine Dosisreduktion von Arzneimitteln, die hauptsächlich durch das CYP2C8-Enzym metabolisiert werden, erforderlich sein, wenn Gemfibrozil gleichzeitig angewendet wird (siehe WARNUNGEN ).
Repaglinid
Bei gesunden Probanden führte die gleichzeitige Anwendung mit Gemfibrozil (600 mg zweimal täglich über 3 Tage) zu einer 8,1-fach (Bereich 5,5- bis 15,0-fach) höheren Repaglinid-AUC und zu einer 28,6-fach (Bereich 18,5- bis 80,1-fach) höheren Repaglinid-AUC. höhere Repaglinid-Plasmakonzentration 7 Stunden nach der Dosis. In derselben Studie führte Gemfibrozil (600 mg zweimal täglich für 3 Tage) + Itraconazol (200 mg morgens und 100 mg abends an Tag 1, dann 100 mg zweimal täglich an Tag 2-3) zu einem 19,4-( Bereich 12,9- bis 24,7-fach) höhere Repaglinid-AUC und eine 70,4-fach (Bereich 42,9- bis 119,2-fach) höhere Repaglinid-Plasmakonzentration 7 Stunden nach der Dosis. Darüber hinaus verlängerte Gemfibrozil allein oder Gemfibrozil + Itraconazol die hypoglykämischen Wirkungen von Repaglinid. Die gleichzeitige Anwendung von Gemfibrozil und Repaglinid erhöht das Risiko einer schweren Hypoglykämie und ist kontraindiziert (s KONTRAINDIKATIONEN ).
Dasabuvir
Die gleichzeitige Anwendung von Gemfibrozil mit Dasabuvir erhöhte die AUC und Cmax von Dasabuvir (Verhältnisse: 11,3 bzw. 2,01) aufgrund der CYP2C8-Hemmung. Eine erhöhte Dasabuvir-Exposition kann das Risiko einer QT-Verlängerung erhöhen, daher ist die gleichzeitige Anwendung von Gemfibrozil mit Dasabuvir kontraindiziert (siehe KONTRAINDIKATIONEN ).
Selexipag
Die gleichzeitige Anwendung von Gemfibrozil mit Selexipag verdoppelte die Exposition gegenüber Selexipag und erhöhte die Exposition gegenüber dem aktiven Metaboliten um etwa das 11-Fache. Die gleichzeitige Anwendung von Gemfibrozil mit Selexipag ist kontraindiziert (siehe KONTRAINDIKATIONEN ).
Enzalutamid
Bei gesunden Probanden, denen eine Einzeldosis von 160 mg Enzalutamid nach 600 mg Gemfibrozil zweimal täglich verabreicht wurde, war die AUC von Enzalutamid plus aktivem Metaboliten (N-Desmethylenzalutamid) um das 2,2-Fache erhöht und die entsprechende Cmax um 16 % verringert. Eine erhöhte Enzalutamid-Exposition kann das Krampfrisiko erhöhen. Wenn eine gleichzeitige Anwendung als notwendig erachtet wird, sollte die Enzalutamid-Dosis reduziert werden (siehe WARNUNGEN ).
OATP1B1-Substrate
Gemfibrozil ist ein Inhibitor des OATP1B1-Transporters und kann die Exposition gegenüber Arzneimitteln erhöhen, die Substrate von OATP1B1 sind (z. B. Atrasentan, Atorvastatin, Bosentan, Ezetimib, Fluvastatin, Glyburid, SN-38 [aktiver Metabolit von Irinotecan], Rosuvastatin, Pitavastatin, Pravastatin, Rifampin). , Valsartan, Olmesartan). Daher kann eine Dosisreduktion von Arzneimitteln, die Substrate von OATP1B1 sind, erforderlich sein, wenn Gemfibrozil gleichzeitig angewendet wird (siehe WARNUNGEN ). Eine Kombinationstherapie von Gemfibrozil mit Simvastatin oder mit Repaglinid, die OATP1B1-Substrate sind, ist kontraindiziert (siehe KONTRAINDIKATIONEN ).
In-vitro-Studien zu CYP-Enzymen, UGTA-Enzymen und OATP1B1-Transportern
In-vitro-Studien haben gezeigt, dass Gemfibrozil ein Inhibitor von CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 und UDP-Glucuronosyltransferase (UGT) 1A1 und 1A3 ist (siehe WARNUNGEN ).
Gallensäurebindende Harze
Die AUC von Gemfibrozil wurde um 30 % reduziert, wenn Gemfibrozil (600 mg) gleichzeitig mit Harzgranulaten wie Colestipol (5 g) verabreicht wurde. Die Verabreichung der Arzneimittel im Abstand von mindestens zwei Stunden wird empfohlen, da die Gemfibrozil-Exposition nicht signifikant beeinflusst wurde, wenn es im Abstand von zwei Stunden zu Colestipol verabreicht wurde.
Colchicin
Bei chronischer Gabe von Colchicin in therapeutischen Dosen wurde über Myopathie, einschließlich Rhabdomyolyse, berichtet. Die gleichzeitige Anwendung von LOPID kann die Entwicklung einer Myopathie verstärken. Patienten mit Nierenfunktionsstörungen und ältere Patienten sind einem erhöhten Risiko ausgesetzt. Vorsicht ist geboten, wenn LOPID zusammen mit Colchicin verschrieben wird, insbesondere bei älteren Patienten oder Patienten mit Nierenfunktionsstörung.
WARNUNGEN
Aufgrund des begrenzteren Umfangs der Helsinki-Herzstudie unterscheidet sich der beobachtete Unterschied in der Sterblichkeit jedweder Ursache zwischen der LOPID-300-mg- und der Placebo-Gruppe nicht statistisch signifikant von der 29 %-igen Übersterblichkeit, die in der Clofibrat-Gruppe in der separaten WHO-Studie bei der berichtet wurde Neun-Jahres-Follow-up (vgl KLINISCHE PHARMAKOLOGIE ). Die Mortalität, die nicht auf koronare Herzkrankheiten zurückzuführen ist, zeigte einen Überschuss in der Gruppe, die ursprünglich für LOPID randomisiert wurde, hauptsächlich aufgrund von Krebstodesfällen, die während der offenen Verlängerung beobachtet wurden.
Während der fünfjährigen Primärpräventionskomponente der Helsinki Heart Study betrug die Sterblichkeit jeglicher Ursache 44 (2,2 %) in der LOPID-300-mg-Gruppe und 43 (2,1 %) in der Placebo-Gruppe; einschließlich der 3,5-jährigen Nachbeobachtungszeit seit Abschluss der Studie betrug die kumulative Sterblichkeit jeglicher Ursache 101 (4,9 %) in der LOPID-Gruppe und 83 (4,1 %) in der ursprünglich auf Placebo randomisierten Gruppe (Hazard Ratio 1:20 zugunsten von Placebo). Aufgrund des begrenzteren Umfangs der Helsinki-Herzstudie unterscheidet sich der beobachtete Unterschied in der Sterblichkeit jeglicher Ursache zwischen der LOPID-300-mg- und der Placebo-Gruppe in Jahr 5 oder in Jahr 8,5 nicht statistisch signifikant von der 29 %igen Übersterblichkeit, die in berichtet wird Clofibrat-Gruppe in der separaten WHO-Studie bei der neunjährigen Nachbeobachtung. Nicht koronare Herzkrankheit bedingte Sterblichkeit zeigte einen Überschuss in der Gruppe, die ursprünglich auf LOPID 300 mg bei der Nachuntersuchung nach 8,5 Jahren randomisiert worden war (65 LOPID 300 mg gegenüber 45 nicht koronaren Todesfällen unter Placebo).
Die während der Studie und in den 3,5 Jahren nach Abschluss der Studie entdeckte Krebsinzidenz (ohne Basalzellkarzinom) betrug in beiden ursprünglich randomisierten Gruppen 51 (2,5 %). Darüber hinaus gab es 16 Basalzellkarzinome in der ursprünglich auf LOPID 300 mg randomisierten Gruppe und 9 in der ursprünglich auf Placebo randomisierten Gruppe (p = 0,22). Es gab 30 (1,5 %) Todesfälle, die auf Krebs in der Gruppe zurückzuführen waren, die ursprünglich auf LOPID 300 mg randomisiert worden war, und 18 (0,9 %) in der Gruppe, die ursprünglich auf Placebo randomisiert worden war (p = 0,11). Unerwünschte Ergebnisse, einschließlich koronarer Ereignisse, waren bei Gemfibrozil-Patienten in einer entsprechenden Studie bei Männern mit bekannter oder vermuteter koronarer Herzkrankheit in der Vorgeschichte in der Sekundärpräventionskomponente der Helsinki Heart Study höher (siehe KLINISCHE PHARMAKOLOGIE ).
Eine vergleichende Karzinogenitätsstudie wurde auch an Ratten durchgeführt, in der drei Arzneimittel dieser Klasse verglichen wurden: Fenofibrat (10 und 60 mg/kg; 0,3- bzw. 1,6-fache Dosis beim Menschen), Clofibrat (400 mg/kg; 1,6-fache Dosis beim Menschen), und Gemfibrozil (250 mg/kg; das 1,7-fache der Humandosis). Azinusadenome des Pankreas waren bei Männern und Frauen unter Fenofibrat vermehrt; Hepatozelluläres Karzinom und azinäre Pankreasadenome waren bei Männern und hepatische neoplastische Knötchen bei Frauen, die mit Clofibrat behandelt wurden, vermehrt; hepatische neoplastische Knötchen waren bei Männern und Frauen, die mit Clofibrat behandelt wurden, vermehrt; hepatische neoplastische Knötchen waren bei Männern und Frauen, die mit Gemfibrozil behandelt wurden, vermehrt, während Hoden-Interstitialzelltumoren (Leydig-Zellen) bei Männern unter allen drei Arzneimitteln vermehrt auftraten.
VORSICHTSMASSNAHMEN
Anfangstherapie
Laboruntersuchungen sollten durchgeführt werden, um sicherzustellen, dass die Lipidspiegel durchgehend anormal sind. Vor Beginn der LOPID-Therapie sollte jeder Versuch unternommen werden, die Serumlipide durch geeignete Ernährung, Bewegung, Gewichtsverlust bei adipösen Patienten und die Kontrolle aller medizinischen Probleme wie Diabetes mellitus und Hypothyreose, die zu den Lipidanomalien beitragen, zu kontrollieren.
Fortsetzung der Therapie
Die Serumlipide sollten regelmäßig bestimmt werden, und das Medikament sollte abgesetzt werden, wenn die Lipidreaktion nach drei Monaten Therapie unzureichend ist.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Langzeitstudien wurden an Ratten mit der 0,2- und 1,3-fachen Exposition beim Menschen (basierend auf der AUC) durchgeführt. Die Inzidenz gutartiger Leberknoten und Leberkarzinome war bei männlichen Ratten mit hoher Dosis signifikant erhöht. Die Inzidenz von Leberkarzinomen nahm auch bei Männern mit niedriger Dosis zu, aber dieser Anstieg war statistisch nicht signifikant (p = 0,1). Männliche Ratten zeigten eine dosisabhängige und statistisch signifikante Zunahme gutartiger Leydig-Zell-Tumoren. Die weiblichen Ratten mit der höheren Dosis hatten einen signifikanten Anstieg der kombinierten Inzidenz gutartiger und bösartiger Leberneoplasmen.
An Mäusen wurden Langzeitstudien mit der 0,1- und 0,7-fachen Exposition beim Menschen (basierend auf der AUC) durchgeführt. Es gab keine statistisch signifikanten Unterschiede zu den Kontrollen in Bezug auf das Auftreten von Lebertumoren, aber die getesteten Dosen waren niedriger als die, die sich mit anderen Fibraten als krebserregend herausstellten.
Elektronenmikroskopische Studien haben eine floride hepatische Peroxisom-Proliferation nach Verabreichung von LOPID an männliche Ratten gezeigt. Beim Menschen wurde keine adäquate Studie zum Testen der Peroxisom-Proliferation durchgeführt, aber es wurden Veränderungen in der Peroxisom-Morphologie beobachtet. Es wurde gezeigt, dass eine Peroxisom-Proliferation bei Menschen mit einem von zwei anderen Arzneimitteln der Fibrate-Klasse auftritt, wenn Leberbiopsien vor und nach der Behandlung bei demselben Individuum verglichen wurden.
Die 10-wöchige Verabreichung der etwa 2-fachen Humandosis (bezogen auf die Oberfläche) an männliche Ratten führte zu einer dosisabhängigen Abnahme der Fertilität. Nachfolgende Studien zeigten, dass sich dieser Effekt nach einer drogenfreien Zeit von etwa acht Wochen umkehrte und nicht auf die Nachkommen übertragen wurde.
Schwangerschaft
Es wurde gezeigt, dass LOPID 300 mg bei Ratten und Kaninchen bei Dosen zwischen dem 0,5- und 3-fachen der menschlichen Dosis (basierend auf der Oberfläche) unerwünschte Wirkungen hervorruft. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. LOPID 300 mg sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Die Verabreichung von 300 mg LOPID an weibliche Ratten in der doppelten menschlichen Dosis (basierend auf der Oberfläche) vor und während der Trächtigkeit verursachte eine dosisabhängige Abnahme der Empfängnisrate, eine Zunahme der Totgeburten und eine leichte Verringerung des Gewichts der Jungtiere während der Laktation. Es gab auch dosisabhängig erhöhte Skelettvariationen. Anophthalmie trat auf, aber selten.
Die Verabreichung der 0,6- und 2-fachen Humandosis (basierend auf der Oberfläche) von LOPID an weibliche Ratten vom 15. Trächtigkeitstag bis zum Absetzen verursachte eine dosisabhängige Abnahme des Geburtsgewichts und eine Unterdrückung des Jungtierwachstums während der Laktation.
Die Verabreichung der 1- und 3-fachen menschlichen Dosis (basierend auf der Oberfläche) von LOPID 300 mg an weibliche Kaninchen während der Organogenese verursachte eine dosisabhängige Abnahme der Wurfgröße und bei der hohen Dosis eine erhöhte Inzidenz von Parietalknochenvariationen.
Stillende Mutter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden und aufgrund des in Tierversuchen für LOPID nachgewiesenen tumorerzeugenden Potenzials sollte eine Entscheidung getroffen werden, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist.
Hämatologische Veränderungen
Nach Beginn der LOPID-Therapie wurde bei gelegentlichen Patienten eine leichte Abnahme von Hämoglobin, Hämatokrit und weißen Blutkörperchen beobachtet. Diese Spiegel stabilisieren sich jedoch während einer Langzeitverabreichung. Selten wurde über schwere Anämie, Leukopenie, Thrombozytopenie und Knochenmarkshypoplasie berichtet.
Daher werden regelmäßige Blutbildkontrollen während der ersten 12 Monate der Verabreichung von LOPID 300 mg empfohlen.
Leberfunktion
Abnormale Leberfunktionstests wurden gelegentlich während der LOPID-Verabreichung beobachtet, einschließlich Erhöhungen von AST, ALT, LDH, Bilirubin und alkalischer Phosphatase. Diese sind normalerweise reversibel, wenn LOPID 300 mg abgesetzt wird. Daher werden regelmäßige Leberfunktionsstudien empfohlen und die Behandlung mit LOPID 300 mg sollte beendet werden, wenn Anomalien bestehen bleiben.
Nierenfunktion
Es gab Berichte über eine Verschlechterung der Niereninsuffizienz nach zusätzlicher LOPID-Therapie bei Personen mit einem Plasma-Kreatinin-Ausgangswert von > 2,0 mg/dl. Bei solchen Patienten sollte die Anwendung einer alternativen Therapie gegen die Risiken und den Nutzen einer niedrigeren LOPID-Dosis abgewogen werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
ÜBERDOSIS
Es wurden Fälle von Überdosierung mit LOPID gemeldet. In einem Fall erholte sich ein 7-jähriges Kind nach der Einnahme von bis zu 9 Gramm LOPID. Als Symptome einer Überdosierung wurden Bauchkrämpfe, abnorme Leberfunktionstests, Durchfall, erhöhte CPK, Gelenk- und Muskelschmerzen, Übelkeit und Erbrechen berichtet. Im Falle einer Überdosierung sollten symptomatische unterstützende Maßnahmen ergriffen werden.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
LOPID ist ein lipidregulierendes Mittel, das die Serumtriglyceride und das Cholesterin von Lipoproteinen sehr niedriger Dichte (VLDL) senkt und das Cholesterin von Lipoproteinen hoher Dichte (HDL) erhöht. Während unter der Therapie mit LOPID 300 mg ein mäßiger Rückgang des Gesamtcholesterins und des LDL-Cholesterins beobachtet werden kann, führt die Behandlung von Patienten mit erhöhten Triglyceriden aufgrund einer Typ-IV-Hyperlipoproteinämie häufig zu einem Anstieg des LDL-Cholesterins. LDL-Cholesterinspiegel bei Typ-IIb-Patienten mit Erhöhungen sowohl des Serum-LDL-Cholesterins als auch der Triglyceride werden im Allgemeinen nur minimal durch die Behandlung mit LOPID 300 mg beeinflusst; LOPID 300 mg erhöht jedoch normalerweise das HDL-Cholesterin in dieser Gruppe signifikant. LOPID 300 mg erhöht die Spiegel der High Density Lipoprotein (HDL) Subfraktionen HDL2 und HDL3 sowie der Apolipoproteine AI und AII. Epidemiologische Studien haben gezeigt, dass sowohl niedriges HDL-Cholesterin als auch hohes LDL-Cholesterin unabhängige Risikofaktoren für koronare Herzkrankheiten sind.
In der Primärpräventionskomponente der Helsinki Heart Study, in der 4081 männliche Patienten im Alter zwischen 40 und 55 randomisiert, doppelblind und placebokontrolliert untersucht wurden, war die Therapie mit LOPID 300 mg mit einer signifikanten Verringerung der Gesamttriglyceride im Plasma verbunden und eine signifikante Erhöhung des Lipoproteincholesterins hoher Dichte. Moderate Reduktionen des Gesamtplasmacholesterins und des Low-Density-Lipoproteincholesterins wurden für die LOPID-Behandlungsgruppe als Ganzes beobachtet, aber die Lipidreaktion war heterogen, insbesondere bei verschiedenen Fredrickson-Typen. An der Studie nahmen Probanden mit Serum-Non-HDL-Cholesterin von über 200 mg/dL und ohne koronare Herzkrankheit in der Vorgeschichte teil. Während der fünfjährigen Studiendauer erlebte die LOPID 300 mg-Gruppe eine 1,4 %ige absolute (34 % relative) Reduktion der Rate schwerer koronarer Ereignisse (plötzlicher Herztod sowie tödliche und nicht tödliche Myokardinfarkte) im Vergleich zu Placebo, p = 0,04 (siehe Tabelle I). Im Vergleich zu Placebo gab es eine relative Verringerung der Rate nicht tödlicher Myokardinfarkte um 37 %, was einem behandlungsbedingten Unterschied von 13,1 Ereignissen pro tausend Personen entspricht. Todesfälle jeglicher Ursache während des doppelblinden Teils der Studie beliefen sich auf insgesamt 44 (2,2 %) in der Randomisierungsgruppe mit LOPID 300 mg und 43 (2,1 %) in der Placebogruppe.
Unter den Fredrickson-Typen trat während des 5-jährigen doppelblinden Teils der Primärpräventionskomponente der Helsinki Heart Study die größte Verringerung der Inzidenz schwerwiegender koronarer Ereignisse bei Typ-IIb-Patienten auf, die sowohl eine Erhöhung des LDL-Cholesterins als auch des Gesamtplasmaspiegels aufwiesen Triglyceride. Diese Untergruppe der Typ-IIb-Gemfibrozil-Gruppenpatienten hatte zu Studienbeginn einen niedrigeren mittleren HDL-Cholesterinspiegel als die Typ-IIa-Untergruppe, die erhöhte LDL-Cholesterinwerte und normale Plasmatriglyzeride aufwies. Der mittlere Anstieg des HDL-Cholesterins bei den Typ-IIb-Patienten in dieser Studie betrug 12,6 % im Vergleich zu Placebo. Die mittlere Veränderung des LDL-Cholesterins bei Typ-IIb-Patienten betrug –4,1 % mit LOPID im Vergleich zu einem Anstieg von 3,9 % in der Placebo-Untergruppe. Die Patienten mit Typ IIb in der Helsinki Heart Study hatten 26 weniger koronare Ereignisse pro tausend Personen über fünf Jahre in der Gemfibrozil-Gruppe im Vergleich zu Placebo. Der Unterschied bei koronaren Ereignissen war zwischen LOPID 300 mg und Placebo für diese Untergruppe von Patienten mit der Trias LDL-Cholesterin > 175 mg/dl (> 4,5 mmol), Triglyceride > 200 mg/dl (> 2,2 mmol) und HDL wesentlich größer -Cholesterin
Weitere Informationen sind aus einer 3,5-jährigen (kumulativen 8,5-jährigen) Nachbeobachtung aller Probanden verfügbar, die an der Helsinki-Herzstudie teilgenommen hatten. Nach Abschluss der Helsinki Heart Study konnten die Probanden entscheiden, LOPID zu erhalten, zu beenden oder fortzusetzen; ohne Kenntnis ihrer eigenen Lipidwerte oder einer doppelblinden Behandlung begannen 60 % der ursprünglich auf Placebo randomisierten Patienten die Therapie mit LOPID 300 mg und 60 % der ursprünglich auf LOPID randomisierten Patienten setzten die Behandlung fort. Etwa 6,5 Jahre nach der Randomisierung wurden alle Patienten über ihre ursprüngliche Behandlungsgruppe und ihre Lipidwerte während der fünfjährigen Doppelblindbehandlung informiert. Nach weiteren elektiven Änderungen des LOPID-Behandlungsstatus nahmen 61 % der Patienten in der ursprünglich für LOPID randomisierten Gruppe Medikamente ein; in der Gruppe, die ursprünglich auf Placebo randomisiert wurde, nahmen 65 % LOPID ein. Die Ereignisrate pro 1000, die während des offenen Nachbeobachtungszeitraums auftrat, ist in Tabelle II aufgeführt.
Die kumulative Sterblichkeit über 8,5 Jahre zeigte einen 20 %igen relativen Überschuss an Todesfällen in der ursprünglich auf LOPID 300 mg randomisierten Gruppe im Vergleich zur ursprünglich randomisierten Placebogruppe und eine 20 %ige relative Abnahme kardialer Ereignisse in der ursprünglich auf LOPID 300 mg randomisierten Gruppe im Vergleich zur ursprünglich randomisierten Placebogruppe (siehe Tabelle III). Diese Analyse der ursprünglich randomisierten „Intent-to-treat“-Population vernachlässigt die möglichen komplizierenden Auswirkungen eines Behandlungswechsels während der Open-Label-Phase. Eine Anpassung der Hazard Ratios unter Berücksichtigung des Open-Label-Behandlungsstatus von den Jahren 6,5 bis 8,5 könnte die berichteten Hazard Ratios für die Mortalität in Richtung Eins verändern.
Es ist nicht klar, inwieweit die Ergebnisse der Primärpräventionskomponente der Helsinki Heart Study auf andere nicht untersuchte Segmente der dyslipidämischen Bevölkerung extrapoliert werden können (z. B. Frauen, jüngere oder ältere Männer oder solche mit ausschließlich auf HDL beschränkten Lipidanomalien -Cholesterin) oder anderen lipidverändernden Arzneimitteln.
Die Sekundärpräventionskomponente der Helsinki Heart Study wurde über fünf Jahre parallel und an denselben Zentren in Finnland bei 628 Männern mittleren Alters durchgeführt, die von der Primärpräventionskomponente der Helsinki Heart Study aufgrund einer Vorgeschichte von Angina pectoris, Myokardinfarkt, oder unerklärliche EKG-Veränderungen. Der primäre Wirksamkeitsendpunkt der Studie waren kardiale Ereignisse (die Summe aus tödlichen und nicht tödlichen Myokardinfarkten und plötzlichem Herztod). Die Hazard Ratio (LOPID:Placebo) für kardiale Ereignisse betrug 1,47 (95 % Konfidenzgrenzen 0,88–2,48, p=0,14). Von den 35 Patienten in der LOPID-300-mg-Gruppe, bei denen kardiale Ereignisse auftraten, erlitten 12 Patienten Ereignisse nach Abbruch der Studie. Von den 24 Patienten in der Placebogruppe mit kardialen Ereignissen erlitten 4 Patienten Ereignisse nach Abbruch der Studie. Es gab 17 Herztode in der LOPID-Gruppe und 8 in der Placebo-Gruppe (Hazard Ratio 2,18; 95 % Konfidenzgrenzen 0,94–5,05, p = 0,06). Zehn dieser Todesfälle in der LOPID-Gruppe und 3 in der Placebo-Gruppe traten nach Absetzen der Therapie auf. In dieser Studie an Patienten mit bekannter oder vermuteter koronarer Herzkrankheit wurde kein Vorteil der Behandlung mit LOPID 300 mg bei der Verringerung von Herzereignissen oder Herztod beobachtet. Daher hat LOPID 300 mg nur bei ausgewählten dyslipidämischen Patienten ohne vermutete oder nachgewiesene koronare Herzkrankheit einen Nutzen gezeigt. Selbst bei Patienten mit koronarer Herzkrankheit und der Trias aus erhöhtem LDL-Cholesterin, erhöhten Triglyceriden plus niedrigem HDL-Cholesterin ist die mögliche Wirkung von LOPID auf koronare Ereignisse nicht ausreichend untersucht worden.
Während des Coronary Drug Project wurde mit dem chemisch und pharmakologisch verwandten Medikament Clofibrat keine Wirksamkeit bei Patienten mit bestehender koronarer Herzkrankheit beobachtet. Das Coronary Drug Project war eine 6-jährige randomisierte, doppelblinde Studie mit 1000 Clofibrat-, 1000 Nicotinsäure- und 3000 Placebo-Patienten mit bekannter koronarer Herzkrankheit. Eine klinisch und statistisch signifikante Reduktion von Myokardinfarkten wurde in der Gruppe mit gleichzeitiger Nikotinsäure im Vergleich zu Placebo beobachtet; Mit Clofibrat wurde keine Reduktion beobachtet.
Der Wirkmechanismus von Gemfibrozil ist nicht eindeutig geklärt. Beim Menschen wurde gezeigt, dass LOPID 300 mg die periphere Lipolyse hemmt und die hepatische Extraktion freier Fettsäuren verringert, wodurch die hepatische Triglyceridproduktion reduziert wird. LOPID 300 mg hemmt die Synthese und erhöht die Clearance des VLDL-Trägers Apolipoprotein B, was zu einer Abnahme der VLDL-Produktion führt.
Tierversuche deuten darauf hin, dass Gemfibrozil zusätzlich zur Erhöhung des HDL-Cholesterins den Einbau langkettiger Fettsäuren in neu gebildete Triglyceride verringern, den Umsatz und die Entfernung von Cholesterin aus der Leber beschleunigen und die Ausscheidung von Cholesterin im Stuhl erhöhen kann. LOPID 300 mg wird nach oraler Verabreichung gut aus dem Magen-Darm-Trakt resorbiert. Maximale Plasmaspiegel treten nach 1 bis 2 Stunden mit einer Plasmahalbwertszeit von 1,5 Stunden nach Mehrfachgabe auf.
Gemfibrozil wird nach oraler Gabe von LOPID 300 mg Tabletten vollständig resorbiert und erreicht 1 bis 2 Stunden nach der Einnahme maximale Plasmakonzentrationen. Die Pharmakokinetik von Gemfibrozil wird durch den Zeitpunkt der Mahlzeiten relativ zum Zeitpunkt der Einnahme beeinflusst. In einer Studie (Ref. 4) wurden sowohl die Geschwindigkeit als auch das Ausmaß der Resorption des Arzneimittels signifikant erhöht, wenn es 0,5 Stunden vor den Mahlzeiten verabreicht wurde. Die durchschnittliche AUC wurde um 14–44 % reduziert, wenn LOPID nach den Mahlzeiten verabreicht wurde, verglichen mit 0,5 Stunden vor den Mahlzeiten. In einer nachfolgenden Studie war die Absorptionsrate von LOPID 300 mg maximal, wenn es 0,5 Stunden vor den Mahlzeiten verabreicht wurde, wobei die Cmax 50–60 % höher war als bei Verabreichung entweder zu den Mahlzeiten oder auf nüchternen Magen. In dieser Studie gab es keine signifikanten Auswirkungen auf die AUC des Zeitpunkts der Dosis relativ zu den Mahlzeiten (siehe DOSIERUNG UND ANWENDUNG ).
LOPID unterliegt hauptsächlich der Oxidation einer Ringmethylgruppe, um nacheinander einen Hydroxymethyl- und einen Carboxyl-Metaboliten zu bilden. Ungefähr siebzig Prozent der verabreichten Dosis beim Menschen werden im Urin ausgeschieden, hauptsächlich als Glucuronid-Konjugat, wobei weniger als 2 % als unverändertes Gemfibrozil ausgeschieden werden. Sechs Prozent der Dosis werden im Kot bilanziert. Gemfibrozil wird stark an Plasmaproteine gebunden und es besteht die Möglichkeit von Verdrängungswechselwirkungen mit anderen Arzneimitteln (siehe VORSICHTSMASSNAHMEN ).
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN und VORSICHTSMASSNAHMEN Abschnitte.