Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Zocor und wie wird es angewendet?
Zocor (Simvastatin) ist ein verschreibungspflichtiges Medikament, das zur Senkung des „schlechten“ Cholesterins (Low-Density-Lipoprotein oder LDL) und zur Erhöhung des „guten“ Cholesterins (High-Density-Lipoprotein oder HDL) und zur Senkung des Triglycerinspiegels angewendet wird das Risiko von Schlaganfällen und Herzinfarkten reduzieren. Zocor kann allein oder zusammen mit anderen Medikamenten angewendet werden.
Zocor gehört zu einer Klasse von Arzneimitteln, die Lipidsenker, Statine und HMG-CoA-Reduktase-Hemmer genannt werden.
Es ist nicht bekannt, ob Zocor bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Zocor haben?
Zocor 20 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Zocor gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Zocor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
ZOCOR (Simvastatin) ist ein Lipidsenker, der synthetisch aus einem Fermentationsprodukt von Aspergillus terreus gewonnen wird. Nach oraler Einnahme wird Simvastatin, ein inaktives Lacton, in die entsprechende β-Hydroxysäure-Form hydrolysiert. Dies ist ein Inhibitor der 3-Hydroxy-3-methylglutaryl-Coenzym A (HMG-CoA)-Reduktase. Dieses Enzym katalysiert die Umwandlung von HMG-CoA in Mevalonat, was ein früher und geschwindigkeitsbestimmender Schritt in der Biosynthese von Cholesterin ist.
Simvastatin ist Butansäure, 2,2-Dimethyl-,1,2,3,7,8,8a-hexahydro-3,7-dimethyl-8-[2-(tetrahydro-4hydroxy-6-oxo-2H-pyran- 2-yl)-ethyl]-1-naphthalinylester, [1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]. Die empirische Formel von Simvastatin ist C25H38O5 und sein Molekulargewicht beträgt 418,57. Seine Strukturformel lautet:
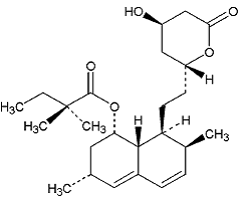
Simvastatin ist ein weißes bis cremefarbenes, nicht hygroskopisches, kristallines Pulver, das praktisch unlöslich in Wasser und frei löslich in Chloroform, Methanol und Ethanol ist.
Tabletten ZOCOR zur oralen Verabreichung enthalten entweder 5 mg, 10 mg, 20 mg, 40 mg oder 80 mg Simvastatin und die folgenden Hilfsstoffe: Ascorbinsäure, Zitronensäure, Hydroxypropylcellulose, Hypromellose, Eisenoxide, Lactose, Magnesiumstearat, mikrokristalline Cellulose , Stärke, Talk und Titandioxid. Als Konservierungsmittel wird butyliertes Hydroxyanisol zugesetzt.
INDIKATIONEN
Die Therapie mit lipidverändernden Wirkstoffen sollte nur ein Bestandteil einer Intervention mit mehreren Risikofaktoren bei Personen mit einem signifikant erhöhten Risiko für atherosklerotische Gefäßerkrankungen aufgrund von Hypercholesterinämie sein. Eine medikamentöse Therapie ist zusätzlich zur Diät indiziert, wenn das Ansprechen auf eine auf gesättigte Fettsäuren und Cholesterin beschränkte Diät und andere nicht-pharmakologische Maßnahmen allein unzureichend war. Bei Patienten mit koronarer Herzkrankheit (KHK) oder hohem KHK-Risiko kann ZOCOR® gleichzeitig mit einer Diät begonnen werden.
Verringerung des Risikos von KHK-Mortalität und kardiovaskulären Ereignissen
Bei Patienten mit hohem Risiko für koronare Ereignisse aufgrund bestehender koronarer Herzkrankheit, Diabetes, peripherer Gefäßerkrankung, Schlaganfall in der Anamnese oder anderer zerebrovaskulärer Erkrankungen ist ZOCOR 5 mg angezeigt für:
Hyperlipidämie
ZOCOR ist angezeigt für:
Jugendliche Patienten mit heterozygoter familiärer Hypercholesterinämie (HeFH)
ZOCOR ist indiziert als Ergänzung zu einer Diät zur Senkung der Gesamt-C-, LDL-C- und Apo-B-Spiegel bei heranwachsenden Jungen und Mädchen im Alter von mindestens 1 Jahr nach der Menarche im Alter von 10 bis 17 Jahren mit HeFH, falls nach einer adäquater Versuch einer Ernährungstherapie folgende Befunde vorliegen:
Das Mindestziel der Behandlung bei pädiatrischen und jugendlichen Patienten ist das Erreichen eines mittleren LDL-C
Nutzungsbeschränkungen
ZOCOR 20 mg wurde nicht bei Erkrankungen untersucht, bei denen die Hauptanomalie eine Erhöhung der Chylomikronen ist (dh Hyperlipidämie Typ I und V nach Fredrickson).
DOSIERUNG UND ANWENDUNG
Empfohlene Dosierung
Der übliche Dosierungsbereich beträgt 5 bis 40 mg/Tag. Bei Patienten mit KHK oder hohem KHK-Risiko kann ZOCOR gleichzeitig mit einer Diät begonnen werden. Die empfohlene übliche Anfangsdosis beträgt 10 oder 20 mg einmal täglich abends. Bei Patienten mit hohem Risiko für ein KHK-Ereignis aufgrund bestehender KHK, Diabetes, peripherer Gefäßerkrankung, Schlaganfall in der Vorgeschichte oder anderer zerebrovaskulärer Erkrankungen beträgt die empfohlene Anfangsdosis 40 mg/Tag. Lipidbestimmungen sollten nach 4 Wochen Therapie und danach in regelmäßigen Abständen durchgeführt werden.
Beschränkte Dosierung für 80 mg
Aufgrund des erhöhten Myopathierisikos, einschließlich Rhabdomyolyse, insbesondere im ersten Behandlungsjahr, sollte die Anwendung der 80-mg-Dosis von ZOCOR auf Patienten beschränkt werden, die Simvastatin 80 mg chronisch (z. B. über 12 Monate oder länger) eingenommen haben. ohne Anzeichen von Muskeltoxizität [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten, die derzeit die 80-mg-Dosis von ZOCOR vertragen und bei denen eine Behandlung mit einem Wechselwirkungsmedikament eingeleitet werden muss, das kontraindiziert ist oder mit einer Dosisobergrenze für Simvastatin verbunden ist, sollten auf ein alternatives Statin mit geringerem Potenzial für Arzneimittelwechselwirkungen umgestellt werden.
Aufgrund des erhöhten Myopathierisikos, einschließlich Rhabdomyolyse, das mit der 80-mg-Dosis von ZOCOR 40 mg verbunden ist, sollten Patienten, die ihr LDL-C-Ziel mit der 40-mg-Dosis von ZOCOR 5 mg nicht erreichen können, nicht auf die 80-mg-Dosis titriert werden , sollte jedoch auf alternative LDL-C-senkende Behandlung(en) gesetzt werden, die eine stärkere LDL-C-Senkung bewirken.
Gleichzeitige Verabreichung mit anderen Arzneimitteln
Patienten, die Verapamil, Diltiazem oder Dronedaron einnehmen
Patienten, die Amiodaron, Amlodipin oder Ranolazin einnehmen
Patienten mit homozygoter familiärer Hypercholesterinämie
Die empfohlene Dosierung beträgt 40 mg/Tag am Abend [Siehe DOSIERUNG UND ANWENDUNG , Beschränkte Dosierung für 80 mg ]. ZOCOR 5 mg sollte bei diesen Patienten zusätzlich zu anderen lipidsenkenden Behandlungen (z. B. LDL-Apherese) angewendet werden oder wenn solche Behandlungen nicht verfügbar sind.
Die Simvastatin-Exposition wird bei gleichzeitiger Anwendung von Lomitapid ungefähr verdoppelt; daher sollte die ZOCOR-Dosis um 50 % reduziert werden, wenn mit Lomitapid begonnen wird. Die Dosierung von ZOCOR 5 mg sollte 20 mg/Tag (oder 40 mg/Tag für Patienten, die zuvor ZOCOR 80 mg/Tag chronisch eingenommen haben, z. B. 12 Monate oder länger, ohne Anzeichen einer Muskeltoxizität) während der Einnahme von Lomitapid nicht überschreiten.
Jugendliche (10–17 Jahre) mit heterozygoter familiärer Hypercholesterinämie
Die empfohlene übliche Anfangsdosis beträgt 10 mg einmal täglich abends. Der empfohlene Dosierungsbereich beträgt 10 bis 40 mg/Tag; Die empfohlene Höchstdosis beträgt 40 mg/Tag. Die Dosen sollten gemäß dem empfohlenen Therapieziel individualisiert werden [siehe Richtlinien des NCEP-Pädiatriegremiums1 und Klinische Studien ]. Anpassungen sollten in Abständen von mindestens 4 Wochen vorgenommen werden.
Patienten mit eingeschränkter Nierenfunktion
Da ZOCOR 5 mg keiner signifikanten renalen Ausscheidung unterliegt, sollte eine Dosisanpassung bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung nicht erforderlich sein. Es ist jedoch Vorsicht geboten, wenn ZOCOR 20 mg Patienten mit schwerer Nierenfunktionsstörung verabreicht wird; solche Patienten sollten mit 5 mg/Tag begonnen und engmaschig überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
Lagerung und Handhabung
Nr. 8146 - Tabletten ZOCOR 10 mg sind pfirsichfarbene, ovale Filmtabletten mit der Kodierung MSD 735 auf der einen Seite und glatt auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 0006-0735-31 Verwendungseinheit Flaschen zu 30 NDC 0006-0735-54 Verwendungseinheit Flaschen zu 90.
Nr. 8147 - Tabletten ZOCOR 20 mg sind hellbraune, ovale Filmtabletten mit der Kodierung MSD 740 auf der einen Seite und glatt auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 0006-0740-31 Verwendungseinheit Flaschen zu 30 NDC 0006-0740-54 Verwendungseinheit Flaschen zu 90.
Nr. 8148 - Tabletten ZOCOR 40 mg sind ziegelrote, ovale Filmtabletten mit der Kodierung MSD 749 auf der einen Seite und glatt auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 0006-0749-31 Verwendungseinheit Flaschen zu 30 NDC 0006-0749-54 Verwendungseinheit Flaschen zu 90.
Nr. 6577 - Tabletten ZOCOR 80 mg sind ziegelrote, kapselförmige Filmtabletten mit der Kodierung 543 auf der einen und 80 auf der anderen Seite. Sie werden wie folgt geliefert:
NDC 0006-0543-31 Verwendungseinheit Flaschen zu 30 NDC 0006-0543-54 Verwendungseinheit Flaschen zu 90.
Lagerung
Zwischen 5-30°C (41-86°F) lagern.
1Nationales Cholesterin-Aufklärungsprogramm (NCEP): Höhepunkte des Berichts des Expertengremiums für Blutcholesterinspiegel bei Kindern und Jugendlichen. Pädiatrie. 89(3):495-501. 1992.
Hergestellt von: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, UK NE23 3JU. Überarbeitet: September 2020
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
In den vor Markteinführung kontrollierten klinischen Studien und ihren offenen Verlängerungen (2.423 Patienten mit einer medianen Nachbeobachtungszeit von etwa 18 Monaten) wurde die Behandlung bei 1,4 % der Patienten aufgrund von Nebenwirkungen abgebrochen. Die häufigsten Nebenwirkungen, die zu einem Behandlungsabbruch führten, waren: Magen-Darm-Beschwerden (0,5 %), Myalgie (0,1 %) und Arthralgie (0,1 %). Die am häufigsten berichteten Nebenwirkungen (Inzidenz ≥ 5 %) in Simvastatin-kontrollierten klinischen Studien waren: Infektionen der oberen Atemwege (9,0 %), Kopfschmerzen (7,4 %), Bauchschmerzen (7,3 %), Verstopfung (6,6 %) und Übelkeit (5.4 %).
Skandinavische Simvastatin-Überlebensstudie
In 4S mit 4.444 (Altersspanne 35–71 Jahre, 19 % Frauen, 100 % Kaukasier), die mit 20–40 mg/Tag ZOCOR (n = 2.221) oder Placebo (n = 2.223) über einen medianen Zeitraum von 5,4 Jahren behandelt wurden, Nebenwirkungen Reaktionen, die bei ≥ 2 % der Patienten und mit einer höheren Häufigkeit als unter Placebo berichtet wurden, sind in Tabelle 2 aufgeführt.
Herzschutzstudie
In der Heart Protection Study (HPS) mit 20.536 Patienten (Altersgruppe 40-80 Jahre, 25 % Frauen, 97 % Kaukasier, 3 % andere Rassen), die mit ZOCOR 40 mg/Tag (n = 10.269) oder Placebo (n = 10.267) wurden im Mittel über 5 Jahre nur schwerwiegende Nebenwirkungen und Abbrüche aufgrund von Nebenwirkungen verzeichnet. Die Abbruchraten aufgrund von Nebenwirkungen betrugen 4,8 % bei mit ZOCOR 10 mg behandelten Patienten im Vergleich zu 5,1 % bei mit Placebo behandelten Patienten. Die Inzidenz von Myopathie/Rhabdomyolyse betrug
Andere klinische Studien
In einer klinischen Studie, in der 12.064 Patienten mit Myokardinfarkt in der Vorgeschichte mit ZOCOR behandelt wurden (mittlere Nachbeobachtungszeit 6,7 Jahre), wurde die Inzidenz von Myopathie (definiert als unerklärliche Muskelschwäche oder Schmerzen mit einer Serum-Kreatinkinase [CK] > 10-fach Obergrenze des Normalwerts [ULN]) bei Patienten unter 80 mg/Tag etwa 0,9 % im Vergleich zu 0,02 % bei Patienten unter 20 mg/Tag. Die Inzidenz von Rhabdomyolyse (definiert als Myopathie mit einer CK > 40-facher ULN) bei Patienten unter 80 mg/Tag betrug etwa 0,4 % im Vergleich zu 0 % bei Patienten unter 20 mg/Tag. Die Inzidenz von Myopathie, einschließlich Rhabdomyolyse, war im ersten Jahr am höchsten und nahm dann in den folgenden Behandlungsjahren deutlich ab. In dieser Studie wurden die Patienten sorgfältig überwacht und einige Arzneimittel mit Wechselwirkungen wurden ausgeschlossen.
Andere in klinischen Studien berichtete Nebenwirkungen waren: Durchfall, Hautausschlag, Dyspepsie, Flatulenz und Asthenie.
Labortests
Deutliche anhaltende Anstiege der hepatischen Transaminasen wurden festgestellt [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Erhöhte alkalische Phosphatase und γ-Glutamyl-Transpeptidase wurden ebenfalls berichtet. Etwa 5 % der Patienten hatten bei einer oder mehreren Gelegenheiten Erhöhungen der CK-Spiegel um das 3-fache oder mehr des Normalwerts. Dies war auf die nichtkardiale Fraktion von CK zurückzuführen. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Jugendliche Patienten (Alter 10-17 Jahre)
In einer 48-wöchigen, kontrollierten Studie mit heranwachsenden Jungen und Mädchen im Alter von mindestens 1 Jahr nach der Menarche im Alter von 10 bis 17 Jahren (43,4 % Frauen, 97,7 % Kaukasier, 1,7 % Hispanoamerikaner, 0,6 % Mischlinge) mit heterozygoter familiärer Hypercholesterinämie (n = 175), die mit Placebo oder ZOCOR (10-40 mg täglich) behandelt wurden, waren die häufigsten Nebenwirkungen, die in beiden Gruppen beobachtet wurden, Infektionen der oberen Atemwege, Kopfschmerzen, Bauchschmerzen und Übelkeit [siehe Verwendung in bestimmten Bevölkerungsgruppen und Klinische Studien ].
Postmarketing-Erfahrung
Da die nachstehenden Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet wurden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Die folgenden zusätzlichen Nebenwirkungen wurden während der Anwendung von Simvastatin nach der Zulassung festgestellt: Juckreiz, Alopezie, verschiedene Hautveränderungen (z. B. Knötchen, Verfärbung, trockene Haut/Schleimhäute, Veränderungen an Haaren/Nägeln), Schwindel, Muskelkrämpfe, Myalgie , Pankreatitis, Parästhesie, periphere Neuropathie, Erbrechen, Anämie, erektile Dysfunktion, interstitielle Lungenerkrankung, Rhabdomyolyse, Hepatitis/Gelbsucht, tödliches und nicht tödliches Leberversagen und Depression.
Es gab seltene Berichte über eine immunvermittelte nekrotisierende Myopathie im Zusammenhang mit der Anwendung von Statinen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Selten wurde über ein scheinbares Überempfindlichkeitssyndrom berichtet, das einige der folgenden Merkmale aufwies: Anaphylaxie, Angioödem, Lupus erythematöses Syndrom, Polymyalgia rheumatica, Dermatomyositis, Vaskulitis, Purpura, Thrombozytopenie, Leukopenie, hämolytische Anämie, positive ANA, ESR-Anstieg, Eosinophilie , Arthritis, Arthralgie, Urtikaria, Asthenie, Lichtempfindlichkeit, Fieber, Schüttelfrost, Hitzegefühl, Unwohlsein, Dyspnoe, toxische epidermale Nekrolyse, Erythema multiforme, einschließlich Stevens-Johnson-Syndrom.
Nach der Markteinführung gab es seltene Berichte über kognitive Beeinträchtigungen (z. B. Gedächtnisverlust, Vergesslichkeit, Amnesie, Gedächtnisstörungen, Verwirrtheit) im Zusammenhang mit der Anwendung von Statinen. Diese kognitiven Probleme wurden für alle Statine berichtet. Die Berichte sind im Allgemeinen nicht schwerwiegend und nach Absetzen des Statins reversibel, mit unterschiedlichen Zeiten bis zum Auftreten der Symptome (1 Tag bis Jahre) und zum Abklingen der Symptome (Median von 3 Wochen).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Starke CYP3A4-Hemmer, Cyclosporin oder Danazol
Starke CYP3A4-Inhibitoren: Simvastatin ist wie mehrere andere Inhibitoren der HMG-CoA-Reduktase ein Substrat von CYP3A4. Simvastatin wird durch CYP3A4 metabolisiert, hat aber keine CYP3A4-hemmende Wirkung; daher ist nicht zu erwarten, dass es die Plasmakonzentrationen anderer Arzneimittel, die durch CYP3A4 metabolisiert werden, beeinflusst.
Erhöhte Plasmaspiegel der HMG-CoA-Reduktase-Hemmaktivität erhöhen das Risiko einer Myopathie und Rhabdomyolyse, insbesondere bei höheren Dosen von Simvastatin. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ] Die gleichzeitige Anwendung von Arzneimitteln, die als stark inhibitorisch auf CYP3A4 gekennzeichnet sind, ist kontraindiziert [siehe KONTRAINDIKATIONEN ]. Wenn eine Behandlung mit Itraconazol, Ketoconazol, Posaconazol, Voriconazol, Erythromycin, Clarithromycin oder Telithromycin unvermeidlich ist, muss die Therapie mit Simvastatin während der Behandlung ausgesetzt werden.
Cyclosporin oder Danazol: Das Risiko einer Myopathie, einschließlich Rhabdomyolyse, wird durch die gleichzeitige Verabreichung von Cyclosporin oder Danazol erhöht. Daher ist die gleichzeitige Anwendung dieser Arzneimittel kontraindiziert [siehe KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Lipidsenkende Medikamente, die bei alleiniger Gabe eine Myopathie verursachen können
Gemfibrozil
Kontraindiziert mit Simvastatin [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Andere Fibrate
Bei der Verschreibung von Simvastatin ist Vorsicht geboten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Amiodaron, Dronedaron, Ranolazin oder Kalziumkanalblocker
Das Risiko einer Myopathie, einschließlich Rhabdomyolyse, wird durch die gleichzeitige Verabreichung von Amiodaron, Dronedaron, Ranolazin oder Kalziumkanalblockern wie Verapamil, Diltiazem oder Amlodipin erhöht [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN , und Tabelle 3 in KLINISCHE PHARMAKOLOGIE ].
Niacin
Fälle von Myopathie/Rhabdomyolyse wurden bei gleichzeitiger Anwendung von Simvastatin mit lipidmodifizierenden Dosen (≥ 1 g/Tag Niacin) von Niacin-haltigen Produkten beobachtet. Das Risiko einer Myopathie ist bei chinesischen Patienten größer. In einer klinischen Studie (mediane Nachbeobachtungszeit 3,9 Jahre) mit Patienten mit hohem Risiko für Herz-Kreislauf-Erkrankungen und gut kontrollierten LDL-C-Spiegeln unter Simvastatin 40 mg/Tag mit oder ohne Ezetimib 10 mg/Tag gab es keinen zusätzlichen Nutzen kardiovaskuläre Ergebnisse durch die Zugabe von lipidmodifizierenden Dosen (≥1 g/Tag) von Niacin. Die gleichzeitige Anwendung von ZOCOR mit lipidmodifizierenden Dosen (≥ 1 g/Tag) von Niacin wird bei chinesischen Patienten nicht empfohlen. Es ist nicht bekannt, ob dieses Risiko auch für andere asiatische Patienten gilt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Digoxin
In einer Studie führte die gleichzeitige Gabe von Digoxin mit Simvastatin zu einer leichten Erhöhung der Plasmakonzentration von Digoxin. Patienten, die Digoxin einnehmen, sollten angemessen überwacht werden, wenn mit Simvastatin begonnen wird [siehe KLINISCHE PHARMAKOLOGIE ].
Cumarin-Antikoagulanzien
In zwei klinischen Studien, eine an gesunden Probanden und die andere an Patienten mit Hypercholesterinämie, verstärkte Simvastatin 20-40 mg/Tag die Wirkung von Cumarin-Antikoagulanzien geringfügig: Die Prothrombinzeit, angegeben als International Normalized Ratio (INR), erhöhte sich von einem Ausgangswert von 1,7 bis 1,8 und von 2,6 bis 3,4 in den Probanden- bzw. Patientenstudien. Bei anderen Statinen wurde bei einigen Patienten, die gleichzeitig Cumarin-Antikoagulanzien einnahmen, über klinisch erkennbare Blutungen und/oder eine verlängerte Prothrombinzeit berichtet. Bei solchen Patienten sollte die Prothrombinzeit vor Beginn der Behandlung mit Simvastatin und häufig genug während der frühen Therapie bestimmt werden, um sicherzustellen, dass keine signifikante Veränderung der Prothrombinzeit auftritt. Sobald eine stabile Prothrombinzeit dokumentiert wurde, können die Prothrombinzeiten in den Intervallen überwacht werden, die üblicherweise für Patienten unter Cumarin-Antikoagulanzien empfohlen werden. Wenn die Dosis von Simvastatin geändert oder abgesetzt wird, sollte das gleiche Verfahren wiederholt werden. Die Behandlung mit Simvastatin wurde bei Patienten, die keine Antikoagulanzien einnahmen, nicht mit Blutungen oder Veränderungen der Prothrombinzeit in Verbindung gebracht.
Colchicin
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden bei gleichzeitiger Anwendung von Simvastatin mit Colchicin berichtet, und bei der Verschreibung von Simvastatin zusammen mit Colchicin ist Vorsicht geboten.
Daptomycin
Fälle von Rhabdomyolyse wurden unter Simvastatin in Kombination mit Daptomycin berichtet. Sowohl Simvastatin als auch Daptomycin können bei alleiniger Gabe Myopathie und Rhabdomyolyse verursachen, und das Risiko einer Myopathie und Rhabdomyolyse kann bei gleichzeitiger Anwendung erhöht sein. Setzen Sie ZOCOR bei Patienten, die Daptomycin einnehmen, vorübergehend aus [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Myopathie/Rhabdomyolyse
Simvastatin verursacht gelegentlich eine Myopathie, die sich in Muskelschmerzen, -empfindlichkeit oder -schwäche manifestiert, wobei die Kreatinkinase (CK) über dem Zehnfachen der oberen Normgrenze (ULN) liegt. Myopathie nimmt manchmal die Form einer Rhabdomyolyse mit oder ohne akutem Nierenversagen als Folge einer Myoglobinurie an, und seltene Todesfälle sind aufgetreten. Das Risiko einer Myopathie wird durch erhöhte Plasmaspiegel von Simvastatin und Simvastatinsäure erhöht. Prädisponierende Faktoren für Myopathie sind fortgeschrittenes Alter (≥65 Jahre), weibliches Geschlecht, unkontrollierte Hypothyreose und Nierenfunktionsstörung. Chinesische Patienten können ein erhöhtes Risiko für Myopathie haben [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Das Risiko einer Myopathie, einschließlich Rhabdomyolyse, ist dosisabhängig. In einer klinischen Studiendatenbank, in der 41.413 Patienten mit ZOCOR 10 mg behandelt wurden, von denen 24.747 (etwa 60 %) in Studien mit einer medianen Nachbeobachtungszeit von mindestens 4 Jahren aufgenommen wurden, betrug die Inzidenz von Myopathie etwa 0,03 % bzw. 0,08 %. bei 20 bzw. 40 mg/Tag. Die Inzidenz von Myopathie war bei 80 mg (0,61 %) unverhältnismäßig höher als bei den niedrigeren Dosen. In diesen Studien wurden die Patienten sorgfältig überwacht und einige Arzneimittel mit Wechselwirkungen wurden ausgeschlossen.
In einer klinischen Studie, in der 12.064 Patienten mit Myokardinfarkt in der Vorgeschichte mit ZOCOR behandelt wurden (mittlere Nachbeobachtungszeit 6,7 Jahre), wurde die Inzidenz von Myopathie (definiert als unerklärliche Muskelschwäche oder Schmerzen mit einer Serum-Kreatinkinase [CK] > 10-fach Obergrenze des Normalwerts [ULN]) bei Patienten unter 80 mg/Tag etwa 0,9 % im Vergleich zu 0,02 % bei Patienten unter 20 mg/Tag. Die Inzidenz von Rhabdomyolyse (definiert als Myopathie mit einer CK > 40-facher ULN) bei Patienten unter 80 mg/Tag betrug etwa 0,4 % im Vergleich zu 0 % bei Patienten unter 20 mg/Tag. Die Inzidenz von Myopathie, einschließlich Rhabdomyolyse, war im ersten Jahr am höchsten und nahm dann in den folgenden Behandlungsjahren deutlich ab. In dieser Studie wurden die Patienten sorgfältig überwacht und einige Arzneimittel mit Wechselwirkungen wurden ausgeschlossen.
Das Risiko einer Myopathie, einschließlich Rhabdomyolyse, ist bei Patienten unter Simvastatin 80 mg größer als bei anderen Statintherapien mit ähnlicher oder größerer LDL-C-senkender Wirksamkeit und im Vergleich zu niedrigeren Dosen von Simvastatin. Daher sollte die 80-mg-Dosis von ZOCOR nur stationär bei Patienten angewendet werden, die Simvastatin 80 mg chronisch (z. B. für 12 Monate oder länger) ohne Anzeichen einer Muskeltoxizität eingenommen haben [Sehen DOSIERUNG UND ANWENDUNG , Beschränkte Dosierung für 80 mg ]. Wenn jedoch ein Patient, der derzeit die 80-mg-Dosis von ZOCOR verträgt, mit einem kontraindizierten oder mit einer Dosisobergrenze für Simvastatin verbundenen Wechselwirkungsmedikament begonnen werden muss, sollte dieser Patient auf ein alternatives Statin mit geringerem Potenzial umgestellt werden Arzneimittelwechselwirkung. Die Patienten sollten auf das erhöhte Risiko einer Myopathie, einschließlich Rhabdomyolyse, hingewiesen werden und alle unerklärlichen Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich melden. Wenn Symptome auftreten, sollte die Behandlung sofort abgebrochen werden. [sehen Immunvermittelte nekrotisierende Myopathie ]
Alle Patienten, die eine Therapie mit ZOCOR 20 mg beginnen oder deren ZOCOR-Dosis erhöht wird, sollten auf das Risiko einer Myopathie, einschließlich Rhabdomyolyse, hingewiesen und aufgefordert werden, unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden, oder wenn Muskelsymptome auftreten und die Symptome bestehen nach Absetzen von ZOCOR fort. Die Behandlung mit ZOCOR sollte sofort abgebrochen werden, wenn eine Myopathie diagnostiziert oder vermutet wird. In den meisten Fällen klangen Muskelsymptome und CK-Anstiege ab, wenn die Behandlung umgehend beendet wurde. Bei Patienten, die eine Therapie mit ZOCOR 5 mg beginnen oder deren Dosis erhöht wird, können regelmäßige CK-Bestimmungen in Betracht gezogen werden, aber es gibt keine Gewissheit, dass eine solche Überwachung eine Myopathie verhindert.
Viele der Patienten, die unter der Therapie mit Simvastatin eine Rhabdomyolyse entwickelt haben, hatten eine komplizierte Krankengeschichte, einschließlich einer Niereninsuffizienz, gewöhnlich als Folge eines langjährigen Diabetes mellitus. Solche Patienten verdienen eine genauere Überwachung. Die Behandlung mit ZOCOR sollte abgebrochen werden, wenn deutlich erhöhte CPK-Spiegel auftreten oder eine Myopathie diagnostiziert oder vermutet wird. Die Behandlung mit ZOCOR sollte auch vorübergehend bei jedem Patienten ausgesetzt werden, der an einer akuten oder schweren Erkrankung leidet, die für die Entwicklung einer Niereninsuffizienz als Folge einer Rhabdomyolyse prädisponiert, z. B. Sepsis; Hypotonie; Große Operation; Trauma; schwere metabolische, endokrine oder Elektrolytstörungen; oder unkontrollierte Epilepsie.
Wechselwirkungen mit anderen Medikamenten
Das Risiko einer Myopathie und Rhabdomyolyse wird durch erhöhte Plasmaspiegel von Simvastatin und Simvastatinsäure erhöht. Simvastatin wird durch die Cytochrom-P450-Isoform 3A4 metabolisiert. Bestimmte Arzneimittel, die diesen Stoffwechselweg hemmen, können die Plasmaspiegel von Simvastatin erhöhen und das Myopathierisiko erhöhen. Dazu gehören Itraconazol, Ketoconazol, Posaconazol, Voriconazol, die Makrolid-Antibiotika Erythromycin und Clarithromycin sowie das Ketolid-Antibiotikum Telithromycin, HIV-Proteasehemmer, Boceprevir, Telaprevir, das Antidepressivum Nefazodon, Cobicistat-haltige Produkte oder Grapefruitsaft [vgl KLINISCHE PHARMAKOLOGIE ]. Die Kombination dieser Arzneimittel mit Simvastatin ist kontraindiziert. Wenn eine kurzfristige Behandlung mit starken CYP3A4-Inhibitoren unvermeidlich ist, muss die Therapie mit Simvastatin während der Behandlung ausgesetzt werden [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die kombinierte Anwendung von Simvastatin mit Gemfibrozil, Cyclosporin oder Danazol ist kontraindiziert [siehe KONTRAINDIKATIONEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Vorsicht ist geboten, wenn andere Fibrate zusammen mit Simvastatin verschrieben werden, da diese Wirkstoffe bei alleiniger Gabe eine Myopathie verursachen können und das Risiko bei gleichzeitiger Gabe erhöht ist [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden bei gleichzeitiger Anwendung von Simvastatin mit Colchicin berichtet, und bei der Verschreibung von Simvastatin zusammen mit Colchicin ist Vorsicht geboten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Der Nutzen der kombinierten Anwendung von Simvastatin mit den folgenden Arzneimitteln sollte sorgfältig gegen die potenziellen Risiken von Kombinationen abgewogen werden: andere lipidsenkende Arzneimittel (Fibrate oder, für Patienten mit HoFH, Lomitapid), Amiodaron, Dronedaron, Verapamil, Diltiazem, Amlodipin, oder Ranolazin [Siehe DOSIERUNG UND ANWENDUNG , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fälle von Myopathie, einschließlich Rhabdomyolyse, wurden bei gleichzeitiger Anwendung von Simvastatin mit lipidmodifizierenden Dosen (≥ 1 g/Tag Niacin) von Niacin-haltigen Arzneimitteln beobachtet [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Fälle von Rhabdomyolyse wurden unter Simvastatin in Kombination mit Daptomycin berichtet. Setzen Sie ZOCOR bei Patienten, die Daptomycin einnehmen, vorübergehend aus [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Verschreibungsempfehlungen für interagierende Wirkstoffe sind in Tabelle 1 zusammengefasst [siehe auch DOSIERUNG UND ANWENDUNG , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Immunvermittelte nekrotisierende Myopathie
Es gab seltene Berichte über immunvermittelte nekrotisierende Myopathie (IMNM), eine Autoimmunmyopathie, die mit der Anwendung von Statinen in Verbindung gebracht wurde. IMNM ist gekennzeichnet durch: proximale Muskelschwäche und erhöhte Serum-Kreatinkinase, die trotz Absetzen der Statinbehandlung bestehen bleiben; positiver Anti-HMG-CoA-Reduktase-Antikörper; Muskelbiopsie, die eine nekrotisierende Myopathie zeigt; und Verbesserung mit Immunsuppressiva. Zusätzliche neuromuskuläre und serologische Tests können erforderlich sein. Eine Behandlung mit Immunsuppressiva kann erforderlich sein. Wägen Sie das IMNM-Risiko sorgfältig ab, bevor Sie mit einem anderen Statin beginnen. Wenn die Therapie mit einem anderen Statin begonnen wird, ist auf Anzeichen und Symptome einer IMNM zu achten.
Leberfunktionsstörung
Anhaltende Anstiege (auf mehr als das 3-fache des ULN) der Serumtransaminasen traten bei etwa 1 % der Patienten auf, die in klinischen Studien Simvastatin erhielten. Wenn die medikamentöse Behandlung bei diesen Patienten unterbrochen oder beendet wurde, fielen die Transaminasenspiegel normalerweise langsam auf die Werte vor der Behandlung. Die Anstiege waren nicht mit Gelbsucht oder anderen klinischen Anzeichen oder Symptomen verbunden. Es gab keine Hinweise auf Überempfindlichkeit.
In der skandinavischen Simvastatin Survival Study (4S) [vgl Klinische Studien unterschied sich die Anzahl der Patienten mit mehr als einer Transaminasenerhöhung auf > 3x ULN im Verlauf der Studie nicht signifikant zwischen der Simvastatin- und der Placebogruppe (14 [0,7 %] vs. 12 [0,6 %]). Erhöhte Transaminasenwerte führten bei 8 Patienten in der Simvastatin-Gruppe (n=2.221) und bei 5 Patienten in der Placebo-Gruppe (n=2.223) zum Therapieabbruch. Von den 1.986 mit Simvastatin behandelten Patienten in 4S mit normalen Leberfunktionstests (LFTs) zu Studienbeginn entwickelten 8 (0,4 %) konsekutive LFT-Erhöhungen auf > das Dreifache des ULN und/oder wurden aufgrund von Transaminasenerhöhungen während der 5,4 Jahre (mediane Nachbeobachtungszeit) abgesetzt ) der Studie. Von diesen 8 Patienten entwickelten 5 diese Anomalien innerhalb des ersten Jahres. Alle Patienten in dieser Studie erhielten eine Anfangsdosis von 20 mg Simvastatin; 37 % wurden auf 40 mg titriert.
In 2 kontrollierten klinischen Studien mit 1.105 Patienten betrug die 12-Monats-Inzidenz einer anhaltenden Erhöhung der hepatischen Transaminasen ohne Berücksichtigung des Arzneimittelzusammenhangs 0,9 % bzw. 2,1 % bei der 40- bzw. 80-mg-Dosis. Kein Patient entwickelte nach den ersten 6 Monaten der Behandlung mit einer gegebenen Dosis anhaltende Leberfunktionsstörungen.
Es wird empfohlen, vor Behandlungsbeginn und danach, wenn klinisch indiziert, Leberfunktionstests durchzuführen. Es gab seltene Postmarketing-Berichte über tödliches und nicht tödliches Leberversagen bei Patienten, die Statine, einschließlich Simvastatin, einnahmen. Wenn während der Behandlung mit ZOCOR 5 mg eine schwere Leberschädigung mit klinischen Symptomen und/oder Hyperbilirubinämie oder Gelbsucht auftritt, ist die Behandlung unverzüglich zu unterbrechen. Wenn keine alternative Ursache gefunden wird, starten Sie ZOCOR nicht neu. Beachten Sie, dass ALT vom Muskel ausgehen kann, daher kann ein Anstieg von ALT mit CK auf eine Myopathie hinweisen [siehe Myopathie/Rhabdomyolyse ].
Das Medikament sollte bei Patienten, die erhebliche Mengen Alkohol konsumieren und/oder eine Lebererkrankung in der Vorgeschichte hatten, mit Vorsicht angewendet werden. Aktive Lebererkrankungen oder ungeklärte Transaminasenerhöhungen sind Kontraindikationen für die Anwendung von Simvastatin.
Nach einer Behandlung mit Simvastatin wurde über mäßige (weniger als das 3-fache des ULN) Anstiegs der Serumtransaminasen berichtet. Diese Veränderungen traten kurz nach Beginn der Behandlung mit Simvastatin auf, waren oft vorübergehend, gingen nicht mit Symptomen einher und erforderten keine Unterbrechung der Behandlung.
Endokrine Funktion
Bei HMG-CoA-Reduktase-Hemmern, einschließlich ZOCOR, wurde über einen Anstieg des HbA1c und des Nüchtern-Serumglukosespiegels berichtet.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 72-wöchigen Kanzerogenitätsstudie wurden Mäusen Simvastatin-Tagesdosen von 25, 100 und 400 mg/kg Körpergewicht verabreicht, was zu ungefähr 1-, 4- und 8-mal höheren mittleren Arzneimittelspiegeln im Plasma führte als die mittlere menschliche Plasmakonzentration (als Gesamthemmaktivität basierend auf AUC) nach einer oralen Dosis von 80 mg. Leberkarzinome waren bei Frauen mit hoher Dosis und Männern mit mittlerer und hoher Dosis signifikant erhöht, mit einer maximalen Inzidenz von 90 % bei Männern. Die Inzidenz von Adenomen der Leber war bei Frauen mit mittlerer und hoher Dosis signifikant erhöht. Die medikamentöse Behandlung erhöhte auch signifikant die Inzidenz von Lungenadenomen bei Männern und Frauen mit mittlerer und hoher Dosis. Adenome der Harderschen Drüse (eine Drüse des Auges von Nagetieren) waren bei Hochdosis-Mäusen signifikant häufiger als bei Kontrollen. Bei 25 mg/kg/Tag wurde kein Hinweis auf eine tumorerzeugende Wirkung beobachtet.
In einer separaten 92-wöchigen Karzinogenitätsstudie an Mäusen mit Dosen von bis zu 25 mg/kg/Tag wurden keine Hinweise auf eine tumorerzeugende Wirkung beobachtet (die mittleren Arzneimittelkonzentrationen im Plasma waren 1-mal höher als bei Menschen, die 80 mg Simvastatin erhielten, gemessen anhand der AUC).
In einer zweijährigen Studie an Ratten mit 25 mg/kg/Tag gab es einen statistisch signifikanten Anstieg der Inzidenz von follikulären Adenomen der Schilddrüse bei weiblichen Ratten, die etwa 11-mal höheren Simvastatin-Spiegeln ausgesetzt waren als bei Menschen, denen 80 mg Simvastatin (als gemessen durch AUC).
Eine zweite zweijährige Kanzerogenitätsstudie an Ratten mit Dosen von 50 und 100 mg/kg/Tag führte zu hepatozellulären Adenomen und Karzinomen (bei weiblichen Ratten bei beiden Dosen und bei männlichen Ratten bei 100 mg/kg/Tag). Adenome der Schilddrüsenfollikelzellen traten bei Männern und Frauen bei beiden Dosierungen vermehrt auf; Follikelzellkarzinome der Schilddrüse waren bei Frauen bei 100 mg/kg/Tag erhöht. Die erhöhte Inzidenz von Schilddrüsenneoplasien scheint mit Befunden anderer Statine übereinzustimmen. Diese Behandlungsspiegel stellten Plasmaspiegel (AUC) dar, die etwa dem 7- und 15-Fachen (Männer) und dem 22- und 25-Fachen (Frauen) der durchschnittlichen menschlichen Plasma-Medikamentenexposition nach einer täglichen Dosis von 80 Milligramm entsprachen.
In einem mikrobiellen Mutagenitätstest (Ames) mit oder ohne metabolischer Aktivierung der Ratten- oder Mausleber wurden keine Hinweise auf Mutagenität beobachtet. Darüber hinaus wurden in einem alkalischen In-vitro-Elutionsassay mit Rattenhepatozyten, einer Vorwärtsmutationsstudie an V-79-Säugerzellen, einer In-vitro-Chromosomenaberrationsstudie in CHO-Zellen oder einem In-vivo-Chromosomenaberrationsassay keine Anzeichen einer Schädigung des genetischen Materials festgestellt im Knochenmark der Maus.
Bei männlichen Ratten, die 34 Wochen lang mit Simvastatin in einer Dosis von 25 mg/kg Körpergewicht behandelt wurden (das 4-fache der maximalen Humanexposition, basierend auf der AUC, bei Patienten, die 80 mg/Tag erhielten), kam es zu einer verringerten Fertilität; dieser Effekt wurde jedoch nicht in einer nachfolgenden Fertilitätsstudie beobachtet, in der Simvastatin in dieser gleichen Dosierung 11 Wochen lang männlichen Ratten verabreicht wurde (der gesamte Zyklus der Spermatogenese einschließlich der Nebenhodenreifung). In den Hoden von Ratten aus beiden Studien wurden keine mikroskopischen Veränderungen beobachtet. Bei 180 mg/kg/Tag (was zu 22-mal höheren Expositionswerten führt als beim Menschen, der 80 mg/Tag einnimmt, basierend auf der Oberfläche, mg/m2), wurde eine Degeneration der Hodenkanälchen (Nekrose und Verlust des spermatogenen Epithels) beobachtet. Bei Hunden kam es bei 10 mg/kg/Tag (ca. 2-fache Exposition beim Menschen, basierend auf der AUC bei 80 mg/Tag) zu arzneimittelbedingter Hodenatrophie, verringerter Spermatogenese, Spermatozytendegeneration und Riesenzellbildung. Die klinische Bedeutung dieser Befunde ist unklar.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaft Kategorie X [Siehe KONTRAINDIKATIONEN ]
ZOCOR ist kontraindiziert bei Frauen, die schwanger sind oder schwanger werden könnten. Lipidsenkende Medikamente bieten während der Schwangerschaft keinen Nutzen, da Cholesterin und Cholesterinderivate für eine normale fetale Entwicklung benötigt werden. Atherosklerose ist ein chronischer Prozess, und das Absetzen von lipidsenkenden Arzneimitteln während der Schwangerschaft sollte nur geringe Auswirkungen auf die langfristigen Ergebnisse der primären Therapie der Hypercholesterinämie haben. Es liegen keine angemessenen und gut kontrollierten Studien zur Anwendung von ZOCOR während der Schwangerschaft vor; Es gibt jedoch seltene Berichte über angeborene Anomalien bei Säuglingen, die in utero Statinen ausgesetzt waren. Tierische Reproduktionsstudien mit Simvastatin bei Ratten und Kaninchen zeigten keine Hinweise auf Teratogenität. Cholesterin und Triglyceride im Serum steigen während einer normalen Schwangerschaft an, und Cholesterin oder Cholesterinderivate sind für die fötale Entwicklung unerlässlich. Da Statine die Cholesterinsynthese und möglicherweise die Synthese anderer aus Cholesterin gewonnener biologisch aktiver Substanzen verringern, kann ZOCOR bei Verabreichung an eine schwangere Frau den Fötus schädigen. Wenn ZOCOR 5 mg während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenzielle Gefahr für den Fötus informiert werden.
Es gibt seltene Berichte über angeborene Anomalien nach intrauteriner Exposition gegenüber Statinen. In einer Übersicht2 von etwa 100 prospektiv verfolgten Schwangerschaften bei Frauen, die Simvastatin oder einem anderen strukturell verwandten Statin ausgesetzt waren, überstieg die Inzidenz angeborener Anomalien, spontaner Aborte und fötaler Todesfälle/Totgeburten nicht die in der Allgemeinbevölkerung erwarteten. Allerdings konnte die Studie nur ein 3- bis 4-fach erhöhtes Risiko für angeborene Anomalien gegenüber der Hintergrundrate ausschließen. In 89 % dieser Fälle wurde die medikamentöse Behandlung vor der Schwangerschaft begonnen und während des ersten Trimesters, wenn eine Schwangerschaft festgestellt wurde, abgebrochen.
Simvastatin war bei Ratten oder Kaninchen in Dosen (25 bzw. 10 mg/kg/Tag) nicht teratogen, die zu einer 3-fachen Exposition beim Menschen, bezogen auf mg/m2 Oberfläche, führten. In Studien mit einem anderen strukturverwandten Statin wurden jedoch Skelettmissbildungen bei Ratten und Mäusen beobachtet.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure During Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Frauen im gebärfähigen Alter, die wegen einer Lipidstörung eine Behandlung mit ZOCOR 5 mg benötigen, sollten angewiesen werden, eine wirksame Empfängnisverhütung anzuwenden. Bei Frauen, die versuchen schwanger zu werden, sollte das Absetzen von ZOCOR in Erwägung gezogen werden. Wenn eine Schwangerschaft eintritt, sollte ZOCOR sofort abgesetzt werden.
Stillende Mutter
Es ist nicht bekannt, ob Simvastatin in die Muttermilch übergeht. Da eine geringe Menge eines anderen Arzneimittels dieser Klasse in die Muttermilch ausgeschieden wird und aufgrund der Möglichkeit schwerwiegender Nebenwirkungen bei gestillten Säuglingen, sollten Frauen, die Simvastatin einnehmen, ihre Säuglinge nicht stillen. Unter Berücksichtigung der Bedeutung des Medikaments für die Mutter sollte eine Entscheidung getroffen werden, ob das Stillen oder das Medikament abgesetzt werden soll [siehe KONTRAINDIKATIONEN ].
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Simvastatin bei Patienten im Alter von 10 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie wurden in einer kontrollierten klinischen Studie mit heranwachsenden Jungen und Mädchen, die mindestens 1 Jahr nach der Menarche waren, untersucht. Mit Simvastatin behandelte Patienten hatten ein ähnliches Nebenwirkungsprofil wie Patienten, die mit Placebo behandelt wurden. Dosen über 40 mg wurden bei dieser Population nicht untersucht. In dieser begrenzt kontrollierten Studie gab es keine signifikante Wirkung auf das Wachstum oder die sexuelle Reifung bei heranwachsenden Jungen oder Mädchen oder auf die Länge des Menstruationszyklus bei Mädchen. [Sehen DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , Klinische Studien ] Heranwachsende Frauen sollten während der Behandlung mit Simvastatin über geeignete Verhütungsmethoden beraten werden [siehe KONTRAINDIKATIONEN und Schwangerschaft ]. Simvastatin wurde weder bei Patienten unter 10 Jahren noch bei prämenarchalen Mädchen untersucht.
Geriatrische Verwendung
Von den 2.423 Patienten, die ZOCOR 5 mg in klinischen Phase-III-Studien erhielten, und den 10.269 Patienten in der Herzschutzstudie, die ZOCOR 40 mg erhielten, waren 363 (15 %) bzw. 5.366 (52 %) ≥ 65 Jahre alt. Bei HPS waren 615 (6 %) ≥ 75 Jahre alt. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden. Da fortgeschrittenes Alter (≥65 Jahre) ein prädisponierender Faktor für Myopathie ist, sollte ZOCOR bei älteren Patienten mit Vorsicht verschrieben werden. [Sehen KLINISCHE PHARMAKOLOGIE ]
Eine pharmakokinetische Studie mit Simvastatin zeigte, dass der mittlere Plasmaspiegel der Statinaktivität bei älteren Patienten zwischen 70 und 78 Jahren im Vergleich zu Patienten zwischen 18 und 30 Jahren etwa 45 % höher war. In 4S waren 1.021 (23 %) von 4.444 Patienten 65 Jahre oder älter. Die lipidsenkende Wirkung war bei älteren Patienten mindestens genauso groß wie bei jüngeren Patienten, und ZOCOR reduzierte die Gesamtmortalität und die KHK-Mortalität bei älteren Patienten mit KHK in der Vorgeschichte signifikant. Bei HPS waren 52 % der Patienten älter (4.891 Patienten 65-69 Jahre und 5.806 Patienten 70 Jahre oder älter). Die relativen Risikoreduktionen für KHK-Tod, nicht-tödlichen Myokardinfarkt, koronare und nicht-koronare Revaskularisationsverfahren und Schlaganfall waren bei älteren und jüngeren Patienten ähnlich [siehe Klinische Studien ]. Bei HPS gab es unter 32.145 Patienten, die in die aktive Run-in-Phase eintraten, 2 Fälle von Myopathie/Rhabdomyolyse; diese Patienten waren 67 und 73 Jahre alt. Von den 7 Fällen von Myopathie/Rhabdomyolyse unter 10.269 Patienten, die Simvastatin zugeteilt wurden, waren 4 65 Jahre oder älter (zu Studienbeginn), von denen einer über 75 Jahre alt war. Es gab insgesamt keine Unterschiede in der Sicherheit zwischen älteren Patienten und jüngere Patienten in entweder 4S oder HPS.
Da fortgeschrittenes Alter (≥ 65 Jahre) ein prädisponierender Faktor für Myopathie, einschließlich Rhabdomyolyse, ist, sollte ZOCOR 40 mg bei älteren Patienten mit Vorsicht verschrieben werden. In einer klinischen Studie mit Patienten, die mit Simvastatin 80 mg/Tag behandelt wurden, hatten Patienten im Alter von ≥ 65 Jahren ein erhöhtes Risiko für Myopathien, einschließlich Rhabdomyolyse, im Vergleich zu Patienten im Alter von WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ]
Nierenfunktionsstörung
Vorsicht ist geboten, wenn ZOCOR 20 mg Patienten mit schwerer Nierenfunktionsstörung verabreicht wird. [Siehe DOSIERUNG UND ANWENDUNG ]
Leberfunktionsstörung
ZOCOR 10 mg ist kontraindiziert bei Patienten mit aktiver Lebererkrankung, die unerklärliche anhaltende Erhöhungen der hepatischen Transaminasenwerte beinhalten kann [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Chinesische Patienten
In einer klinischen Studie, in der Patienten mit hohem Risiko für Herz-Kreislauf-Erkrankungen mit Simvastatin 40 mg/Tag behandelt wurden (mediane Nachbeobachtungszeit 3,9 Jahre), betrug die Myopathie-Inzidenz etwa 0,05 % bei nicht-chinesischen Patienten (n = 7367) im Vergleich zu 0,24 % für chinesische Patienten (n=5468). Die Inzidenz von Myopathie bei chinesischen Patienten unter Simvastatin 40 mg/Tag oder Ezetimib/Simvastatin 10/40 mg/Tag zusammen mit retardiertem Niacin 2 g/Tag betrug 1,24 %.
Chinesische Patienten können ein höheres Risiko für Myopathie haben, Patienten entsprechend überwachen. Die gleichzeitige Verabreichung von ZOCOR 10 mg mit lipidmodifizierenden Dosen (≥ 1 g/Tag Niacin) von Niacin-haltigen Produkten wird bei chinesischen Patienten nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
ÜBERDOSIS
Bei Mäusen wurde nach einer oralen Einzeldosis von 9 g/m2 eine signifikante Letalität beobachtet. Bei Ratten oder Hunden, die mit Dosen von 30 bzw. 100 g/m2 behandelt wurden, wurden keine Anzeichen von Letalität beobachtet. Bei Nagetieren wurden keine spezifischen diagnostischen Anzeichen beobachtet. Bei diesen Dosen waren die einzigen Anzeichen, die bei Hunden beobachtet wurden, Erbrechen und schleimige Stühle.
Es wurden einige Fälle von Überdosierung mit ZOCOR berichtet; die maximal eingenommene Dosis betrug 3,6 g. Alle Patienten erholten sich ohne Folgeerscheinungen. Im Falle einer Überdosierung sollten unterstützende Maßnahmen ergriffen werden. Die Dialysierbarkeit von Simvastatin und seinen Metaboliten beim Menschen ist derzeit nicht bekannt.
KONTRAINDIKATIONEN
ZOCOR 40 mg ist unter folgenden Bedingungen kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Simvastatin ist ein Prodrug und wird nach Verabreichung zu seiner aktiven β-Hydroxysäureform, Simvastatinsäure, hydrolysiert. Simvastatin ist ein spezifischer Inhibitor der 3-Hydroxy-3-methylglutaryl-Coenzym A (HMG-CoA)-Reduktase, dem Enzym, das die Umwandlung von HMG-CoA in Mevalonat katalysiert, einem frühen und geschwindigkeitsbestimmenden Schritt im Biosyntheseweg für Cholesterin. Darüber hinaus reduziert Simvastatin VLDL und TG und erhöht HDL-C.
Pharmakodynamik
Epidemiologische Studien haben gezeigt, dass erhöhte Gesamt-C- und LDL-C-Spiegel sowie erniedrigte HDL-C-Spiegel mit der Entwicklung von Atherosklerose und einem erhöhten kardiovaskulären Risiko verbunden sind. Die Senkung von LDL-C verringert dieses Risiko. Die unabhängige Wirkung einer Erhöhung von HDL-C oder einer Senkung von TG auf das Risiko einer koronaren und kardiovaskulären Morbidität und Mortalität wurde jedoch nicht bestimmt.
Pharmakokinetik
Simvastatin ist ein Lacton, das in vivo leicht zur entsprechenden β-Hydroxysäure, einem starken Inhibitor der HMG-CoA-Reduktase, hydrolysiert wird. Die Hemmung der HMG-CoA-Reduktase ist die Grundlage für einen Assay in pharmakokinetischen Studien der β-Hydroxysäure-Metaboliten (aktive Inhibitoren) und, nach Basenhydrolyse, aktive plus latente Inhibitoren (Gesamtinhibitoren) im Plasma nach Verabreichung von Simvastatin.
Nach oraler Gabe von 14C-markiertem Simvastatin beim Menschen wurden 13 % der Dosis im Urin und 60 % im Stuhl ausgeschieden. Die Plasmakonzentrationen der Gesamtradioaktivität (Simvastatin plus 14C-Metaboliten) erreichten nach 4 Stunden ihren Höchstwert und fielen 12 Stunden nach der Einnahme rasch auf etwa 10 % des Höchstwerts ab. Da Simvastatin einer umfangreichen First-Pass-Extraktion in der Leber unterzogen wird, ist die Verfügbarkeit des Arzneimittels für den allgemeinen Kreislauf gering (
Sowohl Simvastatin als auch sein β-Hydroxysäure-Metabolit werden in hohem Maße (ca. 95 %) an menschliche Plasmaproteine gebunden. Studien an Ratten zeigen, dass bei Verabreichung von radioaktiv markiertem Simvastatin die von Simvastatin stammende Radioaktivität die Blut-Hirn-Schranke passiert.
Die wichtigsten aktiven Metaboliten von Simvastatin im menschlichen Plasma sind die β-Hydroxysäure von Simvastatin und ihre 6′-Hydroxy-, 6′-Hydroxymethyl- und 6′-Exomethylen-Derivate. Maximale Plasmakonzentrationen sowohl der aktiven als auch der Gesamtinhibitoren wurden innerhalb von 1,3 bis 2,4 Stunden nach der Einnahme erreicht. Während der empfohlene therapeutische Dosisbereich 5 bis 40 mg/Tag beträgt, gab es bei einer Erhöhung der Dosis auf bis zu 120 mg keine wesentliche Abweichung von der Linearität der AUC von Inhibitoren im allgemeinen Kreislauf. Im Vergleich zum nüchternen Zustand wurde das Plasmaprofil von Inhibitoren nicht beeinflusst, wenn Simvastatin unmittelbar vor einer von der American Heart Association empfohlenen fettarmen Mahlzeit verabreicht wurde.
In einer Studie mit 16 älteren Patienten im Alter zwischen 70 und 78 Jahren, die ZOCOR 40 mg/Tag erhielten, war der mittlere Plasmaspiegel der HMG-CoA-Reduktase-Hemmaktivität im Vergleich zu 18 Patienten im Alter zwischen 18 und 30 Jahren um etwa 45 % erhöht. Die Erfahrung aus klinischen Studien bei älteren Patienten (n = 1522) legt nahe, dass es insgesamt keine Unterschiede in der Sicherheit zwischen älteren und jüngeren Patienten gab [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Kinetische Studien mit einem anderen Statin mit ähnlichem Hauptausscheidungsweg haben gezeigt, dass bei Patienten mit schwerer Niereninsuffizienz (gemessen anhand der Kreatinin-Clearance) bei einer gegebenen Dosis eine höhere systemische Exposition erreicht werden kann.
Simvastatinsäure ist ein Substrat des Transportproteins OATP1B1. Die gleichzeitige Verabreichung von Arzneimitteln, die Inhibitoren des Transportproteins OATP1B1 sind, kann zu erhöhten Plasmakonzentrationen von Simvastatinsäure und einem erhöhten Myopathierisiko führen. Beispielsweise wurde gezeigt, dass Cyclosporin die AUC von Statinen erhöht; Obwohl der Mechanismus noch nicht vollständig geklärt ist, ist der Anstieg der AUC für Simvastatinsäure vermutlich teilweise auf die Hemmung von CYP3A4 und/oder OATP1B1 zurückzuführen.
Das Myopathierisiko wird durch hohe HMG-CoA-Reduktase-Hemmaktivität im Plasma erhöht. Inhibitoren von CYP3A4 können die Plasmaspiegel der HMG-CoA-Reduktase-Hemmaktivität erhöhen und das Risiko einer Myopathie erhöhen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
In einer Studie mit 12 gesunden Probanden hatte Simvastatin in einer Dosis von 80 mg keine Wirkung auf den Metabolismus der als Cytochrom P450 Isoform 3A4 (CYP3A4) dienenden Substrate Midazolam und Erythromycin. Dies weist darauf hin, dass Simvastatin kein Inhibitor von CYP3A4 ist und daher nicht zu erwarten ist, dass es die Plasmaspiegel anderer Arzneimittel, die durch CYP3A4 metabolisiert werden, beeinflusst.
Die gleichzeitige Verabreichung von Simvastatin (40 mg einmal täglich über 10 Tage) führte zu einem Anstieg der maximalen mittleren Konzentrationen von kardioaktivem Digoxin (gegeben als Einzeldosis von 0,4 mg an Tag 10) um etwa 0,3 ng/ml.
Tiertoxikologie und/oder Pharmakologie
ZNS-Toxizität
Bei klinisch gesunden Hunden, die 14 Wochen lang mit 180 mg/kg/Tag Simvastatin behandelt wurden, wurde eine Degeneration des Sehnervs beobachtet, eine Dosis, die zu mittleren Arzneimittelspiegeln im Plasma führte, die etwa 12-mal höher waren als die mittleren Plasmaspiegel bei Menschen, die 80 mg/Tag einnahmen.
Ein chemisch ähnliches Medikament dieser Klasse verursachte bei klinisch normalen Hunden in dosisabhängiger Weise ab 60 mg/kg/Tag auch eine Degeneration des Sehnervs (Wallesche Degeneration der Retinogenulatfasern), eine Dosis, die etwa 30-mal höhere mittlere Plasmakonzentrationen des Medikaments hervorrief als der durchschnittliche Arzneimittelplasmaspiegel bei Menschen, die die höchste empfohlene Dosis einnehmen (gemessen an der gesamten enzymhemmenden Aktivität). Dasselbe Medikament verursachte auch bei Hunden, die 14 Wochen lang mit 180 mg/kg/Tag behandelt wurden, eine Vestibulocochlear-Wallerian-ähnliche Degeneration und retinale Ganglienzellchromatolyse. Tagesdosis.
ZNS-Gefäßläsionen, gekennzeichnet durch perivaskuläre Blutungen und Ödeme, mononukleäre Zellinfiltration perivaskulärer Räume, perivaskuläre Fibrinablagerungen und Nekrose kleiner Gefäße, wurden bei Hunden beobachtet, die mit Simvastatin in einer Dosis von 360 mg/kg/Tag behandelt wurden, einer Dosis, die mittleres Plasma erzeugte Arzneimittelspiegel, die etwa 14-mal höher waren als die mittleren Arzneimittelspiegel im Plasma bei Menschen, die 80 mg/Tag einnahmen. Ähnliche ZNS-Gefäßläsionen wurden bei mehreren anderen Arzneimitteln dieser Klasse beobachtet.
Katarakte traten bei weiblichen Ratten nach zweijähriger Behandlung mit 50 und 100 mg/kg/Tag (das 22- bzw. 25-fache der humanen AUC bei 80 mg/Tag) und bei Hunden nach drei Monaten bei 90 mg/kg/Tag ( 19 Mal) und nach zwei Jahren bei 50 mg/kg/Tag (5 Mal).
Klinische Studien
Klinische Studien bei Erwachsenen
Verringerung des Risikos von KHK-Mortalität und kardiovaskulären Ereignissen
In 4S wurde die Wirkung einer Therapie mit ZOCOR 20 mg auf die Gesamtmortalität bei 4.444 Patienten mit CHD und einem Gesamtcholesterin-Ausgangswert von 212–309 mg/dl (5,5–8,0 mmol/l) untersucht. In dieser multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie wurden die Patienten mit Standardbehandlung, einschließlich Diät, und entweder ZOCOR 20–40 mg/Tag (n = 2.221) oder Placebo (n = 2.223) für eine mediane Dauer behandelt von 5,4 Jahren. Im Verlauf der Studie führte die Behandlung mit ZOCOR zu einer mittleren Senkung des Gesamt-C, LDL-C und TG um 25 %, 35 % bzw. 10 % und zu einem mittleren Anstieg des HDL-C um 8 %. ZOCOR senkte das Mortalitätsrisiko signifikant um 30 % (p = 0,0003, 182 Todesfälle in der ZOCOR 40 mg-Gruppe vs. 256 Todesfälle in der Placebo-Gruppe). Das KHK-Sterblichkeitsrisiko wurde signifikant um 42 % reduziert (p = 0,00001, 111 vs. 189 Todesfälle). Es gab keinen statistisch signifikanten Unterschied zwischen den Gruppen bei der nicht-kardiovaskulären Mortalität. ZOCOR senkte das Risiko schwerer koronarer Ereignisse (KHK-Mortalität plus im Krankenhaus verifizierter und stiller nicht tödlicher Myokardinfarkt [MI]) signifikant um 34 % (p
Die Heart Protection Study (HPS) war eine große, multizentrische, placebokontrollierte Doppelblindstudie mit einer mittleren Dauer von 5 Jahren, die an 20.536 Patienten (10.269 unter ZOCOR 40 mg und 10.267 unter Placebo) durchgeführt wurde. Die Patienten wurden der Behandlung unter Verwendung einer kovariaten adaptiven Methode3 zugeteilt, die die Verteilung von 10 wichtigen Ausgangsmerkmalen von bereits aufgenommenen Patienten berücksichtigte und das Ungleichgewicht dieser Merkmale zwischen den Gruppen minimierte. Die Patienten hatten ein mittleres Alter von 64 Jahren (Bereich 40-80 Jahre), waren zu 97 % Kaukasier und hatten ein hohes Risiko für die Entwicklung eines schweren koronaren Ereignisses aufgrund einer bestehenden KHK (65 %), Diabetes (Typ 2, 26 %; Typ 1 , 3 %), Schlaganfall oder andere zerebrovaskuläre Erkrankungen in der Vorgeschichte (16 %), periphere Gefäßerkrankungen (33 %) oder Bluthochdruck bei Männern ≥ 65 Jahre (6 %). Zu Studienbeginn hatten 3.421 Patienten (17 %) LDL-C-Spiegel unter 100 mg/dl, davon 953 (5 %) LDL-C-Spiegel unter 80 mg/dl; 7.068 Patienten (34 %) hatten Werte zwischen 100 und 130 mg/dl; und 10.047 Patienten (49 %) hatten Werte über 130 mg/dl.
DR Taves, Minimierung: eine neue Methode zur Zuordnung von Patienten zu Behandlungs- und Kontrollgruppen. Klin. Pharmakol. Ther. 15 (1974), S. 443-453
Die HPS-Ergebnisse zeigten, dass ZOCOR 40 mg/Tag signifikant reduzierte: Gesamt- und KHK-Sterblichkeit; nicht tödlicher Myokardinfarkt, Schlaganfall und Revaskularisierungsverfahren (koronare und nicht koronare) (siehe Tabelle 4).
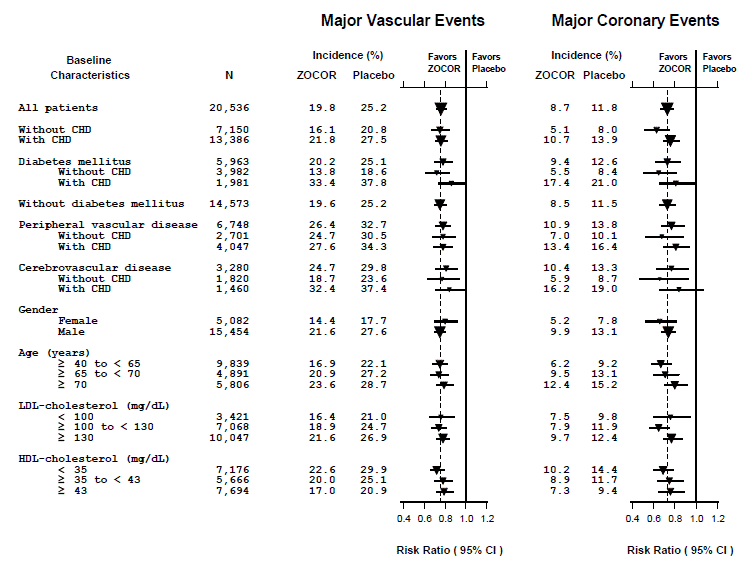
Zwei zusammengesetzte Endpunkte wurden definiert, um genügend Ereignisse zu haben, um die relative Risikominderung über eine Reihe von Ausgangsmerkmalen zu bewerten (siehe Abbildung 1). Eine Zusammensetzung aus schweren koronaren Ereignissen (MCE) bestand aus CHD-Mortalität und nicht tödlichem MI (analysiert nach Zeit bis zum ersten Ereignis; bei 898 mit ZOCOR 5 mg behandelten Patienten traten Ereignisse auf und bei 1.212 Patienten unter Placebo traten Ereignisse auf). Eine Zusammensetzung aus schwerwiegenden vaskulären Ereignissen (MVE) bestand aus MCE, Schlaganfall und Revaskularisierungsverfahren, einschließlich koronarer, peripherer und anderer nicht koronarer Verfahren (analysiert nach Zeit bis zum ersten Ereignis; 2.033 Patienten, die mit ZOCOR 10 mg behandelt wurden, hatten Ereignisse und 2.585 Patienten unter Placebo hatte Ereignisse). Signifikante Reduktionen des relativen Risikos wurden für beide kombinierten Endpunkte beobachtet (27 % für MCE und 24 % für MVE, p
Abbildung 1 Die Auswirkungen der Behandlung mit ZOCOR 5 mg auf schwerwiegende vaskuläre Ereignisse und schwerwiegende koronare Ereignisse bei HPS
Angiographische Studien
In der Multicenter-Anti-Atherom-Studie wurde die Wirkung von Simvastatin auf Atherosklerose durch quantitative Koronarangiographie bei hypercholesterinämischen Patienten mit KHK untersucht. In dieser randomisierten, doppelblinden, kontrollierten Studie wurden die Patienten mit Simvastatin 20 mg/Tag oder Placebo behandelt. Angiogramme wurden zu Studienbeginn sowie nach zwei und vier Jahren ausgewertet. Die co-primären Studienendpunkte waren die mittlere Veränderung des minimalen und mittleren Lumendurchmessers pro Patient, was auf eine fokale bzw. diffuse Erkrankung hinweist. ZOCOR verlangsamte signifikant das Fortschreiten der Läsionen, wie im Jahr-4-Angiogramm anhand beider Parameter sowie anhand der Veränderung des prozentualen Durchmessers der Stenose gemessen wurde. Darüber hinaus verringerte Simvastatin den Anteil der Patienten mit neuen Läsionen und mit neuen totalen Okklusionen signifikant.
Modifikationen von Lipidprofilen
Primäre Hyperlipidämie (Fredrickson Typ lla und llb)
ZOCOR hat sich bei der Senkung von Gesamt-C und LDL-C bei heterozygoten familiären und nicht-familiären Formen der Hyperlipidämie und bei gemischter Hyperlipidämie als wirksam erwiesen. Das maximale bis nahezu maximale Ansprechen wird im Allgemeinen innerhalb von 4-6 Wochen erreicht und während einer chronischen Therapie aufrechterhalten. ZOCOR senkte signifikant Gesamt-C, LDL-C, Gesamt-C/HDL-C-Verhältnis und LDL-C/HDL-C-Verhältnis; ZOCOR verringerte auch TG und erhöhte HDL-C (siehe Tabelle 5).
Hypertriglyzeridämie (Fredrickson Typ IV)
Die Ergebnisse einer Subgruppenanalyse bei 74 Patienten mit Typ-IV-Hyperlipidämie aus einer doppelblinden, placebokontrollierten Crossover-Studie über 3 Perioden mit 130 Patienten sind in Tabelle 6 dargestellt.
Dysbetalipoproteinämie (Fredrickson Typ III)
Die Ergebnisse einer Subgruppenanalyse bei 7 Patienten mit Hyperlipidämie vom Typ III (Dysbetalipoproteinämie) (Apo E2/2) (VLDL-C/TG > 0,25) aus einer doppelblinden, placebokontrollierten Crossover-Studie mit 130 Patienten über 3 Perioden sind in Tabelle 7 dargestellt.
Homozygote familiäre Hypercholesterinämie
In einer kontrollierten klinischen Studie erhielten 12 Patienten im Alter von 15 bis 39 Jahren mit homozygoter familiärer Hypercholesterinämie Simvastatin 40 mg/Tag in einer Einzeldosis oder in 3 geteilten Dosen oder 80 mg/Tag in 3 geteilten Dosen. Bei 11 Patienten mit LDL-C-Senkungen betrugen die mittleren LDL-C-Veränderungen für die 40- und 80-mg-Dosen 14 % (Bereich 8 % bis 23 %, Median 12 %) und 30 % (Bereich 14 % bis 46 % , Median 29 %). Ein Patient hatte einen Anstieg von 15 % des LDL-C. Ein anderer Patient mit fehlender LDL-C-Rezeptorfunktion hatte mit der 80-mg-Dosis eine LDL-C-Reduktion von 41 %.
Endokrine Funktion
In klinischen Studien beeinträchtigte Simvastatin weder die Nebennierenreserve noch signifikant die basale Cortisolkonzentration im Plasma. In klinischen Studien mit Simvastatin wurde bei Männern eine leichte Verringerung des Basalplasma-Testosterons gegenüber dem Ausgangswert beobachtet, eine Wirkung, die auch bei anderen Statinen und dem Gallensäure-Sequestriermittel Cholestyramin beobachtet wurde. Es gab keine Wirkung auf die Gonadotropinspiegel im Plasma. In einer placebokontrollierten 12-wöchigen Studie zeigte Simvastatin 80 mg keine signifikante Wirkung auf die Plasma-Testosteron-Reaktion auf humanes Choriongonadotropin. In einer anderen 24-wöchigen Studie hatte Simvastatin 20-40 mg keine nachweisbare Wirkung auf die Spermatogenese. In der 4S-Studie, in der 4.444 Patienten randomisiert Simvastatin 20–40 mg/Tag oder Placebo für eine mediane Dauer von 5,4 Jahren zugeteilt wurden, unterschied sich die Inzidenz sexueller Nebenwirkungen bei Männern in den beiden Behandlungsgruppen nicht signifikant. Aufgrund dieser Faktoren ist es unwahrscheinlich, dass die kleinen Änderungen des Plasma-Testosterons klinisch signifikant sind. Die Auswirkungen, falls vorhanden, auf die Hypophysen-Gonaden-Achse bei prämenopausalen Frauen sind nicht bekannt.
Klinische Studien bei Jugendlichen
In einer doppelblinden, placebokontrollierten Studie wurden 175 Patienten (99 heranwachsende Jungen und 76 postmenarchale Mädchen) im Alter von 10 bis 17 Jahren (Durchschnittsalter 14,1 Jahre) mit heterozygoter familiärer Hypercholesterinämie (HeFH) randomisiert auf Simvastatin (n= 106) oder Placebo (n=67) für 24 Wochen (Basisstudie). Die Aufnahme in die Studie erforderte einen Ausgangs-LDL-C-Spiegel zwischen 160 und 400 mg/dl und mindestens einen Elternteil mit einem LDL-C-Spiegel > 189 mg/dl. Die Dosierung von Simvastatin (einmal täglich abends) betrug 10 mg für die ersten 8 Wochen, 20 mg für die zweiten 8 Wochen und 40 mg danach. In einer 24-wöchigen Verlängerung entschieden sich 144 Patienten dafür, die Therapie mit Simvastatin 40 mg oder Placebo fortzusetzen.
ZOCOR 20 mg verringerte signifikant die Plasmaspiegel von Gesamt-C, LDL-C und Apo B (siehe Tabelle 8). Die Ergebnisse der Verlängerung nach 48 Wochen waren mit denen der Basisstudie vergleichbar.
Nach 24 Behandlungswochen betrug der mittlere erreichte LDL-C-Wert 124,9 mg/dl (Bereich: 64,0289,0 mg/dl) in der Gruppe mit ZOCOR 40 mg im Vergleich zu 207,8 mg/dl (Bereich: 128,0–334,0 mg/dl). in der Placebogruppe.
Die Sicherheit und Wirksamkeit von Dosen über 40 mg täglich wurde bei Kindern mit HeFH nicht untersucht. Die langfristige Wirksamkeit einer Simvastatin-Therapie im Kindesalter zur Verringerung der Morbidität und Mortalität im Erwachsenenalter wurde nicht nachgewiesen.
INFORMATIONEN ZUM PATIENTEN
Den Patienten sollte geraten werden, sich an die vom National Cholesterol Education Program (NCEP) empfohlene Diät, ein regelmäßiges Trainingsprogramm und regelmäßige Tests eines Nüchtern-Lipid-Panels zu halten.
Die Patienten sollten über Substanzen aufgeklärt werden, die sie nicht gleichzeitig mit Simvastatin einnehmen sollten [sehen KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Patienten sollten auch angewiesen werden, andere medizinische Fachkräfte, die ein neues Medikament verschreiben oder die Dosis eines bestehenden Medikaments erhöhen, darüber zu informieren, dass sie ZOCOR einnehmen.
Muskelschmerzen
Alle Patienten, die eine Behandlung mit ZOCOR beginnen, sollten auf das Risiko einer Myopathie, einschließlich Rhabdomyolyse, hingewiesen und aufgefordert werden, unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden oder wenn diese Muskelzeichen oder -symptome nach Absetzen von ZOCOR anhalten. Patienten, die die 80-mg-Dosis anwenden, sollten darüber informiert werden, dass das Risiko einer Myopathie, einschließlich Rhabdomyolyse, bei Anwendung der 80-mg-Dosis erhöht ist. Das Risiko einer Myopathie, einschließlich Rhabdomyolyse, die bei der Anwendung von ZOCOR 40 mg auftritt, ist erhöht, wenn bestimmte Arten von Medikamenten eingenommen oder Grapefruitsaft konsumiert werden. Patienten sollten alle Medikamente, sowohl verschreibungspflichtige als auch rezeptfreie, mit ihrem Arzt besprechen.
Leberenzyme
Es wird empfohlen, vor Beginn der Behandlung mit ZOCOR 20 mg und danach, wenn klinisch indiziert, Leberfunktionstests durchzuführen. Allen mit ZOCOR behandelten Patienten sollte geraten werden, unverzüglich alle Symptome zu melden, die auf eine Leberschädigung hindeuten können, einschließlich Müdigkeit, Anorexie, Beschwerden im rechten Oberbauch, dunkler Urin oder Gelbsucht.
Schwangerschaft
Frauen im gebärfähigen Alter sollte geraten werden, während der Anwendung von ZOCOR eine wirksame Methode zur Empfängnisverhütung anzuwenden, um eine Schwangerschaft zu verhindern. Besprechen Sie zukünftige Schwangerschaftspläne mit Ihren Patientinnen und besprechen Sie, wann sie die Einnahme von ZOCOR 40 mg beenden sollten, wenn sie versuchen, schwanger zu werden. Patientinnen sollten darauf hingewiesen werden, dass sie im Falle einer Schwangerschaft die Einnahme von ZOCOR abbrechen und ihren Arzt verständigen sollten.
Stillen
Stillende Frauen sollten ZOCOR nicht anwenden. Patientinnen, die an einer Lipidstörung leiden und stillen, sollte geraten werden, die Optionen mit ihrem Arzt zu besprechen.