Cholesterin Behandlung: Lipitor 10mg, 20mg, 40mg Atorvastatin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lipitor 40 mg und wie wird es angewendet?
Lipitor 10 mg ist ein verschreibungspflichtiges Arzneimittel, das zur Senkung des Blutspiegels von „schlechtem“ Cholesterin (Low-Density-Lipoprotein oder LDL), zur Erhöhung des „guten“ Cholesterinspiegels (High-Density-Lipoprotein oder HDL) und zur Senkung von Triglyceriden und verwendet wird zur Behandlung der Symptome eines hohen Cholesterinspiegels (Hyperlipidämie) und zur Senkung des Risikos für Schlaganfall, Herzinfarkt oder andere Herzkomplikationen. Lipitor 40 mg kann allein oder mit anderen Medikamenten verwendet werden.
Lipitor 10 mg gehört zu einer Klasse von Medikamenten, die als Lipidsenker, Statine und HMG-CoA-Reduktase-Hemmer bezeichnet werden.
Es ist nicht bekannt, ob Lipitor 10 mg bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Lipitor haben?
Lipitor 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Lipitor sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Lipitor. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
LIPITOR ist ein synthetischer Lipidsenker. Atorvastatin ist ein Inhibitor der 3-Hydroxy-3-methylglutaryl-Coenzym A (HMG-CoA)-Reduktase. Dieses Enzym katalysiert die Umwandlung von HMG-CoA zu Mevalonat, einem frühen und geschwindigkeitsbestimmenden Schritt in der Cholesterinbiosynthese.
Atorvastatin-Calcium ist [R-(R*, R*)]-2-(4-Fluorphenyl)-β,δ-dihydroxy-5-(1-methylethyl)-3-phenyl-4-[(phenylamino)carbonyl]- 1Hpyrrol-1-heptansäure, Calciumsalz (2:1)trihydrat. Die empirische Formel von Atorvastatin-Calcium lautet (C33H34FN2O5)2Ca•3H2O und sein Molekulargewicht beträgt 1209,42. Seine Strukturformel lautet:
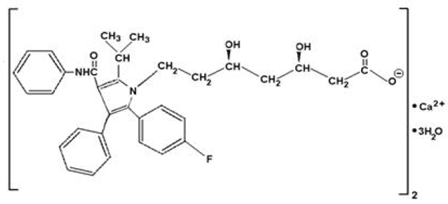
Atorvastatin-Calcium ist ein weißes bis cremefarbenes kristallines Pulver, das in wässrigen Lösungen mit einem pH-Wert von 4 und darunter unlöslich ist. Atorvastatin-Calcium ist in destilliertem Wasser, pH 7,4 Phosphatpuffer und Acetonitril sehr schwer löslich; leicht löslich in Ethanol; und in Methanol frei löslich.
LIPITOR Tabletten zur oralen Verabreichung enthalten 10, 20, 40 oder 80 mg Atorvastatin und die folgenden Hilfsstoffe: Calciumcarbonat, USP; Candelillawachs, FCC; Croscarmellose-Natrium, NF; Hydroxypropylcellulose, NF; Lactosemonohydrat, NF; Magnesiumstearat, NF; mikrokristalline Zellulose, NF; Opadry White YS-1-7040 (Hypromellose, Polyethylenglycol, Talk, Titandioxid); Polysorbat 80, NF; Simethicon-Emulsion.
INDIKATIONEN
Die Therapie mit lipidverändernden Wirkstoffen sollte nur ein Bestandteil einer Intervention mit mehreren Risikofaktoren bei Personen mit einem signifikant erhöhten Risiko für atherosklerotische Gefäßerkrankungen aufgrund von Hypercholesterinämie sein. Eine medikamentöse Therapie wird als Ergänzung zur Diät empfohlen, wenn das Ansprechen auf eine auf gesättigte Fettsäuren und Cholesterin beschränkte Diät und andere nicht-pharmakologische Maßnahmen allein unzureichend war. Bei Patienten mit KHK oder mehreren Risikofaktoren für KHK kann LIPITOR 20 mg gleichzeitig mit einer Diät begonnen werden.
Prävention von Herz-Kreislauf-Erkrankungen bei Erwachsenen
Bei erwachsenen Patienten ohne klinisch erkennbare koronare Herzkrankheit, aber mit mehreren Risikofaktoren für eine koronare Herzkrankheit wie Alter, Rauchen, Bluthochdruck, niedriger HDL-C-Wert oder einer frühen koronaren Herzkrankheit in der Familienanamnese ist LIPITOR 10 mg angezeigt für:
Bei erwachsenen Patienten mit Typ-2-Diabetes und ohne klinisch erkennbare koronare Herzkrankheit, aber mit mehreren Risikofaktoren für eine koronare Herzkrankheit wie Retinopathie, Albuminurie, Rauchen oder Bluthochdruck, ist LIPITOR indiziert für:
Bei erwachsenen Patienten mit klinisch offensichtlicher koronarer Herzkrankheit ist LIPITOR 20 mg angezeigt für:
Hyperlipidämie
LIPITOR 20 mg ist angezeigt:
Nutzungsbeschränkungen
LIPITOR 40 mg wurde nicht bei Erkrankungen untersucht, bei denen die hauptsächliche Lipoproteinanomalie eine Erhöhung der Chylomikronen (Fredrickson-Typen I und V) ist.
DOSIERUNG UND ANWENDUNG
Hyperlipidämie und gemischte Dyslipidämie
Die empfohlene Anfangsdosis von LIPITOR 10 mg beträgt 10 oder 20 mg einmal täglich. Patienten, die eine starke Senkung des LDL-Cholesterins (mehr als 45 %) benötigen, können mit 40 mg einmal täglich beginnen. Der Dosierungsbereich von LIPITOR beträgt 10 bis 80 mg einmal täglich. LIPITOR 10 mg kann als Einzeldosis zu jeder Tageszeit mit oder ohne Nahrung verabreicht werden. Die Anfangsdosis und Erhaltungsdosen von LIPITOR sollten entsprechend den Patientenmerkmalen wie Therapieziel und Ansprechen individuell angepasst werden. Nach Beginn und/oder Titration von LIPITOR 10 mg sollten die Lipidspiegel innerhalb von 2 bis 4 Wochen analysiert und die Dosierung entsprechend angepasst werden.
Heterozygote familiäre Hypercholesterinämie bei pädiatrischen Patienten (10 bis 17 Jahre)
Die empfohlene Anfangsdosis von LIPITOR 10 mg beträgt 10 mg/Tag; Der übliche Dosisbereich beträgt 10 bis 20 mg einmal täglich oral [siehe Klinische Studien ]. Die Dosen sollten gemäß dem empfohlenen Therapieziel individualisiert werden [siehe INDIKATIONEN UND VERWENDUNG und KLINISCHE PHARMAKOLOGIE ]. Anpassungen sollten in Abständen von mindestens 4 Wochen vorgenommen werden.
Homozygote familiäre Hypercholesterinämie
Die Dosierung von LIPITOR 20 mg bei Patienten mit HoFH beträgt 10 bis 80 mg täglich. LIPITOR 20 mg sollte bei diesen Patienten zusätzlich zu anderen lipidsenkenden Behandlungen (z. B. LDL-Apherese) angewendet werden oder wenn solche Behandlungen nicht verfügbar sind.
Begleitende lipidsenkende Therapie
LIPITOR 20 mg kann mit Gallensäureharzen verwendet werden. Die Kombination von HMG-CoA-Reduktase-Hemmern (Statinen) und Fibraten sollte generell mit Vorsicht angewendet werden [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
Eine Nierenerkrankung beeinflusst weder die Plasmakonzentrationen noch die LDL-C-Senkung von LIPITOR; daher ist eine Dosisanpassung bei Patienten mit Nierenfunktionsstörung nicht erforderlich [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Dosierung bei Patienten, die Cyclosporin, Clarithromycin, Itraconazol, Letermovir oder bestimmte Protease-Inhibitoren einnehmen
Bei Patienten, die Ciclosporin oder den HIV-Proteasehemmer Tipranavir plus Ritonavir oder den Hepatitis-C-Virus (HCV)-Proteasehemmer Glecaprevir plus Pibrentasvir oder Letermovir zusammen mit Ciclosporin einnehmen, sollte eine Therapie mit LIPITOR 40 mg vermieden werden. Wenden Sie bei Patienten mit HIV, die Lopinavir plus Ritonavir einnehmen, die niedrigste notwendige Dosis von LIPITOR an. Bei Patienten, die Clarithromycin, Itraconazol, Elbasvir plus Grazoprevir einnehmen, oder bei Patienten mit HIV, die eine Kombination aus Saquinavir plus Ritonavir, Darunavir plus Ritonavir, Fosamprenavir, Fosamprenavir plus Ritonavir oder Letermovir einnehmen, sollte die Therapie mit LIPITOR auf 20 mg begrenzt werden, und eine angemessene klinische Bewertung ist erforderlich empfohlen, um sicherzustellen, dass die niedrigste erforderliche Dosis von LIPITOR 20 mg verwendet wird. Bei Patienten, die den HIV-Proteasehemmer Nelfinavir einnehmen, sollte die Therapie mit LIPITOR 10 mg auf 40 mg begrenzt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
LIPITOR-Tabletten sind weiß, elliptisch, filmbeschichtet und in vier Stärken erhältlich (siehe Tabelle 1).
Lagerung und Handhabung
10 mg Tabletten (10 mg Atorvastatin): codiert „PD 155“ auf der einen Seite und „10“ auf der anderen Seite.
NDC 0071-0155-23 Flaschen à 90 NDC 0071-0155-40 10 x 10 Einzeldosis-Blisterpackungen
20 mg Tabletten (20 mg Atorvastatin): codiert „PD 156“ auf der einen Seite und „20“ auf der anderen Seite.
NDC 0071-0156-23 Flaschen à 90 NDC 0071-0156-40 10 x 10 Einzeldosis-Blisterpackungen
40 mg Tabletten (40 mg Atorvastatin): codiert „PD 157“ auf der einen Seite und „40“ auf der anderen Seite.
NDC 0071-0157-23 Flaschen à 90 NDC 0071-0157-40 10 x 10 Einzeldosis-Blisterpackungen
80 mg Tabletten (80 mg Atorvastatin): codiert „PD 158“ auf der einen Seite und „80“ auf der anderen Seite.
NDC 0071-0158-23 Flaschen à 90 NDC 0071-0158-73 Flaschen zu 500 NDC 0071-0158-92 8 x 8 Einzeldosis-Blisterpackungen
Lagerung
Bei kontrollierter Raumtemperatur von 20 – 25 °C (68 – 77 °F) lagern [siehe USP].
Vertrieb durch: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Überarbeitet: August 2021
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher besprochen:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
In der Datenbank für placebokontrollierte klinische LIPITOR-Studien mit 16.066 Patienten (8755 LIPITOR vs. 7311 Placebo; Altersspanne 10–93 Jahre, 39 % Frauen, 91 % Kaukasier, 3 % Schwarze, 2 % Asiaten, 4 % andere) mit einem Medianwert Behandlungsdauer von 53 Wochen brachen 9,7 % der Patienten unter LIPITOR 10 mg und 9,5 % der Patienten unter Placebo die Behandlung aufgrund von Nebenwirkungen unabhängig von der Kausalität ab. Die fünf häufigsten Nebenwirkungen bei mit LIPITOR 20 mg behandelten Patienten, die zu einem Behandlungsabbruch führten und häufiger auftraten als unter Placebo, waren: Myalgie (0,7 %), Durchfall (0,5 %), Übelkeit (0,4 %), Anstieg der Alaninaminotransferase (0,4 %) und Anstieg der Leberenzyme (0,4 %).
Die am häufigsten berichteten Nebenwirkungen (Inzidenz ≥ 2 % und mehr als Placebo) bei mit LIPITOR behandelten Patienten in placebokontrollierten Studien (n = 8755) waren unabhängig von der Kausalität: Nasopharyngitis (8,3 %), Arthralgie (6,9 %), Durchfall ( 6,8 %), Schmerzen in den Extremitäten (6,0 %) und Harnwegsinfektionen (5,7 %).
Tabelle 2 fasst die Häufigkeit klinischer Nebenwirkungen unabhängig von der Kausalität zusammen, die bei mit LIPITOR behandelten Patienten (n = 8755) aus 17 Placebo-kontrollierten Studien bei ≥ 2 % und mit einer höheren Rate als Placebo berichtet wurden.
Andere Nebenwirkungen, die in placebokontrollierten Studien berichtet wurden, umfassen:
Körper als Ganzes: Unwohlsein, Fieber; Verdauungstrakt: Bauchbeschwerden, Aufstoßen, Blähungen, Hepatitis, Cholestase; Bewegungsapparat: Muskel-Skelett-Schmerzen, Muskelermüdung, Nackenschmerzen, Gelenkschwellungen; Stoffwechsel- und Ernährungssystem: Anstieg der Transaminasen, anormaler Leberfunktionstest, Anstieg der alkalischen Phosphatase im Blut, Anstieg der Kreatinphosphokinase, Hyperglykämie; Nervöses System: Albtraum; Atmungssystem: Nasenbluten; Haut und Anhängsel: Urtikaria; Besondere Sinne: verschwommenes Sehen, Tinnitus; Urogenitalsystem: weiße blutkörperchen im urin positiv.
Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT)
Bei ASCOT [vgl Klinische Studien mit 10.305 Teilnehmern (Altersgruppe 40–80 Jahre, 19 % Frauen; 94,6 % Kaukasier, 2,6 % Afrikaner, 1,5 % Südasiaten, 1,3 % gemischt/andere), die mit LIPITOR 10 mg täglich (n = 5.168) oder Placebo (n = 5.168) behandelt wurden =5.137) war das Sicherheits- und Verträglichkeitsprofil der mit LIPITOR 10 mg behandelten Gruppe vergleichbar mit dem der mit Placebo behandelten Gruppe während einer medianen Nachbeobachtungszeit von 3,3 Jahren.
Kollaborative Atorvastatin-Diabetes-Studie (CARDS)
In KARTEN [vgl Klinische Studien ] mit 2.838 Probanden (Altersgruppe 39–77 Jahre, 32 % Frauen; 94,3 % Kaukasier, 2,4 % Südasiaten, 2,3 % Afrokaribiker, 1,0 % andere) mit Typ-2-Diabetes, die mit LIPITOR 10 mg täglich behandelt wurden (n = 1.428) oder Placebo (n = 1.410) gab es keinen Unterschied in der Gesamthäufigkeit von Nebenwirkungen oder schwerwiegenden Nebenwirkungen zwischen den Behandlungsgruppen während einer medianen Nachbeobachtungszeit von 3,9 Jahren. Es wurden keine Fälle von Rhabdomyolyse berichtet.
Studie zur Behandlung neuer Ziele (TNT)
Bei TNT [vgl Klinische Studien mit 10.001 Probanden (Altersgruppe 29–78 Jahre, 19 % Frauen; 94,1 % Kaukasier, 2,9 % Schwarze, 1,0 % Asiaten, 2,0 % andere) mit klinisch offensichtlicher KHK, die mit LIPITOR 10 mg täglich (n = 5006) oder LIPITOR 80 behandelt wurden mg täglich (n = 4995) kam es in der hochdosierten Atorvastatin-Gruppe (92, 1,8 %; 497, 9,9 %) zu mehr schwerwiegenden Nebenwirkungen und Behandlungsabbrüchen aufgrund von Nebenwirkungen als in der niedrig dosierten Gruppe (69 , 1,4 %; 404, 8,1 %) während einer medianen Nachbeobachtungszeit von 4,9 Jahren. Anhaltende Transaminasenerhöhungen (≥ 3 x ULN zweimal innerhalb von 4-10 Tagen) traten bei 62 (1,3 %) Personen unter Atorvastatin 80 mg und bei neun (0,2 %) Personen unter Atorvastatin 10 mg auf. CK-Erhöhungen (≥ 10 x ULN) waren insgesamt niedrig, waren aber in der hochdosierten Atorvastatin-Behandlungsgruppe (13, 0,3 %) höher als in der niedrig dosierten Atorvastatin-Gruppe (6, 0,1 %).
Inkrementelle Abnahme der Endpunkte durch Studie zur aggressiven Lipidsenkung (IDEAL)
In IDEAL [vgl Klinische Studien mit 8.888 Probanden (Altersgruppe 26–80 Jahre, 19 % Frauen; 99,3 % Kaukasier, 0,4 % Asiaten, 0,3 % Schwarze, 0,04 % andere), die mit LIPITOR 80 mg/Tag (n=4439) oder Simvastatin 20–40 mg behandelt wurden täglich (n = 4449) gab es keinen Unterschied in der Gesamthäufigkeit von Nebenwirkungen oder schwerwiegenden Nebenwirkungen zwischen den Behandlungsgruppen während einer medianen Nachbeobachtungszeit von 4,8 Jahren.
Schlaganfallprävention durch aggressive Senkung des Cholesterinspiegels (SPARCL)
In SPARCL mit 4731 Probanden (Altersgruppe 21–92 Jahre, 40 % Frauen; 93,3 % Kaukasier, 3,0 % Schwarze, 0,6 % Asiaten, 3,1 % andere) ohne klinisch erkennbare KHK, aber mit einem Schlaganfall oder einer transitorischen ischämischen Attacke (TIA) innerhalb der letzten 6 Monaten mit LIPITOR 80 mg (n = 2.365) oder Placebo (n = 2.366) über eine mediane Nachbeobachtungszeit von 4,9 Jahren behandelt, gab es eine höhere Inzidenz von anhaltenden Erhöhungen der hepatischen Transaminasen (≥ 3 x ULN zweimal innerhalb von 4-10 Tage) in der Atorvastatin-Gruppe (0,9 %) im Vergleich zu Placebo (0,1 %). CK-Erhöhungen (> 10 x ULN) waren selten, waren aber in der Atorvastatin-Gruppe höher (0,1 %) als in der Placebo-Gruppe (0,0 %). Diabetes wurde als Nebenwirkung bei 144 Patienten (6,1 %) in der Atorvastatin-Gruppe und 89 Patienten (3,8 %) in der Placebo-Gruppe berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
In einer Post-hoc-Analyse reduzierte LIPITOR 80 mg die Inzidenz von ischämischem Schlaganfall (218/2365, 9,2 % vs. 274/2366, 11,6 %) und erhöhte die Inzidenz von hämorrhagischem Schlaganfall (55/2365, 2,3 % vs. 33/ 2366, 1,4 %) im Vergleich zu Placebo. Die Inzidenz tödlicher hämorrhagischer Schlaganfälle war zwischen den Gruppen ähnlich (17 LIPITOR 40 mg vs. 18 Placebo). Die Inzidenz nicht-tödlicher hämorrhagischer Schlaganfälle war in der Atorvastatin-Gruppe (38 nicht-tödliche hämorrhagische Schlaganfälle) signifikant höher als in der Placebo-Gruppe (16 nicht-tödliche hämorrhagische Schlaganfälle). Patienten, die mit einem hämorrhagischen Schlaganfall in die Studie aufgenommen wurden, schienen ein erhöhtes Risiko für einen hämorrhagischen Schlaganfall zu haben [7 (16 %) LIPITOR vs. 2 (4 %) Placebo].
Es gab keine signifikanten Unterschiede zwischen den Behandlungsgruppen für die Gesamtmortalität: 216 (9,1 %) in der LIPITOR-80-mg/Tag-Gruppe vs. 211 (8,9 %) in der Placebo-Gruppe. Der Anteil der Patienten, die einen kardiovaskulären Tod erlitten, war in der LIPITOR-80-mg-Gruppe zahlenmäßig geringer (3,3 %) als in der Placebo-Gruppe (4,1 %). Der Anteil der Patienten, die einen nicht kardiovaskulären Tod erlitten, war in der LIPITOR 80 mg-Gruppe zahlenmäßig größer (5,0 %) als in der Placebo-Gruppe (4,0 %).
Nebenwirkungen aus klinischen Studien mit LIPITOR 20 mg bei pädiatrischen Patienten
In einer 26-wöchigen kontrollierten Studie mit Jungen und postmenarchalen Mädchen mit HeFH (im Alter von 10 bis 17 Jahren) (n = 140, 31 % weiblich; 92 % Kaukasier, 1,6 % Schwarze, 1,6 % Asiaten, 4,8 % andere), die Sicherheit und das Verträglichkeitsprofil von LIPITOR 10 bis 20 mg täglich als Zusatz zu einer Diät zur Senkung des Gesamtcholesterin-, LDL-C- und Apo-B-Spiegels war im Allgemeinen ähnlich dem von Placebo [siehe Verwendung in speziellen Bevölkerungsgruppen und Klinische Studien ].
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von LIPITOR nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Zu den Nebenwirkungen im Zusammenhang mit der LIPITOR-Therapie, die seit der Markteinführung gemeldet wurden und die oben nicht aufgeführt sind, gehören unabhängig von der Kausalitätsbewertung die folgenden: Anaphylaxie, angioneurotisches Ödem, bullöse Hautausschläge (einschließlich Erythema multiforme, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse), Rhabdomyolyse , Myositis, Müdigkeit, Sehnenriss, tödliches und nicht tödliches Leberversagen, Schwindel, Depression, periphere Neuropathie, Pankreatitis und interstitielle Lungenerkrankung.
Es gab seltene Berichte über eine immunvermittelte nekrotisierende Myopathie im Zusammenhang mit der Anwendung von Statinen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nach der Markteinführung gab es seltene Berichte über kognitive Beeinträchtigungen (z. B. Gedächtnisverlust, Vergesslichkeit, Amnesie, Gedächtnisstörungen, Verwirrtheit) im Zusammenhang mit der Anwendung von Statinen. Diese kognitiven Probleme wurden für alle Statine berichtet. Die Berichte sind im Allgemeinen nicht schwerwiegend und nach Absetzen des Statins reversibel, mit unterschiedlichen Zeiten bis zum Auftreten der Symptome (1 Tag bis Jahre) und zum Abklingen der Symptome (Median von 3 Wochen).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Arzneimittelwechselwirkungen, die das Risiko einer Myopathie und Rhabdomyolyse mit LIPITOR erhöhen können
LIPITOR ist ein Substrat von CYP3A4 und Transportern (z. B. OATP1B1/1B3, P-gp oder BCRP). Die LIPITOR-Plasmaspiegel können bei gleichzeitiger Verabreichung von Inhibitoren von CYP3A4 und Transportern signifikant erhöht werden. Tabelle 3 enthält eine Liste von Arzneimitteln, die die Lipitor-Exposition erhöhen können und bei gleichzeitiger Anwendung das Risiko einer Myopathie und Rhabdomyolyse erhöhen können, sowie Anweisungen zu deren Vorbeugung oder Behandlung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Arzneimittelwechselwirkungen, die die Exposition gegenüber LIPITOR verringern können
Tabelle 4 enthält Arzneimittelwechselwirkungen, die die Exposition gegenüber LIPITOR 20 mg verringern können, sowie Anweisungen zu deren Vorbeugung oder Behandlung.
Auswirkungen von LIPITOR 20mg auf andere Drogen
Tabelle 5 zeigt die Wirkung von LIPITOR auf andere Arzneimittel und Anweisungen zu deren Vorbeugung oder Behandlung.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Myopathie und Rhabdomyolyse
LIPITOR 10 mg kann Myopathie (Muskelschmerzen, -empfindlichkeit oder -schwäche mit einer Kreatinkinase (CK) über dem Zehnfachen der Obergrenze des Normalwerts) und Rhabdomyolyse (mit oder ohne akutes Nierenversagen infolge einer Myoglobinurie) verursachen. Seltene Todesfälle sind als Folge einer Rhabdomyolyse bei der Anwendung von Statinen, einschließlich LIPITOR, aufgetreten.
Risikofaktoren für Myopathie
Zu den Risikofaktoren für Myopathie gehören ein Alter ab 65 Jahren, eine unkontrollierte Hypothyreose, Nierenfunktionsstörung, die gleichzeitige Anwendung mit bestimmten anderen Arzneimitteln und eine höhere LIPITOR-Dosierung [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Schritte zur Vorbeugung oder Verringerung des Risikos einer Myopathie und Rhabdomyolyse
Die LIPITOR-Exposition kann durch Arzneimittelwechselwirkungen aufgrund der Hemmung des Cytochrom-P450-Enzyms 3A4 (CYP3A4) und/oder von Transportern (z. B. Brustkrebs-resistentes Protein [BCRP], organisches Anionen-transportierendes Polypeptid [OATP1B1/OATP1B3] und P-Glykoprotein [P -gp]), was zu einem erhöhten Risiko für Myopathie und Rhabdomyolyse führt. Die gleichzeitige Anwendung von Ciclosporin, Gemfibrozil, Tipranavir plus Ritonavir oder Glecaprevir plus Pibrentasvir mit LIPITOR wird nicht empfohlen. Dosisanpassungen von LIPITOR 40 mg werden für Patienten empfohlen, die bestimmte antivirale Medikamente, Azol-Antimykotika oder Makrolid-Antibiotika einnehmen [siehe DOSIERUNG UND ANWENDUNG ]. Fälle von Myopathie/Rhabdomyolyse wurden bei gleichzeitiger Anwendung von Atorvastatin mit lipidmodifizierenden Dosen (> 1 Gramm/Tag) von Niacin, Fibraten, Colchicin und Ledipasvir plus Sofosbuvir berichtet. Überlegen Sie, ob der Nutzen der Anwendung dieser Produkte das erhöhte Risiko einer Myopathie und Rhabdomyolyse überwiegt [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Die gleichzeitige Einnahme großer Mengen, mehr als 1,2 Liter täglich, Grapefruitsaft wird bei Patienten, die LIPITOR einnehmen, nicht empfohlen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Setzen Sie LIPITOR ab, wenn deutlich erhöhte CK-Spiegel auftreten oder eine Myopathie diagnostiziert oder vermutet wird. Muskelsymptome und CK-Anstiege können zurückgehen, wenn LIPITOR abgesetzt wird. Setzen Sie LIPITOR 40 mg vorübergehend bei Patienten ab, die an einer akuten oder schweren Erkrankung leiden, bei der ein hohes Risiko für die Entwicklung einer Niereninsuffizienz infolge einer Rhabdomyolyse besteht (z. B. Sepsis, Schock, schwere Hypovolämie, größere Operation, Trauma, schwere Stoffwechsel-, Hormon- oder Elektrolytstörungen oder unkontrollierte Epilepsie). .
Informieren Sie die Patienten über das Risiko einer Myopathie und Rhabdomyolyse, wenn Sie mit der LIPITOR-Dosierung beginnen oder diese erhöhen. Weisen Sie die Patienten an, unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden.
Immunvermittelte nekrotisierende Myopathie
Es gab seltene Berichte über immunvermittelte nekrotisierende Myopathie (IMNM), eine Autoimmunmyopathie, die mit der Anwendung von Statinen in Verbindung gebracht wurde. IMNM ist gekennzeichnet durch: proximale Muskelschwäche und erhöhte Serum-Kreatinkinase, die trotz Absetzen der Statinbehandlung bestehen bleiben; positiver Anti-HMG-CoA-Reduktase-Antikörper; Muskelbiopsie, die eine nekrotisierende Myopathie zeigt; und Verbesserung mit Immunsuppressiva. Zusätzliche neuromuskuläre und serologische Tests können erforderlich sein. Eine Behandlung mit Immunsuppressiva kann erforderlich sein. Wägen Sie das IMNM-Risiko sorgfältig ab, bevor Sie mit einem anderen Statin beginnen. Wenn die Therapie mit einem anderen Statin begonnen wird, ist auf Anzeichen und Symptome einer IMNM zu achten.
Leberfunktionsstörung
Statine wurden wie einige andere lipidsenkende Therapien mit biochemischen Anomalien der Leberfunktion in Verbindung gebracht. Bei 0,7 % der Patienten, die LIPITOR in klinischen Studien erhielten, traten anhaltende Erhöhungen (> das Dreifache der Obergrenze des Normalwerts [ULN], die bei 2 oder mehr Gelegenheiten auftraten) der Serumtransaminasen auf. Die Inzidenz dieser Anomalien betrug 0,2 %, 0,2 %, 0,6 % und 2,3 % für 10, 20, 40 bzw. 80 mg.
Ein Patient in klinischen Studien entwickelte Gelbsucht. Anstiege der Leberfunktionstests (LFT) bei anderen Patienten waren nicht mit Gelbsucht oder anderen klinischen Anzeichen oder Symptomen verbunden. Nach Dosisreduktion, Unterbrechung oder Absetzen der Behandlung kehrten die Transaminasespiegel ohne Folgeerscheinungen auf oder in die Nähe der Werte vor der Behandlung zurück. Achtzehn von 30 Patienten mit anhaltenden LFT-Erhöhungen setzten die Behandlung mit einer reduzierten Dosis von LIPITOR fort.
Es wird empfohlen, vor Beginn der Therapie mit LIPITOR 40 mg Leberenzymtests durchzuführen und diese nach klinischer Indikation zu wiederholen. Es gab seltene Postmarketing-Berichte über tödliches und nicht tödliches Leberversagen bei Patienten, die Statine, einschließlich Atorvastatin, einnahmen. Wenn während der Behandlung mit LIPITOR 10 mg eine schwere Leberschädigung mit klinischen Symptomen und/oder Hyperbilirubinämie oder Gelbsucht auftritt, ist die Behandlung unverzüglich zu unterbrechen. Wenn keine alternative Ätiologie gefunden wird, starten Sie LIPITOR nicht neu.
LIPITOR 10 mg sollte bei Patienten, die erhebliche Mengen Alkohol konsumieren und/oder eine Lebererkrankung in der Vorgeschichte haben, mit Vorsicht angewendet werden. Eine aktive Lebererkrankung oder ungeklärte anhaltende Transaminasenerhöhungen sind Kontraindikationen für die Anwendung von LIPITOR [siehe KONTRAINDIKATIONEN ].
Endokrine Funktion
Bei HMG-CoA-Reduktase-Hemmern, einschließlich LIPITOR, wurde über einen Anstieg des HbA1c und des Nüchtern-Serumglukosespiegels berichtet.
Statine stören die Cholesterinsynthese und könnten theoretisch die adrenale und/oder gonadale Steroidproduktion dämpfen. Klinische Studien haben gezeigt, dass LIPITOR 20 mg die basale Cortisolkonzentration im Plasma nicht senkt oder die Nebennierenreserve beeinträchtigt. Die Auswirkungen von Statinen auf die männliche Fertilität wurden nicht an einer ausreichenden Anzahl von Patienten untersucht. Die Auswirkungen, falls vorhanden, auf die Hypophysen-Gonaden-Achse bei prämenopausalen Frauen sind nicht bekannt. Vorsicht ist geboten, wenn ein Statin gleichzeitig mit Arzneimitteln verabreicht wird, die den Spiegel oder die Aktivität von endogenen Steroidhormonen verringern können, wie z. B. Ketoconazol, Spironolacton und Cimetidin.
ZNS-Toxizität
Bei einer Hündin, die 3 Monate lang mit 120 mg/kg/Tag behandelt wurde, wurde eine Gehirnblutung beobachtet. Hirnblutung und Vakuolisierung des Sehnervs wurden bei einer anderen Hündin beobachtet, die nach 11 Wochen eskalierender Dosen bis zu 280 mg/kg/Tag in moribundem Zustand getötet wurde. Die Dosis von 120 mg/kg führte zu einer systemischen Exposition, die etwa dem 16-Fachen der menschlichen Plasma-Fläche unter der Kurve (AUC, 0–24 Stunden) entspricht, basierend auf der maximalen Dosis von 80 mg/Tag beim Menschen. In einer 2-Jahres-Studie wurde bei jedem von 2 männlichen Hunden (einer wurde mit 10 mg/kg/Tag und einer mit 120 mg/kg/Tag behandelt) ein einzelner tonischer Krampf beobachtet. Bei Mäusen wurden nach einer chronischen Behandlung von bis zu 2 Jahren mit Dosen bis zu 400 mg/kg/Tag oder bei Ratten mit Dosen bis zu 100 mg/kg/Tag keine ZNS-Läsionen beobachtet. Diese Dosen waren das 6- bis 11-fache (Maus) und das 8- bis 16-fache (Ratte) der humanen AUC (0–24), basierend auf der maximal empfohlenen Humandosis von 80 mg/Tag.
ZNS-Gefäßläsionen, gekennzeichnet durch perivaskuläre Blutungen, Ödeme und mononukleäre Zellinfiltration perivaskulärer Räume, wurden bei Hunden beobachtet, die mit anderen Vertretern dieser Klasse behandelt wurden. Ein chemisch ähnliches Medikament dieser Klasse führte bei klinisch normalen Hunden in dosisabhängiger Weise zu einer Degeneration des Sehnervs (Wallersche Degeneration der retinogenen Fasern) bei einer Dosis, die zu Plasmaspiegeln führte, die etwa 30-mal höher waren als die mittleren Wirkstoffspiegel bei Menschen, die die höchste Dosis einnahmen empfohlene Dosis.
Anwendung bei Patienten mit aktuellem Schlaganfall oder TIA
In einer Post-hoc-Analyse der Studie „Stroke Prevention by Aggressive Reduction in Cholesterol Levels“ (SPARCL), in der 4.731 Patienten ohne KHK, die innerhalb der vorangegangenen 6 Monate einen Schlaganfall oder eine TIA hatten, LIPITOR 80 mg vs. Placebo verabreicht wurde, war eine höhere Inzidenz von hämorrhagischer Schlaganfall wurde in der LIPITOR-80-mg-Gruppe im Vergleich zu Placebo beobachtet (55, 2,3 % Atorvastatin vs. 33, 1,4 % Placebo; HR: 1,68, 95 % KI: 1,09, 2,59; p = 0,0168). Die Inzidenz tödlicher hämorrhagischer Schlaganfälle war in allen Behandlungsgruppen ähnlich (17 vs. 18 in der Atorvastatin- bzw. Placebogruppe). Die Inzidenz nicht tödlicher hämorrhagischer Schlaganfälle war in der Atorvastatin-Gruppe (38, 1,6 %) signifikant höher als in der Placebo-Gruppe (16, 0,7 %).
Einige Ausgangscharakteristika, einschließlich hämorrhagischer und lakunärer Schlaganfälle bei Studieneintritt, waren mit einer höheren Inzidenz von hämorrhagischen Schlaganfällen in der Atorvastatin-Gruppe verbunden [siehe NEBENWIRKUNGEN ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Patienten, die LIPITOR 10 mg einnehmen, sollten darauf hingewiesen werden, dass Cholesterin eine chronische Erkrankung ist, und sie sollten ihre Medikation zusammen mit ihrer vom National Cholesterol Education Program (NCEP) empfohlenen Diät, einem angemessenen regelmäßigen Trainingsprogramm und regelmäßigen Tests eines Nüchtern-Lipid-Panels einhalten Zielerreichung bestimmen.
Patienten sollten über Substanzen aufgeklärt werden, die sie nicht gleichzeitig mit Atorvastatin einnehmen sollten [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN]. Patienten sollten auch angewiesen werden, andere medizinische Fachkräfte, die ein neues Medikament verschreiben, darüber zu informieren, dass sie LIPITOR einnehmen.
Muskelschmerzen
Alle Patienten, die eine Therapie mit LIPITOR beginnen, sollten auf das Risiko einer Myopathie hingewiesen und aufgefordert werden, unerklärliche Muskelschmerzen, -empfindlichkeit oder -schwäche unverzüglich zu melden, insbesondere wenn sie von Unwohlsein oder Fieber begleitet werden oder wenn diese Muskelzeichen oder -symptome nach Absetzen von LIPITOR anhalten. Das Risiko dafür ist erhöht, wenn bestimmte Arten von Medikamenten eingenommen werden oder größere Mengen (> 1 Liter) Grapefruitsaft konsumiert werden. Sie sollten alle Medikamente, sowohl verschreibungspflichtige als auch rezeptfreie, mit ihrem Arzt besprechen.
Leberenzyme
Es wird empfohlen, vor Beginn der Behandlung mit LIPITOR 40 mg und beim Auftreten von Anzeichen oder Symptomen einer Leberschädigung Leberenzymtests durchzuführen. Allen mit LIPITOR behandelten Patienten sollte geraten werden, unverzüglich alle Symptome zu melden, die auf eine Leberschädigung hindeuten könnten, einschließlich Müdigkeit, Anorexie, Beschwerden im rechten Oberbauch, dunkler Urin oder Gelbsucht.
Embryofetale Toxizität
Weisen Sie gebärfähige Frauen auf das Risiko für einen Fötus hin, wenden Sie während der Behandlung eine wirksame Empfängnisverhütung an und informieren Sie Ihren Arzt über eine bekannte oder vermutete Schwangerschaft [siehe KONTRAINDIKATIONEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie Frauen, während der Behandlung mit LIPITOR nicht zu stillen [siehe KONTRAINDIKATIONEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Die Kennzeichnung dieses Produkts wurde möglicherweise aktualisiert. Die neuesten Verschreibungsinformationen finden Sie unter www.pfizer.com.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 2-Jahres-Karzinogenitätsstudie an Ratten mit Dosierungen von 10, 30 und 100 mg/kg/Tag wurden 2 seltene Tumoren im Muskel von Weibchen mit hoher Dosis gefunden: bei einem gab es ein Rhabdomyosarkom und bei einem anderen Es lag ein Fibrosarkom vor. Diese Dosis stellt einen Plasma-AUC-Wert (0–24) dar, der ungefähr dem 16-fachen der mittleren Humanplasma-Medikamentenexposition nach einer oralen Dosis von 80 mg entspricht.
Eine 2-Jahres-Karzinogenitätsstudie an Mäusen, denen 100, 200 oder 400 mg/kg/Tag verabreicht wurden, führte zu einer signifikanten Zunahme von Leberadenomen bei männlichen Tieren mit hoher Dosis und Leberkarzinomen bei weiblichen Tieren mit hoher Dosis. Diese Befunde traten bei Plasma-AUC-Werten (0–24) auf, die etwa dem 6-Fachen der mittleren Humanplasma-Medikamentenexposition nach einer oralen Dosis von 80 mg entsprachen.
In vitro war Atorvastatin in den folgenden Tests mit und ohne metabolische Aktivierung nicht mutagen oder klastogen: Ames-Test mit Salmonella typhimurium und Escherichia coli, HGPRT-Vorwärtsmutationstest in Lungenzellen des chinesischen Hamsters und Chromosomenaberrationstest in Lungenzellen des chinesischen Hamsters . Atorvastatin war im In-vivo-Maus-Mikrokerntest negativ.
Bei weiblichen Ratten verursachte Atorvastatin in Dosen von bis zu 225 mg/kg (56-fache Exposition beim Menschen) keine nachteiligen Auswirkungen auf die Fertilität. Studien an männlichen Ratten, die mit Dosen von bis zu 175 mg/kg (15-fache Exposition beim Menschen) durchgeführt wurden, führten zu keinen Veränderungen der Fertilität. Bei 2 von 10 Ratten, die 3 Monate lang mit 100 mg/kg/Tag Atorvastatin behandelt wurden (das 16-fache der menschlichen AUC bei der 80-mg-Dosis), traten Aplasie und Aspermie in den Nebenhoden auf; die Hodengewichte waren bei 30 und 100 mg/kg signifikant geringer und das Nebenhodengewicht war bei 100 mg/kg geringer. Männliche Ratten, denen 11 Wochen vor der Paarung 100 mg/kg/Tag verabreicht wurden, zeigten eine verringerte Spermienmotilität, eine verringerte Konzentration des Spermatidenkopfes und eine erhöhte abnorme Spermienzahl. Atorvastatin verursachte bei Hunden, die zwei Jahre lang Dosen von 10, 40 oder 120 mg/kg erhielten, keine unerwünschten Wirkungen auf die Spermienparameter oder die Histopathologie der Fortpflanzungsorgane.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
LIPITOR 10 mg ist für die Anwendung bei schwangeren Frauen kontraindiziert, da die Unbedenklichkeit bei schwangeren Frauen nicht nachgewiesen wurde und es keinen offensichtlichen Nutzen von lipidsenkenden Arzneimitteln während der Schwangerschaft gibt. Da HMG-CoA-Reduktase-Hemmer die Cholesterinsynthese und möglicherweise die Synthese anderer aus Cholesterin gewonnener biologisch aktiver Substanzen verringern, kann LIPITOR bei Verabreichung an eine schwangere Frau den Fötus schädigen. LIPITOR 40 mg sollte abgesetzt werden, sobald eine Schwangerschaft erkannt wird [siehe KONTRAINDIKATIONEN ]. Begrenzte veröffentlichte Daten zur Anwendung von Atorvastatin reichen nicht aus, um ein arzneimittelbedingtes Risiko schwerer angeborener Fehlbildungen oder Fehlgeburten zu bestimmen. In tierexperimentellen Reproduktionsstudien an Ratten und Kaninchen gab es keine Hinweise auf embryofetale Toxizität oder angeborene Fehlbildungen bei Dosen, die das 30- bzw. 20-fache der menschlichen Exposition bei der maximal empfohlenen Humandosis (MRHD) von 80 mg, bezogen auf den Körper, betrugen Oberfläche (mg/m). Bei Ratten, denen während der Trächtigkeit und Laktation Atorvastatin verabreicht wurde, wurde bei Dosen ≥ dem 6-Fachen der MRHD ein verringertes postnatales Wachstum und eine verminderte Entwicklung beobachtet (siehe Daten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Daten
Menschliche Daten
Begrenzte veröffentlichte Daten zu Atorvastatin-Calcium aus Beobachtungsstudien, Metaanalysen und Fallberichten haben kein erhöhtes Risiko für schwere angeborene Fehlbildungen oder Fehlgeburten gezeigt. Seltene Berichte über angeborene Anomalien wurden nach intrauteriner Exposition gegenüber anderen HMGCoA-Reduktase-Inhibitoren erhalten. In einer Überprüfung von etwa 100 prospektiv verfolgten Schwangerschaften bei Frauen, die Simvastatin oder Lovastatin ausgesetzt waren, überstieg die Inzidenz angeborener Anomalien, spontaner Aborte und fötaler Todesfälle/Totgeburten nicht das, was in der Allgemeinbevölkerung zu erwarten wäre. Die Anzahl der Fälle ist ausreichend, um eine ≥ 3- bis 4-fache Zunahme angeborener Anomalien gegenüber der Hintergrundinzidenz auszuschließen. Bei 89 % der prospektiv verfolgten Schwangerschaften wurde die medikamentöse Behandlung vor der Schwangerschaft begonnen und irgendwann im ersten Trimester bei Feststellung einer Schwangerschaft abgebrochen.
Tierdaten
Atorvastatin passiert die Rattenplazenta und erreicht in der fötalen Leber einen Spiegel, der dem des mütterlichen Plasmas entspricht. Atorvastatin wurde trächtigen Ratten und Kaninchen während der Organogenese in oralen Dosen von bis zu 300 mg/kg/Tag bzw. 100 mg/kg/Tag verabreicht. Atorvastatin war bei Ratten in Dosen von bis zu 300 mg/kg/Tag und bei Kaninchen in Dosen von bis zu 100 mg/kg/Tag nicht teratogen. Diese Dosen führten zu einer etwa 30-fachen (Ratte) oder 20-fachen (Kaninchen) Exposition des Menschen bei der MRHD, basierend auf der Oberfläche (mg/m2). Bei Ratten führte die für das Muttertier toxische Dosis von 300 mg/kg zu einem erhöhten Postimplantationsverlust und einem verringerten fötalen Körpergewicht. Bei den für das Muttertier toxischen Dosen von 50 und 100 mg/kg/Tag bei Kaninchen kam es zu einem erhöhten Postimplantationsverlust, und bei 100 mg/kg/Tag war das fötale Körpergewicht verringert.
In einer Studie an trächtigen Ratten, denen 20, 100 oder 225 mg/kg/Tag vom 7. Trächtigkeitstag bis zum 20. Laktationstag (Entwöhnung) verabreicht wurden, kam es bei den Welpen zu einer verringerten Überlebensrate bei der Geburt, am 4. postnatalen Tag, beim Absetzen und nach dem Absetzen von Müttern mit einer Dosis von 225 mg/kg/Tag, einer Dosis, bei der maternale Toxizität beobachtet wurde. Das Körpergewicht der Jungtiere wurde bis zum postnatalen Tag 21 bei 100 mg/kg/Tag und bis zum postnatalen Tag 91 bei 225 mg/kg/Tag verringert. Die Jungtierentwicklung war verzögert (Rotarodleistung bei 100 mg/kg/Tag und akustischer Schreck bei 225 mg/kg/Tag; Ohrmuschelablösung und Augenöffnung bei 225 mg/kg/Tag). Diese Dosen entsprechen dem 6-fachen (100 mg/kg) und dem 22-fachen (225 mg/kg) der Humanexposition bei der MRHD, basierend auf der AUC.
Stillzeit
Zusammenfassung der Risiken
Die Anwendung von LIPITOR 40 mg ist während der Stillzeit kontraindiziert [siehe KONTRAINDIKATIONEN ]. Es liegen keine Informationen über die Auswirkungen des Arzneimittels auf den gestillten Säugling oder die Auswirkungen des Arzneimittels auf die Milchproduktion vor. Es ist nicht bekannt, ob Atorvastatin in der Muttermilch vorhanden ist, aber es wurde gezeigt, dass ein anderes Arzneimittel dieser Klasse in die Muttermilch übergeht und Atorvastatin in der Rattenmilch vorhanden ist. Wegen der Möglichkeit schwerwiegender Nebenwirkungen bei einem gestillten Säugling weisen Sie Frauen darauf hin, dass das Stillen während der Behandlung mit LIPITOR nicht empfohlen wird.
Weibchen und Männchen mit reproduktivem Potenzial
Empfängnisverhütung
LIPITOR kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Weisen Sie gebärfähige Frauen an, während der Behandlung mit LIPITOR eine wirksame Verhütungsmethode anzuwenden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrische Verwendung
Heterozygote familiäre Hypercholesterinämie (HeFH)
Die Sicherheit und Wirksamkeit von LIPITOR 20 mg wurde bei pädiatrischen Patienten im Alter von 10 bis 17 Jahren mit HeFH als Ergänzung zu einer Diät zur Senkung des Gesamtcholesterinspiegels, des LDL-C- und des Apo-B-Spiegels nach einem angemessenen Diätversuch nachgewiesen Therapie sind vorhanden:
Die Anwendung von LIPITOR 20 mg für diese Indikation wird durch Beweise gestützt von [siehe DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE , und Klinische Studien ]:
Informieren Sie Mädchen nach der Menarche über Empfehlungen zur Empfängnisverhütung, falls dies für die Patientin angemessen ist [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Die langfristige Wirksamkeit einer im Kindesalter eingeleiteten LIPITOR-Therapie zur Verringerung der Morbidität und Mortalität im Erwachsenenalter wurde nicht nachgewiesen.
Die Sicherheit und Wirksamkeit von LIPITOR 10 mg wurde bei pädiatrischen Patienten unter 10 Jahren mit HeFH nicht nachgewiesen.
Homozygote Familiäre Hypercholesterinämie (HoFH)
Die klinische Wirksamkeit von LIPITOR 20 mg mit Dosierungen von bis zu 80 mg/Tag für 1 Jahr wurde in einer unkontrollierten Studie an Patienten mit HoFH, einschließlich 8 pädiatrischer Patienten, untersucht [siehe Klinische Studien ].
Geriatrische Verwendung
Von den 39.828 Patienten, die LIPITOR 40 mg in klinischen Studien erhielten, waren 15.813 (40 %) ≥ 65 Jahre und 2.800 (7 %) ≥ 75 Jahre alt. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Erwachsener kann nicht ausgeschlossen werden. Da fortgeschrittenes Alter (≥65 Jahre) ein prädisponierender Faktor für Myopathie ist, sollte LIPITOR bei älteren Patienten mit Vorsicht verschrieben werden.
Leberfunktionsstörung
Lipitor ist kontraindiziert bei Patienten mit aktiver Lebererkrankung, die unerklärliche anhaltende Erhöhungen der hepatischen Transaminasespiegel beinhalten kann [siehe KONTRAINDIKATIONEN und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Es gibt keine spezifische Behandlung für eine LIPITOR-Überdosierung. Im Falle einer Überdosierung sollte der Patient symptomatisch behandelt und erforderlichenfalls unterstützende Maßnahmen eingeleitet werden. Aufgrund der starken Bindung des Arzneimittels an Plasmaproteine ist nicht zu erwarten, dass die Hämodialyse die Clearance von LIPITOR 20 mg signifikant erhöht.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
LIPITOR 20 mg ist ein selektiver, kompetitiver Hemmer der HMG-CoA-Reduktase, des geschwindigkeitsbestimmenden Enzyms, das 3-Hydroxy-3-methylglutaryl-Coenzym A in Mevalonat umwandelt, einen Vorläufer von Sterolen, einschließlich Cholesterin. In Tiermodellen senkt LIPITOR 40 mg den Cholesterin- und Lipoproteinspiegel im Plasma, indem es die HMG-CoA-Reduktase und die Cholesterinsynthese in der Leber hemmt und die Anzahl der hepatischen LDL-Rezeptoren auf der Zelloberfläche erhöht, um die Aufnahme und den Abbau von LDL zu verbessern; LIPITOR reduziert auch die LDL-Produktion und die Anzahl der LDL-Partikel.
Pharmakodynamik
LIPITOR sowie einige seiner Metaboliten sind beim Menschen pharmakologisch aktiv. Die Leber ist der primäre Wirkungsort und der Hauptort der Cholesterinsynthese und LDL-Clearance. Die Medikamentendosis korreliert besser mit der LDL-C-Senkung als die systemische Medikamentenkonzentration. Die Individualisierung der Arzneimitteldosierung sollte auf dem therapeutischen Ansprechen basieren [siehe DOSIERUNG UND ANWENDUNG ].
Pharmakokinetik
Absorption
LIPITOR wird nach oraler Verabreichung schnell resorbiert; maximale Plasmakonzentrationen treten innerhalb von 1 bis 2 Stunden auf. Das Ausmaß der Resorption steigt proportional zur LIPITOR-Dosis. Die absolute Bioverfügbarkeit von Atorvastatin (Mutterarzneimittel) beträgt etwa 14 % und die systemische Verfügbarkeit der HMG-CoA-Reduktase-Inhibitoraktivität beträgt etwa 30 %. Die geringe systemische Verfügbarkeit wird der präsystemischen Clearance in der Magen-Darm-Schleimhaut und/oder dem hepatischen First-Pass-Metabolismus zugeschrieben. Obwohl Nahrung die Geschwindigkeit und das Ausmaß der Arzneimittelresorption um etwa 25 % bzw. 9 % verringert, wie durch Cmax und AUC bestimmt, ist die LDL-C-Senkung ähnlich, unabhängig davon, ob LIPITOR 40 mg mit oder ohne Nahrung verabreicht wird. Plasmakonzentrationen von LIPITOR 20 mg sind nach abendlicher Verabreichung des Arzneimittels niedriger (ca. 30 % für Cmax und AUC) als morgens. Die LDL-C-Senkung ist jedoch unabhängig von der Tageszeit der Arzneimittelverabreichung gleich [vgl DOSIERUNG UND ANWENDUNG ].
Verteilung
Das mittlere Verteilungsvolumen von LIPITOR 20 mg beträgt etwa 381 Liter. LIPITOR 20 mg ist zu ≥ 98 % an Plasmaproteine gebunden. Ein Blut/Plasma-Verhältnis von ungefähr 0,25 weist auf eine schlechte Penetration des Arzneimittels in die roten Blutkörperchen hin. Basierend auf Beobachtungen bei Ratten wird LIPITOR 10 mg wahrscheinlich in die Muttermilch ausgeschieden [siehe KONTRAINDIKATIONEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Stoffwechsel
LIPITOR 20 mg wird umfassend zu ortho- und parahydroxylierten Derivaten und verschiedenen Beta-Oxidationsprodukten metabolisiert. Die In-vitro-Hemmung der HMG-CoA-Reduktase durch ortho- und parahydroxylierte Metaboliten entspricht der von LIPITOR. Ungefähr 70 % der zirkulierenden Hemmaktivität für HMG-CoA-Reduktase werden aktiven Metaboliten zugeschrieben. In-vitro-Studien weisen auf die Bedeutung der Metabolisierung von LIPITOR 40 mg durch Cytochrom P450 3A4 hin, was mit erhöhten Plasmakonzentrationen von LIPITOR 20 mg beim Menschen nach gleichzeitiger Verabreichung mit Erythromycin, einem bekannten Inhibitor dieses Isozyms, übereinstimmt [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Bei Tieren wird der ortho-Hydroxy-Metabolit einer weiteren Glucuronidierung unterzogen.
Ausscheidung
LIPITOR 20 mg und seine Metaboliten werden nach hepatischer und/oder extrahepatischer Metabolisierung hauptsächlich über die Galle ausgeschieden; das Medikament scheint jedoch keiner enterohepatischen Rezirkulation zu unterliegen. Die mittlere Plasmaeliminationshalbwertszeit von LIPITOR beträgt beim Menschen etwa 14 Stunden, aber die Halbwertszeit der inhibitorischen Aktivität für HMG-CoA-Reduktase beträgt 20 bis 30 Stunden aufgrund des Beitrags aktiver Metaboliten. Weniger als 2 % einer LIPITOR-Dosis werden nach oraler Verabreichung im Urin wiedergefunden.
Spezifische Populationen
Geriatrie
Die Plasmakonzentrationen von LIPITOR sind bei gesunden älteren Probanden (Alter ≥ 65 Jahre) höher (ca. 40 % für Cmax und 30 % für AUC) als bei jungen Erwachsenen. Klinische Daten deuten auf eine stärkere LDL-Senkung bei jeder Dosis des Arzneimittels bei älteren Patienten im Vergleich zu jüngeren Erwachsenen hin [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrie
Die scheinbare orale Clearance von Atorvastatin bei pädiatrischen Probanden schien der von Erwachsenen ähnlich zu sein, wenn sie allometrisch nach Körpergewicht skaliert wurde, da das Körpergewicht die einzige signifikante Kovariate im Populations-PK-Modell von Atorvastatin mit Daten war, die pädiatrische HeFH-Patienten (im Alter von 10 bis 17 Jahren, n=29) in einer offenen, 8-wöchigen Studie.
Geschlecht
Die Plasmakonzentrationen von LIPITOR 40 mg bei Frauen unterscheiden sich von denen bei Männern (ungefähr 20 % höher für Cmax und 10 % niedriger für AUC); Es gibt jedoch keinen klinisch signifikanten Unterschied in der LDL-C-Senkung mit LIPITOR 10 mg zwischen Männern und Frauen.
Nierenfunktionsstörung
Eine Nierenerkrankung hat keinen Einfluss auf die Plasmakonzentrationen oder die LDL-C-Senkung von LIPITOR; daher ist eine Dosisanpassung bei Patienten mit Nierenfunktionsstörung nicht erforderlich [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hämodialyse
Obwohl keine Studien an Patienten mit Nierenerkrankungen im Endstadium durchgeführt wurden, ist nicht zu erwarten, dass die Hämodialyse die Clearance von LIPITOR 10 mg signifikant erhöht, da das Arzneimittel stark an Plasmaproteine gebunden wird.
Leberfunktionsstörung
Bei Patienten mit chronischer alkoholbedingter Lebererkrankung sind die Plasmakonzentrationen von LIPITOR deutlich erhöht. Cmax und AUC sind bei Patienten mit Childs-Pugh-A-Krankheit jeweils 4-mal höher. Cmax und AUC sind bei Patienten mit Childs-Pugh-B-Krankheit etwa 16-fach bzw. 11-fach erhöht [siehe KONTRAINDIKATIONEN ].
Arzneimittelwechselwirkungsstudien
Atorvastatin ist ein Substrat der hepatischen Transporter, OATP1B1- und OATP1B3-Transporter. Metaboliten von Atorvastatin sind Substrate von OATP1B1. Atorvastatin wird auch als Substrat des Efflux-Transporters BCRP identifiziert, der die intestinale Resorption und biliäre Clearance von Atorvastatin einschränken kann.
TABELLE 6: Wirkung gleichzeitig verabreichter Arzneimittel auf die Pharmakokinetik von Atorvastatin
TABELLE 7: Wirkung von Atorvastatin auf die Pharmakokinetik von gleichzeitig verabreichten Arzneimitteln
LIPITOR hatte keine klinisch signifikante Wirkung auf die Prothrombinzeit, wenn es Patienten verabreicht wurde, die eine chronische Behandlung mit Warfarin erhielten.
Klinische Studien
Prävention von Herz-Kreislauf-Erkrankungen
In der Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) wurde die Wirkung von LIPITOR 10 mg auf tödliche und nicht tödliche koronare Herzerkrankungen bei 10.305 Bluthochdruckpatienten im Alter von 40 bis 80 Jahren (Mittelwert 63 Jahre) ohne vorherige Myokarderkrankung untersucht Infarkt und mit TC-Werten ≤251 mg/dl (6,5 mmol/l). Zusätzlich hatten alle Patienten mindestens 3 der folgenden kardiovaskulären Risikofaktoren: männliches Geschlecht (81,1 %), Alter > 55 Jahre (84,5 %), Rauchen (33,2 %), Diabetes (24,3 %), KHK in der Anamnese in einem ersten Grad relativ (26 %), TC:HDL >6 (14,3 %), periphere Gefäßerkrankung (5,1 %), linksventrikuläre Hypertrophie (14,4 %), früheres zerebrovaskuläres Ereignis (9,8 %), spezifische EKG-Anomalie (14,3 %), Proteinurie /Albuminurie (62,4 %). In dieser doppelblinden, placebokontrollierten Studie wurden die Patienten mit einer blutdrucksenkenden Therapie behandelt (Ziel-Blutdruck
Die Wirkung von 10 mg/Tag LIPITOR auf die Lipidspiegel war ähnlich wie in früheren klinischen Studien.
LIPITOR reduzierte signifikant die Rate koronarer Ereignisse [entweder tödliche koronare Herzkrankheit (46 Ereignisse in der Placebo-Gruppe vs. 40 Ereignisse in der LIPITOR-40-mg-Gruppe) oder nicht-tödlichen MI (108 Ereignisse in der Placebo-Gruppe vs. 60 Ereignisse in der LIPITOR-Gruppe). 20-mg-Gruppe)] mit einer relativen Risikoreduktion von 36 % [(basierend auf Inzidenzen von 1,9 % für LIPITOR 40 mg vs. 3,0 % für Placebo), p = 0,0005 (siehe Abbildung 1)]. Die Risikoreduktion war unabhängig von Alter, Raucherstatus, Fettleibigkeit oder Vorliegen einer Nierenfunktionsstörung konsistent. Die Wirkung von LIPITOR wurde unabhängig von den LDL-Ausgangswerten beobachtet. Aufgrund der geringen Anzahl von Veranstaltungen waren die Ergebnisse für Frauen nicht schlüssig.
Abbildung 1: Wirkung von LIPITOR 10 mg/Tag auf die kumulative Inzidenz von nicht tödlichem Myokardinfarkt oder Tod durch koronare Herzkrankheit (bei ASCOT-LLA)
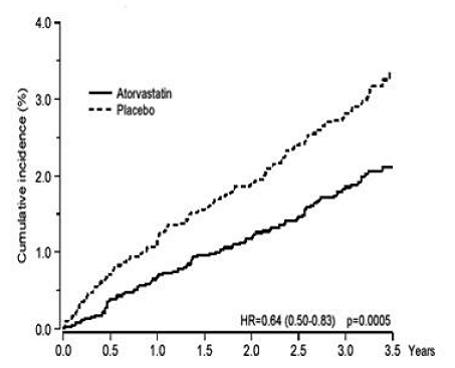
LIPITOR 40 mg verringerte auch signifikant das relative Risiko für Revaskularisationsverfahren um 42 % (Inzidenz von 1,4 % für LIPITOR 20 mg und 2,5 % für Placebo). Obwohl die Reduktion tödlicher und nicht tödlicher Schlaganfälle kein vordefiniertes Signifikanzniveau (p = 0,01) erreichte, wurde ein günstiger Trend mit einer relativen Risikoreduktion von 26 % beobachtet (Inzidenz von 1,7 % für LIPITOR und 2,3 % für Placebo). . Es gab keinen signifikanten Unterschied zwischen den Behandlungsgruppen für Tod aufgrund kardiovaskulärer Ursachen (p = 0,51) oder nicht kardiovaskulärer Ursachen (p = 0,17).
In der Collaborative Atorvastatin Diabetes Study (CARDS) wurde die Wirkung von LIPITOR auf die Endpunkte von Herz-Kreislauf-Erkrankungen (CVD) bei 2838 Probanden (94 % Weiße, 68 % Männer) im Alter von 40–75 Jahren mit Typ-2-Diabetes nach WHO-Kriterien untersucht. ohne Vorgeschichte einer kardiovaskulären Erkrankung und mit LDL ≤ 160 mg/dl und TG ≤ 600 mg/dl. Zusätzlich zu Diabetes wiesen die Probanden einen oder mehrere der folgenden Risikofaktoren auf: derzeitiges Rauchen (23 %), Bluthochdruck (80 %), Retinopathie (30 %) oder Mikroalbuminurie (9 %) oder Makroalbuminurie (3 %). Es wurden keine Patienten mit Hämodialyse in die Studie aufgenommen. In dieser multizentrischen, placebokontrollierten, doppelblinden klinischen Studie wurden die Probanden nach dem Zufallsprinzip entweder täglich 10 mg LIPITOR (1429) oder Placebo (1411) im Verhältnis 1:1 zugeteilt und über eine mittlere Dauer von 3,9 Jahren nachbeobachtet. Der primäre Endpunkt war das Auftreten eines der wichtigsten kardiovaskulären Ereignisse: Myokardinfarkt, akuter KHK-Tod, instabile Angina pectoris, koronare Revaskularisation oder Schlaganfall. Die primäre Analyse war die Zeit bis zum ersten Auftreten des primären Endpunkts.
Ausgangscharakteristika der Probanden waren: mittleres Alter von 62 Jahren, mittlerer HbA 7,7 %; mittlerer LDL-C-Wert 120 mg/dl; mittlerer TC 207 mg/dl; mittlere TG 151 mg/dl; mittlerer HDL-C-Wert 52 mg/dl.
Die Wirkung von LIPITOR 10 mg/Tag auf die Lipidspiegel war ähnlich wie in früheren klinischen Studien.
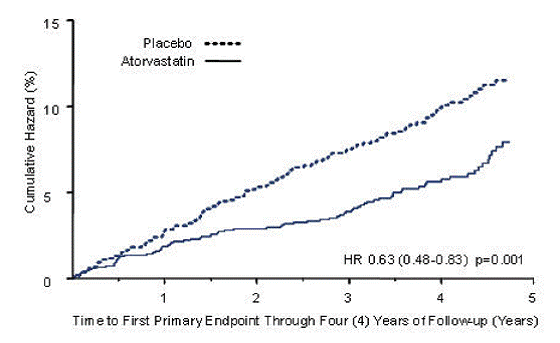
LIPITOR reduzierte signifikant die Rate schwerer kardiovaskulärer Ereignisse (primäre Endpunktereignisse) (83 Ereignisse in der LIPITOR-Gruppe vs. 127 Ereignisse in der Placebo-Gruppe) mit einer relativen Risikoreduktion von 37 %, HR 0,63, 95 % KI (0,48; 0,83) (p = 0,001) (siehe Abbildung 2). Eine Wirkung von LIPITOR wurde unabhängig von Alter, Geschlecht oder Ausgangslipidwerten beobachtet.
LIPITOR 20 mg reduzierte das Schlaganfallrisiko signifikant um 48 % (21 Ereignisse in der LIPITOR 10 mg-Gruppe vs. 39 Ereignisse in der Placebogruppe), HR 0,52, 95 % KI (0,31; 0,89) (p = 0,016) und reduzierte das Risiko von MI um 42 % (38 Ereignisse in der LIPITOR-Gruppe vs. 64 Ereignisse in der Placebo-Gruppe), HR 0,58, 95,1 % KI (0,39; 0,86) (p = 0,007). Es gab keinen signifikanten Unterschied zwischen den Behandlungsgruppen für Angina pectoris, Revaskularisierungsverfahren und akuten KHK-Tod.
Es gab 61 Todesfälle in der LIPITOR-Gruppe gegenüber 82 Todesfällen in der Placebo-Gruppe (HR 0,73, p = 0,059).
Abbildung 2: Wirkung von LIPITOR 10 mg/Tag auf die Zeit bis zum Auftreten eines schwerwiegenden kardiovaskulären Ereignisses (Myokardinfarkt, akuter KHK-Tod, instabile Angina pectoris, koronare Revaskularisation oder Schlaganfall) bei CARDS
In der Treating to New Targets Study (TNT) wurde die Wirkung von LIPITOR 80 mg/Tag vs. LIPITOR 10 mg/Tag auf die Reduktion kardiovaskulärer Ereignisse bei 10.001 Probanden (94 % Weiße, 81 % Männer, 38 % ≥ 65 Jahre) untersucht Jahren) mit klinisch offensichtlicher koronarer Herzkrankheit, die nach Abschluss einer 8-wöchigen, unverblindeten Einlaufphase mit LIPITOR 10 mg/Tag einen LDL-C-Zielwert von
Die Behandlung mit LIPITOR 80 mg/Tag reduzierte signifikant die MCVE-Rate (434 Ereignisse in der 80-mg/Tag-Gruppe vs. 548 Ereignisse in der 10-mg/Tag-Gruppe) mit einer relativen Risikoreduktion von 22 %, HR 0,78, 95 % KI (0,69, 0,89), p=0,0002 (siehe Abbildung 3 und Tabelle 9). Die Gesamtrisikoreduktion war unabhängig vom Alter (
Abbildung 3: Wirkung von LIPITOR 80 mg/Tag vs. 10 mg/Tag auf die Zeit bis zum Auftreten schwerer kardiovaskulärer Ereignisse (TNT)
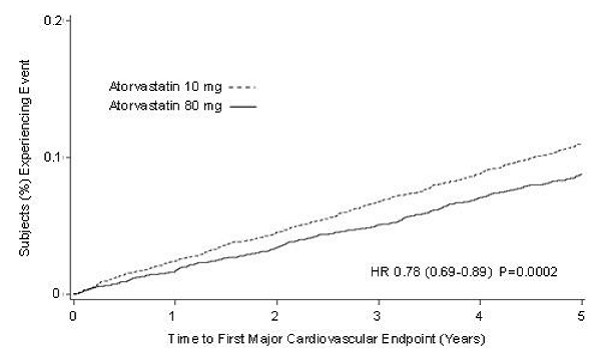
TABELLE 8: Übersicht der Wirksamkeitsergebnisse bei TNT
Von den Ereignissen, die den primären Wirksamkeitsendpunkt bildeten, reduzierte die Behandlung mit LIPITOR 80 mg/Tag signifikant die Rate nicht tödlicher, nicht durch das Verfahren bedingter Myokardinfarkte und tödlicher und nicht tödlicher Schlaganfälle, aber nicht Todesfälle durch KHK oder wiederbelebten Herzstillstand (Tabelle 8). Von den vordefinierten sekundären Endpunkten reduzierte die Behandlung mit LIPITOR 80 mg/Tag signifikant die Rate der koronaren Revaskularisation, Angina pectoris und Krankenhauseinweisungen wegen Herzinsuffizienz, aber nicht der peripheren Gefäßerkrankung. Die Reduktion der CHF-Rate bei Krankenhausaufenthalt wurde nur bei 8 % der Patienten mit CHF in der Vorgeschichte beobachtet.
Es gab keinen signifikanten Unterschied zwischen den Behandlungsgruppen für die Gesamtmortalität (Tabelle 8). Der Anteil der Patienten, die einen kardiovaskulären Tod erlitten, einschließlich der Komponenten KHK-Tod und tödlicher Schlaganfall, war in der LIPITOR-80-mg-Gruppe zahlenmäßig kleiner als in der LIPITOR-10-mg-Behandlungsgruppe. Der Anteil der Patienten, die einen nicht kardiovaskulären Tod erlitten, war in der LIPITOR 80 mg-Gruppe zahlenmäßig größer als in der LIPITOR 10 mg-Behandlungsgruppe.
In der Incremental Decrease in Endpoints Through Aggressive Lipid Lowering Study (IDEAL) wurde die Behandlung mit LIPITOR 80 mg/Tag mit der Behandlung mit Simvastatin 20–40 mg/Tag bei 8.888 Probanden im Alter von bis zu 80 Jahren mit KHK in der Anamnese verglichen beurteilen, ob eine Verringerung des kardiovaskulären Risikos erreicht werden könnte. Die Patienten waren hauptsächlich männlich (81 %), weiß (99 %) mit einem Durchschnittsalter von 61,7 Jahren und einem durchschnittlichen LDL-C-Wert von 121,5 mg/dl bei Randomisierung; 76 % erhielten eine Statintherapie. In dieser prospektiven, randomisierten, offenen, verblindeten Endpunktstudie (PROBE) ohne Einlaufphase wurden die Probanden über eine mediane Dauer von 4,8 Jahren nachbeobachtet. Die mittleren LDL-C-, TC-, TG-, HDL- und Nicht-HDL-Cholesterinwerte in Woche 12 betrugen 78, 145, 115, 45 und 100 mg/dl während der Behandlung mit 80 mg LIPITOR 40 mg und 105, 179, 142, 47 und 132 mg/dL während der Behandlung mit 20–40 mg Simvastatin.
Es gab keinen signifikanten Unterschied zwischen den Behandlungsgruppen für den primären Endpunkt, die Rate des ersten schweren koronaren Ereignisses (tödliche KHK, nicht tödlicher Myokardinfarkt und wiederbelebter Herzstillstand): 411 (9,3 %) in der Gruppe mit LIPITOR 80 mg/Tag gegenüber 463 (10,4 %) in der Simvastatin-Gruppe mit 20–40 mg/Tag, HR 0,89, 95 %-KI (0,78; 1,01), p = 0,07.
Es gab keine signifikanten Unterschiede zwischen den Behandlungsgruppen für die Gesamtmortalität: 366 (8,2 %) in der LIPITOR-80-mg/Tag-Gruppe vs. 374 (8,4 %) in der Simvastatin-20–40-mg/Tag-Gruppe. Die Anteile der Studienteilnehmer, die kardiovaskuläre oder nicht-kardiovaskuläre Todesfälle erlitten, waren in der Gruppe mit 80 mg LIPITOR und in der Gruppe mit 20–40 mg Simvastatin ähnlich.
Hyperlipidämie und gemischte Dyslipidämie
LIPITOR reduziert Gesamt-C, LDL-C, VLDL-C, Apo B und TG und erhöht HDL-C bei Patienten mit Hyperlipidämie (heterozygot familiär und nicht familiär) und gemischter Dyslipidämie (Fredrickson-Typen IIa und IIb). Das therapeutische Ansprechen wird innerhalb von 2 Wochen beobachtet, und das maximale Ansprechen wird normalerweise innerhalb von 4 Wochen erreicht und während einer chronischen Therapie aufrechterhalten.
LIPITOR ist bei einer Vielzahl von Patientenpopulationen mit Hyperlipidämie, mit und ohne Hypertriglyzeridämie, bei Männern und Frauen sowie bei älteren Menschen wirksam.
In zwei multizentrischen, placebokontrollierten Dosis-Wirkungs-Studien bei Patienten mit Hyperlipidämie reduzierte LIPITOR als Einzeldosis über 6 Wochen signifikant Gesamt-C, LDL-C, Apo B und TG. (Gepoolte Ergebnisse sind in Tabelle 9 angegeben.)
TABELLE 9: Dosis-Wirkungs-Verhältnis bei Patienten mit primärer Hyperlipidämie (angepasste mittlere prozentuale Veränderung gegenüber dem Ausgangswert)*
Bei Patienten mit Fredrickson-Hyperlipoproteinämie vom Typ IIa und IIb, gepoolt aus 24 kontrollierten Studien, betrugen die medianen (25. und 75. Perzentil) prozentualen Veränderungen des HDL-C gegenüber dem Ausgangswert für LIPITOR 10, 20, 40 und 80 mg 6,4 (-1,4, 14), 8,7 (0, 17), 7,8 (0, 16) bzw. 5,1 (-2,7, 15). Darüber hinaus zeigte die Analyse der gepoolten Daten konsistente und signifikante Abnahmen von Gesamt-C, LDL-C, TG, Gesamt-C/HDL-C und LDLC/HDL-C.
In drei multizentrischen, doppelblinden Studien bei Patienten mit Hyperlipidämie wurde LIPITOR mit anderen Statinen verglichen. Nach der Randomisierung wurden die Patienten 16 Wochen lang entweder mit LIPITOR 10 mg pro Tag oder einer festen Dosis des Vergleichsmittels behandelt (Tabelle 10).
TABELLE 10: Mittlere prozentuale Veränderung gegenüber dem Ausgangswert am Endpunkt (doppelblinde, randomisierte, aktiv kontrollierte Studien)
Die Auswirkungen der in Tabelle 10 gezeigten Unterschiede in den lipidverändernden Wirkungen zwischen den Behandlungen auf die klinischen Ergebnisse sind nicht bekannt. Tabelle 10 enthält keine Daten zum Vergleich der Wirkungen von LIPITOR 10 mg und höheren Dosen von Lovastatin, Pravastatin und Simvastatin. Die in den in der Tabelle zusammengefassten Studien verglichenen Medikamente sind nicht notwendigerweise austauschbar.
Hypertriglyzeridämie
Das Ansprechen auf LIPITOR bei 64 Patienten mit isolierter Hypertriglyceridämie (Typ Fredrickson Typ IV), die in mehreren klinischen Studien behandelt wurden, ist in der nachstehenden Tabelle aufgeführt (Tabelle 11). Bei den mit LIPITOR behandelten Patienten betrug der mittlere (min., max.) TG-Ausgangswert 565 (267–1502).
TABELLE 11: Kombinierte Patienten mit isolierter erhöhter TG: Mittlere (min., max.) prozentuale Veränderung gegenüber dem Ausgangswert
Dysbetalipoproteinämie
Die Ergebnisse einer offenen Crossover-Studie mit 16 Patienten (Genotypen: 14 Apo E2/E2 und 2 Apo E3/E2) mit Dysbetalipoproteinämie (Fredrickson Typ III) sind in der folgenden Tabelle aufgeführt (Tabelle 12).
TABELLE 12: Offene Crossover-Studie mit 16 Patienten mit Dysbetalipoproteinämie (Fredrickson Typ III)
Homozygote familiäre Hypercholesterinämie
In einer Studie ohne gleichzeitige Kontrollgruppe erhielten 29 Patienten im Alter von 6 bis 37 Jahren mit HoFH maximale Tagesdosen von 20 bis 80 mg LIPITOR. Die mittlere LDL-C-Reduktion in dieser Studie betrug 18 %. Fünfundzwanzig Patienten mit einer Senkung des LDL-Cholesterinspiegels zeigten ein mittleres Ansprechen von 20 % (Bereich von 7 % bis 53 %, Median von 24 %); die verbleibenden 4 Patienten hatten einen Anstieg des LDL-C um 7 % bis 24 %. Fünf der 29 Patienten hatten keine LDL-Rezeptorfunktion. Davon hatten 2 Patienten auch einen portokavalen Shunt und keine signifikante Senkung des LDL-C. Die verbleibenden 3 Rezeptor-negativen Patienten hatten eine mittlere LDL-C-Reduktion von 22 %.
Heterozygote familiäre Hypercholesterinämie bei pädiatrischen Patienten
In einer doppelblinden, placebokontrollierten Studie mit anschließender offener Phase wurden 187 Jungen und postmenarchale Mädchen im Alter von 10 bis 17 Jahren (Durchschnittsalter 14,1 Jahre) mit heterozygoter familiärer Hypercholesterinämie (HeFH) oder schwerer Hypercholesterinämie behandelt randomisiert für 26 Wochen auf LIPITOR (n=140) oder Placebo (n=47) und dann erhielten alle 26 Wochen lang LIPITOR 40 mg. Die Aufnahme in die Studie erforderte 1) einen LDL-C-Ausgangswert von ≥ 190 mg/dl oder 2) einen LDL-C-Ausgangswert von ≥ 160 mg/dl und eine positive Familienanamnese für FH oder eine dokumentierte vorzeitige kardiovaskuläre Erkrankung ersten oder zweiten Grades relativ. Der mittlere LDL-C-Ausgangswert betrug 218,6 mg/dl (Spanne: 138,5–385,0 mg/dl) in der LIPITOR-Gruppe im Vergleich zu 230,0 mg/dl (Spanne: 160,0–324,5 mg/dl) in der Placebogruppe . Die Dosierung von LIPITOR (einmal täglich) betrug in den ersten 4 Wochen 10 mg und wurde auf 20 mg hochtitriert, wenn der LDL-C-Spiegel > 130 mg/dl war. Die Anzahl der mit LIPITOR behandelten Patienten, die nach Woche 4 während der doppelblinden Phase eine Auftitration auf 20 mg benötigten, betrug 78 (55,7 %).
LIPITOR 10 mg senkte die Plasmaspiegel von Gesamt-C, LDL-C, Triglyceriden und Apolipoprotein B während der 26-wöchigen Doppelblindphase signifikant (siehe Tabelle 13).
TABELLE 13: Lipidverändernde Wirkungen von LIPITOR bei heranwachsenden Jungen und Mädchen mit heterozygoter familiärer Hypercholesterinämie oder schwerer Hypercholesterinämie (mittlere prozentuale Veränderung gegenüber dem Ausgangswert am Endpunkt in der Intention-to-Treat-Population)
Der mittlere erreichte LDL-C-Wert betrug 130,7 mg/dl (Spanne: 70,0–242,0 mg/dl) in der LIPITOR-10-mg-Gruppe im Vergleich zu 228,5 mg/dl (Spanne: 152,0–385,0 mg/dl) in der Placebogruppe Gruppe während der 26-wöchigen Doppelblindphase.
Atorvastatin wurde auch in einer dreijährigen offenen, unkontrollierten Studie mit 163 Patienten mit HeFH im Alter von 10 bis 15 Jahren (82 Jungen und 81 Mädchen) untersucht. Alle Patienten hatten eine durch genetische Analyse bestätigte klinische Diagnose von HeFH (falls nicht bereits durch die Familienanamnese bestätigt). Ungefähr 98 % waren Kaukasier und weniger als 1 % waren Schwarze oder Asiaten. Der mittlere LDL-C-Wert zu Studienbeginn betrug 232 mg/dl. Die Anfangsdosis von Atorvastatin betrug 10 mg einmal täglich und die Dosen wurden angepasst, um einen Zielwert von
Die langfristige Wirksamkeit einer Therapie mit LIPITOR 20 mg im Kindesalter zur Verringerung der Morbidität und Mortalität im Erwachsenenalter wurde nicht nachgewiesen.
INFORMATIONEN ZUM PATIENTEN
LIPITOR® Atorvastatin-Calcium-Tabletten (LIP-ih-tore))
Lesen Sie die Patienteninformationen, die mit LIPITOR 20 mg geliefert werden, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Zustand oder Ihre Behandlung.
Wenn Sie Fragen zu LIPITOR haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Was ist LIPITOR?
LIPITOR ist ein verschreibungspflichtiges Arzneimittel, das den Cholesterinspiegel in Ihrem Blut senkt. Es senkt das LDL-C („schlechtes“ Cholesterin) und die Triglyceride in Ihrem Blut. Es kann auch Ihr HDL-C („gutes“ Cholesterin) erhöhen. LIPITOR ist für Erwachsene und Kinder über 10, deren Cholesterinspiegel allein durch Bewegung und eine fettarme Ernährung nicht ausreichend gesenkt werden kann.
LIPITOR kann das Risiko für Herzinfarkt, Schlaganfall, bestimmte Arten von Herzoperationen und Brustschmerzen bei Patienten mit Herzerkrankungen oder Risikofaktoren für Herzerkrankungen senken, wie z.
LIPITOR 20 mg kann das Risiko für Herzinfarkt oder Schlaganfall bei Patienten mit Diabetes und Risikofaktoren wie:
LIPITOR 40 mg beginnt in etwa 2 Wochen zu wirken.
Was ist Cholesterin?
Cholesterin und Triglyceride sind Fette, die in Ihrem Körper hergestellt werden. Sie kommen auch in Lebensmitteln vor. Sie brauchen etwas Cholesterin für eine gute Gesundheit, aber zu viel ist nicht gut für Sie. Cholesterin und Triglyceride können Ihre Blutgefäße verstopfen. Es ist besonders wichtig, Ihren Cholesterinspiegel zu senken, wenn Sie an einer Herzkrankheit leiden, rauchen, Diabetes oder Bluthochdruck haben, älter sind oder wenn Herzkrankheiten in Ihrer Familie früh auftreten.
Wer sollte LIPITOR 40 mg nicht einnehmen?
Nehmen Sie LIPITOR 10 mg nicht ein, wenn Sie:
Die Dosierung von LIPITOR 20 mg bei Kindern unter 10 Jahren wurde nicht ermittelt.
Bevor Sie mit LIPITOR beginnen
Informieren Sie Ihren Arzt, wenn Sie:
Einige Arzneimittel sollten nicht zusammen mit LIPITOR eingenommen werden. Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. LIPITOR und bestimmte andere Arzneimittel können Wechselwirkungen haben und schwerwiegende Nebenwirkungen verursachen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Arzneimittel einnehmen gegen:
Kennen Sie alle Medikamente, die Sie einnehmen. Führen Sie eine Liste davon mit sich, um sie Ihrem Arzt und Apotheker zu zeigen.
Wie sollte ich LIPITOR 40 mg einnehmen?
Was sollte ich bei der Einnahme von LIPITOR 10 mg vermeiden?
Was sind die möglichen Nebenwirkungen von LIPITOR 10mg?
LIPITOR kann schwerwiegende Nebenwirkungen verursachen. Diese Nebenwirkungen sind nur bei einer kleinen Anzahl von Menschen aufgetreten. Ihr Arzt kann Sie auf diese überwachen. Diese Nebenwirkungen klingen normalerweise ab, wenn Ihre Dosis gesenkt oder LIPITOR abgesetzt wird. Zu diesen schwerwiegenden Nebenwirkungen gehören:
Rufen Sie sofort Ihren Arzt an, wenn Sie Folgendes haben:
In klinischen Studien berichteten Patienten während der Einnahme von LIPITOR über die folgenden häufigen Nebenwirkungen: Durchfall, Magenverstimmung, Muskel- und Gelenkschmerzen und Veränderungen bei einigen Laborbluttests.
Die folgenden zusätzlichen Nebenwirkungen wurden bei LIPITOR berichtet:
Müdigkeit, Sehnenprobleme, Gedächtnisverlust und Verwirrtheit.
Sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie Nebenwirkungen haben, die Sie stören oder die nicht abklingen.
Dies sind nicht alle Nebenwirkungen von LIPITOR. Fragen Sie Ihren Arzt oder Apotheker nach einer vollständigen Liste.
Wie speichere ich LIPITOR?
Allgemeine Informationen zu LIPITOR
Medikamente werden manchmal für Erkrankungen verschrieben, die nicht in der Packungsbeilage erwähnt sind. Verwenden Sie LIPITOR 10 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie LIPITOR nicht an andere Personen weiter, selbst wenn sie das gleiche Problem haben wie Sie. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen zu LIPITOR zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über LIPITOR bitten, die für Angehörige der Gesundheitsberufe bestimmt sind. Oder besuchen Sie die LIPITOR-Website unter www.lipitor.com.
Welche Inhaltsstoffe enthält LIPITOR?
Wirkstoff: Atorvastatin-Kalzium
Inaktive Zutaten: Calciumcarbonat, USP; Candelillawachs, FCC; Croscarmellose-Natrium, NF; Hydroxypropylcellulose, NF; Lactosemonohydrat, NF; Magnesiumstearat, NF; mikrokristalline Zellulose, NF; Opadry White YS-1-7040 (Hypromellose, Polyethylenglycol, Talk, Titandioxid); Polysorbat 80, NF; Simethicon-Emulsion.