Asacol 400mg Mesalamine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Asacol 400 mg und wie wird es angewendet?
Asacol ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Colitis ulcerosa. Asacol 400 mg kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Asacol gehört zu einer Klasse von Arzneimitteln, die als 5-Aminosalicylsäure-Derivate bezeichnet werden.
Es ist nicht bekannt, ob Asacol 400 mg bei Kindern unter 5 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Asacol 400 mg haben?
Asacol kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Asacol gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Asacol. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
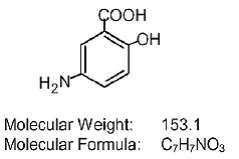
Jede Asacol (Mesalamin) Tablette mit verzögerter Freisetzung zur oralen Verabreichung enthält 400 mg Mesalamin, ein Aminosalicylat. Asacol (Mesalamin)-Tabletten mit verzögerter Freisetzung enthalten Harz auf Acrylbasis, Eudragit S (Methacrylsäure-Copolymer Typ B, NF), das sich bei pH 7 oder höher auflöst und Mesalamin im terminalen Ileum und darüber hinaus für eine topische entzündungshemmende Wirkung im Dickdarm freisetzt . Mesalamin (auch als 5-Aminosalicylsäure oder 5-ASA bezeichnet) hat den chemischen Namen 5-Amino-2-hydroxybenzoesäure. Seine Strukturformel lautet:
Inaktive Zutaten: Jede Tablette enthält kolloidales Siliciumdioxid, Dibutylphthalat, essbare schwarze Tinte, rotes Eisenoxid, gelbes Eisenoxid, Lactose-Monohydrat, Magnesiumstearat, Methacrylsäure-Copolymer B (Eudragit S), Polyethylenglycol, Povidon, Natriumstärkeglycolat und Talkum.
INDIKATIONEN
Behandlung von leicht bis mäßig aktiver Colitis ulcerosa
Asacol® (Mesalamin)-Tabletten mit verzögerter Wirkstofffreisetzung sind indiziert zur Behandlung von leichter bis mäßig aktiver Colitis ulcerosa bei Patienten ab 5 Jahren.
Aufrechterhaltung der Remission von Colitis ulcerosa bei Erwachsenen
Asacol (Mesalamin)-Tabletten mit verzögerter Wirkstofffreisetzung sind zur Aufrechterhaltung der Remission von Colitis ulcerosa bei Erwachsenen indiziert. Die Sicherheit und Wirksamkeit von Asacol zur Aufrechterhaltung der Remission von Colitis ulcerosa bei pädiatrischen Patienten wurde nicht nachgewiesen.
DOSIERUNG UND ANWENDUNG
Dosierung zur Behandlung von leicht bis mäßig aktiver Colitis ulcerosa
Erwachsene
Für Erwachsene beträgt die empfohlene Dosierung von Asacol 400 mg zwei 400-mg-Tabletten, die dreimal täglich mit oder ohne Nahrung eingenommen werden (Tagesgesamtdosis von 2,4 Gramm) über einen Zeitraum von 6 Wochen [siehe Klinische Studien ].
Pädiatrie
Für pädiatrische Patienten ist die empfohlene tägliche Gesamtdosis von Asacol gewichtsabhängig (bis zu einer Höchstdosis von 2,4 g/Tag) (siehe Tabelle 1). Asacol 400 mg Tabletten sind zweimal täglich mit oder ohne Nahrung über einen Zeitraum von 6 Wochen einzunehmen [siehe Klinische Studien ].
Dosierung zur Aufrechterhaltung der Remission von Colitis ulcerosa bei Erwachsenen
Für Erwachsene beträgt die empfohlene Dosierung von Asacol 1,6 Gramm täglich, aufgeteilt in Dosen, mit oder ohne Nahrung [siehe Klinische Studien ].
Wichtige Verwaltungsanweisungen
Asacol-Tabletten unzerkaut schlucken. Schneiden, zerbrechen oder kauen Sie die Tabletten nicht.
Zwei Asacol 400 mg Tabletten haben sich nicht als bioäquivalent mit einer Asacol® HD (Mesalamin) 800 mg Tablette mit verzögerter Freisetzung erwiesen und sollten nicht gegeneinander ausgetauscht werden.
Tests vor der Verabreichung von Asacol 400 mg
Beurteilung der Nierenfunktion vor Beginn der Asacol-Behandlung [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WIE GELIEFERT
Darreichungsformen und Stärken
Asacol (Mesalamin) Retardtabletten: 400 mg (rotbraun, kapselförmig und mit schwarzem Aufdruck „0752 DR“).
Lagerung und Handhabung
Asacol (Mesalamin) Tabletten mit verzögerter Freisetzung sind als rotbraune, kapselförmige Tabletten mit 400 mg Mesalamin und dem schwarzen Aufdruck „0752 DR“ erhältlich.
NDC 0430-0752-27 Flasche mit 180 Tabletten
Bei 20° bis 25° C (68° bis 77° F) lagern; Exkursionen erlaubt 15° bis 30° C (59° bis 86° F) [Siehe USP kontrollierte Raumtemperatur ].
Hersteller: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Deutschland. Vermarktet von: Warner Chilcott (US), LLC Rockaway, NJ 07866. Überarbeitet: Okt. 2013
NEBENWIRKUNGEN
Die schwerwiegendsten Nebenwirkungen, die in klinischen Studien mit Asacol oder bei anderen Produkten beobachtet wurden, die Mesalamin enthalten oder zu Mesalamin metabolisiert werden, sind:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Insgesamt wurden Asacol 400 mg Tabletten bei 2.690 Patienten mit Colitis ulcerosa in kontrollierten und offenen Studien untersucht. Die in den folgenden Abschnitten beschriebenen Nebenwirkungen können unabhängig von der Therapiedauer auftreten, und ähnliche Reaktionen wurden in Kurz- und Langzeitstudien und nach Markteinführung berichtet.
Zu den klinischen Studien, die die Anwendung von Asacol 400 mg zur Behandlung von leichter bis mäßig aktiver Colitis ulcerosa unterstützten, gehörten zwei 6-wöchige, placebokontrollierte, randomisierte Doppelblindstudien bei Erwachsenen mit leichter bis mäßig aktiver Colitis ulcerosa (Studien 1 und 2) und eine 6-wöchige, randomisierte, doppelblinde Studie mit 2 Dosisstufen bei Kindern mit leicht bis mäßig aktiver Colitis ulcerosa. Zu den klinischen Studien, die die Anwendung von Asacol 400 mg Tabletten zur Erhaltung der Remission von Colitis ulcerosa unterstützen, gehörten eine 6-monatige, randomisierte, doppelblinde, placebokontrollierte, multizentrische Studie und vier aktiv kontrollierte Erhaltungsstudien, in denen Asacol 400 mg Tabletten mit Sulfasalazin verglichen wurden . Asacol 400 mg wurde in diesen kontrollierten Studien bei 427 Erwachsenen und 82 Kindern mit Colitis ulcerosa untersucht.
Behandlung von leicht bis mäßig aktiver Colitis ulcerosa bei Erwachsenen
In zwei 6-wöchigen placebokontrollierten klinischen Studien (Studien 1 und 2) mit 245 Patienten, von denen 155 randomisiert Asacol zugeteilt wurden [siehe Klinische Studien ] brachen 3,2 Prozent der mit Asacol behandelten Patienten die Therapie wegen Nebenwirkungen ab, im Vergleich zu 2,2 Prozent der mit Placebo behandelten Patienten. Das Durchschnittsalter der Patienten in Studie 1 betrug 42 Jahre und 48 Prozent der Patienten waren männlich. Das Durchschnittsalter der Patienten in Studie 2 betrug 42 Jahre und 59 Prozent der Patienten waren männlich. Zu den Nebenwirkungen, die zum Absetzen von Asacol führten, gehörten (jeweils bei einem Patienten): Diarrhoe und Colitis-Flare; Schwindel, Übelkeit, Gelenkschmerzen und Kopfschmerzen; Hautausschlag, Lethargie und Verstopfung; Mundtrockenheit, Unwohlsein, Beschwerden im unteren Rückenbereich, leichte Orientierungslosigkeit, leichte Verdauungsstörungen und Krämpfe; Kopfschmerzen, Übelkeit, Schmerzen, Erbrechen, Muskelkrämpfe, ein verstopfter Kopf, verstopfte Ohren und Fieber.
Nebenwirkungen bei mit Asacol behandelten Patienten, die in 6-wöchigen, doppelblinden, placebokontrollierten Studien (Studien 1 und 2) mit einer Häufigkeit von mindestens 2 Prozent und häufiger als unter Placebo auftraten, sind in Tabelle 2 unten aufgeführt.
Behandlung von leicht bis mäßig aktiver Colitis ulcerosa bei pädiatrischen Patienten im Alter von 5 bis 17 Jahren
Eine randomisierte, doppelblinde, 6-wöchige Studie mit 2 Dosierungsstufen von Asacol (Studie 3) wurde bei 82 pädiatrischen Patienten im Alter von 5 bis 17 Jahren mit leichter bis mäßig aktiver Colitis ulcerosa durchgeführt. Alle Patienten wurden nach Körpergewichtskategorie (17 bis weniger als 33 kg, 33 bis weniger als 54 kg und 54 bis 90 kg) eingeteilt und randomisiert einer niedrigen Dosis (1,2, 2,0 und 2,4 g/Tag für die jeweilige Person) zugeteilt Körpergewichtsklasse) oder eine hohe Dosis (2,0, 3,6 und 4,8 g/Tag).
Die hohe Dosis ist keine zugelassene Dosierung, da sie sich als nicht wirksamer als die zugelassene Dosis erwiesen hat [siehe DOSIERUNG UND ANWENDUNG und Klinische Studien ].
Die Expositionsdauer gegenüber Mesalamin bei den 82 Patienten in der Studie reichte von 12 bis 50 Tagen (Mittelwert von 40 Tagen in jeder Dosisgruppe). Die Mehrheit (88 Prozent) der Patienten in jeder Gruppe wurde länger als 5 Wochen behandelt. Tabelle 3 enthält eine Zusammenfassung der spezifischen berichteten Nebenwirkungen (ARs).
Zwölf Prozent der Patienten in der Niedrigdosisgruppe und 5 Prozent der Patienten in der Hochdosisgruppe hatten schwerwiegende Nebenwirkungen (ARs). Colitis ulcerosa wurde bei einem Probanden in jeder Gruppe als schwerwiegende AR gemeldet. Andere schwerwiegende Nebenwirkungen bestanden aus Sinusitis, Bauchschmerzen, verringertem Body-Mass-Index, Adenovirus-Infektion, blutigem Durchfall, sklerosierender Cholangitis und Pankreatitis bei jeweils einem Probanden in der Gruppe mit niedriger Dosis und Anämie und Synkope bei jeweils einem Probanden in der Gruppe mit hoher Dosis.
Sieben Patienten wurden wegen ARs aus der Studie genommen: 5 (12 Prozent) in der niedrigen Dosisgruppe (Colitis ulcerosa, Adenovirus-Infektion, sklerosierende Cholangitis, Pankreatitis) und 2 (5 Prozent) in der hohen Dosisgruppe (erhöhte Amylase und erhöhte Lipase). , Oberbauchschmerzen).
Im Allgemeinen waren Art und Schweregrad der Reaktionen bei Kindern und Jugendlichen ähnlich wie bei erwachsenen Patienten mit Colitis ulcerosa.
Aufrechterhaltung der Remission von Colitis ulcerosa bei Erwachsenen
In einer 6-monatigen placebokontrollierten Erhaltungsstudie mit 264 Patienten (Studie 4), von denen 177 auf Asacol randomisiert wurden, brachen sechs (3,4 Prozent) der Patienten, die Asacol einnahmen, die Therapie wegen Nebenwirkungen ab, im Vergleich zu vier (4,6 Prozent) von Patienten, die Placebo verwenden [siehe Klinische Studien ]. Das Durchschnittsalter der Patienten in Studie 4 betrug 42 Jahre und 55 Prozent der Patienten waren männlich. Zu den Nebenwirkungen, die zum Studienabbruch bei Patienten führten, die Asacol einnahmen, gehörten (jeweils bei einem Patienten): Angst; Kopfschmerzen; Juckreiz; verminderte Libido; rheumatoide Arthritis; und Stomatitis und Asthenie.
Zusätzlich zu den in Tabelle 2 aufgeführten Nebenwirkungen traten bei Patienten, die Asacol einnahmen, in Studie 4 mit einer Häufigkeit von mindestens 2 Prozent folgende Nebenwirkungen auf: Bauchvergrößerung, Gastroenteritis, gastrointestinale Blutung, Infektion, Gelenkerkrankung, Migräne, Nervosität, Parästhesien, Rektum Störung, rektale Blutung, Stuhlanomalien, Tenesmus, häufiges Wasserlassen, Vasodilatation und Sehstörungen.
Bei 3342 Patienten in unkontrollierten klinischen Studien traten die folgenden Nebenwirkungen mit einer Häufigkeit von 5 Prozent oder mehr auf und schienen mit zunehmender Dosis an Häufigkeit zuzunehmen: Asthenie, Fieber, Grippesyndrom, Schmerzen, Bauchschmerzen, Rückenschmerzen, Blähungen, gastrointestinale Blutungen , Arthralgie und Rhinitis.
Postmarketing-Erfahrung
Zusätzlich zu den oben in klinischen Studien mit Asacol berichteten Nebenwirkungen wurden die unten aufgeführten Nebenwirkungen während der Anwendung von Asacol 400 mg und anderen mesalaminhaltigen Produkten nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Nackenschmerzen, Gesichtsödem, Ödem, Lupus-ähnliches Syndrom, Drogenfieber.
Herz-Kreislauf: Perikarditis, Myokarditis [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Magen-Darm: Anorexie, Pankreatitis, Gastritis, gesteigerter Appetit, Cholezystitis, Mundtrockenheit, Geschwüre im Mund, perforiertes Magengeschwür, blutiger Durchfall.
Hämatologisch: Agranulozytose aplastische Anämie, Thrombozytopenie, Eosinophilie, Leukopenie, Anämie, Lymphadenopathie.
Bewegungsapparat: Gicht.
Nervös: Depression, Schläfrigkeit, emotionale Labilität, Hyperästhesie, Schwindel, Verwirrtheit, Tremor, periphere Neuropathie, transversale Myelitis, Guillain-Barré-Syndrom.
Nieren: Nierenversagen, interstitielle Nephritis, Minimal-Change-Nephropathie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Atmung/Lungen: Eosinophile Pneumonie, interstitielle Pneumonitis, Asthmaexazerbation, Pleuritis.
Haut: Alopezie, Psoriasis, Pyoderma gangraenosus, trockene Haut, Erythema nodosum, Urtikaria.
Besondere Sinne: Augenschmerzen, Geschmacksstörungen, verschwommenes Sehen, Tinnitus.
Urogenital: Dysurie, Harndrang, Hämaturie, Epididymitis, Menorrhagie, reversible Oligospermie.
Laboranomalien: Erhöhte AST (SGOT) oder ALT (SGPT), erhöhte alkalische Phosphatase, erhöhte GGT, erhöhtes LDH, erhöhtes Bilirubin, erhöhtes Serumkreatinin und BUN.

WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es wurden keine formellen Arzneimittelwechselwirkungsstudien mit Asacol 400 mg mit anderen Arzneimitteln durchgeführt. Es wurden jedoch die folgenden Wechselwirkungen zwischen Mesalamin-haltigen Produkten und anderen Arzneimitteln berichtet.
Nephrotoxische Mittel, einschließlich nichtsteroidaler entzündungshemmender Arzneimittel
Die gleichzeitige Anwendung von Mesalamin mit bekannten nephrotoxischen Wirkstoffen, einschließlich nichtsteroidaler Antirheumatika (NSAIDs), kann das Risiko von Nierenreaktionen erhöhen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Azathioprin oder 6-Mercaptopurin
Die gleichzeitige Anwendung von Mesalamin mit Azathioprin oder 6-Mercaptopurin kann das Risiko für Bluterkrankungen erhöhen.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Nierenfunktionsstörung
Bei Patienten, die Produkte wie Asacol 400 mg einnahmen, die Mesalamin enthalten oder in Mesalamin umgewandelt werden, wurde über Nierenfunktionsstörungen, einschließlich Minimal-Change-Nephropathie, akute und chronische interstitielle Nephritis und Nierenversagen, berichtet.
Es wird empfohlen, die Nierenfunktion der Patienten vor Beginn der Behandlung mit Asacol 400 mg und in regelmäßigen Abständen während der Therapie zu untersuchen.
Verschreibende Ärzte sollten die Risiken und Vorteile der Anwendung von Asacol bei Patienten mit bekannter Nierenfunktionsstörung oder Nierenerkrankung in der Vorgeschichte sorgfältig abwägen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und Nichtklinische Toxikologie ].
Mesalamin-induziertes akutes Intoleranzsyndrom
Mesalamin wurde mit einem akuten Intoleranzsyndrom in Verbindung gebracht, das möglicherweise schwer von einer Exazerbation einer Colitis ulcerosa zu unterscheiden ist. Obwohl die genaue Häufigkeit des Auftretens nicht bestimmt wurde, trat es in 3 Prozent der kontrollierten klinischen Studien mit Mesalamin oder Sulfasalazin auf. Zu den Symptomen gehören Krämpfe, Bauchschmerzen, blutiger Durchfall und manchmal Fieber, Kopfschmerzen und Hautausschlag. Beobachten Sie die Patienten während der Behandlung engmaschig auf eine Verschlechterung dieser Symptome. Bei Verdacht auf ein akutes Intoleranzsyndrom ist die Behandlung mit Asacol unverzüglich abzubrechen.
Überempfindlichkeitsreaktionen
Einige Patienten, bei denen eine Überempfindlichkeitsreaktion auf Sulfasalazin aufgetreten ist, reagieren möglicherweise ähnlich auf Asacol 400 mg oder auf andere Verbindungen, die Mesalamin enthalten oder in Mesalamin umgewandelt werden.
Mesalamin-induzierte kardiale Überempfindlichkeitsreaktionen (Myokarditis und Perikarditis) wurden im Zusammenhang mit Asacol und anderen Mesalamin-Medikamenten berichtet. Bei der Verschreibung dieses Arzneimittels an Patienten mit Erkrankungen, die sie für die Entwicklung einer Myokarditis oder Perikarditis prädisponieren, ist Vorsicht geboten.
Leberversagen
Es gibt Berichte über Leberversagen bei Patienten mit vorbestehender Lebererkrankung, denen Mesalamin verabreicht wurde. Bei der Verabreichung von Asacol an Patienten mit Lebererkrankungen ist Vorsicht geboten.
Verlängerte Magenretention bei Patienten mit Obstruktion des oberen Gastrointestinaltrakts
Eine organische oder funktionelle Obstruktion im oberen Gastrointestinaltrakt kann zu einer verlängerten Retention von Asacol 400 mg im Magen führen, was die Freisetzung von Mesalamin im Dickdarm verzögern würde.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Mesalamin war in diätetischen Dosen von bis zu 480 mg/kg/Tag bei Ratten und 2000 mg/kg/Tag bei Mäusen nicht karzinogen, was etwa dem 2,9- und 6,1-Fachen der maximal empfohlenen Erhaltungsdosis von Asacol 400 mg von 1,6 g/Tag oder 26,7 entspricht mg/kg/Tag, bezogen auf 60 kg Körpergewicht bzw. bezogen auf die Körperoberfläche.
Mutagenese
Mesalamin war im Ames-Assay negativ auf Mutagenese, negativ auf die Induktion von Schwesterchromatidaustauschen (SCE) und Chromosomenaberrationen in Eierstockzellen des chinesischen Hamsters in vitro und negativ auf die Induktion von Mikrokernen (MN) in polychromatischen Erythrozyten aus dem Knochenmark von Mäusen.
Beeinträchtigung der Fruchtbarkeit
Es wurde festgestellt, dass Mesalamin in oralen Dosen von bis zu 480 mg/kg/Tag (etwa das 1,9-fache der empfohlenen Behandlungsdosis für den Menschen bezogen auf die Körperoberfläche) keine Auswirkungen auf die Fruchtbarkeit oder Fortpflanzungsfähigkeit männlicher und weiblicher Ratten hat.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Zusammenfassung der Risiken
Es liegen keine ausreichenden und gut kontrollierten Studien zur Anwendung von Asacol 400 mg bei Schwangeren vor. Begrenzte veröffentlichte Humandaten zu Mesalamin zeigen keinen Anstieg der Gesamtrate angeborener Missbildungen. Einige Daten zeigen eine erhöhte Rate an Frühgeburten, Totgeburten und niedrigem Geburtsgewicht; Diese negativen Schwangerschaftsergebnisse sind jedoch auch mit einer aktiven entzündlichen Darmerkrankung verbunden. Darüber hinaus haben alle Schwangerschaften, unabhängig von der Medikamenteneinnahme, eine Hintergrundrate von 2 bis 4 Prozent für schwere Fehlbildungen und 15 bis 20 Prozent für Fehlgeburten. In tierexperimentellen Reproduktionsstudien mit Mesalamin an Ratten und Kaninchen wurden bei oralen Dosen, die etwa dem 1,9-Fachen (Ratte) und dem 3,9-Fachen (Kaninchen) der empfohlenen Humandosis entsprachen, keine Hinweise auf eine fetale Schädigung beobachtet. Dibutylphthalat (DBP) ist jedoch ein inaktiver Inhaltsstoff in Asacols magensaftresistentem Überzug, und in Tierversuchen mit Ratten in Dosen von mehr als dem 190-fachen der menschlichen Dosis, basierend auf der Körperoberfläche, wurde mütterliches DBP mit äußeren und skelettalen Fehlbildungen und Nebenwirkungen in Verbindung gebracht das männliche Fortpflanzungssystem. Asacol 400 mg sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Menschliche Daten
Mesalamin passiert die Plazentaschranke. In prospektiven und retrospektiven Studien mit über 600 Frauen, die während der Schwangerschaft Mesalamin ausgesetzt waren, war die beobachtete Rate angeborener Missbildungen nicht über die Hintergrundrate in der Allgemeinbevölkerung erhöht. Einige Daten zeigen eine erhöhte Rate an Frühgeburten, Totgeburten und niedrigem Geburtsgewicht, aber es ist unklar, ob dies auf eine zugrunde liegende Erkrankung der Mutter, eine Arzneimittelexposition oder beides zurückzuführen ist, da eine aktive entzündliche Darmerkrankung auch mit ungünstigen Schwangerschaftsergebnissen verbunden ist.
Tierische Daten
Reproduktionsstudien mit Mesalamin wurden während der Organogenese bei Ratten und Kaninchen in oralen Dosen von bis zu 480 mg/kg/Tag durchgeführt. Es gab keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus. Diese Mesalazin-Dosen waren etwa das 1,9-fache (Ratte) und das 3,9-fache (Kaninchen) der empfohlenen menschlichen Dosis, basierend auf der Körperoberfläche.
Dibutylphthalat (DBP) ist ein inaktiver Inhaltsstoff in Asacols magensaftresistenten Beschichtungen. Die tägliche Aufnahme von DBP beim Menschen aus der maximal empfohlenen Dosis von Asacol-Tabletten beträgt etwa 21 mg. Veröffentlichte Berichte bei Ratten zeigen, dass männliche Rattennachkommen, die in utero DBP (mehr als oder gleich 100 mg/kg/Tag, ungefähr das 39-fache der menschlichen Dosis, basierend auf der Körperoberfläche) ausgesetzt wurden, Anomalien des Fortpflanzungssystems zeigen, die mit einer Störung der androgenen Abhängigkeit kompatibel sind Entwicklung. Die klinische Bedeutung dieses Befundes bei Ratten ist nicht bekannt. Bei höheren Dosierungen (größer als oder gleich 500 mg/kg/Tag, ungefähr das 194-fache der menschlichen Dosis basierend auf der Körperoberfläche) werden zusätzliche Wirkungen, einschließlich Kryptorchismus, Hypospadie, Atrophie oder Agenesie von akzessorischen Geschlechtsorganen, Hodenverletzung, täglich reduziert Spermienproduktion, dauerhafte Retention der Brustwarzen und verringerter anogenitaler Abstand werden festgestellt. Weibliche Nachkommen sind nicht betroffen. Hohe DBP-Dosen, die trächtigen Ratten verabreicht wurden, waren mit einem erhöhten Auftreten von Entwicklungsanomalien wie Gaumenspalten (größer oder gleich 630 mg/kg/Tag, etwa das 244-fache der menschlichen Dosis, basierend auf der Körperoberfläche) und Skelett assoziiert Anomalien (größer als oder gleich 750 mg/kg/Tag, etwa das 290-fache der menschlichen Dosis basierend auf der Körperoberfläche) bei den Nachkommen.
Stillende Mutter
Mesalamin und sein N-Acetyl-Metabolit sind in der Muttermilch vorhanden. In veröffentlichten Laktationsstudien lagen die mütterlichen Mesalamindosen aus verschiedenen oralen und rektalen Formulierungen und Produkten zwischen 500 mg und 3 g täglich. Die Konzentration von Mesalamin in Milch reichte von nicht nachweisbar bis 0,11 mg/L. Die Konzentration des N-Acetyl-5-aminosalicylsäure-Metaboliten lag im Bereich von 5 bis 18,1 mg/L. Basierend auf diesen Konzentrationen betragen die geschätzten täglichen Säuglingsdosen für einen ausschließlich gestillten Säugling 0 bis 0,017 mg/kg/Tag Mesalamin und 0,75 bis 2,72 mg/kg/Tag N-Acetyl-5-aminosalicylsäure.
Dibutylphthalat (DBP), ein inaktiver Inhaltsstoff in der magensaftresistenten Beschichtung von Asacol 400 mg Tabletten, und sein primärer Metabolit Monobutylphthalat (MBP) gehen in die Muttermilch über. Die klinische Bedeutung davon wurde nicht bestimmt.
Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an Asacol 400 mg und allen möglichen Nebenwirkungen auf das gestillte Kind durch das Medikament oder durch die zugrunde liegende Erkrankung der Mutter berücksichtigt werden. Seien Sie vorsichtig, wenn Asacol 400 mg einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Asacol 400 mg bei pädiatrischen Patienten im Alter von 5 bis 17 Jahren zur Behandlung von leichter bis mäßig aktiver Colitis ulcerosa wurden über einen Zeitraum von 6 Wochen nachgewiesen. Die Anwendung von Asacol in diesen Altersgruppen wird durch Belege aus angemessenen und gut kontrollierten Studien mit Asacol 400 mg bei Erwachsenen und einer einzigen Studie bei pädiatrischen Patienten gestützt [siehe NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE und Klinische Studien ].
Asacol 400 mg wurde in einer randomisierten, doppelblinden, 6-wöchigen Parallelgruppen-Behandlungsstudie mit zwei Dosierungsstufen von Asacol 400 mg bei 82 pädiatrischen Patienten im Alter von 5 bis 17 Jahren mit leichter bis mäßig aktiver Colitis ulcerosa untersucht. Alle Patienten wurden nach Gewichtsklassen eingeteilt (17 bis weniger als 33 kg, 33 bis weniger als 54 kg und 54 bis 90 kg) und randomisiert einer niedrigen Dosis (1,2, 2,0 und 2,4 g/Tag für das jeweilige Gewicht) zugeteilt Kategorie) oder eine hohe Dosis (2,0, 3,6 und 4,8 g/Tag). Auf die Baseline- und Screening-Besuche folgte eine Behandlungsdauer von 6 Wochen [vgl DOSIERUNG UND ANWENDUNG ]. Die hohe Dosis war nicht wirksamer als die niedrige Dosis und ist keine zugelassene Dosierung [vgl Klinische Studien ].
Die Sicherheit und Wirksamkeit von Asacol bei pädiatrischen Patienten unter 5 Jahren ist nicht erwiesen. Die Sicherheit und Wirksamkeit von Asacol zur Aufrechterhaltung der Remission von Colitis ulcerosa bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien mit Asacol schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte bei der Verschreibung von Asacol die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie bei älteren Patienten berücksichtigt werden. Berichte aus unkontrollierten klinischen Studien und Berichtssystemen nach der Markteinführung deuten auf eine höhere Inzidenz von Blutdyskrasie, d. h. Agranulozytose, Neutropenie, Panzytopenie, bei Patienten hin, die 65 Jahre oder älter sind und Asacol erhalten. Während der Behandlung mit Asacol ist darauf zu achten, dass die Anzahl der Blutzellen engmaschig überwacht wird.
Nierenfunktionsstörung
Es ist bekannt, dass Mesalamin im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, ist bei der Verschreibung dieser medikamentösen Therapie Vorsicht geboten. Es wird empfohlen, dass bei allen Patienten vor Beginn der Therapie mit Asacol und regelmäßig während der Therapie mit Asacol die Nierenfunktion untersucht wird [siehe DOSIERUNG UND ANWENDUNG , WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ÜBERDOSIS
Es gibt kein spezifisches Antidot für eine Mesalamin-Überdosierung und die Behandlung mit Asacol bei Verdacht auf akute schwere Toxizität sollte symptomatisch und unterstützend sein. Dies kann die Verhinderung einer weiteren Resorption im Magen-Darm-Trakt, die Korrektur eines Flüssigkeits-Elektrolyt-Ungleichgewichts und die Aufrechterhaltung einer angemessenen Nierenfunktion umfassen. Asacol 400 mg ist ein pH-abhängiges Arzneimittel mit verzögerter Freisetzung, und dieser Faktor sollte bei der Behandlung einer vermuteten Überdosierung berücksichtigt werden.
KONTRAINDIKATIONEN
Asacol ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Salicylaten oder Aminosalicylaten oder einem der sonstigen Bestandteile von Asacol [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN , und BEZEICHNUNG ].
ASACOL (Mesalamin) Tabletten mit verzögerter Freisetzung zum Einnehmen
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der Wirkungsmechanismus von Mesalamin ist unbekannt, scheint aber eher topisch als systemisch zu sein. Die Schleimhautproduktion von Arachidonsäure-Metaboliten, sowohl über die Cyclooxygenase-Wege, d. h. Prostanoide, als auch über die Lipoxygenase-Wege, d. h. Leukotriene und Hydroxyeicosatetraensäuren, ist bei Patienten mit chronischer Colitis ulcerosa erhöht, und es ist möglich, dass Mesalamin Entzündungen verringert durch Blockierung der Cyclooxygenase und Hemmung der Prostaglandinproduktion im Dickdarm.
Pharmakokinetik
Absorption
Ungefähr 28 Prozent des Mesalamins in Asacol 400 mg Tabletten werden nach oraler Einnahme resorbiert. Die Resorption von Mesalamin ist bei nüchternen und ernährten Probanden ähnlich. Die T max für Mesalamin und seinen Metaboliten ist normalerweise verzögert, was die verzögerte Freisetzung widerspiegelt, und reicht von 4 bis 16 Stunden.
Stoffwechsel
Das resorbierte Mesalamin wird in der Darmschleimhautwand und durch die Leber schnell zu N-Acetyl-5-aminosalicylsäure acetyliert.
Ausscheidung
Resorbiertes Mesalamin wird hauptsächlich über die Niere als N-Acetyl-5-aminosalicylsäure ausgeschieden. Nicht absorbiertes Mesalamin wird mit dem Kot ausgeschieden.
Nach intravenöser Verabreichung beträgt die Eliminationshalbwertszeit von Mesalamin etwa 40 Minuten. Nach oraler Gabe betragen die terminalen t½-Werte für Mesalamin und N-Acetyl-5-aminosalicylsäure normalerweise etwa 12 Stunden, sind jedoch variabel und reichen von 2 bis 15 Stunden. Die Plasmakonzentrationen von Mesalamin und N-Acetyl-5-aminosalicylsäure und ihre Eliminationshalbwertszeit nach Verabreichung von Asacol weisen große interindividuelle und intraindividuelle Schwankungen auf.
Spezifische Populationen
Pädiatrische Patienten
In einer PK-Dosierungsstudie, in der Dosen von 30, 60 und 90 mg/kg/Tag von Asacol 400 mg zweimal täglich über vier Wochen verabreicht wurden, lagen die mittleren Cavg-Werte von Mesalamin bei pädiatrischen Patienten mit Colitis ulcerosa zwischen etwa 400 ng/ml und 2100 ng /ml basierend auf Daten aller Dosisstufen.
In einer Studie mit pädiatrischen Patienten mit Colitis ulcerosa (Studie 3) betrugen die mittleren Plasmakonzentrationen von Mesalamin (basierend auf wenigen Proben) 820 bis 988 ng/ml bei niedriger Dosis (d. h. 1,2, 2,0 oder 2,4 g/Tag, basierend auf Körpergewichtsschichten von 17 bis über 33 kg, 33 bis unter 54 kg bzw. 54 bis unter 90 kg).
Tiertoxikologie und/oder Pharmakologie
In Tierstudien (Ratten, Mäuse, Hunde) war die Niere das Hauptorgan für Toxizität. (Im Folgenden basieren Vergleiche der Dosierung bei Tieren mit der empfohlenen Dosierung beim Menschen auf der Körperoberfläche und einer Dosis von 2,4 g/Tag für eine 60 kg schwere Person.)
Mesalamin verursacht bei Ratten bei Einzeldosen von etwa 750 mg/kg bis 1000 mg/kg (etwa das 3- bis 4-fache der beim Menschen empfohlenen Dosis, basierend auf der Körperoberfläche) eine Nierenpapillennekrose. Dosen von 170 und 360 mg/kg/Tag (etwa das 0,7- und 1,5-fache der empfohlenen Humandosis basierend auf der Körperoberfläche), die sechs Monate lang an Ratten verabreicht wurden, führten zu Papillennekrose, Papillenödem, tubulärer Degeneration, tubulärer Mineralisierung und Urothelhyperplasie.
Bei Mäusen führten orale Dosen von 4000 mg/kg/Tag Mesalamin (etwa das 8-fache der empfohlenen Humandosis basierend auf der Körperoberfläche) über drei Monate zu tubulärer Nephrose, multifokaler/diffuser tubulo-interstitieller Entzündung und multifokaler/diffuser papillärer Nekrose.
Bei Hunden führten Einzeldosen von 6000 mg (ungefähr das 8-fache der für Menschen empfohlenen Dosis basierend auf der Körperoberfläche) von Mesalamin-Tabletten mit verzögerter Freisetzung zu Nierenpapillennekrose, waren aber nicht tödlich. Nierenveränderungen traten bei Hunden auf, denen Mesalamin in Dosen von 80 mg/kg/Tag (das 1,1-Fache der empfohlenen Humandosis bezogen auf die Körperoberfläche) dauerhaft verabreicht wurde.
Klinische Studien
Behandlung von leicht bis mäßig aktiver Colitis ulcerosa
Erwachsene
Zwei Placebo-kontrollierte Studien (Studie 1 und 2) haben die Wirksamkeit von Asacol-Tabletten bei Patienten mit leichter bis mäßig aktiver Colitis ulcerosa gezeigt.
In einer randomisierten, doppelblinden, multizentrischen Studie mit 158 Patienten (Studie 1) wurden Asacol-Dosen von 1,6 g/Tag und 2,4 g/Tag über 6 Wochen mit Placebo verglichen. Das Bewertungssystem zur Bestimmung der Behandlungswirksamkeit umfasste die Bewertung der Stuhlhäufigkeit, rektaler Blutungen, sigmoidoskopischer Befunde, der funktionellen Bewertung des Patienten und der globalen Bewertung durch den Arzt. Bei einer Dosis von 2,4 g/Tag zeigten 21 von 43 (49 %) Patienten, die Asacol-Tabletten einnahmen, eine Verbesserung des sigmoidoskopischen Erscheinungsbildes des Darms im Vergleich zu 12 von 44 (27 %) Patienten, die Placebo einnahmen (p = 0,048). Darüber hinaus zeigten signifikant mehr Patienten in der Gruppe mit Asacol-Tabletten 2,4 g/Tag eine Verbesserung der rektalen Blutung und der Stuhlhäufigkeit. Die Dosis von 1,6 g/Tag erbrachte keinen konsistenten Beweis für die Wirksamkeit.
In einer zweiten randomisierten, doppelblinden, placebokontrollierten klinischen Studie über 6 Wochen Dauer bei 87 Patienten (Studie 2) führten Asacol-Tabletten in einer Dosis von 4,8 g/Tag über 6 Wochen bei 28 von 38 zu einer sigmoidoskopischen Verbesserung (74 Prozent) Patienten im Vergleich zu 10 von 38 (26 Prozent) Placebo-Patienten (weniger als 0,001 p). Außerdem zeigten mehr Patienten in der Gruppe mit Asacol 400 mg Tabletten 4,8 g/Tag eine Verbesserung der Gesamtsymptome als in der Placebogruppe.
Die Dosis von 4,8 g/Tag ist keine zugelassene Dosis für die Behandlung von leicht bis mäßig aktiver Colitis ulcerosa.
Pädiatrie
Die Sicherheit und Wirksamkeit von Asacol 400 mg bei pädiatrischen Patienten im Alter von 5 bis 17 Jahren zur Behandlung von leichter bis mäßig aktiver Colitis ulcerosa werden durch Belege aus angemessenen und gut kontrollierten Studien mit Asacol 400 mg bei Erwachsenen und einer einzigen Studie bei pädiatrischen Patienten gestützt.
Eine randomisierte, doppelblinde, 6-wöchige Studie mit 2 Dosierungsstufen von Asacol (Studie 3) wurde bei 82 pädiatrischen Patienten im Alter von 5 bis 17 Jahren mit leichter oder mäßig aktiver Colitis ulcerosa durchgeführt. Alle Patienten wurden nach Gewichtsklassen eingeteilt (17 bis weniger als 33 kg, 33 bis weniger als 54 kg und 54 bis 90 kg) und randomisiert einer niedrigen Dosis (1,2, 2,0 und 2,4 g/Tag für das jeweilige Gewicht) zugeteilt Kategorie) oder eine hohe Dosis (2,0, 3,6 und 4,8 g/Tag). Die Dosen wurden alle 12 Stunden verabreicht.
Der Anteil der Patienten, die basierend auf dem Truncated Mayo Score (TM-Mayo) (basierend auf der Stuhlhäufigkeit und den Subscores für rektale Blutungen des Mayo Score) und basierend auf dem Pediatric Ulcerative Colitis Activity Index (PUCAI) (einschließlich der Bewertung von Bauchschmerzen, rektale Blutungen, Stuhlkonsistenz und -häufigkeit, Vorhandensein von nächtlichem Stuhlgang und Aktivitätsniveau) wurden nach 6-wöchiger Behandlung gemessen. Der auf TM-Mayo basierende Erfolg wurde entweder als partielles Ansprechen (Verbesserung der Stuhlhäufigkeit oder Rektalblutungs-Subscores gegenüber dem Ausgangswert ohne Verschlechterung der anderen) oder als vollständiges Ansprechen (sowohl Stuhlfrequenz als auch Rektalblutungs-Subscores gleich 0) definiert. Der auf PUCAI basierende Erfolg wurde entweder als partielles Ansprechen (PUCAI-Reduktion um mehr als oder gleich 20 Punkte von der Baseline bis Woche 6 mit einem Punktwert in Woche 6 von größer oder gleich 10) oder als vollständiges Ansprechen (PUCAI weniger als 10 in Woche 6) definiert.
41 Patienten in der Niedrigdosisgruppe und 41 Patienten in der Hochdosisgruppe erhielten mindestens eine Dosis Asacol; 36 Patienten in jeder Dosisgruppe beendeten die Studie. Patienten wurden als Behandlungsversagen betrachtet, wenn sie keinen Erfolg erzielten oder aufgrund von Nebenwirkungen oder mangelnder Wirksamkeit abbrachen.
In Woche 6 erzielten 73,2 Prozent der Patienten in der Gruppe mit niedriger Dosis und 70,0 Prozent der Patienten in der Gruppe mit hoher Dosis einen Erfolg basierend auf TM-Mayo; 34,1 Prozent der Patienten in der Niedrigdosisgruppe und 42,5 Prozent der Patienten in der Hochdosisgruppe erreichten ein vollständiges Ansprechen. In Woche 6 erzielten 56,1 Prozent der Patienten in der Gruppe mit niedriger Dosis und 55,0 Prozent der Patienten in der Gruppe mit hoher Dosis einen Erfolg basierend auf dem PUCAI; 46,3 Prozent der Patienten in der Niedrigdosisgruppe und 42,5 Prozent der Patienten in der Hochdosisgruppe erreichten ein vollständiges Ansprechen.
Die hohe Dosis war nicht wirksamer als die niedrige Dosis und ist keine zugelassene Dosierung [vgl DOSIERUNG UND ANWENDUNG ].
Aufrechterhaltung der Remission von Colitis ulcerosa bei Erwachsenen
An einer 6-monatigen, randomisierten, doppelblinden, placebokontrollierten, multizentrischen Studie (Studie 4) nahmen 264 Patienten teil, die mit Asacol 400 mg Tabletten 0,8 g/Tag (n = 90), 1,6 g/Tag (n = 87) behandelt wurden. oder Placebo (n = 87). Im Arm mit 0,8 g/Tag erhielten die Patienten zweimal täglich eine Dosis; im Arm mit 1,6 g/Tag erhielten die Patienten viermal täglich eine Dosis. Der Anteil der mit 0,8 g/Tag behandelten Patienten, die eine endoskopische Remission beibehielten, war im Vergleich zu Placebo statistisch nicht signifikant. Der Anteil der Patienten, die Asacol Tabletten 1,6 g/Tag einnahmen und eine endoskopische Remission der Colitis ulcerosa aufrechterhielten, lag bei 61 von 87 (70,1 Prozent) im Vergleich zu 42 von 87 (48,3 Prozent) der Placebo-Patienten (p = 0,005).
Eine gepoolte Wirksamkeitsanalyse von 4 Erhaltungsstudien verglich Asacol 400 mg Tabletten in Dosierungen von 0,8 g/Tag bis 2,8 g/Tag, in aufgeteilten Dosen von zweimal täglich bis viermal täglich, mit Sulfasalazin in Dosierungen von 2 g/Tag bis 4g/Tag. Ein Behandlungserfolg wurde bei 59 von 98 (59 Prozent) Patienten, die Asacol-Tabletten einnahmen, und bei 70 von 102 (69 Prozent) der Patienten, die Sulfasalazin einnahmen, beobachtet, ein nicht signifikanter Unterschied.