Suprax 100mg, 200mg Cefixime Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Suprax 200 mg und wie wird es angewendet?
Suprax (Cefixim) zur oralen Suspension ist ein Cephalosporin-Antibiotikum, das zur Behandlung vieler verschiedener Arten von Infektionen verwendet wird, die durch Bakterien verursacht werden.
Welche Nebenwirkungen hat Suprax?
Häufige Nebenwirkungen von Suprax 100 mg sind:
Informieren Sie Ihren Arzt, wenn bei Ihnen seltene, aber sehr schwerwiegende Nebenwirkungen von Suprax 200 mg auftreten, einschließlich:
BEZEICHNUNG
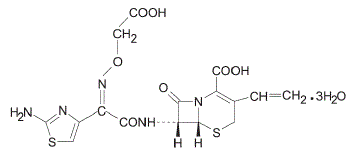
Cefixim ist ein halbsynthetisches Cephalosporin-Antibiotikum zur oralen Verabreichung. Chemisch ist es (6R,7R)-7-[2-(2-Amino-4-thiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-thia-1-azabicyclo[4.2.0]oct-2 -en-2-carbonsäure, 72-(Z)-[O-(Carboxymethyl)oxim]trihydrat.
Molekulargewicht = 507,50 als Trihydrat. Die chemische Formel ist C16H15N5O7S2.3H2O
Die Strukturformel für Cefixim lautet:
INDIKATIONEN
Unkomplizierte Harnwegsinfektionen
SUPRAX ist indiziert zur Behandlung von Erwachsenen und pädiatrischen Patienten ab einem Alter von sechs Monaten mit unkomplizierten Harnwegsinfektionen, die durch empfindliche Isolate von Escherichia coli und Proteus mirabilis verursacht werden.
Mittelohrentzündung
SUPRAX ist indiziert zur Behandlung von Erwachsenen und pädiatrischen Patienten ab einem Alter von sechs Monaten mit Mittelohrentzündung, die durch empfindliche Isolate von Haemophilus influenzae, Moraxella catarrhalis und Streptococcus pyogenes verursacht wird. (Die Wirksamkeit für Streptococcus pyogenes in diesem Organsystem wurde bei weniger als 10 Infektionen untersucht.)
Notiz
Bei Patienten mit Mittelohrentzündung, die durch Streptococcus pneumoniae verursacht wurde, war das Gesamtansprechen auf Cefixim ungefähr 10 % geringer als auf das Vergleichspräparat [siehe Klinische Studien ].
Pharyngitis und Mandelentzündung
SUPRAX ist indiziert zur Behandlung von Erwachsenen und pädiatrischen Patienten ab einem Alter von sechs Monatenmit Pharyngitis und Tonsillitis, die durch empfindliche Isolate von Streptococcus pyogenes verursacht werden. (Anmerkung: Penicillin ist das übliche Mittel der Wahl bei der Behandlung von Infektionen mit Streptococcus pyogenes. SUPRAX ist im Allgemeinen wirksam bei der Eradikation von Streptococcus pyogenes aus dem Nasopharynx; Daten, die die Wirksamkeit von SUPRAX 100 mg bei der anschließenden Prävention von rheumatischem Fieber belegen, sind dies jedoch nicht verfügbar.)
Akute Exazerbationen einer chronischen Bronchitis
SUPRAX 200 mg ist indiziert zur Behandlung von Erwachsenen und pädiatrischen Patienten ab einem Alter von sechs Monaten mit akuten Exazerbationen einer chronischen Bronchitis, die durch empfindliche Isolate von Streptococcus pneumoniae und Haemophilus influenzae verursacht werden.
Unkomplizierte Gonorrhoe (zervikal/urethral)
SUPRAX 100 mg ist indiziert zur Behandlung von Erwachsenen und pädiatrischen Patienten ab einem Alter von sechs Monaten mit unkomplizierter Gonorrhö (zervikal/urethral), die durch empfindliche Isolate von Neisseria gonorrhoeae (Penicillinase- und nicht-Penicillinase-produzierende Isolate) verursacht wird.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von SUPRAX 100 mg und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte SUPRAX 100 mg nur zur Behandlung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antimikrobiellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Erwachsene
Die empfohlene Dosis von Cefixim beträgt 400 mg täglich. Dies kann als 400-mg-Tablette oder -Kapsel täglich gegeben werden, oder die 400-mg-Tablette kann geteilt und als halbe Tablette alle 12 Stunden gegeben werden. Zur Behandlung unkomplizierter zervikaler/urethraler Gonokokkeninfektionen wird eine orale Einzeldosis von 400 mg empfohlen. Die Kapsel und Tablette kann unabhängig von Nahrung verabreicht werden.
Bei der Behandlung von Infektionen durch Streptococcus pyogenes sollte eine therapeutische Dosis von Cefixim für mindestens 10 Tage verabreicht werden.
Pädiatrische Patienten (6 Monate oder älter)
Die empfohlene Dosis beträgt 8 mg/kg/Tag der Suspension. Dies kann als einzelne Tagesdosis verabreicht werden oder kann in zwei getrennten Dosen als 4 mg/kg alle 12 Stunden verabreicht werden.
Notiz
Für jeden pädiatrischen Gewichtsbereich wurde eine empfohlene Dosis festgelegt. Siehe Tabelle 1. Stellen Sie sicher, dass alle Bestellungen, die eine Dosis in Millilitern angeben, eine Konzentration enthalten, da SUPRAX zur Herstellung einer Suspension zum Einnehmen in drei verschiedenen Konzentrationen erhältlich ist (100 mg/5 ml, 200 mg/5 ml und 500 mg/5 ml).
Kinder, die mehr als 45 kg wiegen oder älter als 12 Jahre sind, sollten mit der empfohlenen Erwachsenendosis behandelt werden. SUPRAX (Cefixim) Kautabletten müssen vor dem Schlucken gekaut oder zerkleinert werden.
Otitis media sollte mit den Kautabletten oder der Suspension behandelt werden. Klinische Studien zu Mittelohrentzündung wurden mit den Kautabletten oder der Suspension durchgeführt, und die Kautabletten oder die Suspension führen zu höheren maximalen Blutspiegeln als die Tablette, wenn sie in derselben Dosis verabreicht werden.
Daher sollte die Tablette oder Kapsel die Kautabletten oder Suspension bei der Behandlung von Mittelohrentzündung nicht ersetzen [siehe KLINISCHE PHARMAKOLOGIE ].
Bei der Behandlung von Infektionen durch Streptococcus pyogenes sollte eine therapeutische Dosis von Cefixim für mindestens 10 Tage verabreicht werden.
Nierenfunktionsstörung
SUPRAX 200 mg kann bei eingeschränkter Nierenfunktion verabreicht werden. Bei Patienten mit einer Kreatinin-Clearance von 60 ml/min oder mehr können die normale Dosis und das normale Behandlungsschema angewendet werden. Siehe Tabelle 2 für Dosisanpassungen bei Erwachsenen mit eingeschränkter Nierenfunktion. Weder die Hämodialyse noch die Peritonealdialyse entfernen signifikante Arzneimittelmengen aus dem Körper.
Rekonstitutionsanweisungen für die orale Suspension
Nach der Rekonstitution kann die Suspension 14 Tage lang entweder bei Raumtemperatur oder im Kühlschrank ohne signifikanten Wirkungsverlust aufbewahrt werden. Dicht verschlossen halten. Vor Gebrauch gut schütteln. Verwerfen Sie nicht verwendete Portionen nach 14 Tagen.
WIE GELIEFERT
Darreichungsformen und Stärken
SUPRAX ist zur oralen Verabreichung in den folgenden Darreichungsformen und Stärken erhältlich:
Lagerung und Handhabung
SUPRAX® ist zur oralen Verabreichung in den folgenden Dosierungsformen, Stärken und Packungen erhältlich, die in der folgenden Tabelle aufgeführt sind:
Hergestellt von: Lupine Limited Mandideep 462 046 Indien. Überarbeitet: März 2018.
NEBENWIRKUNGEN
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die am häufigsten beobachteten Nebenwirkungen in US-amerikanischen Studien zur Tablettenformulierung waren gastrointestinale Ereignisse, die bei 30 % der erwachsenen Patienten entweder bei zweimal täglicher oder einmal täglicher Einnahme berichtet wurden. Fünf Prozent (5 %) der Patienten in den klinischen Studien in den USA brachen die Therapie wegen arzneimittelbedingter Nebenwirkungen ab. Einzelne Nebenwirkungen waren Durchfall 16 %, weicher oder häufiger Stuhlgang 6 %, Bauchschmerzen 3 %, Übelkeit 7 %, Dyspepsie 3 % und Flatulenz 4 %. Die Inzidenz von gastrointestinalen Nebenwirkungen, einschließlich Durchfall und weichem Stuhl, bei pädiatrischen Patienten, die die Suspension erhielten, war vergleichbar mit der Inzidenz, die bei erwachsenen Patienten beobachtet wurde, die Tabletten erhielten.
Post-Marketing-Erfahrung
Die folgenden Nebenwirkungen wurden nach der Anwendung von Cefixim nach der Zulassung berichtet. Die Inzidenzraten betrugen weniger als 1 von 50 (weniger als 2 %).
Magen-Darm
In klinischen Studien wurden mehrere Fälle von dokumentierter pseudomembranöser Kolitis identifiziert. Das Auftreten pseudomembranöser Colitis-Symptome kann während oder nach der Therapie auftreten.
Überempfindlichkeitsreaktionen
Anaphylaktische/anaphylaktoide Reaktionen (einschließlich Schock und Todesfälle), Hautausschläge, Urtikaria, Arzneimittelfieber, Pruritus, Angioödem und Gesichtsödem. Erythema multiforme, Stevens-Johnson-Syndrom und Serumkrankheit-ähnliche Reaktionen wurden berichtet.
Leber
Rachenartige Erhöhungen von SGPT, SGOT, alkalischer Phosphatase, Hepatitis, Gelbsucht.
Nieren
Vorübergehende Erhöhungen von BUN oder Kreatinin, akutes Nierenversagen.
Zentrales Nervensystem
Kopfschmerzen, Schwindel, Krampfanfälle.
Hämisches und lymphatisches System
Vorübergehende Thrombozytopenie, Leukopenie, Neutropenie, Verlängerung der Prothrombinzeit, erhöhtes LDH, Panzytopenie, Agranulozytose und Eosinophilie.
Abnormale Labortests
Hyperbilirubinämie.
Andere Nebenwirkungen
Genitaler Pruritus, Vaginitis, Candidiasis, toxische epidermale Nekrolyse.
Gemeldete Nebenwirkungen für Arzneimittel der Cephalosporin-Klasse
Allergische Reaktionen, Superinfektion, Nierenfunktionsstörung, toxische Nephropathie, Leberfunktionsstörung einschließlich Cholestase, aplastische Anämie, hämolytische Anämie, Blutungen und Colitis.
Mehrere Cephalosporine wurden mit der Auslösung von Krampfanfällen in Verbindung gebracht, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, wenn die Dosierung nicht reduziert wurde [siehe DOSIERUNG UND ANWENDUNG sehen ÜBERDOSIS ]. Wenn im Zusammenhang mit der medikamentösen Therapie Krampfanfälle auftreten, sollte das Medikament abgesetzt werden. Bei klinischer Indikation kann eine antikonvulsive Therapie gegeben werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Carbamazepin
Nach Markteinführung wurde über erhöhte Carbamazepin-Spiegel bei gleichzeitiger Anwendung von Cefixim berichtet. Die Überwachung von Arzneimitteln kann hilfreich sein, um Veränderungen der Carbamazepin-Plasmakonzentrationen zu erkennen.
Warfarin und Antikoagulantien
Bei gleichzeitiger Gabe von Cefixim wurde über eine verlängerte Prothrombinzeit mit oder ohne klinische Blutung berichtet.
Arzneimittel-/Labortest-Wechselwirkungen
Eine falsch-positive Reaktion auf Ketone im Urin kann bei Tests auftreten, die Nitroprussid verwenden, aber nicht bei Tests, die Nitroferricyanid verwenden.
Die Verabreichung von Cefixim kann mit Clinitest®, Benedict-Lösung oder Fehling-Lösung zu einer falsch-positiven Reaktion auf Glukose im Urin führen. Es wird empfohlen, Glukosetests auf Basis enzymatischer Glukoseoxidase-Reaktionen (wie Clinistix® oder TesTape®) zu verwenden. Während der Behandlung mit anderen Cephalosporinen wurde über einen falsch positiven direkten Coombs-Test berichtet; Daher sollte berücksichtigt werden, dass ein positiver Coombs-Test auf das Medikament zurückzuführen sein kann.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Überempfindlichkeitsreaktionen
Anaphylaktische/anaphylaktoide Reaktionen (einschließlich Schock und Todesfälle) wurden bei der Anwendung von Cefixim berichtet.
Bevor eine Therapie mit SUPRAX eingeleitet wird, sollte sorgfältig abgeklärt werden, ob beim Patienten frühere Überempfindlichkeitsreaktionen auf Cephalosporine, Penicilline oder andere Arzneimittel aufgetreten sind. Wenn dieses Produkt Penicillin-empfindlichen Patienten verabreicht werden soll, ist Vorsicht geboten, da eine Kreuzallergie zwischen Beta-Lactam-Antibiotika eindeutig dokumentiert wurde und bei bis zu 10 % der Patienten mit Penicillin-Allergie in der Vorgeschichte auftreten kann. Wenn eine allergische Reaktion auf SUPRAX 100 mg auftritt, setzen Sie das Medikament ab.
Clostridium difficile-assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich SUPRAX 200 mg, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Isolate von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, die nach der Anwendung antibakterieller Medikamente an Durchfall leiden. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung antibakterieller Arzneimittel, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibakterielle medikamentöse Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Dosisanpassung bei eingeschränkter Nierenfunktion
Die Dosis von SUPRAX 100 mg sollte bei Patienten mit eingeschränkter Nierenfunktion sowie bei Patienten, die sich einer kontinuierlichen ambulanten Peritonealdialyse (CAPD) und Hämodialyse (HD) unterziehen, angepasst werden. Dialysepatienten sollten sorgfältig überwacht werden [siehe DOSIERUNG UND ANWENDUNG ].
Gerinnungseffekte
Cephalosporine, einschließlich SUPRAX 200 mg, können mit einem Abfall der Prothrombinaktivität in Verbindung gebracht werden. Zu den Risikogruppen gehören Patienten mit eingeschränkter Nieren- oder Leberfunktion oder schlechtem Ernährungszustand sowie Patienten, die eine langwierige antimikrobielle Therapie erhalten, und Patienten, die zuvor mit einer Antikoagulanzientherapie stabilisiert wurden. Bei Risikopatienten sollte die Prothrombinzeit überwacht und exogenes Vitamin K wie angezeigt verabreicht werden.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von SUPRAX (Cefixim) ohne nachgewiesene oder dringend vermutete bakterielle Infektion bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Risiko bei Patienten mit Phenylketonurie
Phenylalanin kann für Patienten mit Phenylketonurie (PKU) schädlich sein. SUPRAX 200 mg Kautabletten enthalten Aspartam, eine Quelle für Phenylalanin. Jede 100-mg-, 150-mg- und 200-mg-Stärke enthält 3,3 mg, 5 mg bzw. 6,7 mg Phenylalanin. Bevor Sie einem Patienten mit PKU SUPRAX Kautabletten verschreiben, sollten Sie die kombinierte tägliche Menge an Phenylalanin aus allen Quellen berücksichtigen, einschließlich SUPRAX 200 mg Kautabletten.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Lebenszeitstudien an Tieren zur Bewertung des kanzerogenen Potenzials wurden nicht durchgeführt. Cefixim verursachte in vitro keine Punktmutationen in Bakterien oder Säugerzellen, DNA-Schäden oder Chromosomenschäden und zeigte in vivo im Maus-Mikrokerntest kein klastogenes Potenzial. Bei Ratten wurden Fertilität und Reproduktionsleistung durch Cefixim in Dosen bis zum 25-Fachen der therapeutischen Dosis für Erwachsene nicht beeinträchtigt.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B
Reproduktionsstudien wurden an Mäusen und Ratten mit bis zum 40-fachen der menschlichen Dosis durchgeführt und ergaben keine Hinweise auf eine Schädigung des Fötus durch Cefixim. Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Arbeit und Lieferung
Cefixim wurde nicht für die Anwendung während der Wehen und der Geburt untersucht. Eine Behandlung sollte nur erfolgen, wenn dies eindeutig erforderlich ist.
Stillende Mutter
Es ist nicht bekannt, ob Cefixim in die Muttermilch übergeht. Es sollte erwogen werden, das Stillen während der Behandlung mit diesem Arzneimittel vorübergehend zu unterbrechen.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Cefixim bei Kindern unter sechs Monaten sind nicht erwiesen. Die Inzidenz von gastrointestinalen Nebenwirkungen, einschließlich Durchfall und weichem Stuhl, bei pädiatrischen Patienten, die die Suspension erhielten, war vergleichbar mit der Inzidenz, die bei erwachsenen Patienten beobachtet wurde, die Tabletten erhielten.
Geriatrische Verwendung
Klinische Studien umfassten keine ausreichende Anzahl von Probanden im Alter von 65 Jahren und älter, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. In einer pharmakokinetischen Studie bei älteren Menschen wurden Unterschiede in den pharmakokinetischen Parametern festgestellt [siehe KLINISCHE PHARMAKOLOGIE ]. Diese Unterschiede waren gering und weisen nicht auf die Notwendigkeit einer Dosisanpassung des Arzneimittels bei älteren Patienten hin.
Nierenfunktionsstörung
Die Dosis von Cefixim sollte bei Patienten mit eingeschränkter Nierenfunktion sowie bei Patienten, die sich einer kontinuierlichen ambulanten Peritonealdialyse (CAPD) und Hämodialyse (HD) unterziehen, angepasst werden. Dialysepatienten sollten sorgfältig überwacht werden [siehe DOSIERUNG UND ANWENDUNG ].
ÜBERDOSIS
Eine Magenspülung kann angezeigt sein; andernfalls existiert kein spezifisches Antidot. Cefixim wird durch Hämodialyse oder Peritonealdialyse nicht in nennenswerten Mengen aus dem Kreislauf entfernt. Die Nebenwirkungen bei einer kleinen Anzahl gesunder erwachsener Probanden, die Einzeldosen von bis zu 2 g Cefixim erhielten, unterschieden sich nicht von dem Profil, das bei Patienten beobachtet wurde, die mit den empfohlenen Dosen behandelt wurden.
KONTRAINDIKATIONEN
Suprax (Cefixim) ist bei Patienten mit bekannter Allergie gegen Cefixim oder andere Cephalosporine kontraindiziert.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Cefixim ist ein halbsynthetisches Cephalosporin-Antibiotikum [vgl Mikrobiologie ].
Pharmakokinetik
SUPRAX 200 mg Kautabletten sind bioäquivalent zu einer Suspension zum Einnehmen.
SUPRAX 200 mg Tabletten und Suspension werden bei oraler Verabreichung zu etwa 40 % bis 50 % resorbiert, unabhängig davon, ob sie mit oder ohne Nahrung verabreicht werden; jedoch verlängert sich die Zeit bis zur maximalen Resorption um etwa 0,8 Stunden, wenn es zusammen mit Nahrung verabreicht wird. Eine einzelne 200-mg-Tablette Cefixim erzeugt eine durchschnittliche maximale Serumkonzentration von etwa 2 µg/ml (Bereich 1 bis 4 µg/ml); eine einzelne 400-mg-Tablette erzeugt eine durchschnittliche Spitzenkonzentration von etwa 3,7 µg/ml (Bereich 1,3 bis 7,7 µg/ml). Die Suspension zum Einnehmen erzeugt durchschnittliche Spitzenkonzentrationen, die etwa 25 % bis 50 % höher sind als die der Tabletten, wenn sie an normalen erwachsenen Probanden getestet wird. 200-mg-Dosen der Suspension zum Einnehmen erzeugen durchschnittliche Spitzenkonzentrationen von 3 µg/ml (Bereich 1 bis 4,5 µg/ml) bzw. 4,6 µg/ml (Bereich 1,9 bis 7,7 µg/ml), wenn sie an normalen erwachsenen Probanden getestet wurden . Die Fläche unter der Zeit-Konzentrations-Kurve (AUC) ist bei der Suspension zum Einnehmen um etwa 10 % bis 25 % größer als bei der Tablette nach Dosierungen von 100 bis 400 mg, wenn an normalen erwachsenen Probanden getestet wurde. Diese erhöhte Resorption sollte berücksichtigt werden, wenn die Tablette durch die Suspension zum Einnehmen ersetzt werden soll. Aufgrund der fehlenden Bioäquivalenz sollten Tabletten zur oralen Suspension bei der Behandlung von Mittelohrentzündung nicht ersetzt werden [siehe DOSIERUNG UND ANWENDUNG ]. Bei Kindern wurden keine Crossover-Studien von Tabletten versus Suspensionen durchgeführt.
Die 400-mg-Kapsel ist unter Nüchternbedingungen mit der 400-mg-Tablette bioäquivalent. Nahrung reduziert jedoch die Resorption nach Verabreichung der Kapsel um etwa 15 %, basierend auf AUC und 25 %, basierend auf Cmax.
Maximale Serumkonzentrationen treten zwischen 2 und 6 Stunden nach oraler Verabreichung einer einzelnen 200-mg-Tablette, einer einzelnen 400-mg-Tablette oder einer 400-mg-Cefixim-Suspension auf. Maximale Serumkonzentrationen treten zwischen 2 und 5 Stunden nach einer einmaligen Verabreichung von 200 mg Suspension auf. Maximale Serumkonzentrationen treten zwischen 3 und 8 Stunden nach der oralen Verabreichung einer einzelnen 400-mg-Kapsel auf.
Verteilung
Die Serumproteinbindung ist mit einem gebundenen Anteil von etwa 65 % konzentrationsunabhängig. In einer Mehrfachdosisstudie, die mit einer Forschungsformulierung durchgeführt wurde, die weniger bioverfügbar ist als die Tablette oder Suspension, kam es nach 14-tägiger Verabreichung zu einer geringen Akkumulation des Arzneimittels im Serum oder Urin. Ausreichende Daten zu Cefixim-Spiegeln im Liquor sind nicht verfügbar.
Stoffwechsel und Ausscheidung
Es gibt keine Hinweise auf eine Metabolisierung von Cefixim in vivo. Ungefähr 50 % der resorbierten Dosis werden innerhalb von 24 Stunden unverändert mit dem Urin ausgeschieden. In Tierversuchen wurde festgestellt, dass Cefixim in mehr als 10 % der verabreichten Dosis auch in die Galle ausgeschieden wird. Die Serumhalbwertszeit von Cefixim bei gesunden Probanden ist unabhängig von der Darreichungsform und beträgt im Durchschnitt 3 bis 4 Stunden, kann aber bei einigen gesunden Probanden bis zu 9 Stunden betragen.
Besondere Populationen
Geriatrie
Die durchschnittlichen AUCs im Steady State bei älteren Patienten sind etwa 40 % höher als die durchschnittlichen AUCs anderer gesunder Erwachsener. Unterschiede in den pharmakokinetischen Parametern zwischen 12 jungen und 12 älteren Probanden, die 400 mg Cefixim einmal täglich über 5 Tage erhielten, werden wie folgt zusammengefasst:
Diese Erhöhungen waren jedoch klinisch nicht signifikant [vgl DOSIERUNG UND ANWENDUNG ].
Nierenfunktionsstörung
Bei Patienten mit mäßig eingeschränkter Nierenfunktion (20 bis 40 ml/min Kreatinin-Clearance) verlängert sich die durchschnittliche Serumhalbwertszeit von Cefixim auf 6,4 Stunden. Bei schwerer Nierenfunktionsstörung (5 bis 20 ml/min Kreatinin-Clearance) erhöhte sich die Halbwertszeit auf durchschnittlich 11,5 Stunden. Das Arzneimittel wird durch Hämodialyse oder Peritonealdialyse nicht signifikant aus dem Blut entfernt. Eine Studie zeigte jedoch, dass Patienten, die sich einer Hämodialyse unterziehen, bei Dosen von 400 mg ähnliche Blutprofile aufweisen wie Patienten mit einer Kreatinin-Clearance von 21 bis 60 ml/min.
Mikrobiologie
Wirkmechanismus
Wie bei anderen Cephalosporinen resultiert die bakterizide Wirkung von Cefixim aus der Hemmung der Zellwandsynthese. Cefixim ist in Gegenwart bestimmter Beta-Lactamase-Enzyme stabil. Infolgedessen können bestimmte Organismen, die aufgrund des Vorhandenseins von Betalactamasen gegen Penicilline und einige Cephalosporine resistent sind, gegenüber Cefixim empfindlich sein.
Widerstand
Resistenz gegen Cefixim bei Isolaten von Haemophilus influenzae und Neisseria gonorrhoeae ist meistens mit Veränderungen der Penicillin-bindenden Proteine (PBPs) verbunden. Cefixim hat möglicherweise eine begrenzte Aktivität gegen Enterobacteriaceae, die Extended-Spectrum-Beta-Lactamasen (ESBLs) produzieren. Pseudomonas-Arten, Enterococcus-Arten, Streptokokkenstämme der Gruppe D, Listeria monocytogenes, die meisten Staphylokokkenstämme (einschließlich Methicillin-resistente Stämme), die meisten Enterobacter-Artenstämme, die meisten Bacteroides-fragilis-Stämme und die meisten Clostridium-Artenstämme sind resistent gegen Cefixim.
Antimikrobielle Aktivität
Es wurde gezeigt, dass Cefixim sowohl in vitro als auch bei klinischen Infektionen gegen die meisten Isolate der folgenden Mikroorganismen aktiv ist [vgl INDIKATIONEN ].
Grampositive Bakterien
Streptococcus pneumoniae Streptococcus pyogenes
Gramnegative Bakterien
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mindestens 90 Prozent der folgenden Bakterien weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich der Empfindlichkeitsgrenze für Cefixim gegenüber Isolaten ähnlicher Gattungen oder Organismengruppen ist. Die Wirksamkeit von Cefixim bei der Behandlung klinischer Infektionen, die durch diese Bakterien verursacht werden, wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Grampositive Bakterien
Streptococcus agalactiae
Gramnegative Bakterien
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia-Spezies Salmonella-Spezies Serratia marcescens Shigella-Spezies
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter: https://www.fda.gov/STIC.
Klinische Studien
Vergleichende klinische Studien zu Mittelohrentzündung wurden an fast 400 Kindern im Alter von 6 Monaten bis 10 Jahren durchgeführt. Streptococcus pneumoniae wurde bei 47 % der Patienten isoliert, Haemophilus influenzae bei 34 %, Moraxella catarrhalis bei 15 % und S. pyogenes bei 4 %.
Die Gesamtansprechrate von Streptococcus pneumoniae auf Cefixim war etwa 10 % niedriger und die von Haemophilus influenzae oder Moraxella catarrhalis etwa 7 % höher (12 %, wenn beta-Lactamase-positive Isolate von H. influenzae eingeschlossen sind) als die Ansprechraten dieser Organismen auf die aktiven Kontrollmedikamente.
In diesen Studien wurden die Patienten randomisiert und entweder mit Cefixim in Dosierungen von 4 mg/kg zweimal täglich oder 8 mg/kg einmal täglich oder mit einem Vergleichspräparat behandelt. Bei 69 bis 70 % der Patienten in jeder Gruppe verschwanden die Anzeichen und Symptome einer Mittelohrentzündung bei der Auswertung 2 bis 4 Wochen nach der Behandlung, aber bei 15 % der Patienten wurde ein anhaltender Erguss festgestellt. Bei der Auswertung am Ende der Therapie wurden 17 % der Patienten, die Cefixim erhielten, und 14 % der Patienten, die wirksame Vergleichsmedikamente erhielten (18 %, einschließlich der Patienten, die eine Haemophilus influenzae-Resistenz gegen das Kontrollmedikament hatten und die das antibakterielle Kontrollmedikament erhielten), als erkrankt angesehen Behandlungsfehler. Bei der 2- bis 4-wöchigen Nachbeobachtung hatten insgesamt 30 % bis 31 % der Patienten Anzeichen eines Behandlungsversagens oder eines Wiederauftretens der Erkrankung.
Bakteriologisches Ergebnis von Otitis media zwei bis vier Wochen nach der Therapie basierend auf wiederholtem Mittelohr
INFORMATIONEN ZUM PATIENTEN
Weisen Sie die Patienten darauf hin, dass antibakterielle Arzneimittel, einschließlich Cefixim, nur zur Behandlung bakterieller Infektionen eingesetzt werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn Cefixim zur Behandlung einer bakteriellen Infektion verschrieben wird, sollten die Patienten darüber aufgeklärt werden, dass sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapiezyklus kann: (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien eine Resistenz entwickeln und nicht mit Cefixim zur Herstellung einer Suspension zum Einnehmen oder Cefixim-Kautabletten oder anderen behandelt werden können antibakterielle Medikamente in der Zukunft.
Weisen Sie Patienten mit Phenylketonurie darauf hin, dass SUPRAX 200 mg Kautabletten Aspartam, eine Phenylalaninquelle, wie folgt enthalten: Jede SUPRAX Kautablette enthält 3,3 mg, 5 mg und 6,7 mg Phenylalanin pro 100 mg, 150 mg bzw. 200 mg Stärke.
Weisen Sie die Patienten darauf hin, dass Durchfall ein häufiges Problem ist, das durch antibakterielle Medikamente verursacht wird und normalerweise endet, wenn das antibakterielle Medikament abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit antibakteriellen Arzneimitteln wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des antibakteriellen Arzneimittels entwickeln. In diesem Fall sollten die Patienten so schnell wie möglich ihren Arzt kontaktieren.