Ceftin 250mg, 500mg, 125mg Cefuroxime Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Ceftin 500 mg und wie wird es angewendet?
Ceftin 500 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome bakterieller Infektionen. Ceftin kann allein oder mit anderen Medikamenten verwendet werden.
Ceftin 250 mg ist ein Cephalosporin-Antibiotikum.
Es ist nicht bekannt, ob Ceftin bei Kindern unter 3 Monaten sicher und wirksam ist.
Welche Nebenwirkungen kann Ceftin haben?
Ceftin 250 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Ceftin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Ceftin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
CEFTIN 500 mg Tabletten und CEFTIN zur Herstellung einer Suspension zum Einnehmen enthalten Cefuroxim als Cefuroximaxetil. CEFTIN ist ein halbsynthetisches Cephalosporin-Antibiotikum zur oralen Verabreichung.
Der chemische Name von Cefuroximaxetil (1-(Acetyloxy)ethylester von Cefuroxim) ist (RS)-1-Hydroxyethyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroxymethyl). )-8-Oxo-5-thia-1-azabicyclo[4.2.0]-oct-2-en-2-carboxylat, 72-(Z)-(O-Methyl-oxim), 1-Acetat-3-carbamat. Seine Summenformel ist C20H22N4O10S und es hat ein Molekulargewicht von 510,48.
Cefuroximaxetil liegt in amorpher Form vor und hat die folgende Strukturformel:
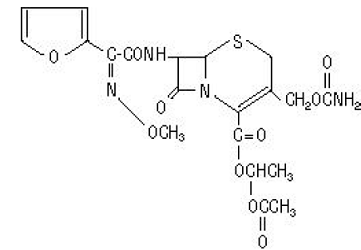
Die Tabletten sind mit einem Film überzogen und enthalten das Äquivalent von 250 oder 500 mg Cefuroxim als Cefuroximaxetil. Tabletten enthalten die Hilfsstoffe kolloidales Siliciumdioxid, Croscarmellose-Natrium, hydriertes Pflanzenöl, Hypromellose, Methylparaben, mikrokristalline Cellulose, Propylenglycol, Propylparaben, Natriumbenzoat, Natriumlaurylsulfat und Titandioxid.
Die orale Suspension ergibt nach Rekonstitution mit Wasser das Äquivalent von 125 mg oder 250 mg Cefuroxim (als Cefuroximaxetil) pro 5 ml. Die orale Suspension enthält die Hilfsstoffe Acesulfam-Kalium, Aspartam, Povidon K30, Stearinsäure, Saccharose, Tutti-Frutti-Aroma und Xanthangummi.
INDIKATIONEN
Pharyngitis/Mandelentzündung
CEFTIN 125 mg Tabletten sind angezeigt für die Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit leichter bis mittelschwerer Pharyngitis/Mandelentzündung, die durch empfindliche Stämme von Streptococcus pyogenes verursacht wird.
CEFTIN 500 mg als Suspension zum Einnehmen ist angezeigt für die Behandlung von pädiatrischen Patienten im Alter von 3 Monaten bis 12 Jahren mit leichter bis mittelschwerer Pharyngitis/Mandelentzündung, die durch empfindliche Stämme von Streptococcus pyogenes verursacht wird.
Nutzungsbeschränkungen
Akute bakterielle Mittelohrentzündung
CEFTIN 125 mg Tabletten sind für die Behandlung von pädiatrischen Patienten (die Tabletten im Ganzen schlucken können) mit akuter bakterieller Mittelohrentzündung indiziert, die durch empfindliche Stämme von Streptococcus pneumoniae, Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Moraxella catarrhalis (einschließlich β-Lactamase) verursacht wird -produzierende Stämme) oder Streptococcus pyogenes.
CEFTIN zur Herstellung einer Suspension zum Einnehmen ist angezeigt für die Behandlung von Kindern und Jugendlichen im Alter von 3 Monaten bis 12 Jahren mit akuter bakterieller Mittelohrentzündung, die durch empfindliche Stämme von Streptococcus pneumoniae, Haemophilus influenzae (einschließlich β-Lactamase-produzierender Stämme), Moraxella catarrhalis (einschließlich β-Lactamase) verursacht wird -produzierende Stämme) oder Streptococcus pyogenes.
Akute bakterielle Sinusitis maxillaris
CEFTIN-Tabletten sind für die Behandlung von erwachsenen und pädiatrischen Patienten (13 Jahre und älter) mit leichter bis mittelschwerer akuter bakterieller Sinusitis maxillaris indiziert, die durch empfindliche Stämme von Streptococcus pneumoniae oder Haemophilus influenzae (nur nicht-β-Lactamase-produzierende Stämme) verursacht wird.
CEFTIN 250 mg Suspension zum Einnehmen ist für die Behandlung von pädiatrischen Patienten im Alter von 3 Monaten bis 12 Jahren mit leichter bis mittelschwerer akuter bakterieller Sinusitis maxillaris indiziert, die durch empfindliche Stämme von Streptococcus pneumoniae oder Haemophilus influenzae (nur nicht-β-Lactamase-produzierende Stämme) verursacht wird. .
Nutzungsbeschränkungen
Die Wirksamkeit von CEFTIN bei Nasennebenhöhlenentzündungen, die durch β-Lactamase-bildendes Haemophilus influenzae oder Moraxella catarrhalis bei Patienten mit akuter bakterieller Sinusitis maxillaris verursacht wurden, wurde aufgrund einer unzureichenden Anzahl dieser Isolate in den klinischen Studien nicht nachgewiesen [siehe Klinische Studien ].
Akute bakterielle Exazerbationen einer chronischen Bronchitis
CEFTIN-Tabletten sind indiziert zur Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit leichten bis mittelschweren akuten bakteriellen Exazerbationen einer chronischen Bronchitis, die durch empfindliche Stämme von Streptococcus pneumoniae, Haemophilus influenzae (β-Lactamase-negative Stämme), oder Haemophilus para influenzae (β-Lactamase-negative Stämme).
Unkomplizierte Haut- und Hautstrukturinfektionen
CEFTIN 250 mg Tabletten sind indiziert zur Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit unkomplizierten Haut- und Hautstrukturinfektionen, die durch empfindliche Stämme von Staphylococcus aureus (einschließlich β-Lactamase-produzierender Stämme) oder Streptococcus pyogenes verursacht werden.
Unkomplizierte Harnwegsinfektionen
CEFTIN 500 mg Tabletten sind angezeigt zur Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit unkomplizierten Harnwegsinfektionen, die durch empfindliche Stämme von Escherichia coli oder Klebsiella pneumoniae verursacht werden.
Unkomplizierter Tripper
CEFTIN-Tabletten sind indiziert zur Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit unkomplizierter Gonorrhoe, urethral und endozervikal, verursacht durch Penicillinase-produzierende und nicht-Penicillinase-produzierende empfindliche Stämme von Neisseria gonorrhoeae und unkomplizierter rektaler Gonorrhoe bei Frauen , verursacht durch nicht-Penicillinase-produzierende empfindliche Stämme von Neisseria gonorrhoeae.
Frühe Borreliose (Erythema migrans)
CEFTIN-Tabletten sind angezeigt für die Behandlung von erwachsenen Patienten und pädiatrischen Patienten (ab 13 Jahren) mit früher Borreliose (Erythema migrans), die durch empfindliche Stämme von Borrelia burgdorferi verursacht wird.
Impetigo
CEFTIN 250 mg als Suspension zum Einnehmen ist angezeigt für die Behandlung von pädiatrischen Patienten im Alter von 3 Monaten bis 12 Jahren mit Impetigo, die durch empfindliche Stämme von Staphylococcus aureus (einschließlich Platamase-produzierender Stämme) oder Streptococcus pyogenes verursacht wird.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von CEFTIN und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte CEFTIN 500 mg nur zur Behandlung oder Vorbeugung von Infektionen verwendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
DOSIERUNG UND ANWENDUNG
Wichtige Verwaltungsanweisungen
Dosierung für CEFTIN 500 mg Tabletten
Verabreichen Sie CEFTIN 250 mg Tabletten, wie in der Tabelle mit den Dosierungsrichtlinien unten beschrieben, mit oder ohne Nahrung.
Dosierung für CEFTIN zur oralen Suspension
Verabreichen Sie CEFTIN zur Herstellung einer Suspension zum Einnehmen, wie in der nachstehenden Tabelle mit den Dosierungsrichtlinien beschrieben, mit Nahrung.
Zubereitung und Verabreichung von CEFTIN zur oralen Suspension
Bereiten Sie zum Zeitpunkt der Abgabe eine Suspension wie folgt vor:
Dosierung bei Patienten mit eingeschränkter Nierenfunktion
Bei Patienten, deren Kreatinin-Clearance weniger als 30 ml/min beträgt, ist eine Anpassung des Dosierungsintervalls erforderlich, wie in Tabelle 4 unten aufgeführt, da Cefuroxim hauptsächlich über die Nieren ausgeschieden wird [siehe KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
CEFTIN-Tabletten sind weiße, kapselförmige Filmtabletten, die in den folgenden Stärken erhältlich sind:
CEFTIN zur Herstellung einer Suspension zum Einnehmen wird als trockenes, weißes bis cremefarbenes Pulver mit Tutti-Frutti-Geschmack bereitgestellt. Bei vorschriftsmäßiger Rekonstitution liefert die Suspension das Äquivalent von 125 mg oder 250 mg Cefuroxim (als Cefuroximaxetil) pro 5 ml.
Lagerung und Handhabung
CEFTIN-Tabletten, 250 mg Cefuroxim (als Cefuroximaxetil), sind weiße, kapselförmige Filmtabletten mit der Prägung „GX ES7“ auf der einen Seite und leer auf der anderen Seite, wie folgt: 20 Tabletten/Flasche NDC 0173-0387-00
CEFTIN-Tabletten, 500 mg Cefuroxim (als Cefuroximaxetil), sind weiße, kapselförmige Filmtabletten mit der Prägung „GX EG2“ auf einer Seite und leer auf der anderen Seite, wie folgt: 20 Tabletten/Flasche NDC 0173-0394-00
Lagern Sie die Tabletten zwischen 15° und 30°C (59° und 86°F). Setzen Sie die Kappe nach jedem Öffnen fest auf.
CEFTIN 500 mg zur Herstellung einer Suspension zum Einnehmen wird als trockenes, weißes bis cremefarbenes Pulver mit Tutti-Frutti-Geschmack bereitgestellt. Bei vorschriftsmäßiger Rekonstitution liefert die Suspension das Äquivalent von 125 mg oder 250 mg Cefuroxim (als Cefuroximaxetil) pro 5 ml. Es wird wie folgt in braunen Glasflaschen geliefert:
125 mg/5 ml
100-ml-Suspension NDC 0173-0740-00
250 mg/5 ml
50-ml-Suspension NDC 0173-0741-10 100-ml-Suspension NDC 0173-0741-00
Trockenpulver vor der Rekonstitution zwischen 2 °C und 30 °C (36 °F und 86 °F) lagern.
Nach der Rekonstitution die Suspension sofort gekühlt zwischen 2 °C und 8 °C (36 °F und 46 °F) lagern. NACH 10 TAGEN ENTSORGEN.
GlaxoSmithKline, Research Triangle Park, NC 27709. Überarbeitet: Okt. 2017
NEBENWIRKUNGEN
Die folgende schwerwiegende und anderweitig wichtige Nebenwirkung wird ausführlicher im Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ auf dem Etikett beschrieben:
Anaphylaktische Reaktionen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Tablets
Mehrfachdosis-Dosierungsschemata mit einer Dauer von 7 bis 10 Tagen
In klinischen Mehrfachdosisstudien wurden 912 Patienten mit CEFTIN (125 bis 500 mg zweimal täglich) behandelt. Es wird darauf hingewiesen, dass 125 mg zweimal täglich keine zugelassene Dosierung ist. Zwanzig (2,2 %) Patienten brachen die Medikation aufgrund von Nebenwirkungen ab. Siebzehn (85 %) der 20 Patienten, die die Therapie abbrachen, taten dies aufgrund von gastrointestinalen Störungen, einschließlich Durchfall, Übelkeit, Erbrechen und Bauchschmerzen. Der Prozentsatz der mit CEFTIN behandelten Patienten, die das Studienmedikament aufgrund von Nebenwirkungen abbrachen, war bei Tagesdosen von 1.000, 500 und 250 mg ähnlich (2,3 %, 2,1 % bzw. 2,2 %). Die Inzidenz gastrointestinaler Nebenwirkungen nahm jedoch mit den höheren empfohlenen Dosen zu.
Die Nebenwirkungen in Tabelle 5 gelten für Probanden (n = 912), die in klinischen Studien mit Mehrfachdosierung mit CEFTIN 250 mg behandelt wurden.
Die folgenden Nebenwirkungen traten bei weniger als 1 %, aber mehr als 0,1 % der Patienten (n = 912) auf, die in klinischen Studien mit Mehrfachdosierung mit CEFTIN behandelt wurden.
Erkrankungen des Immunsystems Nesselsucht, geschwollene Zunge.
Stoffwechsel- und Ernährungsstörungen : Magersucht.
Erkrankungen des Nervensystems : Kopfschmerzen.
Herzerkrankungen : Brustschmerzen.
Atemwegserkrankungen : Kurzatmigkeit.
Gastrointestinale Störungen : Bauchschmerzen, Bauchkrämpfe, Blähungen, Verdauungsstörungen, Geschwüre im Mund.
Erkrankungen der Haut und des Unterhautgewebes : Hautausschlag, Juckreiz.
Nieren- und Harnwegserkrankungen : Dysurie.
Störungen des Fortpflanzungssystems und der Brust : Vaginitis, Juckreiz der Vulva.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort : Schüttelfrost, Schläfrigkeit, Durst.
Untersuchungen : Positiver Coombs-Test.
Frühe Lyme-Borreliose mit 20-tägiger Kur
Zwei multizentrische Studien untersuchten CEFTIN 500 mg zweimal täglich über 20 Tage. Die häufigsten arzneimittelbedingten Nebenwirkungen waren Durchfall (10,6 %), Jarisch-Herxheimer-Reaktion (5,6 %) und Vaginitis (5,4 %). Andere unerwünschte Ereignisse traten mit einer Häufigkeit auf, die mit derjenigen vergleichbar war, die bei einer 7- bis 10-tägigen Dosierung berichtet wurde.
Einzeldosis-Schema für unkomplizierte Gonorrhoe
In klinischen Studien mit einer Einzeldosis von 1.000 mg CEFTIN 250 mg wurden 1.061 Patienten wegen unkomplizierter Gonorrhoe behandelt. Die Nebenwirkungen in Tabelle 6 galten für Patienten, die in klinischen Studien in den USA mit einer Einzeldosis von 1.000 mg CEFTIN behandelt wurden.
Die folgenden Nebenwirkungen traten in klinischen Studien in den USA bei weniger als 1 %, aber mehr als 0,1 % der Studienteilnehmer (n = 1.061) auf, die mit einer Einzeldosis CEFTIN 1.000 mg wegen unkomplizierter Gonorrhoe behandelt wurden.
Infektionen und Schädlinge : Vaginale Candidiasis.
Erkrankungen des Nervensystems : Kopfschmerzen, Schwindel, Schläfrigkeit.
Herzerkrankungen : Engegefühl/Schmerzen in der Brust, Tachykardie.
Gastrointestinale Störungen : Bauchschmerzen, Dyspepsie.
Erkrankungen der Haut und des Unterhautgewebes : Erythem, Hautausschlag, Juckreiz.
Erkrankungen des Bewegungsapparates und des Bindegewebes : Muskelkrämpfe, Muskelsteifheit, Muskelkrämpfe im Nacken, Kiefermuskelreaktion.
Nieren- und Harnwegserkrankungen : Blutungen/Schmerzen in der Harnröhre, Nierenschmerzen.
Störungen des Fortpflanzungssystems und der Brust : Vaginaler Juckreiz, vaginaler Ausfluss.
Mündliche Suspendierung
In klinischen Studien mit Mehrfachdosen von 250 mg CEFTIN wurden pädiatrische Probanden (96,7 % waren jünger als 12 Jahre) mit CEFTIN behandelt (20 bis 30 mg/kg/Tag, aufgeteilt auf zweimal täglich, bis zu einer Höchstdosis von 500 oder 1.000 mg/Tag, beziehungsweise). Elf (1,2 %) Patienten in den USA brachen die Medikation aufgrund von Nebenwirkungen ab. Die Abbrüche erfolgten vor allem wegen Magen-Darm-Störungen, meist Durchfall oder Erbrechen. Dreizehn (1,4 %) pädiatrische Probanden in den USA brachen die Therapie aufgrund von Geschmacksstörungen und/oder Problemen bei der Arzneimittelverabreichung ab.
Die Nebenwirkungen in Tabelle 7 beziehen sich auf Patienten in den USA (n = 931), die in klinischen Studien mit Mehrfachdosierung mit CEFTIN behandelt wurden.
Die folgenden Nebenwirkungen traten bei weniger als 1 %, aber mehr als 0,1 % der Patienten in den USA (n = 931) auf, die in klinischen Studien mit Mehrfachdosierung mit CEFTIN zur Herstellung einer Suspension zum Einnehmen behandelt wurden.
Infektionen und Schädlinge : Gastrointestinale Infektion, Candidiasis, Viruserkrankung, Infektion der oberen Atemwege, Sinusitis, Harnwegsinfektion.
Erkrankungen des Blutes und des Lymphsystems : Eosinophilie.
Psychische Störungen : Hyperaktivität, gereiztes Verhalten.
Gastrointestinale Störungen : Bauchschmerzen, Blähungen, Ptyalismus.
Erkrankungen der Haut und des Unterhautgewebes : Ausschlag.
Erkrankungen des Bewegungsapparates und des Bindegewebes : Gelenkschwellung, Arthralgie.
Störungen des Fortpflanzungssystems und der Brust : Vaginale Reizung.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort : Husten, Fieber.
Untersuchungen : Erhöhte Leberenzyme, positiver Coombs-Test.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CEFTIN nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Blutes und des Lymphsystems
Hämolytische Anämie, Leukopenie, Panzytopenie, Thrombozytopenie.
Gastrointestinale Störungen
Pseudomembranöse Kolitis [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Leber- und Gallenerkrankungen
Leberfunktionsstörung einschließlich Hepatitis und Cholestase, Gelbsucht.
Erkrankungen des Immunsystems
Anaphylaxie, Serumkrankheit-ähnliche Reaktion.
Untersuchungen
Erhöhte Prothrombinzeit.
Erkrankungen des Nervensystems
Krampfanfall, Enzephalopathie.
Nieren- und Harnwegserkrankungen
Nierenfunktionsstörung.
Erkrankungen der Haut und des Unterhautgewebes
Angioödem, Erythema multiforme, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Urtikaria.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Orale Kontrazeptiva
Cefuroximaxetil kann die Darmflora beeinträchtigen, was zu einer geringeren Östrogenreabsorption und einer verringerten Wirksamkeit von kombinierten oralen Östrogen/Progesteron-Kontrazeptiva führt. Raten Sie den Patientinnen, während der Behandlung alternative ergänzende (nicht-hormonelle) Verhütungsmaßnahmen in Erwägung zu ziehen.
Medikamente, die die Magensäure reduzieren
Arzneimittel, die die Magensäure reduzieren, können zu einer geringeren Bioverfügbarkeit von CEFTIN im Vergleich zur Verabreichung im nüchternen Zustand führen. Die Verabreichung von Arzneimitteln, die die Magensäure reduzieren, kann den Nahrungseffekt einer erhöhten Resorption von CEFTIN 250 mg zunichte machen, wenn es im postprandialen Zustand verabreicht wird. CEFTIN mindestens 1 Stunde vor oder 2 Stunden nach der Verabreichung von kurzwirksamen Antazida verabreichen. Histamin-2 (H2)-Antagonisten und Protonenpumpenhemmer sollten vermieden werden.
Probenecid
Die gleichzeitige Verabreichung von Probenecid mit Cefuroximaxetil-Tabletten erhöht die Serumkonzentrationen von Cefuroxim [siehe KLINISCHE PHARMAKOLOGIE ]. Die gleichzeitige Anwendung von Probenecid mit Cefuroximaxetil wird nicht empfohlen.
Arzneimittel-/Labortest-Wechselwirkungen
Eine falsch-positive Reaktion auf Glukose im Urin kann bei Kupferreduktionstests (z. B. Benedikt- oder Fehling-Lösung) auftreten, nicht jedoch bei enzymbasierten Tests auf Glykosurie. Da der Ferricyanid-Test falsch-negativ sein kann, wird empfohlen, bei Patienten, die Cefuroximaxetil erhalten, entweder die Glukoseoxidase- oder die Hexokinase-Methode zur Bestimmung der Blut-/Plasmaglukosespiegel anzuwenden. Das Vorhandensein von Cefuroxim beeinträchtigt die Bestimmung von Serum- und Urin-Kreatinin nach der alkalischen Pikrat-Methode nicht.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Anaphylaktische Reaktionen
Schwerwiegende und gelegentlich tödliche Überempfindlichkeitsreaktionen (anaphylaktische Reaktionen) wurden bei Patienten unter β-Lactam-Antibiotika berichtet. Diese Reaktionen treten mit größerer Wahrscheinlichkeit bei Personen mit einer Vorgeschichte von β-Lactam-Überempfindlichkeit und/oder einer Vorgeschichte von Empfindlichkeit gegenüber mehreren Allergenen auf. Es liegen Berichte über Personen mit bekannter Penicillin-Überempfindlichkeit vor, bei denen schwere Reaktionen auf die Behandlung mit Cephalosporinen aufgetreten sind. CEFTIN 500 mg ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen CEFTIN oder andere β-Lactam-Antibiotika [siehe KONTRAINDIKATIONEN ]. Erkundigen Sie sich vor Beginn der Therapie mit CEFTIN nach früheren Überempfindlichkeitsreaktionen auf Penicilline, Cephalosporine oder andere Allergene. Wenn eine allergische Reaktion auftritt, CEFTIN absetzen und eine geeignete Therapie einleiten.
Clostridium difficile-assoziierter Durchfall
Clostridium difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich CEFTIN, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxinproduzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da über das Auftreten von CDAD über 2 Monate nach der Verabreichung von Antibiotika berichtet wurde.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende Anwendung von Antibiotika, die nicht gegen C. difficile gerichtet sind, möglicherweise eingestellt werden. Je nach klinischer Indikation sollte ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinergänzung, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung eingeleitet werden.
Potenzial für mikrobielles Überwachsen
Die Möglichkeit von Superinfektionen mit pilzlichen oder bakteriellen Erregern sollte während der Therapie berücksichtigt werden.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von CEFTIN entweder ohne nachgewiesene oder stark vermutete bakterielle Infektion oder bei einer prophylaktischen Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Phenylketonurie
CEFTIN 125 mg zur Herstellung einer Suspension zum Einnehmen 125 mg/5 ml enthält 11,8 mg Phenylalanin pro 5 ml (1 Teelöffel) der rekonstituierten Suspension. CEFTIN 250 mg zur Herstellung einer Suspension zum Einnehmen 250 mg/5 ml enthält 25,2 mg Phenylalanin pro 5 ml (1 Teelöffel) der rekonstituierten Suspension.
Interferenz mit Glukosetests
Ein falsch-positives Ergebnis für Glukose im Urin kann bei Kupferreduktionstests und ein falsch-negatives Ergebnis für Blut-/Plasmaglukose bei Ferricyanid-Tests bei Patienten auftreten, die CEFTIN erhalten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Obwohl keine Lebenszeitstudien an Tieren durchgeführt wurden, um das karzinogene Potenzial zu bewerten, wurde für Cefuroximaxetil in einer Reihe von Bakterienmutationstests keine mutagene Aktivität gefunden. Positive Ergebnisse wurden in einem In-vitro-Chromosomenaberrationstest erzielt; negative Ergebnisse wurden jedoch in einem In-vivo-Mikrokerntest bei Dosen bis zu 1,5 g/kg gefunden. Reproduktionsstudien an Ratten mit Dosen von bis zu 1.000 mg/kg/Tag (das Neunfache der empfohlenen maximalen Humandosis basierend auf der Körperoberfläche) haben keine Beeinträchtigung der Fertilität ergeben.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie B. Es liegen keine angemessenen und gut kontrollierten Studien bei Schwangeren vor. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte CEFTIN während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Reproduktionsstudien wurden an Mäusen mit Dosen bis zu 3.200 mg/kg/Tag (das 14-Fache der empfohlenen maximalen Humandosis basierend auf der Körperoberfläche) und an Ratten mit Dosen bis zu 1.000 mg/kg/Tag (das 9-fache der empfohlenen Höchstdosis) durchgeführt menschliche Dosis basierend auf der Körperoberfläche) und haben keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus durch Cefuroximaxetil ergeben.
Stillende Mutter
Da Cefuroxim in die Muttermilch übergeht, ist Vorsicht geboten, wenn CEFTIN 500 mg einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von CEFTIN 250 mg wurde für pädiatrische Patienten im Alter von 3 Monaten bis 12 Jahren mit akuter bakterieller Sinusitis maxillaris basierend auf seiner Zulassung für Erwachsene nachgewiesen. Die Anwendung von CEFTIN bei pädiatrischen Patienten wird durch pharmakokinetische und Sicherheitsdaten bei Erwachsenen und pädiatrischen Patienten sowie durch klinische und mikrobiologische Daten aus angemessenen und gut kontrollierten Studien zur Behandlung der akuten bakteriellen Sinusitis maxillaris bei Erwachsenen und der akuten Mittelohrentzündung mit Erguss gestützt pädiatrische Patienten. Es wird auch durch die Überwachung unerwünschter Ereignisse nach der Markteinführung unterstützt. [Sehen INDIKATIONEN UND VERWENDUNG , DOSIERUNG UND ANWENDUNG , NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE ]
Geriatrische Verwendung
Von der Gesamtzahl der Probanden, die CEFTIN 250 mg in 20 klinischen Studien erhielten, waren 375 im Alter von 65 Jahren und älter, während 151 im Alter von 75 Jahren und älter waren. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren erwachsenen Probanden beobachtet. Berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren erwachsenen Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Cefuroxim wird im Wesentlichen über die Nieren ausgeschieden, und das Risiko von Nebenwirkungen kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da bei älteren Patienten mit größerer Wahrscheinlichkeit eine eingeschränkte Nierenfunktion vorliegt, sollte die Dosis sorgfältig ausgewählt werden, und es kann sinnvoll sein, die Nierenfunktion zu überwachen.
Nierenfunktionsstörung
Bei erwachsenen Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Eine Überdosierung von Cephalosporinen kann eine zerebrale Reizung verursachen, die zu Krämpfen oder Enzephalopathie führen kann. Die Serumspiegel von Cefuroxim können durch Hämodialyse und Peritonealdialyse gesenkt werden.
KONTRAINDIKATIONEN
CEFTIN ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit (z. B. Anaphylaxie) gegen CEFTIN oder andere β-Lactam-Antibiotika (z. B. Penicilline und Cephalosporine).
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
CEFTIN 250 mg ist ein antibakterielles Arzneimittel [siehe Mikrobiologie ].
Pharmakokinetik
Absorption
Cefuroximaxetil wird nach oraler Gabe aus dem Gastrointestinaltrakt resorbiert und schnell durch unspezifische Esterasen in der Darmschleimhaut und im Blut zu Cefuroxim hydrolysiert. Pharmakokinetische Serumparameter für Cefuroxim nach Verabreichung von CEFTIN 250 mg Tabletten an Erwachsene sind in Tabelle 8 aufgeführt.
Food-Effekt
Die Resorption der Tablette ist größer, wenn sie nach einer Mahlzeit eingenommen wird (die absolute Bioverfügbarkeit steigt von 37 % auf 52 %). Trotz dieses Unterschieds in der Resorption waren die klinischen und bakteriologischen Reaktionen der Probanden zum Zeitpunkt der Tabletteneinnahme in 2 Studien, in denen dies untersucht wurde, unabhängig von der Nahrungsaufnahme.
Alle pharmakokinetischen und klinischen Wirksamkeits- und Sicherheitsstudien an pädiatrischen Probanden unter Verwendung der Suspensionsformulierung wurden nach Nahrungsaufnahme durchgeführt. Es liegen keine Daten zur Resorptionskinetik der Suspensionsformulierung bei Verabreichung an nüchterne pädiatrische Probanden vor.
Mangel an Bioäquivalenz
Die orale Suspension war bei Tests an gesunden Erwachsenen nicht bioäquivalent zu Tabletten. Die Tabletten- und Suspensionsformulierungen zum Einnehmen sind NICHT auf Milligramm-Pro-Milligramm-Basis austauschbar. Die Fläche unter der Kurve für die Suspension betrug im Durchschnitt 91 % der für die Tablette, und die maximale Plasmakonzentration für die Suspension betrug im Durchschnitt 71 % der maximalen Plasmakonzentration der Tabletten. Daher wurden die Sicherheit und Wirksamkeit sowohl der Tabletten- als auch der oralen Suspensionsformulierung in separaten klinischen Studien nachgewiesen.
Verteilung
Cefuroxim wird in den extrazellulären Flüssigkeiten verteilt. Etwa 50 % des Serum-Cefuroxims ist an Protein gebunden.
Stoffwechsel
Die Axetil-Einheit wird zu Acetaldehyd und Essigsäure metabolisiert.
Ausscheidung
Cefuroxim wird unverändert im Urin ausgeschieden; Bei Erwachsenen werden etwa 50 % der verabreichten Dosis innerhalb von 12 Stunden im Urin wiedergefunden. Die Pharmakokinetik von Cefuroxim bei Kindern und Jugendlichen wurde nicht untersucht. Bis weitere Daten verfügbar sind, sollte die renale Elimination von Cefuroximaxetil bei Erwachsenen nicht auf pädiatrische Probanden extrapoliert werden.
Spezifische Populationen
Nierenfunktionsstörung
In einer Studie mit 28 Erwachsenen mit normaler Nierenfunktion oder schwerer Nierenfunktionsstörung (Kreatinin-Clearance DOSIERUNG UND ANWENDUNG ].
Pädiatrische Patienten
Pharmakokinetische Serumparameter für Cefuroxim bei Kindern und Jugendlichen, denen CEFTIN zur Herstellung einer Suspension zum Einnehmen verabreicht wurde, sind in Tabelle 9 aufgeführt.
Geriatrische Patienten
In einer Studie mit 20 älteren Probanden (Durchschnittsalter = 83,9 Jahre) mit einer mittleren Kreatinin-Clearance von 34,9 ml/min verlängerte sich die mittlere Eliminationshalbwertszeit aus dem Serum auf 3,5 Stunden; trotz der geringeren Elimination von Cefuroxim bei geriatrischen Patienten ist jedoch eine altersabhängige Dosisanpassung nicht erforderlich [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Wechselwirkungen mit anderen Medikamenten
Die gleichzeitige Verabreichung von Probenecid mit Cefuroximaxetil-Tabletten erhöht die Cefuroxim-Fläche unter der Serumkonzentration-gegen-Zeit-Kurve und der maximalen Serumkonzentration um 50 % bzw. 21 %.
Mikrobiologie
Wirkmechanismus
Cefuroximaxetil ist ein bakterizides Mittel, das durch Hemmung der bakteriellen Zellwandsynthese wirkt. Cefuroximaxetil ist in Gegenwart einiger β-Lactamasen, sowohl Penicillinasen als auch Cephalosporinasen, von gramnegativen und grampositiven Bakterien aktiv.
Widerstandsmechanismus
Die Resistenz gegen Cefuroximaxetil beruht hauptsächlich auf Hydrolyse durch β-Lactamase, Veränderung von Penicillin-bindenden Proteinen (PBPs), verminderter Permeabilität und dem Vorhandensein bakterieller Effluxpumpen.
Die Empfindlichkeit gegenüber Cefuroximaxetil ist geografisch und zeitlich unterschiedlich; lokale Empfindlichkeitsdaten sollten hinzugezogen werden, falls verfügbar. Beta-Lactamase-negative, Ampicillin-resistente (BLNAR) Isolate von H. influenzae sollten als resistent gegen Cefuroximaxetil betrachtet werden.
Es wurde gezeigt, dass Cefuroximaxetil sowohl in vitro als auch bei klinischen Infektionen gegen die meisten Isolate der folgenden Bakterien wirksam ist [vgl INDIKATIONEN UND VERWENDUNG ]:
Gram-positive Bakterien
Staphylococcus aureus (nur Methicillin-empfindliche Isolate) Streptococcus pneumoniae Streptococcus pyogenes
Gramnegative Bakterien
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Isolate, die β-Lactamase (ESBL) und Carbapenemase mit dem größten erweiterten Spektrum produzieren, sind resistent gegen Cefuroximaxetil. Spirochäten Borrelia Burgdorferi
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mindestens 90 Prozent der folgenden Mikroorganismen weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich dem Empfindlichkeitsgrenzwert für Cefuroximaxetil von 1 µg/ml ist. Die Wirksamkeit von Cefuroximaxetil bei der Behandlung klinischer Infektionen durch diese Mikroorganismen wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Gram-positive Bakterien
Staphylococcus epidermidis (nur Methicillin-empfindliche Isolate) Staphylococcus saprophyticus (nur Methicillin-empfindliche Isolate) Streptococcus agalactiae
Gramnegative Bakterien
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaerobe Bakterien Peptococcus niger
Empfindlichkeitstestmethoden
Sofern verfügbar, sollte das klinisch-mikrobiologische Labor die Ergebnisse von In-vitro-Empfindlichkeitstests für antimikrobielle Arzneimittel, die in örtlichen Krankenhäusern und Praxisbereichen verwendet werden, dem Arzt als regelmäßige Berichte zur Verfügung stellen, die das Empfindlichkeitsprofil von nosokomialen und ambulant erworbenen Krankheitserregern beschreiben. Diese Berichte sollen dem Arzt bei der Auswahl eines antibakteriellen Arzneimittels für die Behandlung helfen.
Verdünnungstechniken
Quantitative Methoden werden verwendet, um antimikrobielle MHKs zu bestimmen. Diese MICs liefern reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die MHK-Werte sollten mit einer standardisierten Testmethode (Brühe oder Agar) bestimmt werden.1, 2 Die MHK-Werte sollten gemäß den in Tabelle 10.2,3 angegebenen Kriterien interpretiert werden
Diffusionstechniken
Quantitative Methoden, die die Messung von Zonendurchmessern erfordern, liefern auch reproduzierbare Schätzungen der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße liefert eine Schätzung der Empfindlichkeit von Bakterien gegenüber antimikrobiellen Verbindungen. Die Zonengröße sollte mit einem standardisierten Testverfahren bestimmt werden.4 Bei diesem Verfahren werden mit 30 µg Cefuroximaxetil imprägnierte Papierscheiben verwendet, um die Empfindlichkeit von Mikroorganismen gegenüber Cefuroximaxetil zu testen. Die Interpretationskriterien für die Scheibendiffusion sind in Tabelle 10.3 angegeben
Die Empfindlichkeit von Staphylokokken gegenüber Cefuroxim kann aus der Untersuchung von Penicillin und entweder Cefoxitin oder Oxacillin abgeleitet werden.
Die Anfälligkeit für Streptococcus pyogenes kann aus Tests auf Penicillin abgeleitet werden.3
Ein Bericht „anfällig“ weist darauf hin, dass das antimikrobielle Medikament wahrscheinlich das Wachstum des Krankheitserregers hemmt, wenn das antimikrobielle Medikament die Konzentration erreicht, die normalerweise an der Infektionsstelle erreichbar ist. Ein Bericht von „Zwischen“ weist darauf hin, dass das Ergebnis als zweideutig betrachtet werden sollte und der Test wiederholt werden sollte, wenn der Mikroorganismus nicht vollständig empfindlich gegenüber alternativen, klinisch geeigneten Arzneimitteln ist. Diese Kategorie impliziert eine mögliche klinische Anwendbarkeit an Körperstellen, an denen das Arzneimittel physiologisch konzentriert ist, oder in Situationen, in denen eine hohe Arzneimitteldosis verwendet werden kann. Diese Kategorie bietet auch eine Pufferzone, die verhindert, dass kleine unkontrollierte technische Faktoren größere Diskrepanzen bei der Interpretation verursachen. Ein Bericht „resistent“ weist darauf hin, dass das antimikrobielle Medikament das Wachstum des Pathogens wahrscheinlich nicht hemmt, wenn das antimikrobielle Medikament die Konzentrationen erreicht, die normalerweise an der Infektionsstelle erreichbar sind; andere Therapie gewählt werden.
Qualitätskontrolle
Standardisierte Empfindlichkeitstestverfahren erfordern die Verwendung von Laborkontrollen zur Überwachung und Gewährleistung der Genauigkeit und Präzision der im Assay verwendeten Materialien und Reagenzien sowie der Techniken der Person, die den Test durchführt.1,2,4 Die QC-Bereiche für MHK und Blättchendiffusion Tests mit dem 30-µg-Blättchen sind in Tabelle 11.3 aufgeführt
Klinische Studien
Akute bakterielle Sinusitis maxillaris
Eine adäquate und gut kontrollierte Studie wurde bei Patienten mit akuter bakterieller Sinusitis maxillaris durchgeführt. In dieser Studie wurde jedem Probanden ein Sinus-Aspirat aus der Kieferhöhle durch Sinuspunktion entnommen, bevor die Behandlung einer vermuteten akuten bakteriellen Sinusitis begonnen wurde. Alle Probanden hatten röntgenologische und klinische Anzeichen einer akuten Sinusitis maxillaris. In der Studie war die klinische Wirksamkeit von CEFTIN bei der Behandlung einer akuten Sinusitis maxillaris vergleichbar mit der eines oralen antimikrobiellen Mittels, das einen spezifischen β-Lactamase-Hemmer enthält. Mikrobiologische Daten zeigten jedoch, dass CEFTIN bei der Behandlung von akuter bakterieller Sinusitis maxillaris wirksam ist, die nur durch Streptococcus pneumoniae oder Haemophilus influenzae verursacht wird, die keine β-Lactamase produzieren. In dieser Studie wurden nicht genügend β-Lactamase-produzierende Isolate von Haemophilus influenzae und Moraxella catarrhalis gewonnen, um die Wirksamkeit von CEFTIN bei der Behandlung von akuter bakterieller Sinusitis maxillaris aufgrund dieser beiden Organismen angemessen zu bewerten.
Diese Studie randomisierte 317 erwachsene Probanden, 132 Probanden in den USA und 185 Probanden in Südamerika. Tabelle 12 zeigt die Ergebnisse der Intent-to-treat-Analyse.
In dieser Studie und in einer unterstützenden Studie zur Oberkieferpunktion wurde bei 15 auswertbaren Probanden Haemophilus influenzae, der kein β-Lactamase produziert, als Erreger identifiziert. Von diesen wurde dieser Erreger bei 67 % (10/15) ausgerottet. Achtzehn (18) auswertbare Probanden hatten Streptococcus pneumoniae als identifizierten Erreger. Bei 83 % (15/18) von diesen wurde dieser Erreger ausgerottet.
Frühe Lyme-Borreliose
Zwei adäquate und gut kontrollierte Studien wurden bei Patienten mit früher Lyme-Borreliose durchgeführt. Alle Probanden mit ärztlich dokumentiertem Erythema migrans, mit oder ohne systemische Manifestationen einer Infektion. Die Probanden wurden 1 Monat nach der Behandlung auf Erfolg bei der Behandlung der frühen Lyme-Borreliose (Teil I) und 1 Jahr nach der Behandlung auf Erfolg bei der Verhinderung des Fortschreitens zu den Folgen der späten Lyme-Borreliose (Teil II) untersucht.
Insgesamt 355 erwachsene Probanden (181 mit Cefuroximaxetil behandelt und 174 mit Doxycyclin behandelt) wurden in die 2 Studien randomisiert, wobei die Diagnose einer frühen Lyme-Borreliose in 79 % (281/355) bestätigt wurde. Die klinische Diagnose einer frühen Lyme-Borreliose bei diesen Probanden wurde validiert durch 1) verblindetes Experten-Lesen von Fotografien, sofern verfügbar, der Erythema migrans-Hautläsion vor der Behandlung und 2) serologische Bestätigung (unter Verwendung eines enzymgebundenen Immunosorbent-Assays [ELISA] und eines Immunoblot-Assays). [„Western“-Blot]) auf das Vorhandensein von Antikörpern, die spezifisch gegen Borrelia burgdorferi, den Erreger der Lyme-Borreliose, sind. Die Wirksamkeitsdaten in Tabelle 13 beziehen sich speziell auf diese „validierte“ Patientenuntergruppe, während die nachstehenden Sicherheitsdaten die gesamte Patientenpopulation für die beiden Studien widerspiegeln. Klinische Daten für auswertbare Probanden in der „validierten“ Patientenuntergruppe sind in Tabelle 13 aufgeführt.
CEFTIN und Doxycyclin waren bei der Vorbeugung der Entwicklung von Folgeerscheinungen der späten Lyme-Borreliose wirksam.
Während die Inzidenz arzneimittelbedingter gastrointestinaler Nebenwirkungen in den beiden Behandlungsgruppen ähnlich war (Cefuroximaxetil – 13 %; Doxycyclin – 11 %), war die Inzidenz arzneimittelbedingter Diarrhoe im Cefuroximaxetil-Arm höher als im Doxycyclin-Arm (11 % gegenüber 3 %).
VERWEISE
1. Clinical and Laboratory Standards Institute (CLSI). Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen; Genehmigter Standard - Zehnte Ausgabe. 2015. CLSI-Dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Institut für klinische und Laborstandards (CLSI). Methoden für die antimikrobielle Verdünnung und Disk-Empfindlichkeitstests für selten isolierte oder anspruchsvolle Bakterien: Genehmigte Richtlinien - Zweite Ausgabe. 2010. CLSI-Dokument M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Leistungsstandards für antimikrobielle Empfindlichkeitstests; Fünfundzwanzigste Informationsbeilage. 2015. CLSI-Dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Institut für klinische und Laborstandards (CLSI). Leistungsstandards für antimikrobielle Disk-Diffusions-Empfindlichkeitstests; Genehmigter Standard - Zwölfte Ausgabe. 2015. CLSI-Dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
INFORMATIONEN ZUM PATIENTEN
Allergische Reaktionen
Informieren Sie die Patienten darüber, dass CEFTIN ein Cephalosporin ist, das bei manchen Personen allergische Reaktionen hervorrufen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Clostridium difficile-assoziierter Durchfall
Informieren Sie die Patienten darüber, dass Durchfall ein häufiges Problem ist, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch 2 oder mehr Monate nach Einnahme ihrer letzten Dosis des Antibiotikums entwickeln. Wenn dies auftritt, raten Sie den Patienten, sich so schnell wie möglich an ihren Arzt zu wenden.
Phenylketonurie
Informieren Sie Patienten und Betreuer darüber, dass CEFTIN 125 mg zur Herstellung einer Suspension zum Einnehmen Phenylalanin (ein Bestandteil von Aspartam) enthält [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Tabletten zerkleinern
Weisen Sie die Patienten an, die Tablette im Ganzen zu schlucken, ohne die Tablette zu zerdrücken. Patienten, die die Tablette nicht im Ganzen schlucken können, sollten die Suspension zum Einnehmen erhalten.
Mündliche Suspendierung
Weisen Sie die Patienten an, die Suspension zum Einnehmen vor jeder Anwendung gut zu schütteln, im Kühlschrank aufzubewahren und nach 10 Tagen zu entsorgen. Die Suspension zum Einnehmen sollte mit Nahrung eingenommen werden.
Arzneimittelresistenz
Informieren Sie die Patienten darüber, dass antibakterielle Arzneimittel, einschließlich CEFTIN, nur zur Behandlung bakterieller Infektionen verwendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn CEFTIN 250 mg zur Behandlung einer bakteriellen Infektion verschrieben wird, informieren Sie die Patienten darüber, dass Sie sich zwar zu Beginn der Therapie besser fühlen, das Medikament jedoch genau nach Anweisung eingenommen werden sollte. Das Auslassen von Dosen oder das Nichtbeenden des vollständigen Therapieverlaufs kann: (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit CEFTIN 500 mg oder anderen antibakteriellen Arzneimitteln behandelbar sind .