Behandlung von bakteriellen Infektionen: Bactrim 400/80mg, 800/160mg Trimethoprim Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Markenname: Bactrim
Generischer Name: Sulfamethoxazol und Trimethoprim-Injektion zur intravenösen Infusion
Was ist Bactrim 800 mg?
Bactrim (Sulfamethoxazol und Trimethoprim) DS ist eine Kombination aus zwei Antibiotika zur Behandlung von Harnwegsinfektionen, akuter Mittelohrentzündung, Bronchitis, Shigellose, Pneumocystis-Pneumonie, Reisedurchfall, Methicillin-resistentem Staphylococcus aureus (MRSA) und anderen Bakterien Infektionen, die für dieses Antibiotikum anfällig sind.
Was sind Nebenwirkungen von Bactrim?
Häufige Nebenwirkungen von Bactrim sind:
Informieren Sie Ihren Arzt, wenn bei Ihnen schwerwiegende Nebenwirkungen von Bactrim 800 mg auftreten, einschließlich:
BEZEICHNUNG
BACTRIM™ (Trimethoprim und Sulfamethoxazol) zur Injektion, eine sterile Lösung nur zur intravenösen Infusion, ist eine Kombination aus Sulfamethoxazol, einem Sulfonamid-Antibiotikum, und Trimethoprim, einem Dihydrofolat-Reduktase-Inhibitor-Antibiotikum. Jede 5 ml enthält 80 mg Trimethoprim (16 mg/ml) und 400 mg Sulfamethoxazol (80 mg/ml), gemischt mit 40 % Propylenglycol, 10 % Ethylalkohol und 0,3 % Diethanolamin; 1 % Benzylalkohol und 0,1 % Natriummetabisulfit wurden als Konservierungsmittel hinzugefügt, Wasser für Injektionszwecke und der pH-Wert wurde mit Natriumhydroxid auf etwa 10 eingestellt.
Trimethoprim ist 2,4-Diamino-5-(3,4,5-trimethoxybenzyl)pyrimidin. Es ist eine weiße bis hellgelbe, geruchlose, bittere Verbindung mit einem Molekulargewicht von 290,3 und folgender Strukturformel:
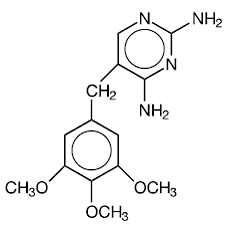
C14H18N4O3 MW 290,3
Sulfamethoxazol ist N1-(5-Methyl-3-isoxazolyl)sulfanilamid. Es ist eine fast weiße, geruchlose, geschmacklose Verbindung mit einem Molekulargewicht von 253,28 und der folgenden Strukturformel:
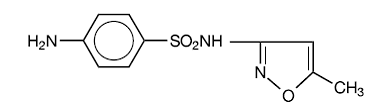
C10H11N3O3S MW 253,28
INDIKATIONEN
Pneumocystis jirovecii Pneumonie
BACTRIM ist indiziert zur Behandlung von Pneumocystis-jirovecii-Pneumonie bei Erwachsenen und pädiatrischen Patienten im Alter von zwei Monaten und älter.
Shigellose
BACTRIM 400 mg ist indiziert zur Behandlung von Enteritis, die durch empfindliche Stämme von Shigella flexneri und Shigella sonnei verursacht wird, bei Erwachsenen und pädiatrischen Patienten im Alter von zwei Monaten und älter.
Harnwegsinfektion
BACTRIM ist indiziert zur Behandlung von schweren oder komplizierten Harnwegsinfektionen bei Erwachsenen und pädiatrischen Patienten ab einem Alter von zwei Monaten aufgrund empfindlicher Stämme von Escherichia coli, Klebsiella-Spezies, Enterobacter-Spezies, Morganella morganii, Proteus mirabilis und Proteus vulgaris bei oraler Verabreichung BACTRIM ist nicht machbar und wenn der Organismus nicht anfällig für antibakterielle Einzelwirkstoffe ist, die im Harntrakt wirksam sind.
Verwendungszweck
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von BACTRIM und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte BACTRIM nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, die nachweislich oder mit starkem Verdacht auf empfindliche Bakterien zurückzuführen sind. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten diese bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Anfälligkeitsmuster zur empirischen Auswahl der Therapie beitragen.
Obwohl geeignete Kultur- und Empfindlichkeitsstudien durchgeführt werden sollten, kann mit der Therapie begonnen werden, während die Ergebnisse dieser Studien abgewartet werden.
DOSIERUNG UND ANWENDUNG
Dosierung bei Erwachsenen und pädiatrischen Patienten (zwei Monate alt und älter)
Die maximal empfohlene Tagesdosis beträgt 60 ml (960 mg Trimethoprim) pro Tag.
Dosierungsänderungen bei Patienten mit eingeschränkter Nierenfunktion
Wenn die Nierenfunktion eingeschränkt ist, sollte eine reduzierte Dosierung angewendet werden, wie in Tabelle 2 gezeigt.
Wichtige Verwaltungsanweisungen
Verabreichen Sie die Lösung als intravenöse Infusion über einen Zeitraum von 60 bis 90 Minuten. Vermeiden Sie die Verabreichung als schnelle Infusion oder Bolusinjektion. BACTRIM 400 mg NICHT intramuskulär verabreichen.
Überprüfen Sie parenterale Arzneimittel vor der Verabreichung visuell auf Partikel und Verfärbungen, wann immer die Lösung und das Behältnis dies zulassen.
Herstellungsverfahren
Verdünnung von Einzel- und Mehrfachdosis-Fläschchen
BACTRIM muss verdünnt werden. Jeweils 5 ml sollten zu 125 ml 5 % Dextrose in Wasser gegeben werden. Nach dem Verdünnen mit 5 % Dextrose in Wasser sollte die Lösung nicht im Kühlschrank aufbewahrt und innerhalb von 6 Stunden verwendet werden.
Wenn eine Verdünnung von 5 ml pro 100 ml 5 %iger Dextrose in Wasser gewünscht wird, sollte sie innerhalb von 4 Stunden verwendet werden. In den Fällen, in denen eine Flüssigkeitsbeschränkung wünschenswert ist, können jeweils 5 ml zu 75 ml 5 % Dextrose in Wasser gegeben werden. Unter diesen Umständen sollte die Lösung unmittelbar vor der Anwendung gemischt und innerhalb von 2 Stunden verabreicht werden.
Wenn nach dem Mischen eine Trübung oder Kristallisation erkennbar ist, sollte die Lösung verworfen und eine frische Lösung hergestellt werden.
Tun NICHT Mischen Sie Bactrim in 5 % Dextrose in Wasser mit Arzneimitteln oder Lösungen im selben Behälter.
Durchstechflaschen mit mehreren Dosen (Handhabung)
Nach dem erstmaligen Einfüllen in die Durchstechflasche muss der restliche Inhalt innerhalb von 48 Stunden verbraucht werden.
Infusionssysteme zur intravenösen Verabreichung
Die folgenden Infusionssysteme wurden getestet und für zufriedenstellend befunden: Einheitsdosis-Glasbehälter; Einzeldosisbehälter aus Polyvinylchlorid und Polyolefin. Andere Systeme wurden nicht getestet und können daher nicht empfohlen werden.
WIE GELIEFERT
Darreichungsformen und Stärken
BACTRIM ist als Injektion mit 80 mg/ml Sulfamethoxazol und 16 mg/ml Trimethoprim in 10-ml-Einzeldosis- und 30-ml-Mehrfachdosis-Durchstechflaschen erhältlich.
Lagerung und Handhabung
Injektion von BACTRIM™ (Sulfamethoxazol und Trimethoprim). wird wie folgt geliefert:
10-ml-Fläschchen enthaltend 160 mg Trimethoprim (16 mg/ml) und 800 mg Sulfamethoxazol (80 mg/ml) zur Infusion mit 5 % Dextrose in Wasser.
10-ml-Fläschchen: NDC 49708-001-4210-ml-Fläschchen (Box mit 10): NDC 49708-001-45
30-ml-Fläschchen mit mehreren Dosen , jeweils 5 ml mit 80 mg Trimethoprim (16 mg/ml) und 400 mg Sulfamethoxazol (80 mg/ml) zur Infusion mit 5 % Dextrose in Wasser.
30-ml-Durchstechflasche (1er-Box): NDC 49708-002-47
Bei Raumtemperatur lagern (15 °C – 30 °C oder 59 °F – 86 °F). NICHT KÜHLEN.
VERWEISE
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimethoprim-Sulfamethoxazol zur Behandlung von Pneumocystis-carinii-Pneumonie. Ann Intern Med. Juni 1980;92:762-769.
Vertrieb durch: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Überarbeitet: Juli 2020
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden an anderer Stelle in der Kennzeichnung beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die häufigsten Nebenwirkungen sind gastrointestinale Störungen (Übelkeit, Erbrechen und Anorexie) und allergische Hautreaktionen (wie Hautausschlag und Nesselsucht).
Lokalreaktionen, Schmerzen und leichte Reizungen bei intravenöser (i.v.) Verabreichung sind selten. Thrombophlebitis wurde beobachtet.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von BACTRIM nach der Zulassung festgestellt. Da diese Reaktionen freiwillig von einer Population unbekannter Größe gemeldet wurden, ist es nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen:
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Potenzielle Auswirkungen von BACTRIM 400 mg auf andere Medikamente
Trimethoprim ist ein Inhibitor von CYP2C8 sowie OCT2-Transporter. Sulfamethoxazol ist ein Inhibitor von CYP2C9. Vermeiden Sie die gleichzeitige Verabreichung von BACTRIM 80 mg mit Arzneimitteln, die Substrate von CYP2C8 und 2C9 oder OCT2 sind.
Wechselwirkungen mit Labor- oder Diagnosetests
BACTRIM, insbesondere die Trimethoprim-Komponente, kann einen Serum-Methotrexat-Assay stören, wie durch die kompetitive Bindungsprotein-Technik (CBPA) bestimmt, wenn eine bakterielle Dihydrofolat-Reduktase als Bindungsprotein verwendet wird. Es treten jedoch keine Interferenzen auf, wenn Methotrexat mit einem Radioimmunoassay (RIA) gemessen wird.
Das Vorhandensein von BACTRIM kann auch den Jaffe-Alkali-Pikrat-Reaktionsassay für Kreatinin stören, was zu Überschätzungen von etwa 10 % im Bereich der normalen Werte führt.
VERWEISE
2. Al-Khatib SM, LaPointe N., Kramer JM, Califf RM. Was Ärzte über das QT-Intervall wissen sollten. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Storch C, Wang RY. Review: Die Pharmakologie und Toxikologie von Dofetilid. Int J Med Toxicol. 2001;4(2):16.
5. London NJ, Garg SJ, Moorthy RS, Cunningham ET. Arzneimittelinduzierte Uveitis. J Ophthalmic Inflamm Infect. 2013;3:43.
6. Marinella MA. Trimethoprim-induzierte Hyperkaliämie: Eine Analyse gemeldeter Fälle. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Lebensbedrohliche Hyperkaliämie und Azidose als Folge einer Behandlung mit Trimethoprimsulfamethoxazol. J. Nephrol. 2001;14(5):410-414.
8. Moh R. et al. Hämatologische Veränderungen bei Erwachsenen, die in der Elfenbeinküste ein Zidovudin-haltiges HAART-Schema in Kombination mit Cotrimoxazol erhielten. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T., Rocci ML Jr., Vlasses PH. Trimethoprim verändert die Disposition von Procainamid und Nacetylprocainamid. Clin Pharmacol Ther. Okt. 1988;44(4):467-77.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Embryo-fötale Toxizität
Einige epidemiologische Studien deuten darauf hin, dass die Exposition gegenüber BACTRIM während der Schwangerschaft mit einem erhöhten Risiko für angeborene Fehlbildungen verbunden sein kann, insbesondere Neuralrohrdefekte, kardiovaskuläre Fehlbildungen, Harnwegsdefekte, Mundspalten und Klumpfuß. Wenn BACTRIM 400 mg während der Schwangerschaft angewendet wird oder wenn die Patientin während der Einnahme dieses Arzneimittels schwanger wird, sollte die Patientin über die potenziellen Gefahren für den Fötus aufgeklärt werden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Überempfindlichkeit und andere tödliche Reaktionen
Todesfälle im Zusammenhang mit der Verabreichung von Sulfonamiden sind aufgrund schwerer Reaktionen aufgetreten, darunter Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, fulminante hepatische Nekrose, Agranulozytose, aplastische Anämie und andere Blutdyskrasien.
Sulfonamide, einschließlich sulfonamidhaltiger Produkte wie BACTRIM, sollten beim ersten Auftreten von Hautausschlag oder Anzeichen einer Nebenwirkung abgesetzt werden. Klinische Anzeichen wie Hautausschlag, Halsschmerzen, Fieber, Arthralgie, Husten, Kurzatmigkeit, Blässe, Purpura oder Gelbsucht können erste Hinweise auf schwerwiegende Reaktionen sein. Auf einen Hautausschlag können schwerwiegendere Reaktionen folgen, wie z. B. Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, hepatische Nekrose oder schwere Blutkrankheit. Bei Patienten, die Sulfonamide erhalten, sollte häufig ein großes Blutbild erstellt werden. Husten, Kurzatmigkeit und Lungeninfiltrate sind Überempfindlichkeitsreaktionen der Atemwege, die im Zusammenhang mit einer Sulfonamidbehandlung berichtet wurden.
Thrombozytopenie
BACTRIM-induzierte Thrombozytopenie kann eine immunvermittelte Erkrankung sein. Schwere Fälle von tödlicher oder lebensbedrohlicher Thrombozytopenie wurden berichtet. Patienten auf hämatologische Toxizität überwachen. Die Thrombozytopenie klingt in der Regel innerhalb einer Woche nach Absetzen von BACTRIM ab.
Streptokokkeninfektionen und rheumatisches Fieber
Vermeiden Sie die Anwendung von BACTRIM bei der Behandlung von Streptokokken-Pharyngitis. Klinische Studien haben dokumentiert, dass Patienten mit β-hämolytischer Streptokokken-Tonsillopharyngitis der Gruppe A häufiger bakteriologisches Versagen aufweisen, wenn sie mit BACTRIM 800 mg behandelt werden, als bei Patienten, die mit Penicillin behandelt werden, was durch das Scheitern der Ausrottung dieses Organismus aus dem Tonsillopharynxbereich belegt wird. Daher wird BACTRIM Folgeerscheinungen wie rheumatisches Fieber nicht verhindern.
Clostridioides difficile-assoziierter Durchfall
Clostridioides difficile-assoziierte Diarrhoe (CDAD) wurde bei der Anwendung von fast allen antibakteriellen Mitteln, einschließlich BACTRIM 80 mg, berichtet und kann in ihrer Schwere von leichter Diarrhoe bis hin zu tödlicher Colitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem übermäßigen Wachstum von C. difficile führt.
C. difficile produziert die Toxine A und B, die zur Entstehung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegenüber einer antimikrobiellen Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung von Antibiotika auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss die laufende antibakterielle Anwendung, die nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Angemessenes Flüssigkeits- und Elektrolytmanagement, Proteinergänzung, antibakterielle Behandlung von
C. difficile, und eine chirurgische Untersuchung sollte nach klinischer Indikation eingeleitet werden.
Sulfit-Empfindlichkeit
BACTRIM 400 mg enthält Natriummetabisulfit, ein Sulfit, das bei bestimmten empfindlichen Personen allergische Reaktionen hervorrufen kann, einschließlich anaphylaktischer Symptome und lebensbedrohlicher oder weniger schwerer asthmatischer Episoden. Die Gesamtprävalenz der Sulfitsensitivität in der Allgemeinbevölkerung ist nicht bekannt. Sulfit-Empfindlichkeit wird häufiger bei Asthmatikern als bei Nicht-Asthmatikern beobachtet.
Toxizität von Benzylalkohol bei pädiatrischen Patienten („Gasping-Syndrom“)
BACTRIM 160 mg enthält Benzylalkohol als Konservierungsmittel. Bei Neugeborenen und Säuglingen mit niedrigem Geburtsgewicht, die mit Benzylalkohol-konservierten Formulierungen in Infusionslösungen, einschließlich BACTRIM, behandelt werden, können schwerwiegende und tödliche Nebenwirkungen einschließlich des „Gasping-Syndroms“ auftreten. Das „Gasping-Syndrom“ ist gekennzeichnet durch eine Depression des zentralen Nervensystems, metabolische Azidose und keuchende Atmung. BACTRIM 160 mg ist bei pädiatrischen Patienten unter zwei Monaten kontraindiziert [siehe KONTRAINDIKATIONEN ].
Berücksichtigen Sie bei der Verschreibung von BACTRIM 400 mg für pädiatrische Patienten (ab zwei Monaten) die kombinierte tägliche metabolische Belastung von Benzylalkohol aus allen Quellen, einschließlich BACTRIM (enthält 10 mg Benzylalkohol pro ml) und anderen Arzneimitteln, die Benzylalkohol enthalten. Die Mindestmenge an Benzylalkohol, bei der schwerwiegende Nebenwirkungen auftreten können, ist nicht bekannt [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Risiko im Zusammenhang mit der gleichzeitigen Anwendung von Leucovorin bei Pneumocystis-jirovecii-Pneumonie
Bei der gleichzeitigen Anwendung von BACTRIM und Leucovorin zur Behandlung von HIV-positiven Patienten mit Pneumocystis-jirovecii-Pneumonie in einer randomisierten placebokontrollierten Studie wurden Behandlungsversagen und erhöhte Sterblichkeit beobachtet.4 Vermeiden Sie die gleichzeitige Anwendung von BACTRIM und Leucovorin während der Behandlung von Pneumocystis-jirovecii-Pneumonie.
Toxizität von Propylenglykol
BACTRIM enthält Propylenglycol als Lösungsmittel (40 % v/v). Bei Verabreichung in hohen Dosen wie zur Behandlung von P. jirovecii-Pneumonie und gleichzeitig mit anderen Produkten, die Propylenglycol enthalten, kann eine Hyperosmolarität mit metabolischer Azidose mit Anionenlücke, einschließlich Laktatazidose, auftreten. Die Toxizität von Propylenglykol kann zu akuter Nierenschädigung, ZNS-Toxizität und Multiorganversagen führen. Überwachen Sie die tägliche Gesamtaufnahme von Propylenglykol aus allen Quellen und auf Säure-Basen-Störungen. BACTRIM 400 mg absetzen, wenn Verdacht auf Propylenglykol-Toxizität besteht [siehe NEBENWIRKUNGEN ].
Folsäuremangel
Vermeiden Sie die Anwendung von BACTRIM 160 mg bei Patienten mit eingeschränkter Nieren- oder Leberfunktion, bei Patienten mit möglichem Folatmangel (z. B. ältere Menschen, chronische Alkoholiker, Patienten, die eine Antikonvulsiva-Therapie erhalten, Patienten mit Malabsorptionssyndrom und Patienten mit Mangelernährung) und bei Patienten mit schweren Allergien oder Asthma bronchiale.
Hämatologische Veränderungen, die auf einen Folsäuremangel hindeuten, können bei älteren Patienten oder bei Patienten mit vorbestehendem Folsäuremangel oder Nierenversagen auftreten. Diese Wirkungen sind durch eine Folinsäuretherapie reversibel [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Hämolyse
Bei Personen mit Glucose-6-Phosphat-Dehydrogenase-Mangel kann Hämolyse auftreten. Diese Reaktion ist häufig dosisabhängig.
Infusionsreaktionen
Bei BACTRIM wurden lokale Reizungen und Entzündungen aufgrund einer extravaskulären Infiltration der Infusion beobachtet. Wenn diese auftreten, sollte die Infusion abgebrochen und an einer anderen Stelle wieder aufgenommen werden.
Hypoglykämie
Bei mit BACTRIM 400 mg behandelten Nicht-Diabetikern wurden Fälle von Hypoglykämie beobachtet, die in der Regel nach einigen Behandlungstagen auftraten. Besonders gefährdet sind Patienten mit Nierenfunktionsstörungen, Lebererkrankungen, Mangelernährung oder Patienten, die hohe Dosen von BACTRIM 800 mg erhalten.
Beeinträchtigter Phenylalaninstoffwechsel
Es wurde festgestellt, dass Trimethoprim, ein Bestandteil von BACTRIM, den Phenylalaninstoffwechsel beeinträchtigt, aber dies ist bei Phenylketonurikern bei entsprechender diätetischer Einschränkung ohne Bedeutung.
Porphyrie und Hypothyreose
Wie andere Arzneimittel, die Sulfonamide enthalten, kann BACTRIM eine Porphyrie-Krise und Hypothyreose auslösen. Vermeiden Sie die Anwendung von BACTRIM bei Patienten mit Porphyrie oder Schilddrüsenfunktionsstörung.
Potentielles Risiko bei der Behandlung von Pneumocystis-jirovecii-Pneumonie bei Patienten mit erworbenem Immunschwächesyndrom (AIDS)
AIDS-Patienten vertragen oder sprechen möglicherweise nicht in der gleichen Weise auf BACTRIM an wie Nicht-AIDS-Patienten. Es wurde berichtet, dass die Inzidenz von Nebenwirkungen, insbesondere Hautausschlag, Fieber, Leukopenie und erhöhte Aminotransferase (Transaminase)-Werte, unter BACTRIM-Therapie bei AIDS-Patienten, die wegen einer Pneumocystis-jirovecii-Pneumonie behandelt werden, im Vergleich zu der normalerweise damit verbundenen Inzidenz stark erhöht ist Verwendung von BACTRIM 800 mg bei Nicht-AIDS-Patienten. Wenn ein Patient Hautausschlag oder Anzeichen einer Nebenwirkung entwickelt, muss die Therapie mit BACTRIM neu bewertet werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Vermeiden Sie die gleichzeitige Verabreichung von BACTRIM 80 mg und Leucovorin während der Behandlung einer Pneumocystis-jirovecii-Pneumonie [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Elektrolytanomalien
Eine hohe Trimethoprim-Dosierung, wie sie bei Patienten mit P. jirovecii-Pneumonie angewendet wird, induziert bei einer beträchtlichen Anzahl von Patienten einen progressiven, aber reversiblen Anstieg der Serumkaliumkonzentrationen. Selbst die Behandlung mit den empfohlenen Dosen kann eine Hyperkaliämie verursachen, wenn Trimethoprim Patienten mit zugrunde liegenden Störungen des Kaliumstoffwechsels oder mit Niereninsuffizienz verabreicht wird oder wenn gleichzeitig Arzneimittel verabreicht werden, von denen bekannt ist, dass sie eine Hyperkaliämie induzieren. Bei diesen Patienten ist eine engmaschige Überwachung des Serumkaliumspiegels erforderlich.
Schwere und symptomatische Hyponatriämie kann bei Patienten auftreten, die BACTRIM 800 mg erhalten, insbesondere zur Behandlung einer P.-jirovecii-Pneumonie. Bei symptomatischen Patienten ist eine Untersuchung auf Hyponatriämie und eine entsprechende Korrektur erforderlich, um lebensbedrohliche Komplikationen zu vermeiden.
Stellen Sie während der Behandlung eine ausreichende Flüssigkeitsaufnahme und Harnausscheidung sicher, um Kristallurie zu verhindern. Patienten, die „langsame Acetylierer“ sind, können anfälliger für idiosynkratische Reaktionen auf Sulfonamide sein.
Überwachung von Labortests
Bei Patienten, die BACTRIM erhalten, sollte häufig ein großes Blutbild erstellt werden. Setzen Sie BACTRIM 800 mg ab, wenn eine signifikante Abnahme der Anzahl gebildeter Blutelemente festgestellt wird. Führen Sie während der Therapie Urinanalysen mit sorgfältiger mikroskopischer Untersuchung und Nierenfunktionstests durch, insbesondere bei Patienten mit eingeschränkter Nierenfunktion.
Entwicklung arzneimittelresistenter Bakterien
Die Verschreibung von BACTRIM ohne nachgewiesene oder dringend vermutete bakterielle Infektion oder ohne prophylaktische Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Sulfamethoxazol war nicht karzinogen, wenn es in einer 26-wöchigen tumorerzeugenden Mausstudie (Tg-rasH2) in Dosen von bis zu 400 mg/kg/Tag Sulfamethoxazol untersucht wurde; entspricht der 2-fachen systemischen Exposition des Menschen (bei einer Tagesdosis von 800 mg Sulfamethoxazol 2-mal täglich (zweimal täglich).
Mutagenese
In-vitro-Rückmutationsbakterientests gemäß dem Standardprotokoll wurden mit Sulfamethoxazol und Trimethoprim in Kombination nicht durchgeführt. Ein In-vitro-Chromosomenaberrationstest an humanen Lymphozyten mit Sulfamethoxazol/Trimethoprim war negativ. In In-vitro- und In-vivo-Tests an Tierarten schädigte Sulfamethoxazol/Trimethoprim die Chromosomen nicht. In-vivo-Mikronukleus-Assays waren nach oraler Verabreichung von Sulfamethoxazol/Trimethoprim positiv. Beobachtungen von Leukozyten von Patienten, die mit Sulfamethoxazol und Trimethoprim behandelt wurden, zeigten keine Chromosomenanomalien.
Sulfamethoxazol allein war in einem In-vitro-Reverse-Mutation-Bakterien-Assay und in In-vitro-Mikronukleus-Assays mit kultivierten menschlichen Lymphozyten positiv.
Trimethoprim allein war in In-vitro-Tests mit Rückmutationsbakterien und in In-vitro-Tests auf Chromosomenaberration mit Eierstock- oder Lungenzellen des Chinesischen Hamsters mit oder ohne S9-Aktivierung negativ. In In-vitro-Tests auf Comet-, Mikronukleus- und Chromosomenschädigung unter Verwendung von kultivierten menschlichen Lymphozyten war Trimethoprim positiv. Bei Mäusen wurde nach oraler Verabreichung von Trimethoprim in Comet-Assays keine DNA-Schädigung von Leber, Niere, Lunge, Milz oder Knochenmark festgestellt.
Beeinträchtigung der Fruchtbarkeit
Bei Ratten, denen orale Dosen von bis zu 350 mg/kg/Tag Sulfamethoxazol plus 70 mg/kg/Tag Trimethoprim verabreicht wurden, wurden keine nachteiligen Auswirkungen auf die Fertilität oder die allgemeine Fortpflanzungsfähigkeit beobachtet, Dosen, die etwa das Zweifache der empfohlenen Tagesdosis für Menschen bezogen auf die Körperoberfläche waren .
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
BACTRIM kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Einige epidemiologische Studien deuten darauf hin, dass die Exposition gegenüber BACTRIM 400 mg während der Schwangerschaft mit einem erhöhten Risiko für angeborene Fehlbildungen verbunden sein kann, insbesondere Neuralrohrdefekte, kardiovaskuläre Anomalien, Harnwegsdefekte, Mundspalten und Klumpfuß (siehe Menschliche Daten ).
Eine von 3 Studien an Ratten zeigte eine Gaumenspalte bei Dosen, die etwa dem Fünffachen der empfohlenen Humandosis bezogen auf die Körperoberfläche entsprachen; die anderen 2 Studien zeigten keine Teratogenität bei ähnlichen Dosen. Studien an trächtigen Kaninchen zeigten einen erhöhten fötalen Verlust bei etwa dem 6-Fachen der Dosis beim Menschen, bezogen auf die Körperoberfläche (vgl Tierdaten ).
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %. Informieren Sie schwangere Frauen über die potenzielle Gefahr von BACTRIM 400 mg für den Fötus (siehe Klinische Überlegungen ).
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryonale/fetales Risiko
Harnwegsinfektionen in der Schwangerschaft sind mit unerwünschten perinatalen Folgen wie Frühgeburt, niedrigem Geburtsgewicht und Präeklampsie sowie einer erhöhten Sterblichkeit der schwangeren Frau verbunden. P. jirovecii-Pneumonie in der Schwangerschaft ist mit Frühgeburt und erhöhter Morbidität und Mortalität für die schwangere Frau verbunden. BACTRIM sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Daten
Menschliche Daten
Während es keine großen, prospektiven, gut kontrollierten Studien bei Schwangeren und ihren Babys gibt, deuten einige retrospektive epidemiologische Studien auf einen Zusammenhang zwischen der Exposition gegenüber BACTRIM 80 mg im ersten Trimester und einem erhöhten Risiko für angeborene Missbildungen, insbesondere Neuralrohrdefekte, kardiovaskuläre Anomalien, Harnwege hin Traktdefekte, Mundspalten und Klumpfuß. Diese Studien waren jedoch durch die geringe Anzahl exponierter Fälle und die fehlende Anpassung für multiple statistische Vergleiche und Confounder begrenzt. Diese Studien werden weiter durch Erinnerungs-, Auswahl- und Informationsverzerrungen sowie durch die begrenzte Verallgemeinerbarkeit ihrer Ergebnisse eingeschränkt. Schließlich variierten die Ergebnismessungen zwischen den Studien, was studienübergreifende Vergleiche einschränkte. Alternativ konnten andere epidemiologische Studien keine statistisch signifikanten Zusammenhänge zwischen der BACTRIM-160-mg-Exposition und spezifischen Missbildungen nachweisen. Brumfitt und Pursell10 berichteten in einer retrospektiven Studie über das Ergebnis von 186 Schwangerschaften, bei denen die Mutter entweder Placebo oder orales Trimethoprim und Sulfamethoxazol erhielt. Die Inzidenz angeborener Anomalien betrug 4,5 % (3 von 66) bei denjenigen, die Placebo erhielten, und 3,3 % (4 von 120) bei denjenigen, die Trimethoprim und Sulfamethoxazol erhielten. Bei den 10 Kindern, deren Mütter das Medikament im ersten Trimester erhielten, gab es keine Auffälligkeiten. In einer separaten Untersuchung fanden Brumfitt und Pursell auch keine angeborenen Anomalien bei 35 Kindern, deren Mütter zum Zeitpunkt der Empfängnis oder kurz danach Trimethoprim und Sulfamethoxazol oral erhalten hatten.
Tierdaten
Bei Ratten führten orale Dosen von entweder 533 mg/kg Sulfamethoxazol oder 200 mg/kg Trimethoprim zu teratologischen Wirkungen, die sich hauptsächlich in Gaumenspalten äußerten. Diese Dosen entsprechen ungefähr dem 5- bis 6-fachen der empfohlenen Gesamttagesdosis für den Menschen, bezogen auf die Körperoberfläche. In zwei Studien an Ratten wurde keine Teratologie beobachtet, wenn 512 mg/kg Sulfamethoxazol in Kombination mit 128 mg/kg Trimethoprim angewendet wurden. In einigen Kaninchenstudien war eine Gesamtzunahme des fötalen Verlusts (tote und resorbierte Empfängnis) mit Trimethoprim-Dosen verbunden, die das 6-Fache der therapeutischen Humandosis bezogen auf die Körperoberfläche betrugen.
Stillzeit
Zusammenfassung der Risiken
Die Konzentration von BACTRIM in der Muttermilch beträgt etwa 2 bis 5 % der empfohlenen Tagesdosis für pädiatrische Patienten über zwei Monate. Es liegen keine Informationen über die Wirkung von BACTRIM auf den gestillten Säugling oder die Wirkung auf die Milchproduktion vor. Aufgrund des potenziellen Risikos einer Bilirubinverdrängung und Kernikterus beim gestillten Kind [siehe KONTRAINDIKATIONEN raten Frauen, während der Behandlung mit BACTRIM nicht zu stillen.
Pädiatrische Verwendung
BACTRIM ist bei pädiatrischen Patienten unter zwei Monaten wegen des potenziellen Risikos einer Bilirubinverdrängung und Kernikterus kontraindiziert [siehe KONTRAINDIKATIONEN ].
Schwerwiegende Nebenwirkungen, einschließlich tödlicher Reaktionen und des „Gasping-Syndroms“, traten bei Frühgeborenen und Säuglingen mit niedrigem Geburtsgewicht auf der Neugeborenen-Intensivstation auf, die Benzylalkohol als Konservierungsmittel in Infusionslösungen erhielten. In diesen Fällen führten Benzylalkohol-Dosierungen von 99 bis 234 mg/kg/Tag zu hohen Konzentrationen von Benzylalkohol und seinen Metaboliten im Blut und Urin (Blutspiegel von Benzylalkohol betrugen 0,61 bis 1,378 mmol/l). Weitere Nebenwirkungen waren eine allmähliche neurologische Verschlechterung, Krampfanfälle, intrakranielle Blutungen, hämatologische Anomalien, Hautschäden, Leber- und Nierenversagen, Hypotonie, Bradykardie und kardiovaskulärer Kollaps. Frühgeborene mit niedrigem Geburtsgewicht können diese Reaktionen eher entwickeln, da sie möglicherweise weniger in der Lage sind, Benzylalkohol zu metabolisieren.
Wenn Sie pädiatrischen Patienten BACTRIM 800 mg verschreiben, berücksichtigen Sie die kombinierte tägliche metabolische Belastung von Benzylalkohol aus allen Quellen, einschließlich BACTRIM (BACTRIM 160 mg enthält 10 mg Benzylalkohol pro ml) und anderen Arzneimitteln, die Benzylalkohol enthalten. Die Mindestmenge an Benzylalkohol, bei der schwerwiegende Nebenwirkungen auftreten können, ist nicht bekannt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Geriatrische Verwendung
Klinische Studien mit BACTRIM schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden.
Bei älteren Patienten kann ein erhöhtes Risiko schwerer Nebenwirkungen bestehen, insbesondere wenn komplizierende Erkrankungen vorliegen, z. B. eingeschränkte Nieren- und/oder Leberfunktion oder gleichzeitige Anwendung anderer Arzneimittel. Schwere Hautreaktionen, generalisierte Knochenmarkdepression [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN , NEBENWIRKUNGEN ], eine spezifische Abnahme der Blutplättchen (mit oder ohne Purpura) und Hyperkaliämie sind die am häufigsten berichteten schweren Nebenwirkungen bei älteren Patienten.
Bei Patienten, die gleichzeitig bestimmte Diuretika, hauptsächlich Thiazide, erhalten, wurde über eine erhöhte Inzidenz von Thrombozytopenie mit Purpura berichtet. Erhöhte Digoxin-Blutspiegel können bei gleichzeitiger Behandlung mit BACTRIM 80 mg auftreten, insbesondere bei älteren Patienten. Die Digoxinspiegel im Serum sollten überwacht werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Bei älteren Patienten können hämatologische Veränderungen auftreten, die auf einen Folsäuremangel hindeuten. Diese Wirkungen sind durch eine Folinsäuretherapie reversibel. Bei Patienten mit eingeschränkter Nierenfunktion sollten angemessene Dosisanpassungen vorgenommen werden und die Anwendungsdauer sollte so kurz wie möglich sein, um das Risiko unerwünschter Reaktionen zu minimieren [siehe DOSIERUNG UND ANWENDUNG ].
Die Trimethoprim-Komponente von BACTRIM kann eine Hyperkaliämie verursachen, wenn sie Patienten mit zugrunde liegenden Störungen des Kaliumstoffwechsels oder mit Niereninsuffizienz verabreicht wird oder wenn sie gleichzeitig mit Arzneimitteln verabreicht wird, die bekanntermaßen eine Hyperkaliämie induzieren, wie z. B. Angiotensin-Converting-Enzym-Hemmern. Bei diesen Patienten ist eine engmaschige Überwachung des Serumkaliumspiegels erforderlich. Es wird empfohlen, die Behandlung mit BACTRIM 160 mg abzubrechen, um den Kaliumspiegel im Serum zu senken.
Die pharmakokinetischen Parameter für Sulfamethoxazol waren bei geriatrischen Probanden und jüngeren erwachsenen Probanden ähnlich. Die mittlere maximale Trimethoprim-Serumkonzentration war höher und die mittlere renale Clearance von Trimethoprim war niedriger bei geriatrischen Probanden im Vergleich zu jüngeren Probanden [siehe KLINISCHE PHARMAKOLOGIE ].
VERWEISE
4. Safrin S., Lee BL, Sande MA. Die Kombination von Folinsäure und Trimethoprim-Sulfamethoxazol bei Pneumocystis-carinii-Pneumonie bei AIDS-Patienten ist mit einem erhöhten Risiko für Therapieversagen und Tod verbunden. J Infektionsdis. Okt. 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimethoprim/Sulfamethoxazol bei der Behandlung von Bakteriurie bei Frauen. J Infektionsdis. Nov. 1973;128 (Ergänzung): S657-S663.
ÜBERDOSIS
Akut
Da keine umfassenden Erfahrungen beim Menschen mit Einzeldosen von BACTRIM 160 mg über 25 ml (400 mg Trimethoprim und 2000 mg Sulfamethoxazol) vorliegen, ist die maximal verträgliche Dosis beim Menschen nicht bekannt.
Anzeichen und Symptome einer Überdosierung, die bei Sulfonamiden berichtet wurden, umfassen Anorexie, Koliken, Übelkeit, Erbrechen, Schwindel, Kopfschmerzen, Schläfrigkeit und Bewusstlosigkeit. Pyrexie, Hämaturie und Kristallurie können festgestellt werden. Blutveränderungen und Gelbsucht sind mögliche Späterscheinungen einer Überdosierung.
Anzeichen einer akuten Überdosierung mit Trimethoprim sind Übelkeit, Erbrechen, Schwindel, Kopfschmerzen, Depression, Verwirrtheit und Knochenmarkdepression.
Zu den allgemeinen Behandlungsprinzipien gehört die Verabreichung von intravenösen Flüssigkeiten, wenn die Urinausscheidung gering und die Nierenfunktion normal ist. Eine Ansäuerung des Urins erhöht die renale Elimination von Trimethoprim. Der Patient sollte anhand von Blutbildern und geeigneten Blutwerten, einschließlich Elektrolyten, überwacht werden. Wenn eine signifikante Blutdyskrasie oder Gelbsucht auftritt, sollte eine spezifische Therapie für diese Komplikationen eingeleitet werden. Die Peritonealdialyse ist nicht wirksam und die Hämodialyse ist nur mäßig wirksam bei der Eliminierung von Trimethoprim und Sulfamethoxazol.
Chronisch
Die Anwendung von BACTRIM 800 mg in hohen Dosen und/oder über einen längeren Zeitraum kann eine Knochenmarkdepression verursachen, die sich als Thrombozytopenie, Leukopenie und/oder megaloblastische Anämie manifestiert. Wenn Anzeichen einer Knochenmarksdepression auftreten, sollte der Patient täglich 5 bis 15 mg Leucovorin erhalten, bis die normale Hämatopoese wiederhergestellt ist.
KONTRAINDIKATIONEN
BACTRIM ist kontraindiziert bei:
VERWEISE
2. Al-Khatib SM, LaPointe N., Kramer JM, Califf RM. Was Ärzte über das QT-Intervall wissen sollten. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Storch C, Wang RY. Review: Die Pharmakologie und Toxikologie von Dofetilid. Int J Med Toxicol. 2001;4(2):16.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
BACTRIM ist ein antimikrobielles Arzneimittel [siehe Mikrobiologie ].
Pharmakokinetik
Nach einer einstündigen intravenösen Infusion einer Einzeldosis von 160 mg Trimethoprim und 800 mg Sulfamethoxazol an 11 Patienten mit einem Gewicht zwischen 105 lbs und 165 lbs (Mittelwert 143 lbs) betrugen die maximalen Plasmakonzentrationen von Trimethoprim und Sulfamethoxazol 3,4 ± 0,3 μg/ml bzw. 46,3 ± 2,7 μg/ml. Nach wiederholter intravenöser Verabreichung derselben Dosis in 8-Stunden-Intervallen betrugen die mittleren Plasmakonzentrationen kurz vor und unmittelbar nach jeder Infusion im Steady State 5,6 ± 0,6 μg/ml und 8,8 ± 0,9 μg/ml für Trimethoprim und 70,6 ± 7,3 μg /ml und 105,6 ± 10,9 μg/ml für Sulfamethoxazol. Die mittlere Plasmahalbwertszeit betrug 11,3 ± 0,7 Stunden für Trimethoprim und 12,8 ± 1,8 Stunden für Sulfamethoxazol. Alle diese 11 Patienten hatten eine normale Nierenfunktion und ihr Alter lag zwischen 17 und 78 Jahren (Median 60 Jahre).11
Pharmakokinetische Studien bei Kindern und Erwachsenen weisen auf eine altersabhängige Halbwertszeit von Trimethoprim hin, wie in Tabelle 5.12 angegeben
Patienten mit stark eingeschränkter Nierenfunktion weisen eine Verlängerung der Halbwertszeit beider Komponenten auf, was eine Anpassung des Dosierungsschemas erfordert [siehe DOSIERUNG UND ANWENDUNG ].
Verteilung
Sowohl Trimethoprim als auch Sulfamethoxazol liegen im Blut in ungebundener, proteingebundener und metabolisierter Form vor; Sulfamethoxazol existiert auch als konjugierte Form.
Ungefähr 44 % von Trimethoprim und 70 % von Sulfamethoxazol werden an Plasmaproteine gebunden. Das Vorhandensein von 10 mg Prozent Sulfamethoxazol im Plasma verringert die Proteinbindung von Trimethoprim um einen unbedeutenden Grad; Trimethoprim beeinflusst die Proteinbindung von Sulfamethoxazol nicht.
Sowohl Trimethoprim als auch Sulfamethoxazol verteilen sich im Sputum und in der Scheidenflüssigkeit; Trimethoprim verteilt sich auch auf Bronchialsekrete, und beide passieren die Plazentaschranke und werden in die Muttermilch ausgeschieden.
Beseitigung
Stoffwechsel
Sulfamethoxazol wird beim Menschen zu mindestens 5 Metaboliten metabolisiert: den N4-Acetyl-, N4-Hydroxy-, 5-Methylhydroxy-, N4-Acetyl-5-methylhydroxy-Sulfamethoxazol-Metaboliten und einem N-Glucuronid-Konjugat. Die Bildung des N4-Hydroxy-Metaboliten wird über CYP2C9 vermittelt.
Trimethoprim wird in vitro zu 11 verschiedenen Metaboliten metabolisiert, von denen fünf Glutathion-Addukte und sechs oxidative Metaboliten sind, darunter die Hauptmetaboliten, 1- und 3-Oxide und die 3- und 4-Hydroxy-Derivate.
Als therapeutisch wirksame Formen gelten die freien Formen von Trimethoprim und Sulfamethoxazol. In-vitro-Studien deuten darauf hin, dass Trimethoprim ein Substrat von P-Glykoprotein, OCT1 und OCT2 ist und dass Sulfamethoxazol kein Substrat von P-Glykoprotein ist.
Ausscheidung
Die Ausscheidung von Trimethoprim und Sulfamethoxazol erfolgt hauptsächlich über die Nieren sowohl durch glomeruläre Filtration als auch durch tubuläre Sekretion. Die Urinkonzentrationen sowohl von Trimethoprim als auch von Sulfamethoxazol sind erheblich höher als die Konzentrationen im Blut. Der Prozentsatz der Dosis, der über einen Zeitraum von 12 Stunden nach der intravenösen Verabreichung der ersten Dosis von 240 mg Trimethoprim und 1200 mg Sulfamethoxazol an Tag 1 im Urin ausgeschieden wurde, reichte von 17 % bis 42,4 % als freies Trimethoprim; 7 % bis 12,7 % als freies Sulfamethoxazol; und 36,7 % bis 56 % als Gesamt (freies plus N4-acetylierter Metabolit) Sulfamethoxazol. Bei gemeinsamer Verabreichung als BACTRIM 400 mg beeinflussen weder Trimethoprim noch Sulfamethoxazol das Harnausscheidungsmuster des anderen.
Spezifische Populationen
Geriatrische Patienten
Die Pharmakokinetik von Sulfamethoxazol 800 mg und Trimethoprim 160 mg wurde bei sechs geriatrischen Probanden (Durchschnittsalter: 78,6 Jahre) und sechs jungen gesunden Probanden (Durchschnittsalter: 29,3 Jahre) unter Verwendung einer nicht in den USA zugelassenen Formulierung untersucht. Die pharmakokinetischen Werte für Sulfamethoxazol bei geriatrischen Probanden waren ähnlich denen, die bei jungen erwachsenen Probanden beobachtet wurden. Die mittlere renale Clearance von Trimethoprim war bei geriatrischen Probanden im Vergleich zu jungen erwachsenen Probanden signifikant niedriger (19 ml/h/kg vs. 55 ml/h/kg). Nach Normalisierung des Körpergewichts war die scheinbare Gesamtkörperclearance von Trimethoprim jedoch bei geriatrischen Probanden um durchschnittlich 19 % niedriger als bei jungen Erwachsenen.
Mikrobiologie
Wirkmechanismus
Sulfamethoxazol hemmt die bakterielle Synthese von Dihydrofolsäure, indem es mit para-Aminobenzoesäure (PABA) konkurriert. Trimethoprim blockiert die Produktion von Tetrahydrofolsäure aus Dihydrofolsäure, indem es an das erforderliche Enzym Dihydrofolatreduktase bindet und es reversibel hemmt. Somit blockieren Sulfamethoxazol und Trimethoprim zwei aufeinanderfolgende Schritte in der Biosynthese von Nukleinsäuren und Proteinen, die für viele Bakterien essentiell sind.
Widerstand
In-vitro-Studien haben gezeigt, dass sich eine bakterielle Resistenz sowohl mit Sulfamethoxazol als auch mit Trimethoprim in Kombination langsamer entwickelt als mit Sulfamethoxazol oder Trimethoprim allein.
Antimikrobielle Aktivität
Es wurde gezeigt, dass BACTRIM gegen die meisten Isolate der folgenden Mikroorganismen aktiv ist, sowohl in vitro als auch bei klinischen Infektionen [vgl INDIKATIONEN UND VERWENDUNG ].
Aerobe gramnegative Bakterien
Escherichia coliKlebsiella-SpeziesEnterobacter-SpeziesMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Andere Mikroorganismen
Pneumocystis jirovecii
Die folgenden In-vitro-Daten sind verfügbar, ihre klinische Bedeutung ist jedoch nicht bekannt. Mindestens 90 Prozent der folgenden Bakterien weisen eine minimale In-vitro-Hemmkonzentration (MHK) auf, die kleiner oder gleich dem Empfindlichkeitsgrenzwert für BACTRIM 160 mg gegenüber Isolaten ähnlicher Gattungen oder Organismengruppen ist. Die Wirksamkeit von BACTRIM 400 mg bei der Behandlung klinischer Infektionen, die durch diese Bakterien verursacht werden, wurde jedoch nicht in angemessenen und gut kontrollierten klinischen Studien nachgewiesen.
Aerobe grampositive Bakterien
Streptococcus pneumoniae
Aerobe gramnegative Bakterien
Hämophilus influenzae
Empfindlichkeitsprüfung
Spezifische Informationen zu den Interpretationskriterien von Empfindlichkeitstests und den zugehörigen Testmethoden und Qualitätskontrollstandards, die von der FDA für dieses Medikament anerkannt sind, finden Sie unter https://www.fda.gov/STIC.
VERWEISE
11. Grose WE, Bodey GP, Loo TL. Klinische Pharmakologie von intravenös verabreichtem Trimethoprim-Sulfamethoxazol. Antimikrobielle Mittel Chemother. März 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Pharmakologie von intravenösem Trimethoprim-Sulfamethoxazol bei Kindern und Erwachsenen. Aktuelle Chemotherapie und Infektionskrankheiten. Amerikanische Gesellschaft für Mikrobiologie, Washington, DC 1980; Vol. 1, S. 691-692.
INFORMATIONEN ZUM PATIENTEN
Embryo-fetale Toxizität
Weisen Sie gebärfähige Patientinnen darauf hin, dass BACTRIM den Fötus schädigen kann, und informieren Sie ihren Arzt über eine bekannte oder vermutete Schwangerschaft [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Stillzeit
Raten Sie stillenden Frauen, das Stillen während der Behandlung mit BACTRIM zu vermeiden.
Antibakterielle Resistenz
Weisen Sie die Patienten darauf hin, dass antibakterielle Arzneimittel, einschließlich BACTRIM, nur zur Behandlung bakterieller Infektionen eingesetzt werden sollten. Es behandelt keine Virusinfektionen (z. B. Erkältung).
Weisen Sie die Patienten an, eine ausreichende Flüssigkeitszufuhr aufrechtzuerhalten, um Kristallurie und Steinbildung zu vermeiden.
Durchfall
Weisen Sie die Patienten darauf hin, dass Durchfall ein häufiges Problem ist, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) sogar noch zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums entwickeln. In diesem Fall sollten die Patienten so schnell wie möglich ihren Arzt kontaktieren.