Feldene 10mg, 20mg Piroxicam Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Feldene 20 mg und wie wird es angewendet?
Piroxicam ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Schmerzen oder Entzündungen bei rheumatoider Arthritis (einschließlich juveniler Arthritis) oder Osteoarthritis. Piroxicam kann allein oder mit anderen Medikamenten verwendet werden.
Piroxicam ist ein nichtsteroidales Antirheumatikum (NSAID).
Es ist nicht bekannt, ob Piroxicam bei Kindern unter 12 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Feldene haben?
Feldene 10 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Feldene sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Feldene. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
RISIKO SCHWERER KARDIOVASKULÄRER UND GASTROINTESTINALER EREIGNISSE
Kardiovaskuläre thrombotische Ereignisse
Magen-Darm-Blutungen, Ulzerationen und Perforationen
BEZEICHNUNG
FELDENE (Piroxicam)-Kapsel ist ein nichtsteroidales entzündungshemmendes Arzneimittel, das als kastanienbraune und blaue #322 10-mg-Kapseln und kastanienbraune #323 20-mg-Kapseln zur oralen Verabreichung erhältlich ist. Der chemische Name lautet 4-Hydroxyl-2-Methyl-N-2-Pyridinyl-2H-1,2-Benzothiazin-3-Carboxamid-1,1-Dioxid. Das Molekulargewicht beträgt 331,35. Seine Summenformel ist C15H13N3O4S und es hat die folgende chemische Struktur.
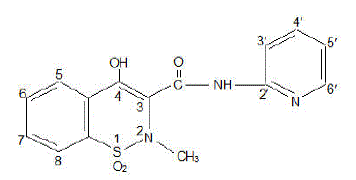
Piroxicam tritt als weißer kristalliner Feststoff auf, der in Wasser, verdünnter Säure und den meisten organischen Lösungsmitteln schwer löslich ist. Es ist leicht löslich in Alkohol und in wässrigen Lösungen. Es weist ein schwach saures 4-Hydroxy-Proton (pKa 5,1) und einen schwach basischen Pyridyl-Stickstoff (pKa 1,8) auf.
Zu den inaktiven Inhaltsstoffen in FELDENE 10 mg gehören: Blue 1, Red 3, Lactose, Magnesiumstearat, Natriumlaurylsulfat, Stärke.
INDIKATIONEN
FELDENE ist angegeben:
DOSIERUNG UND ANWENDUNG
Wägen Sie die potenziellen Vorteile und Risiken von FELDENE 20 mg und anderen Behandlungsoptionen sorgfältig ab, bevor Sie sich für die Anwendung von FELDENE entscheiden. Verwenden Sie die niedrigste wirksame Dosis für die kürzeste Dauer im Einklang mit den individuellen Behandlungszielen des Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nachdem das Ansprechen auf die Initialtherapie mit FELDENE 20 mg beobachtet wurde, sollten Dosis und Häufigkeit an die individuellen Bedürfnisse des Patienten angepasst werden.
Zur Linderung von rheumatoider Arthritis und Osteoarthritis beträgt die Dosierung 20 mg einmal täglich oral. Falls gewünscht, kann die Tagesdosis geteilt werden. Aufgrund der langen Halbwertszeit von FELDENE werden Steady-State-Blutspiegel erst nach 7–12 Tagen erreicht. Obwohl die therapeutischen Wirkungen von FELDENE zu Beginn der Behandlung offensichtlich sind, kommt es daher über mehrere Wochen zu einer progressiven Zunahme des Ansprechens, und die Wirkung der Therapie sollte zwei Wochen lang nicht beurteilt werden.
WIE GELIEFERT
Darreichungsformen und Stärken
FELDENE (Piroxicam) Kapseln
10 mg kastanienbraun und blau Nr. 322 20 mg kastanienbraun Nr. 323
Lagerung und Handhabung
FELDENE® (Piroxicam) 10 mg Kapseln sind kastanienbraun und blau #322, geliefert als:
FELDENE® (Piroxicam) 20 mg Kapseln sind kastanienbraun #323, geliefert als:
Lagerung
Bei Raumtemperatur 20°C bis 25°C (68°F bis 77°F) lagern; Abweichungen zwischen 15 °C und 30 °C (59 °F bis 86 °F) zulässig [siehe USP Controlled Room Temperature].
Vertrieb durch: Pfizer Labs, Division of Pfizer Inc., 235 East 42nd Street, New York, NY 10017. Überarbeitet: April 2017.
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Bei Patienten, die FELDENE 10 mg oder andere NSAIDs einnehmen, sind die am häufigsten berichteten Nebenwirkungen, die bei etwa 1–10 % der Patienten auftraten:
Herz-Kreislauf-System: Ödem
Verdauungstrakt: Anorexie, Bauchschmerzen, Verstopfung, Durchfall, Blähungen, Übelkeit, Erbrechen
Nervöses System : Schwindel, Kopfschmerzen, Schwindel
Haut und Anhängsel: Juckreiz, Hautausschlag
Besondere Sinne: Tinnitus
Weitere gelegentlich berichtete Nebenwirkungen sind:
Herz-Kreislauf-System: Herzklopfen
Verdauungstrakt: Stomatitis
Nervöses System: Schläfrigkeit
Besondere Sinne: Verschwommene Sicht
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von FELDENE nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Körper als Ganzes: Fieber, Infektion, Sepsis, anaphylaktische Reaktionen, Appetitveränderungen, Tod, grippeähnliches Syndrom, Schmerzen (Koliken), Serumkrankheit
Herz-Kreislauf-System: Herzinsuffizienz, Bluthochdruck, Tachykardie, Synkope, Arrhythmie, Exazerbation von Angina pectoris, Hypotonie, Myokardinfarkt, Vaskulitis
Verdauungstrakt: Dyspepsie, erhöhte Leberenzymwerte, starke Blutung/Perforation, Sodbrennen, Geschwüre (Magen/Zwölffingerdarm), Mundtrockenheit, Ösophagitis, Gastritis, Glossitis, Hämatemesis, Hepatitis, Gelbsucht, Meläna, rektale Blutung, Aufstoßen, Leberversagen, Pankreatitis
Hämisches und lymphatisches System: Anämie, erhöhte Blutungszeit, e Cchymose, Eosinophilie, Nasenbluten, Leukopenie, Purpura, Petechienausschlag, Thrombozytopenie, Agranulozytose, hämolytische Anämie, aplastische Anämie, Lymphadenopathie, Panzytopenie
Überempfindlichkeit: Positiver ANA
Stoffwechsel und Ernährung: Gewichtsveränderungen, Flüssigkeitsretention, Hyperglykämie, Hypoglykämie
Nervöses System: Angst, Asthenie, Verwirrung, Depression, Traumanomalien, Schlaflosigkeit, Unwohlsein, Nervosität, Parästhesien, Somnolenz, Zittern, Akathisie, Krämpfe, Koma, Halluzinationen, Meningitis, Stimmungsschwankungen
Atmungssystem: Asthma, Dyspnoe, Atemdepression, Lungenentzündung
Haut und Anhängsel: Alopezie, Blutergüsse, Schuppung, Erythem, Lichtempfindlichkeit, Schweiß, Angioödem, toxische epidermale Nekrose, Erythema multiforme, exfoliative Dermatitis, Onycholyse, Stevens-Johnson-Syndrom, Urtikaria, vesikulobullöse Reaktion
Besondere Sinne: Bindehautentzündung, Schwerhörigkeit, geschwollene Augen
Urogenitalsystem: Abnorme Nierenfunktion, c Ystitis, Dysurie, Hämaturie, Hyperkaliämie, interstitielle Nephritis, nephrotisches Syndrom, Oligurie/Polyurie, Proteinurie, Nierenversagen, Glomerulonephritis
Störungen des Fortpflanzungssystems und der Brust: Die weibliche Fruchtbarkeit nahm ab
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Siehe Tabelle 1 für klinisch signifikante Arzneimittelwechselwirkungen mit Piroxicam.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Kardiovaskuläre thrombotische Ereignisse
Klinische Studien mit mehreren COX-2-selektiven und nicht-selektiven NSAIDs mit einer Dauer von bis zu drei Jahren haben ein erhöhtes Risiko für schwerwiegende kardiovaskuläre (CV) thrombotische Ereignisse, einschließlich Myokardinfarkt (MI) und Schlaganfall, die tödlich sein können, gezeigt. Basierend auf den verfügbaren Daten ist unklar, ob das Risiko für kardiovaskuläre thrombotische Ereignisse bei allen NSAIDs ähnlich ist. Der relative Anstieg schwerer kardiovaskulärer thrombotischer Ereignisse gegenüber dem Ausgangswert, der durch die Verwendung von NSAIDs hervorgerufen wird, scheint bei Patienten mit und ohne bekannte kardiovaskuläre Erkrankung oder Risikofaktoren für kardiovaskuläre Erkrankungen ähnlich zu sein. Allerdings hatten Patienten mit bekannter kardiovaskulärer Erkrankung oder Risikofaktoren aufgrund ihrer erhöhten Baseline-Rate eine höhere absolute Inzidenz von übermäßigen schwerwiegenden kardiovaskulären thrombotischen Ereignissen. Einige Beobachtungsstudien ergaben, dass dieses erhöhte Risiko für schwerwiegende kardiovaskuläre thrombotische Ereignisse bereits in den ersten Behandlungswochen einsetzte. Der Anstieg des kardiovaskulären Thromboserisikos wurde am konsistentesten bei höheren Dosen beobachtet.
Um das potenzielle Risiko eines unerwünschten kardiovaskulären Ereignisses bei NSAID-behandelten Patienten zu minimieren, verwenden Sie die niedrigste wirksame Dosis für die kürzestmögliche Dauer. Ärzte und Patienten sollten während des gesamten Behandlungsverlaufs auf die Entwicklung solcher Ereignisse achten, auch wenn zuvor keine kardiovaskulären Symptome aufgetreten sind. Die Patienten sollten über die Symptome schwerwiegender kardiovaskulärer Ereignisse und die zu ergreifenden Maßnahmen informiert werden, wenn sie auftreten.
Es gibt keine konsistenten Beweise dafür, dass die gleichzeitige Anwendung von Aspirin das erhöhte Risiko schwerer kardiovaskulärer thrombotischer Ereignisse im Zusammenhang mit der Anwendung von NSAR mindert. Die gleichzeitige Anwendung von Aspirin und einem NSAID wie Piroxicam erhöht das Risiko schwerwiegender gastrointestinaler (GI) Ereignisse [siehe Magen-Darm-Blutungen, Ulzerationen und Perforationen ].
Status nach Koronararterien-Bypass-Operation (CABG).
Zwei große, kontrollierte klinische Studien mit einem COX-2-selektiven NSAID zur Behandlung von Schmerzen in den ersten 10–14 Tagen nach einer CABG-Operation ergaben eine erhöhte Inzidenz von Myokardinfarkt und Schlaganfall. NSAIDs sind bei CABG kontraindiziert [vgl KONTRAINDIKATIONEN ].
Post-MI-Patienten
Beobachtungsstudien, die im dänischen Nationalregister durchgeführt wurden, haben gezeigt, dass Patienten, die mit NSAIDs in der Zeit nach einem Myokardinfarkt behandelt wurden, ab der ersten Behandlungswoche ein erhöhtes Risiko für einen Reinfarkt, einen kardiovaskulären Tod und eine Gesamtmortalität hatten. In derselben Kohorte betrug die Inzidenz von Todesfällen im ersten Jahr nach MI 20 pro 100 Personenjahre bei NSAID-behandelten Patienten im Vergleich zu 12 pro 100 Personenjahre bei nicht-NSAID-exponierten Patienten. Obwohl die absolute Todesrate nach dem ersten Jahr nach dem Myokardinfarkt etwas zurückging, blieb das erhöhte relative Todesrisiko bei NSAID-Anwendern mindestens über die nächsten vier Jahre der Nachbeobachtung bestehen.
Vermeiden Sie die Anwendung von FELDENE 10 mg bei Patienten mit kürzlich aufgetretenem MI, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko wiederkehrender kardiovaskulärer thrombotischer Ereignisse. Wenn FELDENE bei Patienten mit kürzlich aufgetretenem MI angewendet wird, sind die Patienten auf Anzeichen einer kardialen Ischämie zu überwachen.
Magen-Darm-Blutungen, Ulzerationen und Perforationen
NSAIDs, einschließlich FELDENE, verursachen schwerwiegende gastrointestinale (GI) unerwünschte Ereignisse, einschließlich Entzündungen, Blutungen, Geschwürbildung und Perforation der Speiseröhre, des Magens, des Dünndarms oder des Dickdarms, die tödlich sein können. Diese schwerwiegenden unerwünschten Ereignisse können jederzeit mit oder ohne Warnsymptome bei Patienten auftreten, die mit NSAIDs behandelt werden. Nur jeder fünfte Patient, der unter NSAID-Therapie ein schwerwiegendes unerwünschtes Ereignis im oberen Gastrointestinaltrakt entwickelt, ist symptomatisch. Geschwüre im oberen Gastrointestinaltrakt, starke Blutungen oder Perforationen, die durch NSAIDs verursacht wurden, traten bei ungefähr 1 % der Patienten auf, die 3–6 Monate behandelt wurden, und bei ungefähr 2 %–4 % der Patienten, die ein Jahr behandelt wurden. Allerdings ist auch eine kurzzeitige NSAID-Therapie nicht ohne Risiko.
Risikofaktoren für GI-Blutungen, Ulzerationen und Perforationen
Patienten mit Magengeschwüren und/oder gastrointestinalen Blutungen in der Vorgeschichte, die NSAR einnahmen, hatten ein mehr als 10-fach erhöhtes Risiko für die Entwicklung einer gastrointestinalen Blutung im Vergleich zu Patienten ohne diese Risikofaktoren. Andere Faktoren, die das Risiko von GI-Blutungen bei mit NSAIDs behandelten Patienten erhöhen, umfassen eine längere Dauer der NSAID-Therapie; gleichzeitige Anwendung von oralen Kortikosteroiden, Aspirin, Antikoagulanzien oder selektiven Serotonin-Wiederaufnahmehemmern (SSRIs); Rauchen; Alkoholkonsum; älteres Alter; und schlechter allgemeiner Gesundheitszustand. Die meisten Postmarketing-Berichte über tödliche gastrointestinale Ereignisse traten bei älteren oder geschwächten Patienten auf. Darüber hinaus besteht bei Patienten mit fortgeschrittener Lebererkrankung und/oder Koagulopathie ein erhöhtes Risiko für gastrointestinale Blutungen.
Strategien zur Minimierung der GI-Risiken bei NSAID-behandelten Patienten
Hepatotoxizität
Erhöhungen von ALT oder AST (mindestens das Dreifache der oberen Normgrenze [ULN]) wurden in klinischen Studien bei etwa 1 % der mit NSAR behandelten Patienten berichtet. Darüber hinaus wurden seltene, manchmal tödliche Fälle von schwerer Leberschädigung, einschließlich fulminanter Hepatitis, Lebernekrose und Leberversagen, berichtet.
Erhöhungen von ALT oder AST (weniger als das Dreifache des ULN) können bei bis zu 15 % der mit NSAIDs einschließlich Piroxicam behandelten Patienten auftreten.
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Durchfall, Juckreiz, Gelbsucht, Empfindlichkeit im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn sich klinische Anzeichen und Symptome einer Lebererkrankung entwickeln oder wenn systemische Manifestationen auftreten (z. B. Eosinophilie, Hautausschlag usw.), setzen Sie FELDENE sofort ab und führen Sie eine klinische Untersuchung des Patienten durch.
Hypertonie
NSAIDs, einschließlich FELDENE, können zu einem erneuten Auftreten von Bluthochdruck oder einer Verschlechterung eines vorbestehenden Bluthochdrucks führen, die beide zu einer erhöhten Inzidenz von kardiovaskulären Ereignissen beitragen können. Patienten, die Angiotensin-Converting-Enzyme (ACE)-Hemmer, Thiaziddiuretika oder Schleifendiuretika einnehmen, können bei der Einnahme von NSAIDs ein beeinträchtigtes Ansprechen auf diese Therapien haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Überwachen Sie den Blutdruck (BP) zu Beginn der NSAID-Behandlung und während des gesamten Therapieverlaufs.
Herzinsuffizienz und Ödem
Die Coxib and Traditional NSAID Trialists' Collaboration Meta-Analyse randomisierter kontrollierter Studien zeigte eine ungefähr zweifache Zunahme der Krankenhauseinweisungen wegen Herzinsuffizienz bei COX-2-selektiv behandelten Patienten und nicht-selektiv NSAID-behandelten Patienten im Vergleich zu Placebo-behandelten Patienten. In einer Studie des Dänischen Nationalen Registers bei Patienten mit Herzinsuffizienz erhöhte die Verwendung von NSAID das Risiko für Herzinfarkt, Krankenhauseinweisung wegen Herzinsuffizienz und Tod.
Darüber hinaus wurden bei einigen Patienten, die mit NSAIDs behandelt wurden, Flüssigkeitsretention und Ödeme beobachtet. Die Anwendung von Piroxicam kann die kardiovaskulären Wirkungen mehrerer Therapeutika abschwächen, die zur Behandlung dieser Erkrankungen eingesetzt werden (z. B. Diuretika, ACE-Hemmer oder Angiotensin-Rezeptorblocker [ARBs]) [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Vermeiden Sie die Anwendung von FELDENE 10 mg bei Patienten mit schwerer Herzinsuffizienz, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Herzinsuffizienz. Wenn FELDENE bei Patienten mit schwerer Herzinsuffizienz angewendet wird, überwachen Sie die Patienten auf Anzeichen einer Verschlechterung der Herzinsuffizienz.
Nierentoxizität und Hyperkaliämie
Nierentoxizität
Die langfristige Verabreichung von NSAIDs hat zu Nierenpapillennekrose und anderen Nierenschäden geführt.
Nierentoxizität wurde auch bei Patienten beobachtet, bei denen renale Prostaglandine eine kompensatorische Rolle bei der Aufrechterhaltung der Nierendurchblutung spielen. Bei diesen Patienten kann die Verabreichung eines NSAID eine dosisabhängige Verringerung der Prostaglandinbildung und sekundär des renalen Blutflusses verursachen, was eine offenkundige Nierendekompensation auslösen kann. Patienten mit dem größten Risiko für diese Reaktion sind Patienten mit eingeschränkter Nierenfunktion, Dehydratation, Hypovolämie, Herzinsuffizienz, Leberfunktionsstörungen, Patienten, die Diuretika und ACE-Hemmer oder ARBs einnehmen, sowie ältere Menschen. Auf das Absetzen der NSAID-Therapie folgt normalerweise die Wiederherstellung des Zustands vor der Behandlung.
Es liegen keine Informationen aus kontrollierten klinischen Studien zur Anwendung von FELDENE 20 mg bei Patienten mit fortgeschrittener Nierenerkrankung vor. Die renale Wirkung von FELDENE 20 mg kann das Fortschreiten der Nierenfunktionsstörung bei Patienten mit vorbestehender Nierenerkrankung beschleunigen.
Korrigieren Sie den Volumenstatus bei dehydrierten oder hypovolämischen Patienten vor Beginn der Behandlung mit FELDENE. Überwachen Sie die Nierenfunktion bei Patienten mit eingeschränkter Nieren- oder Leberfunktion, Herzinsuffizienz, Dehydration oder Hypovolämie während der Anwendung von FELDENE [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Vermeiden Sie die Anwendung von FELDENE bei Patienten mit fortgeschrittener Nierenerkrankung, es sei denn, der Nutzen überwiegt voraussichtlich das Risiko einer Verschlechterung der Nierenfunktion. Wenn FELDENE bei Patienten mit fortgeschrittener Nierenerkrankung angewendet wird, sind die Patienten auf Anzeichen einer Verschlechterung der Nierenfunktion zu überwachen.
Hyperkaliämie
Bei der Anwendung von NSAIDs wurde sogar bei einigen Patienten ohne Nierenfunktionsstörung über Anstiege der Serumkaliumkonzentration, einschließlich Hyperkaliämie, berichtet. Bei Patienten mit normaler Nierenfunktion wurden diese Wirkungen einem hyporeninämischen Hypoaldosteronismus-Zustand zugeschrieben.
Anaphylaktische Reaktionen
Piroxicam wurde mit anaphylaktischen Reaktionen bei Patienten mit und ohne bekannte Überempfindlichkeit gegen Piroxicam und bei Patienten mit Aspirin-empfindlichem Asthma in Verbindung gebracht [siehe KONTRAINDIKATIONEN und Verschlimmerung von Asthma im Zusammenhang mit Aspirin-Empfindlichkeit ].
Suchen Sie Nothilfe auf, wenn eine anaphylaktische Reaktion auftritt.
Verschlimmerung von Asthma im Zusammenhang mit Aspirin-Empfindlichkeit
Eine Subpopulation von Patienten mit Asthma kann Aspirin-empfindliches Asthma haben, das eine durch Nasenpolypen komplizierte chronische Rhinosinusitis umfassen kann; schwerer, möglicherweise tödlicher Bronchospasmus; und/oder Intoleranz gegenüber Aspirin und anderen NSAIDs. Da bei solchen Aspirin-empfindlichen Patienten über Kreuzreaktivität zwischen Aspirin und anderen NSAIDs berichtet wurde, ist FELDENE 20 mg bei Patienten mit dieser Form der Aspirin-Empfindlichkeit kontraindiziert [siehe KONTRAINDIKATIONEN ]. Wenn FELDENE bei Patienten mit vorbestehendem Asthma (ohne bekannte Aspirin-Empfindlichkeit) angewendet wird, sind die Patienten auf Veränderungen der Anzeichen und Symptome von Asthma zu überwachen.
Schwerwiegende Hautreaktionen
NSAIDs, einschließlich Piroxicam, können schwerwiegende Nebenwirkungen der Haut wie exfoliative Dermatitis, Stevens-Johnson-Syndrom (SJS) und toxische epidermale Nekrolyse (TEN) verursachen, die tödlich sein können. Diese schwerwiegenden Ereignisse können ohne Vorwarnung eintreten. Informieren Sie die Patienten über die Anzeichen und Symptome schwerwiegender Hautreaktionen und brechen Sie die Anwendung von FELDENE 10 mg beim ersten Auftreten von Hautausschlag oder anderen Anzeichen einer Überempfindlichkeit ab. FELDENE 20 mg ist kontraindiziert bei Patienten mit früheren schwerwiegenden Hautreaktionen auf NSAIDs [siehe KONTRAINDIKATIONEN ].
Vorzeitiger Verschluss des fötalen Ductus Arteriosus
Piroxicam kann einen vorzeitigen Verschluss des fetalen Ductus arteriosus verursachen. Vermeiden Sie die Anwendung von NSAIDs, einschließlich FELDENE 20 mg, bei schwangeren Frauen ab der 30. Schwangerschaftswoche (drittes Trimester) [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Hämatologische Toxizität
Anämie ist bei NSAID-behandelten Patienten aufgetreten. Dies kann auf okkulten oder groben Blutverlust, Flüssigkeitsretention oder eine unvollständig beschriebene Wirkung auf die Erythropoese zurückzuführen sein. Wenn bei einem mit FELDENE behandelten Patienten Anzeichen oder Symptome einer Anämie auftreten, sollten Hämoglobin oder Hämatokrit überwacht werden.
NSAIDs, einschließlich FELDENE, können das Risiko von Blutungsereignissen erhöhen. Begleiterkrankungen wie Gerinnungsstörungen, gleichzeitige Anwendung von Warfarin, anderen Antikoagulanzien, Thrombozytenaggregationshemmern (z. B. Aspirin), Serotonin-Wiederaufnahmehemmern (SSRIs) und Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRIs) können dieses Risiko erhöhen. Überwachen Sie diese Patienten auf Anzeichen von Blutungen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Maskierung von Entzündungen und Fieber
Die pharmakologische Aktivität von FELDENE 10 mg bei der Reduzierung von Entzündungen und möglicherweise Fieber kann die Nützlichkeit diagnostischer Zeichen beim Nachweis von Infektionen verringern.
Laborüberwachung
Da schwere Magen-Darm-Blutungen, Hepatotoxizität und Nierenschäden ohne Warnsymptome oder -zeichen auftreten können, erwägen Sie eine regelmäßige Überwachung von Patienten unter NSAID-Langzeitbehandlung mit einem Blutbild und einem chemischen Profil [siehe Magen-Darm-Blutungen, Ulzerationen und Perforationen, Hepatotoxizität, Nierentoxizität und Hyperkaliämie ] .
Ophthalmologische Wirkungen
Aufgrund von Berichten über unerwünschte Augenbefunde mit nichtsteroidalen Antirheumatika wird empfohlen, dass Patienten, die während der Behandlung mit FELDENE Sehbeschwerden entwickeln, augenärztlich untersucht werden.

Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ), die jeder ausgestellten Verschreibung beiliegt. Informieren Sie Patienten, Familien oder ihre Betreuer über die folgenden Informationen, bevor Sie eine Therapie mit FELDENE beginnen, und regelmäßig während der laufenden Therapie.
Kardiovaskuläre thrombotische Ereignisse
Weisen Sie die Patienten an, auf die Symptome kardiovaskulärer thrombotischer Ereignisse, einschließlich Brustschmerzen, Kurzatmigkeit, Schwäche oder undeutliche Sprache, zu achten und jedes dieser Symptome unverzüglich ihrem Arzt zu melden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Magen-Darm-Blutungen, Ulzerationen und Perforationen
Raten Sie den Patienten, Symptome von Ulzerationen und Blutungen, einschließlich Oberbauchschmerzen, Dyspepsie, Meläna und Hämatemesis, ihrem Arzt zu melden. Informieren Sie die Patienten bei gleichzeitiger Anwendung von niedrig dosiertem Aspirin zur Herzprophylaxe über das erhöhte Risiko für und die Anzeichen und Symptome von gastrointestinalen Blutungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hepatotoxizität
Informieren Sie die Patienten über die Warnzeichen und Symptome einer Hepatotoxizität (z. B. Übelkeit, Müdigkeit, Lethargie, Juckreiz, Durchfall, Gelbsucht, Empfindlichkeit im rechten oberen Quadranten und „grippeähnliche“ Symptome). Wenn diese auftreten, weisen Sie die Patienten an, FELDENE abzusetzen und sich unverzüglich medizinisch behandeln zu lassen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Herzinsuffizienz und Ödem
Weisen Sie die Patienten an, auf die Symptome einer dekompensierten Herzinsuffizienz, einschließlich Kurzatmigkeit, unerklärliche Gewichtszunahme oder Ödeme, aufmerksam zu sein und sich an ihren Arzt zu wenden, wenn solche Symptome auftreten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Anaphylaktische Reaktionen
Informieren Sie die Patienten über die Anzeichen einer anaphylaktischen Reaktion (z. B. Atembeschwerden, Schwellungen im Gesicht oder Rachen). Weisen Sie die Patienten an, sofort Nothilfe zu suchen, wenn diese auftreten [siehe KONTRAINDIKATIONEN und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Schwerwiegende Hautreaktionen
Weisen Sie die Patienten an, FELDENE sofort abzusetzen, wenn sie irgendeine Art von Hautausschlag entwickeln, und sich so bald wie möglich an ihren Arzt zu wenden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Weibliche Fruchtbarkeit
Weisen Sie Frauen im gebärfähigen Alter, die eine Schwangerschaft wünschen, darauf hin, dass NSAIDs, einschließlich FELDENE 20 mg, mit einer reversiblen Verzögerung des Eisprungs verbunden sein können [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Fötale Toxizität
Informieren Sie schwangere Frauen, dass sie die Anwendung von FELDENE und anderen NSAIDs ab der 30. Schwangerschaftswoche wegen des Risikos eines vorzeitigen Verschlusses des fetalen Ductus arteriosus vermeiden sollen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Vermeiden Sie die gleichzeitige Anwendung von NSAIDs
Informieren Sie die Patienten darüber, dass die gleichzeitige Anwendung von FELDENE mit anderen NSAIDs oder Salicylaten (z. B. Diflunisal, Salsalat) aufgrund des erhöhten Risikos einer gastrointestinalen Toxizität und einer geringen oder keinen Steigerung der Wirksamkeit nicht empfohlen wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Weisen Sie die Patienten darauf hin, dass NSAIDs in „rezeptfreien“ Medikamenten zur Behandlung von Erkältungen, Fieber oder Schlaflosigkeit enthalten sein können.
Verwendung von NSAIDs und niedrig dosiertem Aspirin
Weisen Sie die Patienten darauf hin, kein niedrig dosiertes Aspirin gleichzeitig mit FELDENE anzuwenden, bis sie mit ihrem medizinischen Betreuer gesprochen haben [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Es wurden keine Langzeit-Tierstudien durchgeführt, um das karzinogene Potenzial von Piroxicam zu charakterisieren.
Mutagenese
Piroxicam war in einem Rückmutationstest mit Ames-Bakterien oder in einem Dominant-Letal-Mutationstest bei Mäusen nicht mutagen und in einem In-vivo-Chromosomenaberrationstest bei Mäusen nicht klastogen.
Beeinträchtigung der Fruchtbarkeit
Reproduktionsstudien, in denen Ratten Piroxicam in Dosen von 2, 5 oder 10 mg/kg/Tag verabreicht wurde (bis zum 5-Fachen der maximal empfohlenen Humandosis [MRHD] von 20 mg, basierend auf mg/m2 Körperoberfläche [KOF]) zeigte keine Beeinträchtigung der männlichen oder weiblichen Fertilität.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Die Anwendung von NSAIDs, einschließlich FELDENE 20 mg, während des dritten Schwangerschaftstrimesters erhöht das Risiko eines vorzeitigen Verschlusses des fetalen Ductus arteriosus. Vermeiden Sie die Anwendung von NSAIDs, einschließlich FELDENE 10 mg, bei schwangeren Frauen ab der 30. Schwangerschaftswoche (drittes Trimester).
Es liegen keine ausreichenden und gut kontrollierten Studien zu FELDENE 20 mg bei Schwangeren vor.
Daten aus Beobachtungsstudien zu potenziellen embryofetalen Risiken der NSAID-Anwendung bei Frauen im ersten oder zweiten Trimenon der Schwangerschaft sind nicht schlüssig. In der allgemeinen US-Bevölkerung haben alle klinisch anerkannten Schwangerschaften unabhängig von der Arzneimittelexposition eine Hintergrundrate von 2–4 % für schwere Fehlbildungen und 15–20 % für Fehlgeburten.
In Reproduktionsstudien an Ratten und Kaninchen gab es keine Hinweise auf Teratogenität bei Expositionen bis zum 5- bzw. 10-fachen der MRHD. In Rattenstudien mit Piroxicam wurde Fetotoxizität (Postimplantationsverlust) bei Expositionen beobachtet, die dem 2-fachen der MRHD entsprachen, und verzögerte Geburten und eine erhöhte Inzidenz von Totgeburten wurden bei Dosen festgestellt, die der MRHD von Piroxicam entsprachen. Basierend auf Tierdaten wurde gezeigt, dass Prostaglandine eine wichtige Rolle bei der Gefäßpermeabilität des Endometriums, der Blastozystenimplantation und der Dezidualisierung spielen. In Tierversuchen führte die Verabreichung von Prostaglandinsynthesehemmern wie Piroxicam zu einem erhöhten Prä- und Postimplantationsverlust.
Klinische Überlegungen
Arbeit oder Lieferung
Es liegen keine Studien zu den Wirkungen von FELDENE während der Wehen oder der Geburt vor. In Tierversuchen hemmen NSAIDs, einschließlich Piroxicam, die Prostaglandinsynthese, verursachen verzögerte Geburten und erhöhen die Häufigkeit von Totgeburten.
Daten
Tierische Daten
Trächtige Ratten, denen während der Organogenese (6. bis 15. Trächtigkeitstag) 2, 5 oder 10 mg/kg/Tag Piroxicam verabreicht wurden, zeigten bei 5 und 10 mg/kg/Tag Piroxicam (entsprechend 2 bzw 5-fache der maximal empfohlenen Humandosis [MRHD] von jeweils 20 mg, basierend auf mg/m2 Körperoberfläche [KOF]). Bei den Nachkommen wurden keine arzneimittelbedingten Entwicklungsanomalien festgestellt. Die Magen-Darm-Toxizität war bei trächtigen Ratten im letzten Trächtigkeitstrimester im Vergleich zu nicht trächtigen Ratten oder Ratten in früheren Trächtigkeitstrimestern erhöht. Trächtige Kaninchen, denen während der Organogenese (7. bis 18. Trächtigkeitstag) 2, 5 oder 10 mg/kg/Tag Piroxicam verabreicht wurden, zeigten keine arzneimittelbedingten Entwicklungsanomalien bei den Nachkommen (bis zum 10-fachen der MRHD, basierend auf einem mg/m2 BSA).
In einer prä- und postnatalen Entwicklungsstudie, in der trächtige Ratten Piroxicam mit 2, 5 oder 10 mg/kg/Tag am 15. Trächtigkeitstag bis zur Geburt und Entwöhnung der Nachkommen verabreicht bekamen, wurden bei Muttertieren eine verringerte Gewichtszunahme und Todesfälle beobachtet 10 mg/kg/Tag (5-fache MRHD basierend auf mg/m2 BSA) ab dem 20. Trächtigkeitstag. Behandelte Muttertiere zeigten Peritonitis, Adhäsionen, Magenblutungen, hämorrhagische Enteritis und tote Föten im Uterus. Die Geburt verzögerte sich und es gab eine erhöhte Inzidenz von Totgeburten in allen mit Piroxicam behandelten Gruppen (bei Dosen, die der MRHD entsprachen). Die postnatale Entwicklung konnte aufgrund fehlender mütterlicher Fürsorge infolge schwerer maternaler Toxizität nicht zuverlässig beurteilt werden.
Stillzeit
Zusammenfassung der Risiken
Begrenzte Daten aus 2 veröffentlichten Berichten, die insgesamt 6 stillende Frauen und 2 Säuglinge umfassten, zeigten, dass Piroxicam in einer Menge von etwa 1 % bis 3 % der mütterlichen Konzentration in die Muttermilch ausgeschieden wird. Während der Behandlung trat keine Akkumulation von Piroxicam in der Milch im Vergleich zu der im mütterlichen Plasma auf. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an FELDENE 20 mg und möglichen nachteiligen Auswirkungen von FELDENE oder der zugrunde liegenden Erkrankung der Mutter auf den gestillten Säugling berücksichtigt werden.
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Frauen
Basierend auf dem Wirkmechanismus kann die Anwendung von Prostaglandin-vermittelten NSAIDs, einschließlich FELDENE, das Reißen der Ovarialfollikel verzögern oder verhindern, was bei manchen Frauen mit reversibler Unfruchtbarkeit in Verbindung gebracht wurde. Veröffentlichte Tierstudien haben gezeigt, dass die Verabreichung von Prostaglandinsynthesehemmern das Potenzial hat, die für den Eisprung erforderliche Prostaglandin-vermittelte Follikelruptur zu stören. Kleine Studien an Frauen, die mit NSAR behandelt wurden, haben auch eine reversible Verzögerung des Eisprungs gezeigt. Erwägen Sie das Absetzen von NSAIDs, einschließlich FELDENE, bei Frauen, die Schwierigkeiten haben, schwanger zu werden, oder die sich einer Untersuchung auf Unfruchtbarkeit unterziehen.
Pädiatrische Verwendung
FELDENE 20 mg wurde bei pädiatrischen Patienten nicht untersucht. Die Sicherheit und Wirksamkeit von FELDENE 10 mg wurde nicht nachgewiesen.
Geriatrische Verwendung
Ältere Patienten haben im Vergleich zu jüngeren Patienten ein größeres Risiko für NSAID-assoziierte schwerwiegende kardiovaskuläre, gastrointestinale und/oder renale Nebenwirkungen. Wenn der erwartete Nutzen für den älteren Patienten diese potenziellen Risiken überwiegt, beginnen Sie mit der Dosierung am unteren Ende des Dosierungsbereichs und überwachen Sie die Patienten auf Nebenwirkungen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ÜBERDOSIS
Die Symptome nach einer akuten NSAID-Überdosierung beschränkten sich typischerweise auf Lethargie, Benommenheit, Übelkeit, Erbrechen und epigastrische Schmerzen, die im Allgemeinen mit unterstützender Behandlung reversibel sind. Magen-Darm-Blutungen sind aufgetreten. Bluthochdruck, akutes Nierenversagen, Atemdepression und Koma sind aufgetreten, aber selten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Behandeln Sie Patienten mit symptomatischer und unterstützender Behandlung nach einer NSAID-Überdosis. Es gibt keine spezifischen Gegenmittel. Erwägen Sie Erbrechen und/oder Aktivkohle (60–100 Gramm bei Erwachsenen, 1–2 Gramm pro kg Körpergewicht bei pädiatrischen Patienten) und/oder osmotische Abführmittel bei symptomatischen Patienten, die innerhalb von vier Stunden nach der Einnahme oder bei Patienten mit einer starken Überdosierung beobachtet werden ( 5- bis 10-fache der empfohlenen Dosierung).
Die lange Plasmahalbwertszeit von Piroxicam sollte bei der Behandlung einer Überdosierung mit Piroxicam berücksichtigt werden. Forcierte Diurese, Alkalisierung des Urins, Hämodialyse oder Hämoperfusion sind aufgrund der hohen Proteinbindung möglicherweise nicht sinnvoll.
Wenden Sie sich für weitere Informationen zur Behandlung einer Überdosierung an eine Giftnotrufzentrale (1-800-222-1222).
KONTRAINDIKATIONEN
FELDENE 10 mg ist bei folgenden Patienten kontraindiziert:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Piroxicam hat analgetische, entzündungshemmende und fiebersenkende Eigenschaften.
Der Wirkungsmechanismus von FELDENE 20 mg ist wie der anderer NSAIDs nicht vollständig geklärt, beinhaltet jedoch die Hemmung der Cyclooxygenase (COX-1 und COX-2).
Piroxicam ist ein potenter Inhibitor der Prostaglandin (PG)-Synthese in vitro. Während der Therapie erreichte Piroxicam-Konzentrationen haben in vivo Wirkungen hervorgerufen. Prostaglandine sensibilisieren afferente Nerven und potenzieren die Wirkung von Bradykinin bei der Schmerzauslösung in Tiermodellen. Prostaglandine sind Entzündungsmediatoren. Da Piroxicam ein Hemmer der Prostaglandinsynthese ist, kann seine Wirkungsweise auf einer Abnahme von Prostaglandinen in peripheren Geweben beruhen.
Pharmakokinetik
Allgemeine pharmakokinetische Eigenschaften
Die Pharmakokinetik von Piroxicam wurde bei gesunden Probanden, speziellen Populationen und Patienten charakterisiert. Die Pharmakokinetik von Piroxicam ist linear. Mit zunehmender Dosis wird ein proportionaler Anstieg der Exposition beobachtet. Die verlängerte Halbwertszeit (50 Stunden) führt bei einmal täglicher Gabe zur Aufrechterhaltung relativ stabiler Plasmakonzentrationen über den Tag und bei mehrfacher Gabe zu einer signifikanten Akkumulation. Die meisten Patienten nähern sich innerhalb von 7–12 Tagen dem Steady-State-Plasmaspiegel an. Bei Patienten, bei denen längere Plasmahalbwertszeiten von Piroxicam auftraten, wurden höhere Konzentrationen beobachtet, die nach zwei bis drei Wochen einem Steady State nahekommen.
Absorption
Piroxicam wird nach oraler Gabe gut resorbiert. Die Plasmakonzentrationen des Arzneimittels sind bei 10- und 20-mg-Dosen proportional und erreichen im Allgemeinen innerhalb von drei bis fünf Stunden nach der Verabreichung ihren Höhepunkt. Eine Einzeldosis von 20 mg führt im Allgemeinen zu maximalen Piroxicam-Plasmaspiegeln von 1,5 bis 2 µg/ml, während sich die maximalen Plasmakonzentrationen des Arzneimittels nach wiederholter täglicher Verabreichung von 20 mg Piroxicam normalerweise bei 3–8 µg/ml stabilisieren.
Bei Nahrungsaufnahme kommt es nach oraler Gabe zu einer leichten Verzögerung der Resorptionsgeschwindigkeit, aber nicht des Ausmaßes der Resorption. Es hat sich gezeigt, dass die gleichzeitige Verabreichung von Antazida (Aluminiumhydroxid oder Aluminiumhydroxid mit Magnesiumhydroxid) keinen Einfluss auf die Plasmaspiegel von oral verabreichtem Piroxicam hat.
Verteilung
Das scheinbare Verteilungsvolumen von Piroxicam beträgt etwa 0,14 l/kg. Neunundneunzig Prozent des Plasmapiroxicams sind an Plasmaproteine gebunden. Piroxicam wird in die Muttermilch ausgeschieden. Das Vorhandensein in der Muttermilch wurde während der Anfangs- und Langzeitbedingungen (52 Tage) bestimmt. Piroxicam erschien in der Muttermilch in etwa 1 % bis 3 % der mütterlichen Konzentration. Während der Behandlung trat keine Akkumulation von Piroxicam in der Milch im Vergleich zu der im Plasma auf.
Beseitigung
Stoffwechsel
Der Metabolismus von Piroxicam erfolgt durch Hydroxylierung an der 5-Position der Pyridyl-Seitenkette und Konjugation dieses Produkts; durch Cyclodehydratisierung; und durch eine Folge von Reaktionen, die Hydrolyse der Amidbindung, Decarboxylierung, Ringkontraktion und N-Demethylierung beinhalten. In-vitro-Studien weisen auf Cytochrom P4502C9 (CYP2C9) als das Hauptenzym hin, das an der Bildung von 5'-Hydroxy-Piroxicam, dem Hauptmetaboliten, beteiligt ist [vgl Pharmakogenomik ]. Es wird berichtet, dass die Biotransformationsprodukte des Piroxicam-Metabolismus keine entzündungshemmende Wirkung haben.
Bei Probanden mit CYP2C9-Polymorphismen wurde im Vergleich zu Probanden mit normalem Metabolisierertyp eine höhere systemische Exposition von Piroxicam festgestellt [siehe Pharmakogenomik ].
Ausscheidung
Piroxicam und seine Biotransformationsprodukte werden im Urin und im Stuhl ausgeschieden, wobei etwa doppelt so viel im Urin wie im Stuhl vorkommt. Ungefähr 5 % einer Dosis von FELDENE 10 mg werden unverändert ausgeschieden. Die Plasmahalbwertszeit (t½) von Piroxicam beträgt etwa 50 Stunden.
Spezifische Populationen
Pädiatrie
Piroxicam wurde bei pädiatrischen Patienten nicht untersucht.
Wettrennen
Rassenbedingte pharmakokinetische Unterschiede wurden nicht festgestellt.
Leberfunktionsstörung
Die Auswirkungen einer Lebererkrankung auf die Pharmakokinetik von Piroxicam wurden nicht untersucht. Ein wesentlicher Teil der Elimination von Piroxicam erfolgt jedoch durch hepatischen Metabolismus. Folglich benötigen Patienten mit Lebererkrankungen im Vergleich zu Patienten mit normaler Leberfunktion möglicherweise geringere Piroxicam-Dosen.
Nierenfunktionsstörung
Die Pharmakokinetik von Piroxicam wurde bei Patienten mit Niereninsuffizienz untersucht. Studien zeigen, dass Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung möglicherweise keine Dosisanpassungen benötigen. Die pharmakokinetischen Eigenschaften von Piroxicam bei Patienten mit schwerer Niereninsuffizienz oder Hämodialysepatienten sind jedoch nicht bekannt.
Arzneimittelwechselwirkungsstudien
Antazida
Die gleichzeitige Gabe von Antazida hatte keinen Einfluss auf die Plasmaspiegel von Piroxicam.
Aspirin
Wenn Piroxicam zusammen mit Aspirin verabreicht wurde, war seine Proteinbindung verringert, obwohl die Clearance von freiem FELDENE 20 mg nicht verändert wurde. Die Plasmaspiegel von Piroxicam wurden auf etwa 80 % ihrer normalen Werte gesenkt, wenn FELDENE (20 mg/Tag) in Verbindung mit Aspirin (3900 mg/Tag) verabreicht wurde. Die klinische Bedeutung dieser Wechselwirkung ist nicht bekannt [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Pharmakogenomik
Die CYP2C9-Aktivität ist bei Personen mit genetischen Polymorphismen, wie den CYP2C9*2- und CYP2C9*3-Polymorphismen, verringert. Begrenzte Daten aus zwei veröffentlichten Berichten zeigten, dass Patienten mit heterozygotem CYP2C9*1/*2 (n=9), heterozygotem CYP2C9*1/*3 (n=9) und homozygotem CYP2C9*3/*3 (n=1) Genotyp waren zeigten 1,7-, 1,7- bzw. 5,3-fach höhere systemische Spiegel von Piroxicam als die Probanden mit CYP2C9*1/*1 (n=17, normaler Metabolisierer-Genotyp) nach Verabreichung einer oralen Einzeldosis. Die mittleren Werte der Eliminationshalbwertszeit von Piroxicam waren bei Patienten mit den Genotypen CYP2C9*1/*3 (n=9) und CYP2C9*3/*3 (n=1) 1,7- bzw. 8,8-mal höher als bei Patienten mit CYP2C9*1 /*1 (n=17). Es wird geschätzt, dass die Häufigkeit des homozygoten*3/*3-Genotyps in der Gesamtbevölkerung 0 % bis 1 % beträgt; In bestimmten ethnischen Gruppen wurden jedoch Häufigkeiten von bis zu 5,7 % gemeldet.
Schlechte Metabolisierer von CYP2C9-Substraten
Bei Patienten, bei denen aufgrund des Genotyps oder der Vorgeschichte/Erfahrung mit anderen CYP2C9-Substraten (wie Warfarin und Phenytoin) bekannt ist oder vermutet wird, dass sie langsame CYP2C9-Metabolisierer sind, sollte eine Dosisreduktion in Betracht gezogen werden, da sie aufgrund der verringerten metabolischen Clearance ungewöhnlich hohe Plasmaspiegel aufweisen können.
Klinische Studien
In kontrollierten klinischen Studien wurde die Wirksamkeit von FELDENE sowohl bei akuten Exazerbationen als auch bei der Langzeitbehandlung von rheumatoider Arthritis und Osteoarthritis nachgewiesen.
Die therapeutischen Wirkungen von FELDENE 20 mg zeigen sich früh in der Behandlung beider Erkrankungen mit einem progressiven Anstieg des Ansprechens über mehrere (8–12) Wochen. Die Wirksamkeit wird in Form von Schmerzlinderung und, falls vorhanden, Abklingen von Entzündungen gesehen.
Dosen von 20 mg/Tag FELDENE 20 mg zeigen eine therapeutische Wirkung, die mit therapeutischen Dosen von Aspirin vergleichbar ist, mit einer geringeren Inzidenz geringfügiger gastrointestinaler Wirkungen und Tinnitus.
FELDENE 10 mg wurde gleichzeitig mit Fixdosen von Gold und Kortikosteroiden verabreicht. Die Existenz eines "steroidsparenden" Effekts wurde bisher nicht ausreichend untersucht.
INFORMATIONEN ZUM PATIENTEN
Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Nehmen Sie NSAIDs nicht direkt vor oder nach einer Herzoperation ein, die als „Koronararterien-Bypass-Transplantation (CABG)“ bezeichnet wird.
Vermeiden Sie die Einnahme von NSAIDs nach einem kürzlich erlittenen Herzinfarkt, es sei denn, Ihr medizinischer Betreuer sagt es Ihnen. Sie haben möglicherweise ein erhöhtes Risiko für einen weiteren Herzinfarkt, wenn Sie NSAIDs nach einem kürzlich erlittenen Herzinfarkt einnehmen
Das Risiko, ein Geschwür oder eine Blutung zu bekommen, steigt mit:
NSAIDs sollten nur verwendet werden:
Was sind NSAIDs?
NSAIDs werden zur Behandlung von Schmerzen und Rötungen, Schwellungen und Hitze (Entzündung) aufgrund von Erkrankungen wie verschiedenen Arten von Arthritis, Menstruationsbeschwerden und anderen Arten von kurzfristigen Schmerzen eingesetzt.
Wer sollte keine NSAIDs einnehmen?
Nehmen Sie keine NSAIDs ein:
Informieren Sie vor der Einnahme von NSAIDs Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger oder rezeptfreier Arzneimittel, Vitamine oder pflanzlicher Nahrungsergänzungsmittel. NSAIDs und einige andere Arzneimittel können miteinander interagieren und schwerwiegende Nebenwirkungen verursachen. Beginnen Sie nicht mit der Einnahme eines neuen Arzneimittels, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Welche Nebenwirkungen können NSAIDs haben?
NSAIDs können schwerwiegende Nebenwirkungen haben, einschließlich:
Siehe „Was sind die wichtigsten Informationen, die ich über sogenannte nichtsteroidale Antirheumatika (NSAIDs) wissen sollte?
Holen Sie sofort Hilfe, wenn Sie eines der folgenden Symptome bemerken:
Brechen Sie die Einnahme Ihres NSAID ab und rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome bemerken:
Wenn Sie zu viel von Ihrem NSAID eingenommen haben, rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe.
Dies sind nicht alle möglichen Nebenwirkungen von NSAIDs. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker nach NSAIDs.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Weitere Informationen zu NSAIDs
Allgemeine Informationen zur sicheren und wirksamen Anwendung von NSAIDs
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie NSAIDs nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie NSAIDs nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Wenn Sie weitere Informationen zu NSAIDs wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen über NSAIDs bitten, die für medizinisches Fachpersonal geschrieben sind.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.