Neoral 25mg, 100mg Cyclosporine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Neoral 25 mg und wie wird es angewendet?
Neoral 25 mg ist ein verschreibungspflichtiges Arzneimittel, das zur Prophylaxe zur Verhinderung einer Organabstoßung nach einer Transplantation und zur Behandlung der Symptome von rheumatoider Arthritis und Psoriasis verwendet wird. Neoral kann allein oder mit anderen Medikamenten verwendet werden.
Neoral gehört zu einer Klasse von Medikamenten namens DMARDs, Immunmodulatoren; Immunsuppressiva; Calcineurin-Inhibitoren.
Es ist nicht bekannt, ob Neoral 25 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Neoral haben?
Neoral kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Neoral gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Neoral. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
Nur Ärzte mit Erfahrung in der Behandlung einer systemischen immunsuppressiven Therapie der angegebenen Krankheit sollten Neoral® verschreiben. In Dosierungen, die bei der Transplantation solider Organe verwendet werden, sollte Neoral® nur von Ärzten verschrieben werden, die Erfahrung in der immunsuppressiven Therapie und der Behandlung von Empfängern von Organtransplantaten haben. Patienten, die das Medikament erhalten, sollten in Einrichtungen behandelt werden, die mit angemessenen Labor- und unterstützenden medizinischen Ressourcen ausgestattet und besetzt sind. Der für die Erhaltungstherapie verantwortliche Arzt sollte über alle für die Nachsorge des Patienten erforderlichen Informationen verfügen. Neoral®, ein systemisches Immunsuppressivum, kann die Anfälligkeit für Infektionen und die Entwicklung von Neoplasien erhöhen. Bei nieren-, leber- und herztransplantierten Patienten kann Neoral® zusammen mit anderen Immunsuppressiva verabreicht werden. Eine erhöhte Anfälligkeit für Infektionen und die mögliche Entwicklung von Lymphomen und anderen Neoplasmen können aus der Zunahme des Grades der Immunsuppression bei Transplantationspatienten resultieren.
Neoral® Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIED und Neoral® Oral Solution (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIED haben eine erhöhte Bioverfügbarkeit im Vergleich zu Sandimmune® Weichgelatine-Kapseln (Cyclosporin-Kapseln, USP) und Sandimmune® Oral Solution (Cyclosporin zum Einnehmen). Lösung, USP). Neoral® und Sandimmune® sind nicht bioäquivalent und können ohne ärztliche Aufsicht nicht austauschbar verwendet werden. Bei einer gegebenen Talkonzentration ist die Cyclosporin-Exposition bei Neoral® größer als bei Sandimmune®. Wenn ein Patient, der außergewöhnlich hohe Sandimmune®-Dosen erhält, auf Neoral® umgestellt wird, ist besondere Vorsicht geboten. Die Blutkonzentrationen von Cyclosporin sollten bei Transplantationspatienten und Patienten mit rheumatoider Arthritis, die Neoral® einnehmen, überwacht werden, um Toxizität aufgrund hoher Konzentrationen zu vermeiden. Bei Transplantationspatienten sollten Dosisanpassungen vorgenommen werden, um eine mögliche Organabstoßung aufgrund niedriger Konzentrationen zu minimieren. Der Vergleich von Blutkonzentrationen in der veröffentlichten Literatur mit Blutkonzentrationen, die unter Verwendung aktueller Assays erhalten wurden, muss mit detaillierten Kenntnissen der verwendeten Assay-Methoden durchgeführt werden.
Für Psoriasis-Patienten (Siehe auch die umrahmten Warnhinweise oben)
Psoriasis-Patienten, die zuvor mit PUVA und in geringerem Maße mit Methotrexat oder anderen immunsuppressiven Mitteln, UVB, Steinkohlenteer oder Strahlentherapie behandelt wurden, haben ein erhöhtes Risiko, Hautmalignome zu entwickeln, wenn sie Neoral® einnehmen.
Cyclosporin, der Wirkstoff in Neoral®, kann in empfohlenen Dosierungen systemische Hypertonie und Nephrotoxizität verursachen. Das Risiko steigt mit zunehmender Dosis und Dauer der Ciclosporin-Therapie. Nierenfunktionsstörungen, einschließlich struktureller Nierenschäden, sind eine mögliche Folge von Ciclosporin, und daher muss die Nierenfunktion während der Therapie überwacht werden.
BEZEICHNUNG
Neoral® ist eine orale Formulierung von Cyclosporin, die in wässriger Umgebung sofort eine Mikroemulsion bildet.
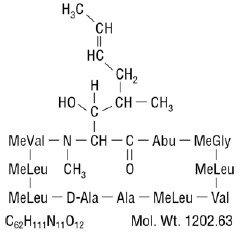
Cyclosporin, der Wirkstoff in Neoral®, ist ein zyklisches Polypeptid-Immunsuppressivum, das aus 11 Aminosäuren besteht. Es wird als Metabolit von der Pilzart Beauveria nivea produziert.
Chemisch wird Cyclosporin als [R-[R*,R*-(E)]]-Cyclo-(L-alanyl-D-alanyl-N-methyl-L-leucyl-N-methyl-L-leucyl-N-methyl) bezeichnet -L-Valyl-3-hydroxy-N,4-dimethyl-L-2-amino-6-octenoyl-L-α-aminobutyryl-N-methylglycyl-N-methyl-L-leucyl-L-valyl-N-methyl -L-Leucyl).
Neoral® Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIZIERT sind in den Stärken 25 mg und 100 mg erhältlich.
Jede 25-mg-Kapsel enthält:
Cyclosporin………………………………25 mg Alkohol, USP dehydriert.............................11,9 % v/v (9,5 % Gew./Vol.)
Jede 100-mg-Kapsel enthält:
Cyclosporin……………………………...100 mg Alkohol, USP dehydriert............................11.9 % V/V (9,5 % Gew./Vol.)
Inaktive Zutaten: Maisöl-Mono-Di-Triglyceride, Polyoxyl 40, hydriertes Rizinusöl NF, DL-α-Tocopherol USP, Gelatine NF, Glycerin, Eisenoxidschwarz, Propylenglykol USP, Titandioxid USP, Karmin und andere Inhaltsstoffe.
Neoral® Oral Solution (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIED ist in 50-ml-Flaschen erhältlich.
Jeder ml enthält:
Cyclosporin…………………..................100 mg/mL Alkohol, USP dehydriert................ ...........11,9 % v/v (9,5 % Gew./Vol.)
Inaktive Zutaten: Maisöl-Mono-Di-Triglyceride, Polyoxyl 40 hydriertes Rizinusöl NF, DL-α-Tocopherol USP, Propylenglykol USP.
Die chemische Struktur von Cyclosporin (auch bekannt als Cyclosporin A) ist:
INDIKATIONEN
Nieren-, Leber- und Herztransplantation
Neoral 25 mg ist angezeigt zur Prophylaxe der Organabstoßung bei allogenen Nieren-, Leber- und Herztransplantationen. Neoral 100 mg wurde in Kombination mit Azathioprin und Kortikosteroiden angewendet.
Rheumatoide Arthritis
Neoral ist indiziert zur Behandlung von Patienten mit schwerer aktiver rheumatoider Arthritis, bei denen die Krankheit nicht ausreichend auf Methotrexat angesprochen hat. Neoral kann in Kombination mit Methotrexat bei Patienten mit rheumatoider Arthritis angewendet werden, die nicht ausreichend auf Methotrexat allein ansprechen.
Schuppenflechte
Neoral ist indiziert zur Behandlung von erwachsenen, nicht immungeschwächten Patienten mit schwerer (d. h. ausgedehnter und/oder beeinträchtigender), widerspenstiger Plaque-Psoriasis, die auf mindestens eine systemische Therapie (z. B. PUVA, Retinoide oder Methotrexat) oder in Patienten, bei denen andere systemische Therapien kontraindiziert sind oder nicht vertragen werden können.
Während ein Rebound selten auftritt, erleiden die meisten Patienten mit Neoral 100 mg wie bei anderen Therapien einen Rückfall nach Beendigung der Behandlung.
DOSIERUNG UND ANWENDUNG
Neoral 25 mg Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIZIERT und Neoral Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT D
Neoral hat im Vergleich zu Sandimmune eine erhöhte Bioverfügbarkeit. Neoral 25 mg und Sandimmune sind nicht bioäquivalent und können ohne ärztliche Aufsicht nicht austauschbar verwendet werden.
Die Tagesdosis von Neoral 100 mg sollte immer in zwei geteilten Dosen (BID) verabreicht werden. Es wird empfohlen, Neoral in Bezug auf die Tageszeit und in Bezug auf die Mahlzeiten nach einem einheitlichen Zeitplan zu verabreichen. Grapefruit und Grapefruitsaft beeinflussen den Stoffwechsel, erhöhen die Blutkonzentration von Cyclosporin und sollten daher vermieden werden.
Spezifische Populationen
Nierenfunktionsstörung bei Nieren-, Leber- und Herztransplantation
Cyclosporin unterliegt einer minimalen renalen Elimination und seine Pharmakokinetik scheint bei Patienten mit einer Nierenerkrankung im Endstadium, die routinemäßige Hämodialysebehandlungen erhalten, nicht signifikant verändert zu sein (siehe KLINISCHE PHARMAKOLOGIE ). Aufgrund seines nephrotoxischen Potenzials (vgl WARNUNGEN ), wird eine sorgfältige Überwachung der Nierenfunktion empfohlen; Ciclosporin-Dosierung sollte reduziert werden, falls angezeigt (siehe WARNUNGEN und VORSICHTSMASSNAHMEN ).
Nierenfunktionsstörung bei rheumatoider Arthritis und Psoriasis
Patienten mit eingeschränkter Nierenfunktion sollten kein Ciclosporin erhalten (siehe KONTRAINDIKATIONEN , WARNUNGEN und VORSICHTSMASSNAHMEN ).
Leberfunktionsstörung
Die Clearance von Ciclosporin kann bei Patienten mit schwerer Lebererkrankung signifikant verringert sein (siehe KLINISCHE PHARMAKOLOGIE ). Bei Patienten mit schwerer Leberfunktionsstörung kann eine Dosisreduktion erforderlich sein, um die Blutkonzentrationen innerhalb des empfohlenen Zielbereichs zu halten (siehe WARNUNGEN und VORSICHTSMASSNAHMEN ).
Neu transplantierte Patienten
Die anfängliche orale Dosis von Neoral 25 mg kann 4 bis 12 Stunden vor der Transplantation oder postoperativ gegeben werden. Die Anfangsdosis von Neoral 25 mg variiert je nach transplantiertem Organ und den anderen im Immunsuppressivprotokoll enthaltenen Immunsuppressiva. Bei neu transplantierten Patienten ist die orale Anfangsdosis von Neoral dieselbe wie die orale Anfangsdosis von Sandimmune. Empfohlene Anfangsdosen sind aus den Ergebnissen einer Untersuchung von 1994 über die Verwendung von Sandimmune in US-amerikanischen Transplantationszentren verfügbar. Die mittleren ± SD-Anfangsdosen betrugen 9 ± 3 mg/kg/Tag für Nierentransplantationspatienten (75 Zentren), 8 ± 4 mg/kg/Tag für Lebertransplantationspatienten (30 Zentren) und 7 ± 3 mg/kg/Tag für herztransplantierte Patienten (24 Zentren). Die Gesamttagesdosen wurden in zwei gleiche Tagesdosen aufgeteilt. Die Neoral-Dosis wird anschließend angepasst, um eine vordefinierte Cyclosporin-Blutkonzentration zu erreichen (siehe Überwachung der Blutkonzentration bei Transplantationspatienten unter). Wenn Cyclosporin-Talblutkonzentrationen verwendet werden, ist der Zielbereich für Neoral 100 mg derselbe wie für Sandimmune. Die Verwendung des gleichen Talspiegel-Zielbereichs für Neoral 100 mg wie für Sandimmune führt zu einer größeren Cyclosporin-Exposition, wenn Neoral verabreicht wird (siehe Pharmakokinetik, Resorption ). Die Dosierung sollte basierend auf der klinischen Beurteilung der Abstoßung und Verträglichkeit titriert werden. Niedrigere 100-mg-Dosen von Neoral können als Erhaltungstherapie ausreichend sein.
Zunächst wird eine Begleittherapie mit adrenalen Kortikosteroiden empfohlen. Verschiedene ausschleichende Dosierungsschemata von Prednison scheinen ähnliche Ergebnisse zu erzielen. Ein repräsentatives Dosierungsschema, das auf dem Gewicht des Patienten basiert, begann mit 2,0 mg/kg/Tag für die ersten 4 Tage, verjüngt auf 1,0 mg/kg/Tag nach 1 Woche, 0,6 mg/kg/Tag nach 2 Wochen, 0,3 mg/kg/Tag bis 1 Monat und 0,15 mg/kg/Tag bis 2 Monate und danach als Erhaltungsdosis. Die Steroiddosen können individuell weiter reduziert werden, je nach Status des Patienten und Funktion des Transplantats. Anpassungen der Prednison-Dosierung müssen entsprechend der klinischen Situation vorgenommen werden.
Umstellung von Sandimmune auf Neoral 25 mg bei Transplantationspatienten
Bei transplantierten Patienten, bei denen eine Umstellung von Sandimmune auf Neoral in Betracht gezogen wird, sollte Neoral mit der gleichen Tagesdosis begonnen werden, die zuvor mit Sandimmune angewendet wurde (1:1-Dosisumstellung). Die Neoral-Dosis sollte anschließend angepasst werden, um die Talspiegel von Cyclosporin vor der Umstellung zu erreichen. Die Verwendung des gleichen Talspiegel-Zielbereichs für Neoral 100 mg wie für Sandimmune führt zu einer größeren Cyclosporin-Exposition, wenn Neoral verabreicht wird (siehe Pharmakokinetik, Resorption ). Patienten mit Verdacht auf eine schlechte Resorption von Sandimmune benötigen andere Dosierungsstrategien (siehe Transplantationspatienten mit schlechter Absorption von Sandimmun, unter). Bei manchen Patienten ist der Anstieg der Talkonzentration im Blut ausgeprägter und kann von klinischer Bedeutung sein.
Bis die Talkonzentration im Blut den Wert vor der Umstellung erreicht, wird dringend empfohlen, die Talkonzentration von Ciclosporin im Blut alle 4 bis 7 Tage nach der Umstellung auf Neoral zu kontrollieren Darüber hinaus sollten klinische Sicherheitsparameter wie Serumkreatinin und Blutdruck in den ersten zwei Monaten nach der Umstellung alle zwei Wochen überwacht werden. Wenn die Talspiegel im Blut außerhalb des gewünschten Bereichs liegen und/oder sich die klinischen Sicherheitsparameter verschlechtern, muss die Dosierung von Neoral 100 mg entsprechend angepasst werden.
Transplantationspatienten mit schlechter Resorption von Sandimmune
Bei Patienten mit niedrigeren als den erwarteten Bluttalspiegeln von Cyclosporin im Verhältnis zur oralen Dosis von Sandimmune kann es zu einer schlechten oder unbeständigen Resorption von Cyclosporin aus Sandimmune kommen. Nach der Umstellung auf Neoral weisen die Patienten tendenziell höhere Ciclosporin-Konzentrationen auf. Aufgrund der erhöhten Bioverfügbarkeit von Cyclosporin nach der Umstellung auf Neoral kann die Bluttalkonzentration von Cyclosporin den Zielbereich überschreiten. Besondere Vorsicht ist geboten, wenn Patienten auf Neoral 100 mg in Dosen von mehr als 10 mg/kg/Tag umgestellt werden. Die Dosis von Neoral sollte individuell auf der Grundlage der Cyclosporin-Talspiegel, der Verträglichkeit und des klinischen Ansprechens titriert werden. Bei dieser Patientengruppe sollte die Ciclosporin-Talkonzentration im Blut häufiger gemessen werden, mindestens zweimal wöchentlich (täglich, wenn die Anfangsdosis 10 mg/kg/Tag übersteigt), bis sich die Konzentration im gewünschten Bereich stabilisiert.
Rheumatoide Arthritis
Die Anfangsdosis von Neoral beträgt 2,5 mg/kg/Tag und wird zweimal täglich als geteilte (BID) orale Dosis eingenommen. Salicylate, NSAIDs und orale Kortikosteroide können fortgesetzt werden (siehe WARNUNGEN und VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Der Wirkungseintritt erfolgt im Allgemeinen zwischen 4 und 8 Wochen. Wenn ein unzureichender klinischer Nutzen zu sehen ist und die Verträglichkeit gut ist (einschließlich Serumkreatinin weniger als 30 % über dem Ausgangswert), kann die Dosis nach 8 Wochen um 0,5 bis 0,75 mg/kg/Tag und erneut nach 12 Wochen auf maximal 4 mg erhöht werden /kg/Tag. Wenn nach 16-wöchiger Therapie kein Nutzen zu sehen ist, sollte die Therapie mit Neoral 25 mg abgebrochen werden.
Dosisreduktionen um 25 % bis 50 % sollten jederzeit vorgenommen werden, um unerwünschte Ereignisse zu kontrollieren, z WARNUNGEN und VORSICHTSMASSNAHMEN ).
Wenn die Dosisreduktion bei der Kontrolle von Anomalien nicht wirksam ist oder wenn das unerwünschte Ereignis oder die Anomalie schwerwiegend ist, sollte Neoral 25 mg abgesetzt werden. Die gleiche Anfangsdosis und der gleiche Dosisbereich sollten verwendet werden, wenn Neoral 25 mg mit der empfohlenen Methotrexat-Dosis kombiniert wird. Die meisten Patienten können mit Neoral 25 mg-Dosen von 3 mg/kg/Tag oder darunter in Kombination mit Methotrexat-Dosen von bis zu 15 mg/Woche behandelt werden (siehe KLINISCHE PHARMAKOLOGIE , Klinische Versuche ).
Es liegen nur begrenzt Daten zur Langzeitbehandlung vor. Das Wiederauftreten der Krankheitsaktivität der rheumatoiden Arthritis ist im Allgemeinen innerhalb von 4 Wochen nach Absetzen von Ciclosporin erkennbar.
Schuppenflechte
Die Anfangsdosis von Neoral 100 mg sollte 2,5 mg/kg/Tag betragen. Neoral sollte zweimal täglich als geteilte orale Dosis (1,25 mg/kg zweimal täglich) eingenommen werden. Die Patienten sollten diese Dosis mindestens 4 Wochen lang beibehalten, sofern keine unerwünschten Ereignisse auftreten. Wenn bei Patienten bis zu diesem Zeitpunkt keine signifikante klinische Besserung eingetreten ist, sollte die Dosis des Patienten in 2-Wochen-Intervallen erhöht werden. Abhängig vom Ansprechen des Patienten sollte die Dosis um etwa 0,5 mg/kg/Tag bis zu einem Maximum von 4,0 mg/kg/Tag erhöht werden.
Dosisreduktionen um 25 % bis 50 % sollten jederzeit vorgenommen werden, um unerwünschte Ereignisse zu kontrollieren, z. B. Bluthochdruck, Erhöhungen des Serumkreatinins (≥ 25 % über dem Wert des Patienten vor der Behandlung) oder klinisch signifikante Laboranomalien. Wenn die Dosisreduktion nicht wirksam ist, um Anomalien zu kontrollieren, oder wenn das unerwünschte Ereignis oder die Anomalie schwerwiegend ist, sollte Neoral 25 mg abgesetzt werden (siehe Spezielle Überwachung von Psoriasis-Patienten ).
Die Patienten zeigen im Allgemeinen innerhalb von 2 Wochen eine gewisse Verbesserung der klinischen Manifestationen der Psoriasis. Es kann 12 bis 16 Wochen dauern, bis eine zufriedenstellende Kontrolle und Stabilisierung der Krankheit erreicht ist. Die Ergebnisse einer klinischen Dosistitrationsstudie mit Neoral 25 mg weisen darauf hin, dass bei 51 % der Patienten nach 8 Wochen und bei 79 % der Patienten nach 16 Wochen eine Verbesserung der Psoriasis um 75 % oder mehr (basierend auf PASI) erreicht wurde. Die Behandlung sollte abgebrochen werden, wenn nach 6 Wochen mit 4 mg/kg/Tag oder der vom Patienten maximal tolerierten Dosis kein zufriedenstellendes Ansprechen erzielt werden kann. Sobald ein Patient ausreichend kontrolliert ist und stabil erscheint, sollte die Dosis von Neoral 25 mg gesenkt und der Patient mit der niedrigsten Dosis behandelt werden, die ein angemessenes Ansprechen aufrechterhält (dies sollte nicht unbedingt eine vollständige Genesung des Patienten sein). In klinischen Studien waren Ciclosporin-Dosen am unteren Ende des empfohlenen Dosierungsbereichs wirksam, um bei 60 % der Patienten ein zufriedenstellendes Ansprechen aufrechtzuerhalten. Dosen unter 2,5 mg/kg/Tag können ebenfalls gleich wirksam sein.
Nach Beendigung der Behandlung mit Ciclosporin kommt es nach etwa 6 Wochen (50 % der Patienten) bis 16 Wochen (75 % der Patienten) zu einem Rückfall. Bei der Mehrzahl der Patienten tritt nach Beendigung der Behandlung mit Ciclosporin kein Rebound auf. Es wurden 13 Fälle einer Umwandlung von chronischer Plaque-Psoriasis in schwerere Formen der Psoriasis berichtet. Es gab 9 Fälle von pustulöser und 4 Fälle von erythrodermischer Psoriasis. Die Langzeiterfahrung mit Neoral bei Psoriasis-Patienten ist begrenzt, und eine kontinuierliche Behandlung über längere Zeiträume von mehr als einem Jahr wird nicht empfohlen. Bei der Langzeitbehandlung von Patienten mit dieser lebenslangen Erkrankung sollte ein Wechsel mit anderen Behandlungsformen in Erwägung gezogen werden.
Neoral 25 mg Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT – Empfehlungen für die Verabreichung
Um Neoral 25 mg Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT schmackhafter zu machen, sollte es mit Orangen- oder Apfelsaft verdünnt werden, der Raumtemperatur hat. Patienten sollten es vermeiden, die Verdünnungsmittel häufig zu wechseln. Grapefruitsaft beeinflusst den Metabolismus von Cyclosporin und sollte vermieden werden. Die Kombination von Neoral-Lösung mit Milch kann unangenehm sein. Die Wirkung von Milch auf die Bioverfügbarkeit von Cyclosporin bei Verabreichung als Neoral 100 mg Lösung zum Einnehmen wurde nicht untersucht.
Nehmen Sie die verschriebene Menge Neoral 25 mg Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT aus dem Behälter mit der mitgelieferten Dosierspritze, nachdem Sie die Schutzkappe entfernt haben, und geben Sie die Lösung in ein Glas Orangen- oder Apfelsaft. Gut umrühren und sofort trinken. Lassen Sie die verdünnte Lösung zum Einnehmen vor dem Trinken nicht stehen. Verwenden Sie einen Glasbehälter (kein Plastik). Spülen Sie das Glas mit mehr Verdünnungsmittel aus, um sicherzustellen, dass die gesamte Dosis verbraucht wird. Trocknen Sie nach Gebrauch die Außenseite der Dosierspritze mit einem sauberen Tuch und setzen Sie die Schutzabdeckung wieder auf. Spülen Sie die Dosierspritze nicht mit Wasser oder anderen Reinigungsmitteln. Wenn die Spritze gereinigt werden muss, muss sie vor der Wiederverwendung vollständig trocken sein.
Überwachung der Blutkonzentration bei Transplantationspatienten
Transplantationszentren haben festgestellt, dass die Überwachung der Blutkonzentration von Cyclosporin ein wesentlicher Bestandteil des Patientenmanagements ist. Von Bedeutung für die Blutkonzentrationsanalyse sind die Art des verwendeten Assays, das transplantierte Organ und andere verabreichte immunsuppressive Mittel. Obwohl keine feste Beziehung hergestellt wurde, kann die Überwachung der Blutkonzentration bei der klinischen Bewertung von Abstoßung und Toxizität, Dosisanpassungen und der Beurteilung der Compliance hilfreich sein.
Verschiedene Assays wurden verwendet, um Blutkonzentrationen von Cyclosporin zu messen. Ältere Studien, in denen ein unspezifischer Assay verwendet wurde, zitierten häufig Konzentrationen, die ungefähr doppelt so hoch waren wie die der spezifischen Assays. Daher muss ein Vergleich zwischen Konzentrationen in der veröffentlichten Literatur und einer individuellen Patientenkonzentration unter Verwendung aktueller Assays mit detaillierter Kenntnis der verwendeten Assay-Methoden durchgeführt werden. Aktuelle Assay-Ergebnisse sind ebenfalls nicht austauschbar und ihre Verwendung sollte sich an ihrer genehmigten Kennzeichnung orientieren. Eine Diskussion der verschiedenen Testverfahren ist in Annals of Clinical Biochemistry 1994; 31: 420-446. Obwohl mehrere Assays und Assay-Matrizen verfügbar sind, herrscht Einigkeit darüber, dass stammsubstanzspezifische Assays am besten mit klinischen Ereignissen korrelieren. Von diesen ist HPLC die Standardreferenz, aber die RIAs mit monoklonalen Antikörpern und der FPIA mit monoklonalen Antikörpern bieten Empfindlichkeit, Reproduzierbarkeit und Bequemlichkeit. Die meisten Ärzte stützen ihre Überwachung auf Talkonzentrationen von Cyclosporin. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) enthält eine umfassende Diskussion der Cyclosporin-Pharmakokinetik und der Techniken zur Arzneimittelüberwachung. Die Überwachung der Blutkonzentration ist kein Ersatz für die Überwachung der Nierenfunktion oder Gewebebiopsien.
WIE GELIEFERT
Neoral® Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIZIERT
25mg
Oval, blaugrau mit rotem Aufdruck „Neoral“ über „25 mg“.
Packungen mit 30 Blisterpackungen zur Abgabe von Einzeldosen ( NDC 0078-0246-15).
100mg
Länglich, blaugrau mit rotem Aufdruck „NEORAL“ über „100 mg“.
Packungen mit 30 Blisterpackungen zur Abgabe von Einzeldosen ( NDC 0078-0248-15).
Speichern und abgeben
Im Original-Einzeldosisbehältnis bei kontrollierter Raumtemperatur von 20 °C bis 25 °C (68 °F bis 77 °F).
Neoral® Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT
Eine klare, gelbe Flüssigkeit, die in 50-ml-Flaschen mit 100 mg/ml ( NDC 0078-0274-22).
Speichern und abgeben
Im Originalbehälter bei kontrollierter Raumtemperatur 20° bis 25°C (68°F bis 77°F). Nicht im Kühlschrank lagern. Nach dem Öffnen muss der Inhalt innerhalb von zwei Monaten verbraucht werden. Bei Temperaturen unter 20 °C kann die Lösung gelieren; Es kann auch zu einer leichten Ausflockung oder zur Bildung eines leichten Bodensatzes kommen. Es gibt keinen Einfluss auf die Produktleistung oder die Dosierung mit der mitgelieferten Spritze. Auf Raumtemperatur von 25 °C (77 °F) erwärmen lassen, um diese Änderungen rückgängig zu machen.
Neoral® Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIZIERT
Neoral® Lösung zum Einnehmen (Cyclosporin Lösung zum Einnehmen, USP) MODIFIZIERT
Vertrieb durch: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Überarbeitet im Juni 2021.
NEBENWIRKUNGEN
Nieren-, Leber- und Herztransplantation
Die wichtigsten Nebenwirkungen der Ciclosporin-Therapie sind Nierenfunktionsstörungen, Tremor, Hirsutismus, Bluthochdruck und Zahnfleischhyperplasie.
Hypertonie
Bluthochdruck, der normalerweise leicht bis mittelschwer ist, kann bei etwa 50 % der Patienten nach einer Nierentransplantation und bei den meisten Herztransplantationspatienten auftreten.
Glomeruläre Kapillarthrombose
Bei mit Ciclosporin behandelten Patienten wurde eine glomeruläre Kapillarthrombose festgestellt, die bis zum Transplantatversagen fortschreiten kann. Die pathologischen Veränderungen ähnelten denen, die beim hämolytisch-urämischen Syndrom beobachtet wurden, und umfassten Thrombosen der Nierenmikrovaskulatur mit Thrombozyten-Fibrin-Thromben, die glomeruläre Kapillaren und afferente Arteriolen verschließen, mikroangiopathische hämolytische Anämie, Thrombozytopenie und verminderte Nierenfunktion. Ähnliche Ergebnisse wurden beobachtet, wenn andere Immunsuppressiva nach der Transplantation eingesetzt wurden.
Hypomagnesiämie
Hypomagnesiämie wurde bei einigen, aber nicht allen Patienten berichtet, die während einer Ciclosporin-Therapie Krämpfe zeigten. Obwohl Magnesiummangelstudien bei gesunden Probanden darauf hindeuten, dass Hypomagnesiämie mit neurologischen Störungen assoziiert ist, scheinen mehrere Faktoren, einschließlich Hypertonie, hochdosiertes Methylprednisolon, Hypocholesterinämie und Nephrotoxizität in Verbindung mit hohen Plasmakonzentrationen von Cyclosporin, mit den neurologischen Manifestationen der Cyclosporin-Toxizität in Zusammenhang zu stehen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Wirkung von Arzneimitteln und anderen Wirkstoffen auf die Pharmakokinetik und/oder Sicherheit von Cyclosporin
Alle unten aufgeführten Einzelmedikamente sind gut belegt, um mit Cyclosporin zu interagieren. Darüber hinaus kann die gleichzeitige Anwendung von NSAIDs mit Ciclosporin, insbesondere bei Dehydrierung, eine Nierenfunktionsstörung verstärken. Bei der Anwendung anderer Arzneimittel, die bekanntermaßen die Nierenfunktion beeinträchtigen, ist Vorsicht geboten (vgl WARNUNGEN , Nephrotoxizität ).
Medikamente, die Nierenfunktionsstörungen verstärken können
Bei gleichzeitiger Anwendung eines Arzneimittels, das zu einer additiven oder synergistischen Nierenfunktionsstörung führen kann, mit Ciclosporin sollte eine engmaschige Überwachung der Nierenfunktion (insbesondere des Serumkreatinins) durchgeführt werden. Wenn eine signifikante Beeinträchtigung der Nierenfunktion auftritt, sollte die Dosis des gleichzeitig angewendeten Arzneimittels reduziert oder eine alternative Behandlung in Betracht gezogen werden.
Cyclosporin wird weitgehend durch CYP 3A-Isoenzyme, insbesondere CYP3A4, metabolisiert und ist ein Substrat des Multidrug-Efflux-Transporters P-Glykoprotein. Von verschiedenen Wirkstoffen ist bekannt, dass sie Plasma- oder Vollblutkonzentrationen von Cyclosporin entweder erhöhen oder verringern, üblicherweise durch Hemmung oder Induktion von CYP3A4 oder P-Glykoprotein-Transportern oder beidem. Verbindungen, die die Resorption von Cyclosporin verringern, wie Orlistat, sollten vermieden werden. Eine angemessene Dosisanpassung von Neoral 100 mg zum Erreichen der gewünschten Ciclosporinkonzentrationen ist unerlässlich, wenn Arzneimittel, die die Ciclosporinkonzentrationen signifikant verändern, gleichzeitig angewendet werden (siehe B Ladungskonzentrationsüberwachung ).
1. Medikamente, die die Cyclosporin-Konzentration erhöhen
HIV-Protease-Inhibitoren
Die HIV-Protease-Inhibitoren (z. B. Indinavir, Nelfinavir, Ritonavir und Saquinavir) hemmen bekanntermaßen Cytochrom P-450 3A und könnten daher möglicherweise die Konzentrationen von Cyclosporin erhöhen, es liegen jedoch keine formalen Studien zur Wechselwirkung vor. Vorsicht ist geboten, wenn diese Arzneimittel gleichzeitig verabreicht werden.
Grapefruitsaft
Grapefruit und Grapefruitsaft beeinflussen den Stoffwechsel, erhöhen die Blutkonzentration von Cyclosporin und sollten daher vermieden werden.
2. Medikamente/Nahrungsergänzungsmittel, die die Konzentration von Cyclosporin verringern
Bosentan
Die gleichzeitige Gabe von Bosentan (250 bis 1000 mg alle 12 Stunden, je nach Verträglichkeit) und Ciclosporin (300 mg alle 12 Stunden für 2 Tage, dann Dosierung zum Erreichen einer Cmax von 200 bis 250 ng/ml) über 7 Tage bei gesunden Probanden führte zu einer Abnahme der Cmax die mittlere dosisnormalisierte AUC, Cmax und Talkonzentration von Ciclosporin von etwa 50 %, 30 % bzw. 60 % im Vergleich zur alleinigen Gabe von Ciclosporin (vgl Wirkung von Cyclosporin auf die Pharmakokinetik und/oder Sicherheit anderer Medikamente oder Wirkstoffe ). Die gleichzeitige Anwendung von Ciclosporin mit Bosentan sollte vermieden werden.
Boceprevir
Die gleichzeitige Anwendung von Boceprevir (800 mg dreimal täglich über 7 Tage) und Ciclosporin (100 mg Einzeldosis) bei gesunden Probanden führte zu einem etwa 2,7- bzw. 2-fachen Anstieg der mittleren AUC und Cmax von Ciclosporin im Vergleich zu Ciclosporin allein gegeben wurde.
Telaprevir
Die gleichzeitige Anwendung von Telaprevir (750 mg alle 8 Stunden über 11 Tage) mit Ciclosporin (10 mg an Tag 8) führte bei gesunden Probanden zu einem Anstieg der mittleren dosisnormalisierten AUC und Cmax von Ciclosporin um das etwa 4,5-Fache bzw. 1,3-Fache. verglichen mit der alleinigen Gabe von Ciclosporin (100 mg Einzeldosis).
Johanniskraut
Es liegen Berichte über schwerwiegende Arzneimittelwechselwirkungen zwischen Cyclosporin und dem pflanzlichen Nahrungsergänzungsmittel Johanniskraut vor. Es wurde berichtet, dass diese Wechselwirkung zu einer deutlichen Verringerung der Blutkonzentrationen von Cyclosporin führt, was zu subtherapeutischen Spiegeln, Abstoßung transplantierter Organe und Transplantatverlust führt.
Rifabutin
Es ist bekannt, dass Rifabutin den Metabolismus anderer Arzneimittel erhöht, die durch das Cytochrom-P-450-System metabolisiert werden. Die Wechselwirkung zwischen Rifabutin und Cyclosporin wurde nicht untersucht. Vorsicht ist geboten, wenn diese beiden Arzneimittel gleichzeitig verabreicht werden.
Wirkung von Cyclosporin auf die Pharmakokinetik und/oder Sicherheit anderer Medikamente oder Wirkstoffe
Cyclosporin ist ein Inhibitor von CYP3A4 und mehreren Arzneimittel-Efflux-Transportern (z. B. P-Glykoprotein) und kann die Plasmakonzentrationen von Komedikationen erhöhen, die Substrate von CYP3A4, P-Glykoprotein oder Transporterproteinen für organische Anionen sind.
Cyclosporin kann die Clearance von Digoxin, Colchicin, Prednisolon, HMG-CoA-Reduktase-Hemmern (Statinen) und Aliskiren, Bosentan, Dabigatran, Repaglinid, NSAIDs, Sirolimus, Etoposid und anderen Arzneimitteln verringern.
Weitere Informationen und spezifische Empfehlungen finden Sie in den vollständigen Verschreibungsinformationen des anderen Arzneimittels. Die Entscheidung über die gleichzeitige Verabreichung von Ciclosporin mit anderen Arzneimitteln oder Wirkstoffen sollte vom Arzt nach sorgfältiger Nutzen-Risiko-Abwägung getroffen werden.
Digoxin
Bei mehreren Patienten, die Digoxin einnahmen, wurde innerhalb weniger Tage nach Beginn der Behandlung mit Ciclosporin eine schwere Digitalis-Toxizität beobachtet. Wenn Digoxin gleichzeitig mit Ciclosporin angewendet wird, sollten die Serumkonzentrationen von Digoxin überwacht werden.
Colchicin
Es gibt Berichte über das Potenzial von Ciclosporin, die toxischen Wirkungen von Colchicin wie Myopathie und Neuropathie zu verstärken, insbesondere bei Patienten mit Nierenfunktionsstörungen. Die gleichzeitige Verabreichung von Ciclosporin und Colchicin führt zu einem signifikanten Anstieg der Colchicin-Plasmakonzentrationen. Wenn Colchicin gleichzeitig mit Ciclosporin angewendet wird, wird eine Reduzierung der Colchicin-Dosis empfohlen.
HMG-CoA-Reduktase-Hemmer (Statine)
In der Literatur und nach Markteinführung wurden Fälle von Myotoxizität, einschließlich Muskelschmerzen und -schwäche, Myositis und Rhabdomyolyse, bei gleichzeitiger Anwendung von Ciclosporin mit Lovastatin, Simvastatin, Atorvastatin, Pravastatin und selten Fluvastatin berichtet. Bei gleichzeitiger Anwendung mit Ciclosporin sollte die Dosierung dieser Statine gemäß den Empfehlungen auf dem Etikett reduziert werden. Die Statintherapie muss bei Patienten mit Anzeichen und Symptomen einer Myopathie oder bei Patienten mit Risikofaktoren, die für eine schwere Nierenschädigung, einschließlich Nierenversagen, als Folge einer Rhabdomyolyse prädisponieren, vorübergehend ausgesetzt oder abgebrochen werden.
Repaglinid
Cyclosporin kann die Plasmakonzentrationen von Repaglinid erhöhen und dadurch das Risiko einer Hypoglykämie erhöhen. Bei 12 gesunden männlichen Probanden, die zwei Dosen von 100 mg Ciclosporin-Kapsel oral im Abstand von 12 Stunden mit einer Einzeldosis von 0,25 mg Repaglinid-Tablette (eine halbe 0,5-mg-Tablette) oral 13 Stunden nach der Ciclosporin-Anfangsdosis erhielten, betrug die mittlere Cmax von Repaglinid und AUC waren 1,8-fach (Bereich: 0,6- bis 3,7-fach) bzw. 2,4-fach (Bereich 1,2- bis 5,3-fach) erhöht. Bei Patienten, die gleichzeitig Ciclosporin und Repaglinid einnehmen, ist eine engmaschige Überwachung des Blutzuckerspiegels ratsam.
Ambrisentan
Die gleichzeitige Anwendung von Ambrisentan (5 mg täglich) und Ciclosporin (anfangs 100 bis 150 mg zweimal täglich, dann Dosierung zum Erreichen von Cmax 150 bis 200 ng/ml) über 8 Tage bei gesunden Probanden führte zu einem mittleren Anstieg der AUC und Cmax von Ambrisentan um etwa 2- fach bzw. 1,5-fach im Vergleich zu Ambrisentan allein. Bei gleichzeitiger Anwendung von Ambrisentan mit Ciclosporin sollte die Ambrisentan-Dosis nicht auf die empfohlene maximale Tagesdosis titriert werden
Anthrazyklin-Antibiotika
Hohe Ciclosporin-Dosen (z. B. bei einer intravenösen Anfangsdosis von 16 mg/kg/Tag) können die Exposition gegenüber Anthracyclin-Antibiotika (z. B. Doxorubicin, Mitoxantron, Daunorubicin) bei Krebspatienten erhöhen.
Aliskiren
Cyclosporin verändert die Pharmakokinetik von Aliskiren, einem Substrat von P-Glykoprotein und CYP3A4. Bei 14 gesunden Probanden, die gleichzeitig Einzeldosen von Ciclosporin (200 mg) und Aliskiren in reduzierter Dosis (75 mg) erhielten, war die mittlere Cmax von Aliskiren um etwa das 2,5-Fache (90 %-KI: 1,96 bis 3,17) und die mittlere AUC um etwa 2,5 erhöht ca. 4,3-fach (90 %-KI: 3,52 bis 5,21), verglichen mit der alleinigen Behandlung mit Aliskiren. Die gleichzeitige Gabe von Aliskiren mit Cyclosporin verlängerte die mediane Aliskiren-Eliminationshalbwertszeit (26 Stunden gegenüber 43 bis 45 Stunden) und die Tmax (0,5 Stunden gegenüber 1,5 bis 2,0 Stunden). Die mittlere AUC und Cmax von Ciclosporin waren mit den in der Literatur angegebenen Werten vergleichbar. Die gleichzeitige Verabreichung von Cyclosporin und Aliskiren bei diesen Patienten führte auch zu einer Zunahme der Anzahl und/oder Intensität von Nebenwirkungen, hauptsächlich Kopfschmerzen, Hitzewallungen, Übelkeit, Erbrechen und Somnolenz. Die gleichzeitige Anwendung von Ciclosporin mit Aliskiren wird nicht empfohlen.
Bosentan
Bei gesunden Probanden führte die gleichzeitige Verabreichung von Bosentan und Ciclosporin zu einem zeitabhängigen mittleren Anstieg der normalisierten Dosis
Talkonzentrationen von Bosentan (d. h. ungefähr das 21-Fache an Tag 1 und das 2-Fache an Tag 8 (Steady-State)) im Vergleich zu einer alleinigen Gabe von Bosentan als Einzeldosis an Tag 1 (siehe Wirkung von Arzneimitteln und anderen Wirkstoffen auf die Pharmakokinetik und/oder Sicherheit von Cyclosporin ). Die gleichzeitige Anwendung von Ciclosporin mit Bosentan sollte vermieden werden.
Dabigatran
Die Wirkung von Ciclosporin auf die Dabigatran-Konzentration wurde nicht formell untersucht. Die gleichzeitige Anwendung von Dabigatran und Ciclosporin kann aufgrund der P-gp-hemmenden Wirkung von Ciclosporin zu erhöhten Plasmakonzentrationen von Dabigatran führen. Die gleichzeitige Anwendung von Ciclosporin mit Dabigatran sollte vermieden werden.
Kaliumsparende Diuretika
Ciclosporin sollte nicht zusammen mit kaliumsparenden Diuretika angewendet werden, da es zu einer Hyperkaliämie kommen kann. Vorsicht ist auch geboten, wenn Ciclosporin zusammen mit kaliumsparenden Arzneimitteln (z. B. Angiotensin-Converting-Enzym-Hemmern, Angiotensin-II-Rezeptorantagonisten), kaliumhaltigen Arzneimitteln sowie bei Patienten mit kaliumreicher Ernährung verabreicht wird. Die Kontrolle des Kaliumspiegels ist in diesen Situationen ratsam.
Wechselwirkungen mit nichtsteroidalen Antiphlogistika (NSAID).
Der klinische Status und das Serum-Kreatinin sollten engmaschig überwacht werden, wenn Ciclosporin zusammen mit NSAIDs bei Patienten mit rheumatoider Arthritis angewendet wird (siehe WARNUNGEN ).
Es wurde über pharmakodynamische Wechselwirkungen zwischen Ciclosporin und sowohl Naproxen als auch Sulindac berichtet, da die gleichzeitige Anwendung mit einer zusätzlichen Abnahme der Nierenfunktion verbunden ist, die durch die Clearance von 99mTc-Diethylentriaminpentaessigsäure (DTPA) und (p-Aminohippursäure) PAH bestimmt wird. Obwohl die gleichzeitige Gabe von Diclofenac die Blutkonzentrationen von Ciclosporin nicht beeinflusst, wurde sie mit einer ungefähren Verdopplung der Diclofenac-Blutkonzentrationen und gelegentlichen Berichten über reversible Abnahmen der Nierenfunktion in Verbindung gebracht. Folglich sollte die Dosis von Diclofenac am unteren Ende des therapeutischen Bereichs liegen.
Methotrexat-Interaktion
Vorläufige Daten weisen darauf hin, dass bei gleichzeitiger Verabreichung von Methotrexat und Cyclosporin an Patienten mit rheumatoider Arthritis (N = 20) die Konzentrationen (AUCs) von Methotrexat um etwa 30 % erhöht und die Konzentrationen (AUCs) seines Metaboliten, 7-Hydroxy-Methotrexat, um etwa 80 % verringert wurden %. Die klinische Bedeutung dieser Wechselwirkung ist nicht bekannt. Die Konzentrationen von Cyclosporin scheinen nicht verändert worden zu sein (N = 6).
Sirolimus
Erhöhungen des Serum-Kreatinins wurden in Studien mit Sirolimus in Kombination mit Volldosis-Cyclosporin beobachtet. Dieser Effekt ist oft mit einer Reduktion der Ciclosporin-Dosis reversibel. Die gleichzeitige gleichzeitige Verabreichung von Ciclosporin erhöht die Blutspiegel von Sirolimus signifikant. Um den Anstieg der Sirolimus-Konzentration so gering wie möglich zu halten, wird empfohlen, Sirolimus 4 Stunden nach der Ciclosporin-Gabe zu verabreichen.
Nifedipin
Bei gleichzeitiger Gabe von Nifedipin und Ciclosporin wurde über häufige Gingivahyperplasie berichtet. Die gleichzeitige Anwendung von Nifedipin sollte bei Patienten vermieden werden, bei denen sich als Nebenwirkung von Ciclosporin eine Gingivahyperplasie entwickelt.
Methylprednisolon
Es wurde über Krampfanfälle berichtet, wenn hochdosiertes Methylprednisolon gleichzeitig mit Ciclosporin gegeben wurde.
Andere immunsuppressive Medikamente und Wirkstoffe
Psoriasis-Patienten, die andere Immunsuppressiva oder Strahlentherapie (einschließlich PUVA und UVB) erhalten, sollten wegen der Möglichkeit einer übermäßigen Immunsuppression nicht gleichzeitig Ciclosporin erhalten.
Wirkung von Cyclosporin auf die Wirksamkeit von Lebendimpfstoffen
Während der Behandlung mit Ciclosporin kann die Impfung weniger wirksam sein. Der Einsatz von Lebendimpfstoffen sollte vermieden werden.
Für weitere Informationen zu Arzneimittelwechselwirkungen von Cyclosporin wenden Sie sich bitte an die medizinische Abteilung von Novartis unter 1-888-NOW-NOVA [1-888-669-6682].
WARNUNGEN
(Siehe auch Eingerahmte Warnung )
Alle Patienten
Cyclosporin, der Wirkstoff von Neoral 25 mg, kann Nephrotoxizität und Hepatotoxizität verursachen. Das Risiko steigt mit steigenden Ciclosporin-Dosen. Nierenfunktionsstörungen einschließlich struktureller Nierenschäden sind eine mögliche Folge von Neoral 100 mg und daher muss die Nierenfunktion während der Therapie überwacht werden. Bei der Anwendung von Ciclosporin mit nephrotoxischen Arzneimitteln ist Vorsicht geboten (sehen VORSICHTSMASSNAHMEN ).
Patienten, die Neoral erhalten, benötigen eine häufige Überwachung des Serumkreatinins (siehe Besondere Überwachung unter DOSIERUNG UND ANWENDUNG ). Ältere Patienten sollten besonders sorgfältig überwacht werden, da mit zunehmendem Alter auch eine Abnahme der Nierenfunktion auftritt. Wenn die Patienten nicht ordnungsgemäß überwacht und die Dosen nicht ordnungsgemäß angepasst werden, kann die Ciclosporin-Therapie mit dem Auftreten struktureller Nierenschäden und anhaltender Nierenfunktionsstörung in Verbindung gebracht werden.
Ein Anstieg von Serumkreatinin und BUN kann während der Therapie mit Neoral auftreten und eine Verringerung der glomerulären Filtrationsrate widerspiegeln. Eine eingeschränkte Nierenfunktion erfordert jederzeit eine engmaschige Überwachung und eine häufige Dosisanpassung kann angezeigt sein. Häufigkeit und Schweregrad von Serum-Kreatinin-Erhöhungen nehmen mit Dosis und Dauer der Ciclosporin-Therapie zu. Diese Anstiege werden wahrscheinlich ohne Dosisreduktion oder Absetzen stärker ausgeprägt sein.
Da Neoral 100 mg nicht bioäquivalent zu Sandimmune ist, kann die Umstellung von Neoral auf Sandimmune im Verhältnis 1:1 (mg/kg/Tag) zu niedrigeren Cyclosporin-Blutkonzentrationen führen. Die Umstellung von Neoral auf Sandimmune sollte unter verstärkter Überwachung erfolgen, um eine mögliche Unterdosierung zu vermeiden.
Nieren-, Leber- und Herztransplantation
Nephrotoxizität
Cyclosporin, der Wirkstoff von Neoral, kann bei Anwendung in hohen Dosen Nephrotoxizität und Hepatotoxizität verursachen. Es ist nicht ungewöhnlich, dass die Serum-Kreatinin- und BUN-Spiegel während der Ciclosporin-Therapie erhöht sind. Diese Erhöhungen bei Nierentransplantationspatienten weisen nicht unbedingt auf eine Abstoßung hin, und jeder Patient muss vollständig untersucht werden, bevor eine Dosisanpassung eingeleitet wird.
Basierend auf den historischen Erfahrungen von Sandimmune mit Lösung zum Einnehmen wurde bei 25 % der Fälle von Nierentransplantationen, 38 % der Fälle von Herztransplantationen und 37 % der Fälle von Lebertransplantationen Nephrotoxizität im Zusammenhang mit Ciclosporin festgestellt. Eine leichte Nephrotoxizität wurde im Allgemeinen 2 bis 3 Monate nach der Nierentransplantation festgestellt und bestand aus einem Stillstand der präoperativen Erhöhungen von BUN und Kreatinin im Bereich von 35 bis 45 mg/dl bzw. 2,0 bis 2,5 mg/dl. Diese Erhöhungen waren häufig eine Reaktion auf eine Dosisreduktion von Ciclosporin.
Eine offenere Nephrotoxizität wurde früh nach der Transplantation beobachtet und war durch einen schnell ansteigenden BUN und Kreatinin gekennzeichnet. Da diese Ereignisse renalen Abstoßungsepisoden ähneln, muss darauf geachtet werden, zwischen ihnen zu unterscheiden. Diese Form der Nephrotoxizität spricht normalerweise auf eine Dosisreduktion von Ciclosporin an.
Obwohl keine spezifischen diagnostischen Kriterien gefunden wurden, die eine Nierentransplantatabstoßung zuverlässig von einer Arzneimitteltoxizität unterscheiden, wurde eine Reihe von Parametern signifikant mit dem einen oder anderen in Verbindung gebracht. Es sollte jedoch beachtet werden, dass bei bis zu 20 % der Patienten gleichzeitig Nephrotoxizität und Abstoßung auftreten können.
Eine Form einer Cyclosporin-assoziierten Nephropathie ist durch eine serielle Verschlechterung der Nierenfunktion und morphologische Veränderungen in den Nieren gekennzeichnet. Bei 5 % bis 15 % der Transplantatempfänger, die Ciclosporin erhalten haben, zeigt sich trotz Verringerung oder Absetzen der Ciclosporin-Therapie keine Verringerung des Anstiegs des Serum-Kreatinins. Nierenbiopsien dieser Patienten zeigen eine oder mehrere der folgenden Veränderungen: tubuläre Vakuolisierung, tubuläre Mikroverkalkungen, peritubulare Kapillarkongestion, Arteriolopathie und eine gestreifte Form von interstitieller Fibrose mit tubulärer Atrophie. Obwohl keine dieser morphologischen Veränderungen vollständig spezifisch ist, erfordert eine Diagnose einer Cyclosporin-assoziierten strukturellen Nephrotoxizität einen Nachweis dieser Befunde.
Bei der Betrachtung der Entwicklung einer Cyclosporin-assoziierten Nephropathie ist es bemerkenswert, dass mehrere Autoren über einen Zusammenhang zwischen dem Auftreten einer interstitiellen Fibrose und höheren kumulativen Dosen oder dauerhaft hohen zirkulierenden Talkonzentrationen von Cyclosporin berichtet haben. Dies gilt insbesondere während der ersten 6 Monate nach der Transplantation, wenn die Dosierung tendenziell am höchsten ist und wenn bei Nierenempfängern das Organ am anfälligsten für die toxischen Wirkungen von Ciclosporin zu sein scheint. Unter anderen beitragenden Faktoren zur Entwicklung von interstitieller Fibrose bei diesen Patienten sind eine verlängerte Perfusionszeit, eine warme Ischämiezeit sowie Episoden von akuter Toxizität und akuter und chronischer Abstoßung. Die Reversibilität der interstitiellen Fibrose und ihre Korrelation zur Nierenfunktion wurden noch nicht bestimmt. Es wurde über eine Reversibilität der Arteriolopathie nach Absetzen von Ciclosporin oder Herabsetzen der Dosis berichtet.
Eine eingeschränkte Nierenfunktion erfordert jederzeit eine engmaschige Überwachung und eine häufige Dosisanpassung kann angezeigt sein.
Im Falle einer schweren und anhaltenden Abstoßung, wenn die Notfalltherapie mit pulsierenden Steroiden und monoklonalen Antikörpern die Abstoßungsepisode nicht aufheben kann, kann es vorzuziehen sein, auf eine alternative immunsuppressive Therapie umzusteigen, anstatt die Neoral-Dosis auf übermäßige Blutkonzentrationen zu erhöhen.
Aufgrund der Möglichkeit einer additiven oder synergistischen Beeinträchtigung der Nierenfunktion ist bei gleichzeitiger Anwendung von Neoral mit anderen Arzneimitteln, die die Nierenfunktion beeinträchtigen können, Vorsicht geboten (siehe VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Thrombotische Mikroangiopathie
Gelegentlich haben Patienten ein Syndrom von Thrombozytopenie und mikroangiopathischer hämolytischer Anämie entwickelt, was zu einem Transplantatversagen führen kann. Die Vaskulopathie kann ohne Abstoßung auftreten und wird von einem heftigen Blutplättchenverbrauch innerhalb des Transplantats begleitet, wie durch Indium 111-markierte Blutplättchenstudien gezeigt wurde. Weder die Pathogenese noch das Management dieses Syndroms ist klar. Obwohl nach Reduktion oder Absetzen von Ciclosporin und 1) Gabe von Streptokinase und Heparin oder 2) Plasmapherese eine Auflösung eingetreten ist, scheint dies von einer frühen Erkennung mit Indium-111-markierten Blutplättchen-Scans abzuhängen (siehe NEBENWIRKUNGEN ).
Hyperkaliämie
Gelegentlich wurde bei einzelnen Patienten eine signifikante Hyperkaliämie (manchmal verbunden mit einer hyperchlorämischen metabolischen Azidose) und Hyperurikämie beobachtet.
Hepatotoxizität
Fälle von Hepatotoxizität und Leberschäden, einschließlich Cholestase, Gelbsucht, Hepatitis und Leberversagen, wurden bei mit Ciclosporin behandelten Patienten berichtet. Die meisten Berichte umfassten Patienten mit signifikanten Komorbiditäten, Grunderkrankungen und anderen Störfaktoren, einschließlich infektiöser Komplikationen und Komedikationen mit hepatotoxischem Potenzial. In einigen Fällen, hauptsächlich bei Transplantationspatienten, wurde über tödliche Verläufe berichtet (vgl NEBENWIRKUNGEN , Postmarketing-Erfahrung, Nieren-, Leber- und Herztransplantation ).
Hepatotoxizität, die sich in der Regel durch Erhöhungen der Leberenzyme und des Bilirubins manifestiert, wurde bei Patienten berichtet, die in klinischen Studien mit Ciclosporin behandelt wurden: 4 % bei Nierentransplantation, 7 % bei Herztransplantation und 4 % bei Lebertransplantation. Dies wurde normalerweise während des ersten Behandlungsmonats festgestellt, wenn hohe Dosen von Ciclosporin angewendet wurden. Die Erhöhungen der Chemie nahmen normalerweise mit einer Verringerung der Dosierung ab.
Malignome
Wie bei Patienten, die andere Immunsuppressiva erhalten, besteht bei Patienten, die Ciclosporin erhalten, ein erhöhtes Risiko für die Entwicklung von Lymphomen und anderen malignen Erkrankungen, insbesondere solchen der Haut. Patienten, die Ciclosporin einnehmen, sollten gewarnt werden, eine übermäßige Exposition gegenüber ultraviolettem Licht zu vermeiden. Das erhöhte Risiko scheint eher mit der Intensität und Dauer der Immunsuppression als mit der Anwendung spezifischer Wirkstoffe zusammenzuhängen. Wegen der Gefahr einer Überunterdrückung des Immunsystems, die zu einem erhöhten Infektions- oder Malignitätsrisiko führt, sollte ein Behandlungsschema, das mehrere Immunsuppressiva enthält, mit Vorsicht angewendet werden. Einige bösartige Erkrankungen können tödlich sein. Transplantationspatienten, die Ciclosporin erhalten, haben ein erhöhtes Risiko für schwere Infektionen mit tödlichem Ausgang.
Schwere Infektionen
Patienten, die Immunsuppressiva, einschließlich Neoral 100 mg, erhalten, haben ein erhöhtes Risiko, bakterielle, virale, Pilz- und Protozoeninfektionen, einschließlich opportunistischer Infektionen, zu entwickeln. Diese Infektionen können zu schwerwiegenden, einschließlich tödlichen Folgen führen (siehe Eingerahmte Warnung , und NEBENWIRKUNGEN ).
Polyoma-Virus-Infektionen
Patienten, die Immunsuppressiva, einschließlich Neoral 100 mg, erhalten, haben ein erhöhtes Risiko für opportunistische Infektionen, einschließlich Polyomavirus-Infektionen. Polyoma-Virusinfektionen bei Transplantationspatienten können schwerwiegende und manchmal tödliche Folgen haben. Dazu gehören Fälle von JC-Virus-assoziierter progressiver multifokaler Leukenzephalopathie (PML) und Polyoma-Virus-assoziierter Nephropathie (PVAN), insbesondere aufgrund einer BK-Virusinfektion, die bei Patienten beobachtet wurden, die Ciclosporin erhielten. PVAN ist mit schwerwiegenden Folgen verbunden, einschließlich einer Verschlechterung der Nierenfunktion und des Verlusts von Nierentransplantaten (siehe NEBENWIRKUNGEN , Postmarketing-Erfahrung, Nieren-, Leber- und Herztransplantation ). Die Patientenüberwachung kann dabei helfen, Risikopatienten für PVAN zu erkennen.
Fälle von PML wurden bei mit Neoral behandelten Patienten berichtet. PML, die manchmal tödlich verläuft, zeigt sich häufig mit Hemiparese, Apathie, Verwirrtheit, kognitiven Mängeln und Ataxie. Zu den Risikofaktoren für PML gehören die Behandlung mit immunsuppressiven Therapien und die Beeinträchtigung der Immunfunktion. Bei immunsupprimierten Patienten sollten Ärzte bei Patienten, die über neurologische Symptome berichten, eine PML in der Differentialdiagnose in Betracht ziehen und die Konsultation eines Neurologen als klinisch indiziert in Betracht ziehen.
Es sollte erwogen werden, die Gesamtimmunsuppression bei Transplantationspatienten zu reduzieren, die eine PML oder PVAN entwickeln. Eine reduzierte Immunsuppression kann jedoch das Transplantat gefährden.
Neurotoxizität
Es liegen Berichte über Konvulsionen bei erwachsenen und pädiatrischen Patienten vor, die Ciclosporin erhielten, insbesondere in Kombination mit hochdosiertem Methylprednisolon.
Enzephalopathie, einschließlich des posterioren reversiblen Enzephalopathie-Syndroms (PRES), wurde sowohl in Post-Marketing-Berichten als auch in der Literatur beschrieben. Zu den Manifestationen gehören Bewusstseinsstörungen, Krämpfe, Sehstörungen (einschließlich Blindheit), Verlust der Motorik, Bewegungsstörungen und psychiatrische Störungen. In vielen Fällen wurden Veränderungen in der weißen Substanz mit bildgebenden Verfahren und pathologischen Proben festgestellt. Prädisponierende Faktoren wie Bluthochdruck, Hypomagnesiämie, Hypocholesterinämie, hochdosierte Kortikosteroide, hohe Cyclosporin-Blutkonzentrationen und Graft-versus-Host-Erkrankung wurden in vielen, aber nicht allen gemeldeten Fällen festgestellt. Die Veränderungen waren in den meisten Fällen nach Absetzen von Ciclosporin reversibel, und in einigen Fällen wurde nach Dosisreduktion eine Besserung festgestellt. Es scheint, dass Patienten, die eine Lebertransplantation erhalten, anfälliger für Enzephalopathie sind als Patienten, die eine Nierentransplantation erhalten. Eine weitere seltene Manifestation einer Cyclosporin-induzierten Neurotoxizität, die bei Transplantationspatienten häufiger auftritt als bei anderen Indikationen, ist ein Papillenödem mit möglicher Sehbehinderung als Folge einer benignen intrakraniellen Hypertonie.
Bei der Anwendung von Ciclosporin mit nephrotoxischen Arzneimitteln ist Vorsicht geboten (siehe VORSICHTSMASSNAHMEN ).
Rheumatoide Arthritis
Bei 6 von 60 (10 %) Patienten mit rheumatoider Arthritis wurde nach einer durchschnittlichen Behandlungsdauer von 19 Monaten in Nierenbiopsien eine Cyclosporin-Nephropathie festgestellt. Nur einer dieser 6 Patienten wurde mit einer Dosis von ≤ 4 mg/kg/Tag behandelt. Das Serumkreatinin verbesserte sich bei allen bis auf einen Patienten nach Absetzen von Ciclosporin. Der „maximale Kreatininanstieg“ scheint ein Faktor bei der Vorhersage einer Cyclosporin-Nephropathie zu sein.
Wie bei anderen Immunsuppressiva besteht auch bei Ciclosporin die Möglichkeit eines erhöhten Auftretens maligner Lymphome. Es ist nicht klar, ob das Risiko unter Ciclosporin größer ist als das bei Patienten mit rheumatoider Arthritis oder bei Patienten mit rheumatoider Arthritis, die für diese Indikation eine zytotoxische Behandlung erhalten. Fünf Fälle von Lymphomen wurden entdeckt: vier in einer Untersuchung von etwa 2.300 Patienten, die mit Cyclosporin gegen rheumatoide Arthritis behandelt wurden, und ein weiterer Fall von Lymphomen wurde in einer klinischen Studie gemeldet. Obwohl andere Tumore (12 Hautkrebsarten, 24 solide Tumoren verschiedener Art und 1 multiples Myelom) in dieser Umfrage ebenfalls gemeldet wurden, unterstützten epidemiologische Analysen außer bei malignen Lymphomen keinen Zusammenhang mit Ciclosporin.
Die Patienten sollten vor und während der Behandlung mit Neoral 25 mg sorgfältig auf die Entwicklung maligner Erkrankungen untersucht werden. Darüber hinaus kann die Anwendung von Neoral 25 mg zusammen mit anderen Immunsuppressiva eine übermäßige Immunsuppression hervorrufen, die bekanntermaßen das Malignitätsrisiko erhöht.
Schuppenflechte
(Siehe auch Eingerahmte Warnung für Psoriasis )
Da Ciclosporin ein starkes Immunsuppressivum mit einer Reihe potenziell schwerwiegender Nebenwirkungen ist, sollten die Risiken und Vorteile der Anwendung von Neoral 100 mg vor der Behandlung von Patienten mit Psoriasis abgewogen werden. Cyclosporin, der Wirkstoff in Neoral, kann Nephrotoxizität und Bluthochdruck verursachen (vgl VORSICHTSMASSNAHMEN ) und das Risiko steigt mit zunehmender Dosis und Therapiedauer. Patienten mit möglicherweise erhöhtem Risiko, wie z. B. Patienten mit anomaler Nierenfunktion, unkontrolliertem Bluthochdruck oder bösartigen Erkrankungen, sollten Neoral nicht erhalten.
Eine Nierenfunktionsstörung ist eine mögliche Folge von Neoral, daher muss die Nierenfunktion während der Therapie überwacht werden.
Bei Patienten, die Neoral 100 mg erhalten, ist eine häufige Überwachung des Serumkreatinins erforderlich (siehe Besondere Überwachung unter DOSIERUNG UND ANWENDUNG ). Ältere Patienten sollten besonders sorgfältig überwacht werden, da mit zunehmendem Alter auch eine Abnahme der Nierenfunktion auftritt. Wenn die Patienten nicht ordnungsgemäß überwacht und die Dosen nicht richtig angepasst werden, kann die Ciclosporin-Therapie zu strukturellen Nierenschäden und anhaltender Nierenfunktionsstörung führen.
Während der Therapie mit Neoral 25 mg kann es zu einem Anstieg von Serum-Kreatinin und BUN kommen, der eine Verringerung der glomerulären Filtrationsrate widerspiegelt.
Nierenbiopsien von 86 Psoriasis-Patienten, die über eine mittlere Dauer von 23 Monaten mit 1,2 bis 7,6 mg/kg/Tag Ciclosporin behandelt wurden, zeigten Hinweise auf eine Ciclosporin-Nephropathie bei 18/86 (21 %) der Patienten. Die Pathologie bestand aus renaler tubulärer Atrophie und interstitieller Fibrose. Bei einer wiederholten Biopsie von 13 dieser Patienten, die für durchschnittlich 2 weitere Jahre verschiedene Ciclosporin-Dosierungen erhielten, stieg die Zahl mit Ciclosporin-induzierter Nephropathie auf 26/86 (30 %). Die Mehrheit der Patienten (19/26) erhielt eine Dosis von ≥ 5,0 mg/kg/Tag (die höchste empfohlene Dosis beträgt 4 mg/kg/Tag). Die Patienten erhielten auch Ciclosporin für mehr als 15 Monate (18/26) und/oder hatten einen klinisch signifikanten Anstieg des Serumkreatinins für mehr als 1 Monat (21/26). Bei 7 von 11 Patienten, bei denen die Ciclosporin-Therapie abgebrochen wurde, kehrten die Kreatininspiegel in den Normalbereich zurück.
Bei mit Ciclosporin behandelten Psoriasis-Patienten besteht ein erhöhtes Risiko für die Entwicklung von Haut- und lymphoproliferativen Malignomen. Das relative Risiko für maligne Erkrankungen ist vergleichbar mit dem bei Psoriasis-Patienten, die mit anderen Immunsuppressiva behandelt wurden.
Bei 32 (2,2 %) von 1439 Psoriasis-Patienten, die weltweit mit Ciclosporin behandelt wurden, wurden Tumore aus klinischen Studien berichtet. Weitere Tumore wurden bei 7 Patienten aus der Postmarketing-Erfahrung mit Ciclosporin berichtet. Malignome der Haut wurden bei 16 (1,1 %) dieser Patienten berichtet; alle außer 2 von ihnen hatten zuvor eine PUVA-Therapie erhalten. Methotrexat wurde von 7 Patienten erhalten.
UVB und Steinkohlenteer wurden von 2 bzw. 3 Patienten verwendet. Sieben Patienten hatten entweder eine Vorgeschichte von Hautkrebs oder eine potenziell prädisponierende Läsion war vor der Cyclosporin-Exposition vorhanden. Von den 16 Patienten mit Hautkrebs hatten 11 Patienten 18 Plattenepithelkarzinome und 7 Patienten 10 Basalzellkarzinome.
Es gab zwei lymphoproliferative Malignome; ein Fall von Non-Hodgkin-Lymphom, der eine Chemotherapie erforderte, und ein Fall von Mycosis fungoides, die sich nach Absetzen von Ciclosporin spontan zurückbildete. Es gab vier Fälle von gutartiger lymphozytärer Infiltration: 3 bildeten sich spontan nach Absetzen von Ciclosporin zurück, während der vierte sich trotz Fortführung des Medikaments zurückbildete. Der Rest der malignen Erkrankungen, 13 Fälle (0,9 %), betraf verschiedene Organe.
Patienten sollten nicht gleichzeitig mit Ciclosporin und PUVA oder UVB, einer anderen Strahlentherapie oder anderen Immunsuppressiva behandelt werden, da die Möglichkeit einer übermäßigen Immunsuppression und des daraus resultierenden Risikos von Malignomen besteht (sehen KONTRAINDIKATIONEN ). Die Patienten sollten auch darauf hingewiesen werden, sich angemessen zu schützen, wenn sie sich in der Sonne aufhalten, und übermäßige Sonnenexposition zu vermeiden. Die Patienten sollten vor und während der Behandlung gründlich auf das Vorhandensein maligner Erkrankungen untersucht werden, wobei daran zu denken ist, dass maligne Läsionen durch Psoriasis-Plaques verdeckt werden können. Hautläsionen, die nicht typisch für Psoriasis sind, sollten vor Beginn der Behandlung biopsiert werden. Patienten sollten mit Neoral nur nach vollständiger Abheilung verdächtiger Läsionen und nur dann behandelt werden, wenn es keine anderen Behandlungsoptionen gibt (siehe Spezielle Überwachung für Psoriasis-Patienten ).
Besondere Hilfsstoffe
Alkohol (Ethanol)
Der Alkoholgehalt (vgl BEZEICHNUNG von Neoral 100 mg sollte berücksichtigt werden, wenn es an Patienten verabreicht wird, bei denen der Alkoholkonsum vermieden oder auf ein Minimum reduziert werden sollte, z. B. schwangere oder stillende Frauen, bei Patienten mit Lebererkrankungen oder Epilepsie, bei Alkoholikern oder pädiatrischen Patienten. Bei einem 70 kg schweren Erwachsenen würde die maximale orale Tagesdosis etwa 1 Gramm Alkohol abgeben, was etwa 6 % der in einem Standardgetränk enthaltenen Alkoholmenge entspricht.
VORSICHTSMASSNAHMEN
Allgemein
Hypertonie
Cyclosporin ist der Wirkstoff von Neoral. Hypertonie ist eine häufige Nebenwirkung der Ciclosporin-Therapie, die andauern kann (siehe NEBENWIRKUNGEN und DOSIERUNG UND ANWENDUNG für Überwachungsempfehlungen). Leichter oder mittelschwerer Bluthochdruck tritt häufiger auf als schwerer Bluthochdruck und die Inzidenz nimmt mit der Zeit ab. Bei Empfängern von Nieren-, Leber- und Herztransplantaten, die mit Ciclosporin behandelt wurden, kann eine antihypertensive Therapie erforderlich sein (siehe Spezielle Überwachung der rheumatoiden Arthritis und Psoriasis-Patienten ). Da Ciclosporin jedoch eine Hyperkaliämie verursachen kann, sollten kaliumsparende Diuretika nicht angewendet werden. Während Calciumantagonisten wirksame Mittel bei der Behandlung von Cyclosporin-assoziierter Hypertonie sein können, können sie den Cyclosporin-Metabolismus stören (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ).
Impfung
Während der Behandlung mit Ciclosporin kann die Impfung weniger wirksam sein; und die Verwendung attenuierter Lebendimpfstoffe sollte vermieden werden.
Spezielle Überwachung von Patienten mit rheumatoider Arthritis
Vor Beginn der Behandlung sollte eine sorgfältige körperliche Untersuchung durchgeführt werden, einschließlich Blutdruckmessungen (mindestens zweimal) und zweier Kreatininwerte zur Bestimmung des Ausgangswertes. Blutdruck und Serumkreatinin sollten während der ersten 3 Monate alle 2 Wochen und dann monatlich, wenn der Patient stabil ist, bestimmt werden. Es ist ratsam, das Serumkreatinin und den Blutdruck immer nach einer Erhöhung der Dosis von nichtsteroidalen Antirheumatika (NSAIDs) und nach Beginn einer neuen NSAID-Therapie während der Behandlung mit Neoral 25 mg zu überwachen. Bei gleichzeitiger Anwendung mit Methotrexat wird empfohlen, das Blutbild und die Leberfunktionstests monatlich zu kontrollieren (siehe VORSICHTSMASSNAHMEN , Allgemein, Bluthochdruck ).
Bei Patienten, die Ciclosporin erhalten, sollte die Neoral-Dosis um 25 % bis 50 % verringert werden, wenn Bluthochdruck auftritt. Bei anhaltender Hypertonie sollte die Dosis von Neoral 100 mg weiter reduziert oder der Blutdruck mit blutdrucksenkenden Mitteln kontrolliert werden. In den meisten Fällen ist der Blutdruck nach Absetzen von Ciclosporin auf den Ausgangswert zurückgekehrt.
In placebokontrollierten Studien mit Patienten mit rheumatoider Arthritis traten systolische Hypertonie (definiert als das Auftreten von zwei systolischen Blutdruckwerten > 140 mmHg) und diastolische Hypertonie (definiert als zwei diastolische Blutdruckwerte > 90 mmHg) bei 33 % bzw. 19 % der Patienten auf Patienten, die mit Cyclosporin behandelt wurden. Die entsprechenden Placeboraten waren 22 % und 8 %.
Spezielle Überwachung für Psoriasis-Patienten
Vor Beginn der Behandlung sollte eine sorgfältige dermatologische und körperliche Untersuchung einschließlich Blutdruckmessung (mindestens zweimal) durchgeführt werden. Da Neoral ein Immunsuppressivum ist, sollten Patienten bei ihrer ersten körperlichen Untersuchung auf das Vorhandensein einer okkulten Infektion und anfänglich und während der gesamten Behandlung mit Neoral auf das Vorhandensein von Tumoren untersucht werden. Hautläsionen, die nicht typisch für Psoriasis sind, sollten vor Beginn der Behandlung mit Neoral biopsiert werden. Patienten mit bösartigen oder prämalignen Hautveränderungen sollten mit Neoral 100 mg nur nach entsprechender Behandlung solcher Läsionen und wenn keine andere Behandlungsmöglichkeit besteht, behandelt werden.
Baseline-Labors sollten Serumkreatinin (bei zwei Gelegenheiten), BUN, CBC, Serummagnesium, Kalium, Harnsäure und Lipide umfassen.
Das Risiko einer Ciclosporin-Nephropathie ist verringert, wenn die Anfangsdosis niedrig ist (2,5 mg/kg/Tag), die Höchstdosis 4,0 mg/kg/Tag nicht übersteigt, das Serumkreatinin während der Gabe von Ciclosporin und die Dosis von Neoral regelmäßig überwacht werden 25 mg wird verringert, wenn der Anstieg des Kreatinins größer oder gleich 25 % über dem Spiegel des Patienten vor der Behandlung liegt. Der Kreatininanstieg ist im Allgemeinen reversibel, wenn die Neoral-Dosis rechtzeitig verringert oder abgesetzt wird.
Serumkreatinin und BUN sollten während der ersten 3 Monate der Therapie alle 2 Wochen und dann monatlich, wenn der Patient stabil ist, bestimmt werden. Wenn das Serum-Kreatinin größer oder gleich 25 % über dem Vorbehandlungswert des Patienten liegt, sollte die Serum-Kreatinin-Untersuchung innerhalb von zwei Wochen wiederholt werden. Wenn die Veränderung des Serumkreatinins größer oder gleich 25 % über dem Ausgangswert bleibt, sollte Neoral 25 mg um 25 % bis 50 % reduziert werden. Wenn bei Jederzeit das Serumkreatinin um mehr als oder gleich 50 % über den Wert vor der Behandlung ansteigt, sollte Neoral 25 mg um 25 % bis 50 % reduziert werden. Neoral sollte abgesetzt werden, wenn nach zwei Dosisänderungen keine Reversibilität (innerhalb von 25 % des Ausgangswerts) des Serumkreatinins erreicht wird. Es ist ratsam, das Serumkreatinin nach einer Erhöhung der Dosis nichtsteroidaler entzündungshemmender Arzneimittel und nach Beginn einer neuen nichtsteroidalen entzündungshemmenden Therapie während der Behandlung mit Neoral 25 mg zu überwachen.
Der Blutdruck sollte während der ersten 3 Monate der Therapie alle 2 Wochen und dann monatlich, wenn der Patient stabil ist, oder häufiger, wenn Dosisanpassungen vorgenommen werden, bestimmt werden. Bei Patienten ohne vorangegangene Hypertonie in der Anamnese vor Beginn der Behandlung mit Neoral sollte das Medikament um 25 % bis 50 % reduziert werden, wenn eine anhaltende Hypertonie festgestellt wird. Wenn der Patient trotz mehrfacher Reduktionen von Neoral 25 mg weiterhin Bluthochdruck hat, sollte Neoral abgesetzt werden. Bei Patienten mit behandeltem Bluthochdruck sollte vor Beginn der Therapie mit Neoral 100 mg ihre Medikation angepasst werden, um den Bluthochdruck während der Behandlung mit Neoral zu kontrollieren. Neoral 100 mg sollte abgesetzt werden, wenn eine Änderung des Blutdruckmanagements nicht wirksam oder tolerierbar ist.
CBC, Harnsäure, Kalium, Lipide und Magnesium sollten in den ersten 3 Monaten der Therapie ebenfalls alle 2 Wochen und dann monatlich, wenn der Patient stabil ist, oder häufiger, wenn Dosisanpassungen vorgenommen werden, überwacht werden. Die Dosierung von Neoral 25 mg sollte bei jeder Anomalie von klinischer Bedeutung um 25 % bis 50 % reduziert werden.
In kontrollierten Studien mit Ciclosporin bei Psoriasis-Patienten korrelierten die Ciclosporin-Blutkonzentrationen weder mit einer Besserung noch mit Nebenwirkungen wie Nierenfunktionsstörungen.
Labortests
Bei allen mit Ciclosporin behandelten Patienten sollten die Nieren- und Leberfunktion wiederholt durch Messung von Serum-Kreatinin, BUN, Serum-Bilirubin und Leberenzymen bestimmt werden. Serumlipide, Magnesium und Kalium sollten ebenfalls überwacht werden.
Die Cyclosporin-Blutkonzentrationen sollten bei Transplantationspatienten routinemäßig überwacht werden (vgl DOSIERUNG UND ANWENDUNG , Überwachung der Blutkonzentration bei Transplantationspatienten ) und bei Patienten mit rheumatoider Arthritis regelmäßig überwacht.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Kanzerogenitätsstudien wurden an männlichen und weiblichen Ratten und Mäusen durchgeführt. In der 78-wöchigen Studie mit Mäusen wurde ein statistisch signifikanter Trend für lymphozytäre Lymphome bei Frauen gefunden, und die Inzidenz hepatozellulärer Karzinome bei Männern mit mittlerer Dosis überstieg den Kontrollwert signifikant. In der 24-monatigen Studie an Ratten überstiegen Inselzelladenome der Bauchspeicheldrüse die Kontrollrate in der niedrigen Dosierung signifikant. Die in den Studien an Mäusen und Ratten verwendeten Dosen betrugen das 0,01- bis 0,16-fache der klinischen Erhaltungsdosis (6 mg/kg). Die hepatozellulären Karzinome und Inselzelladenome des Pankreas waren nicht dosisabhängig. Veröffentlichte Berichte weisen darauf hin, dass die gleichzeitige Behandlung von haarlosen Mäusen mit UV-Bestrahlung und Cyclosporin oder anderen immunsuppressiven Mitteln die Zeit bis zur Hauttumorbildung im Vergleich zur UV-Bestrahlung allein verkürzt.
Cyclosporin war in geeigneten Testsystemen nicht mutagen. Cyclosporin hat sich im Ames-Test, im V79-HGPRT-Test, im Mikronukleustest bei Mäusen und chinesischen Hamstern, im Chromosomenaberrationstest im Knochenmark chinesischer Hamster, im Maus-Dominant-Letal-Assay und im Test nicht als mutagen/genotoxisch erwiesen DNA-Reparaturtest im Sperma von behandelten Mäusen. Eine kürzlich durchgeführte Studie, die die Induktion des Schwesterchromatidaustauschs (SCE) durch Cyclosporin unter Verwendung menschlicher Lymphozyten in vitro analysierte, gab Hinweise auf eine positive Wirkung (dh Induktion von SCE) bei hohen Konzentrationen in diesem System. In zwei veröffentlichten Forschungsstudien zeigten Kaninchen, die Ciclosporin in utero (10 mg/kg/Tag subkutan) ausgesetzt waren, bis zu einem Alter von 35 Wochen eine verringerte Anzahl von Nephronen, Nierenhypertrophie, systemische Hypertonie und fortschreitende Niereninsuffizienz. Trächtige Ratten, die 12 mg/kg/Tag Ciclosporin intravenös (das Doppelte der empfohlenen intravenösen Dosis beim Menschen) erhielten, hatten Föten mit einer erhöhten Inzidenz von Ventrikelseptumdefekten. Diese Befunde wurden bei anderen Arten nicht nachgewiesen und ihre Relevanz für den Menschen ist unbekannt.
In Studien an männlichen und weiblichen Ratten wurde keine Beeinträchtigung der Fertilität nachgewiesen.
Weit verbreitete Papillomatose der Haut wurde nach chronischer Behandlung von Hunden mit Ciclosporin mit dem 9-fachen der anfänglichen Psoriasis-Behandlungsdosis von 2,5 mg/kg beim Menschen beobachtet, wobei die Dosen auf der Grundlage der Körperoberfläche ausgedrückt werden. Diese Papillomatose zeigte eine spontane Regression nach Absetzen von Ciclosporin.
Eine erhöhte Malignitätsinzidenz ist eine anerkannte Komplikation der Immunsuppression bei Empfängern von Organtransplantaten und Patienten mit rheumatoider Arthritis und Psoriasis. Die häufigsten Formen von Neoplasien sind das Non-Hodgkin-Lymphom und Karzinome der Haut. Das Risiko für maligne Erkrankungen bei Ciclosporin-Empfängern ist höher als bei der normalen, gesunden Bevölkerung, aber ähnlich dem bei Patienten, die andere immunsuppressive Therapien erhalten. Eine Verringerung oder Beendigung der Immunsuppression kann zu einer Rückbildung der Läsionen führen.
Bei Psoriasis-Patienten, die mit Ciclosporin behandelt wurden, wurde über die Entwicklung maligner Erkrankungen, insbesondere der Haut, berichtet (s WARNUNGEN ). Psoriasis-untypische Hautläsionen sollten vor Beginn der Ciclosporin-Behandlung biopsiert werden. Patienten mit bösartigen oder prämalignen Hautveränderungen sollten mit Ciclosporin nur nach entsprechender Behandlung solcher Läsionen und wenn keine andere Behandlungsmöglichkeit besteht, behandelt werden.
Schwangerschaft
Tierexperimentelle Studien haben eine Reproduktionstoxizität bei Ratten und Kaninchen gezeigt. Cyclosporin ergab in den Standardtestsystemen bei oraler Applikation (Ratten bis 17 mg/kg und Kaninchen bis 30 mg/kg pro Tag oral) keine Hinweise auf mutagene oder teratogene Wirkungen. Nur bei maternaltoxischen Dosierungen wurden Nebenwirkungen beobachtet in Reproduktionsstudien an Ratten. Cyclosporin hat sich bei Ratten und Kaninchen nach oraler Verabreichung in für das Muttertier toxischen Dosen als embryo- und fetotoxisch erwiesen. Fetale Toxizität wurde bei Ratten beim 0,8-Fachen und bei Kaninchen beim 5,4-Fachen der Transplantationsdosen beim Menschen von 6,0 mg/kg festgestellt, wobei Dosiskorrekturen auf der Körperoberfläche basieren. Cyclosporin war embryo- und fetotoxisch, was durch eine erhöhte prä- und postnatale Sterblichkeit und ein reduziertes fötales Gewicht zusammen mit einer damit verbundenen Skelettretardierung angezeigt wurde.
Es liegen keine angemessenen und gut kontrollierten Studien bei schwangeren Frauen vor, daher sollte Neoral während der Schwangerschaft nicht angewendet werden, es sei denn, der potenzielle Nutzen für die Mutter rechtfertigt das potenzielle Risiko für den Fötus.
Bei schwangeren Transplantatempfängerinnen, die mit Immunsuppressiva behandelt werden, ist das Risiko einer Frühgeburt erhöht. Die folgenden Daten stellen die berichteten Ergebnisse von 116 Schwangerschaften bei Frauen dar, die Ciclosporin während der Schwangerschaft erhielten, von denen 90 % Transplantationspatientinnen waren und die meisten Ciclosporin während der gesamten Schwangerschaft erhielten. Die einzigen konsistenten Anomaliemuster waren Frühgeburten (Schwangerschaftsdauer von 28 bis 36 Wochen) und ein niedriges Geburtsgewicht für das Gestationsalter. Sechzehn fötale Verluste traten auf. Die meisten Schwangerschaften (85 von 100) wurden durch Störungen kompliziert; einschließlich Präeklampsie, Eklampsie, vorzeitige Wehen, Abruptio placentae, Oligohydramnion, Rh-Inkompatibilität und fetoplazentare Dysfunktion. Frühgeburten traten bei 47 % auf. Sieben Missbildungen wurden bei 5 lebensfähigen Säuglingen und in 2 Fällen von fetalem Verlust gemeldet. Achtundzwanzig Prozent der Säuglinge waren klein für das Gestationsalter. Neonatale Komplikationen traten bei 27 % auf. Daher sollten Risiken und Nutzen der Anwendung von Neoral während der Schwangerschaft sorgfältig abgewogen werden.
Es liegt eine begrenzte Anzahl von Beobachtungen bei Kindern vor, die im Mutterleib Cyclosporin ausgesetzt waren, bis zu einem Alter von etwa 7 Jahren. Nierenfunktion und Blutdruck dieser Kinder waren normal.
Wegen der möglichen Störung der mütterlich-fötalen Interaktion sollte das Nutzen-Risiko-Verhältnis der Anwendung von Neoral bei Psoriasis-Patientinnen während der Schwangerschaft sorgfältig abgewogen werden, wobei ein Absetzen von Neoral ernsthaft erwogen werden sollte.
Auch der Alkoholgehalt der Neoral 100mg-Formulierungen sollte bei Schwangeren berücksichtigt werden (vgl WARNUNGEN , Besondere Hilfsstoffe ).
Stillende Mutter
Cyclosporin ist in der Muttermilch vorhanden. Aufgrund des Potenzials schwerwiegender Arzneimittelnebenwirkungen bei gestillten Säuglingen von Neoral 100 mg sollte eine Entscheidung getroffen werden, ob das Stillen oder das Arzneimittel abgesetzt werden soll, wobei die Bedeutung des Arzneimittels für die Mutter zu berücksichtigen ist. Neoral enthält Ethanol. Ethanol ist in der Muttermilch in ähnlichen Konzentrationen wie im mütterlichen Serum vorhanden und wird, wenn es in der Muttermilch vorhanden ist, von einem gestillten Säugling oral aufgenommen (siehe WARNUNGEN ).
Pädiatrische Verwendung
Obwohl keine angemessenen und gut kontrollierten Studien bei Kindern durchgeführt wurden, haben Transplantationsempfänger im Alter von einem Jahr Neoral ohne ungewöhnliche Nebenwirkungen erhalten. Die Sicherheit und Wirksamkeit der Behandlung mit Neoral bei Kindern unter 18 Jahren mit juveniler rheumatoider Arthritis oder Psoriasis wurde nicht nachgewiesen.
Geriatrische Verwendung
In klinischen Studien zu rheumatoider Arthritis mit Ciclosporin waren 17,5 % der Patienten 65 Jahre oder älter. Diese Patienten entwickelten während der Therapie mit größerer Wahrscheinlichkeit eine systolische Hypertonie und zeigten nach 3 bis 4 Monaten Therapie mit größerer Wahrscheinlichkeit einen Anstieg des Serumkreatinins um ≥ 50 % über den Ausgangswert.
Klinische Studien mit Neoral 100 mg bei Transplantations- und Psoriasispatienten schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Es liegen nur minimale Erfahrungen mit einer Ciclosporin-Überdosierung vor. Erzwungenes Erbrechen und Magenspülung können bis zu 2 Stunden nach der Verabreichung von Neoral sinnvoll sein. Vorübergehende Hepatotoxizität und Nephrotoxizität können auftreten, die nach Absetzen des Arzneimittels verschwinden sollten. Orale Dosen von Ciclosporin bis zu 10 g (etwa 150 mg/kg) wurden mit relativ geringen klinischen Folgen, wie Erbrechen, Schläfrigkeit, Kopfschmerzen, Tachykardie und bei einigen Patienten mittelschwerer, reversibler Beeinträchtigung der Nierenfunktion, vertragen. Es wurde jedoch über schwerwiegende Vergiftungssymptome nach versehentlicher parenteraler Überdosierung mit Ciclosporin bei Frühgeborenen berichtet. In allen Fällen einer Überdosierung sollten allgemeine unterstützende Maßnahmen und eine symptomatische Behandlung durchgeführt werden. Cyclosporin ist nicht in großem Umfang dialysierbar und wird auch nicht gut durch Aktivkohle-Hämoperfusion ausgeschieden. Die orale Dosis, bei der schätzungsweise die Hälfte der Versuchstiere stirbt, beträgt das 31-fache, 39-fache und > 54-fache der menschlichen Erhaltungsdosis für Transplantationspatienten (6 mg/kg; Korrekturen basierend auf der Körperoberfläche) bei Mäusen, Ratten und Kaninchen .
KONTRAINDIKATIONEN
Allgemein
Neoral 100 mg ist kontraindiziert bei Patienten mit einer Überempfindlichkeit gegenüber Ciclosporin oder einem der Bestandteile der Formulierung.
Rheumatoide Arthritis
Patienten mit rheumatoider Arthritis mit anomaler Nierenfunktion, unkontrolliertem Bluthochdruck oder bösartigen Erkrankungen sollten Neoral nicht erhalten.
Schuppenflechte
Psoriasis-Patienten, die mit Neoral 100 mg behandelt werden, sollten keine gleichzeitige PUVA- oder UVB-Therapie, Methotrexat oder andere immunsuppressive Mittel, Steinkohlenteer oder Strahlentherapie erhalten. Psoriasis-Patienten mit abnormer Nierenfunktion, unkontrolliertem Bluthochdruck oder bösartigen Erkrankungen sollten Neoral nicht erhalten.
KLINISCHE PHARMAKOLOGIE
Cyclosporin ist ein starkes immunsuppressives Mittel, das bei Tieren das Überleben von allogenen Transplantaten verlängert, die Haut, Niere, Leber, Herz, Bauchspeicheldrüse, Knochenmark, Dünndarm und Lunge betreffen. Es wurde gezeigt, dass Cyclosporin eine gewisse humorale Immunität und in größerem Umfang zellvermittelte Immunreaktionen wie Allotransplantatabstoßung, verzögerte Überempfindlichkeit, experimentelle allergische Enzephalomyelitis, Freund-Adjuvans-Arthritis und Graft-versus-Host-Erkrankung bei vielen Tierarten für eine Vielzahl von Organen unterdrückt .
Die Wirksamkeit von Ciclosporin resultiert aus der spezifischen und reversiblen Hemmung immunkompetenter Lymphozyten in der G0- und G1-Phase des Zellzyklus. T-Lymphozyten werden bevorzugt gehemmt. Die T-Helferzelle ist das Hauptziel, obwohl die T-Suppressorzelle auch unterdrückt werden kann. Cyclosporin hemmt auch die Produktion und Freisetzung von Lymphokinen, einschließlich Interleukin-2.
Bei Tieren wurden keine Auswirkungen auf die phagozytische Funktion (Veränderungen der Enzymsekretion, chemotaktische Migration von Granulozyten, Migration von Makrophagen, Kohlenstoff-Clearance in vivo) festgestellt. Cyclosporin verursacht in Tiermodellen oder beim Menschen keine Knochenmarksuppression.
Pharmakokinetik
Die immunsuppressive Aktivität von Cyclosporin ist hauptsächlich auf die Muttersubstanz zurückzuführen. Nach oraler Gabe ist die Resorption von Cyclosporin unvollständig. Das Ausmaß der Resorption von Ciclosporin hängt vom einzelnen Patienten, der Patientenpopulation und der Formulierung ab. Die Elimination von Cyclosporin erfolgt hauptsächlich biliär, wobei nur 6 % der Dosis (Ausgangssubstanz und Metaboliten) mit dem Urin ausgeschieden werden. Die Disposition von Cyclosporin aus dem Blut ist im Allgemeinen zweiphasig, mit einer terminalen Halbwertszeit von ungefähr 8,4 Stunden (Bereich 5 bis 18 Stunden). Nach intravenöser Verabreichung beträgt die Blutclearance von Ciclosporin (Assay: HPLC) bei erwachsenen Empfängern von Nieren- oder Leberallotransplantaten etwa 5 bis 7 ml/min/kg. Die Cyclosporin-Clearance aus dem Blut scheint bei Herztransplantationspatienten etwas langsamer zu sein.
Die Neoral-Weichgelatinekapseln (Cyclosporin-Kapseln, USP) MODIFIED und Neoral Oral Solution (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIED sind bioäquivalent. Neoral 25 mg Lösung zum Einnehmen, verdünnt mit Orangensaft oder Apfelsaft, ist bioäquivalent zu Neoral Lösung zum Einnehmen, verdünnt mit Wasser. Die Wirkung von Milch auf die Bioverfügbarkeit von Cyclosporin bei Verabreichung als Neoral Lösung zum Einnehmen wurde nicht untersucht.
Die Beziehung zwischen verabreichter Dosis und Exposition (Fläche unter der Konzentrations-Zeit-Kurve, AUC) ist innerhalb des therapeutischen Dosisbereichs linear. Die interindividuelle Variabilität (gesamt, % VK) der Ciclosporin-Exposition (AUC) bei Verabreichung von Neoral oder Sandimmune reicht von etwa 20 % bis 50 % bei Nierentransplantationspatienten. Diese interindividuelle Variabilität trägt zur Notwendigkeit der Individualisierung des Dosierungsschemas für eine optimale Therapie bei (vgl DOSIERUNG UND ANWENDUNG ).
Die intraindividuelle Variabilität der AUC bei Nierentransplantatempfängern (% CV) betrug 9 % bis 21 % für Neoral und 19 % bis 26 % für Sandimmune. In denselben Studien betrug die intraindividuelle Variabilität der Talkonzentrationen (%CV) 17 % bis 30 % für Neoral und 16 % bis 38 % für Sandimmune.
Absorption
Neoral hat im Vergleich zu Sandimmune eine erhöhte Bioverfügbarkeit. Die absolute Bioverfügbarkeit von Ciclosporin, das als Sandimmun verabreicht wird, hängt von der Patientenpopulation ab und wird auf weniger als 10 % bei Lebertransplantationspatienten und bis zu 89 % bei einigen Nierentransplantationspatienten geschätzt. Die absolute Bioverfügbarkeit von als Neoral verabreichtem Cyclosporin wurde bei Erwachsenen nicht bestimmt. In Studien mit Patienten mit Nierentransplantation, rheumatoider Arthritis und Psoriasis war die mittlere AUC von Ciclosporin etwa 20 % bis 50 % höher und die Spitzenkonzentration von Ciclosporin im Blut Cmax etwa 40 % bis 106 % höher nach der Verabreichung von Neoral 100 mg im Vergleich zur Verabreichung von Sandimmune . Die dosisnormalisierte AUC war bei De-novo-Lebertransplantationspatienten, denen Neoral 28 Tage nach der Transplantation verabreicht wurde, um 50 % höher und die Cmax um 90 % höher als bei Patienten, denen Sandimmune verabreicht wurde. AUC und Cmax sind bei Herztransplantationspatienten ebenfalls erhöht (neoral im Vergleich zu Sandimmun), aber die Datenlage ist sehr begrenzt. Obwohl die AUC- und Cmax-Werte bei Neoral 100 mg höher sind als bei Sandimmune, sind die Talkonzentrationen vor der Dosis (dosisnormalisiert) für die beiden Formulierungen ähnlich.
Nach oraler Gabe von Neoral lag die Zeit bis zum Erreichen der maximalen Ciclosporinkonzentration im Blut (Tmax) im Bereich von 1,5 bis 2,0 Stunden. Die Einnahme von Nahrung mit Neoral 25 mg verringert die AUC und Cmax von Cyclosporin. Eine fettreiche Mahlzeit (669 kcal, 45 g Fett), die innerhalb einer halben Stunde vor der Verabreichung von Neoral 25 mg eingenommen wurde, verringerte die AUC um 13 % und die Cmax um 33 %. Die Auswirkungen einer fettarmen Mahlzeit (667 kcal, 15 Gramm Fett) waren ähnlich.
Die Wirkung der T-Tube-Ableitung der Galle auf die Resorption von Cyclosporin aus Neoral 25 mg wurde bei elf De-novo-Lebertransplantationspatienten untersucht. Wenn den Patienten Neoral mit und ohne T-Rohr-Ableitung der Galle verabreicht wurde, wurde nur ein sehr geringer Unterschied in der Resorption beobachtet, gemessen an der Veränderung der maximalen Cyclosporin-Blutkonzentrationen von den Werten vor der Verabreichung bei geschlossenem T-Rohr im Vergleich zu damals offen: 6,9 ± 41 % (Bereich 55 % bis 68 %).
PatientenpopulationVerteilung
Cyclosporin wird weitgehend außerhalb des Blutvolumens verteilt. Das Verteilungsvolumen im Steady State während der intravenösen Gabe wurde bei Empfängern von Organtransplantaten mit 3 bis 5 l/kg angegeben. Im Blut ist die Verteilung konzentrationsabhängig. Ungefähr 33 % bis 47 % befinden sich im Plasma, 4 % bis 9 % in Lymphozyten, 5 % bis 12 % in Granulozyten und 41 % bis 58 % in Erythrozyten. Bei hohen Konzentrationen wird die Bindungskapazität von Leukozyten und Erythrozyten gesättigt. Im Plasma sind etwa 90 % an Proteine, hauptsächlich Lipoproteine, gebunden. Cyclosporin wird in die Muttermilch ausgeschieden (vgl VORSICHTSMASSNAHMEN , Stillende Mutter ).
Stoffwechsel
Cyclosporin wird weitgehend durch das Cytochrom P-450 3A-Enzymsystem in der Leber und in geringerem Maße im Gastrointestinaltrakt und in der Niere metabolisiert. Der Metabolismus von Cyclosporin kann durch die gleichzeitige Verabreichung verschiedener Wirkstoffe verändert werden (vgl VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Mindestens 25 Metaboliten wurden aus menschlicher Galle, Fäkalien, Blut und Urin identifiziert. Die biologische Aktivität der Metaboliten und ihr Beitrag zur Toxizität sind erheblich geringer als die der Ausgangsverbindung. Die Hauptmetaboliten (M1, M9 und M4N) resultieren aus der Oxidation an den 1-beta-, 9-gamma- bzw. 4-N-demethylierten Positionen. Im Steady State nach oraler Gabe von Sandimmune betragen die mittleren AUCs für Blutkonzentrationen von M1, M9 und M4N etwa 70 %, 21 % bzw. 7,5 % der AUC für Cyclosporin-Blutkonzentrationen. Basierend auf Blutkonzentrationsdaten von stabilen Nierentransplantationspatienten (13 Patienten erhielten Neoral und Sandimmune in einer Crossover-Studie) und Gallenkonzentrationsdaten von De-novo-Lebertransplantationspatienten (4 verabreichte Neoral 100 mg, 3 verabreichte Sandimmune), der Prozentsatz der vorhandenen Dosis als M1-, M9- und M4N-Metaboliten sind ähnlich, wenn entweder Neoral 25 mg oder Sandimmune verabreicht wird.
Ausscheidung
Nur 0,1 % einer Ciclosporin-Dosis werden unverändert im Urin ausgeschieden. Die Elimination erfolgt hauptsächlich biliär, wobei nur 6 % der Dosis (Ausgangssubstanz und Metaboliten) mit dem Urin ausgeschieden werden. Weder Dialyse noch Nierenversagen verändern die Ciclosporin-Clearance signifikant.
Wechselwirkungen mit anderen Medikamenten
(Sehen VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ) Bei gleichzeitiger Anwendung von Diclofenac oder Methotrexat mit Ciclosporin bei Patienten mit rheumatoider Arthritis war die AUC von Diclofenac und Methotrexat jeweils signifikant erhöht (siehe VORSICHTSMASSNAHMEN , WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ). Zwischen Ciclosporin und Aspirin, Ketoprofen, Piroxicam oder Indomethacin traten keine klinisch signifikanten pharmakokinetischen Wechselwirkungen auf.
Spezifische Populationen
Nierenfunktionsstörung
In einer Studie, die an 4 Probanden mit Nierenerkrankungen im Endstadium (Kreatinin-Clearance
Leberfunktionsstörung
Cyclosporin wird weitgehend von der Leber metabolisiert. Da eine schwere Leberfunktionsstörung zu einer signifikant erhöhten Ciclosporin-Exposition führen kann, muss die Ciclosporin-Dosis bei diesen Patienten möglicherweise reduziert werden.
Pädiatrische Population
Pharmakokinetische Daten von pädiatrischen Patienten, denen Neoral oder Sandimmune verabreicht wurden, sind sehr begrenzt. Bei 15 nierentransplantierten Patienten im Alter von 3 bis 16 Jahren betrug die Vollblut-Clearance von Cyclosporin nach intravenöser Verabreichung von Sandimmune 10,6 ± 3,7 ml/min/kg (Assay: Cyclo-trac-spezifischer RIA). In einer Studie mit 7 Nierentransplantationspatienten im Alter von 2 bis 16 Jahren lag die Ciclosporin-Clearance im Bereich von 9,8 bis 15,5 ml/min/kg. Bei 9 lebertransplantierten Patienten im Alter von 0,6 bis 5,6 Jahren betrug die Clearance 9,3 ± 5,4 ml/min/kg (Assay: HPLC).
In der pädiatrischen Population zeigt Neoral im Vergleich zu Sandimmune auch eine erhöhte Bioverfügbarkeit. Bei 7 de novo-Lebertransplantationspatienten im Alter von 1,4 bis 10 Jahren betrug die absolute Bioverfügbarkeit von Neoral 43 % (Bereich 30 % bis 68 %) und für Sandimmune betrug die absolute Bioverfügbarkeit bei denselben Personen 28 % (Bereich 17 % bis 42 %).
Geriatrische Bevölkerung
Vergleich der Einzeldosisdaten sowohl von gesunden älteren Freiwilligen (N = 18, Durchschnittsalter 69 Jahre) als auch von älteren Patienten mit rheumatoider Arthritis (N = 16, Durchschnittsalter 68 Jahre) mit Einzeldosisdaten von jungen erwachsenen Freiwilligen (N = 16, Durchschnittsalter 26 Jahre) zeigte keinen signifikanten Unterschied in den pharmakokinetischen Parametern.
Klinische Versuche
Rheumatoide Arthritis
Die Wirksamkeit von Sandimmune und Neoral 100 mg bei der Behandlung von schwerer rheumatoider Arthritis wurde in 5 klinischen Studien mit insgesamt 728 mit Ciclosporin behandelten Patienten und 273 mit Placebo behandelten Patienten untersucht.
Eine Zusammenfassung der Ergebnisse wird für die „Responder“-Raten pro Behandlungsgruppe präsentiert, wobei ein Responder als ein Patient definiert ist, der die Studie mit einer 20 %igen Verbesserung des Druckschmerzes und der Anzahl der geschwollenen Gelenke und einer 20 %igen Verbesserung in 2 von abgeschlossen hat 4 von Investigator Global, Patient Global, Disability und Erythrozytensedimentationsraten (ESR) für die Studien 651 und 652 und 3 von 5 von Investigator Global, Patient Global, Disability, Visual Analog Pain und ESR für die Studien 2008, 654 und 302.
In Studie 651 wurden 264 Patienten mit aktiver rheumatoider Arthritis mit mindestens 20 betroffenen Gelenken aufgenommen, bei denen mindestens ein wichtiges RA-Medikament versagt hatte, wobei eine 3:3:2-Randomisierung zu einer der folgenden drei Gruppen verwendet wurde: (1) Ciclosporin in einer Dosierung von 2,5 to 5 mg/kg/Tag, (2) Methotrexat mit 7,5 bis 15 mg/Woche oder (3) Placebo. Die Behandlungsdauer betrug 24 Wochen. Die mittlere Ciclosporin-Dosis beim letzten Besuch betrug 3,1 mg/kg/Tag. Siehe Grafik unten.
In Studie 652 wurden 250 Patienten mit aktiver RA mit > 6 aktiven schmerzhaften oder empfindlichen Gelenken aufgenommen, bei denen mindestens ein wichtiges RA-Medikament versagt hatte. Die Patienten wurden unter Verwendung einer 3:3:2-Randomisierung auf 1 von 3 Behandlungsarmen randomisiert: (1) 1,5 bis 5 mg/kg/Tag Ciclosporin, (2) 2,5 bis 5 mg/kg/Tag Ciclosporin und (3) Placebo. Die Behandlungsdauer betrug 16 Wochen. Die mittlere Ciclosporin-Dosis für Gruppe 2 betrug beim letzten Besuch 2,92 mg/kg/Tag. Siehe Grafik unten.
In die Studie 2008 wurden 144 Patienten mit aktiver RA und > 6 aktiven Gelenken aufgenommen, die erfolglose Behandlungszyklen mit Aspirin und Gold oder Penicillamin hatten. Die Patienten wurden randomisiert 1 von 2 Behandlungsgruppen zugeteilt (1) Ciclosporin 2,5 bis 5 mg/kg/Tag mit Anpassungen nach dem ersten Monat, um einen angestrebten Talspiegel zu erreichen, und (2) Placebo. Die Behandlungsdauer betrug 24 Wochen. Die mittlere Ciclosporin-Dosis beim letzten Besuch betrug 3,63 mg/kg/Tag. Siehe Grafik unten.
Studie 654 schloss 148 Patienten ein, die trotz Behandlung mit maximal verträglichen Methotrexat-Dosen für mindestens drei Monate eine Anzahl aktiver Gelenke von 6 oder mehr beibehielten. Die Patienten nahmen weiterhin ihre aktuelle Methotrexat-Dosis ein und erhielten randomisiert zusätzlich eines der folgenden Medikamente: (1) Ciclosporin 2,5 mg/kg/Tag mit Dosiserhöhungen von 0,5 mg/kg/Tag in Woche 2 und 4, wenn es gab keine Hinweise auf Toxizität und weitere Erhöhungen um 0,5 mg/kg/Tag in den Wochen 8 und 16, wenn eine
In Studie 302 wurden 299 Patienten mit schwerer aktiver RA aufgenommen, von denen 99 % auf mindestens ein vorheriges wichtiges RA-Medikament nicht ansprachen oder es nicht vertragen. Die Patienten wurden randomisiert 1 von 2 Behandlungsgruppen zugeteilt (1) Neoral 25 mg und (2) Ciclosporin, die beide mit 2,5 mg/kg/Tag begonnen und nach 4 Wochen wegen Unwirksamkeit in Schritten von 0,5 mg/kg/Tag auf a erhöht wurden maximal 5 mg/kg/Tag und kann jederzeit wegen Toxizität verringert werden. Die Behandlungsdauer betrug 24 Wochen. Die mittlere Ciclosporin-Dosis beim letzten Besuch betrug 2,91 mg/kg/Tag (Spanne: 0,72 bis 5,17) für Neoral und 3,27 mg/kg/Tag (Spanne: 0,73 bis 5,68) für Ciclosporin. Siehe Grafik unten.
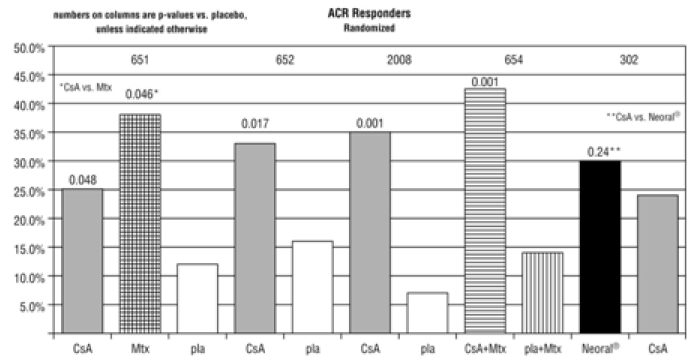
Klinische Studien
In kontrollierten Studien waren Art, Schweregrad und Häufigkeit der Nebenwirkungen, die bei 493 mit Neoral behandelten transplantierten Patienten beobachtet wurden, mit denen vergleichbar, die bei 208 transplantierten Patienten beobachtet wurden, die Sandimmune in denselben Studien erhielten, als die Dosierung der beiden Arzneimittel angepasst wurde um die gleichen Cyclosporin-Talkonzentrationen im Blut zu erreichen.
Basierend auf den historischen Erfahrungen mit Sandimmune traten die folgenden Reaktionen bei 3 % oder mehr von 892 Patienten auf, die an klinischen Studien zu Nieren-, Herz- und Lebertransplantationen teilnahmen.
Unter 705 nierentransplantierten Patienten, die in klinischen Studien mit Ciclosporin-Lösung zum Einnehmen (Sandimmune) behandelt wurden, war der Grund für den Behandlungsabbruch Nierentoxizität bei 5,4 %, Infektion bei 0,9 %, mangelnde Wirksamkeit bei 1,4 %, akute tubuläre Nekrose bei 1,0 %, lymphoproliferative Erkrankungen bei 0,3 %, Bluthochdruck bei 0,3 % und andere Ursachen bei 0,7 % der Patienten.
Die folgenden Reaktionen traten bei 2 % oder weniger der mit Ciclosporin behandelten Patienten auf: allergische Reaktionen, Anämie, Anorexie, Verwirrtheit, Konjunktivitis, Ödeme, Fieber, brüchige Fingernägel, Gastritis, Hörverlust, Schluckauf, Hyperglykämie, Migräne (Neoral), Muskelschmerzen, Magengeschwür, Thrombozytopenie, Tinnitus.
Die folgenden Reaktionen traten selten auf: Angst, Brustschmerzen, Verstopfung, Depression, Haarbruch, Hämaturie, Gelenkschmerzen, Lethargie, wunde Stellen im Mund, Myokardinfarkt, Nachtschweiß, Bauchspeicheldrüsenentzündung, Juckreiz, Schluckbeschwerden, Kribbeln, Blutungen im oberen Gastrointestinaltrakt, Sehstörungen, Schwäche, Gewichtsverlust.
Patienten, die immunsuppressive Therapien erhalten, einschließlich Ciclosporin und Ciclosporin-haltige Therapien, haben ein erhöhtes Infektionsrisiko (viral, bakteriell, durch Pilze, Parasiten). Es können sowohl generalisierte als auch lokalisierte Infektionen auftreten. Vorbestehende Infektionen können ebenfalls verschlimmert werden. Todesfälle wurden berichtet (vgl WARNUNGEN ).
Postmarketing-Erfahrung, Nieren-, Leber- und Herztransplantation
Hepatotoxizität
Fälle von Hepatotoxizität und Leberschäden, einschließlich Cholestase, Gelbsucht, Hepatitis und Leberversagen; schwerwiegende und/oder tödliche Folgen wurden berichtet (siehe WARNUNGEN , Hepatotoxizität ).
Erhöhtes Infektionsrisiko
Fälle von JC-Virus-assoziierter progressiver multifokaler Leukenzephalopathie (PML), manchmal tödlich; und Polyoma-Virus-assoziierte Nephropathie (PVAN), insbesondere BK-Virus, die zu Transplantatverlust führten, wurden berichtet (siehe WARNUNGEN , Polyoma-Virus-Infektion ).
Kopfschmerzen, einschließlich Migräne
Fälle von Migräne wurden berichtet. In einigen Fällen waren Patienten nicht in der Lage, Ciclosporin fortzusetzen, die endgültige Entscheidung über einen Behandlungsabbruch sollte jedoch vom behandelnden Arzt nach sorgfältiger Nutzen-Risiko-Abwägung getroffen werden.
Schmerzen der unteren Extremitäten
In Verbindung mit Ciclosporin wurden vereinzelte Fälle von Schmerzen in den unteren Extremitäten berichtet. Schmerzen der unteren Extremitäten wurden auch als Teil des Calcineurin-Inhibitor-induzierten Schmerzsyndroms (CIPS) festgestellt, wie in der Literatur beschrieben.
Rheumatoide Arthritis
Die wichtigsten Nebenwirkungen im Zusammenhang mit der Anwendung von Ciclosporin bei rheumatoider Arthritis sind Nierenfunktionsstörungen (s WARNUNGEN ), Bluthochdruck (vgl VORSICHTSMASSNAHMEN ), Kopfschmerzen, Magen-Darm-Störungen und Hirsutismus/Hypertrichose.
Bei Patienten mit rheumatoider Arthritis, die in klinischen Studien innerhalb des empfohlenen Dosisbereichs behandelt wurden, wurde die Ciclosporin-Therapie bei 5,3 % der Patienten wegen Bluthochdruck und bei 7 % der Patienten wegen erhöhtem Kreatinin abgesetzt. Diese Veränderungen sind in der Regel bei rechtzeitiger Dosisreduktion oder Absetzen des Arzneimittels reversibel. Häufigkeit und Schweregrad von Serum-Kreatinin-Erhöhungen nehmen mit Dosis und Dauer der Ciclosporin-Therapie zu. Diese Anstiege werden wahrscheinlich ohne Dosisreduktion oder Absetzen stärker ausgeprägt sein.
Die folgenden unerwünschten Ereignisse traten in kontrollierten klinischen Studien auf:
Darüber hinaus wurden in kontrollierten klinischen Studien bei 1 % bis
Vegetatives Nervensystem: Mundtrockenheit, vermehrtes Schwitzen
Körper als Ganzes: Allergie, Asthenie, Hitzewallungen, Unwohlsein, Überdosierung, Eingriff n.a.*, Tumor n.a.*, Gewichtsabnahme, Gewichtszunahme
Herz-Kreislauf: anormale Herztöne, Herzinsuffizienz, Myokardinfarkt, periphere Ischämie
Zentrales und peripheres Nervensystem: Hypästhesie, Neuropathie, Schwindel
Endokrin: Kropf
Magen-Darm: Verstopfung, Dysphagie, Enanthem, Aufstoßen, Ösophagitis, Magengeschwür, Gastritis, Gastroenteritis, Zahnfleischbluten, Glossitis, Magengeschwür, Speicheldrüsenvergrößerung, Zungenerkrankung, Zahnerkrankung
Infektion: Abszess, bakterielle Infektion, Cellulitis, Follikulitis, Pilzinfektion, Herpes simplex, Herpes zoster, Nierenabszess, Moniliasis, Tonsillitis, Virusinfektion
Hämatologisch: Anämie, Epistaxis, Leukopenie, Lymphadenopathie
Leber und Gallensystem: Bilirubinämie
Stoffwechsel und Ernährung: Diabetes mellitus, Hyperkaliämie, Hyperurikämie, Hypoglykämie
Bewegungsapparat: Arthralgie, Knochenbruch, Bursitis, Gelenkluxation, Myalgie, Steifheit, Synovialzyste, Sehnenerkrankung
Neubildungen: Brustfibroadenose, Karzinom
Psychiatrie: Angst, Verwirrtheit, verminderte Libido, emotionale Labilität, Konzentrationsstörungen, gesteigerte Libido, Nervosität, Paronirie, Somnolenz
Fortpflanzung (weiblich): Brustschmerzen, Gebärmutterblutung
Atmungssystem: abnorme Brustgeräusche, Bronchospasmus
Haut und Anhängsel: abnorme Pigmentierung, Angioödem, Dermatitis, trockene Haut, Ekzem, Nagelerkrankung, Juckreiz, Hauterkrankung, Urtikaria
Besondere Sinne: Sehstörungen, Katarakt, Konjunktivitis, Taubheit, Augenschmerzen, Geschmacksstörungen, Tinnitus, vestibuläre Störungen
Harnsystem: anormaler Urin, Hämaturie, erhöhter BUN, Harndrang, Nykturie, Polyurie, Pyelonephritis, Harninkontinenz
*NOS = Nicht anders angegeben
Schuppenflechte
Die wichtigsten Nebenwirkungen im Zusammenhang mit der Anwendung von Ciclosporin bei Patienten mit Psoriasis sind Nierenfunktionsstörungen, Kopfschmerzen, Bluthochdruck, Hypertriglyzeridämie, Hirsutismus/Hypertrichose, Parästhesie oder Hyperästhesie, grippeähnliche Symptome, Übelkeit/Erbrechen, Durchfall, Bauchbeschwerden, Lethargie und Muskel-Skelett-Beschwerden oder Gelenkschmerzen.
Bei Psoriasis-Patienten, die in kontrollierten klinischen Studien in den USA innerhalb des empfohlenen Dosisbereichs behandelt wurden, wurde die Ciclosporin-Therapie bei 1,0 % der Patienten wegen Bluthochdruck und bei 5,4 % der Patienten wegen erhöhtem Kreatinin abgesetzt. In den meisten Fällen waren diese Veränderungen nach Dosisreduktion oder Absetzen von Ciclosporin reversibel.
Es wurde ein Todesfall im Zusammenhang mit der Anwendung von Ciclosporin bei Psoriasis berichtet. Ein 27-jähriger Mann entwickelte eine Nierenverschlechterung und wurde mit Ciclosporin weiter behandelt. Er hatte ein fortschreitendes Nierenversagen, das zum Tod führte.
Häufigkeit und Schweregrad des Serum-Kreatinins nehmen mit Dosis und Dauer der Ciclosporin-Therapie zu. Diese Anstiege werden wahrscheinlich noch ausgeprägter und können ohne Dosisreduktion oder Absetzen zu irreversiblen Nierenschäden führen.
Die folgenden Ereignisse traten bei 1 % bis weniger als 3 % der mit Ciclosporin behandelten Psoriasis-Patienten auf:
Körper als Ganzes: Fieber, Hitzewallungen, Hitzewallungen
Herz-Kreislauf: Brustschmerzen
Zentrales und peripheres Nervensystem: gesteigerter Appetit, Schlaflosigkeit, Schwindel, Nervosität, Schwindel
Magen-Darm: Blähungen, Verstopfung, Zahnfleischbluten
Leber und Gallensystem: Hyperbilirubinämie
Neubildungen: Hautmalignome [Plattenepithelkarzinome (0,9 %) und Basalzellkarzinome (0,4 %)]
Retikuloendothelial: Thrombozyten-, Blutungs- und Gerinnungsstörungen, Störung der roten Blutkörperchen
Atmung: Infektion, virale und andere Infektionen
Haut und Anhängsel: Akne, Follikulitis, Keratose, Pruritus, Hautausschlag, trockene Haut
Harnsystem: Miktionsfrequenz
Vision: abnormales Sehen
Leichte Hypomagnesiämie und Hyperkaliämie können auftreten, sind aber asymptomatisch. Es kann zu einem Anstieg der Harnsäure kommen und selten wurde über Gichtanfälle berichtet. Eine geringfügige und dosisabhängige Hyperbilirubinämie wurde ohne hepatozelluläre Schädigung beobachtet. Die Ciclosporin-Therapie kann mit einem mäßigen Anstieg der Serumtriglyceride oder des Cholesterins einhergehen. Erhöhungen der Triglyceride (> 750 mg/dl) treten bei etwa 15 % der Psoriasis-Patienten auf; Erhöhungen des Cholesterinspiegels (> 300 mg/dl) werden bei weniger als 3 % der Psoriasis-Patienten beobachtet. Im Allgemeinen sind diese Laboranomalien nach Dosisreduktion oder Absetzen von Ciclosporin reversibel.
Postmarketing-Erfahrung, Psoriasis
Fälle einer Umwandlung in erythrodermische Psoriasis oder generalisierte pustulöse Psoriasis nach Absetzen oder Reduktion von Ciclosporin bei Patienten mit chronischer Plaque-Psoriasis wurden berichtet.
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten darauf hingewiesen werden, dass jede Änderung der Ciclosporin-Formulierung mit Vorsicht und nur unter ärztlicher Aufsicht vorgenommen werden sollte, da dies zu einer Änderung der Dosierung führen kann.
Die Patienten sollten über die Notwendigkeit wiederholter Laboruntersuchungen informiert werden, während sie Ciclosporin erhalten. Die Patientinnen sollten auf die potenziellen Risiken während der Schwangerschaft hingewiesen und über das erhöhte Neoplasierisiko informiert werden. Die Patienten sollten auch über das Risiko von Bluthochdruck und Nierenfunktionsstörungen aufgeklärt werden.
Die Patienten sollten darauf hingewiesen werden, dass während der Behandlung mit Ciclosporin die Impfung weniger wirksam sein kann und die Anwendung attenuierter Lebendimpfstoffe vermieden werden sollte.
Den Patienten sollten sorgfältige Dosierungsanweisungen gegeben werden. Neoral Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIED sollte verdünnt werden, vorzugsweise mit Orangen- oder Apfelsaft, der Raumtemperatur hat. Die Kombination von Neoral Lösung zum Einnehmen (Cyclosporin-Lösung zum Einnehmen, USP) MODIFIZIERT mit Milch kann unangenehm sein.
Den Patienten sollte geraten werden, Neoral 100 mg nach einem einheitlichen Zeitplan im Hinblick auf die Tageszeit und in Bezug auf die Mahlzeiten einzunehmen. Grapefruit und Grapefruitsaft beeinflussen den Stoffwechsel, erhöhen die Blutkonzentration von Cyclosporin und sollten daher vermieden werden.