Hydrea 500mg Hydroxyurea Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Hydrea 500 mg und wie wird es angewendet?
Hydrea (Hydroxyharnstoff) ist ein antineoplastisches (krebshemmendes) Mittel zur Behandlung von Melanomen, resistenter chronischer myeloischer Leukämie und rezidivierenden, metastasierten oder inoperablen Karzinomen der Eierstöcke und primären Plattenepithelkarzinomen (Epidermoid) von Kopf und Hals. Hydrea ist in generischer Form erhältlich.
Welche Nebenwirkungen hat Hydrea?
Häufige Nebenwirkungen von Hydrea sind:
Zu den schwerwiegenden Nebenwirkungen von Hydrea gehören:
BEZEICHNUNG
HYDREA (Hydroxyharnstoff-Kapseln, USP) ist ein Antimetabolit, der zur oralen Anwendung als Kapseln mit 500 mg Hydroxyharnstoff erhältlich ist. Zu den inaktiven Inhaltsstoffen gehören Zitronensäure, Farbstoffe (D&C Yellow Nr. 10, FD&C Blue Nr. 1, FD&C Red Nr. 40 und D&C Red Nr. 28), Gelatine, Lactose, Magnesiumstearat, Natriumphosphat und Titandioxid.
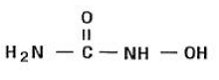
Hydroxyharnstoff ist ein weißes bis cremefarbenes kristallines Pulver. Es ist hygroskopisch und leicht löslich in Wasser, aber praktisch unlöslich in Alkohol. Die Summenformel lautet CH4N2O2 und hat ein Molekulargewicht von 76,05. Seine Strukturformel lautet:
INDIKATIONEN
HYDREA 500 mg ist angezeigt zur Behandlung von:
DOSIERUNG UND ANWENDUNG
Dosierungsinformationen
HYDREA wird allein oder in Verbindung mit anderen Antitumormitteln oder einer Strahlentherapie zur Behandlung von neoplastischen Erkrankungen eingesetzt. Individualisieren Sie die Behandlung basierend auf Tumortyp, Krankheitszustand, Ansprechen auf die Behandlung, Patientenrisikofaktoren und aktuellen Standards der klinischen Praxis.
Basieren Sie alle Dosierungen auf dem tatsächlichen oder idealen Gewicht des Patienten, je nachdem, welcher Wert geringer ist.
HYDREA ist ein zytotoxisches Medikament. Befolgen Sie die anwendbaren speziellen Handhabungs- und Entsorgungsverfahren [siehe VERWEISE ].
Schlucken Sie HYDREA Kapseln unzerkaut. Kapseln NICHT öffnen, zerbrechen oder kauen, da HYDREA ein zytotoxisches Medikament ist.
Die prophylaktische Gabe von Folsäure wird empfohlen [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kontrollieren Sie das Blutbild während der Therapie mit HYDREA 500 mg mindestens einmal wöchentlich. Eine schwere Anämie muss korrigiert werden, bevor eine Therapie mit HYDREA begonnen wird.
Dosisänderungen für Toxizität
Achten Sie auf Folgendes und reduzieren Sie die Dosis oder setzen Sie HYDREA 500 mg entsprechend ab:
Dosisanpassungen bei anderen Toxizitäten erwägen.
Dosisanpassungen bei eingeschränkter Nierenfunktion
Reduzieren Sie die HYDREA-Dosis um 50 % bei Patienten mit einer gemessenen Kreatinin-Clearance von weniger als 60 ml/min oder mit terminaler Niereninsuffizienz (ESRD) [siehe Verwendung in bestimmten Bevölkerungsgruppen und KLINISCHE PHARMAKOLOGIE ].
Bei diesen Patienten wird eine engmaschige Überwachung der hämatologischen Parameter empfohlen.
WIE GELIEFERT
Darreichungsformen und Stärken
Kapseln
500 mg undurchsichtiges grünes Oberteil und undurchsichtiges rosafarbenes Unterteil mit dem Aufdruck „HYDREA“ und „830“.
Lagerung und Handhabung
HYDREA® (Hydroxyharnstoff-Kapseln, USP) wird als 500-mg-Kapseln in HDPE-Flaschen mit Sicherheitsschraubverschluss aus Kunststoff geliefert. Jede Flasche enthält 100 Kapseln.
Die Kappe ist undurchsichtig grün und der Körper ist undurchsichtig rosa. Die Kapseln sind auf beiden Seiten mit „HYDREA“ und „830“ in schwarzer Tinte bedruckt ( NDC 0003-0830-50).
Lagerung
Bei 20-25°C (68-77°F) lagern; Abweichungen bis 15°C-30°C (59°F-86°F) zulässig [siehe USP Controlled RoomTemperature]. Dicht verschlossen halten.
Handhabung und Entsorgung
HYDREA 500 mg ist ein zytotoxisches Medikament. Befolgen Sie die anwendbaren speziellen Handhabungs- und Entsorgungsverfahren [siehe VERWEISE ].
Um das Kontaktrisiko zu verringern, raten Sie den Pflegekräften, beim Umgang mit HYDREA oder Flaschen, die HYDREA enthalten, Einweghandschuhe zu tragen. Waschen Sie vor und nach dem Kontakt mit der Flasche oder den Kapseln beim Umgang mit HYDREA die Hände mit Wasser und Seife. HYDREA 500 mg Kapseln nicht öffnen. Vermeiden Sie den Kontakt mit zerkleinerten oder geöffneten Kapseln. Bei Kontakt mit zerkleinerten oder geöffneten Kapseln auf der Haut den betroffenen Bereich sofort gründlich mit Wasser und Seife waschen. Bei Augenkontakt mit zerkleinerten oder geöffneten Kapseln sollte der betroffene Bereich mindestens 15 Minuten lang gründlich mit Wasser oder einer für diesen Zweck vorgesehenen isotonischen Augenspülung gespült werden. Wenn das Pulver aus der Kapsel verschüttet wird, wischen Sie es sofort mit einem feuchten Einwegtuch auf und entsorgen Sie es in einem geschlossenen Behälter, z. B. einer Plastiktüte; ebenso wie die leeren Kapseln. Die Verschüttungsbereiche sollten dann dreimal mit einer Reinigungslösung und anschließend mit sauberem Wasser gereinigt werden. Halten Sie das Medikament von Kindern und Haustieren fern. Wenden Sie sich an Ihren Arzt, um Anweisungen zur Entsorgung abgelaufener Kapseln zu erhalten.
VERWEISE
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Hergestellt für: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Überarbeitet: Dezember 2020
NEBENWIRKUNGEN
Die folgenden klinisch signifikanten Nebenwirkungen werden in anderen Abschnitten zur Kennzeichnung ausführlich beschrieben:
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von HYDREA nach der Zulassung festgestellt. Da diese Reaktionen freiwillig von einer Population ungewisser Größe gemeldet wurden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen.
Nebenwirkungen, die bei einer kombinierten Hydroxyharnstoff- und Bestrahlungstherapie beobachtet wurden, ähneln denen, die bei der Anwendung von Hydroxyharnstoff oder Bestrahlung allein berichtet wurden. Zu diesen Wirkungen zählen vor allem Knochenmarkdepression (Anämie und Leukopenie), Magenreizung und Mukositis. Nahezu alle Patienten, die einen angemessenen Verlauf einer kombinierten Hydroxyharnstoff- und Bestrahlungstherapie erhalten, zeigen gleichzeitig eine Leukopenie. Bei ausgeprägter Leukopenie ist eine Thrombozytendepression (
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Erhöhte Toxizität bei gleichzeitiger Anwendung von antiretroviralen Medikamenten
Pankreatitis
Bei Patienten mit HIV-Infektion während der Therapie mit Hydroxyharnstoff und Didanosin, mit oder ohne Stavudin, sind tödliche und nicht-tödliche Pankreatitis aufgetreten. Hydroxyharnstoff ist nicht zur Behandlung einer HIV-Infektion indiziert; Wenn jedoch Patienten mit einer HIV-Infektion mit Hydroxyharnstoff und insbesondere in Kombination mit Didanosin und/oder Stavudin behandelt werden, wird eine engmaschige Überwachung auf Anzeichen und Symptome einer Pankreatitis empfohlen. Beenden Sie die Therapie mit Hydroxyurea dauerhaft bei Patienten, die Anzeichen und Symptome einer Pankreatitis entwickeln.
Hepatotoxizität
Hepatotoxizität und Leberversagen mit Todesfolge wurden während der Überwachung nach Markteinführung bei Patienten mit HIV-Infektion berichtet, die mit Hydroxyharnstoff und anderen antiretroviralen Arzneimitteln behandelt wurden. Tödliche hepatische Ereignisse wurden am häufigsten bei Patienten berichtet, die mit der Kombination aus Hydroxyharnstoff, Didanosin und Stavudin behandelt wurden. Vermeiden Sie diese Kombination.
Periphere Neuropathie
Periphere Neuropathie, die in einigen Fällen schwerwiegend war, wurde bei Patienten mit HIV-Infektion berichtet, die Hydroxyurea in Kombination mit antiretroviralen Arzneimitteln, einschließlich Didanosin, mit oder ohne Stavudin erhielten.
Interferenzen bei Labortests
Interferenz mit Harnsäure-, Harnstoff- oder Milchsäure-Assays
Studien haben gezeigt, dass Hydroxyurea eine analytische Interferenz mit den Enzymen (Urease, Uricase und Lactatdehydrogenase) aufweist, die bei der Bestimmung von Harnstoff, Harnsäure und Milchsäure verwendet werden, was zu falsch erhöhten Ergebnissen dieser bei mit Hydroxyurea behandelten Patienten führt.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Myelosuppression
Hydroxyharnstoff verursacht eine schwere Myelosuppression. Eine Behandlung mit Hydroxyharnstoff sollte nicht eingeleitet werden, wenn die Knochenmarkfunktion deutlich herabgesetzt ist. Eine Knochenmarksuppression kann auftreten, und Leukopenie ist im Allgemeinen die erste und häufigste Manifestation. Thrombozytopenie und Anämie treten seltener auf und werden selten ohne vorangegangene Leukopenie beobachtet. Eine Knochenmarkdepression ist wahrscheinlicher bei Patienten, die zuvor eine Strahlentherapie oder zytotoxische Chemotherapeutika gegen Krebs erhalten haben; Verwenden Sie Hydroxyharnstoff bei solchen Patienten mit Vorsicht.
Bewerten Sie den hämatologischen Status vor und während der Behandlung mit HYDREA. Bieten Sie unterstützende Maßnahmen an und ändern Sie die Dosis oder setzen Sie HYDREA nach Bedarf ab. Die Erholung von der Myelosuppression erfolgt normalerweise schnell, wenn die Therapie unterbrochen wird.
Malignome
Hydroxyharnstoff ist ein menschliches Karzinogen. Bei Patienten, die wegen myeloproliferativer Erkrankungen langfristig Hydroxyharnstoff erhielten, wurde über sekundäre Leukämie berichtet. Hautkrebs wurde auch bei Patienten berichtet, die Hydroxyharnstoff über einen längeren Zeitraum erhielten. Empfehlen Sie Schutz vor Sonneneinstrahlung und überwachen Sie die Entwicklung sekundärer Malignome.
Embryo-fötale Toxizität
Basierend auf dem Wirkungsmechanismus und Tierversuchen kann HYDREA 500 mg den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Hydroxyharnstoff war bei Ratten und Kaninchen in Dosen, die das 0,8-Fache bzw. das 0,3-Fache der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis betrugen, embryotoxisch und teratogen. Informieren Sie schwangere Frauen über das potenzielle Risiko für einen Fötus [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Raten Sie gebärfähigen Frauen, während und nach der Behandlung mit HYDREA 500 mg für mindestens 6 Monate nach der Therapie eine wirksame Verhütungsmethode anzuwenden. Raten Sie gebärfähigen Männern, während und nach der Behandlung mit HYDREA 500 mg für mindestens 1 Jahr nach der Therapie eine wirksame Verhütungsmethode anzuwenden [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Vaskulitische Toxizitäten
Kutane vaskulitische Toxizitäten, einschließlich vaskulitischer Ulzerationen und Gangrän, sind bei Patienten mit myeloproliferativen Erkrankungen während der Therapie mit Hydroxyharnstoff aufgetreten. Diese vaskulitischen Toxizitäten wurden am häufigsten bei Patienten berichtet, die in der Vorgeschichte eine Interferontherapie erhalten haben oder derzeit erhalten. Wenn kutane vaskulitische Geschwüre auftreten, leiten Sie eine Behandlung ein und brechen Sie HYDREA ab.
Lebendige Impfungen
Vermeiden Sie die Verwendung von Lebendimpfstoffen bei Patienten, die HYDREA einnehmen. Die gleichzeitige Anwendung von HYDREA mit einem Lebendimpfstoff kann die Replikation des Virus verstärken und/oder die Nebenwirkungen des Impfstoffs verstärken, da normale Abwehrmechanismen durch HYDREA unterdrückt werden können. Die Impfung mit Lebendimpfstoffen bei einem Patienten, der HYDREA 500 mg erhält, kann zu einer schweren Infektion führen. Die Antikörperreaktion des Patienten auf Impfstoffe kann verringert sein. Erwägen Sie die Konsultation eines Spezialisten.
Risiken bei gleichzeitiger Anwendung antiretroviraler Medikamente
Pankreatitis, Hepatotoxizität und periphere Neuropathie sind aufgetreten, wenn Hydroxyharnstoff gleichzeitig mit antiretroviralen Arzneimitteln, einschließlich Didanosin und Stavudin, verabreicht wurde [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Strahlungsrückruf
Bei Patienten, die in der Vergangenheit eine Bestrahlungstherapie erhalten haben, kann es zu einer Verschlimmerung des Erythems nach der Bestrahlung kommen. Überwachen Sie Patienten, die zuvor eine Bestrahlung erhalten haben, auf Hautrötungen und behandeln Sie sie symptomatisch.
Makrozytose
HYDREA 500 mg kann eine Makrozytose verursachen, die selbstlimitierend ist und häufig früh im Behandlungsverlauf auftritt. Die morphologische Veränderung ähnelt einer perniziösen Anämie, steht jedoch nicht im Zusammenhang mit einem Vitamin-B12- oder Folsäuremangel. Dies kann die Diagnose einer perniziösen Anämie verschleiern. Die prophylaktische Gabe von Folsäure wird empfohlen.
Lungentoxizität
Interstitielle Lungenerkrankungen einschließlich Lungenfibrose, Lungeninfiltration, Pneumonitis und Alveolitis/allergische Alveolitis (einschließlich tödlicher Fälle) wurden bei Patienten berichtet, die wegen einer myeloproliferativen Neoplasie behandelt wurden. Überwachen Sie Patienten, die Fieber, Husten, Dyspnoe oder andere respiratorische Symptome entwickeln, häufig, untersuchen Sie sie und behandeln Sie sie umgehend. Setzen Sie HYDREA 500 mg ab und behandeln Sie es mit Kortikosteroiden [siehe NEBENWIRKUNGEN ].
Interferenzen bei Labortests
Interferenzen mit Harnsäure-, Harnstoff- oder Milchsäure-Assays sind möglich, was zu falsch erhöhten Ergebnissen dieser bei mit Hydroxyharnstoff behandelten Patienten führen kann [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Herkömmliche Langzeitstudien zur Bewertung des kanzerogenen Potenzials von Hydroxyharnstoff wurden nicht durchgeführt. Die dreimal wöchentliche intraperitoneale Verabreichung von 125 bis 250 mg/kg Hydroxyharnstoff (etwa das 0,6- bis 1,2-fache der maximal empfohlenen oralen Tagesdosis beim Menschen auf mg/m2-Basis) an weibliche Ratten über 6 Monate erhöhte die Inzidenz von Brusttumoren bei überlebenden Ratten auf 18 Monate im Vergleich zur Kontrolle. Hydroxyharnstoff wirkt in vitro mutagen auf Bakterien, Pilze, Protozoen und Säugerzellen. Hydroxyharnstoff ist in vitro (Hamsterzellen, humane Lymphoblasten) und in vivo (SCE-Assay bei Nagern, Maus-Mikronukleus-Assay) klastogen. Hydroxyharnstoff bewirkt die Umwandlung von Nagetierembryozellen in einen tumorerzeugenden Phänotyp.
Hydroxyharnstoff, der männlichen Ratten in einer Dosis von 60 mg/kg/Tag verabreicht wurde (etwa das 0,3-fache der maximal empfohlenen menschlichen Tagesdosis auf mg/m2-Basis), führte zu einer Hodenatrophie, einer verringerten Spermatogenese und einer signifikanten Verringerung ihrer Fähigkeit, Weibchen zu befruchten.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
HYDREA kann basierend auf Erkenntnissen aus Tierversuchen und dem Wirkmechanismus des Arzneimittels den Fötus schädigen [siehe KLINISCHE PHARMAKOLOGIE ]. Es liegen keine Daten zur Anwendung von HYDREA bei Schwangeren vor, um über arzneimittelbedingte Risiken zu informieren. In Reproduktionsstudien an Tieren führte die Verabreichung von Hydroxyharnstoff an trächtige Ratten und Kaninchen während der Organogenese zu embryotoxischen und teratogenen Wirkungen bei Dosen, die dem 0,8-Fachen bzw. dem 0,3-Fachen der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis entsprachen (siehe Daten ). Weisen Sie Frauen auf das potenzielle Risiko für einen Fötus hin und darauf, eine Schwangerschaft während der Behandlung mit HYDREA zu vermeiden.
In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Daten
Tierdaten
Hydroxyharnstoff hat sich in einer Vielzahl von Tiermodellen, einschließlich Mäusen, Hamstern, Katzen, Zwergschweinen, Hunden und Affen, in Dosen innerhalb des 1-fachen der humanen Dosis auf mg/m2-Basis als starkes Teratogen erwiesen. Hydroxyharnstoff ist embryotoxisch und verursacht fötale Missbildungen (teilweise verknöcherte Schädelknochen, fehlende Augenhöhlen, Hydrozephalie, zweigeteilte Brustbeine, fehlende Lendenwirbel) bei 180 mg/kg/Tag (etwa das 0,8-fache der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis). bei Ratten und 30 mg/kg/Tag (etwa das 0,3-fache der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis) bei Kaninchen. Die Embryotoxizität war durch eine verminderte Lebensfähigkeit des Fötus, eine reduzierte Wurfgröße und Entwicklungsverzögerungen gekennzeichnet. Hydroxyharnstoff ist plazentagängig. Einzeldosen von ≥ 375 mg/kg (etwa das 1,7-fache der maximal empfohlenen Tagesdosis beim Menschen auf mg/m2-Basis) bei Ratten führten zu Wachstumsverzögerungen und beeinträchtigter Lernfähigkeit.
Stillzeit
Zusammenfassung der Risiken
Hydroxyharnstoff wird in die Muttermilch ausgeschieden. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von Hydroxyharnstoff bei einem gestillten Säugling, einschließlich Karzinogenität, sollte das Stillen während der Behandlung mit HYDREA unterbrochen werden.
Weibchen und Männchen mit reproduktivem Potenzial
Schwangerschaftstest
Überprüfen Sie den Schwangerschaftsstatus von Frauen im gebärfähigen Alter vor Beginn der HYDREA-Therapie.
Empfängnisverhütung
Frauen
HYDREA kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird [siehe Schwangerschaft ]. Raten Sie gebärfähigen Frauen, während und nach der Behandlung mit HYDREA für mindestens 6 Monate nach der Therapie eine wirksame Verhütungsmethode anzuwenden. Raten Sie Frauen, eine Schwangerschaft sofort zu melden.
Männchen
HYDREA 500 mg kann Spermatozoen und Hodengewebe schädigen, was zu möglichen genetischen Anomalien führen kann. Männer mit weiblichen Sexualpartnern im gebärfähigen Alter sollten während und nach der Behandlung mit HYDREA 500 mg für mindestens 1 Jahr nach der Therapie eine wirksame Empfängnisverhütung anwenden [siehe Nichtklinische Toxikologie ].
Unfruchtbarkeit
Männchen
Basierend auf Erkenntnissen bei Tieren und Menschen kann die männliche Fertilität durch die Behandlung mit HYDREA beeinträchtigt werden. Azoospermie oder Oligospermie, manchmal reversibel, wurde bei Männern beobachtet. Informieren Sie männliche Patienten vor Therapiebeginn über die Möglichkeit der Samenkonservierung [vgl NEBENWIRKUNGEN und Nichtklinische Toxikologie ].
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Ältere Patienten können empfindlicher auf die Wirkungen von Hydroxyharnstoff reagieren und benötigen möglicherweise ein niedrigeres Dosierungsschema. Hydroxyharnstoff wird über die Nieren ausgeschieden, und das Risiko von Nebenwirkungen dieses Arzneimittels kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte die Dosis sorgfältig ausgewählt werden und es kann sinnvoll sein, die Nierenfunktion zu überwachen [siehe DOSIERUNG UND ANWENDUNG ].
Nierenfunktionsstörung
Die Exposition gegenüber Hydroxyharnstoff ist bei Patienten mit einer Kreatinin-Clearance von weniger als 60 ml/min oder bei Patienten mit terminaler Niereninsuffizienz (ESRD) höher. Reduzieren Sie die Dosierung und überwachen Sie die hämatologischen Parameter engmaschig, wenn diesen Patienten HYDREA 500 mg verabreicht werden soll [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Es liegen keine Daten vor, die eine spezifische Anleitung zur Dosisanpassung bei Patienten mit eingeschränkter Leberfunktion unterstützen. Bei diesen Patienten wird eine engmaschige Überwachung der hämatologischen Parameter empfohlen.
ÜBERDOSIS
Akute mukokutane Toxizität wurde bei Patienten berichtet, die Hydroxyharnstoff in Dosierungen erhielten, die ein Vielfaches der therapeutischen Dosis waren. Schmerzen, violettes Erythem, Ödeme an Handflächen und Fußsohlen, gefolgt von Schuppenbildung an Händen und Füßen, schwere generalisierte Hyperpigmentierung der Haut und Stomatitis wurden ebenfalls beobachtet.
KONTRAINDIKATIONEN
HYDREA 500 mg ist kontraindiziert bei Patienten, die zuvor eine Überempfindlichkeit gegen Hydroxyharnstoff oder einen anderen Bestandteil der Formulierung gezeigt haben.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Der genaue Mechanismus, durch den Hydroxyharnstoff seine antineoplastischen Wirkungen entfaltet, kann derzeit nicht beschrieben werden. Die Berichte über verschiedene Studien in Gewebekulturen bei Ratten und Menschen unterstützen jedoch die Hypothese, dass Hydroxyharnstoff eine sofortige Hemmung der DNA-Synthese bewirkt, indem er als Ribonukleotid-Reduktase-Inhibitor wirkt, ohne die Synthese von Ribonukleinsäure oder Protein zu stören. Diese Hypothese erklärt, warum Hydroxyharnstoff unter bestimmten Bedingungen teratogene Wirkungen hervorrufen kann.
Für die erhöhte Wirksamkeit einer gleichzeitigen Anwendung einer Hydroxyharnstoff-Therapie mit einer Bestrahlung bei Plattenepithelkarzinomen (Epidermoid) des Kopfes und des Halses wurden drei Wirkmechanismen postuliert. In-vitro-Studien mit chinesischen Hamsterzellen legen nahe, dass Hydroxyharnstoff (1) für normalerweise strahlenresistente Zellen im S-Stadium tödlich ist und (2) andere Zellen des Zellzyklus im G1- oder Prä-DNA-Synthesestadium hält, wo sie am anfälligsten für die sind Auswirkungen der Bestrahlung. Der dritte Wirkungsmechanismus wurde auf der Grundlage von In-vitro-Untersuchungen an HeLa-Zellen theoretisiert. Es scheint, dass Hydroxyharnstoff durch Hemmung der DNA-Synthese den normalen Reparaturprozess von Zellen behindert, die durch Bestrahlung beschädigt, aber nicht getötet wurden, wodurch ihre Überlebensrate verringert wird; RNA- und Proteinsynthesen haben keine Veränderung gezeigt.
Pharmakokinetik
Absorption
Nach oraler Gabe von HYDREA erreicht Hydroxyharnstoff innerhalb von 1 bis 4 Stunden maximale Plasmakonzentrationen. Die mittleren maximalen Plasmakonzentrationen und AUCs steigen mehr als proportional mit steigender Dosis.
Es liegen keine Daten zur Wirkung von Nahrung auf die Resorption von Hydroxyharnstoff vor.
Verteilung
Hydroxyharnstoff verteilt sich im ganzen Körper mit einem Verteilungsvolumen, das ungefähr dem des gesamten Körperwassers entspricht.
Hydroxyurea reichert sich in Leukozyten und Erythrozyten an.
Stoffwechsel
Bis zu 60 % einer oralen Dosis werden durch den sättigbaren Leberstoffwechsel und einen geringfügigen Abbauweg durch die in Darmbakterien vorkommende Urease umgewandelt.
Ausscheidung
Bei Patienten mit Sichelzellenanämie betrug die mittlere kumulative Wiederfindung von Hydroxyharnstoff im Urin etwa 40 % der verabreichten Dosis.
Spezifische Populationen
Nierenfunktionsstörung
Die Auswirkung einer Nierenfunktionsstörung auf die Pharmakokinetik von Hydroxyharnstoff wurde bei erwachsenen Patienten mit Sichelzellanämie und Nierenfunktionsstörung untersucht. Patienten mit normaler Nierenfunktion (Kreatinin-Clearance [CrCl] > 80 ml/min), leicht (CrCl 50-80 ml/min), mäßig (CrCl = 30- 60 ml/min). Reduzieren Sie die Dosis von HYDREA 500 mg, wenn es Patienten mit einer Kreatinin-Clearance von DOSIERUNG UND ANWENDUNG und Verwendung in bestimmten Bevölkerungsgruppen ].