Krebsbehandlung: Nolvadex 10mg, 20mg Tamoxifen Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Nolvadex und wie wird es angewendet?
Nolvadex 10 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Brustkrebs. Nolvadex kann allein oder mit anderen Medikamenten verwendet werden.
Nolvadex 20 mg gehört zu einer Klasse von Arzneimitteln, die Antineoplastika, Östrogenrezeptorantagonisten, genannt werden.
Es ist nicht bekannt, ob Nolvadex 20 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Nolvadex 20 mg haben?
Nolvadex kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Nolvadex gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Nolvadex. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
WARNUNG
Für Frauen mit duktalem Karzinom in situ (DCIS) und Frauen mit hohem Brustkrebsrisiko: Zu den schwerwiegenden und lebensbedrohlichen Ereignissen im Zusammenhang mit NOLVADEX (Tamoxifencitrat) im Rahmen der Risikominderung (Frauen mit hohem Krebsrisiko und Frauen mit DCIS) gehören bösartige Uterustumoren, Schlaganfall und Lungenembolie. Die Inzidenzraten für diese Ereignisse wurden anhand der NSABP-P-1-Studie geschätzt (vgl KLINISCHE PHARMAKOLOGIE – Klinische Studien – Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko ). Uterusmalignome bestehen sowohl aus Endometriumadenokarzinom (Inzidenzrate pro 1.000 Frauenjahre von 2,20 für NOLVADEX (Tamoxifencitrat) gegenüber 0,71 für Placebo) als auch aus Uterussarkom (Inzidenzrate pro 1.000 Frauenjahre von 0,17 für NOLVADEX (Tamoxifencitrat) gegenüber 0,4 für Placebo)*. Beim Schlaganfall betrug die Inzidenzrate pro 1.000 Frauenjahre 1,43 für NOLVADEX (Tamoxifencitrat) gegenüber 1,00 für Placebo**. Bei Lungenembolie betrug die Inzidenzrate pro 1.000 Frauenjahre 0,75 für NOLVADEX (Tamoxifencitrat) gegenüber 0,25 für Placebo**.
Einige der Schlaganfälle, Lungenembolien und Uterusmalignome verliefen tödlich.
Gesundheitsdienstleister sollten den potenziellen Nutzen gegenüber den potenziellen Risiken dieser schwerwiegenden Ereignisse mit Frauen mit hohem Brustkrebsrisiko und Frauen mit DCIS besprechen, die NOLVADEX (Tamoxifencitrat) in Betracht ziehen, um ihr Risiko, an Brustkrebs zu erkranken, zu verringern.
Der Nutzen von NOLVADEX (Tamoxifencitrat) überwiegt seine Risiken bei Frauen, bei denen bereits Brustkrebs diagnostiziert wurde.
VERWEISE
*Aktualisierte Langzeit-Follow-up-Daten (mediane Dauer der Follow-up beträgt 6,9 Jahre) aus der NSABP P-1-Studie. Sehen WARNHINWEISE: Auswirkungen auf Uterus-Endometrium-Krebs und Uterus-Sarkom .
**Siehe Tabelle 3 unten KLINISCHE PHARMAKOLOGIE-Klinische Studien .
BEZEICHNUNG
NOLVADEX® (Tamoxifencitrat) Tabletten, ein nichtsteroidales Antiöstrogen, sind zur oralen Verabreichung bestimmt. NOLVADEX (Tamoxifen Citrat) Tabletten sind erhältlich als:
10-mg-Tabletten
Jede Tablette enthält 15,2 mg Tamoxifencitrat, was 10 mg Tamoxifen entspricht.
20 mg Tabletten
Jede Tablette enthält 30,4 mg Tamoxifencitrat, was 20 mg Tamoxifen entspricht.
Inaktive Inhaltsstoffe: Carboxymethylcellulose-Calcium, Magnesiumstearat, Mannit und Stärke.
Chemisch gesehen ist NOLVADEX (Tamoxifencitrat) das trans-Isomer eines Triphenylethylen-Derivats. Die chemische Bezeichnung lautet (Z)2-[4-(1,2-Diphenyl-1-butenyl)phenoxy]-N,N-dimethylethanamin-2-hydroxy-1,2,3-propantricarboxylat (1:1). Die Struktur- und Summenformeln lauten:
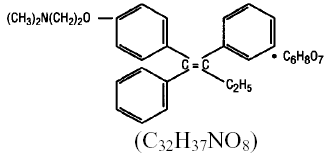
Tamoxifencitrat hat ein Molekulargewicht von 563,62, der pKa' beträgt 8,85, die Gleichgewichtslöslichkeit in Wasser bei 37°C beträgt 0,5 mg/ml und in 0,02 N HCl bei 37°C beträgt sie 0,2 mg/ml.
INDIKATIONEN
Metastasierter Brustkrebs
NOLVADEX (Tamoxifencitrat) ist bei der Behandlung von metastasierendem Brustkrebs bei Frauen und Männern wirksam. Bei prämenopausalen Frauen mit metastasiertem Brustkrebs ist NOLVADEX (Tamoxifencitrat) eine Alternative zur Ovarektomie oder Bestrahlung der Eierstöcke. Die verfügbaren Beweise deuten darauf hin, dass Patienten, deren Tumore Östrogenrezeptor-positiv sind, eher von einer NOLVADEX (Tamoxifencitrat)-Therapie profitieren.
Adjuvante Behandlung von Brustkrebs
NOLVADEX (Tamoxifencitrat) ist für die Behandlung von nodalpositivem Brustkrebs bei Frauen nach totaler Mastektomie oder segmentaler Mastektomie, Axilladissektion und Brustbestrahlung indiziert. In einigen adjuvanten Studien mit NOLVADEX (Tamoxifencitrat) war der größte Nutzen bisher in der Untergruppe mit vier oder mehr positiven Achselknoten zu verzeichnen.
NOLVADEX (Tamoxifencitrat) ist indiziert zur Behandlung von axillärem nodal-negativem Brustkrebs bei Frauen nach totaler Mastektomie oder segmentaler Mastektomie, Axilladissektion und Brustbestrahlung.
Die Östrogen- und Progesteronrezeptorwerte können bei der Vorhersage helfen, ob eine adjuvante Therapie mit NOLVADEX (Tamoxifencitrat) wahrscheinlich von Nutzen ist.
NOLVADEX (Tamoxifencitrat) reduziert das Auftreten von kontralateralem Brustkrebs bei Patientinnen, die eine adjuvante NOLVADEX (Tamoxifencitrat)-Therapie gegen Brustkrebs erhalten.
Duktales Karzinom in situ (DCIS)
Bei Frauen mit DCIS ist nach einer Brustoperation und Bestrahlung NOLVADEX (Tamoxifencitrat) indiziert, um das Risiko eines invasiven Brustkrebses zu verringern (siehe Eingerahmte Warnung am Anfang des Etiketts). Die Entscheidung über eine Therapie mit NOLVADEX (Tamoxifencitrat) zur Verringerung der Brustkrebsinzidenz sollte auf einer individuellen Nutzen-Risiko-Abwägung der Therapie mit NOLVADEX (Tamoxifencitrat) beruhen.
Aktuelle Daten aus klinischen Studien unterstützen eine fünfjährige adjuvante Therapie mit NOLVADEX (Tamoxifencitrat) bei Patientinnen mit Brustkrebs.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko
NOLVADEX (Tamoxifencitrat) ist angezeigt, um das Auftreten von Brustkrebs bei Frauen mit hohem Brustkrebsrisiko zu verringern. Dieser Effekt wurde in einer Studie mit einer geplanten Dauer von 5 Jahren und einer medianen Nachbeobachtungszeit von 4,2 Jahren gezeigt. Fünfundzwanzig Prozent der Teilnehmer erhielten das Medikament für 5 Jahre. Die längerfristigen Wirkungen sind nicht bekannt. In dieser Studie hatte Tamoxifen keinen Einfluss auf die Gesamtmortalität oder die brustkrebsbedingte Mortalität (vgl Eingerahmte Warnung am Anfang des Etiketts).
NOLVADEX (Tamoxifencitrat) ist nur für Frauen mit hohem Risiko angezeigt. „Hohes Risiko“ ist definiert als Frauen im Alter von mindestens 35 Jahren mit einem prognostizierten 5-Jahres-Brustkrebsrisiko von ≥ 1,67 %, berechnet nach dem Gail-Modell.
Beispiele für Kombinationen von Faktoren, die ein 5-Jahres-Risiko von ≥ 1,67 % vorhersagen, sind:
Alter 35 oder älter und eine der folgenden Kombinationen von Faktoren:
Alter 40 oder älter und eine der folgenden Kombinationen von Faktoren:
Alter 45 oder älter und eine der folgenden Kombinationen von Faktoren:
Alter 50 oder älter und eine der folgenden Kombinationen von Faktoren:
Alter 55 oder älter und eine der folgenden Kombinationen von Faktoren:
Alter 60 oder älter und:
Für Frauen, deren Risikofaktoren in den obigen Beispielen nicht beschrieben sind, ist das Gail-Modell notwendig, um das absolute Brustkrebsrisiko abzuschätzen. Angehörige der Gesundheitsberufe können unter der Rufnummer 1-800-544-2007 ein Gail-Modell-Risikobewertungstool erhalten.
Es liegen keine ausreichenden Daten zur Wirkung von NOLVADEX (Tamoxifencitrat) auf die Brustkrebsinzidenz bei Frauen mit erblichen Mutationen (BRCA1, BRCA2) vor, um spezifische Empfehlungen zur Wirksamkeit von NOLVADEX (Tamoxifencitrat) bei diesen Patientinnen geben zu können.
Nach einer Einschätzung des Brustkrebsrisikos sollte die Entscheidung über eine Therapie mit NOLVADEX (Tamoxifencitrat) zur Verringerung der Brustkrebsinzidenz auf einer individuellen Nutzen-Risiko-Abwägung der NOLVADEX (Tamoxifencitrat)-Therapie beruhen. In der NSABP P-1-Studie senkte die Behandlung mit NOLVADEX (Tamoxifencitrat) das Risiko, während der Nachbeobachtungszeit an Brustkrebs zu erkranken, eliminierte das Brustkrebsrisiko jedoch nicht (siehe Tabelle 3 in KLINISCHE PHARMAKOLOGIE ).
DOSIERUNG UND ANWENDUNG
Für Patientinnen mit Brustkrebs beträgt die empfohlene Tagesdosis 20-40 mg. Dosierungen über 20 mg pro Tag sollten in aufgeteilten Dosen (morgens und abends) verabreicht werden.
In drei Einzelwirkstoff-adjuvanten Studien an Frauen wurde eine 10-mg-NOLVADEX (Tamoxifencitrat)-Tablette zwei (ECOG und NATO) oder drei (Toronto) Mal täglich über zwei Jahre verabreicht. In der adjuvanten NSABP-B-14-Studie bei Frauen mit nodal negativem Brustkrebs wurde mindestens 5 Jahre lang zweimal täglich eine 10-mg-NOLVADEX-Tablette (Tamoxifencitrat) verabreicht. Die Ergebnisse der B-14-Studie deuten darauf hin, dass eine Fortführung der Therapie über fünf Jahre hinaus keinen zusätzlichen Nutzen bringt (vgl KLINISCHE PHARMAKOLOGIE ). In der EBCTCG-Übersicht von 1995 war die Reduktion von Rezidiven und Mortalität in den Studien, in denen Tamoxifen über etwa 5 Jahre angewendet wurde, größer als in den Studien, in denen Tamoxifen über einen kürzeren Therapiezeitraum angewendet wurde. Es gab keinen Hinweis darauf, dass Dosen von mehr als 20 mg pro Tag wirksamer waren. Aktuelle Daten aus klinischen Studien unterstützen eine 5-jährige adjuvante Therapie mit NOLVADEX (Tamoxifencitrat) bei Patientinnen mit Brustkrebs.
Duktales Karzinom in situ (DCIS)
Die empfohlene Dosis beträgt 20 mg NOLVADEX (Tamoxifencitrat) täglich über 5 Jahre.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko
Die empfohlene Dosis beträgt 20 mg NOLVADEX (Tamoxifencitrat) täglich über 5 Jahre. Es liegen keine Daten vor, die die Anwendung von NOLVADEX (Tamoxifencitrat) über einen Zeitraum von 5 Jahren hinaus belegen (siehe KLINISCHE PHARMAKOLOGIE – Klinische Studien – Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko ).
WIE GELIEFERT
10-mg-Tabletten die Tamoxifen als Citrat in einer Menge enthalten, die 10 mg Tamoxifen entspricht (runde, bikonvexe, nicht überzogene, weiße Tablette, gekennzeichnet mit NOLVADEX (Tamoxifencitrat) 600 mit der Prägung auf einer Seite und einer Cameo-Prägung auf der anderen Seite) sind in Flaschen mit 60 Stück erhältlich Tablets. NDC 0310-0600-60.
20 mg Tabletten enthält Tamoxifen als Citrat in einer Menge, die 20 mg Tamoxifen entspricht (runde, bikonvexe, unbeschichtete, weiße Tablette, gekennzeichnet mit NOLVADEX (Tamoxifencitrat) 604 mit der Prägung auf einer Seite und einer Cameo-Prägung auf der anderen Seite) sind in Flaschen mit 30 Stück erhältlich Tablets. NDC 0310-0604-30.
Bei kontrollierter Raumtemperatur lagern, 20-25°C (68-77°F) [siehe USP]. In einen gut verschlossenen, lichtbeständigen Behälter füllen.
*Coumadin® ist eine eingetragene Marke von Bristol-Myers Squibb Pharmaceuticals. Alle anderen Warenzeichen sind Eigentum der AstraZeneca-Gruppe, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev. 27.09.05. Revisionsdatum der FDA: 9.3.2006
NEBENWIRKUNGEN
Die Nebenwirkungen von NOLVADEX (Tamoxifencitrat) sind relativ mild und selten so schwerwiegend, dass ein Abbruch der Behandlung bei Brustkrebspatientinnen erforderlich ist.
Fortgesetzte klinische Studien haben zu weiteren Informationen geführt, die das Auftreten von Nebenwirkungen unter NOLVADEX (Tamoxifencitrat) im Vergleich zu Placebo besser anzeigen.
Metastasierter Brustkrebs
Verstärkte Knochen- und Tumorschmerzen sowie lokale Krankheitsschübe sind aufgetreten, die manchmal mit einem guten Ansprechen des Tumors einhergehen. Patienten mit verstärkten Knochenschmerzen können zusätzliche Analgetika benötigen. Bei Patienten mit Weichteilerkrankungen kann es zu einer plötzlichen Größenzunahme vorbestehender Läsionen kommen, die manchmal mit einem ausgeprägten Erythem innerhalb und um die Läsionen und/oder der Entwicklung neuer Läsionen einhergeht. Wenn sie auftreten, werden die Knochenschmerzen oder Krankheitsschübe kurz nach Beginn der Behandlung mit NOLVADEX (Tamoxifencitrat) beobachtet und klingen im Allgemeinen schnell ab.
Bei Patientinnen, die mit NOLVADEX (Tamoxifencitrat) wegen metastasiertem Brustkrebs behandelt wurden, sind Hitzewallungen die häufigste Nebenwirkung von NOLVADEX (Tamoxifencitrat).
Andere Nebenwirkungen, die selten beobachtet werden, sind Hyperkalzämie, periphere Ödeme, Abneigung gegen Nahrung, Pruritus vulva, Depression, Schwindel, Benommenheit, Kopfschmerzen, dünner werdendes Haar und/oder teilweiser Haarausfall und vaginale Trockenheit.
Frauen vor der Menopause
Die folgende Tabelle fasst die Inzidenz von Nebenwirkungen zusammen, die mit einer Häufigkeit von 2 % oder mehr aus klinischen Studien (Ingle, Pritchard, Buchanan) berichtet wurden, in denen eine NOLVADEX (Tamoxifencitrat)-Therapie mit einer Ovarialablation bei prämenopausalen Patientinnen mit metastasiertem Brustkrebs verglichen wurde.
Männlicher Brustkrebs
NOLVADEX (Tamoxifencitrat) wird von Männern mit Brustkrebs gut vertragen. Berichte aus der Literatur und Fallberichte deuten darauf hin, dass das Sicherheitsprofil von NOLVADEX (Tamoxifencitrat) bei Männern ähnlich ist wie bei Frauen. Libidoverlust und Impotenz haben bei männlichen Patienten zum Abbruch der Tamoxifen-Therapie geführt. Auch bei oligospermischen Männern, die mit Tamoxifen behandelt wurden, waren die LH-, FSH-, Testosteron- und Östrogenspiegel erhöht. Es wurden keine signifikanten klinischen Veränderungen berichtet.
Adjuvanter Brustkrebs
In der NSABP-B-14-Studie wurden Frauen mit axillärem Lymphknoten-negativem Brustkrebs nach der primären Operation zu 5 Jahren NOLVADEX (Tamoxifencitrat) 20 mg/Tag oder Placebo randomisiert. Die berichteten Nebenwirkungen sind unten tabellarisch aufgeführt (mittlere Nachbeobachtungszeit von etwa 6,8 Jahren), wobei Nebenwirkungen häufiger unter NOLVADEX (Tamoxifencitrat) als unter Placebo aufgezeigt wurden. Die Inzidenz von Hitzewallungen (64 % vs. 48 %), vaginalem Ausfluss (30 % vs. 15 %) und unregelmäßiger Menstruation (25 % vs. 19 %) war unter NOLVADEX (Tamoxifencitrat) höher als unter Placebo. Alle anderen Nebenwirkungen traten in den beiden Behandlungsgruppen mit ähnlicher Häufigkeit auf, mit Ausnahme von thrombotischen Ereignissen; eine höhere Inzidenz wurde bei mit NOLVADEX (Tamoxifencitrat) behandelten Patienten beobachtet (über 5 Jahre, 1,7 % vs. 0,4 %). Zwei der mit NOLVADEX (Tamoxifencitrat) behandelten Patienten mit thrombotischen Ereignissen starben.
In der adjuvanten Brustkrebsstudie der Eastern Cooperative Oncology Group (ECOG) wurde Frauen nach Mastektomie zwei Jahre lang NOLVADEX (Tamoxifencitrat) oder Placebo verabreicht. Im Vergleich zu Placebo zeigte NOLVADEX (Tamoxifencitrat) eine signifikant höhere Inzidenz von Hitzewallungen (19 % vs. 8 % bei Placebo). Die Inzidenz aller anderen Nebenwirkungen war in den beiden Behandlungsgruppen ähnlich, mit Ausnahme von Thrombozytopenie, wo die Inzidenz für NOLVADEX (Tamoxifencitrat) 10 % gegenüber 3 % für Placebo betrug, eine Beobachtung von grenzwertiger statistischer Signifikanz.
In anderen adjuvanten Studien, Toronto und NOLVADEX (Tamoxifencitrat) Adjuvant Trial Organization (NATO), erhielten Frauen entweder NOLVADEX (Tamoxifencitrat) oder keine Therapie. In der Toronto-Studie wurden Hitzewallungen bei 29 % der Patienten unter NOLVADEX (Tamoxifencitrat) gegenüber 1 % in der unbehandelten Gruppe beobachtet. In der NATO-Studie wurden Hitzewallungen und vaginale Blutungen bei 2,8 % bzw. 2,0 % der Frauen für NOLVADEX (Tamoxifencitrat) berichtet, gegenüber jeweils 0,2 % in der unbehandelten Gruppe.
Adjuvante Anastrozol-Studie – Studie zu Anastrozol im Vergleich zu NOLVADEX (Tamoxifencitrat) zur adjuvanten Behandlung von Brustkrebs im Frühstadium (sehen KLINISCHE PHARMAKOLOGIE - Klinische Studien).
Bei einer medianen Nachbeobachtungszeit von 33 Monaten zeigte die Kombination von Anastrozol und NOLVADEX (Tamoxifencitrat) keinen Wirksamkeitsvorteil im Vergleich zur NOLVADEX (Tamoxifencitrat)-Therapie allein bei allen Patienten sowie in der hormonrezeptorpositiven Subpopulation. Dieser Behandlungsarm wurde aus der Studie ausgeschlossen. Die mediane Dauer der adjuvanten Behandlung zur Sicherheitsbewertung betrug 59,8 Monate bzw. 59,6 Monate bei Patienten, die Anastrozol 1 mg bzw. NOLVADEX (Tamoxifencitrat) 20 mg erhielten.
Nebenwirkungen, die mit einer Inzidenz von mindestens 5 % in jeder Behandlungsgruppe während der Behandlung oder innerhalb von 14 Tagen nach Behandlungsende auftraten, sind in der folgenden Tabelle aufgeführt.
Nebenwirkungen, die mit einer Inzidenz von mindestens 5 % in jeder Behandlungsgruppe während der Behandlung oder innerhalb von 14 Tagen nach Behandlungsende auftreten
Bestimmte unerwünschte Ereignisse und Kombinationen von unerwünschten Ereignissen wurden prospektiv für die Analyse spezifiziert, basierend auf den bekannten pharmakologischen Eigenschaften und Nebenwirkungsprofilen der beiden Medikamente (siehe folgende Tabelle).
Anzahl (%) der Patienten mit vorab festgelegten unerwünschten Ereignissen in der Anastrozol-Adjuvans-Studie1
Patienten, die Anastrozol erhielten, hatten eine Zunahme von Gelenkerkrankungen (einschließlich Arthritis, Arthrose und Arthralgie) im Vergleich zu Patienten, die NOLVADEX (Tamoxifencitrat) erhielten. Patienten, die Anastrozol erhielten, hatten eine erhöhte Inzidenz aller Frakturen (insbesondere Frakturen der Wirbelsäule, Hüfte und des Handgelenks) [315 (10 %)] im Vergleich zu Patienten, die NOLVADEX (Tamoxifencitrat) erhielten [209 (7 %)]. Patienten, die Anastrozol erhielten, hatten im Vergleich zu Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, weniger Hitzewallungen, vaginale Blutungen, vaginalen Ausfluss, Gebärmutterschleimhautkrebs, venöse thromboembolische Ereignisse und ischämische zerebrovaskuläre Ereignisse.
Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, hatten eine Abnahme der Hypercholesterinämie (108 [3,5 %]) im Vergleich zu Patienten, die Anastrozol erhielten (278 [9 %]). Angina pectoris wurde bei 71 [2,3 %] Patienten im Anastrozol-Arm und 51 [1,6 %] Patienten im NOLVADEX (Tamoxifencitrat)-Arm berichtet; Myokardinfarkt wurde bei 37 [1,2 %] Patienten im Anastrozol-Arm und bei 34 [1,1 %] Patienten im NOLVADEX (Tamoxifencitrat)-Arm berichtet.
Die Ergebnisse der adjuvanten Knochensubstudie nach 12 und 24 Monaten zeigten, dass Patienten, die Anastrozol erhielten, im Vergleich zum Ausgangswert eine mittlere Abnahme sowohl der Lendenwirbelsäule als auch der Knochenmineraldichte (BMD) der gesamten Hüfte aufwiesen. Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, hatten im Vergleich zum Ausgangswert einen mittleren Anstieg sowohl der Lendenwirbelsäule als auch der gesamten Hüft-BMD.
Duktales Karzinom in situ (DCIS)
Art und Häufigkeit der unerwünschten Ereignisse in der NSABP B-24-Studie stimmten mit denen überein, die in den anderen mit NOLVADEX (Tamoxifencitrat) durchgeführten adjuvanten Studien beobachtet wurden.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko
In der NSABP P-1-Studie gab es eine Zunahme von fünf schwerwiegenden Nebenwirkungen in der NOLVADEX (Tamoxifen-Citrat)-Gruppe: Endometriumkarzinom (33 Fälle in der NOLVADEX (Tamoxifen-Citrat)-Gruppe vs. 14 in der Placebo-Gruppe); Lungenembolie (18 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe vs. 6 in der Placebo-Gruppe); tiefe Venenthrombose (30 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe vs. 19 in der Placebo-Gruppe); Schlaganfall (34 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe vs. 24 in der Placebo-Gruppe); Kataraktbildung (540 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe vs. 483 in der Placebogruppe) und Kataraktoperation (101 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe vs. 63 in der Placebogruppe) (siehe WARNUNGEN und Tabelle 3 in KLINISCHE PHARMAKOLOGIE ).
Die folgende Tabelle zeigt die bei NSABP P-1 beobachteten unerwünschten Ereignisse nach Behandlungsarm. Es werden nur Nebenwirkungen gezeigt, die unter NOLVADEX (Tamoxifencitrat) häufiger auftreten als unter Placebo.
In der NSABP P-1-Studie brachen 15,0 % bzw. 9,7 % der Teilnehmer, die NOLVADEX (Tamoxifencitrat) bzw. Placebo erhielten, die Studie aus medizinischen Gründen ab. Im Folgenden sind die medizinischen Gründe für das Absetzen von NOLVADEX (Tamoxifencitrat) bzw. Placebo aufgeführt: Hitzewallungen (3,1 % vs. 1,5 %) und Vaginalausfluss (0,5 % vs. 0,1 %).
In der NSABP-P-1-Studie brachen 8,7 % bzw. 9,6 % der Teilnehmer, die NOLVADEX (Tamoxifencitrat) bzw. Placebo erhielten, die Behandlung aus nicht-medizinischen Gründen ab.
In der NSABP-P-1-Studie traten Hitzewallungen jeglicher Schwere bei 68 % der Frauen unter Placebo und bei 80 % der Frauen unter NOLVADEX (Tamoxifencitrat) auf. Schwere Hitzewallungen traten bei 28 % der Frauen unter Placebo und 45 % der Frauen unter NOLVADEX (Tamoxifencitrat) auf. Vaginaler Ausfluss trat bei 35 % bzw. 55 % der Frauen unter Placebo bzw. NOLVADEX (Tamoxifencitrat) auf; und war bei 4,5 % bzw. 12,3 % schwerwiegend. Zwischen den Behandlungsarmen gab es keinen Unterschied in der Inzidenz vaginaler Blutungen.
Pädiatrische Patienten – McCune-Albright-Syndrom
Das mittlere Uterusvolumen stieg nach 6-monatiger Behandlung an und verdoppelte sich am Ende der einjährigen Studie. Ein kausaler Zusammenhang wurde nicht hergestellt; Da jedoch bei Erwachsenen, die mit NOLVADEX behandelt wurden, eine erhöhte Inzidenz von Endometrium-Adenokarzinom und Uterussarkom festgestellt wurde (siehe Eingerahmte Warnung wird eine kontinuierliche Überwachung der mit NOLVADEX (Tamoxifencitrat) behandelten McCune-Albright-Patienten auf Langzeitwirkungen empfohlen. Die Sicherheit und Wirksamkeit von NOLVADEX (Tamoxifencitrat) bei Mädchen im Alter von 2 bis 10 Jahren mit McCune-Albright-Syndrom und verfrühter Pubertät wurden nicht über eine Behandlungsdauer von einem Jahr hinaus untersucht. Die Langzeitwirkungen einer Therapie mit NOLVADEX (Tamoxifencitrat) bei Mädchen wurden nicht nachgewiesen.
Postmarketing-Erfahrung
Weniger häufig berichtete Nebenwirkungen sind vaginale Blutungen, vaginaler Ausfluss, Menstruationsunregelmäßigkeiten, Hautausschlag und Kopfschmerzen. In der Regel waren diese nicht so schwerwiegend, dass eine Dosisreduktion oder ein Abbruch der Behandlung erforderlich wäre. Sehr seltene Berichte über Erythema multiforme, Stevens-Johnson-Syndrom, bullöses Pemphigoid, interstitielle Pneumonitis und seltene Berichte über Überempfindlichkeitsreaktionen einschließlich Angioödem wurden unter der Therapie mit NOLVADEX (Tamoxifencitrat) berichtet. In einigen dieser Fälle betrug die Zeit bis zum Auftreten mehr als ein Jahr. In seltenen Fällen kann die Anwendung von NOLVADEX (Tamoxifencitrat) mit einer Erhöhung der Triglyceridspiegel im Serum, in einigen Fällen mit einer Pankreatitis, einhergehen (siehe VORSICHTSMASSNAHMEN - Wechselwirkungen zwischen Arzneimitteln und Labortests Sektion).
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Wenn NOLVADEX (Tamoxifencitrat) in Kombination mit Antikoagulantien vom Cumarin-Typ angewendet wird, kann es zu einer signifikanten Verstärkung der gerinnungshemmenden Wirkung kommen. Wenn eine solche gleichzeitige Verabreichung erfolgt, wird eine sorgfältige Überwachung der Prothrombinzeit des Patienten empfohlen.
In der NSABP-P-1-Studie waren Frauen, die aus irgendeinem Grund Antikoagulanzien vom Cumarin-Typ benötigten, von der Teilnahme an der Studie ausgeschlossen (siehe KONTRAINDIKATIONEN ).
Es besteht ein erhöhtes Risiko für thromboembolische Ereignisse, wenn Zytostatika in Kombination mit NOLVADEX (Tamoxifencitrat) angewendet werden.
Tamoxifen reduzierte die Plasmakonzentration von Letrozol um 37 %. Die Wirkung von Tamoxifen auf den Metabolismus und die Ausscheidung anderer antineoplastischer Arzneimittel wie Cyclophosphamid und anderer Arzneimittel, die Mischfunktions-Oxidasen zur Aktivierung benötigen, ist nicht bekannt. Es wurde gezeigt, dass die Plasmakonzentrationen von Tamoxifen und N-Desmethyl-Tamoxifen bei gleichzeitiger Anwendung mit Rifampin oder Aminoglutethimid verringert sind. Es wird angenommen, dass die Induktion des CYP3A4-vermittelten Metabolismus der Mechanismus ist, durch den diese Reduktionen auftreten; andere CYP3A4-Induktoren wurden nicht untersucht, um diese Wirkung zu bestätigen.
Ein Patient, der NOLVADEX (Tamoxifencitrat) zusammen mit Phenobarbital erhielt, wies einen Steady-State-Serumspiegel von Tamoxifen auf, der niedriger war als bei anderen Patienten (dh 26 ng/ml gegenüber einem Mittelwert von 122 ng/ml). Die klinische Bedeutung dieses Befundes ist jedoch nicht bekannt. Rifampin induzierte den Metabolismus von Tamoxifen und reduzierte die Plasmakonzentrationen von Tamoxifen bei 10 Patienten signifikant. Aminoglutethimid senkt die Plasmakonzentrationen von Tamoxifen und N-Desmethyl-Tamoxifen. Medroxyprogesteron reduziert die Plasmakonzentrationen von N-Desmethyl, aber nicht von Tamoxifen.
Es wurde gezeigt, dass die gleichzeitige Behandlung mit Bromocriptin die Werte für Tamoxifen und N-Desmethyl-Tamoxifen im Serum erhöht.
Basierend auf den klinischen und pharmakokinetischen Ergebnissen der Anastrozol-Adjuvans-Studie sollte NOLVADEX (Tamoxifencitrat) nicht zusammen mit Anastrozol verabreicht werden (siehe KLINISCHE PHARMAKOLOGIE - Wechselwirkungen zwischen Arzneimitteln Sektion).
Wechselwirkungen zwischen Arzneimitteln und Labortests
Während der Postmarketing-Überwachung wurden bei einigen postmenopausalen Patientinnen T4-Erhöhungen berichtet, die durch Erhöhungen des Schilddrüsen-bindenden Globulins erklärt werden könnten. Diese Erhöhungen wurden nicht von einer klinischen Hyperthyreose begleitet.
Bei postmenopausalen Patientinnen, die NOLVADEX (Tamoxifencitrat) erhielten, wurden selten Schwankungen des karyopyknotischen Index auf Vaginalabstrichen und verschiedene Grade der Östrogenwirkung auf Pap-Abstrichen beobachtet.
In der Postmarketing-Erfahrung mit NOLVADEX (Tamoxifencitrat) wurden seltene Fälle von Hyperlipidämien berichtet. Bei Patienten mit vorbestehender Hyperlipidämie kann eine regelmäßige Überwachung der Plasmatriglyzeride und des Cholesterins angezeigt sein (vgl NEBENWIRKUNGEN-Postmarketing-Erfahrung Sektion).
WARNUNGEN
Wirkungen bei Patienten mit metastasierendem Brustkrebs
Wie bei anderen additiven Hormontherapien (Östrogene und Androgene) wurde bei einigen Brustkrebspatientinnen mit Knochenmetastasen innerhalb weniger Wochen nach Beginn der Behandlung mit NOLVADEX (Tamoxifencitrat) über Hyperkalzämie berichtet. Wenn eine Hyperkalzämie auftritt, sollten geeignete Maßnahmen ergriffen werden und, falls schwerwiegend, NOLVADEX (Tamoxifencitrat) abgesetzt werden.
Auswirkungen auf den Uterus-Endometrium-Krebs und das Uterus-Sarkom
Im Zusammenhang mit der Behandlung mit NOLVADEX (Tamoxifencitrat) wurde über eine erhöhte Inzidenz von Uterusmalignomen berichtet. Der zugrunde liegende Mechanismus ist unbekannt, könnte aber mit der östrogenähnlichen Wirkung von NOLVADEX (Tamoxifencitrat) zusammenhängen. Die meisten Uterusmalignome, die im Zusammenhang mit NOLVADEX (Tamoxifencitrat) beobachtet wurden, werden als Adenokarzinom des Endometriums klassifiziert. Es wurde jedoch auch über seltene Uterussarkome, einschließlich maligner gemischter Müller-Tumoren (MMMT), berichtet. Das Uterussarkom ist im Allgemeinen mit einem höheren FIGO-Stadium (III/IV) bei der Diagnose, einer schlechteren Prognose und einem kürzeren Überleben verbunden. Es wurde berichtet, dass Uterussarkom bei Langzeitanwenderinnen (≥ 2 Jahre) von NOLVADEX (Tamoxifencitrat) häufiger auftritt als bei Nichtanwenderinnen. Einige der Uterusmalignome (Endometriumkarzinom oder Uterussarkom) verliefen tödlich.
In der NSABP-P-1-Studie gab es bei Teilnehmern, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden, einen statistisch signifikanten Anstieg der Inzidenz von Endometriumkarzinom (33 Fälle von invasivem Endometriumkarzinom im Vergleich zu 14 Fällen bei Teilnehmern, die zu Placebo randomisiert wurden (RR = 2,48 , 95 % KI: 1,27-4,92).Die 33 Fälle bei Teilnehmern, die NOLVADEX (Tamoxifencitrat) erhielten, waren FIGO-Stadium I, einschließlich 20 IA-, 12 IB- und 1 IC-Endometrium-Adenokarzinomen. Von den Teilnehmern, die randomisiert Placebo erhielten, waren 13 FIGO-Stadium I (8 IA und 5 IB) und 1 war FIGO-Stadium IV. Fünf Frauen unter NOLVADEX (Tamoxifencitrat) und 1 unter Placebo erhielten zusätzlich zur Operation eine postoperative Strahlentherapie.Diese Zunahme wurde hauptsächlich bei Frauen im Alter von mindestens 50 Jahren beobachtet Zeitpunkt der Randomisierung (26 Fälle von invasivem Endometriumkarzinom, verglichen mit 6 Fällen bei Teilnehmern, die randomisiert Placebo erhielten (RR = 4,50, 95 %-KI: 1,78–13,16). Bei Frauen, die zum Zeitpunkt der Randomisierung ≤ 49 Jahre alt waren, gab es 7 Fälle von i nvasivem Endometriumkarzinom, verglichen mit 8 Fällen bei Teilnehmern, die randomisiert Placebo erhielten (RR = 0,94, 95 % KI: 0,28-2,89). Wenn das Alter zum Zeitpunkt der Diagnose berücksichtigt wird, gab es 4 Fälle von Endometriumkarzinom bei Teilnehmerinnen ≤ 49, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden, im Vergleich zu 2 bei Teilnehmerinnen, die zu Placebo randomisiert wurden (RR = 2,21, 95 % KI: 0,4–12,0). Bei Frauen ≥ 50 zum Zeitpunkt der Diagnose gab es 29 Fälle bei Teilnehmern, die randomisiert NOLVADEX (Tamoxifencitrat) erhielten, verglichen mit 12 Fällen bei Frauen unter Placebo (RR = 2,5, 95 %-KI: 1,3–4,9). Die Risikoverhältnisse waren in beiden Gruppen ähnlich, obwohl bei jüngeren Frauen weniger Ereignisse auftraten. Die meisten (29 von 33 Fälle in der NOLVADEX (Tamoxifencitrat)-Gruppe) Endometriumkarzinome wurden bei symptomatischen Frauen diagnostiziert, obwohl 5 von 33 Fällen in der NOLVADEX (Tamoxifencitrat)-Gruppe bei asymptomatischen Frauen auftraten. Bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, traten die Ereignisse zwischen 1 und 61 Monaten (Durchschnitt = 32 Monate) nach Behandlungsbeginn auf.
In einer aktualisierten Überprüfung von Langzeitdaten (mediane Dauer der gesamten Nachbeobachtung beträgt 6,9 Jahre, einschließlich verblindeter Nachbeobachtung) von 8.306 Frauen mit intaktem Uterus bei Randomisierung in der NSABP-P-1-Risikominderungsstudie wurde die Inzidenz von beiden Adenokarzinome und seltene Uterussarkome war bei Frauen, die NOLVADEX (Tamoxifencitrat) einnahmen, erhöht. Während der verblindeten Nachbeobachtung gab es 36 Fälle von Endometrium-Adenokarzinom im FIGO-Stadium I (22 waren FIGO-Stadium IA, 13 IB und 1 IC) bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, und 15 Fälle bei Frauen, die Placebo erhielten [14 waren im FIGO-Stadium I (9 IA und 5 IB), und 1 Fall war FIGO-Stadium IV]. Von den Patientinnen, die NOLVADEX (Tamoxifencitrat) erhielten und Endometriumkarzinom entwickelten, erhielten einer im Stadium IA und 4 im Stadium IB eine Strahlentherapie. In der Placebogruppe erhielt ein Patient mit Krebs im FIGO-Stadium 1B eine Strahlentherapie und der Patient mit Krebs im FIGO-Stadium IVB erhielt eine Chemotherapie und eine Hormontherapie. Während der gesamten Nachbeobachtung wurde Endometrium-Adenokarzinom bei 53 Frauen berichtet, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden (30 Fälle von FIGO-Stadium IA, 20 waren Stadium IB, 1 war Stadium IC und 2 waren Stadium IIIC), und 17 Frauen wurden randomisiert zu Placebo (9 Fälle waren FIGO-Stadium IA, 6 waren Stadium IB, 1 war Stadium IIIC und 1 war Stadium IVB) (Inzidenz pro 1.000 Frauenjahre von 2,20 bzw. 0,71). Einige Patienten erhielten zusätzlich zur Operation eine postoperative Strahlentherapie. Uterussarkome wurden bei 4 Frauen berichtet, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden (1 war FIGO IA, 1 war FIGO IB, 1 war FIGO IIA und 1 war FIGO IIIC) und bei einer Patientin, die zu Placebo randomisiert wurde (FIGO 1A); Inzidenz pro 1.000 Frauenjahre von 0,17 bzw. 0,04. Von den Patienten, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden, waren die FIGO IA- und IB-Fälle ein MMMT bzw. ein Sarkom; der FIGO II war ein MMMT; und FIGO III war ein Sarkom; und der eine Patient, der randomisiert Placebo zugeteilt wurde, hatte eine MMMT. Eine ähnlich erhöhte Inzidenz von Endometrium-Adenokarzinom und Uterussarkom wurde bei Frauen beobachtet, die NOLVADEX (Tamoxifencitrat) in fünf anderen klinischen NSABP-Studien erhielten.
Jede Patientin, die NOLVADEX (Tamoxifencitrat) erhält oder zuvor erhalten hat und über abnormale vaginale Blutungen berichtet, sollte umgehend untersucht werden. Patientinnen, die NOLVADEX (Tamoxifencitrat) erhalten oder zuvor erhalten haben, sollten sich jährlichen gynäkologischen Untersuchungen unterziehen und sie sollten unverzüglich ihren Arzt informieren, wenn bei ihnen abnormale gynäkologische Symptome auftreten, z Druck.
In der P-1-Studie veränderte die Endometriumprobenahme die Erkennungsrate von Endometriumkrebs im Vergleich zu Frauen, bei denen keine Endometriumprobenahme durchgeführt wurde (0,6 % mit Probenahme, 0,5 % ohne Probenahme), bei Frauen mit intaktem Uterus. Es liegen keine Daten vor, die darauf hindeuten, dass eine routinemäßige Endometriumprobenahme bei asymptomatischen Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, um das Auftreten von Brustkrebs zu reduzieren, von Vorteil wäre.
Nicht bösartige Auswirkungen auf den Uterus
Im Zusammenhang mit der Behandlung mit NOLVADEX (Tamoxifencitrat) wurde über eine erhöhte Inzidenz von Endometriumveränderungen einschließlich Hyperplasie und Polypen berichtet. Die Häufigkeit und das Muster dieses Anstiegs deuten darauf hin, dass der zugrunde liegende Mechanismus mit den östrogenen Eigenschaften von NOLVADEX (Tamoxifencitrat) zusammenhängt.
Es gab einige Berichte über Endometriose und Uterusmyome bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten. Der zugrunde liegende Mechanismus kann auf die teilweise östrogene Wirkung von NOLVADEX (Tamoxifencitrat) zurückzuführen sein. Ovarialzysten wurden auch bei einer kleinen Anzahl prämenopausaler Patientinnen mit fortgeschrittenem Brustkrebs beobachtet, die mit NOLVADEX (Tamoxifencitrat) behandelt wurden.
Es wurde berichtet, dass NOLVADEX (Tamoxifencitrat) Menstruationsstörungen oder Amenorrhoe verursacht.
Thromboembolische Wirkungen von NOLVADEX (Tamoxifencitrat)
Es gibt Hinweise auf eine erhöhte Inzidenz thromboembolischer Ereignisse, einschließlich tiefer Venenthrombose und Lungenembolie, während der Therapie mit NOLVADEX (Tamoxifencitrat). Wenn NOLVADEX (Tamoxifencitrat) zusammen mit einer Chemotherapie verabreicht wird, kann es zu einem weiteren Anstieg der Inzidenz thromboembolischer Wirkungen kommen. Bei der Behandlung von Brustkrebs sollten die Risiken und Vorteile von NOLVADEX (Tamoxifencitrat) bei Frauen mit thromboembolischen Ereignissen in der Vorgeschichte sorgfältig abgewogen werden. In einer kleinen Unterstudie (N = 81) der NSABP P-1-Studie schien es keinen Nutzen zu haben, Frauen auf Faktor-V-Leiden- und Prothrombin-Mutationen G20210A zu untersuchen, um diejenigen zu identifizieren, die möglicherweise keine geeigneten Kandidaten für NOLVADEX (Tamoxifen) sind Citrat) Therapie.
Daten aus der NSABP-P-1-Studie zeigen, dass Teilnehmer, die NOLVADEX (Tamoxifencitrat) ohne eine Vorgeschichte von Lungenembolien (PE) erhielten, einen statistisch signifikanten Anstieg von Lungenembolien aufwiesen (18-NOLVADEX (Tamoxifencitrat), 6-Placebo, RR = 3,01 , 95 % KI: 1,15–9,27). Drei der Lungenembolien, alle im NOLVADEX (Tamoxifencitrat)-Arm, verliefen tödlich. 87 % der Fälle von Lungenembolie traten bei Frauen auf, die zum Zeitpunkt der Randomisierung mindestens 50 Jahre alt waren. Bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, traten die Ereignisse zwischen 2 und 60 Monaten (Durchschnitt = 27 Monate) nach Beginn der Behandlung auf.
In derselben Population wurde in der NOLVADEX (Tamoxifencitrat)-Gruppe (30-NOLVADEX (Tamoxifencitrat) , 19-Placebo; RR = 1,59, 95 % KI: 0,86) ein statistisch nicht signifikanter Anstieg tiefer Venenthrombosen (TVT) beobachtet -2,98). Derselbe Anstieg des relativen Risikos wurde bei Frauen ≤ 49 und bei Frauen ≥ 50 beobachtet, obwohl bei jüngeren Frauen weniger Ereignisse auftraten. Frauen mit thromboembolischen Ereignissen hatten ein Risiko für ein zweites verwandtes Ereignis (7 von 25 Frauen unter Placebo, 5 von 48 Frauen unter NOLVADEX (Tamoxifencitrat)) und hatten ein Risiko für Komplikationen des Ereignisses und seiner Behandlung (0/25 auf Placebo, 4/48 auf NOLVADEX (Tamoxifencitrat)). Bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, traten tiefe Venenthrombose-Ereignisse zwischen 2 und 57 Monaten (Durchschnitt = 19 Monate) nach Beginn der Behandlung auf.
Es gab eine statistisch nicht signifikante Zunahme von Schlaganfällen bei Patienten, die zu NOLVADEX (Tamoxifencitrat) randomisiert wurden (24-Placebo; 34-NOLVADEX (Tamoxifencitrat); RR = 1,42; 95 %-KI 0,82-2,51). Sechs der 24 Schlaganfälle in der Placebogruppe wurden als hämorrhagischen Ursprungs angesehen und 10 der 34 Schlaganfälle in der NOLVADEX (Tamoxifencitrat)-Gruppe wurden als hämorrhagisch kategorisiert. Siebzehn der 34 Schlaganfälle in der NOLVADEX (Tamoxifencitrat)-Gruppe wurden als okklusiv eingestuft und 7 als von unbekannter Ätiologie. Es wurde berichtet, dass 14 der 24 Schlaganfälle im Placebo-Arm okklusiv und 4 von unbekannter Ätiologie waren. Unter diesen Schlaganfällen verliefen 3 Schlaganfälle in der Placebogruppe und 4 Schlaganfälle in der NOLVADEX (Tamoxifencitrat)-Gruppe tödlich. Achtundachtzig Prozent der Schlaganfälle traten bei Frauen auf, die zum Zeitpunkt der Randomisierung mindestens 50 Jahre alt waren. Bei Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, traten die Ereignisse zwischen 1 und 63 Monaten (Durchschnitt = 30 Monate) nach Behandlungsbeginn auf.
Auswirkungen auf die Leber: Leberkrebs
In der schwedischen Studie mit adjuvanter NOLVADEX (Tamoxifencitrat) 40 mg/Tag für 2-5 Jahre wurden 3 Fälle von Leberkrebs in der mit NOLVADEX (Tamoxifencitrat) behandelten Gruppe im Vergleich zu 1 Fall in der Beobachtungsgruppe berichtet (siehe VORSICHTSMASSNAHMEN- Karzinogenese ). In anderen klinischen Studien zur Bewertung von NOLVADEX (Tamoxifencitrat) wurden bisher keine Fälle von Leberkrebs gemeldet.
Ein Fall von Leberkrebs wurde in NSABP P-1 bei einem Teilnehmer gemeldet, der zu NOLVADEX (Tamoxifencitrat) randomisiert wurde.
Wirkungen auf die Leber: Nicht bösartige Wirkungen
NOLVADEX (Tamoxifencitrat) wurde mit Veränderungen der Leberenzymwerte und in seltenen Fällen mit einem Spektrum schwererer Leberanomalien, einschließlich Fettleber, Cholestase, Hepatitis und Lebernekrose, in Verbindung gebracht. Einige dieser schweren Fälle beinhalteten Todesfälle. In den meisten gemeldeten Fällen ist die Beziehung zu NOLVADEX (Tamoxifencitrat) ungewiss. Es wurden jedoch einige positive Rechallenges und Dechallenges berichtet.
In der NSABP-P-1-Studie wurden wenige Veränderungen der Leberfunktion (SGOT, SGPT, Bilirubin, alkalische Phosphatase) vom Grad 3 bis 4 beobachtet (10 unter Placebo und 6 unter NOLVADEX (Tamoxifencitrat)). Serumlipide wurden nicht systematisch gesammelt.
Andere Krebsarten
In klinischen Studien wurde nach der Behandlung von Brustkrebs mit NOLVADEX (Tamoxifencitrat) über eine Reihe von sekundären Primärtumoren berichtet, die an anderen Stellen als dem Endometrium auftraten. Daten aus den Studien NSABP B-14 und P-1 zeigen keinen Anstieg anderer (nicht uteriner) Krebsarten bei Patientinnen, die NOLVADEX (Tamoxifencitrat) erhalten. Ob mit NOLVADEX (Tamoxifencitrat) ein erhöhtes Risiko für andere (nicht uterine) Krebsarten verbunden ist, ist noch ungewiss und wird weiterhin untersucht.
Auswirkungen auf das Auge
Bei Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, wurde über Augenstörungen, einschließlich Hornhautveränderungen, Abnahme der Farbwahrnehmung, retinale Venenthrombose und Retinopathie berichtet. Bei Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, wurde über eine erhöhte Inzidenz von Katarakten und die Notwendigkeit einer Kataraktoperation berichtet.
In der NSABP P-1-Studie war ein erhöhtes Risiko von grenzwertiger Signifikanz für die Entwicklung von Katarakten bei Frauen ohne Katarakt zu Studienbeginn (540-NOLVADEX (Tamoxifencitrat) ; 483-Placebo; RR = 1,13, 95 % KI: 1,00-1,28). beobachtet. Bei denselben Frauen war NOLVADEX (Tamoxifencitrat) mit einem erhöhten Risiko für eine Kataraktoperation verbunden (101-NOLVADEX (Tamoxifencitrat) ; 63-Placebo; RR = 1,62, 95 %-KI 1,18–2,22) (siehe Tabelle 3 in KLINISCHE PHARMAKOLOGIE ). Bei allen Frauen in der Studie (mit oder ohne Katarakt zu Studienbeginn) war NOLVADEX (Tamoxifencitrat) mit einem erhöhten Risiko für eine Kataraktoperation verbunden (201-NOLVADEX (Tamoxifencitrat) ; 129-Placebo; RR = 1,58, 95 % KI 1,26-1,97). Augenuntersuchungen waren während der Studie nicht erforderlich. Es können keine weiteren Schlussfolgerungen zu ophthalmischen Ereignissen ohne Katarakt gezogen werden.
Schwangerschaftskategorie D
NOLVADEX (Tamoxifencitrat) kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Frauen sollten angewiesen werden, während der Einnahme von NOLVADEX (Tamoxifencitrat) oder innerhalb von 2 Monaten nach Absetzen von NOLVADEX (Tamoxifencitrat) nicht schwanger zu werden, und sollten Barriere- oder nichthormonelle Verhütungsmaßnahmen anwenden, wenn sie sexuell aktiv sind. Tamoxifen verursacht selbst bei Menstruationsstörungen keine Unfruchtbarkeit. Aufgrund der antiöstrogenen Eigenschaften des Arzneimittels werden Auswirkungen auf die Fortpflanzungsfunktionen erwartet. In Reproduktionsstudien an Ratten mit Dosierungen, die der humanen Dosis entsprachen oder darunter lagen, wurden nicht teratogene entwicklungsbedingte Skelettveränderungen beobachtet, die als reversibel befunden wurden. Darüber hinaus wurden in Fertilitätsstudien an Ratten und Teratologiestudien an Kaninchen unter Verwendung von Dosen, die denen beim Menschen entsprechen oder darunter liegen, eine geringere Inzidenz von Embryoeinnistung und eine höhere Inzidenz von fötalem Tod oder verzögertem Wachstum im Mutterleib bei langsamerem Lernverhalten beobachtet einige Rattenwelpen im Vergleich zu historischen Kontrollen. Mehrere trächtige Weißbüschelaffen wurden während der Organogenese oder in der letzten Hälfte der Trächtigkeit mit 10 mg/kg/Tag (etwa dem 2-fachen der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis) behandelt. Es wurden keine Missbildungen beobachtet, und obwohl die Dosis bei einigen Tieren hoch genug war, um die Trächtigkeit zu beenden, zeigten diejenigen, die die Trächtigkeit aufrechterhielten, keine Anzeichen von teratogenen Missbildungen.
In Nagetiermodellen zur Entwicklung des fötalen Fortpflanzungstrakts verursachte Tamoxifen (in Dosen, die dem 0,002- bis 2,4-Fachen der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis entsprachen) bei beiden Geschlechtern ähnliche Veränderungen wie Estradiol, Ethinylestradiol und Diethylstilbestrol. Obwohl die klinische Relevanz dieser Veränderungen nicht bekannt ist, ähneln einige dieser Veränderungen, insbesondere vaginaler Adenose, denen, die bei jungen Frauen beobachtet wurden, die Diethylstilbestrol in utero ausgesetzt waren und bei denen ein Risiko von 1 zu 1000 besteht, ein klarzelliges Adenokarzinom zu entwickeln Scheide oder Gebärmutterhals. Bisher wurde nicht gezeigt, dass eine In-utero-Exposition gegenüber Tamoxifen bei jungen Frauen eine vaginale Adenose oder ein klarzelliges Adenokarzinom der Vagina oder des Gebärmutterhalses verursacht. Allerdings wurde nur eine kleine Anzahl junger Frauen Tamoxifen in utero ausgesetzt, und eine kleinere Anzahl wurde lange genug (bis zum Alter von 15 bis 20 Jahren) beobachtet, um festzustellen, ob infolge dieser Exposition eine vaginale oder zervikale Neoplasie auftreten könnte.
Es gibt keine ausreichenden und gut kontrollierten Studien zu Tamoxifen bei Schwangeren. Es gab eine kleine Anzahl von Berichten über vaginale Blutungen, spontane Aborte, Geburtsfehler und fötale Todesfälle bei schwangeren Frauen. Wenn dieses Arzneimittel während der Schwangerschaft angewendet wird oder die Patientin während der Einnahme dieses Arzneimittels schwanger wird oder innerhalb von etwa zwei Monaten nach Absetzen der Therapie, sollte die Patientin über die potenziellen Risiken für den Fötus einschließlich des potenziellen Langzeitrisikos eines DES informiert werden. wie Syndrom.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko – Schwangerschaftskategorie D
Bei sexuell aktiven Frauen im gebärfähigen Alter sollte die Therapie mit NOLVADEX (Tamoxifencitrat) während der Menstruation begonnen werden. Bei Frauen mit Menstruationsstörungen ist ein negatives B-HCG unmittelbar vor Therapiebeginn ausreichend (vgl VORSICHTSMASSNAHMEN – INFORMATIONEN FÜR PATIENTEN – Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko ).
VORSICHTSMASSNAHMEN
Allgemein
Bei Patienten, die NOLVADEX (Tamoxifencitrat) gegen Brustkrebs einnahmen, wurde gelegentlich über eine Abnahme der Thrombozytenzahl berichtet, normalerweise auf 50.000-100.000/mm³, selten niedriger. Bei Patienten mit signifikanter Thrombozytopenie sind selten hämorrhagische Episoden aufgetreten, aber es ist ungewiss, ob diese Episoden auf die Therapie mit NOLVADEX (Tamoxifencitrat) zurückzuführen sind. Leukopenie wurde beobachtet, manchmal in Verbindung mit Anämie und/oder Thrombozytopenie. Es gab seltene Berichte über Neutropenie und Panzytopenie bei Patienten, die NOLVADEX (Tamoxifencitrat) erhielten; dies kann manchmal schwerwiegend sein.
In der NSABP-P-1-Studie kam es bei 6 Frauen unter NOLVADEX (Tamoxifencitrat) und 2 Frauen unter Placebo zu einem Abfall der Thrombozytenzahl Grad 3-4 (≤ 50.000/mm³).
Informationen für Patienten
Die Patienten sollten angewiesen werden, die zu lesen Leitfaden für Medikamente wie gesetzlich vorgeschrieben zugeführt, wenn NOLVADEX 10 mg abgegeben wird. Der vollständige Text der Leitfaden für Medikamente ist am Ende dieses Dokuments abgedruckt.
Reduktion von invasivem Brustkrebs und DCIS bei Frauen mit DCIS
Frauen mit DCIS, die mit Lumpektomie und Strahlentherapie behandelt werden und die NOLVADEX (Tamoxifencitrat) in Betracht ziehen, um die Inzidenz eines zweiten Brustkrebsereignisses zu reduzieren, sollten die Risiken und Vorteile der Therapie abwägen, da die Behandlung mit NOLVADEX (Tamoxifencitrat) die Inzidenz von invasiven Brustkrebs verringert hat Krebs, aber es wurde nicht gezeigt, dass er das Überleben beeinflusst (siehe Tabelle 1 in KLINISCHE PHARMAKOLOGIE ).
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko
Frauen mit einem hohen Brustkrebsrisiko können eine Therapie mit NOLVADEX (Tamoxifencitrat) in Erwägung ziehen, um das Auftreten von Brustkrebs zu verringern. Ob der Nutzen einer Behandlung die Risiken überwiegt, hängt von der persönlichen Krankengeschichte der Frau und davon ab, wie sie Nutzen und Risiken abwägt. Eine Therapie mit NOLVADEX (Tamoxifencitrat) zur Verringerung der Inzidenz von Brustkrebs ist daher möglicherweise nicht für alle Frauen mit hohem Brustkrebsrisiko geeignet. Frauen, die eine Therapie mit NOLVADEX (Tamoxifencitrat) in Betracht ziehen, sollten ihren Arzt konsultieren, um den potenziellen Nutzen und die Risiken vor Beginn der Therapie zur Verringerung der Brustkrebsinzidenz abzuschätzen (siehe Tabelle 3). KLINISCHE PHARMAKOLOGIE ). Frauen sollten sich darüber im Klaren sein, dass NOLVADEX (Tamoxifencitrat) die Inzidenz von Brustkrebs reduziert, aber das Risiko möglicherweise nicht eliminiert. NOLVADEX (Tamoxifencitrat) verringerte die Inzidenz von kleinen Östrogenrezeptor-positiven Tumoren, veränderte jedoch nicht die Inzidenz von Östrogenrezeptor-negativen Tumoren oder größeren Tumoren. Bei Frauen mit Brustkrebs, die ein hohes Risiko haben, einen zweiten Brustkrebs zu entwickeln, reduzierte die Behandlung mit etwa 5 Jahren NOLVADEX (Tamoxifencitrat) die jährliche Inzidenzrate eines zweiten Brustkrebses um etwa 50 %.
Frauen, die schwanger sind oder eine Schwangerschaft planen, sollten NOLVADEX (Tamoxifencitrat) nicht einnehmen, um ihr Brustkrebsrisiko zu verringern. Eine wirksame nichthormonelle Empfängnisverhütung muss von allen prämenopausalen Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, und für etwa zwei Monate nach Beendigung der Therapie angewendet werden, wenn sie sexuell aktiv sind. Tamoxifen verursacht selbst bei Menstruationsstörungen keine Unfruchtbarkeit. Bei sexuell aktiven Frauen im gebärfähigen Alter sollte die Therapie mit NOLVADEX (Tamoxifencitrat) während der Menstruation begonnen werden. Bei Frauen mit Menstruationsstörungen ist ein negatives B-HCG unmittelbar vor Therapiebeginn ausreichend (vgl WARNHINWEISE - Schwangerschaftskategorie D ).
Zwei europäische Studien mit Tamoxifen zur Verringerung des Brustkrebsrisikos wurden durchgeführt und zeigten keinen Unterschied in der Anzahl der Brustkrebsfälle zwischen den Tamoxifen- und Placebo-Armen. Diese Studien hatten Studiendesigns, die sich von denen von NSABP P-1 unterschieden, kleiner als NSABP P-1 waren und Frauen mit einem geringeren Brustkrebsrisiko als diejenigen in P-1 einschlossen.
Überwachung während der Therapie mit NOLVADEX (Tamoxifencitrat).
Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen oder zuvor eingenommen haben, sollten angewiesen werden, bei neuen Knoten in der Brust, vaginalen Blutungen, gynäkologischen Symptomen (Menstruationsunregelmäßigkeiten, Veränderungen des Vaginalausflusses oder Beckenschmerzen oder -druck), Symptomen von geschwollenen Beinen oder sofort einen Arzt aufzusuchen Empfindlichkeit, unerklärliche Kurzatmigkeit oder Sehstörungen. Frauen sollten alle Leistungserbringer unabhängig vom Grund der Untersuchung darüber informieren, dass sie NOLVADEX (Tamoxifencitrat) einnehmen.
Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, um das Auftreten von Brustkrebs zu verringern, sollten sich vor Beginn der Therapie einer Brustuntersuchung, einer Mammographie und einer gynäkologischen Untersuchung unterziehen. Diese Studien sollten während der Therapie nach guter medizinischer Praxis in regelmäßigen Abständen wiederholt werden. Frauen, die NOLVADEX (Tamoxifencitrat) als adjuvante Brustkrebstherapie einnehmen, sollten die gleichen Überwachungsverfahren befolgen wie Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, um das Auftreten von Brustkrebs zu verringern. Frauen, die NOLVADEX (Tamoxifencitrat) zur Behandlung von metastasierendem Brustkrebs einnehmen, sollten diesen Überwachungsplan mit ihrem behandelnden Arzt besprechen und die geeigneten Modalitäten und den Zeitplan für die Bewertung auswählen.
Labortests
Es sollten regelmäßig vollständige Blutbilder, einschließlich Thrombozytenzahlen, und regelmäßige Leberfunktionstests durchgeführt werden.
Während der ATAC-Studie wurde von mehr Patienten, die Anastrozol erhielten, im Vergleich zu Patienten, die NOLVADEX (Tamoxifencitrat) erhielten, ein erhöhtes Serumcholesterin berichtet (9 % gegenüber 3,5 %).
Karzinogenese
Eine konventionelle Karzinogenese-Studie an Ratten in Dosen von 5, 20 und 35 mg/kg/Tag (etwa das 1-, 3- und 7-fache der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis), die bis zu 2 Jahre lang per Schlundsonde verabreicht wurden ) zeigte bei allen Dosierungen eine signifikante Zunahme von hepatozellulären Karzinomen. Die Inzidenz dieser Tumore war bei Ratten, denen 20 oder 35 mg/kg/Tag verabreicht wurden (69 %), signifikant höher als bei Ratten, denen 5 mg/kg/Tag verabreicht wurde (14 %). In einer separaten Studie wurde Ratten Tamoxifen in einer Dosierung von 45 mg/kg/Tag verabreicht (etwa das Neunfache der empfohlenen Tageshöchstdosis für Menschen auf mg/m²-Basis); hepatozelluläre Neoplasie wurde nach 3 bis 6 Monaten gezeigt.
Granulosazell-Ovarialtumoren und interstitielle Hodentumoren wurden in zwei getrennten Mausstudien beobachtet. Den Mäusen wurden die trans- und racemischen Formen von Tamoxifen 13 bis 15 Monate lang in Dosen von 5, 20 und 50 mg/kg/Tag verabreicht (etwa das halbe, zwei- und fünffache der empfohlenen Tagesdosis für Menschen auf einem mg/m² Basis).
Mutagenese
In einer konventionellen Reihe von In-vivo- und In-vitro-Tests mit pro- und eukaryontischen Testsystemen mit Arzneimittel-Metabolisierungssystemen wurde kein genotoxisches Potenzial gefunden. Allerdings wurden erhöhte Mengen an DNA-Addukten durch 32P-Nachmarkierung in DNA aus Rattenleber und kultivierten menschlichen Lymphozyten beobachtet. Es wurde auch festgestellt, dass Tamoxifen das Niveau der Mikronukleusbildung in vitro in der humanen lymphoblastoiden Zelllinie (MCL-5) erhöht. Basierend auf diesen Erkenntnissen ist Tamoxifen in Nagetier- und menschlichen MCL-5-Zellen genotoxisch.
Beeinträchtigung der Fruchtbarkeit
Tamoxifen führte bei weiblichen Ratten in Dosen von 0,04 mg/kg/Tag (etwa das 0,01-fache der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis) zu einer Beeinträchtigung der Fertilität und Empfängnis, wenn es zwei Wochen vor der Paarung bis zum 7. Trächtigkeitstag verabreicht wurde . Bei dieser Dosis waren Fertilität und Reproduktionsindizes mit totaler fötaler Sterblichkeit deutlich reduziert. Die fötale Sterblichkeit war auch bei Dosen von 0,16 mg/kg/Tag (etwa das 0,03-fache der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis) erhöht, wenn weibliche Ratten ab dem 7. bis 17. Tag der Trächtigkeit behandelt wurden. Tamoxifen führte bei Kaninchen, denen Dosen von mindestens 0,125 mg/kg/Tag verabreicht wurden (etwa das 0,05-fache der empfohlenen Tageshöchstdosis beim Menschen auf mg/m²-Basis), zu Fehlgeburten, Frühgeburten und fötalem Tod. Weder bei Ratten noch bei Kaninchen traten teratogene Veränderungen auf.
Schwangerschaftskategorie D
Sehen WARNUNGEN .
Stillende Mutter
Es wurde berichtet, dass Tamoxifen die Laktation hemmt. Zwei placebokontrollierte Studien mit über 150 Frauen haben gezeigt, dass Tamoxifen die frühe postpartale Milchproduktion signifikant hemmt. In beiden Studien wurde Tamoxifen innerhalb von 24 Stunden nach der Entbindung für 5 bis 18 Tage verabreicht. Die Wirkung von Tamoxifen auf die etablierte Milchproduktion ist nicht bekannt.
Es liegen keine Daten vor, die sich damit befassen, ob Tamoxifen in die Muttermilch übergeht. Bei Ausscheidung von Tamoxifen in die Muttermilch liegen keine Daten bei gestillten Säuglingen oder gestillten Tieren vor. Die direkte neonatale Exposition von Mäusen und Ratten mit Tamoxifen (nicht über die Muttermilch) führte jedoch zu 1) Läsionen des Reproduktionstrakts bei weiblichen Nagetieren (ähnlich denen, die beim Menschen nach intrauteriner Exposition gegenüber Diethylstilbestrol beobachtet wurden) und 2) Funktionsstörungen des Reproduktionstrakts bei Männern Nagetieren wie Hodenatrophie und Stillstand der Spermatogenese.
Es ist nicht bekannt, ob NOLVADEX (Tamoxifencitrat) in die Muttermilch übergeht. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von NOLVADEX (Tamoxifencitrat) bei gestillten Säuglingen sollten Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, nicht stillen.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko und DCIS
Es ist nicht bekannt, ob NOLVADEX (Tamoxifencitrat) in die Muttermilch übergeht. Aufgrund der Möglichkeit schwerwiegender Nebenwirkungen von NOLVADEX (Tamoxifencitrat) bei gestillten Säuglingen sollten Frauen, die NOLVADEX (Tamoxifencitrat) einnehmen, nicht stillen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von NOLVADEX (Tamoxifencitrat) bei Mädchen im Alter von 2 bis 10 Jahren mit McCune-Albright-Syndrom und verfrühter Pubertät wurden nicht über eine Behandlungsdauer von einem Jahr hinaus untersucht. Die Langzeitwirkungen einer Therapie mit NOLVADEX (Tamoxifencitrat) bei Mädchen wurden nicht nachgewiesen. Bei Erwachsenen, die mit NOLVADEX (Tamoxifencitrat) behandelt wurden, wurde eine erhöhte Inzidenz von bösartigen Uterustumoren, Schlaganfall und Lungenembolie festgestellt (siehe Eingerahmte Warnung , und KLINISCHE PHARMAKOLOGIE-Klinische Studien-McCune-Albright-Syndrom Unterabschnitt).
Geriatrische Verwendung
In der NSABP-P-1-Studie lag der Anteil der Frauen im Alter von mindestens 65 Jahren bei 16 %. Frauen im Alter von mindestens 70 Jahren machten 6 % der Teilnehmer aus. Bei den Teilnehmern in jeder der Untergruppen wurde eine Verringerung der Brustkrebsinzidenz beobachtet: Insgesamt 28 bzw. 10 invasive Brustkrebserkrankungen wurden bei den Teilnehmern ab 65 Jahren in der Placebo- bzw. NOLVADEX-Gruppe (Tamoxifencitrat) beobachtet. Bei allen anderen Endpunkten spiegeln die Ergebnisse in dieser Untergruppe die Ergebnisse wider, die in der Untergruppe von Frauen im Alter von mindestens 50 Jahren beobachtet wurden. Insgesamt wurden keine Unterschiede in der Verträglichkeit zwischen älteren und jüngeren Patienten beobachtet (vgl KLINISCHE PHARMAKOLOGIE – Klinische Studien – Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko Sektion).
In der NSABP-B-24-Studie lag der Anteil der Frauen im Alter von mindestens 65 Jahren bei 23 %. Frauen im Alter von mindestens 70 Jahren machten 10 % der Teilnehmer aus. Bei Teilnehmern ab 65 Jahren in der Placebo- bzw. NOLVADEX-Gruppe (Tamoxifencitrat) wurden insgesamt 14 bzw. 12 invasive Brustkrebserkrankungen beobachtet. Diese Teilmenge ist zu klein, um Schlussfolgerungen zur Wirksamkeit zu ziehen. Bei allen anderen Endpunkten waren die Ergebnisse in dieser Untergruppe mit denen jüngerer Frauen vergleichbar, die an dieser Studie teilgenommen hatten. Insgesamt wurden keine Unterschiede in der Verträglichkeit zwischen älteren und jüngeren Patienten beobachtet.
ÜBERDOSIS
Anzeichen, die bei den höchsten Dosen nach Studien zur Bestimmung der LD50 bei Tieren beobachtet wurden, waren Atembeschwerden und Krämpfe.
Akute Überdosierung beim Menschen wurde nicht berichtet. In einer Studie an Patienten mit fortgeschrittenem metastasiertem Krebs, in der speziell die maximal tolerierte Dosis von NOLVADEX (Tamoxifencitrat) bestimmt wurde, um die Anwendung sehr hoher Dosen zur Aufhebung einer Multidrug-Resistenz zu evaluieren, wurde eine akute Neurotoxizität festgestellt, die sich in Tremor, Hyperreflexie, unsicherem Gang und Schwindel äußerte. Diese Symptome traten innerhalb von 3-5 Tagen nach Beginn der Behandlung mit NOLVADEX (Tamoxifencitrat) auf und verschwanden innerhalb von 2-5 Tagen nach Beendigung der Therapie. Es wurde keine dauerhafte neurologische Toxizität festgestellt. Bei einem Patienten kam es mehrere Tage nach Absetzen von NOLVADEX (Tamoxifencitrat) zu einem Krampfanfall und nach Abklingen der neurotoxischen Symptome. Der kausale Zusammenhang des Krampfanfalls mit der Therapie mit NOLVADEX (Tamoxifencitrat) ist nicht bekannt. Die Dosen, die diesen Patienten verabreicht wurden, waren alle höher als 400 mg/m² Aufsättigungsdosis, gefolgt von zweimal täglich verabreichten Erhaltungsdosen von 150 mg/m² NOLVADEX (Tamoxifencitrat).
In derselben Studie wurde eine Verlängerung des QT-Intervalls im Elektrokardiogramm festgestellt, wenn Patienten Dosen von mehr als 250 mg/m² Aufsättigungsdosis erhielten, gefolgt von zweimal täglich gegebenen Erhaltungsdosen von 80 mg/m² NOLVADEX (Tamoxifencitrat). Bei einer Frau mit einer Körperoberfläche von 1,5 m² waren die minimale Aufsättigungsdosis und die verabreichten Erhaltungsdosen, bei denen neurologische Symptome und QT-Veränderungen auftraten, mindestens 6-mal höher als die maximal empfohlene Dosis.
Es ist keine spezifische Behandlung einer Überdosierung bekannt; Die Behandlung muss symptomatisch sein.
KONTRAINDIKATIONEN
NOLVADEX (Tamoxifencitrat) ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen das Medikament oder einen seiner Inhaltsstoffe.
Verringerung der Brustkrebsinzidenz bei Frauen mit hohem Risiko und Frauen mit DCIS
NOLVADEX (Tamoxifencitrat) ist kontraindiziert bei Frauen, die gleichzeitig eine gerinnungshemmende Therapie vom Cumarin-Typ benötigen, oder bei Frauen mit einer Vorgeschichte von tiefer Venenthrombose oder Lungenembolie.
KLINISCHE PHARMAKOLOGIE
NOLVADEX (Tamoxifencitrat) ist ein nichtsteroidales Mittel, das in Tierversuchssystemen starke antiöstrogene Eigenschaften gezeigt hat. Die antiöstrogenen Wirkungen können mit seiner Fähigkeit zusammenhängen, mit Östrogen um Bindungsstellen in Zielgeweben wie der Brust zu konkurrieren. Tamoxifen hemmt die durch Dimethylbenzanthracen (DMBA) induzierte Induktion von Mammakarzinomen bei Ratten und bewirkt die Rückbildung von bereits etablierten DMBA-induzierten Tumoren. In diesem Rattenmodell scheint Tamoxifen seine Antitumorwirkung durch Binden der Östrogenrezeptoren auszuüben.
In Zytosolen, die von menschlichen Brustadenokarzinomen stammen, konkurriert Tamoxifen mit Östradiol um das Östrogenrezeptorprotein.
Absorption und Verteilung
Nach einer oralen Einzeldosis von 20 mg Tamoxifen trat etwa 5 Stunden nach der Einnahme eine durchschnittliche maximale Plasmakonzentration von 40 ng/ml (Bereich 35 bis 45 ng/ml) auf. Der Abfall der Plasmakonzentrationen von Tamoxifen ist zweiphasig mit einer terminalen Eliminationshalbwertszeit von etwa 5 bis 7 Tagen. Die durchschnittliche maximale Plasmakonzentration von N-Desmethyl-Tamoxifen beträgt 15 ng/ml (Bereich 10 bis 20 ng/ml). Die chronische Verabreichung von 10 mg Tamoxifen zweimal täglich über 3 Monate an Patienten führt zu durchschnittlichen Steady-State-Plasmakonzentrationen von 120 ng/ml (Bereich 67-183 ng/ml) für Tamoxifen und 336 ng/ml (Bereich 148-654 ng/ml). ml) für N-Desmethyl-Tamoxifen. Die durchschnittlichen Steady-State-Plasmakonzentrationen von Tamoxifen und N-Desmethyl-Tamoxifen nach Gabe von 20 mg Tamoxifen einmal täglich über 3 Monate betragen 122 ng/ml (Bereich 71-183 ng/ml) und 353 ng/ml (Bereich 152-706 ng /ml). Nach Beginn der Therapie werden Steady-State-Konzentrationen für Tamoxifen in etwa 4 Wochen und Steady-State-Konzentrationen für N-Desmethyl-Tamoxifen in etwa 8 Wochen erreicht, was auf eine Halbwertszeit von etwa 14 Tagen für diesen Metaboliten hindeutet. In einer Steady-State-Crossover-Studie mit zweimal täglich gegebenen 10 mg NOLVADEX (Tamoxifencitrat)-Tabletten im Vergleich zu einmal täglich gegebenen 20 mg NOLVADEX (Tamoxifencitrat)-Tabletten war die 20 mg NOLVADEX (Tamoxifencitrat)-Tablette bioäquivalent zu der 10 mg NOLVADEX (Tamoxifencitrat) Tabletten.
Stoffwechsel
Tamoxifen wird nach oraler Gabe weitgehend metabolisiert. N-Desmethyl-Tamoxifen ist der Hauptmetabolit im Plasma der Patienten. Die biologische Aktivität von N-Desmethyl-Tamoxifen scheint der von Tamoxifen ähnlich zu sein. 4-Hydroxytamoxifen und ein primäres Alkoholderivat der Seitenkette von Tamoxifen wurden als untergeordnete Metaboliten im Plasma identifiziert. Tamoxifen ist ein Substrat von Cytochrom P-450 3A, 2C9 und 2D6 und ein Inhibitor von P-Glykoprotein.
Ausscheidung
Studien an Frauen, die 20 mg 14C-Tamoxifen erhielten, haben gezeigt, dass ungefähr 65 % der verabreichten Dosis über einen Zeitraum von 2 Wochen aus dem Körper ausgeschieden wurden, wobei die fäkale Ausscheidung der primäre Eliminationsweg war. Das Medikament wird hauptsächlich als polare Konjugate ausgeschieden, wobei das unveränderte Medikament und die unkonjugierten Metaboliten weniger als 30 % der gesamten fäkalen Radioaktivität ausmachen.
Besondere Populationen
Die Auswirkungen von Alter, Geschlecht und ethnischer Zugehörigkeit auf die Pharmakokinetik von Tamoxifen wurden nicht bestimmt. Die Auswirkungen einer eingeschränkten Leberfunktion auf den Metabolismus und die Pharmakokinetik von Tamoxifen wurden nicht bestimmt.
Pädiatrische Patienten
Die Pharmakokinetik von Tamoxifen und N-Desmethyl-Tamoxifen wurde anhand einer populationspharmakokinetischen Analyse mit spärlichen Proben pro Patientin von 27 weiblichen pädiatrischen Patienten im Alter von 2 bis 10 Jahren charakterisiert, die an einer Studie zur Bewertung der Sicherheit, Wirksamkeit und Pharmakokinetik von NOLVADEX (Tamoxifen) teilnahmen Citrat) bei der Behandlung des McCune-Albright-Syndroms. Umfangreiche Daten aus zwei pharmakokinetischen Tamoxifencitrat-Studien, in denen 59 postmenopausale Frauen mit Brustkrebs die Studien abschlossen, wurden in die Analyse einbezogen, um das strukturelle pharmakokinetische Modell für Tamoxifen zu bestimmen. Ein Ein-Kompartiment-Modell lieferte die beste Anpassung an die Daten.
Bei pädiatrischen Patienten betrugen die durchschnittlichen Spitzenplasmakonzentrationen (Css, max) und AUC im Steady State 187 ng/ml bzw. 4110 ng h/ml, und Css, max trat etwa 8 Stunden nach der Einnahme auf. Die Clearance (CL/F) in Abhängigkeit vom Körpergewicht war bei weiblichen pädiatrischen Patientinnen etwa 2,3-mal höher als bei weiblichen Brustkrebspatientinnen. In der jüngsten Kohorte von weiblichen pädiatrischen Patienten (2-6 Jahre alt) war CL/F 2,6-fach höher; in der ältesten Kohorte (7-10,9-Jährige) war CL/F etwa 1,9-mal höher. Die Exposition gegenüber N-Desmethyl-Tamoxifen war bei pädiatrischen und erwachsenen Patienten vergleichbar. Die Sicherheit und Wirksamkeit von NOLVADEX (Tamoxifencitrat) bei Mädchen im Alter von 2 bis 10 Jahren mit McCune-Albright-Syndrom und verfrühter Pubertät wurden nicht über eine Behandlungsdauer von einem Jahr hinaus untersucht. Die Langzeitwirkungen einer Therapie mit NOLVADEX (Tamoxifencitrat) bei Mädchen wurden nicht nachgewiesen. Bei Erwachsenen, die mit NOLVADEX (Tamoxifencitrat) behandelt wurden, wurde eine erhöhte Inzidenz von Uterusmalignomen, Schlaganfällen und Lungenembolien festgestellt (siehe Eingerahmte Warnung ).
Arzneimittelwechselwirkungen
In-vitro-Studien zeigten, dass Erythromycin, Cyclosporin, Nifedipin und Diltiazem die Bildung von N-Desmethyl-Tamoxifen mit einer scheinbaren K1 von 20, 1, 45 bzw. 30 µM kompetitiv hemmten. Die klinische Bedeutung dieser In-vitro-Studien ist nicht bekannt.
Tamoxifen verringerte die Plasmakonzentration von Letrozol um 37 %, wenn diese Arzneimittel gleichzeitig verabreicht wurden. Rifampin, ein Cytochrom P-450 3A4-Induktor, verringerte die AUC und Cmax von Tamoxifen um 86 % bzw. 55 %. Aminoglutethimid senkt die Plasmakonzentrationen von Tamoxifen und N-Desmethyl-Tamoxifen. Medroxyprogesteron reduziert die Plasmakonzentrationen von N-Desmethyl, aber nicht von Tamoxifen.
In der Anastrozol-Adjuvans-Studie reduzierte die gleichzeitige Verabreichung von Anastrozol und NOLVADEX (Tamoxifencitrat) bei Brustkrebspatientinnen die Anastrozol-Plasmakonzentration um 27 % im Vergleich zu denjenigen, die mit Anastrozol allein erreicht wurden; Die gleichzeitige Verabreichung hatte jedoch keinen Einfluss auf die Pharmakokinetik von Tamoxifen oder N-Desmethyltamoxifen (siehe VORSICHTSMASSNAHMEN - ARZNEIMITTELWECHSELWIRKUNGEN ). NOLVADEX (Tamoxifencitrat) sollte nicht zusammen mit Anastrozol verabreicht werden.
Klinische Studien
Metastasierter Brustkrebs
Prämenopausale Frauen (NOLVADEX (Tamoxifencitrat) vs. Ablation)
Drei prospektive, randomisierte Studien (Ingle, Pritchard, Buchanan) verglichen NOLVADEX (Tamoxifencitrat) mit Ovarialablation (Ovarektomie oder Ovarialbestrahlung) bei prämenopausalen Frauen mit fortgeschrittenem Brustkrebs. Obwohl die objektive Ansprechrate, die Zeit bis zum Therapieversagen und das Überleben bei beiden Behandlungen ähnlich waren, verhinderte die begrenzte Patientenrekrutierung einen Nachweis der Äquivalenz. In einer Übersichtsanalyse der Überlebensdaten aus den 3 Studien betrug die Hazard Ratio für Tod (NOLVADEX (Tamoxifencitrat)/Eierstockablation) 1,00 mit zweiseitigen 95 %-Konfidenzintervallen von 0,73 bis 1,37. Bei prämenopausalen Frauen, die NOLVADEX (Tamoxifencitrat) erhielten, wurden erhöhte Serum- und Plasmaöstrogene beobachtet, aber die Daten aus den randomisierten Studien deuten nicht auf eine nachteilige Wirkung dieses Anstiegs hin. Eine begrenzte Anzahl von prämenopausalen Patientinnen mit Krankheitsprogression während der Therapie mit NOLVADEX (Tamoxifencitrat) sprach auf eine nachfolgende Ovarialablation an.
Männlicher Brustkrebs
Veröffentlichte Ergebnisse von 122 Patienten (119 auswertbar) und Fallberichte von 16 Patienten (13 auswertbar), die mit NOLVADEX (Tamoxifencitrat) behandelt wurden, haben gezeigt, dass NOLVADEX (Tamoxifencitrat) bei der palliativen Behandlung von männlichem Brustkrebs wirksam ist. 66 dieser 132 auswertbaren Patienten sprachen auf NOLVADEX (Tamoxifencitrat) an, was einer objektiven Ansprechrate von 50 % entspricht.
Adjuvanter Brustkrebs
Überblick
Die Early Breast Cancer Trialists' Collaborative Group (EBCTCG) führte 1985, 1990 und erneut 1995 weltweite Übersichten über die systemische adjuvante Therapie von Brustkrebs im Frühstadium durch. 1998 wurden 10-Jahres-Ergebnisdaten für 36.689 Frauen in 55 randomisierten Studien berichtet Adjuvans NOLVADEX (Tamoxifencitrat) mit Dosen von 20-40 mg/Tag für 1-5+ Jahre. 25 % der Patienten erhielten eine Studienbehandlung von 1 Jahr oder weniger, 52 % 2 Jahre und 23 % etwa 5 Jahre. 48 % der Tumoren waren Östrogenrezeptor (ER)-positiv (> 10 fmol/mg), 21 % waren ER-arm (
Bei Frauen mit ER-positivem oder unbekanntem Brustkrebs und positiven Lymphknoten, die etwa 5 Jahre lang behandelt wurden, betrug das Gesamtüberleben nach 10 Jahren 61,4 % für NOLVADEX (Tamoxifencitrat) gegenüber 50,5 % für die Kontrollgruppe (Logrank 2p
Die Wirkung der geplanten Dauer von Tamoxifen kann wie folgt beschrieben werden. Bei Frauen mit ER-positivem oder unbekanntem Brustkrebs, die 1 Jahr oder weniger, 2 Jahre oder etwa 5 Jahre NOLVADEX (Tamoxifencitrat) erhielten, betrug die proportionale Reduktion der Sterblichkeit 12 %, 17 % bzw. 26 % (Trend signifikant bei 2p
Der Vorteil ist weniger klar für Frauen mit ER-armem Brustkrebs, bei denen die proportionale Reduktion der Rezidive 10 % (2p = 0,007) für alle Dauern zusammengenommen oder 9 % (2p = 0,02) betrug, wenn kontralateraler Brustkrebs ausgeschlossen wurde. Die entsprechende Reduktion der Sterblichkeit betrug 6 % (NS). Die Auswirkungen von etwa 5 Jahren NOLVADEX (Tamoxifencitrat) auf Rezidive und Mortalität waren unabhängig vom Alter und der gleichzeitigen Chemotherapie ähnlich. Es gab keinen Hinweis darauf, dass Dosen von mehr als 20 mg pro Tag wirksamer waren.
Anastrozole Adjuvans ATAC-Studie – Studie zu Anastrozol im Vergleich zu NOLVADEX (Tamoxifencitrat) zur adjuvanten Behandlung von Brustkrebs im Frühstadium – Eine Anastrozol-Adjuvans-Studie wurde mit 9366 postmenopausalen Frauen mit operablem Brustkrebs durchgeführt, die randomisiert einer adjuvanten Behandlung mit entweder Anastrozol 1 mg täglich, NOLVADEX (Tamoxifencitrat) 20 mg täglich oder einer Kombination dieser beiden Behandlungen über fünf Jahre oder bis zum Rezidiv unterzogen wurden der Krankheit. Bei einer medianen Nachbeobachtungszeit von 33 Monaten zeigte die Kombination von Anastrozol und NOLVADEX (Tamoxifencitrat) keinen Wirksamkeitsvorteil im Vergleich zur NOLVADEX (Tamoxifencitrat)-Therapie allein bei allen Patienten sowie in der Hormonrezeptor-positiven Subpopulation. Dieser Behandlungsarm wurde aus der Studie ausgeschlossen. Bitte beziehen Sie sich auf KLINISCHE PHARMAKOLOGIE-Spezielle Populationen-Arzneimittel-Arzneimittel-Wechselwirkungen , VORSICHTSMASSNAHMEN-Labortests , VORSICHTSMASSNAHMEN-Medikamentenwechselwirkungen und NEBENWIRKUNGEN Abschnitte für Sicherheitsinformationen aus dieser Studie. Weitere Informationen zu dieser Studie finden Sie in den vollständigen Verschreibungsinformationen für ARIMIDEX® (Anastrozol) 1 mg Tabletten.
Die Patienten in den beiden Monotherapie-Armen der ATAC-Studie wurden im Median 60 Monate (5 Jahre) behandelt und im Median 68 Monate nachbeobachtet. Das krankheitsfreie Überleben in der Intent-to-treat-Population war im Anastrazol-Arm im Vergleich zum NOLVADEX (Tamoxifencitrat)-Arm statistisch signifikant verbessert [Hazard Ratio (HR) = 0,87, 95 % KI: 0,78, 0,97, p = 0,0127]. .
Knoten positiv – Einzelstudien
Zwei Studien (Hubay und NSABP B-09) zeigten ein verbessertes krankheitsfreies Überleben nach radikaler oder modifizierter radikaler Mastektomie bei postmenopausalen Frauen oder Frauen ab 50 Jahren mit chirurgisch heilbarem Brustkrebs mit positiven axillären Lymphknoten, wenn NOLVADEX (Tamoxifencitrat) verabreicht wurde zusätzlich zu einer adjuvanten zytotoxischen Chemotherapie. In der Hubay-Studie wurde NOLVADEX (Tamoxifencitrat) zu „niedrig dosiertem“ CMF (Cyclophosphamid, Methotrexat und Fluorouracil) hinzugefügt. In der NSABP B-09-Studie wurde NOLVADEX (Tamoxifencitrat) zu Melphalan [L-Phenylalaninsenf (P)] und Fluorouracil (F) hinzugefügt.
In der Hubay-Studie war es wahrscheinlicher, dass Patienten mit einem positiven Östrogenrezeptor (mehr als 3 fmol) davon profitierten. In der NSABP B-09-Studie bei Frauen im Alter von 50-59 Jahren profitierten nur Frauen mit Östrogen- und Progesteronrezeptorspiegeln von 10 fmol oder mehr eindeutig, während es einen nicht statistisch signifikanten Trend zu Nebenwirkungen bei Frauen mit sowohl Östrogen- als auch Progesteronrezeptorspiegeln gab weniger als 10 fmol. Bei Frauen im Alter von 60 bis 70 Jahren gab es einen Trend zu einer vorteilhaften Wirkung von NOLVADEX (Tamoxifencitrat) ohne eindeutigen Zusammenhang mit dem Östrogen- oder Progesteronrezeptorstatus.
Drei prospektive Studien (ECOG-1178, Toronto, NATO) mit NOLVADEX (Tamoxifencitrat) adjuvant als Einzelwirkstoff zeigten ein verbessertes krankheitsfreies Überleben nach totaler Mastektomie und Axilladissektion bei postmenopausalen Frauen mit positiven axillären Lymphknoten im Vergleich zu Kontrollen ohne Placebo/ohne Behandlung . Die NATO-Studie zeigte auch einen Gesamtüberlebensvorteil.
Knoten negativ – Einzelstudien
NSABP B-14, eine prospektive, doppelblinde, randomisierte Studie, verglich NOLVADEX (Tamoxifencitrat) mit Placebo bei Frauen mit axillärem Lymphknoten-negativem, Östrogenrezeptor-positivem (≥ 10 fmol/mg Cytosolprotein) Brustkrebs (als adjuvante Therapie). , nach totaler Mastektomie und Axilladissektion oder Segmentresektion
INFORMATIONEN ZUM PATIENTEN
ARZNEIMITTEL-LEITFADEN
NOLVADEX (Tamoxifencitrat)® (NOLE-vah-dex) Tabletten Generischer Name: Tamoxifen (ta-MOX-I-fen)
Geschrieben für Frauen, die NOLVADEX (Tamoxifencitrat) verwenden, um ihre hohe Wahrscheinlichkeit, an Brustkrebs zu erkranken, oder die ein duktales Karzinom in situ (DCIS) haben, zu verringern.
Dieser Medikationsleitfaden behandelt nur die Anwendung von NOLVADEX (Tamoxifencitrat) zur Senkung des Brustkrebsrisikos bei Frauen mit hohem Risiko und bei Frauen, die wegen DCIS behandelt werden.
Personen, die NOLVADEX (Tamoxifencitrat) einnehmen behandeln Brustkrebs haben andere Vorteile und andere Entscheidungen zu treffen als Frauen mit hohem Risiko oder Frauen mit Duktalkarzinom in situ (DCIS), die NOLVADEX (Tamoxifencitrat) einnehmen, um das Risiko, an Brustkrebs zu erkranken, zu verringern. Wenn Sie bereits Brustkrebs haben, sprechen Sie mit Ihrem Arzt darüber, wie der Nutzen einer Behandlung von Brustkrebs mit NOLVADEX (Tamoxifencitrat) im Vergleich zu den Risiken steht, die in diesem Dokument beschrieben werden.
Warum sollte ich diesen Medikationsleitfaden lesen?
Dieser Leitfaden enthält Informationen, die Ihnen bei der Entscheidung helfen, ob Sie NOLVADEX (Tamoxifencitrat) anwenden sollten, um Ihr Brustkrebsrisiko zu senken.
Sie und Ihr Arzt sollten darüber sprechen, ob der mögliche Nutzen von NOLVADEX (Tamoxifencitrat) bei der Senkung Ihres hohen Brustkrebsrisikos größer ist als die möglichen Risiken. Ihr Arzt verfügt über ein spezielles Computerprogramm oder einen Taschenrechner, um festzustellen, ob Sie zur Hochrisikogruppe gehören. Wenn Sie DCIS haben und mit einer Operation und Strahlentherapie behandelt wurden, kann Ihr Arzt Ihnen NOLVADEX (Tamoxifencitrat) verschreiben, um Ihre Wahrscheinlichkeit zu verringern, an invasivem (sich ausbreitendem) Brustkrebs zu erkranken.
Lesen Sie diese Anleitung sorgfältig durch, bevor Sie mit der Einnahme von NOLVADEX (Tamoxifencitrat) beginnen. Es ist wichtig, die Informationen, die Sie erhalten, jedes Mal zu lesen, wenn Sie mehr Arzneimittel erhalten. Vielleicht gibt es etwas Neues. Dieser Leitfaden sagt Ihnen nicht alles über NOLVADEX (Tamoxifencitrat) und tut es nicht das Gespräch mit Ihrem Arzt ersetzen.
Nur Sie und Ihr Arzt können feststellen, ob NOLVADEX (Tamoxifencitrat) für Sie geeignet ist.
Was sind die wichtigsten Informationen, die ich über die Anwendung von NOLVADEX (Tamoxifencitrat) zur Verringerung des Brustkrebsrisikos wissen sollte?
NOLVADEX (Tamoxifencitrat) ist ein verschreibungspflichtiges Medikament, das in mancher Hinsicht wie Östrogen (weibliches Hormon) und in anderer Hinsicht anders ist. In der Brust kann NOLVADEX (Tamoxifencitrat) die Wirkung von Östrogen blockieren. Aus diesem Grund kann NOLVADEX (Tamoxifencitrat) das Wachstum von Brustkrebs hemmen, der Östrogen zum Wachstum benötigt (Krebs, der Östrogen- oder Progesteronrezeptor-positiv ist).
NOLVADEX (Tamoxifencitrat) kann die Wahrscheinlichkeit, an Brustkrebs zu erkranken, bei Frauen mit einer höheren Wahrscheinlichkeit als normal, in den nächsten fünf Jahren an Brustkrebs zu erkranken (Frauen mit hohem Risiko) und bei Frauen mit DCIS verringern.
Da Frauen mit hohem Risiko noch keinen Krebs haben, ist es wichtig, sorgfältig darüber nachzudenken, ob der mögliche Nutzen von NOLVADEX (Tamoxifencitrat) bei der Verringerung der Wahrscheinlichkeit, an Brustkrebs zu erkranken, größer ist als die möglichen Risiken.
Dieser Medikationsleitfaden gibt einen Überblick über die Risiken und Vorteile der Anwendung von NOLVADEX (Tamoxifencitrat), um die Wahrscheinlichkeit, an Brustkrebs zu erkranken, bei Frauen mit hohem Risiko und Frauen mit DCIS zu verringern. Dieser Leitfaden tut es nicht Diskutieren Sie die besonderen Vorteile und Entscheidungen für Menschen, die bereits an Brustkrebs erkrankt sind.
Warum verwenden Frauen und Männer NOLVADEX (Tamoxifencitrat)?
NOLVADEX (Tamoxifencitrat) hat mehr als eine Anwendung. NOLVADEX (Tamoxifencitrat) wird verwendet:
um die Chance zu verringern an Brustkrebs zu erkranken bei Frauen mit einer höheren als der normalen Wahrscheinlichkeit, in den nächsten 5 Jahren an Brustkrebs zu erkranken (Frauen mit hohem Risiko)
um die Chance zu verringern invasiven (sich ausbreitenden) Brustkrebs bei Frauen zu bekommen, die wegen eines duktalen Karzinoms in situ (DCIS) operiert und bestrahlt wurden. DCIS bedeutet, dass sich der Krebs nur in den Milchgängen befindet.
behandeln Brustkrebs bei Frauen nach Abschluss der Frühbehandlung. Eine frühzeitige Behandlung kann eine Operation, Bestrahlung und Chemotherapie umfassen. NOLVADEX (Tamoxifencitrat) kann verhindern, dass sich der Krebs auf andere Teile des Körpers ausbreitet. Es kann auch die Chance der Frau verringern, einen neuen Brustkrebs zu bekommen. bei Frauen und Männern,
behandeln Brustkrebs, der sich auf andere Teile des Körpers ausgebreitet hat (metastasierter Brustkrebs).
Dieser Leitfaden spricht nur über die Verwendung von NOLVADEX (Tamoxifencitrat), um die Wahrscheinlichkeit, an Brustkrebs zu erkranken, zu verringern (Nr. 1 und Nr. 2 oben).
Was sind die Vorteile von NOLVADEX (Tamoxifencitrat), um das Risiko, an Brustkrebs zu erkranken, bei Frauen mit hohem Risiko und bei Frauen, die wegen DCIS behandelt werden, zu verringern?
Eine große US-Studie hat sich das angeschaut Frauen mit hohem Risiko und verglichen diejenigen, die 5 Jahre lang NOLVADEX (Tamoxifencitrat) einnahmen, mit anderen, die eine Pille ohne NOLVADEX (Tamoxifencitrat) (Placebo) einnahmen. Frauen mit hohem Risiko wurden basierend auf einem speziellen Computerprogramm als Frauen definiert, bei denen die Wahrscheinlichkeit, in den nächsten 5 Jahren an Brustkrebs zu erkranken, bei 1,7 % oder mehr liegt. In dieser Studie:
Die Studie zeigte, dass Frauen mit hohem Risiko, die NOLVADEX (Tamoxifencitrat) einnahmen, ihre Wahrscheinlichkeit, an Brustkrebs zu erkranken, im Durchschnitt um 44 % senkten, von 7 zu 1.000 auf 4 zu 1.000.
Eine andere US-Studie betrachtet Frauen mit DCIS und verglichen diejenigen, die 5 Jahre lang NOLVADEX (Tamoxifencitrat) einnahmen, mit anderen, die ein Placebo einnahmen. In dieser Studie:
Die Studie zeigte, dass Frauen mit DCIS, die NOLVADEX (Tamoxifencitrat) einnahmen, ihre Wahrscheinlichkeit, an invasivem (sich ausbreitendem) Brustkrebs zu erkranken, im Durchschnitt um 43 % senkten, von 17 zu 1.000 auf 10 zu 1.000.
Diese Studien bedeuten nicht, dass die Einnahme von NOLVADEX (Tamoxifencitrat) Ihr persönliches Brustkrebsrisiko verringert. Wir wissen nicht, welche Vorteile eine einzelne Frau haben wird, die NOLVADEX (Tamoxifencitrat) einnimmt, um ihr Brustkrebsrisiko zu verringern.
Welche Risiken hat NOLVADEX (Tamoxifencitrat)?
In den unter „Was sind die Vorteile von NOLVADEX (Tamoxifencitrat)?“ beschriebenen Studien traten bei Frauen mit hohem Risiko, die NOLVADEX (Tamoxifencitrat) einnahmen, bestimmte Nebenwirkungen häufiger auf als bei Frauen, die ein Placebo einnahmen.
Einige dieser Nebenwirkungen können zum Tod führen.
In einer Studie bei Frauen, die noch ihre Gebärmutter hatten
Diese Ergebnisse zeigen, dass dies im Durchschnitt bei Frauen mit hohem Risiko der Fall ist die noch ihre Gebärmutter hatten , NOLVADEX (Tamoxifencitrat) verdoppelte die Wahrscheinlichkeit, an Gebärmutterschleimhautkrebs zu erkranken, von 1 zu 1.000 auf 2 zu 1.000, und es erhöhte die Wahrscheinlichkeit, an einem Uterussarkom zu erkranken. Dies bedeutet nicht, dass die Einnahme von NOLVADEX (Tamoxifencitrat) Ihre persönliche Chance, an Gebärmutterschleimhautkrebs zu erkranken, verdoppelt oder Ihre Chance, an einem Uterussarkom zu erkranken, erhöht. Wir wissen nicht, wie hoch dieses Risiko für eine einzelne Frau sein wird. Anders ist das Risiko bei Frauen, die ihre Gebärmutter nicht mehr haben.
Bei allen Frauen in dieser Studie erhöhte die Einnahme von NOLVADEX (Tamoxifencitrat) das Risiko für ein Blutgerinnsel in der Lunge oder den Venen oder für einen Schlaganfall. In einigen Fällen starben Frauen an diesen Auswirkungen.
NOLVADEX (Tamoxifencitrat) erhöhte das Risiko, Katarakte (Trübung der Augenlinse) zu bekommen oder eine Kataraktoperation zu benötigen. (Weitere Informationen zu Nebenwirkungen finden Sie unter „Was sind die möglichen Nebenwirkungen von NOLVADEX (Tamoxifencitrat)?“).
Was wissen wir nicht über die Einnahme von NOLVADEX (Tamoxifencitrat), um das Brustkrebsrisiko zu verringern?
Wir wissen es nicht
Es werden Studien durchgeführt, um mehr über die langfristigen Vorteile und Risiken der Verwendung von NOLVADEX (Tamoxifencitrat) zur Verringerung des Brustkrebsrisikos zu erfahren.
Welche Nebenwirkungen kann NOLVADEX (Tamoxifencitrat) haben?
Die häufigste Nebenwirkung von NOLVADEX (Tamoxifencitrat) sind Hitzewallungen. Dies ist kein Anzeichen für ein ernsthaftes Problem.
Die zweithäufigste Nebenwirkung ist vaginaler Ausfluss. Wenn der Ausfluss blutig ist, könnte dies ein Zeichen für ein ernsthaftes Problem sein. [Siehe „Veränderungen der Schleimhaut (Endometrium) oder des Körpers Ihrer Gebärmutter“ weiter unten.]
Weniger häufige, aber schwerwiegende Nebenwirkungen von NOLVADEX (Tamoxifencitrat) sind unten aufgeführt. Diese können jederzeit auftreten. Rufen Sie sofort Ihren Arzt an, wenn Sie Anzeichen der unten aufgeführten Nebenwirkungen haben:
Dies sind nicht alle möglichen Nebenwirkungen von NOLVADEX (Tamoxifencitrat). Fragen Sie Ihren Arzt oder Apotheker nach einer vollständigen Liste.
Wer sollte NOLVADEX (Tamoxifencitrat) nicht einnehmen?
Nehmen Sie NOLVADEX (Tamoxifencitrat) aus keinem Grund ein, wenn Sie
Wenn Sie während der Einnahme von NOLVADEX (Tamoxifencitrat) schwanger werden, brechen Sie die Einnahme sofort ab und wenden Sie sich an Ihren Arzt. NOLVADEX (Tamoxifencitrat) kann Ihrem ungeborenen Kind schaden. Nehmen Sie NOLVADEX (Tamoxifencitrat) nicht ein, um Ihr Risiko, an Brustkrebs zu erkranken, zu verringern, wenn
Wie soll ich NOLVADEX (Tamoxifencitrat) einnehmen?
Was sollte ich während der Einnahme von NOLVADEX (Tamoxifencitrat) vermeiden?
Was soll ich während der Einnahme von NOLVADEX (Tamoxifencitrat) tun?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von NOLVADEX (Tamoxifencitrat)
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Ihr Arzt hat Ihnen nur NOLVADEX (Tamoxifencitrat) verschrieben. Geben Sie es nicht an andere Personen weiter, selbst wenn sie einen ähnlichen Zustand haben, da es ihnen schaden könnte. Verwenden Sie es nicht für einen Zustand, für den es nicht verschrieben wurde.
Dieser Medikationsleitfaden ist eine Zusammenfassung von Informationen über NOLVADEX (Tamoxifencitrat) für Frauen, die NOLVADEX (Tamoxifencitrat) verwenden, um ihre hohe Wahrscheinlichkeit, an Brustkrebs zu erkranken, oder die an DCIS leiden, zu verringern. Wenn Sie weitere Informationen zu NOLVADEX (Tamoxifencitrat) wünschen, fragen Sie Ihren Arzt oder Apotheker. Sie können Ihnen Informationen über NOLVADEX (Tamoxifencitrat) geben, die für Angehörige der Gesundheitsberufe geschrieben wurden. Weitere Informationen über NOLVADEX (Tamoxifencitrat) oder Brustkrebs erhalten Sie unter www.NOLVADEX (Tamoxifencitrat) .com oder telefonisch unter 1-800-236-9933.
Zutaten: Tamoxifencitrat, Calcium-Carboxymethylcellulose, Magnesiumstearat, Mannitol und Stärke.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt