Actos 15mg, 30mg Pioglitazone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Actos und wie wird es angewendet?
Actos 15 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Diabetes mellitus Typ 2. Actos kann allein oder mit anderen Medikamenten verwendet werden.
Actos ist ein Thiazolidindion-Antidiabetikum.
Es ist nicht bekannt, ob Actos 15 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Actos 15 mg haben?
Actos kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Actos gehören:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Dies sind nicht alle möglichen Nebenwirkungen von Actos. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
STAUUNGSHERZVERSAGEN
BEZEICHNUNG
ACTOS-Tabletten sind ein Thiazolidindion und ein Agonist für den Peroxisom-Proliferator-aktivierten Rezeptor (PPAR) Gamma, der ein orales Antidiabetikum enthält: Pioglitazon.
Pioglitazon [(±)-5-[[4-[2-(5-Ethyl-2-pyridinyl)ethoxy]phenyl]methyl]-2,4-]thiazolidindionmonohydrochlorid enthält ein asymmetrisches Kohlenstoffatom, und die Verbindung wird synthetisiert und verwendet als racemische Mischung. Die beiden Enantiomere von Pioglitazon wandeln sich in vivo ineinander um. Es wurden keine Unterschiede in der pharmakologischen Aktivität zwischen den zwei Enantiomeren gefunden. Die Strukturformel lautet wie folgt:
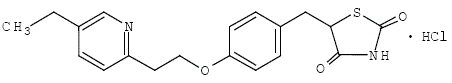
Pioglitazonhydrochlorid ist ein geruchloses, weißes, kristallines Pulver mit der Summenformel C19H20N2O3S·HCl und einem Molekulargewicht von 392,90 Dalton. Es ist löslich in N,N-Dimethylformamid, wenig löslich in wasserfreiem Ethanol, sehr wenig löslich in Aceton und Acetonitril, praktisch unlöslich in Wasser und unlöslich in Ether.
ACTOS ist als Tablette zur oralen Verabreichung mit 15 mg, 30 mg oder 45 mg Pioglitazon (als Basis) mit den folgenden Hilfsstoffen erhältlich: Lactos 30 mg Monohydrat NF, Hydroxypropylcellulose NF, Carboxymethylcellulose-Calcium NF und Magnesiumstearat NF.
INDIKATIONEN
Monotherapie und Kombinationstherapie
ACTOS 30 mg ist als Ergänzung zu Diät und Bewegung indiziert, um die glykämische Kontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus in mehreren klinischen Situationen zu verbessern [siehe Klinische Studien ].
Wichtige Nutzungsbeschränkungen
ACTOS 15 mg entfaltet seine antihyperglykämische Wirkung nur in Gegenwart von körpereigenem Insulin. ACTOS 30 mg sollte nicht zur Behandlung von Typ-1-Diabetes oder diabetischer Ketoazidose angewendet werden, da es in diesen Situationen nicht wirksam wäre.
Seien Sie bei Patienten mit Lebererkrankungen vorsichtig [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
DOSIERUNG UND ANWENDUNG
Empfehlungen für alle Patienten
ACTOS 15 mg sollte einmal täglich eingenommen werden und kann unabhängig von den Mahlzeiten eingenommen werden.
Die empfohlene Anfangsdosis für Patienten ohne dekompensierte Herzinsuffizienz beträgt 15 mg oder 30 mg einmal täglich.
Die empfohlene Anfangsdosis für Patienten mit dekompensierter Herzinsuffizienz (NYHA-Klasse I oder II) beträgt 15 mg einmal täglich.
Die Dosis kann in Schritten von 15 mg bis zu einem Maximum von 45 mg einmal täglich basierend auf der glykämischen Reaktion, bestimmt durch HbA1c, titriert werden.
Überwachen Sie die Patienten nach Beginn der Behandlung mit ACTOS 30 mg oder bei einer Dosiserhöhung sorgfältig auf Nebenwirkungen im Zusammenhang mit Flüssigkeitsretention wie Gewichtszunahme, Ödeme und Anzeichen und Symptome einer dekompensierten Herzinsuffizienz [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Lebertests (Serum-Alanin- und Aspartat-Aminotransferasen, alkalische Phosphatase und Gesamtbilirubin) sollten vor Beginn der Behandlung mit ACTOS durchgeführt werden. Eine routinemäßige regelmäßige Überwachung der Leberwerte während der Behandlung mit ACTOS 30 mg wird bei Patienten ohne Lebererkrankung nicht empfohlen. Patienten, die vor Beginn der Behandlung mit ACTOS abnorme Leberwerte aufweisen oder bei denen während der Einnahme von ACTOS abnorme Leberwerte festgestellt werden, sollten wie unter „Warnhinweise und Vorsichtsmaßnahmen“ beschrieben behandelt werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
Gleichzeitige Anwendung mit einem Insulinsekretagogikum oder Insulin
Wenn bei einem Patienten, der gleichzeitig ACTOS 30 mg und ein Insulin-Sekretagogikum (z. B. Sulfonylharnstoff) verabreicht wird, Hypoglykämie auftritt, sollte die Dosis des Insulin-Sekretagogikums reduziert werden.
Wenn bei einem Patienten unter gleichzeitiger Verabreichung von ACTOS 30 mg und Insulin eine Hypoglykämie auftritt, sollte die Insulindosis um 10 % bis 25 % verringert werden. Weitere Anpassungen der Insulindosis sollten basierend auf der glykämischen Reaktion individualisiert werden.
Gleichzeitige Anwendung mit starken CYP2C8-Inhibitoren
Die gleichzeitige Verabreichung von ACTOS 30 mg und Gemfibrozil, einem starken CYP2C8-Hemmer, erhöht die Pioglitazon-Exposition etwa um das 3-Fache. Daher beträgt die empfohlene Höchstdosis von ACTOS 15 mg täglich bei Anwendung in Kombination mit Gemfibrozil oder anderen starken CYP2C8-Hemmern [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN und KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
Runde Tablette enthält folgendes Pioglitazon:
Lagerung und Handhabung
ACTOS ist in 15-mg-, 30-mg- und 45-mg-Tabletten wie folgt erhältlich:
15-mg-Tablette : Weiße bis cremefarbene, runde, konvexe Tablette ohne Bruchrille mit „ACTOS“ auf der einen und „15“ auf der anderen Seite, erhältlich in:
NDC 64764-151-04 30 Flaschen NDC 64764-151-05 Flaschen zu 90 NDC 64764-151-06 Flaschen zu 500
30-mg-Tablette Weiße bis cremefarbene, runde, flache Tablette ohne Bruchrille mit „ACTOS“ auf der einen und „30“ auf der anderen Seite, erhältlich in:
NDC 64764-301-14 Flaschen zu 30 NDC 64764-301-15 Flaschen zu 90 NDC 64764-301-16 Flaschen zu 500
45-mg-Tablette : Weiße bis cremefarbene, runde, flache Tablette ohne Bruchrille mit „ACTOS“ auf der einen und „45“ auf der anderen Seite, erhältlich in:
NDC 64764-451-24 Flaschen zu 30 NDC 64764-451-25 Flaschen zu 90 NDC 64764-451-26 Flaschen zu 500
Lagerung
Bei 25 °C (77 °F) lagern; Abweichungen bis 15-30°C (59-86°F) zulässig [siehe USP Controlled Room Temperature]. Behälter dicht geschlossen halten und vor Licht, Nässe und Feuchtigkeit schützen.
Vertrieb durch: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Überarbeitet: Dezember 2017
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden an anderer Stelle in der Kennzeichnung erörtert:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Über 8500 Patienten mit Typ-2-Diabetes wurden in randomisierten, doppelblinden, kontrollierten klinischen Studien mit ACTOS behandelt, darunter 2605 Patienten mit Typ-2-Diabetes und makrovaskulären Erkrankungen, die in der klinischen Studie PROactive mit ACTOS 30 mg behandelt wurden. In diesen Studien wurden über 6000 Patienten sechs Monate oder länger mit ACTOS behandelt, über 4500 Patienten wurden ein Jahr oder länger mit ACTOS 15 mg behandelt und über 3000 Patienten wurden mindestens zwei Jahre mit ACTOS behandelt.
In sechs gepoolten 16- bis 26-wöchigen placebokontrollierten Monotherapie- und 16- bis 24-wöchigen Studien zur Kombinationstherapie als Zusatztherapie betrug die Inzidenz von Behandlungsabbrüchen aufgrund unerwünschter Ereignisse 4,5 % bei Patienten, die mit ACTOS 30 mg behandelt wurden, und 5,8 % bei Patienten, die mit ACTOS 30 mg behandelt wurden. behandelte Patienten. Die häufigsten unerwünschten Ereignisse, die zum Absetzen führten, standen im Zusammenhang mit einer unzureichenden Blutzuckerkontrolle, obwohl die Inzidenz dieser Ereignisse unter ACTOS 30 mg geringer war (1,5 %) als unter Placebo (3,0 %).
In der PROactive-Studie betrug die Häufigkeit von Studienabbrüchen aufgrund unerwünschter Ereignisse 9,0 % bei mit ACTOS 30 mg behandelten Patienten und 7,7 % bei mit Placebo behandelten Patienten. Herzinsuffizienz war die häufigste schwerwiegende Nebenwirkung, die zu einem Abbruch führte und bei 1,3 % der mit ACTOS 30 mg behandelten Patienten und bei 0,6 % der mit Placebo behandelten Patienten auftrat.
Häufige Nebenwirkungen: 16- bis 26-wöchige Monotherapie-Studien
Eine Zusammenfassung der Inzidenz und Art der häufigen unerwünschten Ereignisse, die in drei gepoolten 16- bis 26-wöchigen placebokontrollierten Monotherapiestudien mit ACTOS berichtet wurden, ist in Tabelle 1 aufgeführt. Die angegebenen Begriffe stehen für solche, die mit einer Inzidenz von > 5 % und häufiger auftraten bei Patienten, die mit ACTOS 15 mg behandelt wurden, als bei Patienten, die Placebo erhielten. Keines dieser unerwünschten Ereignisse stand im Zusammenhang mit der ACTOS-Dosis.
Häufige unerwünschte Ereignisse: 16- bis 24-wöchige Add-on-Kombinationstherapie-Studien
Eine Zusammenfassung der Gesamtinzidenz und der Arten von häufigen unerwünschten Ereignissen, die in Studien mit ACTOS als Add-on zu Sulfonylharnstoff berichtet wurden, ist in Tabelle 2 angegeben. Die berichteten Begriffe stellen diejenigen dar, die mit einer Inzidenz von > 5 % auftraten, und häufiger mit der höchsten getesteten Dosis von ACTOS.
Eine Zusammenfassung der Gesamthäufigkeit und der Arten von häufigen unerwünschten Ereignissen, die in Studien mit ACTOS 30 mg als Add-on zu Metformin berichtet wurden, ist in Tabelle 3 angegeben. Die angegebenen Begriffe stellen diejenigen dar, die mit einer Häufigkeit von > 5 % und häufiger mit der höchsten aufgetreten sind getestete Dosis von ACTOS.
Tabelle 4 fasst die Inzidenz und Arten von häufigen unerwünschten Ereignissen zusammen, die in Studien mit ACTOS als Add-on zu Insulin berichtet wurden. Die gemeldeten Begriffe stellen diejenigen dar, die bei einer Inzidenz von > 5 % und häufiger bei der höchsten getesteten ACTOS-Dosis auftraten.
Eine Zusammenfassung der Gesamthäufigkeit und der Arten von häufigen unerwünschten Ereignissen, die in der PROactive-Studie gemeldet wurden, ist in Tabelle 5 angegeben. Die angegebenen Begriffe stellen diejenigen dar, die mit einer Inzidenz von > 5 % und häufiger bei Patienten auftraten, die mit ACTOS behandelt wurden, als bei Patienten, die behandelt wurden Placebo erhalten.
Kongestive Herzinsuffizienz
Eine Zusammenfassung der Inzidenz unerwünschter Ereignisse im Zusammenhang mit dekompensierter Herzinsuffizienz ist in Tabelle 6 für die 16- bis 24-wöchigen Add-on-Studien zu Sulfonylharnstoffen, für die 16- bis 24-wöchigen Add-on-Studien zu Insulin und für bereitgestellt die 16- bis 24-wöchige Ergänzung zu Metformin-Studien. Keines der Ereignisse war tödlich.
Patienten mit Typ-2-Diabetes und dekompensierter Herzinsuffizienz der NYHA-Klasse II oder der frühen Klasse III erhielten randomisiert eine 24-wöchige doppelblinde Behandlung mit entweder ACTOS 30 mg in Tagesdosen von 30 mg bis 45 mg (n = 262) oder Glyburid in Tagesdosen von 10 mg bis 15 mg (n=256). Eine Zusammenfassung der in dieser Studie berichteten Inzidenz unerwünschter Ereignisse im Zusammenhang mit dekompensierter Herzinsuffizienz ist in Tabelle 7 aufgeführt.
Ereignisse mit dekompensierter Herzinsuffizienz, die zu einem Krankenhausaufenthalt führten und während der PROactive-Studie auftraten, sind in Tabelle 8 zusammengefasst.
Kardiovaskuläre Sicherheit
In der PROactive-Studie wurden 5.238 Patienten mit Typ-2-Diabetes und makrovaskulärer Erkrankung in der Vorgeschichte randomisiert ACTOS (N = 2.605), forciert auf bis zu 45 mg täglich oder Placebo (N = 2.633) zusätzlich zur Standardbehandlung verabreicht. Fast alle Patienten (95 %) erhielten kardiovaskuläre Medikamente (Betablocker, ACE-Hemmer, Angiotensin-II-Rezeptorblocker, Kalziumkanalblocker, Nitrate, Diuretika, Aspirin, Statine und Fibrate). Zu Studienbeginn hatten die Patienten ein mittleres Alter von 62 Jahren, eine mittlere Diabetesdauer von 9,5 Jahren und einen mittleren HbA1c-Wert von 8,1 %. Die mittlere Nachbeobachtungszeit betrug 34,5 Monate. Das primäre Ziel dieser Studie war die Untersuchung der Wirkung von ACTOS auf Mortalität und makrovaskuläre Morbidität bei Patienten mit Typ-2-Diabetes mellitus, die ein hohes Risiko für makrovaskuläre Ereignisse aufwiesen. Die primäre Wirksamkeitsvariable war die Zeit bis zum ersten Auftreten eines beliebigen Ereignisses in einem kardiovaskulären zusammengesetzten Endpunkt, der Gesamtmortalität, nicht tödlichen Myokardinfarkt (MI) einschließlich stillem MI, Schlaganfall, akutes Koronarsyndrom, Herzintervention einschließlich Koronararterien-Bypass-Operation oder umfasste perkutaner Eingriff, große Beinamputation oberhalb des Knöchels und Bypass-Operation oder Revaskularisation im Bein. Insgesamt 514 (19,7 %) der mit ACTOS 15 mg behandelten Patienten und 572 (21,7 %) der mit Placebo behandelten Patienten erlitten mindestens ein Ereignis des primären kombinierten Endpunkts (Hazard Ratio 0,90; 95 % Konfidenzintervall: 0,80; 1,02; p = 0,10). ).
Obwohl es keinen statistisch signifikanten Unterschied zwischen ACTOS und Placebo für die 3-Jahres-Inzidenz eines ersten Ereignisses innerhalb dieser Kombination gab, gab es unter ACTOS keinen Anstieg der Mortalität oder der Gesamtzahl makrovaskulärer Ereignisse. Die Anzahl der erstmaligen Ereignisse und die Gesamtzahl der einzelnen Ereignisse, die zum primären zusammengesetzten Endpunkt beitragen, sind in Tabelle 9 aufgeführt.
Gewichtszunahme
Eine dosisabhängige Gewichtszunahme tritt auf, wenn ACTOS 30 mg allein oder in Kombination mit anderen Antidiabetika angewendet wird. Der Mechanismus der Gewichtszunahme ist unklar, beinhaltet aber wahrscheinlich eine Kombination aus Flüssigkeitsretention und Fettansammlung.
Die Tabellen 10 und 11 fassen die Veränderungen des Körpergewichts mit ACTOS und Placebo in den 16- bis 26-wöchigen randomisierten, doppelblinden Monotherapie- und 16- bis 24-wöchigen Kombinations-Add-on-Therapiestudien und in der PROactive-Studie zusammen.
Ödem
Durch die Einnahme von ACTOS verursachte Ödeme sind reversibel, wenn ACTOS abgesetzt wird. Das Ödem erfordert normalerweise keinen Krankenhausaufenthalt, es sei denn, es besteht gleichzeitig eine kongestive Herzinsuffizienz. Eine Zusammenfassung der Häufigkeit und Arten von unerwünschten Ödemereignissen, die in klinischen Studien mit ACTOS 30 mg auftraten, ist in Tabelle 12 angegeben.
Hepatische Wirkungen
Bisher gab es in der Datenbank für kontrollierte klinische Studien von ACTOS keine Hinweise auf eine induzierte Hepatotoxizität durch ACTOS. Eine randomisierte, doppelblinde 3-Jahres-Studie, in der ACTOS 15 mg mit Glyburid als Add-on-Therapie zu Metformin und Insulin verglichen wurde, wurde speziell entwickelt, um die Inzidenz einer Serum-ALT-Erhöhung auf mehr als das Dreifache der Obergrenze des Referenzbereichs zu bewerten, jeweils gemessen acht Wochen in den ersten 48 Wochen der Studie, danach alle 12 Wochen. Insgesamt entwickelten 3/1051 (0,3 %) der mit ACTOS behandelten Patienten und 9/1046 (0,9 %) der mit Glyburid behandelten Patienten ALT-Werte, die über dem Dreifachen der Obergrenze des Referenzbereichs lagen. Keiner der bisher mit ACTOS behandelten Patienten in der ACTOS-Datenbank für kontrollierte klinische Studien hatte eine Serum-ALT von mehr als dem Dreifachen der Obergrenze des Referenzbereichs und ein entsprechendes Gesamtbilirubin von mehr als dem Zweifachen der Obergrenze des Referenzbereichs, a Kombination, die das Potenzial für eine schwere arzneimittelinduzierte Leberschädigung vorhersagt.
Hypoglykämie
In den klinischen Studien mit ACTOS 15 mg wurden unerwünschte Ereignisse von Hypoglykämie auf der Grundlage der klinischen Beurteilung der Prüfärzte berichtet und erforderten keine Bestätigung durch Glukosetests an der Fingerbeere.
In der 16-wöchigen Add-on-Studie zu Sulfonylharnstoff betrug die Inzidenz berichteter Hypoglykämien 3,7 % unter ACTOS 30 mg und 0,5 % unter Placebo. In der 16-wöchigen Add-on-Insulin-Studie betrug die Inzidenz berichteter Hypoglykämien 7,9 % mit ACTOS 15 mg, 15,4 % mit ACTOS 30 mg und 4,8 % mit Placebo.
Die Inzidenz berichteter Hypoglykämien war sowohl in der 24-wöchigen Add-on-Studie zu Sulfonylharnstoff (15,7 % vs. 13,4 %) als auch in der 24-wöchigen Add-on-Studie zu Insulin unter ACTOS 45 mg höher als unter ACTOS 30 mg (47,8 % vs. 13,4 %). % gegenüber 43,5 %).
Drei Patienten in diesen vier Studien wurden wegen Hypoglykämie ins Krankenhaus eingeliefert. Alle drei Patienten erhielten ACTOS 30 mg (0,9 %) in der 24-wöchigen Add-on-Insulin-Studie. Weitere 14 Patienten berichteten über eine schwere Hypoglykämie (definiert als erhebliche Beeinträchtigung der üblichen Aktivitäten des Patienten), die keinen Krankenhausaufenthalt erforderte. Diese Patienten erhielten ACTOS 45 mg in Kombination mit Sulfonylharnstoff (n = 2) oder ACTOS 30 mg oder 45 mg in Kombination mit Insulin (n = 12).
Tumore der Harnblase
In der zweijährigen Kanzerogenitätsstudie wurden Tumore in der Harnblase männlicher Ratten beobachtet [vgl Nichtklinische Toxikologie ]. Während der dreijährigen klinischen Studie PROactive wurde bei 14 von 2.605 (0,54 %) Patienten, die ACTOS randomisiert wurden, und bei 5 von 2.633 (0,19 %), die Placebo randomisiert wurden, Blasenkrebs diagnostiziert. Nach Ausschluss von Patienten, bei denen die Exposition gegenüber dem Studienmedikament zum Zeitpunkt der Diagnose von Blasenkrebs weniger als ein Jahr betrug, gab es 6 (0,23 %) Fälle unter ACTOS 15 mg und zwei (0,08 %) Fälle unter Placebo. Nach Abschluss der Studie wurde eine große Untergruppe von Patienten für bis zu 10 weitere Jahre mit geringer zusätzlicher Exposition gegenüber ACTOS beobachtet. Während der 13 Jahre sowohl der PROactive- als auch der Beobachtungsnachbeobachtung unterschied sich das Auftreten von Blasenkrebs nicht zwischen Patienten, die randomisiert ACTOS oder Placebo erhielten (HR = 1,00; 95 % KI: 0,59–1,72) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Laboranomalien
Hämatologische Wirkungen
ACTOS 15 mg kann eine Abnahme des Hämoglobins und des Hämatokrits verursachen. In placebokontrollierten Studien zur Monotherapie sanken die mittleren Hämoglobinwerte bei mit ACTOS behandelten Patienten um 2 % bis 4 %, verglichen mit einer mittleren Hämoglobinveränderung von -1 % bis +1 % bei den mit Placebo behandelten Patienten. Diese Veränderungen traten hauptsächlich innerhalb der ersten 4 bis 12 Wochen der Therapie auf und blieben danach relativ konstant. Diese Veränderungen können mit einem erhöhten Plasmavolumen im Zusammenhang mit der Therapie mit ACTOS 30 mg zusammenhängen und sind wahrscheinlich nicht mit klinisch signifikanten hämatologischen Wirkungen verbunden.
Kreatin-Phosphokinase
Während der protokollspezifischen Messung der Serum-Kreatin-Phosphokinase (CPK) in klinischen Studien mit ACTOS 15 mg wurde bei neun (0,2 %) Patienten, die mit ACTOS behandelt wurden, eine isolierte Erhöhung der CPK auf mehr als das 10-fache der Obergrenze des Referenzbereichs festgestellt (Werte von 2150 bis 11400 IE/l) und bei keinem der mit einem Vergleichspräparat behandelten Patienten. Sechs dieser neun Patienten erhielten weiterhin ACTOS 15 mg, bei zwei Patienten wurde eine CPK-Erhöhung am letzten Tag der Dosierung festgestellt und bei einem Patienten wurde ACTOS aufgrund der Erhöhung abgesetzt. Diese Erhöhungen bildeten sich ohne offensichtliche klinische Folgen zurück. Der Zusammenhang zwischen diesen Ereignissen und der Therapie mit ACTOS 30 mg ist nicht bekannt.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von ACTOS nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Postmarketing-Berichte über dekompensierte Herzinsuffizienz wurden bei mit ACTOS behandelten Patienten sowohl mit als auch ohne zuvor bekannte Herzerkrankung und sowohl mit als auch ohne gleichzeitige Insulinverabreichung berichtet.
Nach der Markteinführung gab es Berichte über ungewöhnlich schnelle Gewichtszunahmen und Gewichtszunahmen, die über die allgemein in klinischen Studien beobachteten hinausgingen. Patienten, bei denen ein solcher Anstieg auftritt, sollten auf Flüssigkeitsansammlung und volumenbezogene Ereignisse wie übermäßige Ödeme und dekompensierte Herzinsuffizienz untersucht werden [siehe KASTENWARNUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Starke CYP2C8-Hemmer
Ein Inhibitor von CYP2C8 (z. B. Gemfibrozil) erhöht signifikant die Exposition (Fläche unter der Serumkonzentrations-Zeit-Kurve oder AUC) und die Halbwertszeit (t½) von Pioglitazon. Daher beträgt die empfohlene Höchstdosis von ACTOS 15 mg täglich, wenn es in Kombination mit Gemfibrozil oder anderen starken CYP2C8-Inhibitoren angewendet wird [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
CYP2C8-Induktoren
Ein Induktor von CYP2C8 (z. B. Rifampin) kann die Exposition (AUC) von Pioglitazon signifikant verringern. Wenn ein Induktor von CYP2C8 während der Behandlung mit ACTOS 30 mg begonnen oder abgesetzt wird, kann daher je nach klinischem Ansprechen eine Änderung der Diabetesbehandlung erforderlich sein, ohne dass die maximal empfohlene Tagesdosis von 45 mg für ACTOS überschritten wird [siehe KLINISCHE PHARMAKOLOGIE ].
Topiramat
Bei gleichzeitiger Gabe von Pioglitazon und Topiramat wurde eine Abnahme der Pioglitazon-Exposition und seiner aktiven Metaboliten festgestellt [siehe KLINISCHE PHARMAKOLOGIE ]. Die klinische Relevanz dieser Abnahme ist nicht bekannt; bei gleichzeitiger Anwendung von ACTOS und Topiramat sind die Patienten jedoch auf eine angemessene glykämische Kontrolle zu überwachen.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Kongestive Herzinsuffizienz
ACTOS 15 mg kann wie andere Thiazolidindione eine dosisabhängige Flüssigkeitsretention verursachen, wenn es allein oder in Kombination mit anderen Antidiabetika angewendet wird, und tritt am häufigsten auf, wenn ACTOS 30 mg in Kombination mit Insulin angewendet wird. Flüssigkeitsretention kann zu kongestiver Herzinsuffizienz führen oder diese verschlimmern. Die Patienten sollten auf Anzeichen und Symptome einer dekompensierten Herzinsuffizienz überwacht werden. Wenn sich eine dekompensierte Herzinsuffizienz entwickelt, sollte diese gemäß den aktuellen Behandlungsstandards behandelt werden, und ein Absetzen oder eine Dosisreduktion von ACTOS muss in Betracht gezogen werden [siehe KASTENWARNUNG , KONTRAINDIKATIONEN , und NEBENWIRKUNGEN ].
Hypoglykämie
Bei Patienten, die ACTOS in Kombination mit Insulin oder anderen Antidiabetika (insbesondere Insulinsekretagoga wie Sulfonylharnstoffe) erhalten, besteht möglicherweise das Risiko einer Hypoglykämie. Eine Reduzierung der Dosis der begleitenden Antidiabetika kann erforderlich sein, um das Risiko einer Hypoglykämie zu verringern [siehe DOSIERUNG UND ANWENDUNG ].
Hepatische Wirkungen
Nach der Markteinführung gab es Berichte über tödliches und nicht tödliches Leberversagen bei Patienten, die ACTOS 15 mg einnahmen, obwohl die Berichte unzureichende Informationen enthalten, um die wahrscheinliche Ursache festzustellen. Bisher gab es in der Datenbank für kontrollierte klinische Studien mit ACTOS 30 mg keine Hinweise auf eine arzneimittelinduzierte Hepatotoxizität [siehe NEBENWIRKUNGEN ].
Patienten mit Typ-2-Diabetes können eine Fettlebererkrankung oder eine Herzerkrankung mit episodischer dekompensierter Herzinsuffizienz haben, die beide Anomalien der Leberwerte verursachen können, und sie können auch andere Formen von Lebererkrankungen haben, von denen viele behandelt oder behandelt werden können. Daher wird empfohlen, vor Beginn der ACTOS-Therapie ein Lebertestpanel (Serum-Alanin-Aminotransferase [ALT], Aspartat-Aminotransferase [AST], alkalische Phosphatase und Gesamtbilirubin) zu erstellen und den Patienten zu beurteilen. Bei Patienten mit anormalen Leberwerten sollte die Behandlung mit ACTOS 15 mg mit Vorsicht begonnen werden.
Führen Sie umgehend Lebertests durch bei Patienten, die Symptome melden, die auf eine Leberschädigung hindeuten können, einschließlich Müdigkeit, Anorexie, Beschwerden im rechten Oberbauch, dunkler Urin oder Gelbsucht. In diesem klinischen Zusammenhang sollte die Behandlung mit ACTOS 15 mg unterbrochen und eine Untersuchung durchgeführt werden, um die wahrscheinliche Ursache festzustellen, wenn beim Patienten abnorme Leberwerte festgestellt werden (ALT größer als das Dreifache der Obergrenze des Referenzbereichs). ACTOS sollte bei diesen Patienten ohne eine andere Erklärung für die Leberwertanomalien nicht wieder aufgenommen werden.
Bei Patienten mit Serum-ALT größer als dem Dreifachen des Referenzbereichs und einem Serum-Gesamtbilirubin größer als dem Zweifachen des Referenzbereichs ohne alternative Ätiologie besteht das Risiko einer schweren arzneimittelinduzierten Leberschädigung und sie sollten nicht wieder mit ACTOS behandelt werden. Bei Patienten mit geringeren Anstiegen von ALT oder Bilirubin im Serum und einer anderen wahrscheinlichen Ursache kann die Behandlung mit ACTOS mit Vorsicht angewendet werden.
Tumore der Harnblase
In der zweijährigen Kanzerogenitätsstudie wurden Tumore in der Harnblase männlicher Ratten beobachtet [vgl Nichtklinische Toxikologie ]. Darüber hinaus wurde während der dreijährigen klinischen PROactive-Studie bei 14 von 2.605 (0,54 %) Patienten, die ACTOS 15 mg randomisiert wurden, und 5 von 2.633 (0,19 %), die Placebo erhielten, Blasenkrebs diagnostiziert. Nach Ausschluss von Patienten, bei denen die Exposition gegenüber dem Studienmedikament zum Zeitpunkt der Diagnose von Blasenkrebs weniger als ein Jahr betrug, gab es 6 (0,23 %) Fälle unter ACTOS 30 mg und zwei (0,08 %) Fälle unter Placebo. Nach Abschluss der Studie wurde eine große Untergruppe von Patienten für bis zu 10 weitere Jahre mit geringer zusätzlicher Exposition gegenüber ACTOS beobachtet. Während der 13 Jahre sowohl der PROactive- als auch der Beobachtungsnachbeobachtung unterschied sich das Auftreten von Blasenkrebs nicht zwischen Patienten, die randomisiert ACTOS 30 mg oder Placebo erhielten (HR = 1,00; [95 %-KI: 0,59–1,72]).
Die Ergebnisse bezüglich des Blasenkrebsrisikos bei Patienten, die ACTOS ausgesetzt waren, variieren je nach Beobachtungsstudie; einige fanden kein erhöhtes Risiko für Blasenkrebs im Zusammenhang mit ACTOS 30 mg, während andere dies taten.
Eine große prospektive 10-Jahres-Kohorten-Beobachtungsstudie, die in den Vereinigten Staaten durchgeführt wurde, ergab keinen statistisch signifikanten Anstieg des Blasenkrebsrisikos bei Diabetikern, die jemals ACTOS ausgesetzt waren, im Vergleich zu Patienten, die nie ACTOS ausgesetzt waren (HR = 1,06 [95 % KI 0,89-1,26 ]).
Eine retrospektive Kohortenstudie, die mit Daten aus dem Vereinigten Königreich durchgeführt wurde, fand einen statistisch signifikanten Zusammenhang zwischen der jemals erfolgten Exposition gegenüber ACTOS und Blasenkrebs (HR: 1,63; [95 %-KI: 1,22–2,19]).
Assoziationen zwischen der kumulativen Dosis oder der kumulativen Dauer der Exposition gegenüber ACTOS 15 mg und Blasenkrebs wurden in einigen Studien, einschließlich der 10-jährigen Beobachtungsstudie in den USA, nicht festgestellt, in anderen jedoch. Inkonsistente Ergebnisse und Einschränkungen, die diesen und anderen Studien innewohnen, schließen schlüssige Interpretationen der Beobachtungsdaten aus.
ACTOS kann mit einem erhöhten Risiko für Harnblasentumoren in Verbindung gebracht werden. Es liegen keine ausreichenden Daten vor, um festzustellen, ob Pioglitazon ein Tumorpromotor für Harnblasentumoren ist.
Folglich sollte ACTOS bei Patienten mit aktivem Blasenkrebs nicht angewendet werden, und bei Patienten mit Blasenkrebs in der Vorgeschichte sollte der Nutzen einer glykämischen Kontrolle gegenüber unbekannten Risiken für ein Wiederauftreten des Krebses mit ACTOS in Betracht gezogen werden.
Ödem
In kontrollierten klinischen Studien wurden Ödeme häufiger bei mit ACTOS 30 mg behandelten Patienten als bei mit Placebo behandelten Patienten berichtet und sind dosisabhängig [siehe NEBENWIRKUNGEN ]. Nach Markteinführung liegen Berichte über neu auftretende oder sich verschlechternde Ödeme vor.
ACTOS 15 mg sollte bei Patienten mit Ödemen mit Vorsicht angewendet werden. Da Thiazolidindione, einschließlich ACTOS, eine Flüssigkeitsretention verursachen können, die eine Herzinsuffizienz verschlimmern oder dazu führen kann, sollte ACTOS 30 mg bei Patienten mit einem Risiko für Herzinsuffizienz mit Vorsicht angewendet werden. Patienten, die mit ACTOS behandelt werden, sollten auf Anzeichen und Symptome einer dekompensierten Herzinsuffizienz überwacht werden [siehe KASTENWARNUNG , Kongestive Herzinsuffizienz und INFORMATIONEN ZUM PATIENTEN ].
Frakturen
In PROactive (der prospektiven klinischen Studie mit Pioglitazon bei makrovaskulären Ereignissen) wurden 5238 Patienten mit Typ-2-Diabetes und makrovaskulärer Erkrankung in der Anamnese randomisiert entweder ACTOS (N=2605), zwangstitriert bis zu 45 mg täglich oder Placebo (N=2633) verabreicht. zusätzlich zum Pflegestandard. Während einer durchschnittlichen Nachbeobachtungszeit von 34,5 Monaten betrug die Inzidenz von Knochenbrüchen bei Frauen 5,1 % (44/870) unter ACTOS 30 mg gegenüber 2,5 % (23/905) unter Placebo. Dieser Unterschied wurde nach dem ersten Behandlungsjahr festgestellt und blieb im Verlauf der Studie bestehen. Die Mehrheit der bei weiblichen Patienten beobachteten Frakturen waren nicht vertebrale Frakturen, einschließlich der unteren Extremität und der distalen oberen Extremität. Bei Männern, die mit ACTOS behandelt wurden (1,7 %), wurde im Vergleich zu Placebo (2,1 %) kein Anstieg der Frakturinzidenz beobachtet. Das Frakturrisiko sollte bei der Behandlung von Patienten, insbesondere weiblichen Patienten, die mit ACTOS behandelt werden, berücksichtigt werden, und es sollte darauf geachtet werden, die Knochengesundheit gemäß den aktuellen Behandlungsstandards zu beurteilen und aufrechtzuerhalten.
Makulaödem
Nach Markteinführung wurde bei Diabetikern, die ACTOS oder ein anderes Thiazolidindion einnahmen, über Makulaödeme berichtet. Einige Patienten zeigten verschwommenes Sehen oder verminderte Sehschärfe, andere wurden jedoch bei routinemäßigen augenärztlichen Untersuchungen diagnostiziert.
Die meisten Patienten hatten zum Zeitpunkt der Diagnose des Makulaödems ein peripheres Ödem. Bei einigen Patienten kam es nach Absetzen des Thiazolidindions zu einer Besserung ihres Makulaödems.
Patienten mit Diabetes sollten regelmäßig Augenuntersuchungen durch einen Augenarzt nach den aktuellen Behandlungsstandards durchführen lassen. Patienten mit Diabetes, die irgendwelche visuellen Symptome melden, sollten unverzüglich an einen Augenarzt überwiesen werden, unabhängig von der zugrunde liegenden Medikation oder anderen körperlichen Befunden des Patienten [siehe NEBENWIRKUNGEN ].
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit ACTOS erbrachten.
Informationen zur Patientenberatung
Siehe FDA-zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Eine zweijährige Karzinogenitätsstudie wurde an männlichen und weiblichen Ratten mit oralen Dosen von bis zu 63 mg/kg (etwa dem 14-Fachen der maximal empfohlenen oralen Dosis von 45 mg beim Menschen, basierend auf mg/m2) durchgeführt. Außer in der Harnblase männlicher Ratten wurden in keinem Organ arzneimittelinduzierte Tumore beobachtet. Gutartige und/oder bösartige Übergangszellneoplasmen wurden bei männlichen Ratten bei 4 mg/kg/Tag und darüber beobachtet (ungefähr gleich der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2). Als Mechanismus für bei männlichen Ratten beobachtete Blasentumoren wurden Harnsteine mit nachfolgender Reizung und Hyperplasie postuliert. Eine zweijährige mechanistische Studie an männlichen Ratten, bei der die Ansäuerung mit der Nahrung zur Reduzierung der Steinbildung eingesetzt wurde, wurde 2009 abgeschlossen. Die Ansäuerung mit der Nahrung nahm ab, beseitigte jedoch nicht die hyperplastischen Veränderungen in der Blase. Das Vorhandensein von Steinen verschlimmerte die hyperplastische Reaktion auf Pioglitazon, wurde jedoch nicht als Hauptursache der hyperplastischen Veränderungen angesehen.
Die Relevanz der Blasenbefunde bei der männlichen Ratte für den Menschen kann nicht ausgeschlossen werden.
Eine zweijährige Karzinogenitätsstudie wurde auch an männlichen und weiblichen Mäusen mit oralen Dosen von bis zu 100 mg/kg/Tag (etwa dem 11-Fachen der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2) durchgeführt. In keinem Organ wurden arzneimittelinduzierte Tumore beobachtet.
Pioglitazonhydrochlorid war in einer Reihe von genetischen Toxikologiestudien nicht mutagen, einschließlich des Ames-Bakterientests, eines Säugerzell-Vorwärts-Genmutationstests (CHO/HPRT und AS52/XPRT), eines zytogenetischen In-vitro-Tests unter Verwendung von CHL-Zellen, eines außerplanmäßigen DNA-Synthesetests und ein in vivo-Mikronukleus-Assay.
Bei männlichen und weiblichen Ratten wurden bei oralen Dosen von bis zu 40 mg/kg Pioglitazonhydrochlorid täglich vor und während der Paarung und Trächtigkeit (etwa das Neunfache der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2) keine nachteiligen Auswirkungen auf die Fertilität beobachtet.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Begrenzte Daten mit ACTOS bei schwangeren Frauen reichen nicht aus, um ein arzneimittelbedingtes Risiko für schwere Geburtsfehler oder Fehlgeburten zu bestimmen. Mit einem schlecht eingestellten Schwangerschaftsdiabetes sind Risiken für Mutter und Fötus verbunden [siehe Klinische Überlegungen ].
In Reproduktionsstudien an Tieren wurden keine nachteiligen Auswirkungen auf die Entwicklung beobachtet, wenn Pioglitazon trächtigen Ratten und Kaninchen während der Organogenese bei Expositionen bis zum 5- bzw. 35-Fachen der klinischen Dosis von 45 mg, bezogen auf die Körperoberfläche, verabreicht wurde [siehe Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler liegt bei Frauen mit Prägestationsdiabetes mit einem HbA1c >7 bei 6–10 % und bei Frauen mit einem HbA1c >10 bei bis zu 20–25 %. Das geschätzte Hintergrundrisiko einer Fehlgeburt für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes maternales und/oder embryo/fetales Risiko
Ein schlecht eingestellter Schwangerschaftsdiabetes erhöht das mütterliche Risiko für diabetische Ketoazidose, Präeklampsie, spontane Fehlgeburten, Frühgeburten, Totgeburten und Geburtskomplikationen. Schlecht kontrollierter Diabetes erhöht das fötale Risiko für schwere Geburtsfehler, Totgeburten und Makrosomie-bedingte Morbidität.
Daten
Tierdaten
Pioglitazon, das trächtigen Ratten während der Organogenese verabreicht wurde, verursachte in einer Dosis von 20 mg/kg (~5-fache der klinischen Dosis von 45 mg) keine nachteiligen Auswirkungen auf die Entwicklung, verzögerte jedoch die Geburt und verringerte die embryofetale Lebensfähigkeit bei 40 und 80 mg/kg oder ≥ Das 9-fache der klinischen Dosis von 45 mg, bezogen auf die Körperoberfläche. Bei trächtigen Kaninchen, denen Pioglitazon während der Organogenese verabreicht wurde, wurden bei 80 mg/kg (~35-fache der klinischen Dosis von 45 mg) keine nachteiligen Auswirkungen auf die Entwicklung beobachtet, aber bei 160 mg/kg oder dem ~69-fachen der klinischen Dosis von 45 mg verringerte sich die embryofetale Lebensfähigkeit Dosis, nach Körperoberfläche. Wenn trächtige Ratten während der späten Trächtigkeit und Laktation Pioglitazon erhielten, trat bei den Nachkommen bei maternalen Dosen von 10 mg/kg und mehr oder ≥ dem 2-fachen der klinischen Dosis von 45 mg, bezogen auf die Körperoberfläche, eine verzögerte postnatale Entwicklung auf, die auf ein verringertes Körpergewicht zurückzuführen war.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von Pioglitazon in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Pioglitazon ist in Rattenmilch vorhanden; Aufgrund artspezifischer Unterschiede in der Laktationsphysiologie kann es jedoch vorkommen, dass Tierdaten Arzneimittelspiegel in der Muttermilch nicht zuverlässig vorhersagen. Die Entwicklungs- und Gesundheitsvorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an ACTOS 15 mg und möglichen Nebenwirkungen von ACTOS 30 mg auf den gestillten Säugling oder aufgrund des zugrunde liegenden Zustands der Mutter berücksichtigt werden.
Weibchen und Männchen mit reproduktivem Potenzial
Besprechen Sie die Möglichkeit einer ungewollten Schwangerschaft mit prämenopausalen Frauen, da die Therapie mit ACTOS, wie auch mit anderen Thiazolidindione, bei einigen anovulatorischen Frauen zu einem Eisprung führen kann.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von ACTOS bei pädiatrischen Patienten wurde nicht nachgewiesen.
ACTOS 15 mg wird nicht für die Anwendung bei pädiatrischen Patienten empfohlen, basierend auf Nebenwirkungen, die bei Erwachsenen beobachtet wurden, einschließlich Flüssigkeitsretention und dekompensierter Herzinsuffizienz, Frakturen und Harnblasentumoren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Geriatrische Verwendung
Insgesamt 92 Patienten (15,2 %), die in den drei gepoolten 16- bis 26-wöchigen doppelblinden, placebokontrollierten Monotherapie-Studien mit ACTOS behandelt wurden, waren ≥ 65 Jahre alt und zwei Patienten (0,3 %) waren ≥ 75 Jahre alt. In den beiden gepoolten 16- bis 24-wöchigen Add-on-Studien zu Sulfonylharnstoffen waren 201 Patienten (18,7 %), die mit ACTOS 30 mg behandelt wurden, ≥ 65 Jahre alt und 19 (1,8 %) waren ≥ 75 Jahre alt. In den beiden gepoolten 16- bis 24-wöchigen Add-on-Studien zu Metformin waren 155 Patienten (15,5 %), die mit ACTOS behandelt wurden, ≥ 65 Jahre alt und 19 (1,9 %) waren ≥ 75 Jahre alt. In den beiden gepoolten 16- bis 24-wöchigen Add-on-Insulin-Studien waren 272 Patienten (25,4 %), die mit ACTOS behandelt wurden, ≥ 65 Jahre alt und 22 (2,1 %) waren ≥ 75 Jahre alt.
In PROactive waren 1068 Patienten (41,0 %), die mit ACTOS behandelt wurden, ≥ 65 Jahre alt und 42 (1,6 %) waren ≥ 75 Jahre alt.
In pharmakokinetischen Studien mit Pioglitazon wurden keine signifikanten Unterschiede in den pharmakokinetischen Parametern zwischen älteren und jüngeren Patienten beobachtet [vgl KLINISCHE PHARMAKOLOGIE ].
Obwohl klinische Erfahrungen keine Unterschiede in der Wirksamkeit und Sicherheit zwischen älteren (≥65 Jahre) und jüngeren Patienten festgestellt haben, sind diese Schlussfolgerungen durch kleine Stichprobenumfänge für Patienten ≥75 Jahre eingeschränkt.
ÜBERDOSIS
Während kontrollierter klinischer Studien wurde ein Fall einer Überdosierung mit ACTOS 30 mg berichtet. Ein männlicher Patient nahm vier Tage lang 120 mg pro Tag ein, dann sieben Tage lang 180 mg pro Tag. Der Patient verneinte während dieser Zeit irgendwelche klinischen Symptome.
Im Falle einer Überdosierung sollte entsprechend den klinischen Anzeichen und Symptomen des Patienten eine geeignete unterstützende Behandlung eingeleitet werden.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
ACTOS 15 mg ist ein Thiazolidindion, dessen Wirkungsmechanismus auf das Vorhandensein von Insulin angewiesen ist. ACTOS verringert die Insulinresistenz in der Peripherie und in der Leber, was zu einer erhöhten insulinabhängigen Glukoseabgabe und einer verringerten hepatischen Glukoseabgabe führt. Pioglitazon ist kein Insulinsekretagogum. Pioglitazon ist ein Agonist für den Peroxisom-Proliferator-aktivierten Rezeptor-Gamma (PPAR?). PPAR-Rezeptoren finden sich in Geweben, die für die Insulinwirkung wichtig sind, wie Fettgewebe, Skelettmuskel und Leber. Aktivierung von PPAR? Kernrezeptoren modulieren die Transkription einer Reihe von auf Insulin ansprechenden Genen, die an der Kontrolle des Glukose- und Lipidstoffwechsels beteiligt sind.
In Tiermodellen für Diabetes reduziert Pioglitazon die Hyperglykämie, Hyperinsulinämie und Hypertriglyzeridämie, die für insulinresistente Zustände wie Typ-2-Diabetes charakteristisch sind. Die durch Pioglitazon hervorgerufenen metabolischen Veränderungen führen zu einer erhöhten Ansprechbarkeit insulinabhängiger Gewebe und werden in zahlreichen Tiermodellen zur Insulinresistenz beobachtet.
Da Pioglitazon die Wirkung des zirkulierenden Insulins verstärkt (durch Verringerung der Insulinresistenz), senkt es den Blutzucker in Tiermodellen, denen endogenes Insulin fehlt, nicht.
Pharmakodynamik
Klinische Studien zeigen, dass ACTOS 15 mg die Insulinsensitivität bei insulinresistenten Patienten verbessert. ACTOS verbessert die zelluläre Reaktionsfähigkeit auf Insulin, erhöht die insulinabhängige Glukoseverwertung und verbessert die Empfindlichkeit der Leber gegenüber Insulin. Bei Patienten mit Typ-2-Diabetes führt die durch ACTOS hervorgerufene verringerte Insulinresistenz zu niedrigeren Plasmaglukosekonzentrationen, niedrigeren Plasmainsulinkonzentrationen und niedrigeren HbA1c-Werten. In kontrollierten klinischen Studien hatte ACTOS eine additive Wirkung auf die glykämische Kontrolle, wenn es in Kombination mit einem Sulfonylharnstoff, Metformin oder Insulin angewendet wurde [siehe Klinische Studien ].
Patienten mit Lipidanomalien wurden in klinische Studien mit ACTOS eingeschlossen. Insgesamt zeigten die mit ACTOS 15 mg behandelten Patienten mittlere Senkungen der Serumtriglyceride, mittlere Erhöhungen des HDL-Cholesterins und keine konsistenten mittleren Veränderungen des LDL- und Gesamtcholesterins. Es gibt keine schlüssigen Beweise für einen makrovaskulären Nutzen von ACTOS [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
In einer 26-wöchigen placebokontrollierten Dosisfindungs-Monotherapiestudie sanken die mittleren Serumtriglyzeride in den 15-mg-, 30-mg- und 45-mg-Actos-15-mg-Dosisgruppen im Vergleich zu einem mittleren Anstieg in der Placebogruppe. Das mittlere HDL-Cholesterin stieg bei den mit ACTOS 30 mg behandelten Patienten stärker an als bei den mit Placebo behandelten Patienten. Es gab keine konsistenten Unterschiede für LDL und Gesamtcholesterin bei mit ACTOS behandelten Patienten im Vergleich zu Placebo (siehe Tabelle 14).
In den beiden anderen Monotherapie-Studien (16 Wochen und 24 Wochen) und in Kombinationstherapie-Studien mit Sulfonylharnstoff (16 Wochen und 24 Wochen), Metformin (16 Wochen und 24 Wochen) oder Insulin (16 Wochen und 24 Wochen) waren die Ergebnisse allgemein stimmt mit den Daten oben überein.
Pharmakokinetik
Nach einmal täglicher Verabreichung von ACTOS 15 mg werden Steady-State-Serumkonzentrationen sowohl von Pioglitazon als auch von seinen wichtigsten aktiven Metaboliten, M-III (Keto-Derivat von Pioglitazon) und M-IV (Hydroxyl-Derivat von Pioglitazon), innerhalb von sieben Tagen erreicht. Im Steady State erreichen M-III und M-IV Serumkonzentrationen, die gleich oder höher sind als die von Pioglitazon. Im Steady-State macht Pioglitazon sowohl bei gesunden Probanden als auch bei Patienten mit Typ-2-Diabetes etwa 30 % bis 50 % der maximalen Pioglitazon-Gesamtserumkonzentrationen (Pioglitazon plus aktive Metaboliten) und 20 % bis 25 % der gesamten AUC aus.
Cmax, AUC und Serum-Talspiegel (Cmin) für Pioglitazon und M-III und M-IV stiegen proportional mit verabreichten Dosen von 15 mg und 30 mg pro Tag.
Absorption
Nach oraler Verabreichung von Pioglitazon lag Tmax von Pioglitazon innerhalb von zwei Stunden. Nahrung verzögert die Tmax um drei bis vier Stunden, verändert aber nicht das Ausmaß der Resorption (AUC).
Verteilung
Das mittlere scheinbare Verteilungsvolumen (Vd/F) von Pioglitazon nach Gabe einer Einzeldosis beträgt 0,63 ± 0,41 (Mittelwert ± Standardabweichung) l/kg Körpergewicht. Pioglitazon wird in Humanserum weitgehend an Proteine gebunden (>99 %), hauptsächlich an Serumalbumin. Pioglitazon bindet auch an andere Serumproteine, jedoch mit geringerer Affinität. M-III und M-IV werden auch weitgehend (> 98 %) an Serumalbumin gebunden.
Stoffwechsel
Pioglitazon wird weitgehend durch Hydroxylierung und Oxidation metabolisiert; die Metaboliten wandeln sich auch teilweise in Glucuronid- oder Sulfat-Konjugate um. Die Metaboliten M-III und M-IV sind die wichtigsten zirkulierenden aktiven Metaboliten beim Menschen.
In-vitro-Daten zeigen, dass mehrere CYP-Isoformen am Metabolismus von Pioglitazon beteiligt sind, darunter CYP2C8 und in geringerem Maße CYP3A4 mit zusätzlichen Beiträgen von einer Vielzahl anderer Isoformen, einschließlich des hauptsächlich extrahepatischen CYP1A1. In-vivo-Studien mit Pioglitazon in Kombination mit Gemfibrozil, einem starken CYP2C8-Inhibitor, zeigten, dass Pioglitazon ein CYP2C8-Substrat ist [siehe DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Die bei mit ACTOS 30 mg behandelten Patienten gemessenen 6β-Hydroxycortisol/Cortisol-Quotienten im Urin zeigten, dass Pioglitazon kein starker Induktor des CYP3A4-Enzyms ist.
Ausscheidung und Ausscheidung
Nach oraler Gabe werden etwa 15 % bis 30 % der Pioglitazon-Dosis im Urin wiedergefunden. Die renale Elimination von Pioglitazon ist vernachlässigbar und das Arzneimittel wird hauptsächlich als Metaboliten und deren Konjugate ausgeschieden. Es wird angenommen, dass der größte Teil der oralen Dosis entweder unverändert oder als Metaboliten in die Galle ausgeschieden und mit den Fäzes ausgeschieden wird.
Die mittlere Serumhalbwertszeit (t1/2) von Pioglitazon und seinen Metaboliten (M-III und M-IV) liegt im Bereich von drei bis sieben Stunden bzw. 16 bis 24 Stunden. Pioglitazon hat eine scheinbare Clearance, CL/F, die auf fünf bis sieben l/h berechnet wird.
Nierenfunktionsstörung
Die Eliminationshalbwertszeit aus dem Serum von Pioglitazon, M-III und M-IV bleibt bei Patienten mit mäßiger (Kreatinin-Clearance [CLcr] 30 bis 50 ml/min) und schwerer (CLcr
Leberfunktionsstörung
Im Vergleich zu gesunden Kontrollpersonen weisen Probanden mit eingeschränkter Leberfunktion (Child-Turcotte-Pugh-Grad B/C) eine etwa 45 %ige Verringerung der mittleren Cmax von Pioglitazon und Gesamt-Pioglitazon (Pioglitazon, M-III und M-IV) auf, aber keine Veränderung der Cmax die mittleren AUC-Werte. Daher ist bei Patienten mit eingeschränkter Leberfunktion keine Dosisanpassung erforderlich.
Es gibt Postmarketing-Berichte über Leberversagen mit ACTOS und klinische Studien haben im Allgemeinen Patienten mit Serum-ALT > 2,5-fach der Obergrenze des Referenzbereichs ausgeschlossen. Seien Sie bei Patienten mit Lebererkrankungen vorsichtig [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Geriatrische Patienten
Bei gesunden älteren Probanden war die Cmax von Pioglitazon nicht signifikant unterschiedlich, aber die AUC-Werte waren etwa 21 % höher als die bei jüngeren Probanden erreichten. Die mittlere t1/2 von Pioglitazon war bei älteren Probanden (etwa zehn Stunden) im Vergleich zu jüngeren Probanden (etwa sieben Stunden) ebenfalls verlängert. Diese Veränderungen waren nicht in einem Ausmaß, das als klinisch relevant angesehen werden würde.
Pädiatrische Patienten
Sicherheit und Wirksamkeit von Pioglitazon bei pädiatrischen Patienten wurden nicht nachgewiesen. ACTOS 15 mg wird für die Anwendung bei pädiatrischen Patienten nicht empfohlen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
Die mittleren Cmax- und AUC-Werte von Pioglitazon waren bei Frauen im Vergleich zu Männern um 20 % bis 60 % erhöht. In kontrollierten klinischen Studien war die HbA1c-Senkung gegenüber dem Ausgangswert bei Frauen im Allgemeinen größer als bei Männern (durchschnittliche mittlere HbA1c-Differenz 0,5 %). Da die Therapie für jeden Patienten individuell angepasst werden sollte, um eine glykämische Kontrolle zu erreichen, wird keine Dosisanpassung allein aufgrund des Geschlechts empfohlen.
Ethnizität
Pharmakokinetische Daten für verschiedene ethnische Gruppen sind nicht verfügbar.
Arzneimittelwechselwirkungen
Tiertoxikologie und/oder Pharmakologie
Herzvergrößerung wurde bei Mäusen (100 mg/kg), Ratten (4 mg/kg und mehr) und Hunden (3 mg/kg) beobachtet, die oral mit Pioglitazonhydrochlorid behandelt wurden (ungefähr das 11-, 1- und 2-fache der maximal empfohlenen oralen Dosis beim Menschen). Dosis für Mäuse, Ratten bzw. Hunde, basierend auf mg/m2). In einer einjährigen Studie an Ratten trat bei einer oralen Dosis von 160 mg/kg/Tag (etwa dem 35-Fachen der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2) ein arzneimittelbedingter früher Tod aufgrund einer offensichtlichen Herzfunktionsstörung auf. Eine Herzvergrößerung wurde in einer 13-wöchigen Studie an Affen bei oralen Dosen von 8,9 mg/kg und mehr (etwa das Vierfache der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2) beobachtet, jedoch nicht in einer 52-wöchigen Studie bei oralen Dosen bis zu 32 mg/kg (etwa das 13-fache der maximal empfohlenen oralen Dosis beim Menschen, basierend auf mg/m2).
Klinische Studien
Monotherapie
Drei randomisierte, doppelblinde, placebokontrollierte Studien mit einer Dauer von 16 bis 26 Wochen wurden durchgeführt, um die Anwendung von ACTOS als Monotherapie bei Patienten mit Typ-2-Diabetes zu bewerten. Diese Studien untersuchten ACTOS 15 mg in Dosen von bis zu 45 mg oder Placebo einmal täglich bei insgesamt 865 Patienten.
In einer 26-wöchigen Dosisfindungs-Monotherapiestudie wurden 408 Patienten mit Typ-2-Diabetes randomisiert und erhielten einmal täglich 7,5 mg, 15 mg, 30 mg oder 45 mg ACTOS oder Placebo. Die Therapie mit einem früheren Antidiabetikum wurde acht Wochen vor der Doppelblindperiode abgebrochen. Die Behandlung mit 15 mg, 30 mg und 45 mg ACTOS 30 mg führte am Endpunkt im Vergleich zu Placebo zu statistisch signifikanten Verbesserungen des HbA1c und der Nüchtern-Plasmaglukose (FPG) (siehe Abbildung 1, Tabelle 17).
Abbildung 1 zeigt den zeitlichen Verlauf der HbA1c-Veränderungen in dieser 26-wöchigen Studie.
Abbildung 1. Mittlere Veränderung gegenüber dem Ausgangswert für HbA1c in einer 26-wöchigen Placebo-kontrollierten Dosisfindungsstudie (beobachtete Werte)
In einer 24-wöchigen placebokontrollierten Monotherapiestudie wurden 260 Patienten mit Typ-2-Diabetes randomisiert einer von zwei ACTOS-Behandlungsgruppen mit erzwungener Titration oder einer Placebogruppe mit Scheintitration zugeteilt. Die Therapie mit einem früheren Antidiabetikum wurde sechs Wochen vor der Doppelblindperiode abgebrochen. In einer Behandlungsgruppe mit ACTOS 15 mg erhielten die Patienten eine Anfangsdosis von 7,5 mg einmal täglich. Nach vier Wochen wurde die Dosis auf 15 mg einmal täglich erhöht und nach weiteren vier Wochen wurde die Dosis für den Rest der Studie (16 Wochen) auf 30 mg einmal täglich erhöht. In der zweiten ACTOS-Behandlungsgruppe erhielten die Patienten eine Anfangsdosis von 15 mg einmal täglich und wurden auf ähnliche Weise auf 30 mg einmal täglich und 45 mg einmal täglich titriert. Die Behandlung mit ACTOS 15 mg, wie beschrieben, führte zu statistisch signifikanten Verbesserungen von HbA1c und FPG am Endpunkt im Vergleich zu Placebo (siehe Tabelle 18).
In einer 16-wöchigen Monotherapiestudie wurden 197 Patienten mit Typ-2-Diabetes randomisiert einer Behandlung mit 30 mg ACTOS oder Placebo einmal täglich zugeteilt. Die Therapie mit einem früheren Antidiabetikum wurde sechs Wochen vor der Doppelblindperiode abgebrochen. Die Behandlung mit 30 mg ACTOS führte zu statistisch signifikanten Verbesserungen von HbA1c und FPG am Endpunkt im Vergleich zu Placebo (siehe Tabelle 19).
Kombinationstherapie
Drei 16-wöchige, randomisierte, doppelblinde, placebokontrollierte klinische Studien wurden durchgeführt, um die Wirkungen von ACTOS (15 mg und/oder 30 mg) auf die glykämische Kontrolle bei Patienten mit Typ-2-Diabetes, die unzureichend eingestellt waren (HbA1c ≥8 %) trotz aktueller Therapie mit einem Sulfonylharnstoff, Metformin oder Insulin. Darüber hinaus wurden drei 24-wöchige randomisierte, doppelblinde klinische Studien durchgeführt, um die Wirkungen von ACTOS 30 mg vs. ACTOS 45 mg auf die glykämische Kontrolle bei Patienten mit Typ-2-Diabetes zu bewerten, die trotz Strom unzureichend eingestellt waren (HbA1c ≥ 8 %). Therapie mit einem Sulfonylharnstoff, Metformin oder Insulin. Eine frühere Diabetesbehandlung kann eine Monotherapie oder eine Kombinationstherapie gewesen sein.
Ergänzung zu Sulfonylharnstoff-Studien
Es wurden zwei klinische Studien mit ACTOS in Kombination mit einem Sulfonylharnstoff durchgeführt. Beide Studien schlossen Patienten mit Typ-2-Diabetes ein, die eine beliebige Dosis eines Sulfonylharnstoffs erhielten, entweder allein oder in Kombination mit einem anderen Antidiabetikum. Alle anderen Antidiabetika wurden mindestens drei Wochen vor Beginn der Studienbehandlung abgesetzt.
In der ersten Studie wurden 560 Patienten randomisiert und erhielten 16 Wochen lang einmal täglich 15 mg oder 30 mg ACTOS 30 mg oder Placebo zusätzlich zu ihrer aktuellen Sulfonylharnstoff-Therapie. Die Behandlung mit ACTOS als Add-on zu Sulfonylharnstoff führte zu statistisch signifikanten Verbesserungen von HbA1c und NPG am Endpunkt im Vergleich zu Placebo als Add-on zu Sulfonylharnstoff (siehe Tabelle 20).
In der zweiten Studie erhielten 702 Patienten randomisiert 30 mg oder 45 mg ACTOS einmal täglich über 24 Wochen zusätzlich zu ihrer aktuellen Sulfonylharnstoff-Therapie. Die mittlere Reduktion des HbA1c gegenüber dem Ausgangswert in Woche 24 betrug 1,6 % für die 30-mg-Dosis und 1,7 % für die 45-mg-Dosis (siehe Tabelle 21). Die mittlere Reduktion des FPG gegenüber dem Ausgangswert in Woche 24 betrug 52 mg/dl für die 30-mg-Dosis und 56 mg/dl für die 45-mg-Dosis.
Die therapeutische Wirkung von ACTOS in Kombination mit Sulfonylharnstoff wurde bei Patienten unabhängig von der Sulfonylharnstoffdosis beobachtet.
Ergänzung zu Metformin-Studien
Es wurden zwei klinische Studien mit ACTOS 30 mg in Kombination mit Metformin durchgeführt. Beide Studien schlossen Patienten mit Typ-2-Diabetes ein, die eine beliebige Metformin-Dosis erhielten, entweder allein oder in Kombination mit einem anderen Antidiabetikum. Alle anderen Antidiabetika wurden mindestens drei Wochen vor Beginn der Studienbehandlung abgesetzt.
In der ersten Studie erhielten 328 Patienten randomisiert entweder 30 mg ACTOS oder Placebo einmal täglich für 16 Wochen zusätzlich zu ihrer aktuellen Metformin-Therapie. Die Behandlung mit ACTOS 30 mg als Add-on zu Metformin führte zu statistisch signifikanten Verbesserungen von HbA1c und NPG am Endpunkt im Vergleich zu Placebo als Add-on zu Metformin (siehe Tabelle 22).
In der zweiten Studie erhielten 827 Patienten randomisiert entweder 30 mg oder 45 mg ACTOS 30 mg einmal täglich über 24 Wochen zusätzlich zu ihrer aktuellen Metformin-Therapie. Die mittlere Reduktion des HbA1c gegenüber dem Ausgangswert in Woche 24 betrug 0,8 % für die 30-mg-Dosis und 1,0 % für die 45-mg-Dosis (siehe Tabelle 23). Die mittlere Reduktion des FPG gegenüber dem Ausgangswert in Woche 24 betrug 38 mg/dl für die 30-mg-Dosis und 51 mg/dl für die 45-mg-Dosis.
Die therapeutische Wirkung von ACTOS in Kombination mit Metformin wurde bei Patienten unabhängig von der Metformin-Dosis beobachtet.
Zusatz zu Insulin-Studien
Es wurden zwei klinische Studien mit ACTOS 15 mg in Kombination mit Insulin durchgeführt. Beide Studien schlossen Patienten mit Typ-2-Diabetes unter Insulin ein, entweder allein oder in Kombination mit einem anderen Antidiabetikum. Alle anderen Antidiabetika wurden vor Beginn der Studienbehandlung abgesetzt. In der ersten Studie erhielten 566 Patienten randomisiert entweder 15 mg oder 30 mg ACTOS 15 mg oder Placebo einmal täglich für 16 Wochen zusätzlich zu ihrer Insulinbehandlung. Die Behandlung mit ACTOS 30 mg als Add-on zu Insulin führte zu statistisch signifikanten Verbesserungen von HbA1c und FPG am Endpunkt im Vergleich zu Placebo als Add-on zu Insulin (siehe Tabelle 24). Die mittlere tägliche Insulindosis zu Studienbeginn betrug in jeder Behandlungsgruppe etwa 70 Einheiten. Bei der Mehrheit der Patienten (75 % insgesamt, 86 % mit Placebo behandelt, 77 % mit ACTOS 15 mg behandelt und 61 % mit ACTOS 30 mg behandelt) änderte sich ihre tägliche Insulindosis vom Ausgangswert bis zum letzten Studienbesuch nicht. Die mittlere Änderung der täglichen Insulindosis gegenüber dem Ausgangswert (einschließlich Patienten ohne Insulindosisanpassungen) betrug -3 Einheiten bei den mit ACTOS 15 mg behandelten Patienten, -8 Einheiten bei den mit ACTOS 30 mg behandelten Patienten und -1 Einheit bei den Patienten mit Placebo behandelt.
In der zweiten Studie wurden 690 Patienten, die im Mittel 60 Einheiten Insulin pro Tag erhielten, randomisiert und erhielten 24 Wochen lang entweder 30 mg oder 45 mg ACTOS einmal täglich zusätzlich zu ihrer derzeitigen Insulinbehandlung. Die mittlere Reduktion des HbA1c gegenüber dem Ausgangswert in Woche 24 betrug 1,2 % für die 30-mg-Dosis und 1,5 % für die 45-mg-Dosis. Die mittlere Reduktion des FPG gegenüber dem Ausgangswert in Woche 24 betrug 32 mg/dl für die 30-mg-Dosis und 46 mg/dl für die 45-mg-Dosis (siehe Tabelle 25). Die mittlere tägliche Insulindosis zu Studienbeginn betrug in beiden Behandlungsgruppen etwa 70 Einheiten. Bei der Mehrheit der Patienten (55 % insgesamt, 58 % mit ACTOS 30 mg behandelt und 52 % mit ACTOS 45 mg behandelt) änderte sich ihre tägliche Insulindosis vom Ausgangswert bis zum letzten Studienbesuch nicht. Die mittlere Änderung der täglichen Insulindosis gegenüber dem Ausgangswert (einschließlich Patienten ohne Insulindosisanpassungen) betrug -5 Einheiten bei den mit ACTOS 30 mg behandelten Patienten und -8 Einheiten bei den mit ACTOS 45 mg behandelten Patienten.
Die therapeutische Wirkung von ACTOS in Kombination mit Insulin wurde bei Patienten unabhängig von der Insulindosis beobachtet.
INFORMATIONEN ZUM PATIENTEN
ACTOS (ak-TOS) (Pioglitazon) Tabletten
Lesen Sie diesen Arzneimittelleitfaden sorgfältig durch, bevor Sie mit der Einnahme von ACTOS 15 mg beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung. Wenn Sie Fragen zu ACTOS haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Was sind die wichtigsten Informationen, die ich über ACTOS wissen sollte?
ACTOS kann schwerwiegende Nebenwirkungen verursachen, einschließlich neuer oder schlimmerer Herzinsuffizienz.
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Probleme haben:
ACTOS kann andere schwerwiegende Nebenwirkungen haben. Siehe „Welche Nebenwirkungen kann ACTOS haben?“
Was ist ACTOS?
ACTOS 15 mg ist ein verschreibungspflichtiges Arzneimittel, das zusammen mit Diät und Bewegung angewendet wird, um die Kontrolle des Blutzuckers (Glukose) bei Erwachsenen mit Typ-2-Diabetes zu verbessern. ACTOS ist ein Diabetes-Arzneimittel namens Pioglitazon, das allein oder zusammen mit anderen Diabetes-Arzneimitteln eingenommen werden kann.
Es ist nicht bekannt, ob ACTOS bei Kindern unter 18 Jahren sicher und wirksam ist. ACTOS wird für die Anwendung bei Kindern nicht empfohlen.
ACTOS ist nicht für Menschen mit Typ-1-Diabetes geeignet.
ACTOS 30 mg ist nicht für Menschen mit diabetischer Ketoazidose (erhöhte Ketone in Ihrem Blut oder Urin) geeignet.
Wer sollte ACTOS nicht einnehmen?
Siehe „Was sind die wichtigsten Informationen, die ich über ACTOS 15 mg wissen sollte?“
Nehmen Sie ACTOS 15 mg nicht ein, wenn Sie:
Sprechen Sie mit Ihrem Arzt, bevor Sie ACTOS einnehmen, wenn Sie an einer dieser Erkrankungen leiden.
Was sollte ich meinem Arzt vor der Einnahme von ACTOS 30 mg mitteilen?
Informieren Sie vor der Einnahme von ACTOS Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen.
ACTOS 30 mg und einige Ihrer anderen Arzneimittel können sich gegenseitig beeinflussen. Möglicherweise müssen Sie Ihre Dosis von ACTOS 15 mg oder bestimmten anderen Arzneimitteln ändern.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel und zeigen Sie diese Ihrem Arzt und Apotheker, bevor Sie mit einem neuen Arzneimittel beginnen. Sie werden Ihnen sagen, ob es in Ordnung ist, ACTOS 15 mg zusammen mit anderen Arzneimitteln einzunehmen.
Wie sollte ich ACTOS 15 mg einnehmen?
Welche Nebenwirkungen kann ACTOS haben?
ACTOS kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von ACTOS gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle Nebenwirkungen von ACTOS. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist ACTOS 15 mg aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von ACTOS
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie ACTOS nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie ACTOS nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Dieser Arzneimittelleitfaden fasst die wichtigsten Informationen zu ACTOS zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Arzt oder Apotheker um Informationen über ACTOS bitten, die für medizinisches Fachpersonal bestimmt sind. Weitere Informationen erhalten Sie unter www.actos.com oder telefonisch unter 1-877-825-3327.
Welche Inhaltsstoffe enthält ACTOS 15 mg?
Wirkstoff: Pioglitazon Inaktive Inhaltsstoffe: Lactos 15 mg Monohydrat, Hydroxypropylcellulose, Carboxymethylcellulose-Calcium und Magnesiumstearat
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.