Prandin 0.5mg, 1mg, 2mg Repaglinide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Prandin 2 mg und wie wird es angewendet?
Prandin 1 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Diabetes mellitus Typ 2. Prandin kann allein oder mit anderen Medikamenten verwendet werden.
Prandin gehört zu einer Klasse von Arzneimitteln, die als Antidiabetika, Maglitinide-Derivate bezeichnet werden.
Es ist nicht bekannt, ob Prandin 1 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Prandin haben?
Prandin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Prandin gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Prandin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
PRANDIN (Repaglinid) ist ein orales blutzuckersenkendes Medikament aus der Klasse der Glinide. Repaglinid, S(+)2-Ethoxy-4(2((3-methyl-1-(2-(1piperidinyl)phenyl)-butyl)amino)-2-oxoethyl)benzoesäure, ist chemisch nicht mit dem oralen Sulfonylharnstoff-Insulin verwandt Sekretagogen.
Strukturformel von Repaglinid
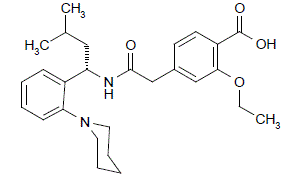
Repaglinid ist ein weißes bis cremefarbenes Pulver mit der Summenformel C27H36N2O4 und einem Molekulargewicht von 452,6. PRANDIN-Tabletten enthalten 0,5 mg, 1 mg oder 2 mg Repaglinid. Zusätzlich enthält jede Tablette die folgenden Hilfsstoffe: Calciumhydrogenphosphat (wasserfrei), mikrokristalline Cellulose, Maisstärke, Polacrilin-Kalium, Povidon, Glycerol (85 %), Magnesiumstearat, Meglumin und Poloxamer. Die 1-mg- und 2-mg-Tabletten enthalten Eisenoxide (gelb bzw. rot) als Farbstoffe.
INDIKATIONEN
PRANDIN ist indiziert als Ergänzung zu Diät und Bewegung zur Verbesserung der glykämischen Kontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus.
Nutzungsbeschränkung
PRANDIN sollte nicht bei Patienten mit Diabetes mellitus Typ 1 oder zur Behandlung einer diabetischen Ketoazidose angewendet werden.
DOSIERUNG UND ANWENDUNG
Empfohlene Dosierung und Verabreichung
Die empfohlene Anfangsdosis für Patienten mit einem HbA1c-Wert von weniger als 8 % beträgt 0,5 mg oral vor jeder Mahlzeit. Bei Patienten mit einem HbA1c-Wert von 8 % oder mehr beträgt die Anfangsdosis 1 oder 2 mg oral vor jeder Mahlzeit.
Der empfohlene Dosisbereich beträgt 0,5 mg bis 4 mg vor den Mahlzeiten mit einer maximalen Tagesdosis von 16 mg. Die Dosis des Patienten sollte mit jeder Mahlzeit auf bis zu 4 mg verdoppelt werden, bis eine zufriedenstellende glykämische Kontrolle erreicht ist. Nach jeder Dosisanpassung sollte mindestens eine Woche vergehen, um das Ansprechen zu beurteilen.
Weisen Sie die Patienten an, PRANDIN innerhalb von 30 Minuten vor den Mahlzeiten einzunehmen. PRANDIN 2 mg kann 2-, 3- oder 4-mal täglich als Reaktion auf Veränderungen im Essverhalten des Patienten verabreicht werden.
Weisen Sie Patienten, die Mahlzeiten auslassen, an, die geplante Dosis von PRANDIN 1 mg auszulassen, um das Risiko einer Hypoglykämie zu verringern. Bei Patienten mit Hypoglykämie sollte die Dosis von PRANDIN 1 mg reduziert werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Patienten mit schwerer Nierenfunktionsstörung
Bei Patienten mit schwerer Nierenfunktionsstörung (CrCl = 20 bis 40 ml/min) ist die Behandlung mit PRANDIN 0,5 mg oral vor jeder Mahlzeit einzuleiten. Titrieren Sie die Dosis schrittweise, falls erforderlich, um eine glykämische Kontrolle zu erreichen.
Dosisanpassungen bei Arzneimittelwechselwirkungen
Dosisanpassungen werden bei Patienten empfohlen, die gleichzeitig starke CYP3A4- oder CYP2C8-Hemmer oder starke CYP3A4- oder CYP2C8-Induktoren einnehmen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Die gleichzeitige Anwendung mit Gemfibrozil ist kontraindiziert [siehe KONTRAINDIKATIONEN ].
Vermeiden Sie die gleichzeitige Anwendung von PRANDIN 2 mg mit Clopidogrel. Wenn eine gleichzeitige Anwendung nicht vermieden werden kann, beginnen Sie mit PRANDIN mit 0,5 mg vor jeder Mahlzeit und überschreiten Sie eine tägliche Gesamtdosis von 4 mg nicht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Bei Patienten, die Ciclosporin erhalten, darf eine tägliche Gesamtdosis von 6 mg PRANDIN 2 mg nicht überschritten werden [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
PRANDIN (Repaglinid) Tabletten, 1 mg , sind als gelbe, runde, bikonvexe Tabletten mit der Prägung „745“ auf der einen Seite und „C“ auf der anderen Seite erhältlich. Sie sind wie folgt erhältlich:
Flaschen zu 100 NDC 60846-882-01
PRANDIN (Repaglinid) Tabletten, 2 mg , sind als rosafarbene, runde, bikonvexe Tabletten mit der Prägung „747“ auf der einen Seite und „C“ auf der anderen Seite erhältlich. Sie sind wie folgt erhältlich:
Flaschen zu 100 NDC 60846-884-01
Bei 20° bis 25°C (68° bis 77°F) lagern [siehe USP Kontrollierte Raumtemperatur]. Vor Feuchtigkeit schützen. Flaschen fest verschlossen halten.
In dichten Behältern mit Sicherheitsverschlüssen abgeben.
Vertrieb durch: Amneal Specialty, eine Abteilung von Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Überarbeitet: März 2019
NEBENWIRKUNGEN
Die folgende schwerwiegende Nebenwirkung wird auch an anderer Stelle in der Kennzeichnung beschrieben:
Hypoglykämie [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Erfahrung mit klinischen Studien
Da klinische Studien mit sehr unterschiedlichen Designs durchgeführt werden, lassen sich die in einer klinischen Studie gemeldeten Nebenwirkungsraten möglicherweise nicht einfach mit den in einer anderen klinischen Studie berichteten Raten vergleichen und spiegeln möglicherweise nicht die tatsächlich in der klinischen Praxis beobachteten Raten wider.
PRANDIN 1 mg wurde in klinischen Studien an 2931 Personen verabreicht. Ungefähr 1500 dieser Personen mit Typ-2-Diabetes wurden für mindestens 3 Monate, 1000 für mindestens 6 Monate und 800 für mindestens 1 Jahr behandelt. Die Mehrheit dieser Personen (1228) erhielt PRANDIN in einer von fünf 1-jährigen, aktiv kontrollierten Studien. Im Laufe eines Jahres wurde die Behandlung bei 13 % der Patienten mit PRANDIN 1 mg aufgrund von Nebenwirkungen abgebrochen. Die häufigsten Nebenwirkungen, die zum Entzug führten, waren Hyperglykämie, Hypoglykämie und verwandte Symptome.
Tabelle 1 listet die häufigsten Nebenwirkungen bei PRANDIN-Patienten im Vergleich zu Placebo in Studien mit einer Dauer von 12 bis 24 Wochen auf.
Hypoglykämie
In klinischen Studien mit PRANDIN 1 mg ist Hypoglykämie die am häufigsten beobachtete Nebenwirkung. Eine leichte oder mittelschwere Hypoglykämie trat bei 31 % der mit PRANDIN 1 mg behandelten Patienten und bei 7 % der mit Placebo behandelten Patienten auf [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypoglykämie wurde in 1-jährigen kontrollierten Studien bei 16 % von 1228 PRANDIN-Patienten, 20 % von 417 Glyburid-Patienten und 19 % von 81 Glipizid-Patienten berichtet. Von den mit PRANDIN behandelten Patienten mit symptomatischer Hypoglykämie entwickelte keiner ein Koma oder musste ins Krankenhaus eingeliefert werden.
In einer 24-wöchigen placebokontrollierten Studie traten bei Patienten, die keine orale Antidiabetika-Therapie erhalten hatten, und bei Patienten mit einem HbA1c-Wert unter 8 % zu Studienbeginn häufiger Hypoglykämien auf.
Gewichtszunahme
Es gab keine durchschnittliche Zunahme des Körpergewichts, wenn Patienten, die zuvor mit oralen Antidiabetika behandelt wurden, auf PRANDIN umgestellt wurden. Die durchschnittliche Gewichtszunahme bei Patienten, die mit PRANDIN 0,5 mg behandelt und zuvor nicht mit Sulfonylharnstoffen behandelt wurden, betrug 3,3 %.
Kardiovaskuläre Ereignisse
Die Inzidenz schwerwiegender kardiovaskulärer Nebenwirkungen einschließlich Ischämie war in kontrollierten klinischen Vergleichsstudien unter PRANDIN (51/1228 oder 4 %) höher als unter Sulfonylharnstoffen (13/498 oder 3 %).
Sieben kontrollierte klinische Studien umfassten eine PRANDIN-Kombinationstherapie mit NPH-Insulin (n=431), Insulinformulierungen allein (n=388) oder andere Kombinationen (Sulfonylharnstoff plus NPH-Insulin oder PRANDIN 1 mg plus Metformin) (n=120). Aus zwei Studien traten sechs schwerwiegende unerwünschte Ereignisse einer Myokardischämie bei Patienten auf, die mit PRANDIN 0,5 mg plus NPH-Insulin behandelt wurden, und ein Ereignis aus einer anderen Studie bei Patienten, die nur Insulinformulierungen verwendeten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Kombinationstherapie mit Thiazolidindione
Hypoglykämie
Während der 24-wöchigen Behandlung klinischer Studien mit PRANDIN-Rosiglitazon- oder PRANDIN-Pioglitazon-Kombinationstherapie (insgesamt 250 Patienten in Kombinationstherapie) trat Hypoglykämie (Blutzucker
Peripheres Ödem und Herzinsuffizienz
Periphere Ödeme wurden bei 12 von 250 (4,8 %) Patienten mit PRANDIN-Thiazolidindion-Kombinationstherapie und 3 von 124 (2,4 %) Patienten mit Thiazolidindion-Monotherapie berichtet, wobei in diesen Studien keine Fälle für PRANDIN-Monotherapie berichtet wurden. Bei 2 von 250 Patienten (0,8 %), die mit einer PRANDIN-Thiazolidindion-Therapie behandelt wurden, gab es Berichte über Episoden von Ödemen mit dekompensierter Herzinsuffizienz. Beide Patienten hatten in der Vorgeschichte eine koronare Herzkrankheit und erholten sich nach der Behandlung mit Diuretika. Es wurden keine vergleichbaren Fälle in den Monotherapie-Behandlungsgruppen berichtet.
Gewichtszunahme
Die mittlere Gewichtszunahme im Zusammenhang mit der Kombinations-, PRANDIN- und Pioglitazontherapie betrug 5,5 kg, 0,3 kg bzw. 2,0 kg. Die mittlere Gewichtszunahme im Zusammenhang mit der Kombinations-, PRANDIN- und Rosiglitazontherapie betrug 4,5 kg, 1,3 kg bzw. 3,3 kg.
Seltene Nebenwirkungen (
Weniger häufige unerwünschte klinische oder Laborereignisse, die in klinischen Studien beobachtet wurden, waren erhöhte Leberenzyme, Thrombozytopenie, Leukopenie und anaphylaktoide Reaktionen.
Postmarketing-Erfahrung
Die folgenden zusätzlichen Nebenwirkungen wurden während der Anwendung von PRANDIN nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es im Allgemeinen nicht möglich, ihre Häufigkeit oder einen kausalen Zusammenhang mit der Arzneimittelexposition zuverlässig abzuschätzen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Klinisch wichtige Arzneimittelwechselwirkungen mit PRANDIN
Tabelle 3 enthält eine Liste von Arzneimitteln mit klinisch bedeutsamen Arzneimittelwechselwirkungen bei gleichzeitiger Verabreichung mit PRANDIN 1 mg und Anweisungen zu deren Vorbeugung oder Behandlung.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Hypoglykämie
Alle Glinide, einschließlich PRANDIN 0,5 mg, können Hypoglykämie verursachen [siehe NEBENWIRKUNGEN ]. Eine schwere Hypoglykämie kann Krampfanfälle verursachen, lebensbedrohlich sein oder zum Tod führen. Hypoglykämie kann Konzentrationsfähigkeit und Reaktionszeit beeinträchtigen; Dies kann eine Person und andere in Situationen gefährden, in denen diese Fähigkeiten wichtig sind (z. B. Fahren oder Bedienen anderer Maschinen).
Hypoglykämie kann plötzlich auftreten und die Symptome können bei jedem Individuum unterschiedlich sein und sich im Laufe der Zeit bei demselben Individuum ändern. Das symptomatische Bewusstsein für Hypoglykämie kann bei Patienten mit langjährigem Diabetes, bei Patienten mit diabetischer Nervenerkrankung, bei Patienten, die Medikamente einnehmen, die das sympathische Nervensystem blockieren (z. B. Betablocker), weniger ausgeprägt sein [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ] oder bei Patienten mit wiederkehrender Hypoglykämie.
Zu den Faktoren, die das Risiko einer Hypoglykämie erhöhen können, gehören Änderungen im Mahlzeitenmuster (z. B. Makronährstoffgehalt), Änderungen im Grad der körperlichen Aktivität, Änderungen bei gleichzeitig verabreichten Medikamenten [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ] und gleichzeitige Anwendung mit anderen Antidiabetika. Patienten mit eingeschränkter Nieren- oder Leberfunktion können ein höheres Hypoglykämierisiko haben [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Die Patienten sollten PRANDIN 0,5 mg vor den Mahlzeiten verabreichen und angewiesen werden, die PRANDIN-Dosis auszulassen, wenn eine Mahlzeit ausgelassen wird. Bei Patienten mit Hypoglykämie sollte die Dosis von PRANDIN reduziert werden [siehe DOSIERUNG UND ANWENDUNG ]. Patienten und Pflegekräfte müssen darin geschult werden, Hypoglykämien zu erkennen und zu behandeln. Die Selbstkontrolle des Blutzuckers spielt eine wesentliche Rolle bei der Prävention und Behandlung von Hypoglykämien. Bei Patienten mit erhöhtem Risiko für Hypoglykämie und Patienten mit reduziertem symptomatischem Bewusstsein für Hypoglykämie wird eine häufigere Blutzuckerkontrolle empfohlen.
Schwerwiegende kardiovaskuläre Nebenwirkungen bei gleichzeitiger Anwendung mit NPH-Insulin
In sieben kontrollierten Studien traten bei Patienten, die mit PRANDIN 0,5 mg plus NPH-Insulin behandelt wurden, aus zwei Studien sechs schwerwiegende unerwünschte Ereignisse einer myokardialen Ischämie auf, und ein Ereignis bei Patienten, die Insulinformulierungen allein aus einer anderen Studie verwendeten [siehe NEBENWIRKUNGEN ]. PRANDIN ist nicht zur Anwendung in Kombination mit NPH-Insulin angezeigt.
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit PRANDIN erbrachten.

Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen Karzinogenitätsstudie an Ratten mit Dosen von bis zu 120 mg/kg/Tag, was etwa dem 60-Fachen der klinischen Exposition auf mg/m2-Basis entspricht, war die Häufigkeit gutartiger Adenome der Schilddrüse und der Leber bei männlichen Ratten erhöht. Bei weiblichen Ratten wurden keine Hinweise auf Karzinogenität gefunden. Die höhere Inzidenz von Schilddrüsen- und Lebertumoren bei männlichen Ratten wurde bei niedrigeren Dosen von 30 mg/kg/Tag bzw. 60 mg/kg/Tag nicht beobachtet (was mehr als das 15- bzw. 30-fache der klinischen Exposition bei einer mg/m2 Basis). In einer 104-wöchigen Karzinogenitätsstudie an Mäusen mit Dosen von bis zu 500 mg/kg/Tag wurden keine Hinweise auf Karzinogenität bei Mäusen gefunden (was etwa dem 125-fachen der klinischen Exposition auf mg/m2-Basis entspricht).
Repaglinid war in einer Reihe von In-vivo- und In-vitro-Studien nicht genotoxisch: Bakterielle Mutagenese (Ames-Test), In-vitro-Vorwärtszellmutationstest in V79-Zellen (HGPRT), In-vitro-Chromosomenaberrationstest in menschlichen Lymphozyten, ungeplante und replizierende DNA-Synthese in Rattenleber und in vivo-Maus- und Ratten-Mikronukleus-Tests.
In einer Fertilitätsstudie an Ratten wurde Repaglinid männlichen und weiblichen Ratten in Dosen von bis zu 300 bzw. 80 mg/kg/Tag verabreicht. Es wurden keine nachteiligen Wirkungen auf die Fertilität beobachtet (die mehr als das 40-fache der klinischen Exposition auf mg/m2-Basis betragen).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Begrenzte Daten zur Anwendung von PRANDIN und Repaglinid bei schwangeren Frauen reichen nicht aus, um über ein arzneimittelbedingtes Risiko für schwere Geburtsfehler oder Fehlgeburten zu informieren. Mit einem schlecht eingestellten Schwangerschaftsdiabetes sind Risiken für Mutter und Fötus verbunden [siehe Klinische Überlegungen ].
Repaglidin erwies sich in Tierversuchen (Ratten und Kaninchen) als nicht teratogen. Bei weiblichen Ratten, die im letzten Trächtigkeitsstadium hohen Dosen ausgesetzt wurden, wurden Embryotoxizität und abnorme Gliedmaßenentwicklung beim Rattenfötus beobachtet.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler beträgt 6 % bis 10 % bei Frauen mit Prägestationsdiabetes mit einem HbA1c > 7 und liegt Berichten zufolge sogar bei 20 % bis 25 % bei Frauen mit einem HbA1c > 10. Das geschätzte Hintergrundrisiko einer Fehlgeburt für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch erkannten Schwangerschaften bei 2 % bis 4 % bzw. 15 % bis 20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryo/fetales Risiko
Ein schlecht eingestellter Schwangerschaftsdiabetes erhöht das mütterliche Risiko für diabetische Ketoazidose, Präeklampsie, spontane Fehlgeburten, Frühgeburten, Totgeburten und Geburtskomplikationen. Schlecht kontrollierter Diabetes erhöht das fötale Risiko für schwere Geburtsfehler, Totgeburten und Makrosomie-bedingte Morbidität.
Daten
Menschliche Daten
Es liegen keine hinreichenden Daten zu den Entwicklungsrisiken im Zusammenhang mit der Anwendung von PRANDIN 2 mg bei Schwangeren vor.
Tierdaten
Repaglinid war bei Ratten oder Kaninchen in Dosen, die dem 40-Fachen (Ratten) und etwa dem 0,8-Fachen (Kaninchen) der klinischen Exposition (auf mg/m2-Basis) während der Schwangerschaft entsprachen, nicht teratogen. Nachkommen von Rattenmüttern, die Repaglinid bei einer 15-fachen klinischen Exposition auf mg/m2-Basis an den Tagen 17 bis 22 der Trächtigkeit und während der Laktation ausgesetzt waren, entwickelten nichtteratogene Skelettdeformitäten, bestehend aus Verkürzung, Verdickung und Biegung des Humerus während der postnatalen Phase. Dieser Effekt wurde bei Dosen bis zum 2,5-Fachen der klinischen Exposition (auf mg/m2-Basis) an den Tagen 1 bis 22 der Schwangerschaft oder bei höheren Dosen, die während der Tage 1 bis 16 der Schwangerschaft verabreicht wurden, nicht beobachtet.
Stillzeit
Zusammenfassung der Risiken
Es liegen keine Informationen über das Vorhandensein von PRANDIN 0,5 mg in der Muttermilch, die Auswirkungen auf den gestillten Säugling oder die Auswirkungen auf die Milchproduktion vor. Repaglinid wurde in Rattenmilch nachgewiesen, obwohl Tierdaten aufgrund speziesspezifischer Unterschiede in der Laktationsphysiologie möglicherweise keine zuverlässigen Vorhersagen über die Wirkstoffspiegel in der Muttermilch treffen. Die Entwicklung und der gesundheitliche Nutzen des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter an PRANDIN und möglichen Nebenwirkungen von PRANDIN oder zugrunde liegenden mütterlichen Erkrankungen auf den gestillten Säugling berücksichtigt werden.
Klinische Überlegungen
Obwohl nicht bekannt ist, ob Repaglinid in die Muttermilch übergeht, ist bekannt, dass einige orale Wirkstoffe auf diesem Weg ausgeschieden werden. Da die Möglichkeit einer Hypoglykämie bei stillenden Säuglingen bestehen kann und wegen der Auswirkungen auf stillende Tiere, sollte entschieden werden, ob PRANDIN bei stillenden Müttern abgesetzt werden sollte oder ob Mütter das Stillen abbrechen sollten. Wenn PRANDIN abgesetzt wird und eine Diät allein zur Kontrolle des Blutzuckers nicht ausreicht, sollte eine Insulintherapie in Erwägung gezogen werden.
Daten
In Reproduktionsstudien an Ratten wurden messbare Repaglinid-Spiegel in der Muttermilch der Muttertiere nachgewiesen und bei den Jungtieren wurden erniedrigte Blutzuckerspiegel beobachtet. Cross-Pflegestudien zeigten, dass Skelettveränderungen [vgl Schwangerschaft ] konnte bei Kontrollwelpen, die von behandelten Muttertieren gesäugt wurden, induziert werden, obwohl dies in geringerem Maße auftrat als bei den in utero behandelten Jungtieren.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit wurden bei pädiatrischen Patienten nicht nachgewiesen.
Geriatrische Verwendung
In klinischen Studien mit einer Dauer von 24 Wochen oder länger waren 415 Patienten über 65 Jahre alt und kein Patient war älter als 75 Jahre. In aktiv kontrollierten Einjahresstudien wurden keine Unterschiede in der Wirksamkeit oder den Nebenwirkungen zwischen diesen Probanden und jenen unter 65 Jahren festgestellt. Es gab keine Zunahme der Häufigkeit oder Schwere von Hypoglykämien bei älteren Probanden, aber eine größere Empfindlichkeit einiger älterer Personen gegenüber Eine Therapie mit PRANDIN 0,5 mg kann nicht ausgeschlossen werden.
Nierenfunktionsstörung
Pharmakokinetische Studien zu Repaglinid wurden bei Patienten mit leichter bis mäßiger Nierenfunktionsstörung (CrCl = 40 bis 80 ml/min) und schwerer Nierenfunktionsstörung (CrCl = 20 bis 40 ml/min) durchgeführt. Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung ist keine anfängliche Dosisanpassung erforderlich. Allerdings sollten Patienten mit schwerer Nierenfunktionsstörung die PRANDIN-Therapie mit der 0,5-mg-Dosis beginnen und vorsichtig titrieren [siehe DOSIERUNG UND ANWENDUNG ].
Es wurden keine Studien bei Patienten mit einer Kreatinin-Clearance unter 20 ml/min oder bei Patienten mit Nierenversagen, die eine Hämodialyse benötigten, durchgeführt.
Leberfunktionsstörung
Eine Einzeldosisstudie wurde an 12 Patienten mit chronischer Lebererkrankung durchgeführt. Patienten mit mittelschwerer bis schwerer Leberfunktionsstörung hatten höhere und längere Serumkonzentrationen. Daher sollte PRANDIN 0,5 mg bei Patienten mit eingeschränkter Leberfunktion mit Vorsicht angewendet werden. Längere Intervalle zwischen Dosisanpassungen können erforderlich sein, um eine vollständige Beurteilung des Ansprechens zu ermöglichen.
ÜBERDOSIS
Schwere hypoglykämische Reaktionen mit Koma, Krampfanfällen oder anderen neurologischen Beeinträchtigungen können auftreten und medizinische Notfälle darstellen, die eine sofortige Einweisung ins Krankenhaus erfordern. Hypoglykämische Symptome ohne Bewusstlosigkeit oder neurologische Befunde sollten aggressiv mit oraler Glukose und Anpassungen der Medikamentendosierung und/oder des Ernährungsmusters behandelt werden. Die engmaschige Überwachung kann fortgesetzt werden, bis der Arzt sicher ist, dass der Patient außer Gefahr ist. Die Patienten sollten für mindestens 24 bis 48 Stunden engmaschig überwacht werden, da eine Hypoglykämie nach offensichtlicher klinischer Erholung erneut auftreten kann. Es gibt keine Hinweise darauf, dass PRANDIN durch Hämodialyse dialysierbar ist.
KONTRAINDIKATIONEN
PRANDIN ist kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Repaglinid senkt den Blutzuckerspiegel, indem es die Freisetzung von Insulin aus der Bauchspeicheldrüse stimuliert. Diese Wirkung ist abhängig von funktionierenden Beta (ß)-Zellen in den Pankreasinseln. Die Insulinfreisetzung ist glukoseabhängig und nimmt bei niedrigen Glukosekonzentrationen ab.
Repaglinid schließt ATP-abhängige Kaliumkanäle in der ß-Zellmembran durch Bindung an charakterisierbare Stellen. Diese Kaliumkanalblockade depolarisiert die ß-Zelle, was zu einer Öffnung von Calciumkanälen führt. Der resultierende erhöhte Calciumeinstrom induziert die Insulinsekretion. Der Ionenkanalmechanismus ist hochgradig gewebeselektiv mit geringer Affinität für Herz- und Skelettmuskel.
Pharmakodynamik
Bei 138 Patienten mit Typ-2-Diabetes wurde eine vierwöchige, doppelblinde, Placebo-kontrollierte Dosis-Wirkungs-Studie mit Dosen von 0,25 (keine zugelassene Dosis) bis 4 mg zu jeder der drei Mahlzeiten durchgeführt. Die PRANDIN-Therapie führte über den gesamten Dosisbereich zu einer dosisproportionalen Glukosesenkung. Die Plasmainsulinspiegel stiegen nach den Mahlzeiten an und kehrten vor der nächsten Mahlzeit zum Ausgangswert zurück. Der größte Teil der blutzuckersenkenden Nüchternwirkung zeigte sich innerhalb von 1 bis 2 Wochen.
In einer doppelblinden, placebokontrollierten, 3-monatigen Dosistitrationsstudie wurden die Dosen von PRANDIN 0,5 mg oder Placebo für jeden Patienten wöchentlich von 0,25 mg (keine zugelassene Dosis) über 0,5, 1 und 2 mg bis zu einem Maximum erhöht von 4 mg, bis ein Nüchtern-Plasmaglukosespiegel (FPG)
Die Dosierung von PRANDIN 0,5 mg im Verhältnis zur mahlzeitbezogenen Insulinfreisetzung wurde in drei Studien mit 58 Patienten untersucht. Die glykämische Kontrolle wurde während eines Zeitraums aufrechterhalten, in dem das Mahlzeiten- und Dosierungsmuster variiert wurde (2, 3 oder 4 Mahlzeiten pro Tag; vor den Mahlzeiten x 2, 3 oder 4), verglichen mit einem Zeitraum von 3 regulären Mahlzeiten und 3 Dosen pro Tag ( vor den Mahlzeiten x 3). Die blutzuckersenkende Wirkung unterschied sich nicht, wenn PRANDIN 0,5 mg zu Beginn einer Mahlzeit, 15 Minuten vor oder 30 Minuten vor der Mahlzeit verabreicht wurde.
Pharmakokinetik
Die pharmakokinetischen Parameter von Repaglinid, die aus einer Einzeldosis-Crossover-Studie bei gesunden Probanden und aus einer Paralleldosis-Proportionalitätsstudie (0,5, 1, 2 und 4 mg) mit Mehrfachdosis bei Patienten mit Typ-2-Diabetes erhalten wurden, sind in den Tabellen zusammengefasst 5 und 6. Diese Daten zeigen, dass Repaglinid nicht im Serum akkumuliert. Die Clearance von oralem Repaglinid veränderte sich nicht über den Dosisbereich von 0,5 bis 4 mg, was auf eine lineare Beziehung zwischen Dosis und Plasmaspiegel hinweist.
Absorption
Nach oraler Gabe wird Repaglinid vollständig aus dem Gastrointestinaltrakt resorbiert. Nach einmaliger und mehrfacher oraler Gabe bei gesunden Probanden oder Patienten treten innerhalb von 1 Stunde (Tmax) maximale Plasmakonzentrationen des Arzneimittels (Cmax) auf. Repaglinid wird mit einer Halbwertszeit von etwa 1 Stunde aus dem Blutstrom eliminiert. Die mittlere absolute Bioverfügbarkeit beträgt 56 %. Wenn Repaglinid zusammen mit Nahrung verabreicht wurde, änderte sich die mittlere Tmax nicht, aber die mittlere Cmax und AUC (Fläche unter der Zeit/Plasmakonzentrationskurve) waren um 20 % bzw. 12,4 % verringert.
Verteilung
Nach intravenöser (i.v.) Verabreichung an gesunde Probanden betrug das Verteilungsvolumen im Steady-State (Vss) 31 l und die Gesamtkörperclearance (CL) 38 l/h. Die Proteinbindung und die Bindung an Humanserumalbumin betrug mehr als 98 %.
Stoffwechsel und Ausscheidung
Repaglinid wird entweder nach intravenöser oder oraler Gabe vollständig durch oxidative Biotransformation und direkte Konjugation mit Glucuronsäure metabolisiert. Die Hauptmetaboliten sind eine oxidierte Dicarbonsäure (M2), das aromatische Amin (M1) und das Acylglucuronid (M7). Es wurde gezeigt, dass das Cytochrom-P-450-Enzymsystem, insbesondere 2C8 und 3A4, an der N-Dealkylierung von Repaglinid zu M2 und der weiteren Oxidation zu M1 beteiligt ist. Metaboliten tragen nicht zur blutzuckersenkenden Wirkung von Repaglinid bei. Innerhalb von 96 Stunden nach Gabe von 14C-Repaglinid als orale Einzeldosis wurden etwa 90 % der radioaktiven Markierung im Stuhl und etwa 8 % im Urin wiedergefunden. Nur 0,1 % der Dosis werden als Muttersubstanz im Urin ausgeschieden. Der Hauptmetabolit (M2) machte 60 % der verabreichten Dosis aus. Weniger als 2 % der Muttersubstanz wurden im Stuhl wiedergefunden. Repaglinid scheint ein Substrat für den aktiven hepatischen Aufnahmetransporter (Organic Anion Transporting Protein OATP1B1) zu sein.
Variabilität der Exposition
Die AUC von Repaglinid nach Mehrfachdosen von 0,25 bis 4 mg zu jeder Mahlzeit variiert über einen weiten Bereich. Die intraindividuellen und interindividuellen Variationskoeffizienten betrugen 36 % bzw. 69 %. Die AUC über den therapeutischen Dosisbereich umfasste 69 bis 1005 ng/ml*h, aber eine AUC-Exposition von bis zu 5417 ng/ml*h wurde in Dosiseskalationsstudien ohne offensichtliche nachteilige Folgen erreicht.
Spezifische Populationen
Geriatrie
Gesunde Freiwillige wurden mit einer Dosierung von 2 mg PRANDIN 0,5 mg vor jeder von 3 Mahlzeiten behandelt. Es gab keine signifikanten Unterschiede in der Pharmakokinetik von Repaglinid zwischen der Gruppe der Patienten im Alter von Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
Ein Vergleich der Pharmakokinetik bei Männern und Frauen zeigte, dass die AUC über den Dosisbereich von 0,5 mg bis 4 mg bei Frauen mit Typ-2-Diabetes um 15 % bis 70 % höher war. Dieser Unterschied spiegelte sich nicht in der Häufigkeit hypoglykämischer Episoden (Männer: 16 %; Frauen: 17 %) oder anderer unerwünschter Ereignisse wider.
Wettrennen
Es wurden keine pharmakokinetischen Studien zur Bewertung der Auswirkungen der ethnischen Zugehörigkeit durchgeführt, aber in einer US-amerikanischen 1-Jahres-Studie bei Patienten mit Typ-2-Diabetes war die blutzuckersenkende Wirkung bei Kaukasiern (n=297) und Afroamerikanern (n= 33). In einer Dosis-Wirkungs-Studie in den USA gab es keinen offensichtlichen Unterschied in der Exposition (AUC) zwischen Kaukasiern (n = 74) und Hispanics (n = 33).
Nierenfunktionsstörung
Die Pharmakokinetik von Repaglinid nach Einzeldosis und Steady-State wurde zwischen Patienten mit Typ-2-Diabetes und normaler Nierenfunktion (CrCl > 80 ml/min), leichter bis mittelschwerer Nierenfunktionsstörung (CrCl = 40 bis 80 ml/min) und schwerer Nierenfunktionsstörung verglichen Nierenfunktionsstörung (CrCl = 20 bis 40 ml/min). Sowohl AUC als auch Cmax von Repaglinid waren bei Patienten mit normaler und leicht bis mäßig eingeschränkter Nierenfunktion ähnlich (Mittelwerte 56,7 ng/ml*h vs. 57,2 ng/ml*h bzw. 37,5 ng/ml vs. 37,7 ng/ml). Patienten mit stark eingeschränkter Nierenfunktion hatten erhöhte mittlere AUC- und Cmax-Werte (98,0 ng/ml*h bzw. 50,7 ng/ml), aber diese Studie zeigte nur eine schwache Korrelation zwischen den Repaglinid-Spiegeln und der Kreatinin-Clearance.
Leberfunktionsstörung
An 12 gesunden Probanden und 12 Patienten mit chronischer Lebererkrankung (CLD), klassifiziert nach der Child-Pugh-Skala und der Koffein-Clearance, wurde eine unverblindete Einzeldosis-Studie durchgeführt. Patienten mit mäßiger bis schwerer Leberfunktionsstörung hatten höhere und länger anhaltende Serumkonzentrationen von Gesamt- und ungebundenem Repaglinid als gesunde Probanden (AUCgesund: 91,6 ng/ml*h; AUCCLD-Patienten: 368,9 ng/ml*h; Cmax, gesund: 46,7 ng/ml; Cmax, CLD-Patienten: 105,4 ng/ml). Die AUC war statistisch mit der Coffein-Clearance korreliert. Zwischen den Patientengruppen wurde kein Unterschied in den Glukoseprofilen beobachtet.
Arzneimittelwechselwirkungen
Studien zu Arzneimittelwechselwirkungen, die an gesunden Freiwilligen durchgeführt wurden, zeigen, dass PRANDIN 0,5 mg keine klinisch relevante Wirkung auf die pharmakokinetischen Eigenschaften von Digoxin, Theophyllin oder Warfarin hatte. Die gleichzeitige Verabreichung von Cimetidin mit PRANDIN 1 mg veränderte die Resorption und Disposition von Repaglinid nicht signifikant.
Zusätzlich wurden die folgenden Arzneimittel bei gleichzeitiger Verabreichung von PRANDIN an gesunden Freiwilligen untersucht.
Klinische Studien
Monotherapie-Studien
Eine doppelblinde, placebokontrollierte Studie wurde an 362 Patienten durchgeführt, die 24 Wochen lang behandelt wurden. Der HbA1c-Wert der mit PRANDIN behandelten Gruppen (1- und 4-mg-Gruppen zusammen) war am Ende der Studie im Vergleich zur mit Placebo behandelten Gruppe bei nicht vorbehandelten Patienten und bei Patienten, die zuvor mit oralen Antidiabetika behandelt wurden, um 2,1 % bzw. 1,7 % gesunken. beziehungsweise. In dieser Studie mit fester Dosis zeigten Patienten, die keine Behandlung mit oralen Antidiabetika erhalten hatten, und Patienten mit einem HbA1c-Wert unter 8 % zu Studienbeginn eine stärkere Blutzuckersenkung.
Kombinationsversuche
PRANDIN in Kombination mit Metformin
PRANDIN wurde in Kombination mit Metformin bei 83 Patienten untersucht, die mit Bewegung, Diät und Metformin allein nicht zufriedenstellend eingestellt werden konnten. Die Dosierung von PRANDIN 2 mg wurde für 4 bis 8 Wochen titriert, gefolgt von einer 3-monatigen Erhaltungsphase. Die Kombinationstherapie mit PRANDIN 1 mg und Metformin führte zu einer statistisch signifikanten Verbesserung von HbA1c und Nüchtern-Plasmaglukose (FPG) im Vergleich zu PRANDIN 2 mg oder Metformin-Monotherapie (Tabelle 8). In dieser Studie, in der die Metformin-Dosierung konstant gehalten wurde, zeigte die Kombinationstherapie von PRANDIN und Metformin im Vergleich zu PRANDIN dosissparende Effekte. Die Verbesserung von HbA1c und FPG der Kombinationsgruppe wurde bei einer niedrigeren Tagesdosis von 0,5 mg PRANDIN als in der PRANDIN-Monotherapiegruppe erreicht (Tabelle 8).
PRANDIN 1 mg in Kombination mit Pioglitazon
In einer 24-wöchigen Studie, an der 246 Patienten teilnahmen, die zuvor mit einer Sulfonylharnstoff- oder Metformin-Monotherapie (HbA1c > 7,0 %). Die Dosierung von PRANDIN 1 mg wurde während der ersten 12 Wochen titriert, gefolgt von einer 12-wöchigen Erhaltungsphase. Die Kombinationstherapie führte zu einer statistisch signifikanten Verbesserung von HbA1c und FPG im Vergleich zur Monotherapie (Abbildung 1). Die Veränderungen gegenüber dem Ausgangswert für Completer in FPG (mg/dl) bzw. HbA1c (%) waren: -39,8 mg/dl und -0,1 % für PRANDIN, -35,3 mg/dl und -0,1 % für Pioglitazon und -92,4 mg/ dL und -1,9 % für die Kombination. In dieser Studie, in der die Pioglitazon-Dosierung konstant gehalten wurde, zeigte die Kombinationstherapie-Gruppe dosissparende Wirkungen in Bezug auf PRANDIN (siehe Legende von Abbildung 1). Die Verbesserung von HbA1c und FPG der Kombinationsgruppe wurde bei einer niedrigeren PRANDIN-Tagesdosis erreicht als in der PRANDIN-Monotherapie-Gruppe.
Abbildung 1: PRANDIN in Kombination mit Pioglitazon: HbA1c-Werte
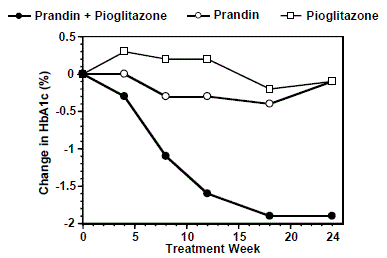
LEGENDE
HbA1c-Werte nach Studienwoche für Patienten, die die Studie abgeschlossen haben (Kombination, N = 101; PRANDIN 1 mg, N = 35, Pioglitazon, N = 26). Probanden mit FPG über 270 mg/dL wurden aus der Studie genommen.
Pioglitazon-Dosis: festgelegt auf 30 mg/Tag; PRANDIN 1 mg mittlere Enddosis: 6 mg/Tag für die Kombination und 10 mg/Tag für die Monotherapie.
PRANDIN in Kombination mit Rosiglitazon
In einer 24-wöchigen Studie, an der 252 Patienten teilnahmen, die zuvor mit Sulfonylharnstoff oder Metformin (HbA1c > 7,0 %) behandelt wurden, wurde eine Kombinationstherapie aus PRANDIN und Rosiglitazon mit einer Monotherapie mit einem der Wirkstoffe allein verglichen. Die Kombinationstherapie führte zu einer statistisch signifikanten Verbesserung von HbA1c und FPG im Vergleich zur Monotherapie (Tabelle 9 unten). Die glykämischen Wirkungen der Kombinationstherapie waren sowohl in Bezug auf die tägliche Gesamtdosis von PRANDIN 1 mg als auch die tägliche Gesamtdosis von Rosiglitazon dosissparend (siehe Legende von Tabelle 9). Die Verbesserung von HbA1c und FPG der Kombinationstherapiegruppe wurde im Vergleich zu den jeweiligen Monotherapiegruppen mit einer niedrigeren Tagesdosis von PRANDIN 1 mg und Rosiglitazon erreicht.
INFORMATIONEN ZUM PATIENTEN
Hypoglykämie
Informieren Sie die Patienten darüber, dass PRANDIN 2 mg Hypoglykämie verursachen kann, und weisen Sie die Patienten und ihre Betreuer auf Selbstbehandlungsverfahren hin, einschließlich Glukoseüberwachung und Behandlung von Hypoglykämie. Informieren Sie die Patienten darüber, dass ihre Konzentrations- und Reaktionsfähigkeit infolge einer Hypoglykämie beeinträchtigt sein kann. Bei Patienten mit erhöhtem Risiko für Hypoglykämie und Patienten mit reduziertem symptomatischem Bewusstsein für Hypoglykämie wird eine häufigere Blutzuckerkontrolle empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Verwaltung
Weisen Sie die Patienten an, PRANDIN 0,5 mg innerhalb von 30 Minuten vor den Mahlzeiten einzunehmen. Weisen Sie die Patienten an, ihre PRANDIN-Dosis auszulassen, wenn eine Mahlzeit ausgelassen wird [siehe DOSIERUNG UND ANWENDUNG ].
Wechselwirkungen mit anderen Medikamenten
Besprechen Sie mögliche Arzneimittelwechselwirkungen mit Patienten und informieren Sie sie über mögliche Arzneimittelwechselwirkungen mit PRANDIN [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].