Precose 25mg, 50mg Acarbose Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Precose 50 mg und wie wird es angewendet?
Precose (Acarbose-Tabletten) ist ein oraler Alpha-Glucosidase-Hemmer zur Behandlung von Typ-2-Diabetes. Precose 50 mg wird manchmal in Kombination mit Insulin oder anderen Diabetes-Medikamenten verwendet, die Sie oral einnehmen. Precose 25 mg ist in generischer Form erhältlich.
Welche Nebenwirkungen hat Precose 25mg?
Häufige Nebenwirkungen von Precose sind:
Andere Nebenwirkungen von Precose 50 mg sind Hautausschlag oder Juckreiz. Informieren Sie Ihren Arzt, wenn Sie seltene, aber sehr schwerwiegende Nebenwirkungen von Precose 25 mg haben, einschließlich:
BEZEICHNUNG
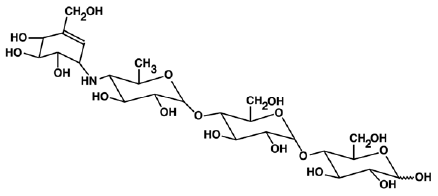
PRECOSE® (Acarbose-Tabletten) ist ein oraler Alpha-Glucosidase-Hemmer zur Behandlung von Typ-2-Diabetes mellitus. Acarbose ist ein Oligosaccharid, das aus Fermentationsprozessen eines Mikroorganismus, Actinoplanes utahensis, gewonnen wird und chemisch als O-4,6-Didesoxy4-[[(1S,4R,5S,6S)-4,5,6-Trihydroxy- 3-(Hydroxymethyl)-2-cyclohexen-1-yl]amino]-α-D-glucopyranosyl-(1 → 4)-O-α-D-glucopyranosyl-(1 → 4)-D-glucose. Es ist ein weißes bis cremefarbenes Pulver mit einem Molekulargewicht von 645,6. Acarbose ist wasserlöslich und hat einen pKa-Wert von 5,1. Seine Summenformel ist C25H43NO18 und seine chemische Struktur ist wie folgt:
PRECOSE 50 mg ist als 25-mg-, 50-mg- und 100-mg-Tablette zum Einnehmen erhältlich. Die inaktiven Bestandteile sind Stärke, mikrokristalline Zellulose, Magnesiumstearat und kolloidales Siliziumdioxid.
INDIKATIONEN
PRECOSE ist indiziert als Ergänzung zu Diät und Bewegung zur Verbesserung der glykämischen Kontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus.
DOSIERUNG UND ANWENDUNG
Es gibt kein festes Dosierungsschema für die Behandlung von Diabetes mellitus mit PRECOSE oder anderen pharmakologischen Wirkstoffen. Die Dosierung von PRECOSE 25 mg muss auf der Grundlage sowohl der Wirksamkeit als auch der Verträglichkeit individuell angepasst werden, darf jedoch die maximal empfohlene Dosis von 100 mg dreimal täglich nicht überschreiten. PRECOSE sollte dreimal täglich zu Beginn (mit dem ersten Bissen) jeder Hauptmahlzeit eingenommen werden.
PRECOSE sollte mit einer niedrigen Dosis begonnen werden, mit allmählicher Dosissteigerung wie unten beschrieben, sowohl um gastrointestinale Nebenwirkungen zu reduzieren als auch um die Bestimmung der Mindestdosis zu ermöglichen, die für eine angemessene glykämische Kontrolle des Patienten erforderlich ist. Wird die vorgeschriebene Diät nicht eingehalten, können die Darmnebenwirkungen verstärkt werden. Treten trotz Einhaltung der verordneten Diabetikerdiät stark belastende Symptome auf, muss der Arzt konsultiert und die Dosis vorübergehend oder dauerhaft reduziert werden.
Während des Behandlungsbeginns und der Dosistitration (siehe unten) kann eine einstündige postprandiale Plasmaglukosemessung verwendet werden, um das therapeutische Ansprechen auf PRECOSE zu bestimmen und die minimal wirksame Dosis für den Patienten zu ermitteln. Danach sollte glykosyliertes Hämoglobin in Abständen von etwa drei Monaten gemessen werden. Das therapeutische Ziel sollte darin bestehen, sowohl die postprandialen Plasmaglukose- als auch die glykosylierten Hämoglobinspiegel auf normale oder nahezu normale Werte zu senken, indem die niedrigste wirksame Dosis von PRECOSE entweder als Monotherapie oder in Kombination mit Sulfonylharnstoffen, Insulin oder Metformin angewendet wird.
Anfangsdosierung
Die empfohlene Anfangsdosis von PRECOSE 25 mg beträgt 25 mg oral dreimal täglich zu Beginn (mit dem ersten Bissen) jeder Hauptmahlzeit. Einige Patienten können jedoch von einer langsameren Dosistitration profitieren, um gastrointestinale Nebenwirkungen zu minimieren. Dies kann erreicht werden, indem die Behandlung mit 25 mg einmal täglich begonnen und anschließend die Verabreichungshäufigkeit erhöht wird, um 25 mg 3-mal täglich zu erreichen
Erhaltungsdosierung
Sobald ein Dosierungsschema von 25 mg tid erreicht ist, sollte die Dosierung von PRECOSE 50 mg in 4–8-wöchigen Intervallen angepasst werden, basierend auf den einstündigen postprandialen Glukose- oder glykosylierten Hämoglobinspiegeln und der Verträglichkeit. Die Dosis kann von 25 mg 3-mal täglich auf 50 mg 3-mal täglich erhöht werden. Einige Patienten können von einer weiteren Erhöhung der Dosis auf 100 mg 3-mal täglich profitieren. Die Erhaltungsdosis reicht von 50 mg 3-mal täglich bis 100 mg 3-mal täglich. Da Patienten mit niedrigem Körpergewicht jedoch möglicherweise erhöht werden müssen Risiko für erhöhte Serumtransaminasen, sollte nur bei Patienten mit einem Körpergewicht > 60 kg eine Dosistitration über 50 mg dreimal täglich in Betracht gezogen werden (siehe VORSICHTSMASSNAHMEN ). Wenn bei Titration auf 100 mg 3-mal täglich keine weitere Verringerung der postprandialen Glukose- oder glykosylierten Hämoglobinspiegel beobachtet wird, sollte eine Verringerung der Dosis in Betracht gezogen werden. Sobald eine wirksame und verträgliche Dosierung ermittelt wurde, sollte diese beibehalten werden.
Maximale Dosierung
Die empfohlene Höchstdosis für Patienten ≤ 60 kg beträgt 50 mg dreimal täglich. Die empfohlene Höchstdosis für Patienten > 60 kg beträgt 100 mg dreimal täglich
Patienten, die Sulfonylharnstoffe oder Insulin erhalten
Sulfonylharnstoffe oder Insulin können Hypoglykämie verursachen. PRECOSE in Kombination mit einem Sulfonylharnstoff oder Insulin bewirkt eine weitere Senkung des Blutzuckerspiegels und kann das Potenzial für Hypoglykämie erhöhen. Wenn eine Hypoglykämie auftritt, sollte die Dosierung dieser Mittel entsprechend angepasst werden.
WIE GELIEFERT
PRECOSE ist als runde 25-mg-, 50-mg- oder 100-mg-Tabletten ohne Bruchkerbe erhältlich. Jede Tablettenstärke ist weiß bis gelbstichig. Die 25-mg-Tablette ist auf der einen Seite mit dem Wort „PRECOSE“ und auf der anderen Seite mit „25“ gekennzeichnet. Die 50-mg-Tablette ist mit dem Wort „PRECOSE“ und „50“ auf derselben Seite gekennzeichnet. Die 100-mg-Tablette ist mit dem Wort „PRECOSE“ und „100“ auf derselben Seite kodiert. PRECOSE ist in Flaschen mit 100 und 50 mg Stärke in Einzeldosispackungen mit 100 Stück erhältlich.
Nicht über 25 °C (77 °F) lagern. Vor Feuchtigkeit schützen. Bei Flaschen Behälter dicht verschlossen halten.
Bayer HealthCare Pharmaceuticals Inc. Wayne, NJ 07470. Hergestellt in Deutschland. 11.11
NEBENWIRKUNGEN
Verdauungstrakt
Gastrointestinale Symptome sind die häufigsten Reaktionen auf PRECOSE. In placebokontrollierten Studien in den USA betrug die Häufigkeit von Bauchschmerzen, Durchfall und Blähungen 19 %, 31 % bzw. 74 % bei 1255 mit PRECOSE 50–300 mg dreimal täglich behandelten Patienten, während die entsprechenden Häufigkeiten 9 %, 12 % betrugen. und 29 % bei 999 mit Placebo behandelten Patienten.
In einer einjährigen Sicherheitsstudie, in der Patienten Tagebuch über Magen-Darm-Symptome führten, neigten Bauchschmerzen und Durchfall dazu, mit der Zeit auf das Niveau vor der Behandlung zurückzukehren, und die Häufigkeit und Intensität von Blähungen ließ mit der Zeit tendenziell nach. Die verstärkten Symptome des Magen-Darm-Trakts bei mit PRECOSE 50 mg behandelten Patienten sind eine Manifestation des Wirkungsmechanismus von PRECOSE und hängen mit dem Vorhandensein von unverdauten Kohlenhydraten im unteren Gastrointestinaltrakt zusammen.
Wird die vorgeschriebene Diät nicht eingehalten, können die Darmnebenwirkungen verstärkt werden. Treten trotz Einhaltung der verordneten Diabetikerdiät stark belastende Symptome auf, muss der Arzt konsultiert und die Dosis vorübergehend oder dauerhaft reduziert werden.
Erhöhte Serum-Transaminase-Spiegel
Sehen VORSICHTSMASSNAHMEN .
Andere anormale Laborbefunde
Kleine Senkungen des Hämatokritwertes traten bei den mit PRECOSE behandelten Patienten häufiger auf als bei den mit Placebo behandelten Patienten, waren jedoch nicht mit einer Senkung des Hämoglobinwertes verbunden. Niedrige Serum-Calcium- und niedrige Plasma-Vitamin-B6-Spiegel wurden mit der PRECOSE 50 mg-Therapie in Verbindung gebracht, es wird jedoch davon ausgegangen, dass sie entweder falsch oder ohne klinische Bedeutung sind.
Berichte zu unerwünschten Ereignissen nach der Markteinführung
Weitere unerwünschte Ereignisse, die aus der weltweiten Erfahrung nach der Markteinführung berichtet wurden, umfassen fulminante Hepatitis mit tödlichem Ausgang, überempfindliche Hautreaktionen (z. B. Hautausschlag, Erythem, Exanthem und Utikaria), Ödeme, Ileus/Subileus, Gelbsucht und/oder Hepatitis und damit verbundene Leberschäden, Thrombozytopenie und Pneumatose Cystoides intestinalis (vgl VORSICHTSMASSNAHMEN ).
Pneumatosis Cystoides Intestinalis
Nach Markteinführung gab es seltene Berichte über Pneumatosis cystoides intestinalis im Zusammenhang mit der Anwendung von Alpha-Glucosidase-Hemmern, einschließlich Precose. Pneumatosis cystoides intestinalis kann mit Symptomen wie Durchfall, Schleimausfluss, rektalen Blutungen und Verstopfung auftreten. Zu den Komplikationen können Pneumoperitoneum, Volvulus, Darmverschluss, Invagination, Darmblutung und Darmperforation gehören. Bei Verdacht auf Pneumatosis cystoides intestinalis ist Precose 25 mg abzusetzen und die entsprechende diagnostische Bildgebung durchzuführen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Bestimmte Medikamente neigen zu Hyperglykämie und können zu einem Verlust der Blutzuckerkontrolle führen. Zu diesen Arzneimitteln gehören Thiazide und andere Diuretika, Kortikosteroide, Phenothiazine, Schilddrüsenprodukte, Östrogene, orale Kontrazeptiva, Phenytoin, Nikotinsäure, Sympathomimetika, Kalziumkanalblocker und Isoniazid. Wenn solche Arzneimittel einem Patienten verabreicht werden, der PRECOSE 25 mg erhält, sollte der Patient engmaschig auf einen Verlust der Blutzuckerkontrolle überwacht werden. Wenn solche Arzneimittel Patienten abgesetzt werden, die PRECOSE 50 mg in Kombination mit Sulfonylharnstoffen oder Insulin erhalten, sollten die Patienten engmaschig auf Anzeichen einer Hypoglykämie überwacht werden.
Patienten, die Sulfonylharnstoffe oder Insulin erhalten: Sulfonylharnstoffe oder Insulin können Hypoglykämie verursachen. PRECOSE 25 mg in Kombination mit einem Sulfonylharnstoff oder Insulin kann eine weitere Senkung des Blutzuckerspiegels verursachen und das Potenzial für Hypoglykämie erhöhen. Wenn eine Hypoglykämie auftritt, sollte die Dosierung dieser Mittel entsprechend angepasst werden. Sehr selten wurden einzelne Fälle von hypoglykämischem Schock bei Patienten berichtet, die eine PRECOSE-Therapie in Kombination mit Sulfonylharnstoffen und/oder Insulin erhielten.
Darmadsorbentien (z. B. Aktivkohle) und Verdauungsenzympräparate, die kohlenhydratspaltende Enzyme (z. B. Amylase, Pankreatin) enthalten, können die Wirkung von PRECOSE verringern und sollten nicht gleichzeitig eingenommen werden.
Es hat sich gezeigt, dass PRECOSE 25 mg die Bioverfügbarkeit von Digoxin bei gleichzeitiger Verabreichung verändert, was eine Anpassung der Digoxin-Dosis erforderlich machen kann. (Sehen KLINISCHE PHARMAKOLOGIE , Arzneimittelwechselwirkungen .)
WARNUNGEN
Keine Informationen bereitgestellt
VORSICHTSMASSNAHMEN
Allgemein
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit PRECOSE 25 mg oder einem anderen Antidiabetikum erbrachten.
Hypoglykämie
Aufgrund seines Wirkmechanismus sollte PRECOSE bei alleiniger Verabreichung im nüchternen oder postprandialen Zustand keine Hypoglykämie verursachen. Sulfonylharnstoffe oder Insulin können Hypoglykämie verursachen. Da PRECOSE 50 mg in Kombination mit einem Sulfonylharnstoff oder Insulin eine weitere Senkung des Blutzuckers bewirkt, kann es das Potenzial für eine Hypoglykämie erhöhen. Eine Hypoglykämie tritt bei Patienten, die Metformin allein unter den üblichen Anwendungsbedingungen erhalten, nicht auf, und bei Patienten, die PRECOSE 50 mg zusätzlich zur Metformin-Therapie erhielten, wurde keine erhöhte Inzidenz von Hypoglykämien beobachtet.
Orale Glucose (Dextrose), deren Resorption durch PRECOSE nicht gehemmt wird, sollte anstelle von Saccharose (Rohrzucker) zur Behandlung von leichter bis mittelschwerer Hypoglykämie verwendet werden. Saccharose, deren Hydrolyse zu Glucose und Fructose durch PRECOSE gehemmt wird, ist zur schnellen Korrektur von Hypoglykämien ungeeignet. Eine schwere Hypoglykämie kann die Anwendung entweder einer intravenösen Glucose-Infusion oder einer Glucagon-Injektion erfordern.
Erhöhte Serum-Transaminase-Spiegel
In Langzeitstudien (bis zu 12 Monate und einschließlich PRECOSE 25 mg-Dosen bis zu 300 mg dreimal täglich), die in den Vereinigten Staaten durchgeführt wurden, zeigten behandlungsbedingte Erhöhungen der Serumtransaminasen (AST und/oder ALT) über die obere Grenze des Normalwerts (ULN ), mehr als das 1,8-fache des ULN und mehr als das 3-fache des ULN traten bei 14 %, 6 % bzw. 3 % der mit PRECOSE behandelten Patienten auf, verglichen mit 7 %, 2 % bzw. 1 %. von mit Placebo behandelten Patienten. Obwohl diese Unterschiede zwischen den Behandlungen statistisch signifikant waren, waren diese Erhöhungen asymptomatisch, reversibel, häufiger bei Frauen und im Allgemeinen nicht mit anderen Anzeichen einer Leberfunktionsstörung verbunden. Darüber hinaus schienen diese Erhöhungen der Serumtransaminasen dosisabhängig zu sein. In US-amerikanischen Studien mit PRECOSE-Dosen von 50 mg bis zur maximal zugelassenen Dosis von 100 mg dreimal täglich waren die behandlungsbedingten Erhöhungen von AST und/oder ALT bei allen Schweregraden bei den mit PRECOSE behandelten Patienten und den mit Placebo behandelten Patienten ähnlich (p ≥ 0,496). .
In etwa 3 Millionen Patientenjahren internationaler Postmarketing-Erfahrung mit PRECOSE 50 mg wurden 62 Fälle von Serumtransaminase-Erhöhungen > 500 IE/l (von denen 29 mit Gelbsucht assoziiert waren) berichtet. Einundvierzig dieser 62 Patienten erhielten eine Behandlung mit 100 mg dreimal täglich oder mehr, und 33 von 45 Patienten, für die ein Gewicht angegeben wurde, wogen
Verlust der Blutzuckerkontrolle
Wenn Diabetiker Stress wie Fieber, Trauma, Infektion oder Operation ausgesetzt sind, kann es zu einem vorübergehenden Kontrollverlust des Blutzuckers kommen. In solchen Fällen kann eine vorübergehende Insulintherapie erforderlich sein.
Labortests
Das therapeutische Ansprechen auf PRECOSE sollte durch regelmäßige Blutzuckertests überwacht werden. Zur Überwachung der langfristigen glykämischen Kontrolle wird die Messung des glykosylierten Hämoglobinspiegels empfohlen.
PRECOSE 25 mg, insbesondere bei Dosen von mehr als 50 mg 3-mal täglich, kann zu Erhöhungen der Serumtransaminasen und in seltenen Fällen zu Hyperbilirubinämie führen. Es wird empfohlen, die Serum-Transaminase-Spiegel im ersten Jahr der Behandlung mit PRECOSE alle 3 Monate und danach regelmäßig zu kontrollieren. Wenn erhöhte Transaminasen beobachtet werden, kann eine Dosisreduktion oder ein Therapieabbruch angezeigt sein, insbesondere wenn die Erhöhungen bestehen bleiben.
Nierenfunktionsstörung
Die Plasmakonzentrationen von PRECOSE bei Probanden mit eingeschränkter Nierenfunktion waren proportional zum Grad der Nierenfunktionsstörung erhöht. Klinische Langzeitstudien bei Diabetikern mit signifikanter Nierenfunktionsstörung (Serum-Kreatinin > 2,0 mg/dl) wurden nicht durchgeführt. Daher wird die Behandlung dieser Patienten mit PRECOSE 50 mg nicht empfohlen.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Mit Acarbose wurden acht Kanzerogenitätsstudien durchgeführt. Sechs Studien wurden an Ratten (zwei Stämme, Sprague-Dawley und Wistar) und zwei Studien an Hamstern durchgeführt.
In der ersten Rattenstudie erhielten Sprague-Dawley-Ratten 104 Wochen lang Acarbose im Futter in hohen Dosen (bis zu etwa 500 mg/kg Körpergewicht). Die Behandlung mit Acarbose führte zu einem signifikanten Anstieg der Inzidenz von Nierentumoren (Adenome und Adenokarzinome) und gutartigen Leydig-Zell-Tumoren. Diese Studie wurde mit ähnlichem Ergebnis wiederholt. Weitere Studien wurden durchgeführt, um die direkten karzinogenen Wirkungen von Acarbose von den indirekten Wirkungen zu trennen, die aus der Kohlenhydrat-Mangelernährung resultieren, die durch die in den Studien verwendeten großen Dosen von Acarbose verursacht wurde. In einer Studie mit Sprague-Dawley-Ratten wurde Acarbose mit Futter gemischt, aber ein Kohlenhydratentzug wurde durch die Zugabe von Glukose zur Nahrung verhindert.

In einer 26-monatigen Studie an Sprague-Dawley-Ratten wurde Acarbose durch tägliche postprandiale Schlundsonde verabreicht, um die pharmakologischen Wirkungen des Arzneimittels zu vermeiden. In beiden Studien trat die in den ursprünglichen Studien festgestellte erhöhte Inzidenz von Nierentumoren nicht auf. Acarbose wurde in zwei getrennten Studien an Wistar-Ratten auch über das Futter und postprandial verabreicht. In keiner dieser Studien an Wistar-Ratten wurde eine erhöhte Inzidenz von Nierentumoren festgestellt. In zwei Fütterungsstudien an Hamstern mit und ohne Glucose-Supplementierung ergaben sich ebenfalls keine Hinweise auf Kanzerogenität.
Acarbose induzierte in vitro im CHO-Chromosomenaberrationstest, bakteriellen Mutagenesetest (Ames) oder DNA-Bindungstest keine DNA-Schäden. In vivo wurden im Dominant-Letal-Test bei männlichen Mäusen und im Maus-Mikronukleus-Test keine DNA-Schäden festgestellt.
Fertilitätsstudien, die an Ratten nach oraler Verabreichung durchgeführt wurden, zeigten keine nachteiligen Auswirkungen auf die Fertilität oder die Gesamtreproduktionsfähigkeit.
Schwangerschaft
Teratogene Wirkungen: Schwangerschaftskategorie B.
Die Sicherheit von PRECOSE bei schwangeren Frauen wurde nicht nachgewiesen. Reproduktionsstudien wurden an Ratten in Dosen von bis zu 480 mg/kg (entsprechend der 9-fachen Exposition beim Menschen, basierend auf den Blutspiegeln des Arzneimittels) durchgeführt und ergaben keine Hinweise auf eine Beeinträchtigung der Fertilität oder eine Schädigung des Fötus aufgrund von Acarbose. Bei Kaninchen könnte eine verringerte Körpergewichtszunahme des Muttertiers, wahrscheinlich das Ergebnis der pharmakodynamischen Wirkung hoher Dosen von Acarbose im Darm, für einen leichten Anstieg der Zahl der embryonalen Verluste verantwortlich gewesen sein. Kaninchen, denen 160 mg/kg Acarbose (entsprechend der 10-fachen Dosis beim Menschen, bezogen auf die Körperoberfläche) verabreicht wurden, zeigten jedoch keine Hinweise auf Embryotoxizität und es gab keine Hinweise auf Teratogenität bei einer Dosis, die der 32-fachen Dosis beim Menschen (bezogen auf die Körperoberfläche) entsprach Oberfläche). Es gibt jedoch keine ausreichenden und gut kontrollierten Studien zu PRECOSE 25 mg bei Schwangeren. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist. Da aktuelle Informationen stark darauf hindeuten, dass anormale Blutzuckerwerte während der Schwangerschaft mit einer höheren Inzidenz angeborener Anomalien sowie einer erhöhten neonatalen Morbidität und Mortalität einhergehen, empfehlen die meisten Experten, während der Schwangerschaft Insulin zu verwenden, um den Blutzuckerspiegel so nah wie möglich am Normalwert zu halten .
Stillende Mutter
In der Milch säugender Ratten wurde nach Verabreichung von radioaktiv markierter Acarbose eine geringe Menge Radioaktivität gefunden. Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, sollte PRECOSE 25 mg einer stillenden Frau nicht verabreicht werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von PRECOSE 25 mg bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Von der Gesamtzahl der Teilnehmer an klinischen Studien mit PRECOSE 25 mg in den Vereinigten Staaten waren 27 % 65 Jahre und älter, während 4 % 75 Jahre und älter waren. Insgesamt wurden keine Unterschiede in Sicherheit und Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet. Die mittlere Steady-State-Fläche unter der Kurve (AUC) und die maximalen Konzentrationen von Acarbose waren bei älteren Probanden etwa 1,5-mal höher als bei jungen Probanden; diese Unterschiede waren jedoch statistisch nicht signifikant.
ÜBERDOSIS
Im Gegensatz zu Sulfonylharnstoffen oder Insulin führt eine Überdosierung von PRECOSE nicht zu einer Hypoglykämie. Eine Überdosierung kann zu einer vorübergehenden Zunahme von Blähungen, Durchfall und Bauchbeschwerden führen, die kurzzeitig abklingen. Im Falle einer Überdosierung sollten dem Patienten für die nächsten 4–6 Stunden keine Getränke oder Mahlzeiten verabreicht werden, die Kohlenhydrate (Polysaccharide, Oligosaccharide und Disaccharide) enthalten.
KONTRAINDIKATIONEN
PRECOSE 25 mg ist bei Patienten mit bekannter Überempfindlichkeit gegen das Medikament kontraindiziert. Precose 25 mg ist bei Patienten mit diabetischer Ketoazidose oder Zirrhose kontraindiziert. PRECOSE 25 mg ist auch kontraindiziert bei Patienten mit entzündlichen Darmerkrankungen, Dickdarmgeschwüren, partiellem Darmverschluss oder bei Patienten, die für Darmverschluss prädisponiert sind. Darüber hinaus ist PRECOSE kontraindiziert bei Patienten mit chronischen Darmerkrankungen, die mit ausgeprägten Verdauungs- oder Resorptionsstörungen einhergehen, sowie bei Patienten, deren Zustand sich durch eine verstärkte Gasbildung im Darm verschlechtern kann.
KLINISCHE PHARMAKOLOGIE
Acarbose ist ein komplexes Oligosaccharid, das die Verdauung aufgenommener Kohlenhydrate verzögert und dadurch zu einem geringeren Anstieg der Blutzuckerkonzentration nach den Mahlzeiten führt. Als Folge der Senkung des Plasmaglukosespiegels senkt PRECOSE die Spiegel von glykosyliertem Hämoglobin bei Patienten mit Typ-2-Diabetes mellitus. Die systemische nicht-enzymatische Proteinglykosylierung, die sich in den Spiegeln des glykosylierten Hämoglobins widerspiegelt, ist eine Funktion der durchschnittlichen Blutglukosekonzentration über die Zeit.
Wirkmechanismus
Im Gegensatz zu Sulfonylharnstoffen verstärkt PRECOSE 50 mg die Insulinsekretion nicht. Die antihyperglykämische Wirkung von Acarbose resultiert aus einer kompetitiven, reversiblen Hemmung der Pankreas-Alpha-Amylase und der membrangebundenen Darm-Alpha-Glucosid-Hydrolase-Enzyme. Pankreatische Alpha-Amylase hydrolysiert komplexe Stärken zu Oligosacchariden im Lumen des Dünndarms, während die membrangebundenen intestinalen Alpha-Glucosidasen Oligosaccharide, Trisaccharide und Disaccharide zu Glucose und anderen Monosacchariden im Bürstensaum des Dünndarms hydrolysieren. Bei Diabetikern führt diese Enzymhemmung zu einer verzögerten Glukoseaufnahme und einer Senkung der postprandialen Hyperglykämie.
Da der Wirkmechanismus unterschiedlich ist, ist die Wirkung von PRECOSE zur Verbesserung der glykämischen Kontrolle additiv zu der von Sulfonylharnstoffen, Insulin oder Metformin, wenn sie in Kombination verwendet werden. Darüber hinaus vermindert PRECOSE 50 mg die insulinotrope und gewichtssteigernde Wirkung von Sulfonylharnstoffen.
Acarbose hat keine inhibitorische Aktivität gegenüber Laktase und es ist daher nicht zu erwarten, dass es eine Laktoseintoleranz auslöst.
Pharmakokinetik
Absorption
In einer Studie mit 6 gesunden Männern wurden weniger als 2 % einer oralen Dosis Acarbose als aktives Arzneimittel resorbiert, während ungefähr 35 % der gesamten Radioaktivität einer 14C-markierten oralen Dosis resorbiert wurden. Durchschnittlich 51 % einer oralen Dosis wurden innerhalb von 96 Stunden nach der Einnahme als nicht absorbierte arzneimittelbedingte Radioaktivität mit dem Stuhl ausgeschieden. Da Acarbose lokal im Gastrointestinaltrakt wirkt, ist diese geringe systemische Bioverfügbarkeit der Mutterverbindung therapeutisch erwünscht. Nach oraler Verabreichung von 14C-markierter Acarbose an gesunde Probanden wurden die maximalen Plasmakonzentrationen der Radioaktivität 14–24 Stunden nach der Verabreichung erreicht, während die maximalen Plasmakonzentrationen des Wirkstoffs nach etwa 1 Stunde erreicht wurden. Die verzögerte Absorption von Acarbose-bezogener Radioaktivität spiegelt die Absorption von Metaboliten wider, die entweder durch Darmbakterien oder durch intestinale enzymatische Hydrolyse gebildet werden können.
Stoffwechsel
Acarbose wird ausschließlich im Magen-Darm-Trakt hauptsächlich durch Darmbakterien, aber auch durch Verdauungsenzyme verstoffwechselt. Ein Teil dieser Metaboliten (ca. 34 % der Dosis) wurde resorbiert und anschließend mit dem Urin ausgeschieden. Mindestens 13 Metaboliten wurden chromatographisch aus Urinproben getrennt. Die Hauptmetaboliten wurden als 4-Methylpyrogallol-Derivate (d. h. Sulfat-, Methyl- und Glucuronid-Konjugate) identifiziert. Ein Metabolit (gebildet durch Spaltung eines Glucosemoleküls aus Acarbose) hat auch eine alpha-Glucosidase-hemmende Aktivität. Dieser Metabolit macht zusammen mit der aus dem Urin wiedergefundenen Ausgangsverbindung weniger als 2 % der verabreichten Gesamtdosis aus.
Ausscheidung
Der Anteil an Acarbose, der als intakter Wirkstoff resorbiert wird, wird fast vollständig über die Nieren ausgeschieden. Bei intravenöser Gabe von Acarbose wurden 89 % der Dosis innerhalb von 48 Stunden als Wirkstoff im Urin wiedergefunden. Im Gegensatz dazu wurden weniger als 2 % einer oralen Dosis als Wirkstoff (d. h. Muttersubstanz und aktiver Metabolit) im Urin wiedergefunden. Dies steht im Einklang mit der geringen Bioverfügbarkeit des Ausgangsarzneimittels. Die Plasmaeliminationshalbwertszeit der Acarboseaktivität beträgt bei gesunden Probanden etwa 2 Stunden. Folglich tritt bei oraler Gabe dreimal täglich (tid) keine Arzneimittelakkumulation auf.
Besondere Populationen
Die mittlere Steady-State-Fläche unter der Kurve (AUC) und die maximalen Konzentrationen von Acarbose waren bei älteren Probanden etwa 1,5-mal höher als bei jungen Probanden; diese Unterschiede waren jedoch statistisch nicht signifikant. Patienten mit schwerer Nierenfunktionsstörung (Clcr
Arzneimittelwechselwirkungen
Studien an gesunden Probanden haben gezeigt, dass PRECOSE weder die Pharmakokinetik noch die Pharmakodynamik von Nifedipin, Propranolol oder Ranitidin beeinflusst. PRECOSE beeinflusste die Resorption oder Disposition des Sulfonylharnstoffglyburids bei Diabetikern nicht. PRECOSE kann die Bioverfügbarkeit von Digoxin beeinflussen und kann eine Dosisanpassung von Digoxin um 16 % (90 % Konfidenzintervall: 8–23 %) erfordern, die mittlere Cmax von Digoxin um 26 % (90 % Konfidenzintervall: 16–34 %) und den mittleren Talwert verringern Konzentrationen von Digoxin um 9 % (90 % Konfidenzgrenze: 19 % Abnahme bis 2 % Zunahme). (Sehen VORSICHTSMASSNAHMEN: WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN .)
Die während der Einnahme von PRECOSE resorbierte Metforminmenge war bioäquivalent zu der unter Placebo resorbierten Menge, wie durch die Plasma-AUC-Werte angezeigt. Der Spitzenplasmaspiegel von Metformin war jedoch bei der Einnahme von PRECOSE aufgrund einer leichten Verzögerung der Resorption von Metformin um etwa 20 % reduziert. Es gibt kaum oder gar keine klinisch signifikante Wechselwirkung zwischen PRECOSE und Metformin.
Klinische Versuche
Klinische Erfahrung aus Dosisfindungsstudien bei Patienten mit Typ-2-Diabetes mellitus, die nur diätetisch behandelt werden
Die Ergebnisse aus sechs kontrollierten Monotherapiestudien mit fester Dosis von PRECOSE bei der Behandlung von Typ-2-Diabetes mellitus, an denen 769 mit PRECOSE behandelte Patienten teilnahmen, wurden kombiniert und ein gewichteter Durchschnitt der Differenz zu Placebo in der mittleren Veränderung des glykosylierten Hämoglobins gegenüber dem Ausgangswert ( HbA1c) wurde für jede Dosisstufe wie folgt berechnet:
Obwohl in Studien eine Höchstdosis von 200 oder 300 mg dreimal täglich verwendet wurde, beträgt die empfohlene Höchstdosis für Patienten 60 kg beträgt 100 mg 3-mal täglich
Die Ergebnisse aus diesen sechs Monotherapiestudien mit fester Dosierung wurden ebenfalls kombiniert, um einen gewichteten Durchschnitt der Differenz zu Placebo in der mittleren Änderung der postprandialen Plasmaglukosespiegel nach einer Stunde gegenüber dem Ausgangswert abzuleiten, wie in der folgenden Abbildung dargestellt:
Abbildung 1 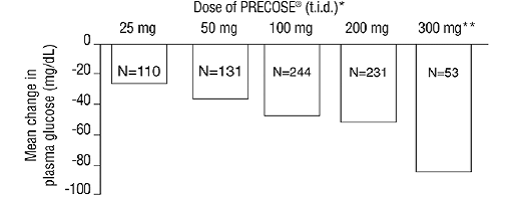
* PRECOSE 50 mg unterschied sich bei allen Dosierungen statistisch signifikant von Placebo in Bezug auf die Wirkung auf die postprandiale Plasmaglukose nach einer Stunde. ** Das Behandlungsschema mit 300 mg dreimal täglich PRECOSE 50 mg war niedrigeren Dosen überlegen, aber es gab keine statistisch signifikanten Unterschiede zwischen 50 und 200 mg dreimal täglich
Klinische Erfahrung bei Patienten mit Diabetes mellitus Typ 2 unter Monotherapie oder in Kombination mit Sulfonylharnstoffen, Metformin oder Insulin
PRECOSE wurde als Monotherapie und als Kombinationstherapie mit einer Sulfonylharnstoff-, Metformin- oder Insulinbehandlung untersucht. Die Behandlungseffekte auf die HbA1c-Spiegel und die postprandialen Glukosespiegel nach einer Stunde sind für vier placebokontrollierte, doppelblinde, randomisierte Studien, die in den Vereinigten Staaten durchgeführt wurden, in den Tabellen 2 bzw. 3 zusammengefasst. Die Behandlungsunterschiede, die um Placebo abgezogen werden und unten zusammengefasst sind, waren in allen diesen Studien für beide Variablen statistisch signifikant.
An Studie 1 (n=109) nahmen Patienten teil, die nur eine Hintergrundbehandlung mit Diät erhielten. Die mittlere Wirkung der Zugabe von PRECOSE zur Diättherapie war eine Veränderung des HbA1c um -0,78 % und eine Verbesserung des postprandialen Glukosespiegels nach einer Stunde um -74,4 mg/dl.
In Studie 2 (n = 137) war die mittlere Wirkung der Zugabe von PRECOSE 25 mg zur Sulfonylharnstoff-Maximaltherapie eine Veränderung des HbA1c um -0,54 % und eine Verbesserung des postprandialen Glukosespiegels nach einer Stunde um -33,5 mg/dl.
In Studie 3 (n = 147) war die mittlere Wirkung der Zugabe von PRECOSE 50 mg zur maximalen Metformintherapie eine Veränderung des HbA1c um -0,65 % und eine Verbesserung des postprandialen Glukosespiegels nach einer Stunde um -34,3 mg/dl.
Studie 4 (n = 145) zeigte, dass PRECOSE bei Patienten unter Hintergrundbehandlung mit Insulin zu einer mittleren Veränderung des HbA1c von -0,69 % und einer Verbesserung des postprandialen Glukosewerts von -36,0 mg/dl nach einer Stunde führte.
In Kanada wurde eine einjährige Studie mit PRECOSE als Monotherapie oder in Kombination mit einer Sulfonylharnstoff-, Metformin- oder Insulinbehandlung durchgeführt, in die 316 Patienten in die primäre Wirksamkeitsanalyse eingeschlossen wurden (Abbildung 2). In den Diät-, Sulfonylharnstoff- und Metformingruppen war die mittlere Abnahme des HbA1c, die durch die Zugabe von PRECOSE 50 mg hervorgerufen wurde, nach sechs Monaten statistisch signifikant, und dieser Effekt hielt nach einem Jahr an. Bei den mit PRECOSE behandelten Patienten unter Insulin zeigte sich eine statistisch signifikante Senkung des HbA1c nach sechs Monaten und eine Tendenz zu einer Senkung nach einem Jahr.
Figur 2 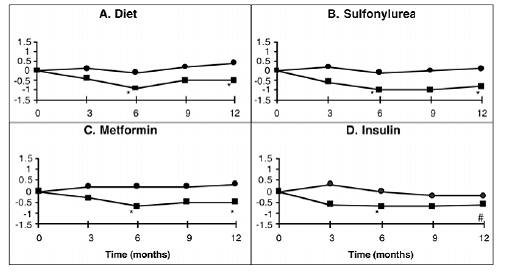
Figur 2: Wirkungen von PRECOSE (III) und Placebo (III) auf die mittlere Veränderung der HbA1c-Spiegel gegenüber dem Ausgangswert während einer einjährigen Studie bei Patienten mit Typ-2-Diabetes mellitus bei Anwendung in Kombination mit: (A) Diät allein; (B) Sulfonylharnstoff; (C) Metformin; oder (D) Insulin. Behandlungsunterschiede nach 6 und 12 Monaten wurden getestet: * p
INFORMATIONEN ZUM PATIENTEN
Die Patienten sollten angewiesen werden, PRECOSE 50 mg dreimal täglich zu Beginn (mit dem ersten Bissen) jeder Hauptmahlzeit einzunehmen. Es ist wichtig, dass sich die Patienten weiterhin an die Ernährungsanweisungen, ein regelmäßiges Trainingsprogramm und regelmäßige Urin- und/oder Blutzuckertests halten.
PRECOSE selbst verursacht keine Hypoglykämie, selbst wenn es Patienten im nüchternen Zustand verabreicht wird. Sulfonylharnstoffe und Insulin können jedoch den Blutzuckerspiegel ausreichend senken, um Symptome oder manchmal lebensbedrohliche Hypoglykämien zu verursachen. Da PRECOSE in Kombination mit einem Sulfonylharnstoff oder Insulin eine weitere Senkung des Blutzuckers bewirkt, kann es das hypoglykämische Potenzial dieser Wirkstoffe erhöhen. Hypoglykämie tritt bei Patienten, die Metformin allein erhalten, unter normalen Anwendungsbedingungen nicht auf, und bei Patienten, die PRECOSE zusätzlich zur Metformin-Therapie erhielten, wurde keine erhöhte Inzidenz von Hypoglykämien beobachtet. Das Risiko einer Hypoglykämie, ihre Symptome und Behandlung sowie die Bedingungen, die für ihre Entwicklung prädisponieren, sollten von Patienten und verantwortlichen Familienmitgliedern gut verstanden werden. Da PRECOSE 50 mg den Abbau von Haushaltszucker verhindert, sollten Patienten eine leicht verfügbare Glucosequelle (Dextrose, D-Glucose) zur Verfügung haben, um die Symptome eines niedrigen Blutzuckers zu behandeln, wenn sie PRECOSE in Kombination mit einem Sulfonylharnstoff oder Insulin einnehmen.
Wenn unter PRECOSE Nebenwirkungen auftreten, treten diese normalerweise in den ersten Behandlungswochen auf. Am häufigsten handelt es sich um leichte bis mittelschwere gastrointestinale Wirkungen wie Blähungen, Durchfall oder Bauchbeschwerden, die im Allgemeinen mit der Zeit an Häufigkeit und Intensität abnehmen.