Glucovance 400/2.50mg, 500/5mg Metformin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Glucovance 2,50 mg und wie wird es angewendet?
Glucovance 400 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Diabetes mellitus Typ 2. Glucovance kann allein oder zusammen mit anderen Medikamenten verwendet werden.
Glucovance gehört zu einer Klasse von Arzneimitteln, die als Antidiabetika, Sulfonylharnstoffe/Biguanide bezeichnet werden.
Es ist nicht bekannt, ob Glucovance 2,50 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Glucovance 400 mg haben?
Glucovance kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Glucovance gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Glucovance. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
GLUCOVANCE® (Glyburide and Metformin HCl) Tablets enthalten 2 orale Antihyperglykämika, die zur Behandlung von Typ-2-Diabetes verwendet werden, Glyburide und Metforminhydrochlorid.
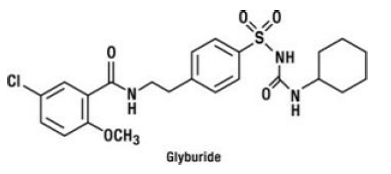
Glyburid ist ein orales Antihyperglykämikum aus der Klasse der Sulfonylharnstoffe. Der chemische Name für Glyburid ist 1-[[p-[2-(5-Chlor-o-anisamido)ethyl]phenyl]sulfonyl]-3-cyclohexylharnstoff. Glyburid ist eine weiße bis cremefarbene kristalline Verbindung mit der Summenformel C23H28ClN3O5S und einem Molekulargewicht von 494,01. Das in GLUCOVANCE 5 mg verwendete Glyburid hat eine Partikelgrößenverteilung von 25 % Untergrößenwert von nicht mehr als 6 μm, 50 % Untergrößenwert von nicht mehr als 7 bis 10 μm und 75 % Untergrößenwert von nicht mehr als 21 μm. Die Strukturformel ist unten dargestellt.
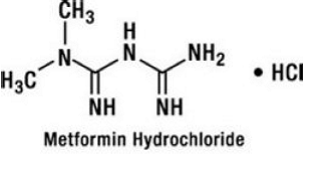
Metforminhydrochlorid ist ein orales Antihyperglykämikum, das zur Behandlung von Typ-2-Diabetes verwendet wird. Metforminhydrochlorid (N,N-Dimethylimidodicarbonimiddiamid-Monohydrochlorid) ist chemisch oder pharmakologisch nicht mit Sulfonylharnstoffen, Thiazolidindionen oder α-Glucosidase-Inhibitoren verwandt. Es ist eine weiße bis cremefarbene kristalline Verbindung mit der Summenformel C4H12ClN5 (Monohydrochlorid) und einem Molekulargewicht von 165,63. Metforminhydrochlorid ist in Wasser frei löslich und in Aceton, Ether und Chloroform praktisch unlöslich. Der pKa-Wert von Metformin beträgt 12,4. Der pH-Wert einer 1%igen wässrigen Lösung von Metforminhydrochlorid beträgt 6,68. Die Strukturformel lautet wie folgt:
GLUCOVANCE 500 mg ist zur oralen Verabreichung in Tabletten mit 1,25 mg Glyburid mit 250 mg Metforminhydrochlorid, 2,5 mg Glyburid mit 500 mg Metforminhydrochlorid und 5 mg Glyburid mit 500 mg Metforminhydrochlorid erhältlich. Darüber hinaus enthält jede Tablette die folgenden Hilfsstoffe: mikrokristalline Zellulose, Povidon, Croscarmellose-Natrium und Magnesiumstearat. Die Tabletten sind filmbeschichtet, was für eine farbliche Unterscheidung sorgt.
INDIKATIONEN
GLUCOVANCE (Glyburid und Metformin HCl) Tabletten sind als Ergänzung zu Diät und Bewegung indiziert, um die Blutzuckerkontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus zu verbessern.
DOSIERUNG UND ANWENDUNG
allgemeine Überlegungen
Die Dosierung von GLUCOVANCE muss auf der Grundlage sowohl der Wirksamkeit als auch der Verträglichkeit individuell angepasst werden, darf jedoch die maximal empfohlene Tagesdosis von 20 mg Glyburid/2000 mg Metformin nicht überschreiten. GLUCOVANCE sollte zu den Mahlzeiten verabreicht werden und sollte mit einer niedrigen Dosis begonnen werden, mit allmählicher Dosissteigerung wie unten beschrieben, um Hypoglykämie (hauptsächlich aufgrund von Glyburid) zu vermeiden, gastrointestinale Nebenwirkungen (hauptsächlich aufgrund von Metformin) zu reduzieren und die Bestimmung von zu ermöglichen die minimale wirksame Dosis für eine angemessene Kontrolle des Blutzuckers für den einzelnen Patienten.
Bei der Erstbehandlung und während der Dosistitration sollte eine angemessene Blutzuckerüberwachung durchgeführt werden, um das therapeutische Ansprechen auf GLUCOVANCE 2,50 mg zu bestimmen und die minimal wirksame Dosis für den Patienten zu ermitteln. Danach sollte der HbA1c in Abständen von etwa 3 Monaten gemessen werden, um die Wirksamkeit der Therapie zu beurteilen. Das therapeutische Ziel bei allen Patienten mit Typ-2-Diabetes ist es, FPG, PPG und HbA1c auf den Normalwert oder so nahe wie möglich zu senken. Idealerweise sollte das Ansprechen auf die Therapie anhand von HbA (glykosyliertem Hämoglobin) bewertet werden, das ein besserer Indikator für die langfristige glykämische Kontrolle ist als FPG allein.
Es wurden keine Studien durchgeführt, die speziell die Sicherheit und Wirksamkeit einer Umstellung auf eine Therapie mit GLUCOVANCE 400 mg bei Patienten untersuchten, die gleichzeitig Glyburid (oder einen anderen Sulfonylharnstoff) plus Metformin einnahmen. Bei solchen Patienten können Veränderungen der glykämischen Kontrolle auftreten, wobei entweder eine Hyperglykämie oder eine Hypoglykämie möglich ist. Jede Änderung der Therapie des Typ-2-Diabetes sollte mit Vorsicht und angemessener Überwachung vorgenommen werden.
GLUCOVANCE bei Patienten mit unzureichender glykämischer Kontrolle durch Ernährung und Bewegung
Empfohlene Anfangsdosis: 1,25 mg/250 mg ein- oder zweimal täglich zu den Mahlzeiten.
Bei Patienten mit Typ-2-Diabetes, deren Hyperglykämie allein durch Diät und Bewegung nicht zufriedenstellend behandelt werden kann, beträgt die empfohlene Anfangsdosis von GLUCOVANCE 400 mg 1,25 mg/250 mg einmal täglich zu einer Mahlzeit. Als Anfangstherapie bei Patienten mit einem Ausgangs-HbA1c > 9 % oder einem FPG > 200 mg/dl kann eine Anfangsdosis von GLUCOVANCE 1,25 mg/250 mg zweimal täglich mit den Mahlzeiten morgens und abends angewendet werden. Dosiserhöhungen sollten in Schritten von 1,25 mg/250 mg pro Tag alle 2 Wochen bis zu der wirksamen Mindestdosis erfolgen, die erforderlich ist, um eine angemessene Kontrolle des Blutzuckers zu erreichen. In klinischen Studien mit GLUCOVANCE als Anfangstherapie gab es keine Erfahrungen mit Tagesgesamtdosen > 10 mg/2000 mg pro Tag. GLUCOVANCE 5 mg/500 mg sollte aufgrund eines erhöhten Hypoglykämierisikos nicht als Initialtherapie angewendet werden.
GLUCOVANCE 500 mg Anwendung bei Patienten mit unzureichender glykämischer Kontrolle unter Sulfonylharnstoff und/oder Metformin
Empfohlene Anfangsdosis: 2,5 mg/500 mg oder 5 mg/500 mg zweimal täglich zu den Mahlzeiten.
Bei Patienten, die weder mit Glyburid (oder einem anderen Sulfonylharnstoff) noch mit Metformin allein ausreichend eingestellt sind, beträgt die empfohlene Anfangsdosis von GLUCOVANCE 2,5 mg/500 mg oder 5 mg/500 mg zweimal täglich zu den Mahlzeiten morgens und abends. Um eine Hypoglykämie zu vermeiden, sollte die Anfangsdosis von GLUCOVANCE 2,50 mg die bereits eingenommene Tagesdosis von Glyburid oder Metformin nicht überschreiten. Die Tagesdosis sollte in Schritten von nicht mehr als 5 mg/500 mg bis zur wirksamen Mindestdosis titriert werden, um eine angemessene Kontrolle des Blutzuckers zu erreichen, oder bis zu einer Höchstdosis von 20 mg/2000 mg pro Tag.
Bei Patienten, die zuvor mit einer Kombinationstherapie aus Glyburid (oder einem anderen Sulfonylharnstoff) plus Metformin behandelt wurden, sollte die Anfangsdosis bei Umstellung auf GLUCOVANCE die bereits eingenommene Tagesdosis von Glyburid (oder einer äquivalenten Dosis eines anderen Sulfonylharnstoffs) und Metformin nicht überschreiten. Die Patienten sollten nach einer solchen Umstellung engmaschig auf Anzeichen und Symptome einer Hypoglykämie überwacht werden, und die Dosis von GLUCOVANCE sollte wie oben beschrieben titriert werden, um eine angemessene Kontrolle des Blutzuckers zu erreichen.
Zusatz von Thiazolidindionen zur GLUCOVANCE-Therapie
Bei Patienten, die mit GLUCOVANCE nicht ausreichend eingestellt werden können, kann der Therapie mit GLUCOVANCE 400 mg ein Thiazolidindion hinzugefügt werden. Wenn ein Thiazolidindion zur GLUCOVANCE-Therapie hinzugefügt wird, kann die aktuelle Dosis von GLUCOVANCE 500 mg fortgesetzt und die Behandlung mit Thiazolidindion in der empfohlenen Anfangsdosis begonnen werden. Bei Patienten, die eine zusätzliche glykämische Kontrolle benötigen, kann die Thiazolidindion-Dosis entsprechend dem empfohlenen Titrationsschema erhöht werden. Die mit GLUCOVANCE plus einem Thiazolidindion erreichbare verbesserte glykämische Kontrolle kann das Risiko einer Hypoglykämie zu jeder Tageszeit erhöhen. Bei Patienten, die während der Behandlung mit GLUCOVANCE 5 mg und einem Thiazolidindion eine Hypoglykämie entwickeln, sollte eine Verringerung der Dosis der Glyburid-Komponente von GLUCOVANCE in Betracht gezogen werden. Wenn klinisch gerechtfertigt, sollte auch eine Anpassung der Dosierungen der anderen Komponenten des antidiabetischen Regimes in Betracht gezogen werden.
Patienten, die Colesevelam erhalten
Bei gleichzeitiger Anwendung von Colesevelam und Glyburid sind die maximale Plasmakonzentration und die Gesamtexposition gegenüber Glyburid verringert. Daher sollte GLUCOVANCE mindestens 4 Stunden vor Colesevelam verabreicht werden.
Spezifische Patientenpopulationen
GLUCOVANCE wird für die Anwendung während der Schwangerschaft nicht empfohlen. Die Anfangs- und Erhaltungsdosis von GLUCOVANCE sollte bei Patienten im fortgeschrittenen Alter konservativ sein, da bei dieser Population die Möglichkeit einer verminderten Nierenfunktion besteht. Jede Dosisanpassung erfordert eine sorgfältige Beurteilung der Nierenfunktion. Im Allgemeinen sollten ältere, geschwächte und unterernährte Patienten nicht auf die maximale Dosis von GLUCOVANCE titriert werden, um das Risiko einer Hypoglykämie zu vermeiden. Die Überwachung der Nierenfunktion ist erforderlich, um eine Metformin-assoziierte Laktatazidose zu verhindern, insbesondere bei älteren Patienten. (Sehen WARNUNGEN .)
WIE GELIEFERT
GLUCOVANCE® (Glyburid und Metformin HCl) Tabletten
GLUKOVANCE 1,25 mg/250 mg Tablette ist eine blassgelbe, kapselförmige, bikonvexe Filmtablette mit abgeschrägten Kanten und dem Zusatz „ BMS „ Prägung auf einer Seite und „ 6072 ” Prägung auf der gegenüberliegenden Seite.
GLUKOVANCE 2,5 mg/500 mg Tablette ist eine hellorange, kapselförmige, bikonvexe Filmtablette mit abgeschrägten Kanten und dem Zusatz „ BMS „ Prägung auf einer Seite und „ 6073 ” Prägung auf der gegenüberliegenden Seite.
GLUCOVANCE 5 mg/500 mg Tablette ist eine gelbe, kapselförmige, bikonvexe Filmtablette mit abgeschrägten Kanten und dem Zusatz „ BMS „ Prägung auf einer Seite und „ 6074 ” Prägung auf der gegenüberliegenden Seite.
Lagerung
Bei Temperaturen bis zu 25 °C (77 °F) lagern. [Sehen USP kontrollierte Raumtemperatur .]
In lichtbeständige Behälter füllen.
Vertrieb durch: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Rev. Okt. 2013
NEBENWIRKUNGEN
GLUKOVANCE
In doppelblinden klinischen Studien mit GLUCOVANCE 2,50 mg als Initialtherapie oder als Zweitlinientherapie erhielten insgesamt 642 Patienten GLUCOVANCE 2,50 mg, 312 eine Metformintherapie, 324 eine Glyburidtherapie und 161 ein Placebo. Der Prozentsatz der Patienten, die über Ereignisse und Arten von unerwünschten Ereignissen berichteten, die in klinischen Studien mit GLUCOVANCE (alle Stärken) als Initialtherapie und Zweitlinientherapie berichtet wurden, sind in Tabelle 6 aufgeführt.
In einer kontrollierten klinischen Studie zu Rosiglitazon versus Placebo bei mit GLUCOVANCE behandelten Patienten (n = 365) erhielten 181 Patienten GLUCOVANCE 5 mg mit Rosiglitazon und 184 erhielten GLUCOVANCE mit Placebo.
Ödeme wurden bei 7,7 % (14/181) der mit Rosiglitazon behandelten Patienten berichtet, verglichen mit 2,2 % (4/184) der mit Placebo behandelten Patienten. Bei den mit Rosiglitazon behandelten Patienten wurde eine mittlere Gewichtszunahme von 3 kg beobachtet.
Disulfiram-ähnliche Reaktionen wurden sehr selten bei Patienten berichtet, die mit Glyburid-Tabletten behandelt wurden.
Hypoglykämie
In kontrollierten klinischen Studien mit GLUCOVANCE 5 mg traten keine hypoglykämischen Episoden auf, die einen medizinischen Eingriff und/oder eine pharmakologische Therapie erforderten; Alle Veranstaltungen wurden von den Patienten verwaltet. Die Inzidenz der berichteten Symptome einer Hypoglykämie (wie Schwindel, Zittern, Schwitzen und Hunger) in der Ersttherapiestudie mit GLUCOVANCE 2,50 mg ist in Tabelle 7 zusammengefasst. Die Häufigkeit hypoglykämischer Symptome bei Patienten, die mit GLUCOVANCE 1,25 mg/250 mg behandelt wurden war am höchsten bei Patienten mit einem Ausgangs-HbA1c 8 % vergleichbar mit Placebo und Metformin. Bei Patienten mit einem Ausgangs-HbA1c zwischen 8 % und 11 %, die mit GLUCOVANCE 2,5 mg/500 mg als Initialtherapie behandelt wurden, betrug die Häufigkeit hypoglykämischer Symptome 30 % bis 35 %. Als Zweitlinientherapie bei Patienten, die mit Sulfonylharnstoff allein unzureichend eingestellt waren, traten bei etwa 6,8 % aller mit GLUCOVANCE 2,50 mg behandelten Patienten hypoglykämische Symptome auf. Wenn Rosiglitazon zusätzlich zu einer Therapie mit GLUCOVANCE 2,50 mg verabreicht wurde, berichteten 22 % der Patienten über 1 oder mehr Glukosemessungen an der Fingerbeere von ≤ 50 mg/dl, verglichen mit 3,3 % der mit Placebo behandelten Patienten. Alle hypoglykämischen Ereignisse wurden von den Patienten behandelt und nur 1 Patient brach die Behandlung wegen Hypoglykämie ab. (Sehen VORSICHTSMASSNAHMEN : Allgemein : Zusatz von Thiazolidindione zur GLUCOVANCE-Therapie .)
Magen-Darm-Reaktionen
Die Inzidenz von gastrointestinalen (GI) Nebenwirkungen (Durchfall, Übelkeit/Erbrechen und Bauchschmerzen) in der Ersttherapiestudie sind in Tabelle 7 zusammengefasst. In allen Studien mit GLUCOVANCE 500 mg waren und waren gastrointestinale Symptome die häufigsten unerwünschten Ereignisse bei GLUCOVANCE 400 mg häufiger bei höheren Dosen.
In kontrollierten Studien brachen
In Postmarketing-Berichten können selten cholestatischer Ikterus und Hepatitis auftreten, die zu Leberversagen führen können; In diesem Fall sollte GLUCOVANCE 5 mg abgesetzt werden.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
GLUKOVANCE
Bestimmte Medikamente neigen zu Hyperglykämie und können zu einem Verlust der Blutzuckerkontrolle führen. Zu diesen Medikamenten gehören Thiazide und andere Diuretika, Kortikosteroide, Phenothiazine, Schilddrüsenprodukte, Östrogene, orale Kontrazeptiva, Phenytoin, Nikotinsäure, Sympathomimetika, Kalziumkanalblocker und Isoniazid. Wenn solche Arzneimittel einem Patienten verabreicht werden, der GLUCOVANCE 400 mg erhält, sollte der Patient engmaschig auf einen Verlust der Blutzuckerkontrolle überwacht werden. Wenn einem Patienten, der GLUCOVANCE erhält, solche Arzneimittel abgesetzt werden, sollte der Patient engmaschig auf Hypoglykämie überwacht werden. Metformin wird kaum an Plasmaproteine gebunden und interagiert daher weniger wahrscheinlich mit stark proteingebundenen Arzneimitteln wie Salicylaten, Sulfonamiden, Chloramphenicol und Probenecid im Vergleich zu Sulfonylharnstoffen, die stark an Serumproteine gebunden sind.
Glyburid
Die hypoglykämische Wirkung von Sulfonylharnstoffen kann durch bestimmte Medikamente verstärkt werden, darunter nichtsteroidale Antirheumatika und andere stark proteingebundene Medikamente, Salicylate, Sulfonamide, Chloramphenicol, Probenecid, Cumarine, Monoaminooxidase-Hemmer und Betablocker. Wenn solche Arzneimittel einem Patienten verabreicht werden, der GLUCOVANCE erhält, sollte der Patient engmaschig auf Hypoglykämie überwacht werden. Wenn einem Patienten, der GLUCOVANCE 2,50 mg erhält, solche Arzneimittel abgesetzt werden, sollte der Patient engmaschig auf einen Verlust der Blutzuckerkontrolle überwacht werden.
Bei Patienten, die Glyburid gleichzeitig mit Bosentan erhielten, wurde ein erhöhtes Risiko für Leberenzymerhöhungen beobachtet. Daher ist die gleichzeitige Anwendung von GLUCOVANCE und Bosentan kontraindiziert.
Es wurde über eine mögliche Wechselwirkung zwischen Glyburid und Ciprofloxacin, einem Fluorchinolon-Antibiotikum, berichtet, die zu einer Potenzierung der hypoglykämischen Wirkung von Glyburid führt. Der Mechanismus für diese Wechselwirkung ist nicht bekannt.
Es wurde über eine mögliche Wechselwirkung zwischen oralem Miconazol und oralen Antidiabetika berichtet, die zu einer schweren Hypoglykämie führen kann. Ob diese Wechselwirkung auch bei intravenösen, topischen oder vaginalen Zubereitungen von Miconazol auftritt, ist nicht bekannt.
Colesevelam: Die gleichzeitige Anwendung von Colesevelam und Glyburid führte zu einer Verringerung der AUC und Cmax von Glyburid um 32 % bzw. 47 %. Die Verringerung der AUC und Cmax von Glyburid betrug 20 % bzw. 15 % bei Verabreichung 1 Stunde vor Colesevelam und keine signifikante Veränderung (-7 % bzw. 4 %) bei Verabreichung 4 Stunden vor Colesevelam.
Metforminhydrochlorid
Furosemid
Eine Einzeldosis-Metformin-Furosemid-Arzneimittelwechselwirkungsstudie an gesunden Probanden zeigte, dass die pharmakokinetischen Parameter beider Verbindungen durch die gleichzeitige Verabreichung beeinflusst wurden. Furosemid erhöhte die Plasma- und Blut-Cmax von Metformin um 22 % und die AUC im Blut um 15 %, ohne dass es zu einer signifikanten Veränderung der renalen Clearance von Metformin kam. Bei Verabreichung mit Metformin waren Cmax und AUC von Furosemid um 31 % bzw. 12 % kleiner als bei alleiniger Verabreichung, und die terminale Halbwertszeit war um 32 % verringert, ohne dass es zu einer signifikanten Veränderung der renalen Clearance von Furosemid kam. Über die Wechselwirkung von Metformin und Furosemid bei gleichzeitiger chronischer Gabe liegen keine Informationen vor.
Nifedipin
Eine Wechselwirkungsstudie mit Einzeldosis Metformin und Nifedipin an gesunden Probanden zeigte, dass die gleichzeitige Verabreichung von Nifedipin die Cmax und AUC von Metformin im Plasma um 20 % bzw. 9 % erhöhte und die im Urin ausgeschiedene Menge erhöhte. Tmax und Halbwertszeit wurden nicht beeinflusst. Nifedipin scheint die Resorption von Metformin zu verstärken. Metformin hatte minimale Auswirkungen auf Nifedipin.
Kationische Medikamente
Kationische Arzneimittel (z. B. Amilorid, Digoxin, Morphin, Procainamid, Chinidin, Chinin, Ranitidin, Triamteren, Trimethoprim oder Vancomycin), die durch renale tubuläre Sekretion eliminiert werden, haben theoretisch das Potenzial für eine Wechselwirkung mit Metformin, indem sie um gemeinsame renale tubuläre Transportsysteme konkurrieren. Eine solche Wechselwirkung zwischen Metformin und oralem Cimetidin wurde bei gesunden Probanden sowohl in Metformin-Cimetidin-Arzneimittelwechselwirkungsstudien mit Einzel- als auch Mehrfachdosis beobachtet, mit einem 60 %igen Anstieg der maximalen Plasma- und Vollblutkonzentrationen von Metformin und einem 40 %igen Anstieg des Plasmas und Vollblut-Metformin-AUC. In der Einzeldosisstudie gab es keine Veränderung der Eliminationshalbwertszeit. Metformin hatte keinen Einfluss auf die Pharmakokinetik von Cimetidin. Obwohl solche Wechselwirkungen theoretisch bleiben (mit Ausnahme von Cimetidin), wird eine sorgfältige Patientenüberwachung und Dosisanpassung von GLUCOVANCE und/oder des interferierenden Arzneimittels bei Patienten empfohlen, die kationische Medikamente einnehmen, die über das proximale renale tubuläre Sekretionssystem ausgeschieden werden.
Sonstiges
Bei gesunden Probanden wurde die Pharmakokinetik von Metformin und Propranolol sowie von Metformin und Ibuprofen bei gleichzeitiger Verabreichung in Einzeldosis-Wechselwirkungsstudien nicht beeinflusst.
WARNUNGEN
Metforminhydrochlorid
Laktatazidose
Laktatazidose ist eine seltene, aber schwerwiegende metabolische Komplikation, die aufgrund einer Anhäufung von Metformin während der Behandlung mit GLUCOVANCE (Glyburide and Metformin HCl) Tabletten auftreten kann; Wenn es auftritt, ist es in etwa 50% der Fälle tödlich. Eine Laktatazidose kann auch im Zusammenhang mit einer Reihe von pathophysiologischen Zuständen, einschließlich Diabetes mellitus, und immer dann auftreten, wenn eine signifikante Minderdurchblutung und Hypoxämie des Gewebes vorliegt. Laktatazidose ist gekennzeichnet durch erhöhte Blutlaktatspiegel (> 5 mmol/l), erniedrigten Blut-pH-Wert, Elektrolytstörungen mit einer vergrößerten Anionenlücke und einem erhöhten Laktat/Pyruvat-Verhältnis. Wenn Metformin als Ursache einer Laktatazidose impliziert wird, werden im Allgemeinen Metformin-Plasmaspiegel > 5 μg/ml gefunden.
Die berichtete Inzidenz von Laktatazidose bei Patienten, die Metforminhydrochlorid erhalten, ist sehr gering (ungefähr 0,03 Fälle/1000 Patientenjahre, mit ungefähr 0,015 tödlichen Fällen/1000 Patientenjahre). In mehr als 20.000 Patientenjahren mit Metformin-Exposition in klinischen Studien gab es keine Berichte über Laktatazidose. Gemeldete Fälle traten hauptsächlich bei Diabetikern mit signifikanter Niereninsuffizienz auf, einschließlich sowohl intrinsischer Nierenerkrankung als auch renaler Hypoperfusion, häufig im Zusammenhang mit mehreren begleitenden medizinischen/chirurgischen Problemen und mehreren Begleitmedikationen. Patienten mit dekompensierter Herzinsuffizienz, die eine medikamentöse Behandlung erfordern, insbesondere solche mit instabiler oder akuter dekompensierter Herzinsuffizienz, bei denen das Risiko einer Hypoperfusion und Hypoxämie besteht, haben ein erhöhtes Risiko für eine Laktatazidose. Das Risiko einer Laktatazidose steigt mit dem Grad der Nierenfunktionsstörung und dem Alter des Patienten. Das Risiko einer Laktatazidose kann daher durch regelmäßige Überwachung der Nierenfunktion bei Patienten, die Metformin einnehmen, und durch Anwendung der minimal wirksamen Dosis von Metformin signifikant verringert werden. Insbesondere sollte die Behandlung älterer Patienten von einer sorgfältigen Überwachung der Nierenfunktion begleitet werden. Die Behandlung mit GLUCOVANCE 2,50 mg sollte bei Patienten im Alter von ≥ 80 Jahren nicht begonnen werden, es sei denn, die Messung der Kreatinin-Clearance zeigt, dass die Nierenfunktion nicht eingeschränkt ist, da diese Patienten anfälliger für die Entwicklung einer Laktatazidose sind. Darüber hinaus sollte GLUCOVANCE bei Vorliegen von Zuständen im Zusammenhang mit Hypoxämie, Dehydration oder Sepsis unverzüglich ausgesetzt werden. Da eine eingeschränkte Leberfunktion die Fähigkeit zum Abbau von Laktat erheblich einschränken kann, sollte GLUCOVANCE im Allgemeinen bei Patienten mit klinischen oder Laborwerten einer Lebererkrankung vermieden werden. Patienten sollten während der Einnahme von GLUCOVANCE 2,50 mg vor akutem oder chronischem exzessivem Alkoholkonsum gewarnt werden, da Alkohol die Wirkung von Metforminhydrochlorid auf den Laktatstoffwechsel verstärkt. Darüber hinaus sollte GLUCOVANCE 5 mg vor jeder intravaskulären Röntgenkontrastuntersuchung und vor jedem chirurgischen Eingriff vorübergehend abgesetzt werden (siehe auch VORSICHTSMASSNAHMEN).
Der Beginn einer Laktatazidose ist oft subtil und wird nur von unspezifischen Symptomen wie Unwohlsein, Myalgien, Atemnot, zunehmender Somnolenz und unspezifischen Bauchschmerzen begleitet. Es können Hypothermie, Hypotonie und resistente Bradyarrhythmien mit ausgeprägterer Azidose auftreten. Der Patient und der Arzt des Patienten müssen sich der möglichen Bedeutung solcher Symptome bewusst sein und der Patient sollte angewiesen werden, den Arzt sofort zu benachrichtigen, wenn sie auftreten (siehe auch VORSICHTSMASSNAHMEN). GLUCOVANCE 500 mg sollte abgesetzt werden, bis die Situation geklärt ist. Serumelektrolyte, Ketone, Blutglukose und, falls angezeigt, Blut-pH, Laktatspiegel und sogar Metforminspiegel im Blut können nützlich sein. Sobald sich ein Patient auf einer beliebigen Dosisstufe von GLUCOVANCE stabilisiert hat, ist es unwahrscheinlich, dass gastrointestinale Symptome, die zu Beginn einer Therapie mit Metformin auftreten, mit dem Arzneimittel in Zusammenhang stehen. Ein späteres Auftreten von gastrointestinalen Symptomen könnte auf eine Laktatazidose oder eine andere schwere Erkrankung zurückzuführen sein.
Nüchternblutspiegel im venösen Plasma über der Obergrenze des Normalbereichs, aber weniger als 5 mmol/l bei Patienten, die GLUCOVANCE einnehmen, weisen nicht unbedingt auf eine bevorstehende Laktatazidose hin und können durch andere Mechanismen erklärt werden, wie z. B. schlecht eingestellter Diabetes oder Fettleibigkeit, starke körperliche Aktivität, oder technische Probleme bei der Probenhandhabung. (Siehe auch VORSICHTSMASSNAHMEN.)
Eine Laktatazidose sollte bei jedem Diabetiker mit metabolischer Azidose ohne Anzeichen einer Ketoazidose (Ketonurie und Ketonämie) vermutet werden.
Laktatazidose ist ein medizinischer Notfall, der im Krankenhaus behandelt werden muss. Bei einem Patienten mit Laktatazidose, der GLUCOVANCE 500 mg einnimmt, sollte das Arzneimittel sofort abgesetzt und unverzüglich allgemeine unterstützende Maßnahmen eingeleitet werden. Da Metforminhydrochlorid dialysierbar ist (mit einer Clearance von bis zu 170 ml/min unter guten hämodynamischen Bedingungen), wird eine sofortige Hämodialyse empfohlen, um die Azidose zu korrigieren und angesammeltes Metformin zu entfernen. Eine solche Behandlung führt oft zu einer sofortigen Umkehrung der Symptome und Genesung. (Siehe auch GEGENANZEIGEN und VORSICHTSMASSNAHMEN.)
BESONDERE WARNUNG ZUM ERHÖHTEN RISIKO DER KARDIOVASKULÄREN MORTALITÄT
Es wurde berichtet, dass die Verabreichung oraler hypoglykämischer Arzneimittel mit einer erhöhten kardiovaskulären Sterblichkeit im Vergleich zu einer Behandlung mit einer Diät allein oder einer Diät plus Insulin verbunden ist. Diese Warnung basiert auf der vom University Group Diabetes Program (UGDP) durchgeführten Studie, einer prospektiven klinischen Langzeitstudie zur Bewertung der Wirksamkeit von blutzuckersenkenden Arzneimitteln zur Vorbeugung oder Verzögerung vaskulärer Komplikationen bei Patienten mit nicht-insulinabhängigem Diabetes. An der Studie nahmen 823 Patienten teil, die nach dem Zufallsprinzip 1 von 4 Behandlungsgruppen zugeordnet wurden (Diabetes 19 (Suppl. 2):747–830, 1970).
UGDP berichtete, dass Patienten, die 5 bis 8 Jahre lang mit einer Diät plus einer festen Dosis Tolbutamid (1,5 g pro Tag) behandelt wurden, eine etwa 2½-mal höhere kardiovaskuläre Sterblichkeitsrate aufwiesen als Patienten, die nur mit Diät behandelt wurden. Ein signifikanter Anstieg der Gesamtmortalität wurde nicht beobachtet, aber die Anwendung von Tolbutamid wurde aufgrund des Anstiegs der kardiovaskulären Mortalität eingestellt, wodurch die Möglichkeit der Studie, einen Anstieg der Gesamtmortalität zu zeigen, eingeschränkt wurde. Trotz Kontroversen über die Interpretation dieser Ergebnisse bieten die Ergebnisse der UGDP-Studie eine angemessene Grundlage für diese Warnung. Der Patient sollte über die potenziellen Risiken und Vorteile von Glyburid und alternative Therapieformen aufgeklärt werden.
Obwohl nur 1 Medikament der Klasse der Sulfonylharnstoffe (Tolbutamid) in diese Studie eingeschlossen wurde, ist es aus Sicherheitsgründen ratsam zu berücksichtigen, dass dieser Warnhinweis auch für andere hypoglykämische Medikamente dieser Klasse gelten kann, da sie in ihrer Wirkungsweise sehr ähnlich sind und chemische Struktur.
VORSICHTSMASSNAHMEN
Allgemein
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit GLUCOVANCE 5 mg oder einem anderen Antidiabetikum erbrachten.
GLUKOVANCE
Hypoglykämie
GLUCOVANCE 400 mg kann Hypoglykämie oder hypoglykämische Symptome hervorrufen, daher sind die richtige Patientenauswahl, Dosierung und Anweisungen wichtig, um potenzielle hypoglykämische Episoden zu vermeiden. Das Risiko einer Hypoglykämie ist erhöht, wenn die Kalorienaufnahme unzureichend ist, wenn anstrengende körperliche Betätigung nicht durch eine Kalorienergänzung kompensiert wird oder wenn gleichzeitig andere blutzuckersenkende Arzneimittel oder Ethanol angewendet werden. Eine Nieren- oder Leberinsuffizienz kann zu erhöhten Arzneimittelspiegeln sowohl von Glyburid als auch von Metforminhydrochlorid führen, und die Leberinsuffizienz kann auch die gluconeogene Kapazität verringern, was beides das Risiko hypoglykämischer Reaktionen erhöht. Ältere, geschwächte oder unterernährte Patienten und Patienten mit Nebennieren- oder Hypophyseninsuffizienz oder Alkoholvergiftung sind besonders anfällig für hypoglykämische Wirkungen. Hypoglykämie kann bei älteren Menschen und Menschen, die Betablocker einnehmen, schwer zu erkennen sein.
Glyburid
Hämolytische Anämie
Die Behandlung von Patienten mit Glucose-6-Phosphat-Dehydrogenase (G6PD)-Mangel mit Sulfonylharnstoffen kann zu einer hämolytischen Anämie führen. Da GLUCOVANCE 400 mg zur Klasse der Sulfonylharnstoffe gehört, sollte bei Patienten mit G6PD-Mangel Vorsicht walten und eine Alternative ohne Sulfonylharnstoff in Betracht gezogen werden. In Postmarketing-Berichten wurde auch über hämolytische Anämie bei Patienten ohne bekannten G6PD-Mangel berichtet.
Metforminhydrochlorid
Überwachung der Nierenfunktion
Es ist bekannt, dass Metformin im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko einer Metformin-Akkumulation und einer Laktatazidose steigt mit dem Grad der Beeinträchtigung der Nierenfunktion. Daher sollten Patienten mit Serum-Kreatininspiegeln oberhalb der für ihr Alter normalen Obergrenze GLUCOVANCE nicht erhalten. Bei Patienten in fortgeschrittenem Alter sollte GLUCOVANCE 400 mg sorgfältig titriert werden, um die Mindestdosis für eine angemessene glykämische Wirkung festzulegen, da das Altern mit einer verringerten Nierenfunktion einhergeht. Bei älteren Patienten, insbesondere im Alter von ≥ 80 Jahren, sollte die Nierenfunktion regelmäßig überwacht werden, und im Allgemeinen sollte GLUCOVANCE 2,50 mg nicht auf die Höchstdosis titriert werden (siehe WARNUNGEN und DOSIERUNG UND ANWENDUNG ). Vor Beginn der Therapie mit GLUCOVANCE 2,50 mg und danach mindestens einmal jährlich sollte die Nierenfunktion beurteilt und als normal bestätigt werden. Bei Patienten, bei denen die Entwicklung einer Nierenfunktionsstörung zu erwarten ist, sollte die Nierenfunktion häufiger überprüft und GLUCOVANCE abgesetzt werden, wenn Anzeichen einer Nierenfunktionsstörung vorliegen.
Verwendung von begleitenden Medikamenten, die die Nierenfunktion oder die Disposition von Metformin beeinflussen können
Begleitmedikation(en), die die Nierenfunktion beeinträchtigen oder zu signifikanten hämodynamischen Veränderungen führen oder die Disposition von Metformin beeinträchtigen können, wie kationische Arzneimittel, die durch renale tubuläre Sekretion ausgeschieden werden (siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ), sollte mit Vorsicht verwendet werden.
Radiologische Studien, bei denen intravaskuläre jodhaltige Kontrastmittel verwendet werden (z. B. intravenöses Urogramm, intravenöse Cholangiographie, Angiographie und Computertomographie (CT)-Scans mit intravaskulären Kontrastmitteln)
Intravaskuläre Kontrastmittelstudien mit jodhaltigen Substanzen können zu einer akuten Veränderung der Nierenfunktion führen und wurden bei Patienten, die Metformin erhielten, mit einer Laktatazidose in Verbindung gebracht (s KONTRAINDIKATIONEN ). Daher sollte bei Patienten, bei denen eine solche Studie geplant ist, GLUCOVANCE 400 mg zum Zeitpunkt oder vor dem Eingriff vorübergehend abgesetzt und für 48 Stunden nach dem Eingriff ausgesetzt und erst wieder aufgenommen werden, nachdem die Nierenfunktion erneut beurteilt und festgestellt wurde normal.
Hypoxische Zustände
Herz-Kreislauf-Kollaps (Schock) gleich welcher Ursache, akute dekompensierte Herzinsuffizienz, akuter Myokardinfarkt und andere Zustände, die durch Hypoxämie gekennzeichnet sind, wurden mit Laktatazidose in Verbindung gebracht und können auch eine prärenale Azotämie verursachen. Wenn solche Ereignisse bei Patienten auftreten, die mit GLUCOVANCE 2,50 mg behandelt werden, sollte das Arzneimittel unverzüglich abgesetzt werden.
Chirurgische Maßnahmen
Die Therapie mit GLUCOVANCE 400 mg sollte für jeden chirurgischen Eingriff vorübergehend ausgesetzt werden (mit Ausnahme kleinerer Eingriffe, die nicht mit einer eingeschränkten Nahrungs- und Flüssigkeitsaufnahme verbunden sind) und sollte nicht wieder aufgenommen werden, bis die orale Einnahme des Patienten wieder aufgenommen und die Nierenfunktion als normal bewertet wurde.
Alkoholkonsum
Es ist bekannt, dass Alkohol die Wirkung von Metformin auf den Laktatstoffwechsel verstärkt. Patienten sollten daher während der Behandlung mit GLUCOVANCE vor akutem oder chronischem exzessivem Alkoholkonsum gewarnt werden. Aufgrund seiner Wirkung auf die glukoneogene Kapazität der Leber kann Alkohol auch das Risiko einer Hypoglykämie erhöhen.
Beeinträchtigte Leberfunktion
Da eine eingeschränkte Leberfunktion mit einigen Fällen von Laktatazidose in Verbindung gebracht wurde, sollte GLUCOVANCE 500 mg bei Patienten mit klinischen oder Laboranzeichen einer Lebererkrankung im Allgemeinen vermieden werden.
Vitamin B12-Spiegel
In kontrollierten klinischen Studien mit Metformin über 29 Wochen wurde bei etwa 7 % der Patienten ein Absinken des zuvor normalen Serum-Vitamin-B12-Spiegels auf subnormale Werte ohne klinische Manifestationen beobachtet. Eine solche Abnahme, möglicherweise aufgrund einer Störung der B12-Absorption aus dem B12-Intrinsic-Faktor-Komplex, ist jedoch sehr selten mit Anämie verbunden und scheint nach Absetzen von Metformin oder einer Vitamin-B-Ergänzung schnell reversibel zu sein. Bei Patienten, die Metformin erhalten, wird eine jährliche Messung der hämatologischen Parameter empfohlen, und alle offensichtlichen Anomalien sollten angemessen untersucht und behandelt werden (siehe VORSICHTSMASSNAHMEN : Labortests ).
Bestimmte Personen (Personen mit unzureichender Aufnahme oder Absorption von Vitamin B12 oder Kalzium) scheinen für die Entwicklung subnormaler Vitamin B12-Spiegel prädisponiert zu sein. Bei diesen Patienten können routinemäßige Serum-Vitamin-B12-Messungen in 2- bis 3-Jahres-Intervallen sinnvoll sein.
Änderung des klinischen Status von Patienten mit zuvor kontrolliertem Typ-2-Diabetes
Ein Patient mit Typ-2-Diabetes, der zuvor mit Metformin gut eingestellt war und bei dem Laboranomalien oder eine klinische Erkrankung (insbesondere eine vage und schlecht definierte Erkrankung) auftritt, sollte unverzüglich auf Anzeichen einer Ketoazidose oder Laktatazidose untersucht werden. Die Bewertung sollte Serumelektrolyte und -ketone, Blutglukose und, falls angezeigt, Blut-pH-, Laktat-, Pyruvat- und Metforminspiegel umfassen. Wenn eine der beiden Formen einer Azidose auftritt, muss GLUCOVANCE sofort abgesetzt und andere geeignete Korrekturmaßnahmen eingeleitet werden (siehe auch WARNUNGEN ).
Zusatz von Thiazolidindione zur GLUCOVANCE 500 mg-Therapie
Hypoglykämie
Patienten, die GLUCOVANCE 2,50 mg in Kombination mit einem Thiazolidindion erhalten, können einem Hypoglykämie-Risiko ausgesetzt sein.
Gewichtszunahme
Bei der Zugabe von Rosiglitazon zu GLUCOVANCE 5 mg wurde eine Gewichtszunahme beobachtet, ähnlich wie bei der Thiazolidindion-Therapie allein.
Hepatische Wirkungen
Wenn ein Thiazolidindion in Kombination mit GLUCOVANCE 2,50 mg angewendet wird, sollte eine regelmäßige Überwachung der Leberfunktionstests in Übereinstimmung mit den auf dem Etikett angegebenen Empfehlungen für das Thiazolidindion durchgeführt werden.
Informationen für Patienten
GLUKOVANCE
Die Patienten sollten über die potenziellen Risiken und Vorteile von GLUCOVANCE 500 mg und alternativen Therapieformen informiert werden. Sie sollten auch über die Bedeutung der Einhaltung von Ernährungsanweisungen informiert werden; ein regelmäßiges Trainingsprogramm; und regelmäßiges Testen von Blutzucker, glykosyliertem Hämoglobin, Nierenfunktion und hämatologischen Parametern.
Die Risiken einer Laktatazidose im Zusammenhang mit einer Metformin-Therapie, ihre Symptome und Bedingungen, die für ihre Entwicklung prädisponieren, wie in den Abschnitten WARNHINWEISE und VORSICHTSMASSNAHMEN angegeben, sollten den Patienten erklärt werden. Patienten sollten angewiesen werden, GLUCOVANCE sofort abzusetzen und unverzüglich ihren Arzt zu benachrichtigen, wenn unerklärliche Hyperventilation, Myalgie, Unwohlsein, ungewöhnliche Schläfrigkeit oder andere unspezifische Symptome auftreten. Sobald sich ein Patient auf einer beliebigen Dosisstufe von GLUCOVANCE stabilisiert hat, ist es unwahrscheinlich, dass gastrointestinale Symptome, die zu Beginn einer Metformin-Therapie auftreten, mit dem Arzneimittel zusammenhängen. Ein späteres Auftreten von gastrointestinalen Symptomen könnte auf eine Laktatazidose oder eine andere schwere Erkrankung zurückzuführen sein.
Die Risiken einer Hypoglykämie, ihre Symptome und Behandlung sowie Bedingungen, die für ihre Entwicklung prädisponieren, sollten Patienten und verantwortlichen Familienmitgliedern erklärt werden.
Patienten sollten während der Behandlung mit GLUCOVANCE von akutem oder chronischem exzessivem Alkoholkonsum abgeraten werden. (Sehen PATIENTENINFORMATION gedruckt unter.)
Labortests
Regelmäßige Nüchtern-Blutzucker- (FBG) und HbA1c-Messungen sollten durchgeführt werden, um das therapeutische Ansprechen zu überwachen.
Eine anfängliche und regelmäßige Überwachung der hämatologischen Parameter (z. B. Hämoglobin/Hämatokrit und Erythrozytenindizes) und der Nierenfunktion (Serumkreatinin) sollte mindestens einmal jährlich durchgeführt werden. Während eine Megaloblastenanämie unter Metformintherapie selten beobachtet wurde, sollte bei entsprechendem Verdacht ein Vitamin-B12-Mangel ausgeschlossen werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Tierversuche mit den kombinierten Produkten in GLUCOVANCE durchgeführt. Die folgenden Daten basieren auf Erkenntnissen aus Studien, die mit den einzelnen Produkten durchgeführt wurden.
Glyburid
Studien an Ratten mit Glyburid allein in Dosen von bis zu 300 mg/kg/Tag (ungefähr das 145-fache der maximal empfohlenen menschlichen Tagesdosis [MRHD] von 20 mg für die Glyburidkomponente von GLUCOVANCE 5 mg, basierend auf Vergleichen der Körperoberfläche) über 18 Monate ergaben keine krebserzeugende Wirkung. In einer 2-jährigen Onkogenitätsstudie mit Glyburid an Mäusen gab es keine Hinweise auf behandlungsbedingte Tumoren.
In den folgenden In-vitro-Tests ergaben sich keine Hinweise auf ein mutagenes Potenzial von Glyburid allein: Salmonella-Mikrosomentest (Ames-Test) und im DNA-Schädigungs-/Alkaline-Elutions-Assay.
Metforminhydrochlorid
Langzeitstudien zur Karzinogenität wurden mit Metformin allein bei Ratten (Dosierungsdauer 104 Wochen) und Mäusen (Dosierungsdauer 91 Wochen) mit Dosen bis einschließlich 900 mg/kg/Tag bzw. 1500 mg/kg/Tag durchgeführt. Diese Dosen sind beide ungefähr das Vierfache der MRHD-Dosis von 2000 mg der Metformin-Komponente von GLUCOVANCE 400 mg, basierend auf Vergleichen der Körperoberfläche. Weder bei männlichen noch bei weiblichen Mäusen wurden Hinweise auf Karzinogenität mit Metformin allein gefunden. In ähnlicher Weise wurde bei männlichen Ratten mit Metformin allein kein tumorerzeugendes Potenzial beobachtet. Es gab jedoch eine erhöhte Inzidenz gutartiger stromaler Uteruspolypen bei weiblichen Ratten, die mit 900 mg/kg/Tag Metformin allein behandelt wurden.
In folgenden In-vitro-Tests ergaben sich keine Hinweise auf ein mutagenes Potenzial von Metformin allein: Ames-Test (S. typhimurium), Genmutationstest (Maus-Lymphomzellen) oder Chromosomenaberrationstest (humane Lymphozyten). Die Ergebnisse im In-vivo-Maus-Mikrokerntest waren ebenfalls negativ.
Die Fertilität männlicher oder weiblicher Ratten wurde durch Metformin allein nicht beeinflusst, wenn es in Dosen von bis zu 600 mg/kg/Tag verabreicht wurde, was ungefähr dem Dreifachen der MRHD-Dosis der Metformin-Komponente von GLUCOVANCE 400 mg entspricht, basierend auf Vergleichen der Körperoberfläche.
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie B
Jüngste Informationen deuten stark darauf hin, dass abnormale Blutzuckerspiegel während der Schwangerschaft mit einer höheren Inzidenz angeborener Anomalien verbunden sind. Die meisten Experten empfehlen, während der Schwangerschaft Insulin zu verwenden, um den Blutzuckerspiegel so nah wie möglich am Normalwert zu halten. Da Reproduktionsstudien an Tieren nicht immer aussagekräftig für die Reaktion des Menschen sind, sollte GLUCOVANCE 400 mg während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. (Siehe unten.)

Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen mit GLUCOVANCE oder seinen einzelnen Bestandteilen. Es wurden keine Tierversuche mit den kombinierten Produkten in GLUCOVANCE durchgeführt. Die folgenden Daten basieren auf Erkenntnissen aus Studien, die mit den einzelnen Produkten durchgeführt wurden.
Glyburid
Reproduktionsstudien wurden an Ratten und Kaninchen mit Dosen bis zum 500-fachen der MRHD-Dosis von 20 mg der Glyburidkomponente von GLUCOVANCE 500 mg durchgeführt, basierend auf Vergleichen der Körperoberfläche, und ergaben keine Hinweise auf eine beeinträchtigte Fertilität oder eine Schädigung des Fötus aufgrund von Glyburid.
Metforminhydrochlorid
Metformin allein war bei Ratten oder Kaninchen in Dosen von bis zu 600 mg/kg/Tag nicht teratogen. Dies entspricht einer Exposition von etwa dem 2- bzw. 6-fachen der MRHD-Dosis von 2000 mg der Metformin-Komponente von GLUCOVANCE 500 mg, basierend auf Vergleichen der Körperoberfläche von Ratten bzw. Kaninchen. Die Bestimmung der fötalen Konzentrationen zeigte eine partielle Plazentabarriere gegenüber Metformin.
Nicht teratogene Wirkungen
Bei Neugeborenen von Müttern, die zum Zeitpunkt der Entbindung ein Sulfonylharnstoff-Medikament erhielten, wurde über eine anhaltende schwere Hypoglykämie (4-10 Tage) berichtet. Dies wurde häufiger bei der Anwendung von Wirkstoffen mit verlängerter Halbwertszeit berichtet. Es wird nicht empfohlen, GLUCOVANCE 400 mg während der Schwangerschaft anzuwenden. Wenn es jedoch angewendet wird, sollte GLUCOVANCE mindestens 2 Wochen vor dem voraussichtlichen Entbindungstermin abgesetzt werden. (Sehen Schwangerschaft : Teratogene Wirkungen : Schwangerschaftskategorie B .)
Stillende Mutter
Obwohl nicht bekannt ist, ob Glyburid in die Muttermilch übergeht, ist bekannt, dass einige Sulfonylharnstoffe in die Muttermilch übergehen. Studien an säugenden Ratten zeigen, dass Metformin in die Milch ausgeschieden wird und vergleichbare Konzentrationen wie im Plasma erreicht. Ähnliche Studien wurden bei stillenden Müttern nicht durchgeführt. Da bei gestillten Säuglingen die Möglichkeit einer Hypoglykämie bestehen kann, sollte unter Berücksichtigung der Bedeutung des Arzneimittels für die Mutter entschieden werden, ob das Stillen beendet oder GLUCOVANCE abgesetzt werden soll. Wenn GLUCOVANCE abgesetzt wird und eine Diät allein zur Kontrolle des Blutzuckers nicht ausreicht, sollte eine Insulintherapie in Erwägung gezogen werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von GLUCOVANCE 500 mg wurden in einer aktiv kontrollierten, doppelblinden, randomisierten 26-wöchigen Studie mit insgesamt 167 pädiatrischen Patienten (im Alter von 9 bis 16 Jahren) mit Typ-2-Diabetes untersucht. GLUCOVANCE 500 mg erwies sich statistisch weder als überlegen gegenüber Metformin noch gegenüber Glyburid in Bezug auf die Senkung des HbA1c gegenüber dem Ausgangswert (siehe Tabelle 5). In dieser Studie wurden keine unerwarteten Sicherheitsbefunde mit GLUCOVANCE 2,50 mg in Verbindung gebracht.
Geriatrische Verwendung
Von den 642 Patienten, die GLUCOVANCE in doppelblinden klinischen Studien erhielten, waren 23,8 % 65 Jahre und älter, während 2,8 % 75 Jahre und älter waren. Von den 1302 Patienten, die GLUCOVANCE 500 mg in offenen klinischen Studien erhielten, waren 20,7 % 65 Jahre und älter, während 2,5 % 75 Jahre und älter waren. Insgesamt wurden keine Unterschiede in der Wirksamkeit oder Sicherheit zwischen diesen Patienten und jüngeren Patienten beobachtet, und andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Es ist bekannt, dass Metforminhydrochlorid im Wesentlichen über die Nieren ausgeschieden wird, und da das Risiko schwerwiegender Nebenwirkungen des Arzneimittels bei Patienten mit eingeschränkter Nierenfunktion größer ist, sollte GLUCOVANCE 500 mg nur bei Patienten mit normaler Nierenfunktion angewendet werden (siehe KONTRAINDIKATIONEN , WARNUNGEN , und KLINISCHE PHARMAKOLOGIE : Pharmakokinetik ). Da das Altern mit einer verminderten Nierenfunktion einhergeht, sollte GLUCOVANCE 5 mg mit zunehmendem Alter mit Vorsicht angewendet werden. Die Dosis sollte mit Sorgfalt ausgewählt werden und auf einer sorgfältigen und regelmäßigen Überwachung der Nierenfunktion beruhen. Im Allgemeinen sollten ältere Patienten nicht auf die Höchstdosis von GLUCOVANCE titriert werden (siehe auch WARNUNGEN und DOSIERUNG UND ANWENDUNG ).
ÜBERDOSIS
Glyburid
Eine Überdosierung von Sulfonylharnstoffen, einschließlich Glyburid-Tabletten, kann zu Hypoglykämie führen. Leichte hypoglykämische Symptome ohne Bewusstlosigkeit oder neurologische Befunde sollten aggressiv mit oraler Glukose und Anpassungen der Medikamentendosis und/oder des Ernährungsmusters behandelt werden. Eine engmaschige Überwachung sollte fortgesetzt werden, bis der Arzt sicher ist, dass der Patient außer Gefahr ist. Schwere hypoglykämische Reaktionen mit Koma, Krampfanfällen oder anderen neurologischen Beeinträchtigungen treten selten auf, stellen jedoch medizinische Notfälle dar, die einen sofortigen Krankenhausaufenthalt erfordern. Wenn ein hypoglykämisches Koma diagnostiziert oder vermutet wird, sollte dem Patienten eine schnelle intravenöse Injektion einer konzentrierten (50 %) Glucoselösung verabreicht werden. Darauf sollte eine kontinuierliche Infusion einer stärker verdünnten (10 %) Glukoselösung mit einer Geschwindigkeit folgen, die den Blutzucker auf einem Wert über 100 mg/dL hält. Die Patienten sollten für mindestens 24 bis 48 Stunden engmaschig überwacht werden, da eine Hypoglykämie nach offensichtlicher klinischer Erholung erneut auftreten kann.
Metforminhydrochlorid
Eine Überdosierung von Metforminhydrochlorid ist aufgetreten, einschließlich Einnahme von Mengen > 50 g. Hypoglykämie wurde in etwa 10 % der Fälle berichtet, es wurde jedoch kein kausaler Zusammenhang mit Metforminhydrochlorid festgestellt. Laktatazidose wurde bei etwa 32 % der Fälle von Metformin-Überdosierung berichtet (siehe WARNUNGEN ). Metformin ist unter guten hämodynamischen Bedingungen mit einer Clearance von bis zu 170 ml/min dialysierbar. Daher kann eine Hämodialyse nützlich sein, um bei Patienten, bei denen eine Metformin-Überdosierung vermutet wird, angesammelte Medikamente zu entfernen.
KONTRAINDIKATIONEN
GLUCOVANCE 2,50 mg ist kontraindiziert bei Patienten mit:
GLUCOVANCE 500 mg sollte bei Patienten, die sich radiologischen Studien mit intravaskulärer Verabreichung von jodhaltigen Kontrastmitteln unterziehen, vorübergehend abgesetzt werden, da die Anwendung solcher Produkte zu einer akuten Veränderung der Nierenfunktion führen kann. (Siehe auch VORSICHTSMASSNAHMEN .)
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
GLUCOVANCE kombiniert Glyburid und Metforminhydrochlorid, zwei antihyperglykämische Wirkstoffe mit komplementären Wirkmechanismen, um die Blutzuckerkontrolle bei Patienten mit Typ-2-Diabetes zu verbessern.
Glyburid scheint den Blutzuckerspiegel akut zu senken, indem es die Freisetzung von Insulin aus der Bauchspeicheldrüse stimuliert, eine Wirkung, die von funktionierenden Betazellen in den Pankreasinseln abhängt. Der Mechanismus, durch den Glyburid den Blutzuckerspiegel während einer Langzeitanwendung senkt, ist nicht eindeutig geklärt. Bei chronischer Verabreichung bei Patienten mit Typ-2-Diabetes bleibt die blutzuckersenkende Wirkung trotz einer allmählichen Abnahme der insulinsekretorischen Reaktion auf das Arzneimittel bestehen. Extrapankreatische Wirkungen können am Wirkmechanismus von oralen Sulfonylharnstoff-Antidiabetika beteiligt sein.
Metforminhydrochlorid ist ein Antihyperglykämikum, das die Glukosetoleranz bei Patienten mit Typ-2-Diabetes verbessert und sowohl den basalen als auch den postprandialen Plasmaglukosespiegel senkt. Metforminhydrochlorid verringert die hepatische Glukoseproduktion, verringert die intestinale Glukoseabsorption und verbessert die Insulinsensitivität, indem es die periphere Glukoseaufnahme und -verwertung erhöht.
Pharmakokinetik
Resorption und Bioverfügbarkeit
GLUKOVANCE
In Studien zur Bioverfügbarkeit von GLUCOVANCE 2,5 mg/500 mg und 5 mg/500 mg war die mittlere Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) für die Glyburid-Komponente 18 % bzw. 7 % größer als die von Micronase® Marke von Glyburid zusammen mit Metformin verabreicht. Die Glyburid-Komponente von GLUCOVANCE ist daher nicht bioäquivalent zu Micronase®. Die Metformin-Komponente von GLUCOVANCE 400 mg ist bioäquivalent zu Metformin in Kombination mit Glyburid.
Nach Verabreichung einer einzelnen GLUCOVANCE 5 mg/500 mg-Tablette mit entweder einer 20 %igen Glukoselösung oder einer 20 %igen Glukoselösung mit einer Mahlzeit hatte die Nahrung keine Auswirkung auf die Cmax und eine relativ geringe Auswirkung der Nahrung auf die AUC von Glyburid Komponente. Die Tmax für die Glyburid-Komponente wurde mit Nahrung von 7,5 Stunden auf 2,75 Stunden verkürzt, verglichen mit der gleichen Tablettenstärke, die nüchtern mit einer 20 %igen Glucoselösung verabreicht wurde. Die klinische Bedeutung einer früheren Tmax für Glyburid nach einer Mahlzeit ist nicht bekannt. Die Wirkung von Nahrungsmitteln auf die Pharmakokinetik der Metformin-Komponente war unbestimmt.
Glyburid
Einzeldosisstudien mit Micronase®-Tabletten bei normalen Probanden zeigen eine signifikante Resorption von Glyburid innerhalb von 1 Stunde, Spitzenkonzentrationen des Medikaments nach etwa 4 Stunden und niedrige, aber nachweisbare Konzentrationen nach 24 Stunden. Die mittleren Glyburid-Serumspiegel, die sich in den Bereichen unter der Serumkonzentrations-Zeit-Kurve widerspiegeln, steigen proportional zu den entsprechenden Dosiserhöhungen. Es wurde keine Bioäquivalenz zwischen GLUCOVANCE 500 mg und Glyburid-Produkten mit einem Bestandteil festgestellt.
Metforminhydrochlorid
Die absolute Bioverfügbarkeit einer 500-mg-Metforminhydrochlorid-Tablette, die unter nüchternen Bedingungen verabreicht wird, beträgt ungefähr 50 % bis 60 %. Studien mit oralen Einzeldosen von Metformin-Tabletten von 500 mg und 1500 mg sowie 850 mg bis 2550 mg weisen darauf hin, dass es bei steigenden Dosen an Dosisproportionalität mangelt, was eher auf eine verringerte Resorption als auf eine Veränderung der Elimination zurückzuführen ist. Nahrung verringert das Ausmaß und verzögert die Resorption von Metformin leicht, wie durch eine um etwa 40 % niedrigere Spitzenkonzentration und eine um 25 % niedrigere AUC im Plasma und eine 35-minütige Verlängerung der Zeit bis zum Erreichen der maximalen Plasmakonzentration nach Gabe einer Einzeldosis von 850 mg gezeigt wird Tablette Metformin mit Nahrung, verglichen mit der gleichen Tablettenstärke, die nüchtern verabreicht wurde. Die klinische Relevanz dieser Abnahmen ist nicht bekannt.
Verteilung
Glyburid
Sulfonylharnstoff-Medikamente werden stark an Serumproteine gebunden. Die Verdrängung von Proteinbindungsstellen durch andere Arzneimittel kann zu einer verstärkten hypoglykämischen Wirkung führen. In vitro ist die Proteinbindung von Glyburid überwiegend nichtionisch, während die anderer Sulfonylharnstoffe (Chlorpropamid, Tolbutamid, Tolazamid) überwiegend ionisch ist. Saure Medikamente, wie Phenylbutazon, Warfarin und Salicylate, verdrängen die ionenbindenden Sulfonylharnstoffe in weit größerem Ausmaß aus Serumproteinen als das nicht-ionisch bindende Glyburid. Es wurde nicht gezeigt, dass dieser Unterschied in der Proteinbindung zu weniger Arzneimittelwechselwirkungen mit Glyburid-Tabletten im klinischen Einsatz führt.
Metforminhydrochlorid
Das scheinbare Verteilungsvolumen (V/F) von Metformin nach oraler Einzeldosis von 850 mg betrug durchschnittlich 654 ± 358 l. Metformin wird vernachlässigbar an Plasmaproteine gebunden. Metformin verteilt sich in Erythrozyten, höchstwahrscheinlich als Funktion der Zeit. Bei üblichen klinischen Dosen und Dosierungsschemata von Metformin werden Steady-State-Plasmakonzentrationen von Metformin innerhalb von 24 bis 48 Stunden erreicht und betragen im Allgemeinen
Stoffwechsel und Ausscheidung
Glyburid
Die Abnahme von Glyburid im Serum normaler gesunder Personen ist zweiphasig; die terminale Halbwertszeit beträgt etwa 10 Stunden. Der Hauptmetabolit von Glyburid ist das 4-trans-Hydroxy-Derivat. Ein zweiter Metabolit, das 3-cis-Hydroxy-Derivat, tritt ebenfalls auf. Diese Metaboliten tragen beim Menschen wahrscheinlich zu keiner signifikanten hypoglykämischen Wirkung bei, da sie bei Kaninchen nur schwach aktiv sind (1/400 bzw. 1/40 der Aktivität von Glyburid). Glyburid wird als Metaboliten über die Galle und den Urin ausgeschieden, etwa 50 % auf jedem Weg. Dieser duale Ausscheidungsweg unterscheidet sich qualitativ von dem anderer Sulfonylharnstoffe, die hauptsächlich über den Urin ausgeschieden werden.
Metforminhydrochlorid
Studien mit intravenöser Einzeldosis bei gesunden Probanden zeigen, dass Metformin unverändert mit dem Urin ausgeschieden wird und weder einer hepatischen Metabolisierung (beim Menschen wurden keine Metaboliten identifiziert) noch einer biliären Ausscheidung unterliegt. Die renale Clearance (siehe Tabelle 1) ist etwa 3,5-mal größer als die Kreatinin-Clearance, was darauf hindeutet, dass die tubuläre Sekretion der Hauptweg der Metformin-Elimination ist. Nach oraler Gabe werden ca. 90 % des resorbierten Arzneimittels innerhalb der ersten 24 Stunden renal eliminiert, mit einer Eliminationshalbwertszeit aus dem Plasma von ca. 6,2 Stunden. Im Blut beträgt die Eliminationshalbwertszeit etwa 17,6 Stunden, was darauf hindeutet, dass die Erythrozytenmasse ein Verteilungskompartiment sein könnte.
Besondere Populationen
Patienten mit Typ-2-Diabetes
Mehrfachdosisstudien mit Glyburid bei Patienten mit Typ-2-Diabetes zeigen Konzentrations-Zeit-Kurven des Arzneimittelspiegels, die denen von Einzeldosisstudien ähneln, was darauf hindeutet, dass sich das Arzneimittel nicht in Gewebedepots ansammelt.
Bei normaler Nierenfunktion gibt es keine Unterschiede zwischen der Pharmakokinetik von Metformin nach Einzel- oder Mehrfachdosis zwischen Patienten mit Typ-2-Diabetes und gesunden Probanden (siehe Tabelle 1), noch gibt es in beiden Gruppen bei üblichen klinischen Werten eine Akkumulation von Metformin Dosen.
Leberinsuffizienz
Bei Patienten mit Leberinsuffizienz wurden weder für Glyburid noch für Metformin pharmakokinetische Studien durchgeführt.
Niereninsuffizienz
Es liegen keine Informationen zur Pharmakokinetik von Glyburid bei Patienten mit Niereninsuffizienz vor.
Bei Patienten mit eingeschränkter Nierenfunktion (basierend auf der Kreatinin-Clearance) ist die Plasma- und Bluthalbwertszeit von Metformin verlängert und die renale Clearance proportional zur Abnahme der Kreatinin-Clearance verringert (siehe Tabelle 1; siehe auch WARNUNGEN ).
Geriatrie
Es liegen keine Informationen zur Pharmakokinetik von Glyburid bei älteren Patienten vor.
Begrenzte Daten aus kontrollierten pharmakokinetischen Studien zu Metformin bei gesunden älteren Probanden deuten darauf hin, dass die Gesamtplasmaclearance im Vergleich zu gesunden jungen Probanden verringert, die Halbwertszeit verlängert und Cmax erhöht ist. Aus diesen Daten geht hervor, dass die altersbedingte Veränderung der Pharmakokinetik von Metformin hauptsächlich auf eine Veränderung der Nierenfunktion zurückzuführen ist (siehe Tabelle 1). Eine Behandlung mit Metformin sollte bei Patienten ≥ 80 Jahren nicht begonnen werden, es sei denn, die Messung der Kreatinin-Clearance zeigt, dass die Nierenfunktion nicht eingeschränkt ist.
Pädiatrie
Nach Einnahme einer einzelnen Tablette GLUCOPHAGE® (Metforminhydrochlorid) 500 mg zum Einnehmen mit einer Mahlzeit unterschied sich das geometrische Mittel der Cmax und AUC von Metformin um
Nach Einnahme einer einzelnen oralen GLUCOVANCE-Tablette mit Nahrung wichen das dosisnormalisierte geometrische Mittel von Glyburid C und AUC bei pädiatrischen Patienten mit Typ-2-Diabetes (11-16 Jahre, n = 28, mittleres Körpergewicht von 97 kg) um
Geschlecht
Es liegen keine Informationen zum Einfluss des Geschlechts auf die Pharmakokinetik von Glyburid vor.
Die pharmakokinetischen Parameter von Metformin unterschieden sich bei Probanden mit oder ohne Typ-2-Diabetes nicht signifikant, wenn sie nach Geschlecht analysiert wurden (Männer = 19, Frauen = 16). In ähnlicher Weise war in kontrollierten klinischen Studien bei Patienten mit Typ-2-Diabetes die antihyperglykämische Wirkung von Metformin bei Männern und Frauen vergleichbar.
Wettrennen
Es liegen keine Informationen über Rassenunterschiede in der Pharmakokinetik von Glyburid vor.
Es wurden keine Studien zu den pharmakokinetischen Parametern von Metformin je nach ethnischer Zugehörigkeit durchgeführt. In kontrollierten klinischen Studien mit Metformin bei Patienten mit Typ-2-Diabetes war die antihyperglykämische Wirkung bei Weißen (n = 249), Schwarzen (n = 51) und Hispanics (n = 24) vergleichbar.
Klinische Studien
Patienten mit unzureichender glykämischer Kontrolle allein durch Ernährung und Bewegung
In einer 20-wöchigen, doppelblinden, multizentrischen klinischen Studie in den USA wurden insgesamt 806 arzneimittelnaive Patienten mit Typ-2-Diabetes, deren Hyperglykämie mit Diät und Bewegung allein nicht ausreichend kontrolliert werden konnte (Baseline Nüchtern-Plasmaglukose [FPG]
Die Behandlung mit GLUCOVANCE führte im Vergleich zu Glyburid, Metformin oder Placebo zu einer signifikant stärkeren Senkung des HbA und der postprandialen Plasmaglukose (PPG). Außerdem führte die GLUCOVANCE-Therapie im Vergleich zu Glyburid, Metformin oder Placebo zu einer stärkeren Senkung der FPG, aber die Unterschiede zu Glyburid und Metformin erreichten keine statistische Signifikanz.
Die mit der Behandlung mit GLUCOVANCE 2,50 mg verbundenen Veränderungen des Lipidprofils waren ähnlich denen, die mit Glyburid, Metformin und Placebo beobachtet wurden.
Die oben beschriebene doppelblinde, placebokontrollierte Studie beschränkte die Aufnahme auf Patienten mit HbA1c
Patienten mit unzureichender glykämischer Kontrolle unter Sulfonylharnstoff allein
In einer 16-wöchigen, doppelblinden, aktiv kontrollierten klinischen Studie in den USA wurden insgesamt 639 Patienten mit Typ-2-Diabetes nicht ausreichend kontrolliert (mittlerer HbA1c-Ausgangswert 9,5 %, mittlerer FPG-Ausgangswert 213 mg/dl), während sie mit mindestens behandelt wurden die Hälfte der maximalen Dosis eines Sulfonylharnstoffs (z. B. Glyburid 10 mg, Glipizid 20 mg) erhielten randomisiert Glyburid (Festdosis 20 mg), Metformin (500 mg), GLUCOVANCE 2,5 mg/500 mg oder GLUCOVANCE 5 mg /500mg. Die Dosen von Metformin und GLUCOVANCE wurden nach Bedarf auf maximal 4 Tabletten täglich titriert, um FPG
Nach 16 Wochen gab es keine signifikante Veränderung des mittleren HbA-Werts bei Patienten, die randomisiert einer Glyburid- oder Metformin-Therapie zugeteilt wurden. Die Behandlung mit GLUCOVANCE 2,50 mg in Dosen von bis zu 20 mg/2000 mg pro Tag führte im Vergleich zu Glyburid oder Metformin allein zu einer signifikanten Senkung von HbA, FPG und PPG gegenüber dem Ausgangswert.
Zusatz von Thiazolidindione zur GLUCOVANCE 400 mg-Therapie
In einer 24-wöchigen, doppelblinden, multizentrischen klinischen Studie in den USA wurden Patienten mit Typ-2-Diabetes, die mit der derzeitigen oralen antihyperglykämischen Therapie (entweder Monotherapie oder Kombinationstherapie) nicht ausreichend eingestellt waren, zunächst auf unverblindete GLUCOVANCE 2,5 mg/500 mg Tabletten umgestellt und titriert bis zu einer maximalen Tagesdosis von 10 mg/2000 mg. Insgesamt 365 Patienten, die nach 10 bis 12 Wochen einer täglichen GLUCOVANCE 500 mg-Dosis von mindestens 7,5 mg/1500 mg unzureichend eingestellt waren (HbA1c > 7,0 % und ≤ 10 %), wurden randomisiert und erhielten eine Zusatztherapie mit Rosiglitazon 4 mg oder Placebo einmal täglich . Nach 8 Wochen wurde die Rosiglitazon-Dosis je nach Bedarf auf maximal 8 mg täglich erhöht, um einen mittleren Tagesglukosezielwert von 126 mg/dl oder einen HbA1c
Bei Patienten, die mit GLUCOVANCE 400 mg keine ausreichende glykämische Kontrolle erreichten, führte die Zugabe von Rosiglitazon im Vergleich zu Placebo zu einer signifikanten Senkung von HbA und FPG.
INFORMATIONEN ZUM PATIENTEN
GLUCOVANCE® (Glyburid und Metformin HCl) Tabletten
WARNUNG: Eine kleine Anzahl von Personen, die Metforminhydrochlorid eingenommen haben, hat eine schwere Erkrankung namens Laktatazidose entwickelt. Gut funktionierende Nieren sind erforderlich, um eine Laktatazidose zu verhindern. Die meisten Menschen mit Nierenproblemen sollten GLUCOVANCE nicht einnehmen. (Siehe Frage Nr. 9-13.)
Q1. Warum muss ich GLUCOVANCE 5 mg einnehmen?
Ihr Arzt hat Ihnen GLUCOVANCE 500 mg zur Behandlung Ihres Typ-2-Diabetes verschrieben. Dies wird auch als nichtinsulinabhängiger Diabetes mellitus bezeichnet.
Q2. Was ist Typ-2-Diabetes?
Menschen mit Diabetes sind nicht in der Lage, genügend Insulin zu produzieren und/oder reagieren normal auf das Insulin, das ihr Körper produziert. Wenn dies geschieht, baut sich Zucker (Glukose) im Blut auf. Dies kann zu ernsthaften medizinischen Problemen führen, einschließlich Nierenschäden, Amputationen und Erblindung. Diabetes ist auch eng mit Herzerkrankungen verbunden. Das Hauptziel der Behandlung von Diabetes ist es, Ihren Blutzucker auf ein normales Niveau zu senken.
Q3. Warum ist es wichtig, Typ-2-Diabetes zu kontrollieren?
Das Hauptziel der Behandlung von Diabetes ist es, Ihren Blutzucker auf ein normales Niveau zu senken. Studien haben gezeigt, dass eine gute Kontrolle des Blutzuckers Komplikationen wie Herzerkrankungen, Nierenerkrankungen oder Erblindung verhindern oder verzögern kann.
Q4. Wie wird Typ-2-Diabetes normalerweise kontrolliert?
Hoher Blutzucker kann durch Ernährung und Bewegung, eine Reihe von oralen Medikamenten und Insulininjektionen gesenkt werden. Vor der Einnahme von GLUCOVANCE 2,50 mg sollten Sie zunächst versuchen, Ihren Diabetes durch Bewegung und Gewichtsabnahme unter Kontrolle zu bringen. Auch wenn Sie GLUCOVANCE einnehmen, sollten Sie trotzdem Sport treiben und die für Ihren Diabetes empfohlene Diät einhalten.
Q5. Wirkt GLUCOVANCE 400 mg anders als andere Medikamente zur Blutzuckerkontrolle?
Ja tut es. GLUCOVANCE 400 mg kombiniert 2 blutzuckersenkende Medikamente, Glyburid und Metformin. Diese 2 Medikamente wirken zusammen, um die verschiedenen Stoffwechseldefekte zu verbessern, die bei Typ-2-Diabetes auftreten. Glyburid senkt den Blutzucker in erster Linie, indem es bewirkt, dass mehr körpereigenes Insulin freigesetzt wird, und Metformin senkt den Blutzucker teilweise, indem es Ihrem Körper hilft, Ihr eigenes Insulin effektiver zu nutzen. Zusammen helfen sie Ihnen effizient dabei, eine bessere Glukosekontrolle zu erreichen.
Q6. Was passiert, wenn mein Blutzucker immer noch zu hoch ist?
Wenn der Blutzucker durch GLUCOVANCE nicht ausreichend gesenkt werden kann, kann Ihr Arzt Ihnen injizierbares Insulin verschreiben oder andere Maßnahmen zur Kontrolle Ihres Diabetes ergreifen.
Q7. Kann GLUCOVANCE 400mg Nebenwirkungen verursachen?
GLUCOVANCE 2,50 mg kann, wie alle blutzuckersenkenden Medikamente, bei manchen Patienten Nebenwirkungen verursachen. Die meisten dieser Nebenwirkungen sind geringfügig. Es gibt jedoch auch schwerwiegende, aber seltene Nebenwirkungen im Zusammenhang mit GLUCOVANCE (siehe Q9–Q13).
Q8. Was sind die häufigsten Nebenwirkungen von GLUCOVANCE 500 mg?
Die häufigsten Nebenwirkungen von GLUCOVANCE 5 mg sind normalerweise geringfügig wie Durchfall, Übelkeit und Magenverstimmung. Wenn diese Nebenwirkungen auftreten, treten sie normalerweise in den ersten Behandlungswochen auf. Die Einnahme von GLUCOVANCE zu den Mahlzeiten kann helfen, diese Nebenwirkungen zu reduzieren.
Weniger häufig können Symptome einer Hypoglykämie (Unterzuckerung) wie Benommenheit, Schwindel, Zittern oder Hunger auftreten. Das Risiko hypoglykämischer Symptome steigt, wenn Mahlzeiten ausgelassen werden, zu viel Alkohol konsumiert wird oder schwere körperliche Betätigung ohne ausreichende Nahrung erfolgt. Wenn Sie den Rat Ihres Arztes befolgen, können Sie diese Symptome vermeiden.
Q9. Gibt es schwerwiegende Nebenwirkungen, die GLUCOVANCE verursachen kann?
Personen mit einem als Glucose-6-Phosphat-Dehydrogenase (G6PD)-Mangel bekannten Zustand, die GLUCOVANCE einnehmen, können eine hämolytische Anämie (schneller Abbau roter Blutkörperchen) entwickeln. G6PD-Mangel tritt normalerweise in Familien auf. Informieren Sie Ihren Arzt, wenn bei Ihnen oder einem Familienmitglied ein G6PD-Mangel diagnostiziert wurde, bevor Sie mit der Einnahme von GLUCOVANCE beginnen.
GLUCOVANCE verursacht selten schwerwiegende Nebenwirkungen. Die schwerwiegendste Nebenwirkung, die GLUCOVANCE 2,50 mg verursachen kann, wird als Laktatazidose bezeichnet.
Q10. Was ist Milchsäure und kann es mir passieren?
Laktatazidose wird durch eine Ansammlung von Milchsäure im Blut verursacht. Laktatazidose im Zusammenhang mit Metformin ist selten und trat hauptsächlich bei Menschen auf, deren Nieren nicht normal funktionierten. Laktatazidose wurde bei etwa 1 von 33.000 Patienten berichtet, die Metformin im Laufe eines Jahres einnahmen. Obwohl selten, kann eine Laktatazidose in bis zu der Hälfte der Fälle tödlich sein.
Es ist auch wichtig, dass Ihre Leber normal arbeitet, wenn Sie GLUCOVANCE einnehmen. Ihre Leber hilft, Milchsäure aus Ihrem Blutkreislauf zu entfernen.
Ihr Arzt wird Ihren Diabetes überwachen und kann von Zeit zu Zeit Bluttests bei Ihnen durchführen, um sicherzustellen, dass Ihre Nieren und Ihre Leber normal funktionieren.
Es gibt keine Hinweise darauf, dass GLUCOVANCE die Nieren oder die Leber schädigt.
Q11. Gibt es weitere Risikofaktoren für eine Laktatazidose?
Ihr Risiko, durch die Einnahme von GLUCOVANCE 400 mg eine Laktatazidose zu entwickeln, ist sehr gering, solange Ihre Nieren und Ihre Leber gesund sind. Einige Faktoren können jedoch Ihr Risiko erhöhen, da sie die Nieren- und Leberfunktion beeinträchtigen können. Sie sollten Ihr Risiko mit Ihrem Arzt besprechen.
Sie sollten GLUCOVANCE 400 mg nicht einnehmen, wenn:
Q12. Was sind die Symptome einer Laktatazidose?
Einige der Symptome umfassen: sich sehr schwach, müde oder unwohl fühlen; ungewöhnliche Muskelschmerzen; Atembeschwerden; ungewöhnliche oder unerwartete Magenbeschwerden; frieren; Schwindel oder Benommenheit; oder plötzlich einen langsamen oder unregelmäßigen Herzschlag entwickeln.
Wenn Sie diese Symptome bemerken oder wenn sich Ihr Gesundheitszustand plötzlich verändert hat, beenden Sie die Einnahme von GLUCOVANCE-Tabletten und rufen Sie sofort Ihren Arzt an. Laktatazidose ist ein medizinischer Notfall, der in einem Krankenhaus behandelt werden muss.
Q13. Was muss mein Arzt wissen, um mein Risiko einer Laktatazidose zu verringern?
Informieren Sie Ihren Arzt, wenn Sie an einer Krankheit leiden, die zu schwerem Erbrechen, Durchfall und/oder Fieber führt, oder wenn Ihre Flüssigkeitsaufnahme erheblich reduziert ist. Diese Situationen können zu schwerer Dehydrierung führen und es kann erforderlich sein, die Einnahme von GLUCOVANCE 400 mg vorübergehend zu unterbrechen.
Sie sollten Ihren Arzt informieren, wenn Sie sich einer Operation oder speziellen Röntgenverfahren unterziehen müssen, die eine Injektion von Kontrastmitteln erfordern. In solchen Fällen muss die Therapie mit GLUCOVANCE 2,50 mg vorübergehend unterbrochen werden.
F14. Kann ich GLUCOVANCE 500 mg zusammen mit anderen Medikamenten einnehmen?
Erinnern Sie Ihren Arzt daran, dass Sie GLUCOVANCE 2,50 mg einnehmen, wenn Ihnen ein neues Medikament verschrieben wird oder wenn die Art und Weise, wie Sie ein bereits verschriebenes Medikament einnehmen, geändert wird. GLUCOVANCE 400 mg kann die Wirkungsweise einiger Arzneimittel beeinträchtigen, und einige Arzneimittel können die Wirkung von GLUCOVANCE beeinträchtigen.
Nehmen Sie GLUCOVANCE nicht ein, wenn Sie Bosentan zur Behandlung von pulmonaler arterieller Hypertonie (PAH), einem hohen Blutdruck in den Lungengefäßen, einnehmen.
Q15. Was ist, wenn ich während der Einnahme von GLUCOVANCE 400 mg schwanger werde?
Informieren Sie Ihren Arzt, wenn Sie eine Schwangerschaft planen oder schwanger geworden sind. Wie bei anderen oralen blutzuckersenkenden Arzneimitteln sollten Sie GLUCOVANCE während der Schwangerschaft nicht einnehmen.
Normalerweise wird Ihnen Ihr Arzt während der Schwangerschaft Insulin verschreiben. Wie bei allen Medikamenten sollten Sie und Ihr Arzt die Anwendung von GLUCOVANCE 5 mg besprechen, wenn Sie ein Kind stillen.
Q16. Wie nehme ich GLUCOVANCE?
Ihr Arzt wird Ihnen sagen, wie viele GLUCOVANCE-Tabletten Sie einnehmen sollen und wie oft. Dies sollte auch auf dem Etikett Ihres Rezepts aufgedruckt sein. Sie werden wahrscheinlich mit einer niedrigen Dosis von GLUCOVANCE 400 mg beginnen und Ihre Dosis wird schrittweise erhöht, bis Ihr Blutzucker unter Kontrolle ist.
Q17. Wo erhalte ich weitere Informationen über GLUCOVANCE 400 mg?
Diese Packungsbeilage ist eine Zusammenfassung der wichtigsten Informationen über GLUCOVANCE. Wenn Sie Fragen oder Probleme haben, sollten Sie mit Ihrem Arzt oder einem anderen Gesundheitsdienstleister über Typ-2-Diabetes sowie über GLUCOVANCE und seine Nebenwirkungen sprechen. Es gibt auch eine Packungsbeilage (Packungsbeilage) für Angehörige der Gesundheitsberufe, die Sie von Ihrem Apotheker lesen lassen können.