Amaryl 1mg, 2mg, 4mg Glimepiride Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Amaryl 1 mg und wie wird es angewendet?
Amaryl 4 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Diabetes mellitus Typ 2. Amaryl 4 mg kann allein oder mit anderen Medikamenten verwendet werden.
Amaryl 2 mg gehört zu einer Klasse von Arzneimitteln, die als Antidiabetika, Sulfonylharnstoffe bezeichnet werden.
Es ist nicht bekannt, ob Amaryl bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Amaryl haben?
Amaryl kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Amaryl sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Amaryl. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
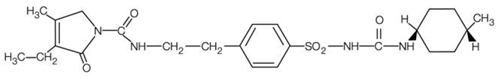
AMARYL ist ein oraler Sulfonylharnstoff, der den Wirkstoff Glimepirid enthält. Glimepirid wird chemisch als 1-[[p-[2-(3-Ethyl-4-methyl-2-oxo-3-pyrrolin-1-carboxamido)ethyl]phenyl]sulfonyl]-3-(trans-4- Methylcyclohexyl)harnstoff (C24H34N4O5S) mit einem Molekulargewicht von 490,62. Glimepirid ist ein weißes bis gelblich-weißes, kristallines, geruchloses bis praktisch geruchloses Pulver und ist in Wasser praktisch unlöslich. Die Strukturformel lautet:
AMARYL Tabletten enthalten den Wirkstoff Glimepirid und die folgenden Hilfsstoffe: Lactose (wässrig), Natriumstärkeglycolat, Povidon, mikrokristalline Cellulose und Magnesiumstearat. Darüber hinaus enthalten AMARYL 1 mg Tabletten Eisenoxidrot, AMARYL 2 mg Tabletten enthalten Eisenoxidgelb und FD&C Blau Nr. 2 Aluminiumlack und AMARYL 4 mg Tabletten enthalten FD&C Blau Nr. 2 Aluminiumlack.
INDIKATIONEN
AMARYL 2 mg ist indiziert als Ergänzung zu Diät und Bewegung zur Verbesserung der glykämischen Kontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus [siehe Klinische Studien ].
Wichtige Nutzungsbeschränkungen
AMARYL sollte nicht zur Behandlung von Typ-1-Diabetes mellitus oder diabetischer Ketoazidose angewendet werden, da es in diesen Situationen nicht wirksam wäre.
DOSIERUNG UND ANWENDUNG
Empfohlene Dosierung
AMARYL 1 mg sollte mit dem Frühstück oder der ersten Hauptmahlzeit des Tages eingenommen werden.
Die empfohlene Anfangsdosis von AMARYL beträgt 1 mg oder 2 mg einmal täglich. Patienten mit erhöhtem Risiko für Hypoglykämie (z. B. ältere Menschen oder Patienten mit eingeschränkter Nierenfunktion) sollten mit 1 mg einmal täglich begonnen werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Populationen ].
Nach Erreichen einer Tagesdosis von 2 mg können weitere Dosiserhöhungen in Schritten von 1 mg oder 2 mg je nach glykämischer Reaktion des Patienten vorgenommen werden. Die Auftitration sollte nicht häufiger als alle 1-2 Wochen erfolgen. Bei Patienten mit erhöhtem Hypoglykämierisiko wird ein konservatives Titrationsschema empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Populationen ].
Die empfohlene Höchstdosis beträgt 8 mg einmal täglich.
Patienten, die von Sulfonylharnstoffen mit längerer Halbwertszeit (z. B. Chlorpropamid) auf AMARYL 1 mg umgestellt werden, können für 1-2 Wochen eine überlappende Arzneimittelwirkung haben und sollten entsprechend auf Hypoglykämie überwacht werden.
Bei gleichzeitiger Anwendung von Colesevelam und Glimepirid sind die maximale Plasmakonzentration und die Gesamtexposition gegenüber Glimepirid verringert. Daher sollte AMARYL 2 mg mindestens 4 Stunden vor Colesevelam verabreicht werden.
WIE GELIEFERT
Darreichungsformen und Stärken
AMARYL 4 mg ist als Tabletten formuliert mit:
Lagerung und Handhabung
AMARYL Tabletten sind in folgenden Stärken und Packungsgrößen erhältlich:
1mg (rosa, flache Oberfläche, länglich mit gekerbten Seiten in doppelter Halbierung, auf einer Seite mit „AMA RYL“ bedruckt) in Flaschen zu 100 ( NDC 0039-0221-10)
2 mg (grün, flach, länglich mit gekerbten Seiten in doppelter Halbierung, auf einer Seite mit „AMA RYL“ bedruckt) in Flaschen zu 100 ( NDC 0039-0222-10)
4mg (blau, flach, länglich mit gekerbten Seiten in doppelter Halbierung, auf einer Seite mit „AMA RYL“ bedruckt) in Flaschen zu 100 ( NDC 0039-0223-10)
Bei 25 °C (77 °F) lagern; Exkursionen erlaubt bis 20 - 25°C (68 - 77°F) (siehe USP kontrollierte Raumtemperatur ).
In gut verschlossenen Behältern mit Sicherheitsverschlüssen abgeben.
sanofi-aventis US LLC, Bridgewater, NJ 08807, EIN UNTERNEHMEN VON SANOFI. Überarbeitet im Dezember 2016
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden nachstehend und an anderer Stelle in der Kennzeichnung ausführlicher erörtert:
In klinischen Studien waren die häufigsten Nebenwirkungen von AMARYL 4 mg Hypoglykämie, Schwindel, Asthenie, Kopfschmerzen und Übelkeit.
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Etwa 2.800 Patienten mit Typ-2-Diabetes wurden in den kontrollierten klinischen Studien mit AMARYL 4 mg behandelt. In diesen Studien wurden etwa 1.700 Patienten mindestens 1 Jahr lang mit AMARYL behandelt.
Tabelle 1 fasst andere unerwünschte Ereignisse als Hypoglykämie zusammen, die in 11 gepoolten placebokontrollierten Studien berichtet wurden, unabhängig davon, ob sie möglicherweise oder wahrscheinlich mit der Studienmedikation zusammenhängen. Die Behandlungsdauer lag zwischen 13 Wochen und 12 Monaten. Die berichteten Begriffe stellen diejenigen dar, die bei mit AMARYL behandelten Patienten mit einer Inzidenz von ≥ 5 % auftraten und häufiger auftraten als bei Patienten, die Placebo erhielten.
Hypoglykämie
In einer randomisierten, doppelblinden, placebokontrollierten Monotherapiestudie mit einer Dauer von 14 Wochen wurden Patienten, die bereits eine Sulfonylharnstoff-Therapie erhielten, einer 3-wöchigen Auswaschphase unterzogen und dann randomisiert entweder AMARYL 1 mg, 4 mg, 8 mg oder Placebo zugeteilt. Patienten, die auf AMARYL 4 mg oder 8 mg randomisiert wurden, wurden je nach Verträglichkeit einer forcierten Titration von einer Anfangsdosis von 1 mg auf diese Enddosen unterzogen [siehe Klinische Studien ]. Die Gesamtinzidenz einer möglichen Hypoglykämie (definiert durch das Vorhandensein mindestens eines Symptoms, von dem der Prüfarzt annahm, dass es mit einer Hypoglykämie zusammenhängen könnte; eine gleichzeitige Glukosemessung war nicht erforderlich) betrug 4 % für AMARYL 1 mg, 17 % für AMARYL 4 mg, 16 % für AMARYL 8 mg und 0 % für Placebo. Alle diese Ereignisse wurden selbst behandelt.
In einer randomisierten, doppelblinden, placebokontrollierten Monotherapiestudie mit einer Dauer von 22 Wochen erhielten die Patienten eine Anfangsdosis von entweder 1 mg AMARYL oder Placebo täglich. Die Dosis von AMARYL 2 mg wurde auf einen Nüchtern-Plasmaglukosezielwert von 90–150 mg/dl titriert. Die letzten Tagesdosen von AMARYL 2 mg waren 1, 2, 3, 4, 6 oder 8 mg [siehe Klinische Studien ]. Die Gesamtinzidenz einer möglichen Hypoglykämie (wie oben für die 14-wöchige Studie definiert) für AMARYL vs. Placebo betrug 19,7 % vs. 3,2 %. Alle diese Ereignisse wurden selbst behandelt.
Gewichtszunahme: AMARYL kann, wie alle Sulfonylharnstoffe, eine Gewichtszunahme verursachen [vgl Klinische Studien ].
Allergische Reaktionen: In klinischen Studien traten bei weniger als 1 % der mit AMARYL behandelten Patienten allergische Reaktionen wie Pruritus, Erythem, Urtikaria und morbilliforme oder makulopapulöse Eruptionen auf. Diese können sich trotz fortgesetzter Behandlung mit AMARYL zurückbilden. Es gibt Postmarketing-Berichte über schwerwiegendere allergische Reaktionen (z. B. Dyspnoe, Hypotonie, Schock) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Labortests
Erhöhte Serum-Alanin-Aminotransferase (ALT): In 11 gepoolten placebokontrollierten Studien mit AMARYL entwickelten 1,9 % der mit AMARYL behandelten Patienten und 0,8 % der mit Placebo behandelten Patienten Serum-ALT, die größer als das 2-fache der Obergrenze des Referenzbereichs war.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von AMARYL nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Medikamente, die den Glukosestoffwechsel beeinflussen
Eine Reihe von Medikamenten beeinflusst den Glukosestoffwechsel und erfordert möglicherweise eine Dosisanpassung von AMARYL 4 mg und eine besonders engmaschige Überwachung auf Hypoglykämie oder sich verschlechternde glykämische Kontrolle.
Im Folgenden finden Sie Beispiele für Medikamente, die die blutzuckersenkende Wirkung von Sulfonylharnstoffen, einschließlich AMARYL 2 mg, verstärken und die Anfälligkeit für und/oder die Intensität von Hypoglykämien erhöhen können: orale Antidiabetika, Pramlintidacetat, Insulin, Angiotensin-Converting-Enzym (ACE)-Hemmer, H2-Rezeptorantagonisten, Fibrate, Propoxyphen, Pentoxifyllin, Somatostatin-Analoga, anabole Steroide und Androgene, Cyclophosphamid, Phenyramidol, Guanethidin, Fluconazol, Sulfinpyrazon, Tetracycline, Clarithromycin, Disopyramid, Chinolone und solche Arzneimittel, die stark an Proteine gebunden sind, wie Fluoxetin, nichtsteroidale entzündungshemmende Arzneimittel, Salicylate, Sulfonamide, Chloramphenicol, Cumarine, Probenecid und Monoaminooxidase-Hemmer. Wenn diese Medikamente einem Patienten verabreicht werden, der AMARYL erhält, ist der Patient engmaschig auf Hypoglykämie zu überwachen. Wenn diese Medikamente einem Patienten, der AMARYL 2 mg erhält, abgesetzt werden, überwachen Sie den Patienten engmaschig auf eine Verschlechterung der glykämischen Kontrolle.
Im Folgenden sind Beispiele für Medikamente aufgeführt, die die blutzuckersenkende Wirkung von Sulfonylharnstoffen, einschließlich AMARYL, verringern und zu einer Verschlechterung der glykämischen Kontrolle führen können: Danazol, Glukagon, Somatropin, Proteasehemmer, atypische Antipsychotika (z. B. Olanzapin und Clozapin), Barbiturate, Diazoxid, Abführmittel , Rifampin, Thiazide und andere Diuretika, Kortikosteroide, Phenothiazine, Schilddrüsenhormone, Östrogene, orale Kontrazeptiva, Phenytoin, Nikotinsäure, Sympathomimetika (z. B. Epinephrin, Albuterol, Terbutalin) und Isoniazid. Wenn diese Medikamente einem Patienten verabreicht werden, der AMARYL 2 mg erhält, ist der Patient engmaschig auf eine Verschlechterung der glykämischen Kontrolle zu überwachen. Wenn diese Medikamente einem Patienten, der AMARYL 2 mg erhält, abgesetzt werden, ist der Patient engmaschig auf Hypoglykämie zu überwachen.
Betablocker, Clonidin und Reserpin können zu einer Verstärkung oder Abschwächung der blutzuckersenkenden Wirkung von AMARYL führen.
Sowohl akuter als auch chronischer Alkoholkonsum kann die blutzuckersenkende Wirkung von AMARYL 1 mg auf unvorhersehbare Weise verstärken oder abschwächen.
Die Anzeichen einer Hypoglykämie können bei Patienten, die Sympatholytika wie Betablocker, Clonidin, Guanethidin und Reserpin einnehmen, reduziert sein oder fehlen.
Miconazol
Es wurde über eine mögliche Wechselwirkung zwischen oralem Miconazol und Sulfonylharnstoffen berichtet, die zu schwerer Hypoglykämie führt. Ob diese Wechselwirkung auch bei anderen Darreichungsformen von Miconazol auftritt, ist nicht bekannt.
Cytochrom P450 2C9 Wechselwirkungen
Es kann eine Wechselwirkung zwischen Glimepirid und Inhibitoren (z. B. Fluconazol) und Induktoren (z. B. Rifampin) von Cytochrom P450 2C9 geben. Fluconazol kann den Metabolismus von Glimepirid hemmen, was zu erhöhten Plasmakonzentrationen von Glimepirid führen kann, was zu Hypoglykämie führen kann. Rifampin kann den Metabolismus von Glimepirid induzieren, was zu verringerten Plasmakonzentrationen von Glimepirid führt, was zu einer Verschlechterung der glykämischen Kontrolle führen kann.
Gleichzeitige Verabreichung von Colesevelam
Colesevelam kann die maximale Plasmakonzentration und die Gesamtexposition von Glimepirid verringern, wenn beide gleichzeitig verabreicht werden. Die Resorption wird jedoch nicht verringert, wenn Glimepirid 4 Stunden vor Colesevelam verabreicht wird. Daher sollte AMARYL mindestens 4 Stunden vor Colesevelam verabreicht werden.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Hypoglykämie
Alle Sulfonylharnstoffe, einschließlich AMARYL, können eine schwere Hypoglykämie verursachen [siehe NEBENWIRKUNGEN ]. Die Konzentrations- und Reaktionsfähigkeit des Patienten kann als Folge einer Hypoglykämie beeinträchtigt sein. Diese Beeinträchtigungen können in Situationen ein Risiko darstellen, in denen diese Fähigkeiten besonders wichtig sind, wie z. B. beim Autofahren oder Bedienen anderer Maschinen. Eine schwere Hypoglykämie kann zu Bewusstlosigkeit oder Krämpfen führen und kann zu einer vorübergehenden oder dauerhaften Beeinträchtigung der Gehirnfunktion oder zum Tod führen.
Die Patienten müssen darin geschult werden, Hypoglykämien zu erkennen und zu behandeln. Seien Sie vorsichtig, wenn Sie bei Patienten, die möglicherweise für Hypoglykämie prädisponiert sind (z. B. ältere Menschen, Patienten mit eingeschränkter Nierenfunktion, Patienten, die andere Antidiabetika einnehmen), mit der Einnahme von AMARYL 2 mg beginnen und die Dosis erhöhen. Geschwächte oder unterernährte Patienten und Patienten mit eingeschränkter Nebennieren-, Hypophysen- oder Leberfunktion sind besonders anfällig für die hypoglykämische Wirkung von blutzuckersenkenden Medikamenten. Eine Hypoglykämie tritt auch eher auf, wenn die Kalorienaufnahme unzureichend ist, nach schwerer oder längerer körperlicher Betätigung oder wenn Alkohol eingenommen wird.
Frühwarnsymptome einer Hypoglykämie können bei Patienten mit autonomer Neuropathie, älteren Menschen und bei Patienten, die Betablocker oder andere Sympatholytika einnehmen, anders oder weniger ausgeprägt sein. Diese Situationen können zu schwerer Hypoglykämie führen, bevor der Patient sich der Hypoglykämie bewusst ist.
Überempfindlichkeitsreaktionen
Nach der Markteinführung liegen Berichte über Überempfindlichkeitsreaktionen bei Patienten vor, die mit AMARYL behandelt wurden, einschließlich schwerwiegender Reaktionen wie Anaphylaxie, Angioödem und Stevens-Johnson-Syndrom. Wenn eine Überempfindlichkeitsreaktion vermutet wird, setzen Sie AMARYL unverzüglich ab, suchen Sie nach anderen möglichen Ursachen für die Reaktion und leiten Sie eine alternative Behandlung für Diabetes ein.
Hämolytische Anämie
Sulfonylharnstoffe können bei Patienten mit Glucose-6-Phosphat-Dehydrogenase (G6PD)-Mangel eine hämolytische Anämie verursachen. Da AMARYL 4 mg ein Sulfonylharnstoff ist, seien Sie bei Patienten mit G6PD-Mangel vorsichtig und ziehen Sie die Verwendung einer Alternative ohne Sulfonylharnstoff in Betracht. Es gibt auch Postmarketing-Berichte über hämolytische Anämie bei Patienten, die AMARYL 1 mg erhielten und keinen bekannten G6PD-Mangel hatten [siehe NEBENWIRKUNGEN ].
Erhöhtes Risiko für kardiovaskuläre Mortalität mit Sulfonylharnstoffen
Es wurde berichtet, dass die Verabreichung oraler hypoglykämischer Arzneimittel mit einer erhöhten kardiovaskulären Sterblichkeit im Vergleich zu einer Behandlung mit einer Diät allein oder einer Diät plus Insulin verbunden ist. Diese Warnung basiert auf der vom University Group Diabetes Program (UGDP) durchgeführten Studie, einer langfristigen, prospektiven klinischen Studie zur Bewertung der Wirksamkeit von blutzuckersenkenden Arzneimitteln zur Vorbeugung oder Verzögerung vaskulärer Komplikationen bei nicht insulinabhängigen Patienten Diabetes. An der Studie nahmen 823 Patienten teil, die nach dem Zufallsprinzip einer von vier Behandlungsgruppen zugeordnet wurden. UGDP berichtete, dass Patienten, die 5 bis 8 Jahre lang mit einer Diät plus einer festen Dosis Tolbutamid (1,5 Gramm pro Tag) behandelt wurden, eine etwa 2-½-fache kardiovaskuläre Sterblichkeitsrate aufwiesen die von Patienten, die nur mit Diät behandelt werden. Ein signifikanter Anstieg der Gesamtmortalität wurde nicht beobachtet, aber die Anwendung von Tolbutamid wurde aufgrund des Anstiegs der kardiovaskulären Mortalität eingestellt, wodurch die Möglichkeit der Studie, einen Anstieg der Gesamtmortalität zu zeigen, eingeschränkt wurde. Trotz Kontroversen bezüglich der Interpretation dieser Ergebnisse bieten die Ergebnisse der UGDP-Studie eine angemessene Grundlage für diese Warnung. Der Patient sollte über die möglichen Risiken und Vorteile von AMARYL 4 mg und über alternative Therapieformen aufgeklärt werden. Obwohl nur ein Medikament aus der Klasse der Sulfonylharnstoffe (Tolbutamid) in diese Studie eingeschlossen wurde, ist es aus Sicherheitsgründen ratsam zu berücksichtigen, dass dieser Warnhinweis auch für andere orale hypoglykämische Medikamente in dieser Klasse gelten kann, angesichts ihrer großen Ähnlichkeiten in der Wirkungsweise Wirkung und chemische Struktur.
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit AMARYL oder anderen Antidiabetika erbrachten.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Studien an Ratten mit Dosen von bis zu 5000 Teilen pro Million (ppm) im Alleinfuttermittel (etwa das 340-fache der maximal empfohlenen Dosis beim Menschen, basierend auf der Oberfläche) über 30 Monate ergaben keine Hinweise auf Karzinogenese. Bei Mäusen führte die Verabreichung von Glimepirid über 24 Monate zu einer dosisabhängigen Zunahme der gutartigen Pankreasadenombildung, von der angenommen wurde, dass sie das Ergebnis einer chronischen Pankreasstimulation ist. Bei Mäusen wurde bei einer Dosis von 320 ppm im Alleinfuttermittel bzw. 46-54 mg/kg Körpergewicht/Tag keine Adenombildung beobachtet. Dies entspricht etwa dem 35-fachen der für den Menschen empfohlenen Höchstdosis von 8 mg einmal täglich, bezogen auf die Oberfläche.
Glimepirid war in einer Reihe von In-vitro- und In-vivo-Mutagenitätsstudien (Ames-Test, somatische Zellmutation, Chromosomenaberration, außerplanmäßige DNA-Synthese und Maus-Mikrokerntest) nicht mutagen.
Bei Tieren, die bis zu 2.500 mg/kg Körpergewicht (> 1.700-fache der maximal empfohlenen Humandosis, bezogen auf die Oberfläche) ausgesetzt waren, hatte Glimepirid keine Wirkung auf die Fertilität männlicher Mäuse. Glimepirid hatte keine Wirkung auf die Fertilität männlicher und weiblicher Ratten, die bis zu 4000 mg/kg Körpergewicht (etwa das 4000-fache der empfohlenen Höchstdosis für den Menschen, bezogen auf die Oberfläche) verabreicht wurden.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Es liegen keine ausreichenden und gut kontrollierten Studien zu AMARYL 2 mg bei Schwangeren vor. In Tierstudien gab es keine Zunahme angeborener Anomalien, aber bei Ratten und Kaninchen bei Glimepirid-Dosen, die dem 50-Fachen (Ratten) und dem 0,1-Fachen (Kaninchen) der maximal empfohlenen Humandosis (basierend auf der Körperoberfläche) entsprachen, trat eine Zunahme an fötalen Todesfällen auf. Diese Fetotoxizität, die nur bei Dosen beobachtet wurde, die eine mütterliche Hypoglykämie hervorrufen, steht vermutlich in direktem Zusammenhang mit der pharmakologischen (hypoglykämischen) Wirkung von Glimepirid und wurde in ähnlicher Weise bei anderen Sulfonylharnstoffen beobachtet. AMARYL sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Da Daten darauf hindeuten, dass ein abnormaler Blutzucker während der Schwangerschaft mit einer höheren Inzidenz angeborener Anomalien verbunden ist, sollte die Diabetesbehandlung während der Schwangerschaft den Blutzucker so nahe wie möglich am Normalwert halten.
Nicht teratogene Wirkungen
Bei Neugeborenen von Müttern, die zum Zeitpunkt der Geburt einen Sulfonylharnstoff erhielten, wurde über eine anhaltende schwere Hypoglykämie (4 bis 10 Tage) berichtet.
Stillende Mutter
Es ist nicht bekannt, ob AMARYL 1 mg in die Muttermilch übergeht. Während prä- und postnataler Studien an Ratten waren signifikante Konzentrationen von Glimepirid in der Muttermilch und im Serum der Jungtiere vorhanden. Nachkommen von Ratten, die während der Trächtigkeit und Laktation hohen Glimepiridspiegeln ausgesetzt waren, entwickelten während der postnatalen Phase Skelettdeformitäten, die aus einer Verkürzung, Verdickung und Biegung des Oberarmknochens bestanden. Es wurde festgestellt, dass diese Skelettdeformationen das Ergebnis des Stillens von Müttern waren, die Glimepirid ausgesetzt waren. Basierend auf diesen Tierdaten und der Möglichkeit einer Hypoglykämie bei einem gestillten Säugling sollte eine Entscheidung getroffen werden, ob das Stillen beendet oder AMARYL 2 mg abgesetzt werden soll, wobei die Bedeutung von AMARYL für die Mutter zu berücksichtigen ist.
Pädiatrische Verwendung
Die Pharmakokinetik, Wirksamkeit und Sicherheit von AMARYL 4 mg wurden bei pädiatrischen Patienten mit Typ-2-Diabetes wie unten beschrieben untersucht. AMARYL 4 mg wird bei pädiatrischen Patienten wegen seiner nachteiligen Auswirkungen auf das Körpergewicht und Hypoglykämie nicht empfohlen.
Die Pharmakokinetik einer Einzeldosis von 1 mg AMARYL wurde bei 30 Patienten mit Typ-2-Diabetes (männlich = 7; weiblich = 23) im Alter zwischen 10 und 17 Jahren untersucht. Die mittlere (±SD) AUC (339±203 ng·h/ml), Cmax (102±48 ng/ml) und t½ (3,1±1,7 Stunden) für Glimepirid waren vergleichbar mit historischen Daten von Erwachsenen (AUC(0-last ) 315±96 ng·h/ml, Cmax 103±34 ng/ml und t½ 5,3±4,1 Stunden).
Die Sicherheit und Wirksamkeit von AMARYL bei pädiatrischen Patienten wurde in einer einfach verblindeten, 24-wöchigen Studie untersucht, in der 272 Patienten (8-17 Jahre) mit Typ-2-Diabetes randomisiert einer Behandlung mit AMARYL (n=135) oder Metformin (n=137) zugeteilt wurden ). Teilnahmeberechtigt waren sowohl behandlungsnaive Patienten (solche, die vor der Randomisierung mindestens 2 Wochen lang nur mit Diät und Bewegung behandelt wurden) als auch vorbehandelte Patienten (solche, die mindestens 3 Monate lang mit anderen oralen Antidiabetika behandelt wurden oder derzeit behandelt werden). Patienten, die zum Zeitpunkt des Studieneintritts orale Antidiabetika erhielten, brachen diese Medikamente vor der Randomisierung ohne Auswaschphase ab. Die Behandlung mit AMARYL wurde mit 1 mg begonnen und dann bis Woche 12 auf 2, 4 oder 8 mg (mittlere letzte Dosis 4 mg) titriert, wobei ein selbstkontrollierter Nüchtern-Blutzuckerwert
Nach 24 Wochen betrug der durchschnittliche HbA1c-Unterschied zwischen AMARYL 4 mg und Metformin insgesamt 0,2 % zugunsten von Metformin (95 % Konfidenzintervall -0,3 % bis +0,6 %). Basierend auf diesen Ergebnissen hat die Studie ihr primäres Ziel nicht erreicht, eine ähnliche Senkung des HbA1c mit AMARYL 4 mg im Vergleich zu Metformin zu zeigen.
Das Nebenwirkungsprofil bei pädiatrischen Patienten, die mit AMARYL 2 mg behandelt wurden, war ähnlich wie bei Erwachsenen [siehe NEBENWIRKUNGEN ].
Hypoglykämische Ereignisse, dokumentiert durch Blutzuckerwerte
Geriatrische Verwendung
In klinischen Studien mit AMARYL 2 mg waren 1053 von 3491 Patienten (30 %) > 65 Jahre alt. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Patienten und jüngeren Patienten beobachtet, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Es gab keine signifikanten Unterschiede in der Pharmakokinetik von Glimepirid zwischen Patienten mit Typ-2-Diabetes ≤ 65 Jahre (n = 49) und Patienten > 65 Jahre (n = 42) [siehe KLINISCHE PHARMAKOLOGIE ].
Glimepirid wird im Wesentlichen über die Nieren ausgeschieden. Ältere Patienten haben häufiger eine Nierenfunktionsstörung. Darüber hinaus kann es bei älteren Menschen schwierig sein, eine Hypoglykämie zu erkennen [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Seien Sie vorsichtig, wenn Sie mit AMARYL beginnen und die Dosis von AMARYL 1 mg bei dieser Patientengruppe erhöhen.
Nierenfunktionsstörung
Um das Risiko einer Hypoglykämie zu minimieren, beträgt die empfohlene Anfangsdosis von AMARYL 1 mg täglich für alle Patienten mit Typ-2-Diabetes und eingeschränkter Nierenfunktion [siehe DOSIERUNG UND ANWENDUNG und WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Bei 16 Patienten mit Typ-2-Diabetes und eingeschränkter Nierenfunktion wurde eine Mehrfachdosistitrationsstudie mit Dosen von 1 mg bis 8 mg täglich über 3 Monate durchgeführt. Die Baseline-Kreatinin-Clearance lag im Bereich von 10–60 ml/min. Die Pharmakokinetik von AMARYL wurde in der Mehrfachdosis-Titrationsstudie bewertet und die Ergebnisse stimmten mit denen überein, die bei Patienten beobachtet wurden, die an einer Einzeldosis-Studie teilgenommen hatten. In beiden Studien nahm die relative Gesamtclearance von AMARYL zu, wenn die Nierenfunktion eingeschränkt war. Beide Studien zeigten auch, dass die Elimination der beiden Hauptmetaboliten bei Patienten mit eingeschränkter Nierenfunktion reduziert war [vgl KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Eine Überdosierung von AMARYL 2 mg kann wie bei anderen Sulfonylharnstoffen zu schwerer Hypoglykämie führen. Leichte Episoden von Hypoglykämie können mit oraler Glukose behandelt werden. Schwere hypoglykämische Reaktionen stellen medizinische Notfälle dar, die eine sofortige Behandlung erfordern. Schwere Hypoglykämie mit Koma, Krampfanfällen oder neurologischen Beeinträchtigungen kann mit Glukagon oder intravenöser Glukose behandelt werden. Eine fortgesetzte Überwachung und zusätzliche Kohlenhydrataufnahme können erforderlich sein, da eine Hypoglykämie nach offensichtlicher klinischer Erholung wieder auftreten kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KONTRAINDIKATIONEN
AMARYL ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeitsreaktion auf:
Sulfonamid-Derivate: Patienten, die eine allergische Reaktion auf Sulfonamid-Derivate entwickelt haben, können eine allergische Reaktion auf AMARYL entwickeln. Verwenden Sie AMARYL 4 mg nicht bei Patienten, die in der Vorgeschichte eine allergische Reaktion auf Sulfonamid-Derivate hatten.
Berichtete Überempfindlichkeitsreaktionen umfassen Hautausschläge mit oder ohne Pruritus sowie schwerwiegendere Reaktionen (z. B. Anaphylaxie, Angioödem, Stevens-Johnson-Syndrom, Dyspnoe) [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Glimepirid senkt hauptsächlich den Blutzucker, indem es die Freisetzung von Insulin aus Betazellen der Bauchspeicheldrüse stimuliert. Sulfonylharnstoffe binden an den Sulfonylharnstoffrezeptor in der Plasmamembran der Betazellen der Bauchspeicheldrüse, was zur Schließung des ATP-empfindlichen Kaliumkanals führt und dadurch die Freisetzung von Insulin stimuliert.
Pharmakodynamik
Bei gesunden Probanden betrug die Zeit bis zum Erreichen der maximalen Wirkung (minimale Blutzuckerkonzentrationen) etwa 2-3 Stunden nach oraler Einzeldosis von AMARYL. Die Wirkungen von AMARYL auf HbA1c, Nüchtern-Plasmaglukose und postprandiale Glukose wurden in klinischen Studien untersucht [siehe Klinische Studien ].
Pharmakokinetik
Absorption
Studien mit oralen Einzeldosen von Glimepirid bei gesunden Probanden und mit oralen Mehrfachdosen bei Patienten mit Typ-2-Diabetes zeigten Spitzenkonzentrationen (Cmax) des Arzneimittels 2 bis 3 Stunden nach der Einnahme. Wenn Glimepirid zu den Mahlzeiten gegeben wurde, verringerten sich die mittlere Cmax und AUC (Fläche unter der Kurve) um 8 % bzw. 9 %.
Glimepirid reichert sich nach Mehrfachgabe nicht im Serum an. Die Pharmakokinetik von Glimepirid unterscheidet sich nicht zwischen gesunden Probanden und Patienten mit Typ-2-Diabetes. Die Clearance von Glimepirid nach oraler Gabe ändert sich im Dosisbereich von 1 mg bis 8 mg nicht, was auf eine lineare Pharmakokinetik hindeutet.
Bei gesunden Probanden betrugen die intra- und interindividuellen Schwankungen der pharmakokinetischen Parameter von Glimepirid 15-23 % bzw. 24-29 %.
Verteilung
Nach intravenöser Verabreichung an gesunde Probanden betrug das Verteilungsvolumen (Vd) 8,8 l (113 ml/kg) und die Gesamtkörperclearance (CL) 47,8 ml/min. Die Proteinbindung war größer als 99,5 %.
Stoffwechsel
Glimepirid wird entweder nach intravenöser oder oraler Gabe vollständig durch oxidative Biotransformation metabolisiert. Die Hauptmetaboliten sind das Cyclohexylhydroxymethyl-Derivat (M1) und das Carboxyl-Derivat (M2). Cytochrom P450 2C9 ist an der Biotransformation von Glimepirid zu M1 beteiligt. M1 wird durch ein oder mehrere zytosolische Enzyme weiter zu M2 metabolisiert. M2 ist inaktiv. Bei Tieren besitzt M1 etwa ein Drittel der pharmakologischen Aktivität von Glimepirid, aber es ist unklar, ob M1 zu klinisch bedeutsamen Wirkungen auf den Blutzucker beim Menschen führt.
Ausscheidung
Nach oraler Gabe von 14C-Glimepirid an 3 gesunde männliche Probanden wurden innerhalb von 7 Tagen etwa 60 % der Gesamtradioaktivität im Urin wiedergefunden. M1 und M2 machten 80-90 % der im Urin wiedergefundenen Radioaktivität aus. Das Verhältnis von M1 zu M2 im Urin betrug etwa 3:2 bei zwei Probanden und 4:1 bei einem Probanden. Ungefähr 40 % der gesamten Radioaktivität wurde im Kot wiedergefunden. M1 und M2 machten etwa 70 % (Verhältnis von M1 zu M2 war 1:3) der im Kot wiedergefundenen Radioaktivität aus. Aus Urin oder Fäkalien wurde kein Ausgangsarzneimittel gewonnen. Nach intravenöser Verabreichung an Patienten wurde keine signifikante biliäre Ausscheidung von Glimepirid oder seines M1-Metaboliten beobachtet.
Geriatrische Patienten
Ein Vergleich der Pharmakokinetik von Glimepirid bei Patienten mit Typ-2-Diabetes ≤ 65 Jahren und Patienten > 65 Jahren wurde in einer Mehrfachdosisstudie mit täglich 6 mg AMARYL bewertet. Es gab keine signifikanten Unterschiede in der Pharmakokinetik von Glimepirid zwischen den beiden Altersgruppen. Die mittlere AUC im Steady State war bei den älteren Patienten etwa 13 % niedriger als bei den jüngeren Patienten; die mittlere gewichtsbereinigte Clearance war bei den älteren Patienten etwa 11 % höher als bei den jüngeren Patienten.
Geschlecht
Es gab keine Unterschiede zwischen Männern und Frauen in der Pharmakokinetik von Glimepirid, wenn Anpassungen für Unterschiede im Körpergewicht vorgenommen wurden.
Wettrennen
Es wurden keine Studien durchgeführt, um die Auswirkungen der Rasse auf die Pharmakokinetik von Glimepirid zu beurteilen, aber in placebokontrollierten Studien mit AMARYL 2 mg bei Patienten mit Typ-2-Diabetes war die Senkung des HbA bei Kaukasiern (n = 536) und Schwarzen (n = 63) vergleichbar. , und Hispanics (n = 63).
Nierenfunktionsstörung
In einer offenen Studie mit Einzeldosis AMARYL 3 mg wurde Patienten mit leichter, mittelschwerer und schwerer Nierenfunktionsstörung, geschätzt anhand der Kreatinin-Clearance (CLcr), verabreicht: Gruppe I bestand aus 5 Patienten mit leichter Nierenfunktionsstörung (CLcr > 50 ml/min ), Gruppe II bestand aus 3 Patienten mit mäßiger Nierenfunktionsstörung (CLcr = 20-50 ml/min) und Gruppe III bestand aus 7 Patienten mit schwerer Nierenfunktionsstörung (CLcr
Leberfunktionsstörung
Es ist nicht bekannt, ob sich eine Leberfunktionsstörung auf die Pharmakokinetik von AMARYL 1 mg auswirkt, da die Pharmakokinetik von AMARYL 1 mg bei Patienten mit Leberfunktionsstörung nicht ausreichend untersucht wurde.
Übergewichtige Patienten
Die Pharmakokinetik von Glimepirid und seinen Metaboliten wurde in einer Einzeldosisstudie an 28 Patienten mit Typ-2-Diabetes gemessen, die entweder ein normales Körpergewicht hatten oder krankhaft fettleibig waren. Während tmax, Clearance und Verteilungsvolumen von Glimepirid bei krankhaft fettleibigen Patienten ähnlich denen in der Gruppe mit normalem Gewicht waren, hatten krankhaft fettleibige Patienten niedrigere Cmax und AUC als diejenigen mit normalem Körpergewicht. Die mittleren Cmax-, AUC0-24-, AUC0-∞-Werte von Glimepirid bei normalen vs. krankhaft adipösen Patienten waren 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 Stunden·ng/ml vs. 2820 ± 1110 Stunden·ng/ml bzw. 4000 ± 1320 Stunden·ng/ml gegenüber 3280 ± 1360 Stunden·ng/ml.
Wechselwirkungen mit anderen Medikamenten
Aspirin: In einer randomisierten, doppelblinden Crossover-Studie über zwei Perioden erhielten gesunde Probanden dreimal täglich entweder Placebo oder 1 Gramm Aspirin für eine Gesamtbehandlungsdauer von 5 Tagen. An Tag 4 jedes Studienzeitraums wurde eine Einzeldosis von 1 mg AMARYL 4 mg verabreicht. Zwischen den AMARYL-4-mg-Dosen lag eine 14-tägige Auswaschphase. Die gleichzeitige Anwendung von Aspirin und AMARYL 4 mg führte zu einer Verringerung der mittleren AUC von Glimepirid um 34 % und einer Verringerung der mittleren Cmax von Glimepirid um 4 %.
Colesevelam: Die gleichzeitige Anwendung von Colesevelam und Glimepirid führte zu einer Verringerung der AUC0-∞ und Cmax von Glimepirid um 18 % bzw. 8 %. Wenn Glimepirid 4 Stunden vor Colesevelam verabreicht wurde, gab es keine signifikante Veränderung der AUC0-∞ und Cmax von Glimepirid, -6 % bzw. 3 % [siehe DOSIERUNG UND ANWENDUNG und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Cimetidin und Ranitidin: In einer randomisierten, unverblindeten 3-Wege-Crossover-Studie erhielten gesunde Probanden entweder eine Einzeldosis von 4 mg AMARYL allein, AMARYL mit Ranitidin (150 mg zweimal täglich für 4 Tage; AMARYL 2 mg wurde an Tag 3 verabreicht) oder AMARYL 2 mg mit Cimetidin (800 mg täglich für 4 Tage; AMARYL wurde an Tag 3 verabreicht). Die gleichzeitige Verabreichung von Cimetidin oder Ranitidin mit einer oralen Einzeldosis von 4 mg AMARYL 4 mg veränderte die Resorption und Disposition von Glimepirid nicht signifikant.
Propranolol: In einer randomisierten, doppelblinden Crossover-Studie über zwei Perioden erhielten gesunde Probanden entweder Placebo oder 40 mg Propranolol dreimal täglich für eine Gesamtbehandlungsdauer von 5 Tagen. An Tag 4 oder jedem Studienzeitraum wurde eine Einzeldosis von 2 mg AMARYL 4 mg verabreicht. Zwischen den AMARYL-4-mg-Dosen lag eine 14-tägige Auswaschphase. Die gleichzeitige Gabe von Propranolol und AMARYL 1 mg erhöhte die Cmax, AUC und T½ von Glimepirid signifikant um 23 %, 22 % bzw. 15 % und verringerte die CL/f von Glimepirid um 18 %. Die Wiederfindung von M1 und M2 aus dem Urin war nicht verändert.
Warfarin: In einer offenen, zweifachen Crossover-Studie erhielten gesunde Probanden 10 Tage lang täglich 4 mg AMARYL 2 mg. Einzeldosen von 25 mg Warfarin wurden 6 Tage vor Beginn der Behandlung mit AMARYL und an Tag 4 der Verabreichung von AMARYL verabreicht. Die gleichzeitige Verabreichung von AMARYL veränderte die Pharmakokinetik von R- und S-Warfarin-Enantiomeren nicht. Bei der Plasmaproteinbindung von Warfarin wurden keine Veränderungen beobachtet. AMARYL 1 mg führte zu einer statistisch signifikanten Abnahme der pharmakodynamischen Reaktion auf Warfarin. Die Verringerungen der mittleren Fläche unter der Prothrombinzeitkurve (PT) und der maximalen PT-Werte während der AMARYL-Behandlung betrugen 3,3 % bzw. 9,9 % und sind wahrscheinlich nicht klinisch relevant.
Klinische Studien
Monotherapie
Insgesamt 304 Patienten mit Typ-2-Diabetes, die bereits mit einer Sulfonylharnstoff-Therapie behandelt wurden, nahmen an einer 14-wöchigen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie zur Untersuchung der Sicherheit und Wirksamkeit der Monotherapie mit AMARYL 1 mg teil. Die Patienten brachen ihre Sulfonylharnstoff-Therapie ab und traten dann in eine 3-wöchige Auswaschphase mit Placebo ein, gefolgt von einer Randomisierung in 1 von 4 Behandlungsgruppen: Placebo (n = 74), AMARYL 1 mg (n = 78), AMARYL 4 mg (n = 76) und AMARYL 8 mg (n = 76). Alle Patienten, die auf AMARYL 4 mg randomisiert wurden, begannen mit 1 mg täglich. Patienten, die auf AMARYL 4 mg oder 8 mg randomisiert wurden, erhielten eine verblindete, forcierte Titration der AMARYL 2 mg-Dosis in wöchentlichen Abständen, zunächst auf 4 mg und dann auf 8 mg, solange die Dosis vertragen wurde, bis die randomisierte Dosis erreicht war. Patienten, die auf die 4-mg-Dosis randomisiert wurden, erreichten die zugewiesene Dosis in Woche 2. Patienten, die auf die 8-mg-Dosis randomisiert wurden, erreichten die zugewiesene Dosis in Woche 3. Sobald die randomisierte Dosis erreicht war, sollten die Patienten diese Dosis bis Woche 14 beibehalten. Ungefähr 66 % der mit Placebo behandelten Patienten beendeten die Studie im Vergleich zu 81 % der mit 1 mg Glimepirid behandelten Patienten und 92 % der mit 4 mg oder 8 mg Glimepirid behandelten Patienten. Im Vergleich zu Placebo führte die Behandlung mit AMARYL 1 mg, 4 mg und 8 mg täglich zu statistisch signifikanten Verbesserungen des HbA1c im Vergleich zu Placebo (Tabelle 3).
Insgesamt 249 Patienten, die behandlungsnaiv waren oder in der Vergangenheit eine begrenzte Behandlung mit einer antidiabetischen Therapie erhalten hatten, wurden randomisiert und erhielten in einem randomisierten Multicenter eine 22-wöchige Behandlung mit AMARYL (n = 123) oder Placebo (n = 126). , doppelblinde, placebokontrollierte Dosistitrationsstudie. Die Anfangsdosis von AMARYL betrug 1 mg täglich und wurde in 2-wöchigen Intervallen auf einen FPG-Zielwert von 90-150 mg/dl auf- oder abtitriert. Die Blutzuckerwerte sowohl für FPG als auch für PPG wurden im Labor analysiert. Nach 10-wöchiger Dosisanpassung wurden die Patienten für die verbleibenden 12 Wochen der Studie auf ihrer optimalen Dosis (1, 2, 3, 4, 6 oder 8 mg) gehalten. Die Behandlung mit AMARYL 2 mg führte zu statistisch signifikanten Verbesserungen von HbA1c und FPG im Vergleich zu Placebo (Tabelle 4).
INFORMATIONEN ZUM PATIENTEN
Informieren Sie die Patienten über die Bedeutung der Einhaltung von Ernährungsanweisungen, eines regelmäßigen Bewegungsprogramms und regelmäßiger Blutzuckermessungen.
Informieren Sie die Patienten über die möglichen Nebenwirkungen von AMARYL 1 mg, einschließlich Hypoglykämie und Gewichtszunahme.
Erklären Sie die Symptome und Behandlung von Hypoglykämie sowie Bedingungen, die eine Hypoglykämie prädisponieren. Die Patienten sollten darüber informiert werden, dass die Konzentrations- und Reaktionsfähigkeit als Folge einer Hypoglykämie beeinträchtigt sein kann. Dies kann in Situationen, in denen diese Fähigkeiten besonders wichtig sind, wie z. B. beim Autofahren oder Bedienen anderer Maschinen, ein Risiko darstellen.
Patienten mit Diabetes sollten angewiesen werden, ihren Arzt zu informieren, wenn sie schwanger sind, eine Schwangerschaft in Betracht ziehen, stillen oder stillen möchten.