Clarinex 5mg Desloratadine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
CLARINEX® (Desloratadin) Tabletten
BEZEICHNUNG
CLARINEX (Desloratadin) Tabletten sind hellblaue, runde Filmtabletten mit 5 mg Desloratadin, einem Antihistaminikum, zur oralen Verabreichung. CLARINEX 5 mg Tabletten enthalten außerdem die folgenden Hilfsstoffe: dibasisches Calciumphosphat-Dihydrat USP, mikrokristalline Cellulose NF, Maisstärke NF, Talkum USP, Carnaubawachs NF, weißes Wachs NF, Beschichtungsmaterial bestehend aus Lactose-Monohydrat, Hypromellose, Titandioxid, Polyethylenglycol und FD&C Blau Nr. 2 Aluminiumlack.
CLARINEX Lösung zum Einnehmen ist eine klare, orangefarbene Flüssigkeit, die 0,5 mg/1 ml Desloratadin enthält. Die Lösung zum Einnehmen enthält die folgenden inaktiven Bestandteile: Propylenglycol USP, Sorbitollösung USP, Citronensäure (wasserfrei) USP, Natriumcitratdihydrat USP, Natriumbenzoat NF, Dinatriumedetat USP, gereinigtes Wasser USP. Es enthält auch Kristallzucker, natürliches und künstliches Aroma für Kaugummi und den Farbstoff FDC Yellow #6.
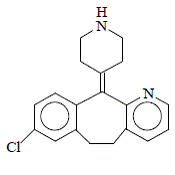
Desloratadin ist ein weißes bis cremefarbenes Pulver, das leicht wasserlöslich, aber sehr gut löslich in Ethanol und Propylenglykol ist. Es hat eine Summenformel: C19H19ClN2 und ein Molekulargewicht von 310,8. Der chemische Name lautet 8-Chlor-6,11-dihydro-11-(4-piperidinyliden)-5H-benzo[5,6]cyclohepta[1,2-b]pyridin und hat die folgende Struktur:
INDIKATIONEN
Saisonale allergische Rhinitis
CLARINEX® ist angezeigt zur Linderung der nasalen und nicht-nasalen Symptome der saisonalen allergischen Rhinitis bei Patienten ab 2 Jahren.
Ganzjährige allergische Rhinitis
CLARINEX ist indiziert zur Linderung der nasalen und nicht-nasalen Symptome der ganzjährigen allergischen Rhinitis bei Patienten ab 6 Monaten.
Chronische idiopathische Urtikaria
CLARINEX 5 mg ist indiziert zur symptomatischen Linderung von Juckreiz, Verringerung der Anzahl und Größe der Nesselsucht bei Patienten mit chronischer idiopathischer Urtikaria ab einem Alter von 6 Monaten.
DOSIERUNG UND ANWENDUNG
Obwohl eine oral zerfallende Tablettenformulierung von Desloratadin möglicherweise auf dem Markt erhältlich ist, werden CLARINEX® RediTabs® Tabletten nicht mehr vermarktet.
CLARINEX 5 mg Tabletten, Lösung zum Einnehmen oder RediTabs Tabletten können unabhängig von den Mahlzeiten eingenommen werden. Legen Sie CLARINEX (Desloratadin) RediTabs Tabletten auf die Zunge und lassen Sie sie vor dem Schlucken zerfallen. Der Tablettenzerfall erfolgt schnell. Mit oder ohne Wasser verabreichen. Nehmen Sie die Tablette sofort nach dem Öffnen der Blisterpackung ein.
Die altersgerechte Dosis CLARINEX Lösung zum Einnehmen sollte mit einer handelsüblichen Messpipette oder Spritze verabreicht werden, die auf 2 ml und 2,5 ml (½ Teelöffel) kalibriert ist.
Erwachsene und Jugendliche ab 12 Jahren
Die empfohlene Dosis von CLARINEX-Tabletten oder CLARINEX RediTabs-Tabletten beträgt einmal täglich eine 5-mg-Tablette. Die empfohlene Dosis von CLARINEX Lösung zum Einnehmen beträgt einmal täglich 2 Teelöffel (5 mg in 10 ml).
Kinder im Alter von 6 bis 11 Jahren
Die empfohlene Dosis von CLARINEX Lösung zum Einnehmen beträgt 1 Teelöffel (2,5 mg in 5 ml) einmal täglich. Die empfohlene Dosis von CLARINEX RediTabs Tabletten beträgt eine 2,5-mg-Tablette einmal täglich.
Kinder im Alter von 12 Monaten bis 5 Jahren
Die empfohlene Dosis von CLARINEX 5 mg Lösung zum Einnehmen beträgt einmal täglich ½ Teelöffel (1,25 mg in 2,5 ml).
Kinder im Alter von 6 bis 11 Monaten
Die empfohlene Dosis von CLARINEX Lösung zum Einnehmen beträgt 2 ml (1 mg) einmal täglich.
Erwachsene mit eingeschränkter Leber- oder Nierenfunktion
Bei erwachsenen Patienten mit eingeschränkter Leber- oder Nierenfunktion wird basierend auf pharmakokinetischen Daten eine Anfangsdosis von einer 5-mg-Tablette jeden zweiten Tag empfohlen. Eine Dosierungsempfehlung für Kinder mit eingeschränkter Leber- oder Nierenfunktion kann aufgrund fehlender Daten nicht gegeben werden [vgl KLINISCHE PHARMAKOLOGIE ].
WIE GELIEFERT
Darreichungsformen und Stärken
CLARINEX Tabletten sind hellblaue Filmtabletten mit der Prägung „C5“, die 5 mg Desloratadin enthalten. CLARINEX Lösung zum Einnehmen ist eine klare, orangefarbene Flüssigkeit, die 0,5 mg Desloratadin/1 ml enthält.
Lagerung und Handhabung
CLARINEX 5 mg Tabletten: Hellblaue Filmtabletten mit der Prägung „C5“, die in Kunststoffflaschen aus Polyethylen hoher Dichte zu 100 ( NDC 0085-1264-01).
CLARINEX 5 mg Lösung zum Einnehmen: Klare orangefarbene Flüssigkeit mit 0,5 mg/1 ml Desloratadin in einer 16-Unzen-Braunglasflasche ( NDC 0085-1334-01) und eine 4-Unzen-Braunglasflasche ( NDC 0085-1334-02).
Lagerung
CLARINEX-Tabletten: Schützen Sie die Unit-of-Use-Verpackung und die Unit-Dose-Krankenhauspackung vor übermäßiger Feuchtigkeit. Bei 25 °C (77 °F) lagern; Exkursionen bis 15-30°C (59-86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Hitzeempfindlich. Exposition bei oder über 30 °C (86 °F) vermeiden.
CLARINEX Lösung zum Einnehmen: Bei 25 °C (77 °F) lagern; Exkursionen bis 15-30°C (59-86°F) erlaubt [siehe USP kontrollierte Raumtemperatur ]. Vor Licht schützen.
Hergestellt für: Merck Sharp & Dohme Corp., eine Tochtergesellschaft von MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Überarbeitet: März 2019
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher besprochen:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Erwachsene und Jugendliche
Allergischer Schnupfen
In Placebo-kontrollierten Mehrfachdosisstudien erhielten 2834 Patienten im Alter von 12 Jahren oder älter CLARINEX-Tabletten in Dosen von 2,5 mg bis 20 mg täglich, von denen 1655 Patienten die empfohlene Tagesdosis von 5 mg erhielten. Bei Patienten, die täglich 5 mg erhielten, war die Häufigkeit unerwünschter Ereignisse bei den mit CLARINEX 5 mg behandelten Patienten und den mit Placebo behandelten Patienten ähnlich. Der Prozentsatz der Patienten, die aufgrund von Nebenwirkungen vorzeitig abbrachen, betrug 2,4 % in der CLARINEX-5-mg-Gruppe und 2,6 % in der Placebo-Gruppe. In diesen Studien traten bei Patienten, die Desloratadin erhielten, keine schwerwiegenden unerwünschten Ereignisse auf. Alle Nebenwirkungen, die von mindestens 2 % der Patienten berichtet wurden, die die empfohlene Tagesdosis von CLARINEX 5-mg-Tabletten (5 mg einmal täglich) erhielten, und die unter CLARINEX-Tabletten häufiger auftraten als unter Placebo, sind in Tabelle 1 aufgeführt.
Die Häufigkeit und das Ausmaß von Labor- und elektrokardiographischen Anomalien waren bei CLARINEX- und Placebo-behandelten Patienten ähnlich.
Es gab keine Unterschiede bei den Nebenwirkungen für Untergruppen von Patienten, definiert nach Geschlecht, Alter oder ethnischer Zugehörigkeit.
Chronische idiopathische Urtikaria
In Placebo-kontrollierten Mehrfachdosis-Studien zu chronischer idiopathischer Urtikaria erhielten 211 Patienten ab 12 Jahren CLARINEX 5 mg Tabletten und 205 Placebo. Nebenwirkungen, die von mindestens 2 % der Patienten berichtet wurden, die CLARINEX 5 mg Tabletten erhielten und die unter CLARINEX 5 mg häufiger auftraten als unter Placebo, waren (Raten für CLARINEX 5 mg bzw. Placebo): Kopfschmerzen (14 %, 13 %) , Übelkeit (5 %, 2 %), Müdigkeit (5 %, 1 %), Schwindel (4 %, 3 %), Pharyngitis (3 %, 2 %), Dyspepsie (3 %, 1 %) und Myalgie (3 %, 1 %).
Pädiatrie
246 pädiatrische Probanden im Alter von 6 Monaten bis 11 Jahren erhielten CLARINEX Lösung zum Einnehmen 15 Tage lang in drei placebokontrollierten klinischen Studien. Kinder und Jugendliche im Alter von 6 bis 11 Jahren erhielten 2,5 mg einmal täglich, Probanden im Alter von 1 bis 5 Jahren erhielten 1,25 mg einmal täglich und Probanden im Alter von 6 bis 11 Monaten erhielten 1,0 mg einmal täglich.
Bei Probanden im Alter von 6 bis 11 Jahren wurde von 2 Prozent oder mehr der Probanden kein einzelnes unerwünschtes Ereignis berichtet.
Bei Probanden im Alter von 2 bis 5 Jahren waren die Nebenwirkungen, die für CLARINEX und Placebo bei mindestens 2 Prozent der Probanden, die CLARINEX 5 mg Lösung zum Einnehmen erhielten, häufiger als unter Placebo berichtet wurden, Fieber (5,5 %, 5,4 %), Harnwegsinfektionen (3.6 %, 0 %) und Windpocken (3,6 %, 0 %).
Bei Probanden im Alter von 12 bis 23 Monaten waren die Nebenwirkungen, die für das CLARINEX 5 mg-Produkt und Placebo bei mindestens 2 Prozent der Probanden, die CLARINEX Lösung zum Einnehmen erhielten, und mit einer höheren Häufigkeit als Placebo berichtet wurden, Fieber (16,9 %, 12,9 %), Durchfall ( 15,4 %, 11,3 %), Infektionen der oberen Atemwege (10,8 %, 9,7 %), Husten (10,8 %, 6,5 %), gesteigerter Appetit (3,1 %, 1,6 %), emotionale Labilität (3,1 %, 0 %), Nasenbluten ( 3,1 %, 0 %), parasitäre Infektion (3,1 %, 0 %), Pharyngitis (3,1 %, 0 %), makulopapulöser Ausschlag (3,1 %, 0 %).
Bei Probanden im Alter von 6 bis 11 Monaten waren die Nebenwirkungen, die für CLARINEX 5 mg und Placebo bei mindestens 2 Prozent der Probanden berichtet wurden, die CLARINEX 5 mg Lösung zum Einnehmen erhielten, häufiger als unter Placebo Infektionen der oberen Atemwege (21,2 %, 12,9 %), Durchfall (19,7 %, 8,1 %), Fieber (12,1 %, 1,6 %), Reizbarkeit (12,1 %, 11,3 %), Husten (10,6 %, 9,7 %), Schläfrigkeit (9,1 %, 8,1 %), Bronchitis (6,1 %, 0 %), Mittelohrentzündung (6,1 %, 1,6 %), Erbrechen (6,1 %, 3,2 %), Anorexie (4,5 %, 1,6 %), Pharyngitis (4,5 %, 1,6 %), Schlaflosigkeit (4,5 %, 0 %), Rhinorrhoe (4,5 %, 3,2 %), Erythem (3,0 %, 1,6 %) und Übelkeit (3,0 %, 0 %).
Es gab keine klinisch bedeutsamen Veränderungen bei irgendeinem elektrokardiographischen Parameter, einschließlich des QTc-Intervalls. Nur eines der 246 pädiatrischen Probanden, die CLARINEX 5 mg Lösung zum Einnehmen in den klinischen Studien erhielten, brach die Behandlung wegen eines unerwünschten Ereignisses ab.
Post-Marketing-Erfahrung
Da unerwünschte Ereignisse freiwillig von einer Population ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Die folgenden spontanen unerwünschten Ereignisse wurden während der Vermarktung von Desloratadin berichtet:
Herzerkrankungen: Tachykardie, Herzklopfen
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Dyspnoe
Erkrankungen der Haut und des Unterhautzellgewebes: Hautausschlag, Juckreiz
Erkrankungen des Nervensystems: psychomotorische Hyperaktivität, Bewegungsstörungen (einschließlich Dystonie, Tics und extrapyramidale Symptome), Krampfanfälle (berichtet bei Patienten mit und ohne bekanntes Anfallsleiden)
Erkrankungen des Immunsystems: Überempfindlichkeitsreaktionen (wie Urtikaria, Ödeme und Anaphylaxie)
Untersuchungen: erhöhte Leberenzyme einschließlich Bilirubin
Leber- und Gallenerkrankungen: Hepatitis
Stoffwechsel- und Ernährungsstörungen: gesteigerter Appetit
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Inhibitoren von Cytochrom P450 3A4
In kontrollierten klinischen Studien führte die gleichzeitige Anwendung von Desloratadin mit Ketoconazol, Erythromycin oder Azithromycin zu erhöhten Plasmakonzentrationen von Desloratadin und 3-Hydroxy-Desloratadin, aber es gab keine klinisch relevanten Änderungen im Sicherheitsprofil von Desloratadin. [Sehen KLINISCHE PHARMAKOLOGIE ]
Fluoxetin
In kontrollierten klinischen Studien führte die gleichzeitige Anwendung von Desloratadin mit Fluoxetin, einem selektiven Serotonin-Wiederaufnahmehemmer (SSRI), zu erhöhten Plasmakonzentrationen von Desloratadin und 3-Hydroxydesloratadin, aber es gab keine klinisch relevanten Veränderungen im Sicherheitsprofil von Desloratadin. [Sehen KLINISCHE PHARMAKOLOGIE ]
Cimetidin
In kontrollierten klinischen Studien führte die gleichzeitige Verabreichung von Desloratadin mit Cimetidin, einem Histamin-H2-Rezeptor-Antagonisten, zu erhöhten Plasmakonzentrationen von Desloratadin und 3-Hydroxydesloratadin, aber es gab keine klinisch relevanten Änderungen im Sicherheitsprofil von Desloratadin. [Sehen KLINISCHE PHARMAKOLOGIE ]
Drogenmissbrauch und -abhängigkeit
Es liegen keine Informationen vor, die darauf hindeuten, dass es bei CLARINEX-Tabletten zu Missbrauch oder Abhängigkeit kommt.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Pruritus, Urtikaria, Ödeme, Dyspnoe und Anaphylaxie wurden nach Verabreichung von Desloratadin berichtet. Wenn eine solche Reaktion auftritt, sollte die Therapie mit CLARINEX 5 mg abgebrochen und eine alternative Behandlung in Betracht gezogen werden. [Sehen NEBENWIRKUNGEN ]
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Informationen für Patienten
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Kanzerogenitätsstudien
Das kanzerogene Potenzial von Desloratadin wurde anhand einer Loratadin-Studie an Ratten und einer Desloratadin-Studie an Mäusen bewertet. In einer 2-Jahres-Studie an Ratten wurde Loratadin mit der Nahrung in Dosen von bis zu 25 mg/kg/Tag verabreicht (die geschätzte Exposition gegenüber Desloratadin und Desloratadin-Metaboliten betrug etwa das 30-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis). Eine signifikant höhere Inzidenz hepatozellulärer Tumore (kombinierte Adenome und Karzinome) wurde bei Männern, die 10 mg/kg/Tag Loratadin erhielten, und bei Männern und Frauen, die 25 mg/kg/Tag Loratadin erhielten, beobachtet. Die geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition bei Ratten, die 10 mg/kg Loratadin erhielten, betrug etwa das 7-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis. Die klinische Bedeutung dieser Befunde während der Langzeitanwendung von Desloratadin ist nicht bekannt.
In einer 2-jährigen Ernährungsstudie an Mäusen, männlichen und weiblichen Mäusen, die bis zu 16 mg/kg/Tag bzw. 32 mg/kg/Tag Desloratadin erhielten, zeigte sich kein signifikanter Anstieg der Inzidenz von Tumoren. Die geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition bei Mäusen betrug bei diesen Dosen das 12- bzw. 27-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis.
Genotoxizitätsstudien
In Genotoxizitätsstudien mit Desloratadin gab es keine Hinweise auf ein genotoxisches Potenzial in einem Rückmutationsassay (Salmonella/E. coli-Säugermikrosomen-Bakterien-Mutagenitätsassay) oder in 2 Assays auf Chromosomenaberrationen (humaner peripherer Blut-Lymphozyten-Klastogenitätsassay und Maus-Knochenmark-Mikronukleus-Assay). ).
Beeinträchtigung der Fruchtbarkeit
Es gab keine Wirkung auf die weibliche Fertilität bei Ratten bei Desloratadin-Dosen von bis zu 24 mg/kg/Tag (die geschätzte Exposition gegenüber Desloratadin und Desloratadin-Metaboliten betrug etwa das 130-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis). Bei einer oralen Desloratadin-Dosis von 12 mg/kg bei Ratten (geschätzte Desloratadin- und Desloratadin-Metaboliten-Expositionen waren etwa das 45-Fache höher) trat bei Ratten eine männliche spezifische Abnahme der Fertilität auf, die sich in einer verringerten weiblichen Empfängnisrate, verringerter Anzahl und Beweglichkeit der Spermien und histopathologischen Hodenveränderungen zeigte AUC beim Menschen bei der empfohlenen oralen Tagesdosis). Desloratadin hatte bei einer oralen Dosis von 3 mg/kg/Tag keine Auswirkung auf die Fertilität von Ratten (die geschätzte Exposition gegenüber Desloratadin und Desloratadin-Metaboliten betrug etwa das 8-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis).
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
Es liegen keine adäquaten und gut kontrollierten Studien bei Schwangeren vor. Da Reproduktionsstudien an Tieren die Reaktion des Menschen nicht immer vorhersagen, sollte Desloratadin während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Desloratadin war bei Ratten oder Kaninchen bei etwa dem 210- bzw. 230-Fachen der Fläche unter der Konzentrations-Zeit-Kurve (AUC) beim Menschen bei der empfohlenen oralen Tagesdosis nicht teratogen. In einer separaten Studie an weiblichen Ratten wurde jedoch bei etwa dem 120-fachen der AUC beim Menschen bei der empfohlenen oralen Tagesdosis ein Anstieg des Präimplantationsverlusts und eine verringerte Anzahl von Implantationen und Föten festgestellt. Verringertes Körpergewicht und verlangsamter Aufrichtungsreflex wurden bei Welpen bei etwa dem 50-fachen oder mehr der AUC beim Menschen bei der empfohlenen oralen Tagesdosis berichtet. Desloratadin hatte bei etwa dem 7-Fachen der AUC beim Menschen bei der empfohlenen oralen Tagesdosis keine Auswirkung auf die Entwicklung der Jungtiere. Die AUCs bezogen sich im Vergleich auf die Desloratadin-Exposition bei Kaninchen bzw. die Summe der Desloratadin- und seiner Metaboliten-Exposition bei Ratten. [Sehen Nichtklinische Toxikologie ]
Stillende Mutter
Desloratadin geht in die Muttermilch über; Daher sollte unter Berücksichtigung des Nutzens des Arzneimittels für die stillende Mutter und des möglichen Risikos für das Kind entschieden werden, ob das Stillen beendet oder Desloratadin abgesetzt werden soll.
Pädiatrische Verwendung
Die empfohlene Dosis von CLARINEX 5 mg Lösung zum Einnehmen bei Kindern und Jugendlichen basiert auf einem studienübergreifenden Vergleich der Plasmakonzentration von CLARINEX 5 mg bei Erwachsenen und Kindern. Die Sicherheit von CLARINEX Lösung zum Einnehmen wurde bei 246 pädiatrischen Probanden im Alter von 6 Monaten bis 11 Jahren in drei placebokontrollierten klinischen Studien nachgewiesen. Da der Verlauf von saisonaler und ganzjähriger allergischer Rhinitis und chronischer idiopathischer Urtikaria und die Wirkungen von CLARINEX bei Kindern und Erwachsenen hinreichend ähnlich sind, ermöglicht dies eine Extrapolation der Wirksamkeitsdaten von Erwachsenen auf pädiatrische Patienten. Die Wirksamkeit von CLARINEX 5 mg Lösung zum Einnehmen in diesen Altersgruppen wird durch Belege aus angemessenen und gut kontrollierten Studien mit CLARINEX 5 mg Tabletten bei Erwachsenen gestützt. Die Sicherheit und Wirksamkeit von CLARINEX 5 mg Tabletten oder CLARINEX 5 mg Lösung zum Einnehmen wurde bei pädiatrischen Patienten unter 6 Monaten nicht nachgewiesen. [Sehen KLINISCHE PHARMAKOLOGIE ]
Die CLARINEX RediTabs 2,5-mg-Tablette wurde bei pädiatrischen Patienten nicht untersucht. Die Bioäquivalenz der CLARINEX 5 mg RediTabs Tablette und der zuvor vermarkteten RediTabs Tablette wurde bei Erwachsenen nachgewiesen. In Verbindung mit den beschriebenen Dosisfindungsstudien in der Pädiatrie unterstützen die pharmakokinetischen Daten für CLARINEX 5 mg RediTabs die Anwendung der 2,5-mg-Dosisstärke bei pädiatrischen Patienten im Alter von 6 bis 11 Jahren.
Geriatrische Verwendung
Klinische Studien mit Desloratadin schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln. [Sehen KLINISCHE PHARMAKOLOGIE ]
Nierenfunktionsstörung
Eine Dosisanpassung für Patienten mit eingeschränkter Nierenfunktion wird empfohlen [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Eine Dosisanpassung für Patienten mit eingeschränkter Leberfunktion wird empfohlen [siehe DOSIERUNG UND ANWENDUNG und KLINISCHE PHARMAKOLOGIE ].
ÜBERDOSIS
Im Falle einer Überdosierung sind Standardmaßnahmen zur Entfernung nicht resorbierter Arzneimittel in Betracht zu ziehen. Eine symptomatische und unterstützende Behandlung wird empfohlen. Desloratadin und 3-Hydroxydesloratadin werden nicht durch Hämodialyse eliminiert.
Informationen zur akuten Überdosierung beschränken sich auf Erfahrungen aus Berichten über unerwünschte Ereignisse nach der Markteinführung und aus klinischen Studien, die während der Entwicklung des CLARINEX 5 mg-Produkts durchgeführt wurden. In einer Dosisfindungsstudie wurde bei Dosen von 10 mg und 20 mg/Tag Schläfrigkeit berichtet.
In einer anderen Studie wurden keine klinisch relevanten unerwünschten Ereignisse bei gesunden männlichen und weiblichen Probanden berichtet, denen 10 Tage lang eine tägliche Einzeldosis von 45 mg CLARINEX verabreicht wurde [siehe KLINISCHE PHARMAKOLOGIE ].

Letalität trat bei Ratten bei oralen Dosen von 250 mg/kg oder mehr auf (die geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition betrug etwa das 120-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis). Die orale mediane tödliche Dosis bei Mäusen betrug 353 mg/kg (die geschätzte Desloratadin-Exposition betrug etwa das 290-fache der oralen Tagesdosis beim Menschen auf mg/m²-Basis). Bei oralen Dosen von bis zu 250 mg/kg traten bei Affen keine Todesfälle auf (die geschätzte Desloratadin-Exposition betrug etwa das 810-fache der oralen Tagesdosis beim Menschen auf mg/m²-Basis).
KONTRAINDIKATIONEN
CLARINEX 5 mg Tabletten, RediTabs und Lösung zum Einnehmen sind bei Patienten kontraindiziert, die auf dieses Medikament oder einen seiner Bestandteile oder auf Loratadin überempfindlich reagieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Desloratadin ist ein langwirksamer trizyklischer Histamin-Antagonist mit selektiver H1-Rezeptor-Histamin-antagonistischer Aktivität. Rezeptorbindungsdaten weisen darauf hin, dass Desloratadin bei einer Konzentration von 2-3 ng/ml (7 Nanomolar) eine signifikante Wechselwirkung mit dem menschlichen Histamin-H1-Rezeptor zeigt. Desloratadin hemmte in vitro die Histaminfreisetzung aus menschlichen Mastzellen. Die Ergebnisse einer Studie zur Verteilung radioaktiv markierter Gewebe bei Ratten und einer Studie zur Bindung von H1-Rezeptoren mit Radioliganden bei Meerschweinchen zeigten, dass Desloratadin die Blut-Hirn-Schranke nicht ohne Weiteres passiert. Die klinische Bedeutung dieses Befundes ist nicht bekannt.
Pharmakodynamik
Quaddel und Flare
Humane Histamin-Hautquaddeln-Studien nach einmaliger und wiederholter Gabe von 5 mg Desloratadin haben gezeigt, dass das Medikament nach 1 Stunde eine antihistaminische Wirkung entfaltet; diese Aktivität kann bis zu 24 Stunden andauern. Während der 28-tägigen Behandlungsdauer gab es in der 5-mg-Desloratadin-Gruppe keine Hinweise auf eine durch Histamin induzierte Tachyphylaxie der Hautquaddeln. Die klinische Relevanz des Histamin-Quaddel-Hauttests ist nicht bekannt.
Auswirkungen auf QTc
Einmalige Tagesdosen von 45 mg wurden normalen männlichen und weiblichen Probanden 10 Tage lang verabreicht. Alle in dieser Studie erhaltenen EKGs wurden von einem Kardiologen manuell und verblindet abgelesen. Bei den mit CLARINEX behandelten Probanden gab es im Vergleich zu Placebo einen Anstieg der mittleren Herzfrequenz um 9,2 bpm. Das QT-Intervall wurde sowohl nach der Bazett- als auch nach der Fridericia-Methode um die Herzfrequenz (QTc) korrigiert. Unter Verwendung des QTc (Bazett) gab es bei den mit CLARINEX behandelten Probanden im Vergleich zu Placebo eine mittlere Zunahme von 8,1 ms. Unter Verwendung von QTc (Fridericia) gab es bei den mit CLARINEX behandelten Probanden im Vergleich zu Placebo eine mittlere Zunahme von 0,4 ms. Es wurden keine klinisch relevanten unerwünschten Ereignisse berichtet.
Pharmakokinetik
Absorption
Nach oraler Verabreichung einer 5-mg-Tablette Desloratadin einmal täglich über 10 Tage an gesunde Probanden traten die mittlere Zeit bis zum Erreichen der maximalen Plasmakonzentrationen (Tmax) etwa 3 Stunden nach der Einnahme auf und die mittleren maximalen Plasmakonzentrationen (Cmax) und AUC im Steady-State betrugen 4 ng/ml bzw. 56,9 ng.h/ml wurden beobachtet. Weder Nahrung noch Grapefruitsaft hatten einen Einfluss auf die Bioverfügbarkeit (Cmax und AUC) von Desloratadin.
Das pharmakokinetische Profil von CLARINEX Lösung zum Einnehmen wurde in einer dreifachen Crossover-Studie mit 30 erwachsenen Freiwilligen bewertet. Eine Einzeldosis von 10 ml CLARINEX Lösung zum Einnehmen mit 5 mg Desloratadin war bioäquivalent zu einer Einzeldosis von 5 mg CLARINEX Tablette. Nahrung hatte keinen Einfluss auf die Bioverfügbarkeit (AUC und Cmax) von CLARINEX 5 mg Lösung zum Einnehmen.
Das pharmakokinetische Profil von CLARINEX 5 mg RediTabs-Tabletten wurde in einer dreifachen Crossover-Studie mit 24 erwachsenen Freiwilligen bewertet. Eine einzelne CLARINEX RediTabs-Tablette mit 5 mg Desloratadin war sowohl für Desloratadin als auch für 3-Hydroxydesloratadin bioäquivalent zu einer einzelnen 5-mg-CLARINEX RediTabs-Tablette (Originalformulierung). Nahrung und Wasser hatten keinen Einfluss auf die Bioverfügbarkeit (AUC und Cmax) von CLARINEX RediTabs-Tabletten.
Verteilung
Desloratadin und 3-Hydroxydesloratadin sind zu etwa 82 % bis 87 % bzw. 85 % bis 89 % an Plasmaproteine gebunden. Die Proteinbindung von Desloratadin und 3-Hydroxydesloratadin war bei Patienten mit eingeschränkter Nierenfunktion unverändert.
Stoffwechsel
Desloratadin (ein Hauptmetabolit von Loratadin) wird weitgehend zu 3-Hydroxydesloratadin, einem aktiven Metaboliten, metabolisiert, der anschließend glucuronidiert wird. Die für die Bildung von 3-Hydroxydesloratadin verantwortlichen Enzyme wurden nicht identifiziert. Daten aus klinischen Studien weisen darauf hin, dass eine Untergruppe der Allgemeinbevölkerung eine verminderte Fähigkeit zur Bildung von 3-Hydroxy-Desloratadin hat und Desloratadin schlecht verstoffwechselt. In pharmakokinetischen Studien (n = 3748) waren etwa 6 % der Studienteilnehmer schlechte Metabolisierer von Desloratadin (definiert als Studienteilnehmer mit einem AUC-Verhältnis von 3-Hydroxydesloratadin zu Desloratadin von weniger als 0,1 oder Studienteilnehmer mit einer Desloratadin-Halbwertszeit von mehr als 50 Stunden). ). Diese pharmakokinetischen Studien umfassten Probanden im Alter zwischen 2 und 70 Jahren, darunter 977 Probanden im Alter von 2 bis 5 Jahren, 1575 Probanden im Alter von 6 bis 11 Jahren und 1196 Probanden im Alter von 12 bis 70 Jahren. Es gab keinen Unterschied in der Prävalenz von langsamen Metabolisierern zwischen den Altersgruppen. Die Häufigkeit schlechter Metabolisierer war bei Schwarzen (17 %, n = 988) höher als bei Kaukasiern (2 %, n = 1.462) und Hispanics (2 %, n = 1.063). Die mittlere Desloratadin-Exposition (AUC) war bei den langsamen Metabolisierern etwa 6-mal höher als bei den Probanden, die keine langsamen Metabolisierer sind. Personen, die Desloratadin schlecht metabolisieren, können nicht prospektiv identifiziert werden und werden nach Verabreichung der empfohlenen Desloratadin-Dosis höheren Konzentrationen von Desloratadin ausgesetzt sein. In klinische Mehrfachdosis-Sicherheitsstudien, in denen der Metabolisiererstatus identifiziert wurde, wurden insgesamt 94 langsame Metabolisierer und 123 normale Metabolisierer aufgenommen und 15 bis 35 Tage lang mit CLARINEX Lösung zum Einnehmen behandelt. In diesen Studien wurden insgesamt keine Unterschiede in der Sicherheit zwischen langsamen Metabolisierern und normalen Metabolisierern beobachtet. Obwohl in diesen Studien nicht beobachtet, kann ein erhöhtes Risiko für expositionsbedingte unerwünschte Ereignisse bei Patienten, die langsame Metabolisierer sind, nicht ausgeschlossen werden.
Beseitigung
Die mittlere Eliminationshalbwertszeit von Desloratadin aus dem Plasma betrug etwa 27 Stunden. Die Cmax- und AUC-Werte stiegen nach oralen Einzeldosen zwischen 5 und 20 mg dosisproportional an. Der Grad der Akkumulation nach 14-tägiger Dosierung stimmte mit der Halbwertszeit und der Dosierungshäufigkeit überein. Eine Massenbilanzstudie beim Menschen dokumentierte eine Wiederfindung von etwa 87 % der 14C-Desloratadin-Dosis, die als Stoffwechselprodukte gleichmäßig im Urin und im Stuhl verteilt wurde. Die Analyse von 3-Hydroxydesloratadin im Plasma zeigte ähnliche Tmax- und Halbwertszeitwerte im Vergleich zu Desloratadin.
Besondere Populationen
Geriatrische Themen
Bei älteren Probanden (≥ 65 Jahre; n = 17) waren nach Mehrfachgabe von CLARINEX 5 mg Tabletten die mittleren Cmax- und AUC-Werte für Desloratadin um 20 % höher als bei jüngeren Probanden (
Pädiatrische Fächer
Bei Probanden im Alter von 6 bis 11 Jahren führte eine Einzeldosis von 5 ml CLARINEX Lösung zum Einnehmen mit 2,5 mg Desloratadin zu ähnlichen Desloratadin-Plasmakonzentrationen wie bei Erwachsenen, denen eine einzelne 5-mg-CLARINEX-Tablette verabreicht wurde. Bei Probanden im Alter von 2 bis 5 Jahren führte eine Einzeldosis von 2,5 ml CLARINEX Lösung zum Einnehmen mit 1,25 mg Desloratadin zu ähnlichen Desloratadin-Plasmakonzentrationen wie bei Erwachsenen, denen eine einzelne 5-mg-CLARINEX-Tablette verabreicht wurde. Die Cmax und AUC des Metaboliten (3-Hydroxydesloratadin) waren jedoch 1,27- und 1,61-mal höher für die 5-mg-Dosis der Lösung zum Einnehmen, die Erwachsenen verabreicht wurde, verglichen mit der Cmax und AUC, die bei Kindern im Alter von 2 bis 11 Jahren, die 1,25- 2,5 mg CLARINEX Lösung zum Einnehmen.
Eine Einzeldosis von entweder 2,5 ml oder 1,25 ml CLARINEX 5 mg Lösung zum Einnehmen mit 1,25 mg bzw. 0,625 mg Desloratadin wurde Probanden im Alter von 6 bis 11 Monaten und 12 bis 23 Monaten verabreicht. Die Ergebnisse einer populationspharmakokinetischen Analyse zeigten, dass eine Dosis von 1 mg bei Personen im Alter von 6 bis 11 Monaten und 1,25 mg bei Personen im Alter von 12 bis 23 Monaten erforderlich ist, um Desloratadin-Plasmakonzentrationen zu erreichen, die denen ähnlich sind, die bei Erwachsenen erreicht werden, die eine einzelne 5- bis mg-Dosis CLARINEX Lösung zum Einnehmen.
Die CLARINEX 5 mg RediTabs 2,5-mg-Tablette wurde bei pädiatrischen Patienten nicht untersucht. Die Bioäquivalenz der CLARINEX 5 mg RediTabs Tablette und der ursprünglichen CLARINEX 5 mg RediTabs Tablette wurde bei Erwachsenen nachgewiesen. In Verbindung mit den beschriebenen Dosisfindungsstudien in der Pädiatrie unterstützen die pharmakokinetischen Daten für CLARINEX 5 mg RediTabs-Tabletten die Anwendung der 2,5-mg-Dosisstärke bei pädiatrischen Patienten im Alter von 6 bis 11 Jahren.
Nierenbeeinträchtigt
Die Pharmakokinetik von Desloratadin nach einer Einzeldosis von 7,5 mg wurde bei Patienten mit leichter (n = 7; Kreatinin-Clearance 51-69 ml/min/1,73 m²) oder mittelschwerer (n = 6; Kreatinin-Clearance 34-43 ml/min/1,73 m²) charakterisiert ) und Patienten mit schwerer (n=6; Kreatinin-Clearance 5-29 ml/min/1,73 m²) Nierenfunktionsstörung oder Hämodialyse-abhängigen (n=6) Patienten. Bei Patienten mit leichter und mittelschwerer Nierenfunktionsstörung stiegen die medianen Cmax- und AUC-Werte im Vergleich zu Patienten mit normaler Nierenfunktion um etwa das 1,2- bzw. 1,9-Fache an. Bei Patienten mit schwerer Nierenfunktionsstörung oder Hämodialysepflichtigen stiegen die Cmax- und AUC-Werte um etwa das 1,7- bzw. 2,5-Fache an. Es wurden minimale Veränderungen der 3-Hydroxydesloratadin-Konzentration beobachtet. Desloratadin und 3-Hydroxydesloratadin wurden schlecht durch Hämodialyse entfernt. Die Plasmaproteinbindung von Desloratadin und 3-Hydroxydesloratadin blieb durch Nierenfunktionsstörung unverändert. Eine Dosisanpassung für Patienten mit eingeschränkter Nierenfunktion wird empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Leberfunktionsstörung
Die Pharmakokinetik von Desloratadin wurde nach einer oralen Einzeldosis bei Patienten mit leichter (n = 4), mittelschwerer (n = 4) und schwerer (n = 4) Leberfunktionsstörung gemäß der Definition der Child-Pugh-Klassifikation der Leberfunktion und 8 Patienten mit eingeschränkter Leberfunktion charakterisiert normale Leberfunktion. Patienten mit eingeschränkter Leberfunktion hatten unabhängig vom Schweregrad eine etwa 2,4-fache Erhöhung der AUC im Vergleich zu gesunden Probanden. Die scheinbare orale Clearance von Desloratadin bei Patienten mit leichter, mäßiger und schwerer Leberfunktionsstörung betrug 37 %, 36 % bzw. 28 % derjenigen bei gesunden Probanden. Bei Patienten mit eingeschränkter Leberfunktion wurde eine Verlängerung der mittleren Eliminationshalbwertszeit von Desloratadin beobachtet. Für 3-Hydroxydesloratadin unterschieden sich die mittleren Cmax- und AUC-Werte bei Patienten mit eingeschränkter Leberfunktion nicht statistisch signifikant von denen bei Patienten mit normaler Leberfunktion. Eine Dosisanpassung für Patienten mit eingeschränkter Leberfunktion wird empfohlen [siehe DOSIERUNG UND ANWENDUNG ].
Geschlecht
Bei weiblichen Probanden, die 14 Tage lang mit CLARINEX 5 mg Tabletten behandelt wurden, waren die Cmax- und AUC-Werte von Desloratadin um 10 % bzw. 3 % höher als bei männlichen Probanden. Die Cmax- und AUC-Werte von 3-Hydroxydesloratadin waren bei Frauen im Vergleich zu Männern ebenfalls um 45 % bzw. 48 % erhöht. Diese offensichtlichen Unterschiede sind jedoch wahrscheinlich nicht klinisch relevant und daher wird keine Dosisanpassung empfohlen.
Wettrennen
Nach 14-tägiger Behandlung mit CLARINEX-Tabletten waren die Cmax- und AUC-Werte für Desloratadin bei Schwarzen um 18 % bzw. 32 % höher als bei Kaukasiern. Für 3-Hydroxydesloratadin gab es eine entsprechende Verringerung der Cmax- und AUC-Werte um 10 % bei Schwarzen im Vergleich zu Kaukasiern. Diese Unterschiede sind wahrscheinlich nicht klinisch relevant und daher wird keine Dosisanpassung empfohlen.
Wechselwirkungen mit anderen Medikamenten
In zwei kontrollierten klinisch-pharmakologischen Crossover-Studien mit gesunden männlichen (n = 12 in jeder Studie) und weiblichen (n = 12 in jeder Studie) Probanden wurde Desloratadin 7,5 mg (das 1,5-fache der Tagesdosis) einmal täglich zusammen mit 500 mg Erythromycin alle 8 verabreicht Stunden oder Ketoconazol 200 mg alle 12 Stunden für 10 Tage. In drei separaten kontrollierten klinischen Pharmakologiestudien mit parallelen Gruppen wurde Desloratadin in der klinischen Dosis von 5 mg zusammen mit 500 mg Azithromycin gefolgt von 250 mg einmal täglich für 4 Tage (n = 18) oder mit Fluoxetin 20 mg einmal täglich für 7 Tage verabreicht nach einer 23-tägigen Vorbehandlung mit Fluoxetin (n = 18) oder mit Cimetidin 600 mg alle 12 Stunden für 14 Tage (n = 18) unter Steady-State-Bedingungen an gesunden männlichen und weiblichen Probanden. Obwohl erhöhte Plasmakonzentrationen (Cmax und AUC0-24 h) von Desloratadin und 3-Hydroxy-Desloratadin beobachtet wurden (siehe Tabelle 2), gab es keine klinisch relevanten Veränderungen im Sicherheitsprofil von Desloratadin, wie es anhand elektrokardiographischer Parameter (einschließlich des korrigierten QT-Intervalls) beurteilt wurde. klinische Labortests, Vitalfunktionen und unerwünschte Ereignisse.
Tiertoxikologie und/oder Pharmakologie Studien zur Reproduktionstoxikologie
Desloratadin war bei Ratten in Dosen von bis zu 48 mg/kg/Tag (die geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition betrug etwa das 210-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis) oder bei Kaninchen in Dosen von bis zu 60 mg/kg/Tag nicht teratogen. Tag (die geschätzte Desloratadin-Exposition betrug etwa das 230-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis). In einer separaten Studie wurde bei weiblichen Ratten bei 24 mg/kg (geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition etwa das 120-fache der AUC beim Menschen bei der empfohlenen täglichen oralen Gabe) ein Anstieg des Präimplantationsverlusts und eine verringerte Anzahl von Implantationen und Föten festgestellt Dosis). Verringertes Körpergewicht und verlangsamter Aufrichtungsreflex wurden bei Welpen bei Dosen von 9 mg/kg/Tag oder mehr berichtet (die geschätzte Desloratadin- und Desloratadin-Metaboliten-Exposition war etwa 50-mal oder höher als die AUC beim Menschen bei der empfohlenen täglichen oralen Dosis). Desloratadin hatte bei einer oralen Dosis von 3 mg/kg/Tag keine Auswirkung auf die Entwicklung der Jungtiere (die geschätzte Exposition gegenüber Desloratadin und Desloratadin-Metaboliten betrug etwa das 7-fache der AUC beim Menschen bei der empfohlenen oralen Tagesdosis).
Klinische Studien
Saisonale allergische Rhinitis
Die klinische Wirksamkeit und Sicherheit von CLARINEX-Tabletten wurde bei über 2300 Patienten im Alter von 12 bis 75 Jahren mit saisonaler allergischer Rhinitis untersucht. Insgesamt 1838 Patienten erhielten 2,5 bis 20 mg/Tag CLARINEX in 4 doppelblinden, randomisierten, placebokontrollierten klinischen Studien mit einer Dauer von 2 bis 4 Wochen, die in den Vereinigten Staaten durchgeführt wurden. Die Ergebnisse dieser Studien zeigten die Wirksamkeit und Sicherheit von CLARINEX 5 mg bei der Behandlung von erwachsenen und jugendlichen Patienten mit saisonaler allergischer Rhinitis. In einer Dosisfindungsstudie wurde CLARINEX 2,5 bis 20 mg/Tag untersucht. Dosen von 5, 7,5, 10 und 20 mg/Tag waren Placebo überlegen; und bei Dosen über 5,0 mg wurde kein zusätzlicher Nutzen festgestellt. In derselben Studie wurde bei Dosen von 10 mg/Tag und 20 mg/Tag (5,2 % bzw. 7,6 %) im Vergleich zu Placebo (2,3 %) eine Zunahme der Inzidenz von Somnolenz beobachtet.
In zwei 4-wöchigen Studien mit 924 Patienten (im Alter von 15 bis 75 Jahren) mit saisonaler allergischer Rhinitis und begleitendem Asthma verbesserten CLARINEX 5 mg Tabletten 5 mg einmal täglich die Rhinitis-Symptome ohne Beeinträchtigung der Lungenfunktion. Dies unterstützt die Sicherheit der Verabreichung von CLARINEX 5 mg Tabletten an erwachsene Patienten mit saisonaler allergischer Rhinitis mit leichtem bis mittelschwerem Asthma.
CLARINEX-Tabletten 5 mg einmal täglich reduzierten bei Patienten mit saisonaler allergischer Rhinitis signifikant den Gesamtsymptom-Score (die Summe der individuellen Scores von nasalen und nicht-nasalen Symptomen). Siehe Tabelle 3.
Es gab keine signifikanten Unterschiede in der Wirksamkeit von CLARINEX 5 mg Tabletten 5 mg zwischen den Untergruppen der Patienten, definiert nach Geschlecht, Alter oder ethnischer Zugehörigkeit.
Ganzjährige allergische Rhinitis
Die klinische Wirksamkeit und Sicherheit von CLARINEX-Tabletten 5 mg wurden bei über 1300 Patienten im Alter von 12 bis 80 Jahren mit ganzjähriger allergischer Rhinitis untersucht. Insgesamt 685 Patienten erhielten 5 mg/Tag CLARINEX 5 mg in zwei doppelblinden, randomisierten, placebokontrollierten klinischen Studien mit einer Dauer von 4 Wochen, die in den Vereinigten Staaten und international durchgeführt wurden. In einer dieser Studien wurde gezeigt, dass CLARINEX 5 mg Tabletten einmal täglich 5 mg den Gesamtsymptom-Score bei Patienten mit perennialer allergischer Rhinitis signifikant reduzierten (Tabelle 4).
Chronische idiopathische Urtikaria
Die Wirksamkeit und Sicherheit von CLARINEX 5 mg Tabletten 5 mg einmal täglich wurde an 416 Patienten mit chronischer idiopathischer Urtikaria im Alter von 12 bis 84 Jahren untersucht, von denen 211 CLARINEX erhielten. In zwei doppelblinden, placebokontrollierten, randomisierten klinischen Studien mit einer Dauer von sechs Wochen reduzierten CLARINEX-Tabletten zum vorab festgelegten einwöchigen primären Bewertungszeitpunkt die Schwere des Pruritus im Vergleich zu Placebo signifikant (Tabelle 5). Sekundäre Endpunkte wurden ebenfalls bewertet, und während der ersten Therapiewoche reduzierten CLARINEX 5 mg Tabletten 5 mg die sekundären Endpunkte „Anzahl der Nesselsucht“ und „Größe des größten Nesselsucht“ im Vergleich zu Placebo.
Die klinische Sicherheit von CLARINEX Lösung zum Einnehmen wurde in drei 15-tägigen, doppelblinden, placebokontrollierten Sicherheitsstudien bei pädiatrischen Probanden mit einer dokumentierten Vorgeschichte von allergischer Rhinitis, chronischer idiopathischer Urtikaria oder Probanden dokumentiert, die Kandidaten für eine Antihistamintherapie waren. In der ersten Studie wurden 60 pädiatrischen Probanden im Alter von 6 bis 11 Jahren 2,5 mg CLARINEX Lösung zum Einnehmen verabreicht. In der zweiten Studie wurde die Verabreichung von 1,25 mg CLARINEX Lösung zum Einnehmen an 55 pädiatrische Probanden im Alter von 2 bis 5 Jahren bewertet. In der dritten Studie wurden 65 pädiatrischen Probanden im Alter von 12 bis 23 Monaten 1,25 mg CLARINEX 5 mg Lösung zum Einnehmen und 66 pädiatrischen Probanden im Alter von 6 bis 11 Monaten 1,0 mg CLARINEX Lösung zum Einnehmen verabreicht. Die Ergebnisse dieser Studien zeigten die Sicherheit von CLARINEX 5 mg Lösung zum Einnehmen bei pädiatrischen Probanden im Alter von 6 Monaten bis 11 Jahren.
INFORMATIONEN ZUM PATIENTEN
CLARINEX® (CLA-RI-NEX) (Desloratadin) Tabletten, RediTabs® und orale Lösung
Lesen Sie die mit CLARINEX® gelieferte Patienteninformation, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ist eine Zusammenfassung der Informationen für Patienten. Ihr Arzt oder Apotheker kann Ihnen weitere Informationen geben. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem Arzt über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist CLARINEX 5 mg?
CLARINEX ist ein verschreibungspflichtiges Arzneimittel, das das Arzneimittel Desloratadin (ein Antihistaminikum) enthält.
CLARINEX wird verwendet, um die Symptome zu kontrollieren von:
CLARINEX ist nicht für Kinder unter 6 Monaten geeignet.
Wer sollte CLARINEX nicht einnehmen?
Nehmen Sie CLARINEX 5 mg nicht ein, wenn Sie:
Sprechen Sie mit Ihrem Arzt, bevor Sie dieses Arzneimittel einnehmen, wenn Sie Fragen dazu haben, ob Sie dieses Arzneimittel einnehmen sollen oder nicht.
Was sollte ich meinem Arzt vor der Einnahme von CLARINEX 5 mg mitteilen?
Informieren Sie vor der Einnahme von CLARINEX 5 mg Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. CLARINEX 5 mg kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von CLARINEX 5 mg beeinflussen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Folgendes einnehmen:
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel und zeigen Sie diese Ihrem Arzt und Apotheker, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich CLARINEX einnehmen?
Was sind die möglichen Nebenwirkungen von CLARINEX Tabletten?
CLARINEX 5 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Die häufigsten Nebenwirkungen von CLARINEX bei Erwachsenen und Kindern ab 12 Jahren mit allergischer Rhinitis sind:
Erhöhte Schläfrigkeit oder Müdigkeit können auftreten, wenn Sie mehr CLARINEX einnehmen, als Ihr Arzt Ihnen verschrieben hat.
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von CLARINEX. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie soll ich CLARINEX 5 mg aufbewahren?
Behalten CLARINEX-Tabletten, RediTabs-Tabletten , und Mündliche Lösung und alle Arzneimittel außerhalb der Reichweite von Kindern.
Allgemeine Informationen zu CLARINEX
Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie CLARINEX 5 mg nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie CLARINEX 5 mg nicht an andere Personen weiter, selbst wenn sie die gleiche Erkrankung wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen über CLARINEX zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt. Sie können Ihren Apotheker oder Arzt um Informationen über CLARINEX bitten, die für Angehörige der Gesundheitsberufe bestimmt sind.
Weitere Informationen finden Sie unter www.CLARINEX.com
Was sind die Inhaltsstoffe von CLARINEX 5 mg?
Wirkstoff: Desloratadin
Patienten mit Phenylketonurie: CLARINEX RediTabs Tabletten enthalten Phenylalanin.
Inaktive Inhaltsstoffe in CLARINEX 5 mg Tabletten: dibasisches Calciumphosphatdihydrat USP, mikrokristalline Cellulose NF, Maisstärke NF, Talkum USP, Carnaubawachs NF, weißes Wachs NF, Beschichtungsmaterial bestehend aus Lactosemonohydrat, Hypromellose, Titandioxid, Polyethylenglycol und FD&C Blue #2 Aluminium Lake.
Inaktive Bestandteile in CLARINEX 5 mg Lösung zum Einnehmen: Propylenglycol USP, Sorbitollösung USP, Citronensäure (wasserfrei) USP, Natriumcitratdihydrat USP, Natriumbenzoat NF, Dinatriumedetat USP, gereinigtes Wasser USP. Es enthält auch Kristallzucker, natürliches und künstliches Aroma für Kaugummi und FDC Yellow #6-Farbstoff.