Rhinocort 100mcg Budesonide Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Rhinocort Aqua und wie wird es angewendet?
Rhinocort Aqua (Budesonid) Nasenspray ist ein Steroid zur Behandlung von Nasensymptomen wie Verstopfung, Niesen und laufender Nase, die durch saisonale oder ganzjährige Allergien verursacht werden. Rhinocort Aqua Nasenspray wird auch verwendet, um zu verhindern, dass Nasenpolypen nach einer chirurgischen Entfernung wiederkehren.
Welche Nebenwirkungen hat Rhinocort 100mcg Aqua?
Häufige Nebenwirkungen von Rhinocort Aqua Nasenspray sind:
Informieren Sie Ihren Arzt, wenn Sie seltene, aber schwerwiegende Nebenwirkungen von Rhinocort Aqua Nasenspray haben, einschließlich:
BEZEICHNUNG
Budesonid, der Wirkstoff von RHINOCORT AQUA (Budesonid) Nasenspray, ist ein entzündungshemmendes synthetisches Kortikosteroid.
Es wird chemisch als (RS)-11-beta, 16-alpha, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion zyklisches 16,17-acetal mit Butyraldehyd bezeichnet.
Budesonid wird als Mischung aus zwei Epimeren (22R und 22S) bereitgestellt.
Die Summenformel von Budesonid ist C25H34O6 und sein Molekulargewicht beträgt 430,5.
Seine Strukturformel lautet:
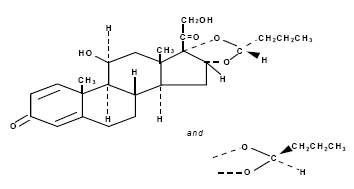
Budesonid ist ein weißes bis cremefarbenes, geruchloses Pulver, das in Wasser und Heptan praktisch unlöslich, in Ethanol schwer löslich und in Chloroform gut löslich ist.
Sein Verteilungskoeffizient zwischen Octanol und Wasser bei pH 5 beträgt 1,6 x 103.
RHINOCORT AQUA (Budesonid) Nasenspray ist ein unparfümiertes, dosiertes Spray mit manueller Pumpe, das eine mikronisierte Suspension von Budesonid in einem wässrigen Medium enthält. In diesem Medium sind mikrokristalline Zellulose und Natriumcarboxymethylzellulose, wasserfreie Dextrose, Polysorbat 80, Dinatriumedetat, Kaliumsorbat und gereinigtes Wasser enthalten; Salzsäure wird zugegeben, um den pH-Wert auf einen Zielwert von 4,5 einzustellen.
RHINOCORT 100 mcg AQUA Nasenspray liefert 32 mcg Budesonid pro Sprühstoß.
Jede Flasche RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg enthält 120 dosierte Sprühstöße nach der ersten Vorbereitung.
Vor dem ersten Gebrauch muss das Gebinde leicht geschüttelt und die Pumpe durch achtmaliges Betätigen entlüftet werden. Bei täglichem Gebrauch muss die Pumpe nicht neu entlüftet werden. Wenn es an zwei aufeinanderfolgenden Tagen nicht verwendet wird, mit einem Sprühstoß erneut füllen oder bis ein feiner Sprühnebel erscheint. Wenn der Applikator länger als 14 Tage nicht verwendet wird, spülen Sie ihn aus und füllen Sie ihn erneut mit zwei Sprühstößen oder bis ein feiner Sprühnebel erscheint.
INDIKATIONEN
Behandlung von saisonaler oder ganzjähriger allergischer Rhinitis
RHINOCORT AQUA (Budesonid) Nasenspray ist angezeigt zur Behandlung von nasalen Symptomen saisonaler oder ganzjähriger allergischer Rhinitis bei Erwachsenen und Kindern ab sechs Jahren.
DOSIERUNG UND ANWENDUNG
Die empfohlene Anfangsdosis für Erwachsene und Kinder ab 6 Jahren beträgt 64 µg pro Tag, verabreicht als ein Sprühstoß pro Nasenloch von RHINOCORT AQUA (Budesonid) Nasenspray 32 µg einmal täglich. Einige Patienten, die mit der empfohlenen Anfangsdosis keine Symptomkontrolle erreichen, können von einer höheren Dosis profitieren. Die empfohlene Höchstdosis für Erwachsene (12 Jahre und älter) beträgt 256 Mikrogramm pro Tag, verabreicht als vier Sprühstöße pro Nasenloch einmal täglich RHINOCORT AQUA (Budesonid) Nasenspray 32 Mikrogramm, und die empfohlene Höchstdosis für pädiatrische Patienten (6 bis
Es ist immer wünschenswert, einen einzelnen Patienten auf die minimal wirksame Dosis zu titrieren, um die Möglichkeit von Nebenwirkungen zu verringern. Eine Verbesserung der nasalen Symptome kann bei Patienten innerhalb von 10 Stunden nach der ersten Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray festgestellt werden, die klinische Besserung dauert jedoch normalerweise 1-2 Tage mit dem maximalen Nutzen in etwa 2 Wochen. Wenn der maximale Nutzen erreicht und die Symptome unter Kontrolle gebracht wurden, kann eine Dosisreduktion wirksam sein, um die Symptome der allergischen Rhinitis bei Patienten, die anfänglich mit höheren Dosierungen kontrolliert wurden, unter Kontrolle zu halten.
Vor dem ersten Gebrauch muss das Gebinde leicht geschüttelt und die Pumpe durch achtmaliges Betätigen entlüftet werden. Bei täglichem Gebrauch muss die Pumpe nicht neu entlüftet werden. Wenn es an zwei aufeinanderfolgenden Tagen nicht verwendet wird, mit einem Sprühstoß erneut füllen oder bis ein feiner Sprühnebel erscheint. Wenn der Applikator länger als 14 Tage nicht verwendet wird, spülen Sie ihn aus und füllen Sie ihn erneut mit zwei Sprühstößen oder bis ein feiner Sprühnebel erscheint. Schütteln Sie den Behälter vor jedem Gebrauch leicht.
Illustriert Gebrauchsanweisung des Patienten Begleiten Sie jede Packung RHINOCORT AQUA (Budesonid) Nasenspray 32 mcg.
WIE GELIEFERT
Darreichungsformen und Stärken
RHINOCORT AQUA (Budesonid) Nasenspray ist eine Nasenspray-Suspension. Jeder Sprühstoß liefert 32 µg Budesonid. Jede Flasche RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg enthält 120 dosierte Sprühstöße nach der ersten Vorbereitung.
RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg ist in einer Braunglasflasche mit Dosierpumpspray und grüner Schutzkappe erhältlich. RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg ( NDC 0186-1070-08) liefert 120 dosierte Sprühstöße nach der ersten Grundierung; Nettofüllgewicht 8,6 g. Die Flasche RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg wurde mit einem Überschuss gefüllt, um die Priming-Aktivität aufzunehmen. Die Flasche sollte nach 120 Sprühstößen nach dem ersten Vorfüllen entsorgt werden, da die danach pro Sprühstoß abgegebene Budesonidmenge wesentlich geringer sein kann als die auf dem Etikett angegebene Dosis. Jeder Sprühstoß gibt 32 µg Budesonid an den Patienten ab.
RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray sollte bei kontrollierter Raumtemperatur von 20 bis 25 °C (68 bis 77 °F) mit geöffnetem Ventil gelagert werden. Nicht einfrieren. Vor Licht schützen. Vor Gebrauch leicht schütteln. Nicht in die Augen sprühen.
Vertrieb durch: AstraZeneca LP, Wilmington, DE 19850. Überarbeitet: 12/2010
NEBENWIRKUNGEN
Die systemische und intranasale Anwendung von Kortikosteroiden kann zu Folgendem führen:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die Häufigkeit häufiger Nebenwirkungen in Tabelle 1 basiert auf zwei kontrollierten klinischen Studien in den USA und fünf außerhalb der USA an 1.526 Patienten mit saisonaler oder ganzjähriger Rhinitis bei Erwachsenen und Kindern ≥ 6 Jahren, die mit RHINOCORT AQUA (Budesonid) Nasenspray in Dosen bis zu behandelt wurden 400 mcg einmal täglich für 3-6 Wochen. Diese Population umfasste 745 Frauen und 781 Männer mit einem Durchschnittsalter von 31 Jahren (Bereich von 6 bis 85 Jahren, 349 waren 6
Ein ähnliches Nebenwirkungsprofil wurde in der Untergruppe der pädiatrischen Patienten im Alter von 6 bis 12 Jahren beobachtet. Diese Patienten sind in Tabelle 1 enthalten.
Zwei bis drei Prozent (2-3 %) der Patienten in klinischen Studien brachen die Behandlung wegen Nebenwirkungen ab. Systemische Kortikosteroid-Nebenwirkungen wurden während kontrollierter klinischer Studien mit RHINOCORT AQUA (Budesonid) Nasenspray nicht berichtet.
Wenn die empfohlenen Dosen überschritten werden oder Personen besonders empfindlich sind, können Symptome von Hyperkortizismus, dh Gushing-Syndrom, und Nebennierensuppression auftreten.
Post-Marketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray nach der Zulassung berichtet. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Erkrankungen des Immunsystems: Sofortige und verzögerte Überempfindlichkeitsreaktionen (einschließlich anaphylaktischer Reaktion, Urtikaria, Hautausschlag, Dermatitis, Angioödem und Juckreiz), [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KONTRAINDIKATIONEN ]
Augenerkrankungen: Glaukom, erhöhter Augeninnendruck, Katarakte [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ]
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Perforation der Nasenscheidewand, Anosmie, Erkrankungen des Rachens (Halsreizung, Halsschmerzen, geschwollener Hals, brennender Hals und juckender Hals) und Keuchen
Herzerkrankungen: Herzklopfen
Erkrankungen des Bewegungsapparates und des Bindegewebes: Wachstumsunterdrückung [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ]
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Inhibitoren von Cytochrom P450 3A4
Der Hauptstoffwechselweg von Kortikosteroiden, einschließlich Budesonid, verläuft über Cytochrom P450 (CYP) Isoenzym 3A4 (CYP3A4). Nach oraler Verabreichung von Ketoconazol, einem starken Inhibitor von CYP3A4, stieg die mittlere Plasmakonzentration von oral verabreichtem Budesonid an. Die gleichzeitige Verabreichung von CYP3A4 kann den Metabolismus von Budesonid hemmen und die systemische Exposition gegenüber Budesonid erhöhen. Vorsicht ist geboten, wenn die gleichzeitige Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray mit Langzeit-Ketoconazol und anderen bekannten starken CYP3A4-Inhibitoren (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir-Saquinavir, Telithromycin) in Erwägung gezogen wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und KLINISCHE PHARMAKOLOGIE ].
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Lokale nasale Wirkungen
Epistaxis
In klinischen Studien mit einer Dauer von 3 bis 52 Wochen wurde Nasenbluten häufiger bei Patienten beobachtet, die mit RHINOCORT 100 µg AQUA (Budesonid) Nasenspray behandelt wurden, als bei Patienten, die Placebo erhielten [siehe NEBENWIRKUNGEN ].
Candida-Infektion
In klinischen Studien mit intranasal verabreichtem Budesonid ist die Entwicklung lokalisierter Infektionen der Nase und des Rachens mit Candida albicans aufgetreten. Wenn sich eine solche Infektion entwickelt, kann eine Behandlung mit einer geeigneten lokalen oder systemischen Therapie und ein Abbruch der Behandlung mit RHINOCORT AQUA (Budesonid) Nasenspray erforderlich sein. Patienten, die RHINOCORT AQUA (Budesonid) Nasenspray über mehrere Monate oder länger anwenden, sollten regelmäßig auf Anzeichen einer Candida-Infektion oder andere Anzeichen von Nebenwirkungen auf die Nasenschleimhaut untersucht werden.
Perforation der Nasenscheidewand
Fälle von Perforation der Nasenscheidewand wurden nach der intranasalen Anwendung von Kortikosteroiden, einschließlich Budesonid, berichtet [siehe NEBENWIRKUNGEN ].
Beeinträchtigte Wundheilung
Aufgrund der hemmenden Wirkung von Kortikosteroiden auf die Wundheilung sollten Patienten, die kürzlich ein Nasenseptumgeschwür, eine Nasenoperation oder ein Nasentrauma erlitten haben, kein nasales Kortikosteroid anwenden, bis die Heilung eingetreten ist.
Überempfindlichkeitsreaktionen einschließlich Anaphylaxie
Überempfindlichkeitsreaktionen einschließlich anaphylaktischer Reaktion, Urtikaria, Hautausschlag, Dermatitis, Angioödem und Juckreiz können auftreten [siehe KONTRAINDIKATIONEN und NEBENWIRKUNGEN, Erfahrung nach Markteinführung ].
Immunsuppression
Patienten, die Medikamente einnehmen, die das Immunsystem unterdrücken, sind anfälliger für Infektionen als gesunde Personen. Windpocken und Masern beispielsweise können bei empfindlichen Kindern oder Erwachsenen, die Kortikosteroide einnehmen, einen schwereren oder sogar tödlichen Verlauf nehmen. Bei solchen Kindern oder Erwachsenen, die diese Krankheiten nicht hatten oder ordnungsgemäß geimpft wurden, sollte besonders darauf geachtet werden, eine Exposition zu vermeiden. Wie sich Dosis, Art und Dauer der Kortikosteroidverabreichung auf das Risiko der Entwicklung einer disseminierten Infektion auswirken, ist nicht bekannt. Der Beitrag der zugrunde liegenden Erkrankung und/oder einer vorherigen Behandlung mit Kortikosteroiden zum Risiko ist ebenfalls nicht bekannt. Bei Exposition gegenüber Windpocken kann eine Therapie mit Varizella-Zoster-Immunglobulin (VZIG) oder gepooltem intravenösem Immunglobulin (WIG) angezeigt sein. Bei Exposition gegenüber Masern kann eine Prophylaxe mit gepooltem intramuskulärem Immunglobulin (IG) angezeigt sein. (Sehen die jeweiligen Packungsbeilagen für vollständige VZIG- und IG-Verschreibungsinformationen ). Wenn sich Windpocken entwickeln, kann eine Behandlung mit antiviralen Mitteln in Betracht gezogen werden.
Der klinische Verlauf einer Windpocken- oder Maserninfektion bei Patienten, die intranasale oder inhalative Kortikosteroide erhalten, wurde nicht untersucht. Obwohl keine Daten mit intranasalen Kortikosteroiden vorliegen, hat eine klinische Studie die Immunantwort auf den Varizellen-Impfstoff bei Asthmapatienten im Alter von 12 Monaten bis 8 Jahren untersucht, die mit Budesonid-Inhalationssuspension behandelt wurden.
Eine unverblindete, nicht randomisierte klinische Studie untersuchte die Immunantwort auf Varizellen-Impfstoff bei 243 Asthmapatienten im Alter von 12 Monaten bis 8 Jahren, die mit Budesonid-Inhalationssuspension 0,25 mg bis 1 mg täglich (n = 151) oder einer Nicht-Kortikosteroid-Asthmatherapie behandelt wurden (n = 92) (dh Beta-Agonisten, Leukotrien-Rezeptor-Antagonisten oder Cromone). Der Prozentsatz der Patienten, die als Reaktion auf die Impfung einen seroprotektiven Antikörpertiter ≥ 5,0 (gpELISA-Wert) entwickelten, war bei Patienten, die mit Budesonid-Inhalationssuspension behandelt wurden (85 %), ähnlich wie bei Patienten, die mit einer Nicht-Kortikosteroid-Asthmatherapie behandelt wurden (90 %). Kein Patient, der mit Budesonid-Inhalationssuspension behandelt wurde, entwickelte infolge der Impfung Windpocken.
Kortikosteroide sollten, wenn überhaupt, mit Vorsicht angewendet werden bei Patienten mit aktiver oder ruhender Tuberkuloseinfektion, unbehandelten Pilz-, Bakterien-, systemischen Virus- oder Parasiteninfektionen; oder okulärer Herpes simplex.
Auswirkungen der Hypothalamus-Hypophysen-Nebennieren-Achse
Hyperkortizismus und Nebennierensuppression: Wenn intranasale Steroide in höheren als den empfohlenen Dosierungen oder bei empfindlichen Personen in den empfohlenen Dosierungen angewendet werden, können systemische Kortikosteroidwirkungen wie Hyperkortizismus und Nebennierensuppression auftreten. Wenn solche Veränderungen auftreten, sollte die Dosierung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray langsam abgesetzt werden, im Einklang mit den anerkannten Verfahren zum Absetzen einer oralen Kortikosteroidtherapie.
Der Ersatz eines systemischen Kortikosteroids durch ein topisches Kortikosteroid kann von Anzeichen einer Nebenniereninsuffizienz begleitet sein, und zusätzlich können bei einigen Patienten Symptome eines Kortikosteroid-Entzugs auftreten, z. B. Gelenk- und/oder Muskelschmerzen, Müdigkeit, Schwäche, Übelkeit, Erbrechen, Hypotonie, Abgeschlagenheit und Depression. Patienten, die zuvor über einen längeren Zeitraum mit systemischen Kortikosteroiden behandelt wurden, sollten langsam entwöhnt werden, wenn sie auf topische Kortikosteroide umgestellt werden, und sorgfältig auf akute Nebenniereninsuffizienz als Reaktion auf Stress überwacht werden. Bei Patienten mit Asthma oder anderen klinischen Zuständen, die eine langfristige Behandlung mit systemischen Kortikosteroiden erfordern, kann eine zu rasche Abnahme der systemischen Kortikosteroide zu einer schweren Verschlechterung ihrer Symptome führen.
Wechselwirkungen mit starken Cytochrom P450 3A4-Inhibitoren
Vorsicht ist geboten, wenn die gleichzeitige Anwendung von RHINOCORT AQUA Nasenspray mit Ketoconazol und anderen bekannten starken CYP3A4-Inhibitoren (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir, Telithromycin) in Betracht gezogen wird, da die Nebenwirkungen im Zusammenhang damit zunehmen Es kann zu einer systemischen Exposition gegenüber Budesonid kommen [siehe WECHSELWIRKUNGEN MIT ARZNEIMITTELN, KLINISCHE PHARMAKOLOGIE ].
Auswirkung auf das Wachstum
Intranasale Kortikosteroide, einschließlich Budesonid, können eine Verringerung der Wachstumsgeschwindigkeit verursachen, wenn sie pädiatrischen Patienten verabreicht werden. Überwachen Sie routinemäßig das Wachstum von pädiatrischen Patienten, die eine Langzeitbehandlung mit RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray erhalten. Um die systemischen Wirkungen von intranasalen Kortikosteroiden, einschließlich RHINOCORT AQUA (Budesonid) Nasenspray, zu minimieren, titrieren Sie die Dosis jedes Patienten auf die niedrigste, die seine/ihre Symptome wirksam kontrolliert [siehe Verwendung in bestimmten Populationen, pädiatrische Verwendung ].
Glaukom und Katarakte
Glaukom, erhöhter Augeninnendruck und Katarakte wurden nach intranasaler Anwendung von Kortikosteroiden, einschließlich Budesonid, berichtet. Daher ist eine engmaschige Überwachung bei Patienten mit Sehstörungen oder mit erhöhtem Augeninnendruck, Glaukom und/oder Katarakt in der Anamnese erforderlich [siehe NEBENWIRKUNGEN ].
Informationen zur Patientenberatung
[Sehen Von der FDA zugelassene Patientenkennzeichnung ]
Patienten, die mit RHINOCORT 100 µg AQUA (Budesonid) Nasenspray behandelt werden, sollten die folgenden Informationen und Anweisungen erhalten. Diese Informationen sollen den Patienten bei der sicheren und wirksamen Anwendung des Medikaments unterstützen. Es handelt sich nicht um eine Offenlegung aller möglichen nachteiligen oder beabsichtigten Wirkungen. Für die ordnungsgemäße Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray und um eine maximale Verbesserung zu erzielen, sollte der Patient die begleitende, von der FDA zugelassene Patientenkennzeichnung lesen und befolgen.
Lokale nasale Wirkungen
Die Patienten sollten darauf hingewiesen werden, dass bei einigen Patienten Nasenbluten und lokalisierte Infektionen mit Candida albicans in Nase und Rachen auftraten. Wenn sich eine Candidiasis entwickelt, sollte sie mit einer geeigneten lokalen oder systemischen Therapie behandelt und die Behandlung mit RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray abgebrochen werden. Darüber hinaus sind nasale Kortikosteroide mit einer Perforation der Nasenscheidewand und einer beeinträchtigten Wundheilung verbunden. Patienten, bei denen kürzlich Nasengeschwüre, Nasenoperationen oder Nasentrauma aufgetreten sind, sollten RHINOCORT AQUA (Budesonid) Nasenspray nicht anwenden, bis die Heilung eingetreten ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Überempfindlichkeit einschließlich Anaphylaxie
Die Patienten sollten darauf hingewiesen werden, dass bei der Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray über Überempfindlichkeitsreaktionen einschließlich anaphylaktischer Reaktionen, Urtikaria, Hautausschlag, Dermatitis, Angioödem und Juckreiz berichtet wurde. Unterbrechen
RHINOCORT AQUA (Budesonid) Nasenspray, wenn solche Reaktionen auftreten [siehe KONTRAINDIKATIONEN, WARNUNGEN UND VORSICHTSMASSNAHMEN und NEBENWIRKUNGEN ].
Immunsuppression
Patienten, die immunsuppressive Dosen von Kortikosteroiden erhalten, sollten gewarnt werden, eine Exposition gegenüber Windpocken oder Masern zu vermeiden und im Falle einer Exposition unverzüglich ihren Arzt aufzusuchen. Die Patienten sollten über eine mögliche Verschlechterung einer bestehenden Tuberkulose, Pilz-, Bakterien-, Virus- oder Parasiteninfektion oder Herpes simplex am Auge informiert werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Reduzierte Wachstumsgeschwindigkeit
Die Patienten sollten darauf hingewiesen werden, dass intranasale Kortikosteroide, einschließlich Budesonid, eine Verringerung der Wachstumsgeschwindigkeit verursachen können, wenn sie pädiatrischen Patienten verabreicht werden. Ärzte sollten das Wachstum von Kindern und Jugendlichen, die Kortikosteroide auf beliebige Weise einnehmen, engmaschig überwachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Glaukom und Katarakte
Die Patienten sollten darauf hingewiesen werden, dass die langfristige Anwendung von intranasalen Kortikosteroiden, einschließlich Budesonid, das Risiko für einige Augenprobleme (Katarakte und Glaukom) erhöhen kann. Patienten sollten ihren Arzt informieren, wenn während der Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray eine Veränderung des Sehvermögens festgestellt wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Täglich verwenden
Patienten sollten RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray in regelmäßigen Abständen anwenden, da seine Wirksamkeit von seiner regelmäßigen Anwendung abhängt. Patienten können innerhalb von 10 Stunden nach der ersten Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray eine Verbesserung der nasalen Symptome feststellen. Der maximale Nutzen wird möglicherweise erst etwa 2 Wochen nach Beginn der Behandlung erreicht [siehe DOSIERUNG UND ANWENDUNG ].
Die Patienten sollten das Medikament wie verordnet einnehmen und die vorgeschriebene Dosierung nicht überschreiten. Der Patient sollte den Arzt kontaktieren, wenn sich die Symptome nach zwei Wochen nicht bessern oder wenn sich der Zustand verschlechtert. Patienten, bei denen während der Einnahme dieses Medikaments wiederkehrende Episoden von Epistaxis (Nasenbluten) oder Beschwerden der Nasenscheidewand auftreten, sollten sich an ihren Arzt wenden. Für die richtige Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray und um eine maximale Besserung zu erzielen, sollte der Patient die beigefügte Patienteninformation sorgfältig lesen und befolgen. Verwenden Sie RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray nicht, nachdem die angegebene Anzahl von Sprühstößen verwendet wurde (ohne Vorbereitung) oder nach dem auf dem Karton- oder Flaschenetikett angegebenen Verfallsdatum.
Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray
Die Patienten sollten sorgfältig in die Anwendung dieses Arzneimittels eingewiesen werden, um eine optimale Dosisabgabe sicherzustellen [siehe INFORMATIONEN ZUM PATIENTEN ].
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen oralen Studie an Sprague-Dawley-Ratten wurde ein statistisch signifikanter Anstieg der Inzidenz von Gliomen bei männlichen Ratten beobachtet, die eine orale Dosis von Budesonid 50 mcg/kg/Tag (etwa das Doppelte der maximal empfohlenen intranasalen Tagesdosis) erhielten Erwachsene und Kinder auf mcg/m2-Basis). Bei männlichen Ratten wurde bei oralen Dosen bis zu 25 µg/kg (ungefähr gleich der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen und Kindern auf µg/m2-Basis) und bei weiblichen Ratten bei oralen Dosen bis zu 50 µg/kg keine Tumorigenität beobachtet etwa das Zweifache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen und Kindern auf mcg/m2-Basis). In zwei weiteren zweijährigen Studien an männlichen Fischer- und Sprague-Dawley-Ratten verursachte Budesonid bei einer oralen Dosis von 50 µg/kg (ungefähr das Doppelte der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen und Kindern auf µg/m2-Basis) keine Gliome. Bei männlichen Sprague-Dawley-Ratten verursachte Budesonid jedoch einen statistisch signifikanten Anstieg der Inzidenz hepatozellulärer Tumore bei einer oralen Dosis von 50 µg/kg (etwa das Doppelte der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen und Kindern auf µg/m2-Basis). ). Die gleichzeitigen Referenzkortikosteroide (Prednisolon und Triamcinolonacetonid) in diesen beiden Studien zeigten ähnliche Ergebnisse.
Es gab keine Hinweise auf eine krebserzeugende Wirkung, wenn Budesonid 91 Wochen lang oral an Mäuse in Dosen von bis zu 200 µg/kg/Tag verabreicht wurde (ungefähr das Dreifache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen und Kindern auf µg/m2-Basis). .
Budesonid war in sechs verschiedenen Testsystemen nicht mutagen oder klastogen: Ames-Salmonella/Mikrosomenplattentest, Maus-Mikrokerntest, Maus-Lymphomtest, Chromosomenaberrationstest in menschlichen Lymphozyten, geschlechtsgebundener rezessiver Letaltest in Drosophila melanogaster und DNA-Reparaturanalyse in Ratten Hepatozytenkultur.
Bei Ratten hatte Budesonid in subkutanen Dosen von bis zu 80 µg/kg (ungefähr das Dreifache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf µg/m2-Basis) keine Auswirkung auf die Fertilität.
Bei einer subkutanen Dosis von 20 µg/kg/Tag (weniger als die maximal empfohlene intranasale Tagesdosis bei Erwachsenen auf µg/m2-Basis) verringert sich die Körpergewichtszunahme der Mutter, die pränatale Lebensfähigkeit und die Lebensfähigkeit der Jungen bei der Geburt und während der Laktation wurden beobachtet. Bei 5 µg/kg (weniger als der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf µg/m2-Basis) wurden keine derartigen Wirkungen festgestellt.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen: Schwangerschaftskategorie B. Die Auswirkung von Budesonid auf den Ausgang einer Schwangerschaft beim Menschen wurde durch Bewertungen von Geburtsregistern im Zusammenhang mit der mütterlichen Anwendung von inhaliertem Budesonid (d. h. PULMICORT TURBUHALER) und intranasal verabreichtem Budesonid (d. h. RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray) bewertet. Die Ergebnisse bevölkerungsbezogener prospektiver epidemiologischer Kohortenstudien, in denen Daten aus drei schwedischen Registern überprüft wurden, die etwa 99 % der Schwangerschaften von 1995 bis 2001 abdecken (dh schwedisches medizinisches Geburtsregister; Register für angeborene Fehlbildungen; Register für Kinderkardiologie), weisen auf kein erhöhtes Gesamtrisiko hin Angeborene Fehlbildungen durch die Anwendung von inhalativem oder intranasal verabreichtem Budesonid während der frühen Schwangerschaft.
Angeborene Fehlbildungen wurden bei 2.014 Säuglingen von Müttern untersucht, die über die Anwendung von inhalativem Budesonid gegen Asthma in der Frühschwangerschaft (normalerweise 10–12 Wochen nach der letzten Menstruation) berichteten, dem Zeitraum, in dem die meisten größeren Organfehlbildungen auftreten.1 Die Rate angeborener Fehlbildungen insgesamt war im Vergleich zur allgemeinen Bevölkerungsrate ähnlich (3,8 % vs. 3,5 %). Die Anzahl der mit Mund- und Gesichtsspalten und Herzfehlern geborenen Säuglinge war ähnlich der erwarteten Anzahl in der Allgemeinbevölkerung (4 Kinder vs. 3,3 bzw. 18 Kinder vs. 17–18). In einer Folgestudie, die die Gesamtzahl der Säuglinge auf 2.534 erhöhte, unterschied sich die Gesamtrate angeborener Missbildungen bei Säuglingen, deren Mütter während der Frühschwangerschaft inhalativem Budesonid ausgesetzt waren, nicht von der Rate aller Neugeborenen im gleichen Zeitraum (3,6 % ).2 Eine dritte Studie des schwedischen medizinischen Geburtsregisters mit 2.968 Schwangerschaften, die inhalativem Budesonid ausgesetzt waren, von denen die meisten Expositionen im ersten Trimester waren, berichtete über Gestationsalter, Geburtsgewicht, Geburtslänge, Totgeburten und Mehrlingsgeburten, die für exponierte Säuglinge im Vergleich zu ähnlich waren nicht exponierte Säuglinge.3
Angeborene Fehlbildungen wurden bei 2.113 Säuglingen von Müttern untersucht, die über die intranasale Anwendung von Budesonid in der Frühschwangerschaft berichteten. Die Gesamtrate der angeborenen Fehlbildungen war im Vergleich zur allgemeinen Bevölkerungsrate ähnlich (4,5 % vs. 3,5 %). Das adjustierte Odds Ratio (OR) betrug 1,06 (95 % KI 0,86-1,31). Die Anzahl der mit orofazialen Spalten geborenen Säuglinge war ähnlich der erwarteten Anzahl in der Allgemeinbevölkerung (jeweils 3 Kinder vs. 3). Die Zahl der mit Herzfehlern geborenen Säuglinge überstieg die Erwartungen der Allgemeinbevölkerung (28 Kinder vs. 17,8). Die systemische Exposition durch intranasales Budesonid ist 6-mal geringer als durch inhalatives Budesonid, und ein Zusammenhang mit Herzfehlern wurde bei höheren Budesonid-Expositionen nicht beobachtet.
Trotz der Tierbefunde scheint es, dass die Möglichkeit einer fetalen Schädigung gering ist, wenn das Medikament während der Schwangerschaft verwendet wird. Da die Studien am Menschen jedoch die Möglichkeit einer Schädigung nicht ausschließen können, sollte RHINOCORT AQUA (Budesonid) Nasenspray während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Budesonid führte bei Kaninchen bei einer subkutanen Dosis, die ungefähr dem 2-fachen der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf mcg/m2-Basis entsprach, und bei einer subkutanen Dosis bei Ratten, die ungefähr dem 16-fachen entsprach, zu fötalen Verlusten, vermindertem Gewicht der Jungtiere und Skelettanomalien maximal empfohlene intranasale Tagesdosis bei Erwachsenen auf mcg/m2-Basis. Bei Ratten wurden keine teratogenen oder embryoziden Wirkungen beobachtet, wenn Budesonid durch Inhalation in Dosen bis zum ungefähr 8-Fachen der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf Mikrogramm/m2-Basis verabreicht wurde.
Erfahrungen mit oralen Kortikosteroiden seit ihrer Einführung in pharmakologische, im Gegensatz zu physiologischen Dosen, legen nahe, dass Nagetiere anfälliger für teratogene Wirkungen von Kortikosteroiden sind als Menschen.
Nicht teratogene Wirkungen: Hypoadrenalismus kann bei Säuglingen auftreten, deren Mütter während der Schwangerschaft Kortikosteroide erhalten haben. Solche Säuglinge sollten sorgfältig beobachtet werden.
Stillende Mutter
Budesonid wird in die Muttermilch ausgeschieden. Daten zu Budesonid, das über einen Trockenpulverinhalator verabreicht wurde, weisen darauf hin, dass die gesamte tägliche orale Dosis von Budesonid, die dem Säugling in der Muttermilch zur Verfügung steht, etwa 0,3 % bis 1 % der von der Mutter inhalierten Dosis beträgt [siehe KLINISCHE PHARMAKOLOGIE, Pharmakokinetik, spezielle Bevölkerungsgruppen, Krankenpflege ]. Es wurden keine Studien speziell mit RHINOCORT 100 mcg AQUA Nasenspray an stillenden Frauen durchgeführt; es ist jedoch zu erwarten, dass die Budesonid-Dosis, die dem Säugling in der Muttermilch zur Verfügung steht, als Prozentsatz der mütterlichen Dosis ähnlich ist. RHINOCORT AQUA (Budesonid) Nasenspray sollte bei stillenden Frauen nur angewendet werden, wenn es klinisch angemessen ist. Verschreibende Ärzte sollten die bekannten Vorteile des Stillens für Mutter und Kind gegen die potenziellen Risiken einer minimalen Budesonid-Exposition beim Kind abwägen. Zu den Überlegungen zur Dosierung gehören die Verschreibung oder Titration auf die niedrigste klinisch wirksame Dosis und die Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray unmittelbar nach dem Stillen, um das Zeitintervall zwischen der Einnahme und dem Stillen zu maximieren und die Exposition des Säuglings zu minimieren.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 6 Jahren wurden nicht nachgewiesen.
Kontrollierte klinische Studien haben gezeigt, dass intranasale Kortikosteroide eine Verringerung der Wachstumsgeschwindigkeit bei pädiatrischen Patienten verursachen können. Dieser Effekt wurde in Abwesenheit von Labornachweisen für eine Unterdrückung der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) beobachtet, was darauf hindeutet, dass die Wachstumsgeschwindigkeit ein empfindlicherer Indikator für die systemische Kortikosteroid-Exposition bei pädiatrischen Patienten ist als einige häufig verwendete Tests der HPA-Achsenfunktion . Die langfristigen Auswirkungen dieser Verringerung der Wachstumsgeschwindigkeit im Zusammenhang mit intranasalen Kortikosteroiden, einschließlich der Auswirkungen auf die Endgröße des Erwachsenen, sind nicht bekannt. Das Potenzial für ein „aufholendes“ Wachstum nach Absetzen der Behandlung mit intranasalen Kortikosteroiden wurde nicht ausreichend untersucht.
Das Wachstum von pädiatrischen Patienten, die intranasale Kortikosteroide, einschließlich RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray, erhalten, sollte routinemäßig überwacht werden (z. B. durch Stadiometrie). Die potenziellen Wachstumseffekte einer verlängerten Behandlung sollten gegen den erzielten klinischen Nutzen und die mit alternativen Therapien verbundenen Risiken und Vorteile abgewogen werden. Um die systemischen Wirkungen von intranasalen Kortikosteroiden, einschließlich RHINOCORT AQUA (Budesonid) Nasenspray, zu minimieren, sollte jeder Patient auf die niedrigste Dosis titriert werden, die seine/ihre Symptome wirksam kontrolliert.
Eine einjährige placebokontrollierte klinische Wachstumsstudie wurde an 229 pädiatrischen Patienten (im Alter von 4 bis 8 Jahren) durchgeführt, um die Wirkung von RHINOCORT AQUA (Budesonid) Nasenspray (tägliche Einzeldosis von 64 µg, die empfohlene Anfangsdosis) zu beurteilen für Kinder ab 6 Jahren) zur Wachstumsgeschwindigkeit. Bei einer Population von 141 Patienten, die RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray erhielten, und 67 Patienten, die Placebo erhielten, war die Punktschätzung für die Wachstumsgeschwindigkeit mit RHINOCORT AQUA (Budesonid) Nasenspray 0,25 cm/Jahr niedriger als mit Placebo (95 % Konfidenzintervall). von 0,59 cm/Jahr niedriger als Placebo bis 0,08 cm/Jahr höher als Placebo).
In einer Studie mit asthmatischen Kindern im Alter von 5 bis 12 Jahren hatten diejenigen, die mit Budesonid behandelt wurden, das zweimal täglich 200 µg Budesonid über einen Trockenpulverinhalator verabreicht wurde (n = 311), eine 1,1-Zentimeter (0,433 Zoll) Verringerung des Wachstums im Vergleich zu denen, die Placebo erhielten ( n=418) am Ende eines Jahres; der Unterschied zwischen diesen beiden Behandlungsgruppen nahm über drei Jahre zusätzlicher Behandlung nicht weiter zu. Am Ende von vier Jahren hatten Kinder, die mit Budesonid-Trockenpulverinhalator behandelt wurden, und Kinder, die mit Placebo behandelt wurden, ähnliche Wachstumsgeschwindigkeiten. Die aus dieser Studie gezogenen Schlussfolgerungen können durch die ungleiche Verwendung von Kortikosteroiden in den Behandlungsgruppen und die Einbeziehung von Daten von Patienten, die im Verlauf der Studie die Pubertät erreichten, verfälscht werden.
Die systemischen Wirkungen von inhalativen Kortikosteroiden hängen mit der systemischen Exposition gegenüber solchen Arzneimitteln zusammen. Pharmakokinetische Studien haben gezeigt, dass sowohl bei Erwachsenen als auch bei Kindern die systemische Exposition gegenüber Budesonid bei den höchsten empfohlenen Dosen von RHINOCORT AQUA (Budesonid) Nasenspray erwartungsgemäß nicht größer ist als die Exposition bei den niedrigsten empfohlenen Dosen über einen Trockenpulverinhalator. Daher ist zu erwarten, dass die systemischen Wirkungen (HPA-Achse und Wachstum) von Budesonid, das aus RHINOCORT AQUA (Budesonid) Nasenspray abgegeben wird, nicht größer sind als die, die für inhalatives Budesonid berichtet werden, wenn es über den Trockenpulverinhalator verabreicht wird.
Es kann nicht ausgeschlossen werden, dass RHINOCORT 100 µg AQUA (Budesonid) Nasenspray bei empfindlichen Patienten oder bei Gabe von Dosen über 64 µg pro Tag eine Wachstumsunterdrückung verursacht. Der empfohlene Dosierungsbereich für Patienten im Alter von 6 bis 11 Jahren beträgt 64 bis 128 Mikrogramm pro Tag [siehe DOSIERUNG UND ANWENDUNG ].
Geriatrische Verwendung
Von den 2.461 Patienten in klinischen Studien mit RHINOCORT 100 µg AQUA (Budesonid) Nasenspray waren 5 % 60 Jahre und älter. Insgesamt wurden keine Unterschiede in der Sicherheit oder Wirksamkeit zwischen diesen Probanden und jüngeren Probanden beobachtet, mit Ausnahme einer Nebenwirkung, die über die Häufigkeit von Nasenbluten berichtete, die mit dem Alter zunahm. Darüber hinaus haben andere berichtete klinische Erfahrungen keine weiteren Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten ergeben, aber eine größere Empfindlichkeit einiger älterer Personen kann nicht ausgeschlossen werden.
Leberfunktionsstörung
Formelle pharmakokinetische Studien mit RHINOCORT 100 µg AQUA (Budesonid) Nasenspray wurden bei Patienten mit eingeschränkter Leberfunktion nicht durchgeführt. Da Budesonid jedoch überwiegend durch Leberstoffwechsel ausgeschieden wird, kann eine Beeinträchtigung der Leberfunktion zu einer Akkumulation von Budesonid im Plasma führen. Daher sollten Patienten mit Lebererkrankungen engmaschig überwacht werden.
ÜBERDOSIS
Eine akute Überdosierung mit dieser Darreichungsform ist unwahrscheinlich, da eine Flasche mit 120 Sprühstößen RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray 32 mcg nur etwa 5,4 mg Budesonid enthält. Eine chronische Überdosierung kann zu Anzeichen/Symptomen von Hyperkortizismus führen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KONTRAINDIKATIONEN
RHINOCORT AQUA (Budesonid) Nasenspray ist kontraindiziert bei Patienten mit Überempfindlichkeit gegen einen der Inhaltsstoffe [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Budesonid ist ein entzündungshemmendes Corticosteroid, das eine starke Glucocorticoid-Aktivität und eine schwache Mineralocorticoid-Aktivität aufweist. In standardmäßigen In-vitro- und Tiermodellen hat Budesonid eine etwa 200-fach höhere Affinität zum Glukokortikoidrezeptor und eine 1000-fach höhere topische entzündungshemmende Wirkung als Cortisol (Ratten-Crotonöl-Ohrödem-Assay). Als Maß für die systemische Aktivität ist Budesonid 40-mal wirksamer als Cortisol, wenn es subkutan verabreicht wird, und 25-mal wirksamer, wenn es oral verabreicht wird, im Ratten-Thymus-Involutions-Assay. Die klinische Bedeutung davon ist nicht bekannt.
Die Aktivität von RHINOCORT 100 mcg AQUA Nasenspray beruht auf dem Ausgangsarzneimittel Budesonid. In Glucocorticoidrezeptor-Affinitätsstudien war die 22R-Form zweimal so aktiv wie das 22S-Epimer. In-vitro-Studien zeigten, dass sich die beiden Formen von Budesonid nicht ineinander umwandeln.
Der genaue Wirkmechanismus von Kortikosteroiden bei Entzündungen bei saisonaler und ganzjähriger allergischer Rhinitis ist nicht bekannt. Entzündungen sind eine wichtige Komponente in der Pathogenese von saisonaler und ganzjähriger allergischer Rhinitis. Kortikosteroide haben ein breites Spektrum an inhibitorischen Aktivitäten gegen mehrere Zelltypen (z. B. Mastzellen, Eosinophile, Neutrophile, Makrophagen und Lymphozyten) und Mediatoren (z. B. Histamin, Eicosanoide, Leukotriene und Zytokine), die an allergischen und nicht-allergischen Reaktionen beteiligt sind Entzündung. Diese entzündungshemmenden Wirkungen von Kortikosteroiden können zu ihrer Wirksamkeit bei saisonaler und ganzjähriger allergischer Rhinitis beitragen.
Pharmakodynamik
Eine 3-wöchige klinische Studie bei saisonaler Rhinitis, in der RHINOCORT 100 mcg Naseninhalator, oral eingenommenes Budesonid und Placebo bei 98 Patienten mit allergischer Rhinitis aufgrund von Birkenpollen verglichen wurden, zeigte, dass die therapeutische Wirkung von RHINOCORT Naseninhalator auf die topische Wirkung von RHINOCORT zurückzuführen ist Budesonid.

HPA-Achseneffekte
Die Wirkungen von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray auf die Nebennierenfunktion wurden in mehreren klinischen Studien untersucht. In einer vierwöchigen klinischen Studie zeigten 61 erwachsene Patienten, die täglich 256 µg RHINOCORT AQUA (Budesonid) Nasenspray erhielten, keine signifikanten Unterschiede in den Plasmacortisolspiegeln, die vor und 60 Minuten nach 0,25 mg intramuskulärem Cosyntropin gemessen wurden, im Vergleich zu Patienten, die Placebo erhielten. Bei Patienten, die täglich bis zu 400 mcg erhielten, gab es keine konsistenten Unterschiede bei den Cortisolmessungen im 24-Stunden-Urin. Ähnliche Ergebnisse wurden in einer Studie mit 150 Kindern und Jugendlichen im Alter von 6 bis 17 Jahren mit ganzjähriger Rhinitis beobachtet, die bis zu 12 Monate lang täglich mit 256 Mikrogramm behandelt wurden.
Nach siebentägiger Behandlung mit der empfohlenen maximalen Tagesdosis von RHINOCORT AQUA (Budesonid) Nasenspray (256 µg) kam es zu einer kleinen, aber statistisch signifikanten Abnahme der Fläche unter der Plasma-Cortisol-Zeit-Kurve über 24 Stunden (AUC0-24h ) bei gesunden erwachsenen Probanden.
Eine dosisabhängige Unterdrückung der Cortisolausscheidung im 24-Stunden-Urin wurde nach Verabreichung von RHINOCORT AQUA (Budesonid) Nasenspray in Dosen von 100–800 µg täglich über bis zu vier Tage bei 78 gesunden erwachsenen Probanden beobachtet. Die klinische Relevanz dieser Ergebnisse ist nicht bekannt.
Pharmakokinetik
Absorption
Nach intranasaler Verabreichung einer Einzeldosis RHINOCORT AQUA (Budesonid) Nasenspray (128 µg) tritt die mittlere maximale Plasmakonzentration von etwa 0,3 nmol/l etwa 0,5 Stunden nach der Dosis auf. Im Vergleich zu einer intravenösen Dosis erreichen etwa 34 % der verabreichten intranasalen Dosis den systemischen Kreislauf, wovon der größte Teil über die Nasenschleimhaut resorbiert wird. Während Budesonid gut aus dem Gastrointestinaltrakt resorbiert wird, ist die orale Bioverfügbarkeit von Budesonid gering (~10 %), hauptsächlich aufgrund des ausgedehnten First-Pass-Metabolismus in der Leber.
Verteilung
Das Verteilungsvolumen von Budesonid betrug etwa 2-3 l/kg. Es war zu 85-90 % an Plasmaproteine gebunden. Das Verteilungsvolumen des 22R-Epimers ist fast doppelt so hoch wie das des 22S-Epimers. Die Proteinbindung war über einen Konzentrationsbereich (1–100 nmol/l) konstant, der mit und über den empfohlenen Dosen von RHINOCORT 100 µg AQUA Nasenspray erreicht wurde. Budesonid zeigte wenig oder keine Bindung an Corticosteroid-bindendes Globulin. Budesonid äquilibrierte schnell mit roten Blutkörperchen in einer konzentrationsunabhängigen Weise mit einem Blut/Plasma-Verhältnis von etwa 0,8.
Stoffwechsel
In-vitro-Studien mit humanen Leberhomogenaten haben gezeigt, dass Budesonid schnell und extensiv metabolisiert wird. Zwei Hauptmetaboliten, die durch Cytochrom P450 (CYP) Isoenzym 3A4 (CYP3A4)-katalysierte Biotransformation gebildet werden, wurden isoliert und als 16α-Hydroxyprednisolon und 6p-Hydroxybudesonid identifiziert. Die Corticosteroid-Aktivität jedes dieser beiden Metaboliten beträgt weniger als 1 % der Aktivität der Ausgangssubstanz. Es wurde kein qualitativer Unterschied zwischen den Stoffwechselmustern in vitro und in vivo festgestellt. In menschlichen Lungen- und Serumpräparaten wurde eine vernachlässigbare metabolische Inaktivierung beobachtet.
Ausscheidung/Elimination
Die 22R-Form von Budesonid wurde vorzugsweise von der Leber mit einer systemischen Clearance von 1,4 l/min gegenüber 1,0 l/min für die 22S-Form ausgeschieden. Die terminale Halbwertszeit, 2 bis 3 Stunden, war für beide Epimere gleich und dosisunabhängig. Budesonid wurde in Form von Metaboliten im Urin und im Stuhl ausgeschieden. Ungefähr 2/3 einer intranasalen radioaktiv markierten Dosis wurden im Urin und der Rest im Stuhl wiedergefunden. Im Urin wurde kein unverändertes Budesonid nachgewiesen.
Spezifische Populationen
Geriatrie
Die Pharmakokinetik von RHINOCORT 100 µg AQUA (Budesonid) Nasenspray bei geriatrischen Patienten wurde nicht speziell untersucht.
Pädiatrie
Nach Verabreichung von RHINOCORT 100 µg AQUA (Budesonid) Nasenspray waren die Zeit bis zum Erreichen der maximalen Arzneimittelkonzentration und die Plasmahalbwertszeit bei Kindern und Erwachsenen ähnlich. Kinder hatten Plasmakonzentrationen, die ungefähr doppelt so hoch waren wie die bei Erwachsenen beobachteten, hauptsächlich aufgrund von Gewichtsunterschieden zwischen Kindern und Erwachsenen.
Geschlecht
Es wurde keine spezifische pharmakokinetische Studie durchgeführt, um die Auswirkung des Geschlechts auf die Pharmakokinetik von Budesonid zu untersuchen. Nach Verabreichung von 400 µg RHINOCORT 100 µg AQUA (Budesonid) Nasenspray an 7 männliche und 8 weibliche Probanden in einer pharmakokinetischen Studie wurden jedoch keine wesentlichen geschlechtsspezifischen Unterschiede in den pharmakokinetischen Parametern gefunden.
Wettrennen
Es wurde keine spezifische Studie durchgeführt, um die Auswirkung der ethnischen Zugehörigkeit auf die Pharmakokinetik von Budesonid zu bewerten.
Stillende Mutter
Die Disposition von Budesonid nach oraler Inhalation aus einem Trockenpulverinhalator in Dosen von 200 oder 400 µg zweimal täglich über mindestens 3 Monate wurde bei acht stillenden Frauen mit Asthma im Zeitraum von 1 bis 6 Monaten nach der Geburt untersucht. Die systemische Budesonid-Exposition bei diesen Frauen scheint mit derjenigen bei nicht-stillenden Frauen mit Asthma aus anderen Studien vergleichbar zu sein. Muttermilch, die über acht Stunden nach der Einnahme gewonnen wurde, ergab, dass die maximale Konzentration von Budesonid für die 400- und 800-Mikrogramm-Dosen 0,39 bzw. 0,78 nmol/l betrug und innerhalb von 45 Minuten nach der Einnahme auftrat. Die geschätzte orale Tagesdosis von Budesonid aus der Muttermilch an den Säugling betrug ungefähr 0,007 und 0,014 µg/kg/Tag für die beiden in dieser Studie verwendeten Dosierungsschemata, was ungefähr 0,3 % bis 1 % der von der Mutter inhalierten Dosis entspricht. Budesonidspiegel in Plasmaproben von fünf Säuglingen etwa 90 Minuten nach dem Stillen (und etwa 140 Minuten nach Verabreichung des Arzneimittels an die Mutter) lagen unter quantifizierbaren Spiegeln ( Verwendung in bestimmten Bevölkerungsgruppen, stillenden Müttern ].
Nieren- oder Leberfunktionsstörung
Die Pharmakokinetik von Budesonid wurde bei Patienten mit eingeschränkter Nierenfunktion nicht untersucht. Eine eingeschränkte Leberfunktion kann die Ausscheidung von Kortikosteroiden beeinträchtigen. Die Pharmakokinetik von Budesonid wurde durch eine beeinträchtigte Leberfunktion beeinflusst, was durch eine doppelte systemische Verfügbarkeit nach oraler Einnahme belegt wurde. Die Relevanz dieses Ergebnisses für intranasal verabreichtes Budesonid wurde nicht nachgewiesen.
Arzneimittelwechselwirkungen
Inhibitoren von Cytochrom-P450-Enzymen
Ketoconazol: Ketoconazol, ein starker Inhibitor von Cytochrom P450 (CYP) Isoenzym 3A4 (CYP3A4), dem wichtigsten metabolischen Enzym für Kortikosteroide, erhöhte die Plasmaspiegel von oral eingenommenem Budesonid [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Cimetidin: Bei empfohlener Dosierung hatte Cimetidin, ein unspezifischer Inhibitor von CYP-Enzymen, eine leichte, aber klinisch unbedeutende Wirkung auf die Pharmakokinetik von oralem Budesonid.
Tiertoxikologie und/oder Pharmakologie
Budesonid war bei Kaninchen und Ratten teratogen und embryozid. Budesonid führte bei Kaninchen bei einer subkutanen Dosis von 25 µg/kg (ungefähr das Zweifache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf µg/m2-Basis) und bei einer subkutanen Dosis von 500 µg zu fötalen Verlusten, vermindertem Gewicht der Jungtiere und Skelettanomalien /kg bei Ratten (etwa das 16-fache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf mcg/m2-Basis). Bei Ratten wurden keine teratogenen oder embryoziden Wirkungen beobachtet, wenn Budesonid inhalativ in Dosen von bis zu 250 µg/kg verabreicht wurde (etwa das 8-fache der maximal empfohlenen intranasalen Tagesdosis bei Erwachsenen auf µg/m2-Basis).
Klinische Studien
Die therapeutische Wirksamkeit von RHINOCORT AQUA (Budesonid) Nasenspray wurde in placebokontrollierten klinischen Studien zu saisonaler und ganzjähriger allergischer Rhinitis von 3-6 Wochen Dauer untersucht.
Die Anzahl der mit Budesonid behandelten Patienten in diesen Studien betrug 90 Männer und 51 Frauen im Alter von 6 bis 12 Jahren und 691 Männer und 694 Frauen im Alter von 12 Jahren und älter. Die Patienten waren überwiegend Kaukasier.
Insgesamt zeigten die Ergebnisse dieser klinischen Studien, dass die einmal tägliche Verabreichung von RHINOCORT AQUA (Budesonid) Nasenspray eine statistisch signifikante Verringerung der Schwere der nasalen Symptome der saisonalen und ganzjährigen allergischen Rhinitis, einschließlich laufender Nase, Niesen und verstopfter Nase, bewirkt.
Eine Verbesserung der nasalen Symptome kann bei Patienten innerhalb von 10 Stunden nach der ersten Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray festgestellt werden. Diese Zeit bis zum Einsetzen wird durch eine Umweltbelastungsstudie bei Patienten mit saisonaler allergischer Rhinitis gestützt, die zeigte, dass RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray zu einer statistisch signifikanten Verbesserung der nasalen Symptome im Vergleich zu Placebo um 10 Stunden führte. Weitere Unterstützung kommt von einer klinischen Studie an Patienten mit ganzjähriger allergischer Rhinitis, die eine statistisch signifikante Verbesserung der nasalen Symptome sowohl für RHINOCORT AQUA (Budesonid) Nasenspray als auch für das aktive Vergleichspräparat (Mometasonfuroat) im Vergleich zu Placebo um 8 Stunden zeigte. Der Beginn wurde in dieser Studie auch mit der maximalen nasalen Inspirationsflussrate bewertet, und dieser Endpunkt zeigte keine Wirksamkeit für eine der aktiven Behandlungen. Obwohl in diesen Studien statistisch signifikante Verbesserungen der nasalen Symptome im Vergleich zu Placebo innerhalb von 8-10 Stunden festgestellt wurden, tritt etwa die Hälfte bis zwei Drittel der endgültigen klinischen Verbesserung mit RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray in den ersten 1-2 Tagen auf. und der maximale Nutzen wird möglicherweise erst etwa 2 Wochen nach Beginn der Behandlung erreicht.
VERWEISE
Kallen B, Rydhstroem H, Aberg A. Angeborene Fehlbildungen nach der Anwendung von inhaliertem Budesonid in der Frühschwangerschaft. Obstet Gynecol 1999; 93:392–395.
2 Ericson A, Kallen B. Drogenkonsum während der Schwangerschaft: Einzigartige schwedische Registrierungsmethode, die verbessert werden kann. Schwedische Arzneimittelbehörde 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Normale Schwangerschaftsergebnisse in einer populationsbasierten Studie mit 2968 schwangeren Frauen, die Budesonid ausgesetzt waren. J Allergy Clin Immunol 2003;! 11:736-742.
INFORMATIONEN ZUM PATIENTEN
RHINOCORT 100mcg AQUA (Budesonid) ® (RINE-o-cort AH-kwa) (Budesonid) Nasenspray
Nur zur Anwendung in der Nase
Lesen Sie die Patienteninformationen, die mit RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray geliefert werden, bevor Sie damit beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Informationen ersetzen nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung. Wenn Sie Fragen zu RHINOCORT AQUA (Budesonid) Nasenspray haben, wenden Sie sich an Ihren Arzt oder Apotheker.
Was ist RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray?
RHINOCORT AQUA (Budesonid) Nasenspray ist ein verschreibungspflichtiges Arzneimittel zur Behandlung saisonaler und ganzjähriger Allergiesymptome bei Erwachsenen und Kindern ab 6 Jahren.
RHINOCORT AQUA Nasenspray enthält Budesonid, ein künstlich hergestelltes (synthetisches) Kortikosteroid. Intranasale Kortikosteroide sind natürliche Hormone, die im Körper vorkommen und die Schwellung der Nasenschleimhaut reduzieren. Wenn Sie RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray in Ihre Nase sprühen, hilft es, die nasalen Symptome von allergischer Rhinitis (Entzündung der Nasenschleimhaut) wie verstopfte Nase, laufende Nase, Juckreiz und Niesen zu lindern.
Die Sicherheit und Wirksamkeit von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray wurde bei Kindern unter 6 Jahren nicht nachgewiesen.
Wer sollte RHINOCORT AQUA (Budesonid) Nasenspray nicht anwenden?
Verwenden Sie RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray nicht:
Was sollte ich meinem Arzt vor der Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray mitteilen?
Bevor Sie RHINOCORT AQUA (Budesonid) Nasenspray anwenden, informieren Sie Ihren Arzt oder Apotheker, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen.
RHINOCORT AQUA (Budesonid) Nasenspray kann die Wirkungsweise anderer Arzneimittel beeinflussen, und andere Arzneimittel können die Wirkungsweise von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray beeinflussen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste Ihrer Arzneimittel mit sich, die Sie Ihrem Arzt und Apotheker zeigen können, wenn Sie ein neues Arzneimittel erhalten.
Wie sollte ich RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray anwenden?
Welche Nebenwirkungen kann RHINOCORT AQUA (Budesonid) Nasenspray haben?
RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe, wenn Sie Symptome einer der oben aufgeführten schwerwiegenden Nebenwirkungen haben.
Zu den häufigsten Nebenwirkungen von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray gehören:
Informieren Sie Ihren Arzt, wenn Sie eine Nebenwirkung haben, die Sie stört oder nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt an, um medizinischen Rat zu Nebenwirkungen zu erhalten. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch melden.
Sie können AstraZeneca Nebenwirkungen unter 1-800-236-9933 melden.
Was sollte ich über allergische Rhinitis wissen?
„Rhinitis“ bedeutet eine Entzündung der Nasenschleimhaut. Es wird manchmal als "Heuschnupfen" bezeichnet. Allergische Rhinitis kann durch Allergien gegen Pollen, Tierhaare, Hausstaubmilben und Schimmelpilzsporen verursacht werden. Wenn Sie an allergischer Rhinitis leiden, wird Ihre Nase verstopft, läuft und juckt. Sie können auch viel niesen. Sie können rote, juckende, tränende Augen haben; kratzender Hals; oder verstopfte, juckende Ohren.
RHINOCORT AQUA (Budesonid) Nasenspray hilft, Ihre Nasensymptome zu lindern.
Wenn Sie auch juckende, tränende Augen haben, sollten Sie dies Ihrem Arzt mitteilen. Er oder sie kann zusätzliche Medikamente zur Behandlung dieser Symptome verschreiben.
Wie ist RHINOCORT AQUA (Budesonid) Nasenspray aufzubewahren?
Allgemeine Informationen zur sicheren und wirksamen Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray:
Verwenden Sie RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie RHINOCORT AQUA (Budesonid) Nasenspray nicht an andere Personen, selbst wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen über RHINOCORT 100 µg AQUA (Budesonid) Nasenspray zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray fragen, das für Angehörige der Gesundheitsberufe bestimmt ist.
Weitere Informationen erhalten Sie unter www.astrazeneca-us.com oder telefonisch unter 1-800-236-9933 bei AstraZeneca.
Was sind die Inhaltsstoffe von RHINOCORT AQUA (Budesonid) Nasenspray?
Wirkstoff: Budesonid
Inaktive Zutaten: Mikrokristalline Cellulose und Natriumcarboxymethylcellulose, wasserfreie Dextrose, Polysorbat 80, Dinatriumedetat, Kaliumsorbat und gereinigtes Wasser und Salzsäure.
Gebrauchsanweisung für Patienten
Nur zur Anwendung in der Nase. Nicht in die Augen oder den Mund sprühen.
Lesen Sie die Gebrauchsanweisung für Patienten sorgfältig durch, bevor Sie mit der Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray beginnen. Wenn Sie Fragen haben, wenden Sie sich an Ihren Arzt
Abbildung A 
So bereiten Sie Ihr RHINOCORT AQUA (Budesonid) Nasenspray vor
Vor der Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray muss die Flasche vorbereitet werden. Zur Grundierung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray:
1. Ziehen Sie die grüne Schutzkappe von der Nasensprayeinheit ab.
2. Schütteln Sie die Flasche vor jedem Gebrauch einige Sekunden lang vorsichtig.
3. Halten Sie die Flasche fest, wie in Abbildung B gezeigt, mit Ihrem Zeige- und Mittelfinger auf beiden Seiten der Sprühspitze und Ihrem Daumen unter der Flasche.
Abbildung B 
4. Aktivieren Sie die Pumpe, indem Sie schnell und fest auf den weißen Kragen drücken, während Sie den Boden der Flasche mit Ihrem Daumen halten.
5. Schütteln Sie die Flasche vor der ersten Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray leicht. Die Pumpe muss durch 8-maliges Herunterdrücken des weißen Kragens angesaugt werden. Die Pumpe ist jetzt einsatzbereit. Bei täglichem Gebrauch muss die Pumpe nicht neu entlüftet werden. Wenn es 2 Tage hintereinander nicht verwendet wird, mit 1 Sprühstoß erneut grundieren oder bis ein feiner Sprühnebel erscheint. Wenn die Pumpe länger als 14 Tage nicht verwendet wird, spülen Sie die Sprühspitze der Pumpe mit den am Ende dieser Packungsbeilage aufgeführten Reinigungsschritten. Nach der Reinigung erneut grundieren mit 2 Sprühstößen oder bis ein feiner Sprühnebel erscheint.
Jede Flasche RHINOCORT AQUA (Budesonid) Nasenspray enthält genug Arzneimittel, um das Arzneimittel 120 Mal aus der Flasche zu sprühen, nachdem die Flasche gefüllt wurde.
Sie sollten die Flasche RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray nicht nach 120 Sprühstößen verwenden. Zusätzliche Sprühstöße nach 120 enthalten möglicherweise nicht die richtige Menge des Arzneimittels. Sie sollten die Anzahl der Sprühstöße, die Sie von jeder Flasche RHINOCORT 100 mcg AQUA Nasenspray verwenden, im Auge behalten und alle Arzneimittelreste, die in der Flasche zurückgeblieben sind, wegwerfen. Füllen Sie Ihr Rezept monatlich auf.
So verwenden Sie Ihr RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray
Befolgen Sie diese Anweisungen für die tägliche Anwendung von RHINOCORT AQUA (Budesonid) Nasenspray:
Abbildung C 
4. Führen Sie die Sprühspitze in Ihr Nasenloch ein (die Spitze sollte nicht weit in Ihre Nase reichen). Schließen Sie das andere Nasenloch mit einem Finger und lehnen Sie Ihren Kopf leicht nach vorne, sodass das Spray auf Ihren Nasenrücken gerichtet ist (Siehe Abbildung D ).
Abbildung D 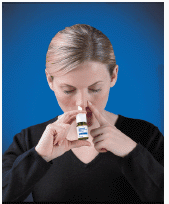
5. Aktivieren Sie für jeden Sprühstoß die Pumpe, indem Sie schnell und fest auf den weißen Kragen drücken, während Sie den Boden der Flasche mit Ihrem Daumen halten. Atme sanft durch das Nasenloch nach innen.
6. Nachdem Sie in Ihr Nasenloch gesprüht haben, lehnen Sie Ihren Kopf für einige Sekunden nach hinten (siehe Abbildung E ).
Abbildung E 
7. Wenn ein zweiter Sprühstoß in dasselbe Nasenloch benötigt wird, wiederholen Sie die Schritte 3 bis 6.
8. Wiederholen Sie die Schritte 3 bis 7 für Ihr anderes Nasenloch.
9. Vermeiden Sie es, sich 15 Minuten lang nach der Anwendung von RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray die Nase zu putzen.
10. Wischen Sie die Sprühspitze mit einem sauberen Tuch ab (siehe Abbildung F ) und setzen Sie die grüne Schutzkappe wieder auf. Bewahren Sie die Flasche aufrecht auf.
Abbildung F 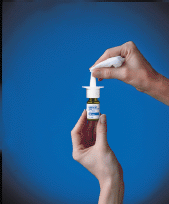
So reinigen Sie Ihr RHINOCORT 100 mcg AQUA (Budesonid) Nasenspray
Abbildung G 
Spülen Sie die grüne Schutzkappe und die Sprühspitze regelmäßig aus. Um dies zu tun:
Für weitere Informationen über RHINOCORT 100 mcg AQUA (Budesonid) ® Nasenspray wenden Sie sich bitte telefonisch an das AstraZeneca-Informationszentrum, Montag bis Freitag, 8.00 - 18.00 Uhr ET, außer an Feiertagen unter 1-800-236-9933.