Flonase Nasal Spray 50mcg Fluticasone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Flonase und wie wird es angewendet?
Flonase ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von allergischer Rhinitis (Niesen, laufende Nase und juckende oder tränende Augen) und Nasenpolypen. Flonase kann allein oder mit anderen Medikamenten verwendet werden.
Flonase gehört zu einer Klasse von Medikamenten namens Corticosteroide, Intranasal, Immunsuppressiva, PHD.
Es ist nicht bekannt, ob Flonase bei Kindern unter 4 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Flonase haben?
Flonase kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Flonase gehören:
BEZEICHNUNG
Der Wirkstoff von FLONASE Nasenspray 50 µg ist Fluticasonpropionat, ein Kortikosteroid mit dem chemischen Namen S-(Fluormethyl) 6α,9-difluor-11β,17-dihydroxy-16α-methyl-3oxoandrosta-1,4-dien-17β-carbothioat , 17-Propionat und die folgende chemische Struktur:
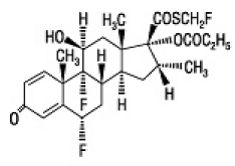
Fluticasonpropionat ist ein weißes Pulver mit einem Molekulargewicht von 500,6 und die empirische Formel ist C25H31F3O5S. Es ist praktisch unlöslich in Wasser, frei löslich in Dimethylsulfoxid und Dimethylformamid und leicht löslich in Methanol und 95 % Ethanol.
FLONASE Nasenspray, 50 mcg ist eine wässrige Suspension von mikrofeinem Fluticasonpropionat zur topischen Anwendung auf der Nasenschleimhaut mittels einer Sprühpumpe mit Dosierzerstäuber. FLONASE Nasenspray 50 µg enthält außerdem mikrokristalline Cellulose und Carboxymethylcellulose-Natrium, Dextrose, 0,02 % w/w Benzalkoniumchlorid, Polysorbat 80 und 0,25 % w/w Phenylethylalkohol und hat einen pH-Wert zwischen 5 und 7.
Nach dem ersten Priming werden bei jedem Sprühstoß 50 µg Fluticasonpropionat in 100 mg Formulierung durch den Nasenadapter abgegeben.
INDIKATIONEN
FLONASE® Nasenspray ist für die Behandlung der nasalen Symptome der ganzjährigen nichtallergischen Rhinitis bei erwachsenen und pädiatrischen Patienten ab 4 Jahren indiziert.
DOSIERUNG UND ANWENDUNG
FLONASE Nasenspray nur intranasal verabreichen. FLONASE Nasenspray vor dem ersten Gebrauch oder nach einer Zeit der Nichtbenutzung (1 Woche oder länger) vorbereiten, indem der Inhalt gut geschüttelt und 6 Sprühstöße vom Gesicht weg in die Luft abgegeben werden. FLONASE Nasenspray vor jedem Gebrauch leicht schütteln.
Patienten sollten FLONASE Nasenspray in regelmäßigen Abständen anwenden, da seine Wirksamkeit von seiner regelmäßigen Anwendung abhängt. Die maximale Wirkung kann mehrere Tage andauern, und einzelne Patienten werden eine unterschiedliche Zeit bis zum Einsetzen und einen unterschiedlichen Grad der Symptomlinderung erfahren.
Erwachsene
Die empfohlene Anfangsdosis für Erwachsene beträgt 2 Sprühstöße (je 50 Mikrogramm Fluticasonpropionat) einmal täglich in jedes Nasenloch (Tagesgesamtdosis 200 Mikrogramm). Die gleiche tägliche Gesamtdosis, 1 Sprühstoß in jedes Nasenloch, zweimal täglich verabreicht (z. B. 8 Uhr morgens und 20 Uhr abends), ist ebenfalls wirksam. Nach den ersten Tagen können die Patienten ihre Dosis zur Erhaltungstherapie möglicherweise auf einmal täglich 1 Sprühstoß in jedes Nasenloch reduzieren.
Die maximale Gesamttagesdosis sollte 2 Sprühstöße in jedes Nasenloch nicht überschreiten (Gesamtdosis 200 µg/Tag). Es gibt keine Hinweise darauf, dass eine Überschreitung der empfohlenen Dosis wirksamer ist.
Jugendliche und Kinder (ab 4 Jahren)
Die empfohlene Anfangsdosis für Jugendliche und Kinder ab 4 Jahren beträgt einmal täglich 1 Sprühstoß in jedes Nasenloch (Tagesgesamtdosis 100 Mikrogramm). Patienten, die auf 1 Sprühstoß in jedes Nasenloch nicht ausreichend ansprechen, können einmal täglich 2 Sprühstöße in jedes Nasenloch anwenden (Tagesgesamtdosis 200 Mikrogramm). Sobald eine ausreichende Kontrolle erreicht ist, sollte die Dosierung auf einmal täglich 1 Sprühstoß in jedes Nasenloch reduziert werden.
Die maximale Gesamttagesdosis sollte 2 Sprühstöße in jedes Nasenloch (200 mcg/Tag) nicht überschreiten. Es gibt keine Hinweise darauf, dass eine Überschreitung der empfohlenen Dosis wirksamer ist.
WIE GELIEFERT
Darreichungsformen und Stärken
FLONASE Nasenspray ist eine Suspension als Nasenspray. Jeder 100-mg-Spray liefert 50 µg Fluticasonpropionat.
Lagerung und Handhabung
FLONASE Nasenspray, 50 mcg wird in einer braunen Glasflasche geliefert, die mit einer weißen Dosierzerstäuberpumpe, einem weißen Nasenadapter und einer grünen Staubschutzhülle in einer Schachtel mit 1 ( NDC 0173-0453-01) mit FDA-Zulassung Patientenkennzeichnung (sehen Patienten-Gebrauchsanweisung für die ordnungsgemäße Betätigung des Geräts ). Jede Flasche enthält ein Nettofüllgewicht von 16 g und reicht für 120 Sprühstöße. Jeder Sprühstoß gibt 50 µg Fluticasonpropionat in 100 mg Formulierung durch den Nasenadapter ab. Die richtige Menge des Medikaments in jedem Sprühstoß kann nach 120 Sprühstößen nicht garantiert werden, selbst wenn die Flasche nicht vollständig leer ist. Die Flasche sollte entsorgt werden, wenn die auf dem Etikett angegebene Anzahl von Sprühstößen aufgebraucht ist.
Zwischen 4° und 30°C (39° und 86°F) lagern.
GlaxoSmithKline Research Triangle Park, NC 27709. Überarbeitet: Januar 2015
NEBENWIRKUNGEN
Die systemische und lokale Anwendung von Kortikosteroiden kann zu Folgendem führen:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
In kontrollierten klinischen Studien in den USA erhielten mehr als 3.300 Patienten mit allergischer und nicht allergischer Rhinitis eine intranasale Behandlung mit Fluticasonpropionat. Im Allgemeinen wurden Nebenwirkungen in klinischen Studien hauptsächlich mit Reizungen der Nasenschleimhäute in Verbindung gebracht, und die Nebenwirkungen wurden mit ungefähr der gleichen Häufigkeit von mit Placebo behandelten Personen berichtet. Weniger als 2 % der Patienten in klinischen Studien brachen die Behandlung wegen Nebenwirkungen ab; diese Rate war für Vehikel-Placebo und aktive Vergleichspräparate ähnlich.
Die unten beschriebenen Sicherheitsdaten basieren auf 7 placebokontrollierten klinischen Studien bei Patienten mit allergischer Rhinitis. Die 7 Studien umfassten 536 Probanden (57 Mädchen und 108 Jungen im Alter von 4 bis 11 Jahren, 137 weibliche und 234 männliche Jugendliche und Erwachsene), die mit FLONASE 200 mcg einmal täglich über 2 bis 4 Wochen behandelt wurden, sowie 2 placebokontrollierte klinische Studien mit 246 Probanden (119 weibliche und 127 männliche Jugendliche und Erwachsene) mit FLONASE 200 mcg einmal täglich über 6 Monate behandelt (Tabelle 1). Ebenfalls in Tabelle 1 enthalten sind Nebenwirkungen aus 2 Studien, in denen 167 Kinder (45 Mädchen und 122 Jungen im Alter von 4 bis 11 Jahren) 2 bis 4 Wochen lang einmal täglich mit 100 µg FLONASE behandelt wurden.
Andere Nebenwirkungen mit FLONASE Nasenspray 50 µg, die mit einer Inzidenz von kleiner oder gleich 3 %, aber größer oder gleich 1 % und häufiger als unter Placebo beobachtet wurden, waren: Blut im Nasenschleim, laufende Nase, Bauchschmerzen, Durchfall, Fieber, grippeähnliche Symptome, Schmerzen, Schwindel und Bronchitis.
Postmarketing-Erfahrung
Zusätzlich zu den aus klinischen Studien berichteten unerwünschten Ereignissen wurden die folgenden unerwünschten Ereignisse während der Anwendung von intranasalem Fluticasonpropionat nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Diese Ereignisse wurden entweder aufgrund ihres Schweregrads, ihrer Meldehäufigkeit oder ihres kausalen Zusammenhangs mit Fluticasonpropionat oder einer Kombination dieser Faktoren für die Aufnahme ausgewählt.
Allgemeine Erkrankungen und Bedingungen am Verabreichungsort
Überempfindlichkeitsreaktionen, einschließlich Angioödem, Hautausschlag, Ödem des Gesichts und der Zunge, Juckreiz, Urtikaria, Bronchospasmus, Keuchen, Dyspnoe und Anaphylaxie/anaphylaktoide Reaktionen, die in seltenen Fällen schwerwiegend waren.
Erkrankungen des Ohrs und des Labyrinths
Veränderung oder Verlust des Geschmacks- und/oder Geruchssinns und selten Perforation der Nasenscheidewand, Nasengeschwür, Halsschmerzen, Rachenreizung und -trockenheit, Husten, Heiserkeit und Stimmveränderungen.
Augenerkrankungen
Trockenheit und Reizung, Konjunktivitis, verschwommenes Sehen, Glaukom, erhöhter Augeninnendruck und Katarakte.
Fälle von Wachstumshemmung wurden für intranasale Kortikosteroide, einschließlich FLONASE, berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Inhibitoren von Cytochrom P450 3A4
Fluticasonpropionat ist ein Substrat von CYP3A4. Die Anwendung starker CYP3A4-Hemmer (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir, Ketoconazol, Telithromycin, Conivaptan, Lopinavir, Nefazodon, Voriconazol) mit FLONASE Nasenspray wird nicht empfohlen, da systemische Kortikosteroid-Nebenwirkungen verstärkt werden kann auftreten.
Ritonavir
Eine Wechselwirkungsstudie mit wässrigem Fluticasonpropionat-Nasenspray bei gesunden Probanden hat gezeigt, dass Ritonavir (ein starker CYP3A4-Hemmer) die Fluticasonpropionat-Exposition im Plasma signifikant erhöhen kann, was zu signifikant verringerten Cortisolkonzentrationen im Serum führt [siehe KLINISCHE PHARMAKOLOGIE ]. Nach der Markteinführung gab es Berichte über klinisch signifikante Arzneimittelwechselwirkungen bei Patienten, die Fluticasonpropionat-Produkte, einschließlich FLONASE, mit Ritonavir erhielten, was zu systemischen Kortikosteroidwirkungen führte, einschließlich Cushing-Syndrom und Nebennierensuppression.
Ketoconazol
Die gleichzeitige Verabreichung von oral inhaliertem Fluticasonpropionat (1.000 mcg) und Ketoconazol (200 mg einmal täglich) führte zu einer 1,9-fachen Erhöhung der Fluticasonpropionat-Exposition im Plasma und einer 45 %-igen Abnahme der Plasma-Cortisol-Fläche unter der Kurve (AUC), hatte aber keine Wirkung auf die Ausscheidung von Cortisol im Urin.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Lokale nasale Wirkungen
Epistaxis
In klinischen Studien mit einer Dauer von 2 bis 26 Wochen wurde Epistaxis häufiger bei Patienten beobachtet, die mit FLONASE Nasenspray behandelt wurden, als bei Patienten, die Placebo erhielten [siehe NEBENWIRKUNGEN ].
Nasale Ulzeration
Nach Markteinführung wurden Fälle von Nasengeschwüren bei Patienten berichtet, die mit FLONASE Nasenspray behandelt wurden [siehe NEBENWIRKUNGEN ].
Candida-Infektion
In klinischen Studien mit intranasal verabreichtem Fluticasonpropionat ist die Entwicklung lokalisierter Infektionen der Nase und des Rachens mit Candida albicans aufgetreten. Wenn sich eine solche Infektion entwickelt, kann eine Behandlung mit einer geeigneten lokalen Therapie und das Absetzen von FLONASE Nasenspray erforderlich sein. Patienten, die FLONASE Nasenspray über mehrere Monate oder länger anwenden, sollten regelmäßig auf Anzeichen einer Candida-Infektion oder andere Anzeichen von Nebenwirkungen auf die Nasenschleimhaut untersucht werden.
Perforation der Nasenscheidewand
Postmarketing-Fälle von Nasenseptumperforation wurden bei mit FLONASE-Nasenspray behandelten Patienten berichtet [siehe NEBENWIRKUNGEN ].
Beeinträchtigte Wundheilung
Aufgrund der hemmenden Wirkung von Kortikosteroiden auf die Wundheilung sollten Patienten, die kürzlich ein Nasengeschwür, eine Nasenoperation oder ein Nasentrauma erlitten haben, die Anwendung von FLONASE Nasenspray vermeiden, bis die Heilung eingetreten ist.
Glaukom und Katarakte
Die Anwendung von intranasalen und inhalativen Kortikosteroiden kann zur Entwicklung von Glaukom und/oder Katarakt führen. Daher ist eine engmaschige Überwachung bei Patienten mit Sehstörungen oder mit erhöhtem Augeninnendruck, Glaukom und/oder Katarakt in der Anamnese erforderlich.
Überempfindlichkeitsreaktionen einschließlich Anaphylaxie
Überempfindlichkeitsreaktionen (z. B. Anaphylaxie, Angioödem, Urtikaria, Kontaktdermatitis und Hautausschlag) wurden nach Verabreichung von FLONASE Nasenspray berichtet. FLONASE absetzen
Nasenspray, wenn solche Reaktionen auftreten [siehe KONTRAINDIKATIONEN ]. Selten können unmittelbar nach der Verabreichung von FLONASE Nasenspray Überempfindlichkeitsreaktionen auftreten.
Immunsuppression
Personen, die Medikamente einnehmen, die das Immunsystem unterdrücken, sind anfälliger für Infektionen als gesunde Personen. Windpocken und Masern beispielsweise können bei empfindlichen Kindern oder Erwachsenen, die Kortikosteroide einnehmen, einen schwerwiegenderen oder sogar tödlichen Verlauf nehmen. Bei solchen Kindern oder Erwachsenen, die diese Krankheiten nicht hatten oder ordnungsgemäß geimpft wurden, sollte besonders darauf geachtet werden, eine Exposition zu vermeiden. Wie sich Dosis, Art und Dauer der Kortikosteroidverabreichung auf das Risiko der Entwicklung einer disseminierten Infektion auswirken, ist nicht bekannt. Der Beitrag der zugrunde liegenden Erkrankung und/oder einer vorherigen Behandlung mit Kortikosteroiden zum Risiko ist ebenfalls nicht bekannt. Wenn ein Patient Windpocken ausgesetzt ist, kann eine Prophylaxe mit Varizella-Zoster-Immunglobulin (VZIG) indiziert sein. Wenn ein Patient Masern ausgesetzt ist, kann eine Prophylaxe mit gepooltem intramuskulärem Immunglobulin (IG) indiziert sein. (Sehen die vollständigen Verschreibungsinformationen für VZIG und IG. Wenn sich Windpocken entwickeln, kann eine Behandlung mit antiviralen Mitteln in Erwägung gezogen werden.
Intranasale Kortikosteroide sollten bei Patienten mit aktiven oder ruhenden tuberkulösen Infektionen der Atemwege, wenn überhaupt, mit Vorsicht angewendet werden; systemische Pilz-, Bakterien-, Virus- oder Parasiteninfektionen; oder okulärer Herpes simplex.
Hyperkortizismus und Nebennierensuppression
Wenn intranasale Kortikosteroide in höheren als den empfohlenen Dosierungen oder bei empfindlichen Personen in den empfohlenen Dosierungen angewendet werden, können systemische Kortikosteroidwirkungen wie Hyperkortizismus und Nebennierensuppression auftreten. Wenn solche Veränderungen auftreten, sollte die Dosierung von FLONASE Nasenspray gemäß den anerkannten Verfahren zum Absetzen einer oralen Kortikosteroidtherapie langsam abgesetzt werden.
Der Ersatz eines systemischen Kortikosteroids durch ein topisches Kortikosteroid kann von Anzeichen einer Nebenniereninsuffizienz begleitet sein. Darüber hinaus können bei manchen Patienten Symptome eines Kortikosteroid-Entzugs auftreten (z. B. Gelenk- und/oder Muskelschmerzen, Abgeschlagenheit, Depression). Patienten, die zuvor über einen längeren Zeitraum mit systemischen Kortikosteroiden behandelt und auf topische Kortikosteroide umgestellt wurden, sollten sorgfältig auf eine akute Nebenniereninsuffizienz als Reaktion auf Stress überwacht werden. Bei Patienten mit Asthma oder anderen klinischen Zuständen, die eine langfristige Behandlung mit systemischen Kortikosteroiden erfordern, kann eine rasche Verringerung der Dosierung von systemischen Kortikosteroiden zu einer schweren Verschlimmerung ihrer Symptome führen.
Arzneimittelwechselwirkungen mit starken Cytochrom P450 3A4-Inhibitoren
Die Anwendung starker Cytochrom P450 3A4 (CYP3A4)-Hemmer (z. B. Ritonavir, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Saquinavir, Ketoconazol, Telithromycin, Conivaptan, Lopinavir, Nefazodon, Voriconazol) mit FLONASE Nasenspray wird nicht empfohlen, weil verstärkte systemische Kortikosteroid-Nebenwirkungen können auftreten [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN , KLINISCHE PHARMAKOLOGIE ].
Auswirkung auf das Wachstum
Intranasale Kortikosteroide können eine Verringerung der Wachstumsgeschwindigkeit verursachen, wenn sie pädiatrischen Patienten verabreicht werden [siehe Verwendung in bestimmten Populationen ]. Überwachen Sie routinemäßig das Wachstum von pädiatrischen Patienten, die FLONASE Nasenspray erhalten. Um die systemischen Wirkungen von intranasalen Kortikosteroiden, einschließlich FLONASE Nasenspray, zu minimieren, titrieren Sie die Dosis jedes Patienten auf die niedrigste Dosis, die seine/ihre Symptome wirksam kontrolliert [siehe DOSIERUNG UND ANWENDUNG , Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( PATIENTENINFORMATION und Gebrauchsanweisung ).
Lokale nasale Wirkungen
Informieren Sie die Patienten darüber, dass die Behandlung mit FLONASE Nasenspray 50 µg zu Nebenwirkungen führen kann, darunter Nasenbluten und Nasengeschwüre. Bei der Behandlung mit FLONASE Nasenspray kann auch eine Candida-Infektion auftreten. Darüber hinaus wurde FLONASE Nasenspray 50 mcg mit Perforation der Nasenscheidewand und beeinträchtigter Wundheilung in Verbindung gebracht. Patienten, die kürzlich Nasengeschwüre, Nasenoperationen oder Nasentrauma erlitten haben, sollten FLONASE Nasenspray 50 µg nicht anwenden, bis die Heilung eingetreten ist [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Glaukom und Katarakte
Informieren Sie die Patienten darüber, dass Glaukom und Katarakte mit der Anwendung von nasalen und inhalativen Kortikosteroiden in Verbindung gebracht werden. Raten Sie den Patienten, ihren Arzt zu benachrichtigen, wenn während der Anwendung von FLONASE Nasenspray eine Veränderung des Sehvermögens festgestellt wird [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie
Informieren Sie die Patienten darüber, dass nach Verabreichung von FLONASE Nasenspray Überempfindlichkeitsreaktionen, einschließlich Anaphylaxie, Angioödem, Urtikaria, Kontaktdermatitis und Hautausschlag, auftreten können. Wenn solche Reaktionen auftreten, sollten die Patienten die Anwendung von FLONASE Nasenspray abbrechen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Immunsuppression
Warnen Sie Patienten, die immunsuppressive Dosen von Kortikosteroiden erhalten, davor, sich Windpocken oder Masern auszusetzen, und wenden Sie sich im Falle einer Exposition unverzüglich an Ihren Arzt. Informieren Sie die Patienten über eine mögliche Verschlechterung einer bestehenden Tuberkulose; Pilz-, Bakterien-, Virus- oder Parasiteninfektionen; oder okulärer Herpes simplex [vgl WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Reduzierte Wachstumsgeschwindigkeit
Weisen Sie die Eltern darauf hin, dass FLONASE Nasenspray 50 µg bei pädiatrischen Patienten zu einer Verringerung der Wachstumsgeschwindigkeit führen kann. Ärzte sollten das Wachstum von Kindern und Jugendlichen, die Kortikosteroide auf beliebige Weise einnehmen, engmaschig überwachen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN , Pädiatrische Verwendung ].
Verwenden Sie täglich für beste Wirkung
Informieren Sie die Patienten darüber, dass sie FLONASE Nasenspray 50 µg regelmäßig anwenden sollten. FLONASE Nasenspray 50 µg hat, wie andere Kortikosteroide, keine unmittelbare Wirkung auf die Rhinitis-Symptome. Der maximale Nutzen kann möglicherweise mehrere Tage lang nicht erreicht werden. Patienten sollten die verschriebene Dosis nicht erhöhen, sich jedoch an ihren Arzt wenden, wenn sich die Symptome nicht bessern oder sich der Zustand verschlechtert.
Spray von Augen und Mund fernhalten
Weisen Sie die Patienten darauf hin, FLONASE Nasenspray nicht in Augen und Mund zu sprühen.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Fluticasonpropionat zeigte bei oralen Dosen von bis zu 1.000 µg/kg (ungefähr das 20-fache der MRHDID bei Erwachsenen und ungefähr das 10-fache der MRHDID bei Kindern auf µg/m²-Basis) über 78 Wochen kein tumorigenes Potenzial bei Mäusen oder bei Ratten bei Inhalationsdosen darüber bis 57 µg/kg (ungefähr das 2-fache der MRHDID bei Erwachsenen und ungefähr gleich der MRHDID bei Kindern auf µg/m²-Basis) für 104 Wochen.
Fluticasonpropionat induzierte in vitro keine Genmutation in prokaryotischen oder eukaryotischen Zellen. Bei kultivierten humanen peripheren Lymphozyten wurde in vitro oder im Maus-Mikrokerntest keine signifikante klastogene Wirkung beobachtet.
Bei männlichen und weiblichen Ratten wurden bei subkutanen Dosen von bis zu 50 µg/kg (etwa das 2-fache der MRHDID bei Erwachsenen auf µg/m²-Basis) keine Hinweise auf eine Beeinträchtigung der Fertilität beobachtet. Das Prostatagewicht wurde bei einer subkutanen Dosis von 50 mcg/kg signifikant reduziert.
Klinische Studien
Perenniale nichtallergische Rhinitis
Drei randomisierte, doppelblinde, Placebo-kontrollierte Parallelgruppen-Vehikelstudien wurden mit 1.191 Probanden durchgeführt, um die regelmäßige Anwendung von FLONASE Nasenspray 50 µg bei Probanden mit ganzjähriger nichtallergischer Rhinitis zu untersuchen. Diese Studien bewerteten die von den Probanden bewerteten totalen nasalen Symptomwerte (TNSS), die nasale Obstruktion, postnasales Tropfen, Rhinorrhoe bei Probanden einschlossen, die 28 Tage lang doppelblind behandelt wurden, und in 1 der 3 Studien eine 6-monatige Open-Label-Behandlung. Zwei dieser Studien zeigten, dass mit Flonase-Nasenspray (zweimal täglich 100 µg) behandelte Personen eine statistisch signifikante Verringerung des TNSS im Vergleich zu mit Vehikel behandelten Personen aufwiesen.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C. Es gibt keine ausreichenden und gut kontrollierten Studien mit FLONASE Nasenspray bei Schwangeren. Kortikosteroide haben sich bei Labortieren als teratogen erwiesen, wenn sie systemisch in relativ niedrigen Dosierungen verabreicht wurden. Da Reproduktionsstudien an Tieren die menschliche Reaktion nicht immer vorhersagen, sollte FLONASE Nasenspray während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Frauen sollte geraten werden, sich an ihren Arzt zu wenden, wenn sie während der Einnahme von FLONASE Nasenspray schwanger werden.
Mäuse und Ratten bei Fluticasonpropionat-Dosen, die ungefähr dem 1- bzw. 4-Fachen der maximal empfohlenen intranasalen Tagesdosis beim Menschen (MRHDID) für Erwachsene entsprechen (auf mg/m²-Basis bei maternalen subkutanen Dosen von 45 bzw. 100 mcg/kg/Tag) zeigte fötale Toxizität, die für starke Kortikosteroidverbindungen charakteristisch ist, einschließlich embryonaler Wachstumsverzögerung, Omphalozele, Gaumenspalte und verzögerter Schädelknochenbildung. Bei Ratten wurde bei Dosen bis zum Dreifachen der MRHDID (auf mg/m²-Basis bei maternalen Inhalationsdosen von bis zu 68,7 mcg/kg/Tag) keine Teratogenität beobachtet.
Bei Kaninchen wurden bei einer Fluticasonpropionat-Dosis, die ungefähr dem 0,3-Fachen der MRHDID für Erwachsene entsprach, eine fötale Gewichtsreduktion und eine Gaumenspalte beobachtet (auf mg/m²-Basis bei einer maternalen subkutanen Dosis von 4 µg/kg/Tag). Es wurden jedoch keine teratogenen Wirkungen bei Fluticasonpropionat-Dosen bis zum etwa 20-fachen der MRHDID für Erwachsene (auf mg/m²-Basis bei einer mütterlichen oralen Dosis von bis zu 300 mcg/kg/Tag) berichtet. In dieser Studie wurde kein Fluticasonpropionat im Plasma nachgewiesen, was mit der festgestellten niedrigen Bioverfügbarkeit nach oraler Verabreichung übereinstimmt [siehe KLINISCHE PHARMAKOLOGIE ].
Fluticasonpropionat passierte die Plazentaschranke nach subkutaner Verabreichung an Mäuse und Ratten und oraler Verabreichung an Kaninchen.
Die Erfahrungen mit oralen Kortikosteroiden seit ihrer Einführung in pharmakologische, im Gegensatz zu physiologischen, Dosierungen deuten darauf hin, dass Nagetiere anfälliger für teratogene Wirkungen von Kortikosteroiden sind als Menschen. Da die Kortikosteroidproduktion während der Schwangerschaft natürlich ansteigt, benötigen die meisten Frauen außerdem eine niedrigere exogene Kortikosteroiddosis, und viele benötigen während der Schwangerschaft keine Kortikosteroidbehandlung.
Nicht teratogene Wirkungen
Hypoadrenalismus kann bei Säuglingen auftreten, deren Mütter während der Schwangerschaft Kortikosteroide erhalten haben. Solche Säuglinge sollten sorgfältig überwacht werden.
Stillende Mutter
Es ist nicht bekannt, ob Fluticasonpropionat in die Muttermilch übergeht. In der Muttermilch wurden jedoch andere Kortikosteroide nachgewiesen. Die subkutane Verabreichung von tritiiertem Fluticasonpropionat an laktierende Ratten in einer Dosis, die etwa dem 0,4-Fachen der MRHDID für Erwachsene auf mg/m²-Basis entsprach, führte zu einer messbaren Radioaktivität in der Milch.
Da keine Daten aus kontrollierten Studien zur intranasalen Anwendung von FLONASE Nasenspray 50 µg durch stillende Mütter vorliegen, ist Vorsicht geboten, wenn FLONASE Nasenspray 50 µg einer stillenden Frau verabreicht wird.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von FLONASE Nasenspray bei Kindern ab 4 Jahren wurde nachgewiesen [siehe NEBENWIRKUNGEN , KLINISCHE PHARMAKOLOGIE ].Sechshundertfünfzig (650) Probanden im Alter von 4 bis 11 Jahren und 440 Probanden im Alter von 12 bis 17 Jahren wurden in klinischen Studien in den USA mit Fluticasonpropionat-Nasenspray untersucht. Die Sicherheit und Wirksamkeit von FLONASE Nasenspray 50 µg bei Kindern unter 4 Jahren ist nicht erwiesen.
Auswirkungen auf das Wachstum
Kontrollierte klinische Studien haben gezeigt, dass intranasale Kortikosteroide eine Verringerung der Wachstumsgeschwindigkeit verursachen können, wenn sie an pädiatrische Patienten verabreicht werden. Dieser Effekt wurde in Abwesenheit von Labornachweisen für eine Unterdrückung der Hypothalamus-Hypophysen-Nebennierenrindenachse (HPA) beobachtet, was darauf hindeutet, dass die Wachstumsgeschwindigkeit ein empfindlicherer Indikator für die systemische Kortikosteroid-Exposition bei pädiatrischen Patienten ist als einige häufig verwendete Tests der HPA-Achsenfunktion. Die langfristigen Auswirkungen dieser Verringerung der Wachstumsgeschwindigkeit im Zusammenhang mit intranasalen Kortikosteroiden, einschließlich der Auswirkungen auf die Endgröße des Erwachsenen, sind nicht bekannt. Das Potenzial für ein „aufholendes“ Wachstum nach Absetzen der Behandlung mit intranasalen Kortikosteroiden wurde nicht ausreichend untersucht. Das Wachstum von pädiatrischen Patienten, die intranasale Kortikosteroide, einschließlich FLONASE Nasenspray, erhalten, sollte routinemäßig überwacht werden (z. B. mittels Stadiometrie). Die potenziellen Wachstumseffekte einer längeren Behandlung sollten gegen den erzielten klinischen Nutzen und die mit alternativen Therapien verbundenen Risiken abgewogen werden. Um die systemischen Wirkungen von intranasalen Kortikosteroiden, einschließlich FLONASE Nasenspray, zu minimieren, sollte die Dosis jedes Patienten auf die niedrigste Dosis titriert werden, die seine/ihre Symptome wirksam kontrolliert.
Eine 1-jährige placebokontrollierte Studie wurde an 150 pädiatrischen Probanden (im Alter von 3 bis 9 Jahren) durchgeführt, um die Wirkung von FLONASE Nasenspray (tägliche Einzeldosis von 200 mcg) auf die Wachstumsgeschwindigkeit zu beurteilen. Bei der Primärpopulation, die FLONASE Nasenspray (n = 56) und Placebo (n = 52) erhielt, war die Punktschätzung für die Wachstumsgeschwindigkeit mit FLONASE Nasenspray 50 µg 0,14 cm/Jahr niedriger als bei Placebo (95 % KI: -0,54, 0,27 cm). /Jahr). Daher wurde im Vergleich zu Placebo keine statistisch signifikante Wirkung auf das Wachstum festgestellt. Es wurden keine Hinweise auf klinisch relevante Veränderungen der HPA-Achsenfunktion oder der Knochenmineraldichte beobachtet, wie anhand der 12-Stunden-Cortisolausscheidung im Urin bzw. der Dual-Energy-Röntgen-Absorptiometrie beurteilt.
Es kann nicht ausgeschlossen werden, dass FLONASE Nasenspray 50 µg bei empfindlichen Patienten oder bei Verabreichung in höheren als den empfohlenen Dosierungen eine Wachstumsunterdrückung verursacht.
Geriatrische Verwendung
Eine begrenzte Anzahl von Probanden im Alter von 65 Jahren und älter (n = 129) oder 75 Jahren und älter (n = 11) wurde in klinischen Studien mit FLONASE Nasenspray behandelt. Obwohl die Anzahl der Probanden zu klein ist, um eine getrennte Analyse der Wirksamkeit und Sicherheit zu ermöglichen, waren die Nebenwirkungen, die in dieser Population berichtet wurden, denen ähnlich, die von jüngeren Patienten berichtet wurden. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
Leberfunktionsstörung
Formale pharmakokinetische Studien mit FLONASE Nasenspray 50 µg wurden bei Patienten mit eingeschränkter Leberfunktion nicht durchgeführt. Da Fluticasonpropionat überwiegend durch den hepatischen Metabolismus ausgeschieden wird, kann eine Beeinträchtigung der Leberfunktion zu einer Akkumulation von Fluticasonpropionat im Plasma führen. Daher sollten Patienten mit Lebererkrankungen engmaschig überwacht werden.

Nierenfunktionsstörung
Formale pharmakokinetische Studien mit FLONASE Nasenspray wurden bei Patienten mit eingeschränkter Nierenfunktion nicht durchgeführt.
ÜBERDOSIS
Eine chronische Überdosierung kann zu Anzeichen/Symptomen von Hyperkortizismus führen (siehe VORSICHTSMASSNAHMEN ). Die intranasale Verabreichung von 2 mg (das 10-fache der empfohlenen Dosis) Fluticasonpropionat zweimal täglich über 7 Tage an gesunde Probanden wurde gut vertragen. Orale Einzeldosen von bis zu 16 mg wurden an Freiwilligen untersucht, ohne dass akute toxische Wirkungen berichtet wurden. Wiederholte orale Dosen von bis zu 80 mg täglich für 10 Tage bei Freiwilligen und wiederholte orale Dosen von bis zu 10 mg täglich für 14 Tage bei Patienten wurden gut vertragen. Die Nebenwirkungen waren von leichter oder mittlerer Schwere und die Inzidenz war in der aktiven und der Placebo-Behandlungsgruppe ähnlich. Eine akute Überdosierung mit dieser Darreichungsform ist unwahrscheinlich, da 1 Flasche FLONASE (Fluticasonpropionat) Nasenspray ungefähr 8 mg Fluticasonpropionat enthält.
Die oralen und subkutanen mittleren tödlichen Dosen bei Mäusen und Ratten betrugen > 1.000 mg/kg (> 20.000- bzw. > 41.000-fach die maximal empfohlene tägliche intranasale Dosis bei Erwachsenen und > 10.000- bzw. > 20.000-fach die maximal empfohlene tägliche intranasale Dosis). Dosis bei Kindern auf mg/m2-Basis).
KONTRAINDIKATIONEN
FLONASE (Fluticasonpropionat) Nasenspray ist kontraindiziert bei Patienten mit Überempfindlichkeit gegen einen der Inhaltsstoffe.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Fluticasonpropionat ist ein synthetisches trifluoriertes Kortikosteroid mit entzündungshemmender Wirkung. In vitro wurde gezeigt, dass Fluticasonpropionat eine Bindungsaffinität für den menschlichen Glukokortikoidrezeptor aufweist, die 18-mal höher ist als die von Dexamethason, fast doppelt so hoch wie die von Beclomethason-17-monopropionat (BMP), dem aktiven Metaboliten von Beclomethasondipropionat, und mehr als dreimal so hoch von Budesonid. Daten aus dem McKenzie-Vasokonstriktor-Assay beim Menschen stimmen mit diesen Ergebnissen überein. Die klinische Bedeutung dieser Befunde ist nicht bekannt.
Der genaue Mechanismus, durch den Fluticasonpropionat die Rhinitis-Symptome beeinflusst, ist nicht bekannt. Es wurde gezeigt, dass Kortikosteroide ein breites Wirkungsspektrum auf mehrere Zelltypen (z. B. Mastzellen, Eosinophile, Neutrophile, Makrophagen, Lymphozyten) und Mediatoren (z. B. Histamin, Eicosanoide, Leukotriene, Zytokine) haben, die an Entzündungen beteiligt sind. In 7 Studien mit Erwachsenen hat FLONASE Nasenspray die Eosinophilen der Nasenschleimhaut bei 66 % der Patienten (35 % bei Placebo) und die Basophilen bei 39 % der Patienten (28 % bei Placebo) verringert. Die direkte Beziehung dieser Ergebnisse zur langfristigen Symptomlinderung ist nicht bekannt.
Pharmakodynamik
HPA-Achseneffekt
Die potenziellen systemischen Wirkungen von FLONASE Nasenspray 50 µg auf die HPA-Achse wurden bewertet. FLONASE Nasenspray 50 µg, gegeben als 200 µg einmal täglich oder 400 µg zweimal täglich, wurde mit Placebo oder oralem Prednison 7,5 oder 15 mg morgens verglichen. FLONASE Nasenspray hatte in beiden Dosierungen über 4 Wochen keinen Einfluss auf die Reaktion der Nebennierenrinde auf eine 6-stündige Cosyntropin-Stimulation, während beide Dosierungen von oralem Prednison die Reaktion auf Cosyntropin signifikant reduzierten.
Herzelektrophysiologie
Es wurde keine Studie durchgeführt, die speziell darauf ausgelegt ist, die Wirkung von FLONASE auf das QT-Intervall zu bewerten.
Pharmakokinetik
Die Aktivität von FLONASE Nasenspray 50 µg beruht auf der Muttersubstanz Fluticasonpropionat. Aufgrund der geringen Bioverfügbarkeit bei intranasaler Gabe wurden die meisten pharmakokinetischen Daten über andere Verabreichungswege gewonnen.
Absorption
Indirekte Berechnungen zeigen, dass Fluticasonpropionat, das intranasal verabreicht wird, eine absolute Bioverfügbarkeit von durchschnittlich weniger als 2 % hat. Studien mit oraler Gabe von gekennzeichnetem und nicht gekennzeichnetem Arzneimittel haben gezeigt, dass die orale systemische Bioverfügbarkeit von Fluticasonpropionat vernachlässigbar ist (
Verteilung
Nach der intravenösen Verabreichung war die anfängliche Dispositionsphase für Fluticasonpropionat schnell und konsistent mit seiner hohen Lipidlöslichkeit und Gewebebindung. Das Verteilungsvolumen betrug durchschnittlich 4,2 l/kg.
Der Prozentsatz von Fluticasonpropionat, der an menschliche Plasmaproteine gebunden ist, betrug durchschnittlich 99 %. Fluticasonpropionat wird schwach und reversibel an Erythrozyten und nicht signifikant an menschliches Transcortin gebunden.
Beseitigung
Nach intravenöser Gabe zeigte Fluticasonpropionat eine polyexponentielle Kinetik und hatte eine terminale Eliminationshalbwertszeit von etwa 7,8 Stunden. Die Gesamtblutclearance von Fluticasonpropionat ist hoch (Durchschnitt: 1.093 ml/min), wobei die renale Clearance weniger als 0,02 % der Gesamtclearance ausmacht.
Stoffwechsel: Der einzige beim Menschen nachgewiesene zirkulierende Metabolit ist das 17β-Carbonsäurederivat von Fluticasonpropionat, das über den CYP3A4-Weg gebildet wird. Dieser Metabolit hatte in vitro eine geringere Affinität (ca. 1/2.000) für den Glukokortikoidrezeptor des menschlichen Lungenzytosols und eine vernachlässigbare pharmakologische Aktivität in Tierversuchen als das Ausgangsarzneimittel. Andere Metaboliten, die in vitro unter Verwendung von kultivierten menschlichen Hepatomzellen nachgewiesen wurden, wurden beim Menschen nicht nachgewiesen.
Ausscheidung: Weniger als 5 % einer radioaktiv markierten oralen Dosis wurden als Metaboliten im Urin ausgeschieden, der Rest als Muttersubstanz und Metaboliten im Stuhl.
Besondere Populationen
Fluticasonpropionat-Nasenspray wurde an keiner speziellen Population untersucht, und es wurden keine geschlechtsspezifischen pharmakokinetischen Daten erhoben.
Wechselwirkungen mit anderen Medikamenten
Inhibitoren von Cytochrom P450 3A4: Ritonavir: Fluticasonpropionat ist ein Substrat von CYP3A4. Die gleichzeitige Verabreichung von Fluticasonpropionat und dem starken CYP3A4-Hemmer Ritonavir wird nicht empfohlen, basierend auf einer Crossover-Interaktionsstudie mit Mehrfachdosis an 18 gesunden Probanden. Fluticasonpropionat wässriges Nasenspray (200 µg einmal täglich) wurde zusammen mit Ritonavir (100 mg zweimal täglich) über 7 Tage verabreicht. Plasmakonzentrationen von Fluticasonpropionat nach Anwendung von wässrigem Fluticasonpropionat-Nasenspray allein waren bei den meisten Probanden nicht nachweisbar (
Ketoconazol: Die gleichzeitige Verabreichung von oral inhaliertem Fluticasonpropionat (1.000 Mikrogramm) und Ketoconazol (200 mg einmal täglich) führte zu einer 1,9-fachen Erhöhung der Fluticasonpropionat-Exposition im Plasma und einer 45 %-igen Abnahme der Cortisol-AUC im Plasma, hatte aber keine Auswirkung auf die Ausscheidung von Cortisol im Urin.
Erythromycin: In einer Arzneimittelinteraktionsstudie mit Mehrfachdosis hatte die gleichzeitige Verabreichung von oral inhaliertem Fluticasonpropionat (500 µg zweimal täglich) und Erythromycin (333 mg dreimal täglich) keinen Einfluss auf die Pharmakokinetik von Fluticasonpropionat.
INFORMATIONEN ZUM PATIENTEN
FLONASE® [flow'naz] (Fluticasonpropionat) Nasenspray, 50 mcg
Lesen Sie die dem FLONASE-Nasenspray beiliegende Patienteninformation, bevor Sie mit der Anwendung beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Patienteninformation ersetzt nicht das Gespräch mit Ihrem Gesundheitsdienstleister über Ihren Gesundheitszustand oder Ihre Behandlung.
Was ist FLONASE Nasenspray?
FLONASE Nasenspray 50 mcg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung nicht allergischer Nasensymptome wie laufende Nase, verstopfte Nase, Niesen und Nasenjucken bei Erwachsenen und Kindern ab 4 Jahren.
Es ist nicht bekannt, ob FLONASE Nasenspray 50 µg bei Kindern unter 4 Jahren sicher und wirksam ist.
Wer sollte FLONASE Nasenspray 50 mcg nicht anwenden?
Verwenden Sie FLONASE Nasenspray 50 mcg nicht, wenn Sie allergisch gegen Fluticasonpropionat oder einen der Bestandteile von FLONASE Nasenspray sind. Siehe „Welche Inhaltsstoffe enthält FLONASE Nasenspray 50 mcg?“ unten für eine vollständige Liste der Zutaten.
Was sollte ich meinem Arzt vor der Anwendung von FLONASE Nasenspray 50 mcg mitteilen?
Informieren Sie Ihren Arzt über alle Ihre Gesundheitsprobleme, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und Kräuterergänzungen. FLONASE Nasenspray und bestimmte andere Arzneimittel können miteinander interagieren. Dies kann schwerwiegende Nebenwirkungen verursachen. Informieren Sie Ihren Arzt insbesondere, wenn Sie Antimykotika oder Anti-HIV-Medikamente einnehmen.
Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Wie soll ich FLONASE Nasenspray anwenden?
Lesen Sie die Schritt-für-Schritt-Anleitung zur Anwendung von FLONASE Nasenspray am Ende dieser Patienteninformation.
Welche Nebenwirkungen kann FLONASE Nasenspray 50 mcg haben?
FLONASE Nasenspray 50 mcg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von FLONASE Nasenspray 50 mcg gehören:
Informieren Sie Ihren Arzt über jede Nebenwirkung, die Sie stört oder die nicht abklingt.
Dies sind nicht alle Nebenwirkungen von FLONASE Nasenspray. Fragen Sie Ihren Arzt oder Apotheker nach weiteren Informationen.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist FLONASE Nasenspray 50 mcg aufzubewahren?
Bewahren Sie FLONASE Nasenspray 50 mcg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von FLONASE Nasenspray.
Arzneimittel werden manchmal für Zwecke verschrieben, die nicht in einer Packungsbeilage angegeben sind. Verwenden Sie FLONASE Nasenspray nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie Ihr FLONASE-Nasenspray nicht an andere Personen weiter, selbst wenn sie unter der gleichen Erkrankung leiden wie Sie. Es kann ihnen schaden.
Diese Packungsbeilage fasst die wichtigsten Informationen über FLONASE Nasenspray zusammen. Wenn Sie weitere Informationen wünschen, wenden Sie sich an Ihren Arzt. Sie können Ihren Apotheker oder medizinischen Betreuer um Informationen über FLONASE Nasenspray bitten, die für medizinisches Fachpersonal geschrieben wurden.
Rufen Sie für weitere Informationen über FLONASE Nasenspray 1-888-825-5249 an.
Was sind die Inhaltsstoffe von FLONASE Nasenspray 50 mcg?
Wirkstoff: Fluticasonpropionat.
Inaktive Inhaltsstoffe: mikrokristalline Cellulose, Carboxymethylcellulose-Natrium, Dextrose, 0,02 % w/w Benzalkoniumchlorid, Polysorbat 80 und 0,25 % w/w Phenylethylalkohol.
Gebrauchsanweisung
FLONASE® [flow'naz] (Fluticasonpropionat) Nasenspray, 50 mcg
FLONASE Nasenspray 50 mcg ist nur zur Anwendung in der Nase bestimmt.
Lesen Sie diese Informationen, bevor Sie mit der Anwendung Ihres FLONASE-Nasensprays beginnen.
Teile Ihres FLONASE Nasensprays (Siehe Abbildung A)
Abbildung A 
Ihr FLONASE Nasenspray 50 mcg muss vor der ersten Anwendung und wenn Sie es eine Woche oder länger nicht verwendet haben, vorbereitet werden.
So bereiten Sie Ihr FLONASE Nasenspray vor
Abbildung B 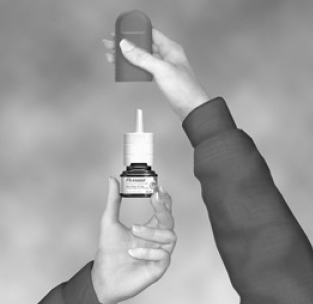
Abbildung C 
Anwendung Ihres FLONASE Nasensprays:
Schritt 1 . Schnäuzen Sie sich die Nase, um Ihre Nasenlöcher zu reinigen.
Schritt 2 . Schließe 1 Nasenloch. Neigen Sie Ihren Kopf leicht nach vorne, halten Sie die Flasche aufrecht und führen Sie den Nasenapplikator vorsichtig in das andere Nasenloch ein (siehe Abbildung D).
Abbildung D 
Schritt 3 Beginnen Sie, durch die Nase einzuatmen, und drücken Sie während des Einatmens 1 Mal fest und schnell auf den Applikator, um das Spray freizusetzen. Um eine volle Dosis zu erhalten, verwenden Sie Ihren Zeige- und Mittelfinger zum Sprühen, während Sie den Boden der Flasche mit Ihrem Daumen stützen. Vermeiden Sie es, in Ihre Augen zu sprühen. Atmen Sie sanft durch das Nasenloch ein (siehe Abbildung E).
Abbildung E 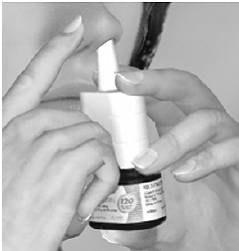
Schritt 4 . Atme durch deinen Mund aus.
Schritt 5 . Wenn ein zweiter Sprühstoß in diesem Nasenloch erforderlich ist, wiederholen Sie die Schritte 2 bis 4.
Schritt 6 . Wiederholen Sie die Schritte 2 bis 5 im anderen Nasenloch.
Schritt 7 . Wischen Sie den Nasenapplikator mit einem sauberen Tuch ab und bringen Sie die Staubschutzhülle wieder an (siehe Abbildung F).
Abbildung F 
Verwenden Sie diese Flasche nicht für mehr als die auf dem Etikett angegebene Anzahl von Sprühstößen, auch wenn die Flasche nicht vollständig leer ist. Bevor Sie die Flasche wegwerfen, sollten Sie mit Ihrem Arzt sprechen, um zu sehen, ob eine Nachfüllung erforderlich ist. Nehmen Sie keine zusätzlichen Dosen ein und beenden Sie die Einnahme von FLONASE Nasenspray 50 mcg nicht, ohne vorher mit Ihrem Arzt gesprochen zu haben.
Reinigung Ihres FLONASE Nasensprays:
Ihr Nasenspray sollte mindestens 1 Mal pro Woche gereinigt werden.
1. Entfernen Sie die Staubschutzhülle und ziehen Sie sie dann vorsichtig nach oben, um den Nasenapplikator zu lösen.
2. Waschen Sie den Applikator und die Staubschutzhülle unter warmem Leitungswasser. Bei Raumtemperatur trocknen lassen.
3. Setzen Sie den Applikator und die Staubschutzhülle wieder auf die Flasche.
4. Wenn der Nasenapplikator verstopft ist, kann er entfernt und in warmem Wasser eingeweicht werden. Spülen Sie den Nasenapplikator mit kaltem Leitungswasser. Trocknen Sie den Nasenapplikator und setzen Sie ihn wieder auf die Flasche. Versuchen Sie nicht, den Nasenapplikator zu entsperren, indem Sie eine Nadel oder einen anderen scharfen Gegenstand einführen.
Aufbewahrung Ihres FLONASE Nasensprays: