Diabetes-Behandlung: Glucophage 500mg, 850mg, 1000mg Metformin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Glucophage und wie wird es angewendet?
Glucophage ist ein verschreibungspflichtiges Arzneimittel zur Behandlung zur Verbesserung der Blutzuckerkontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus. Glucophage kann allein oder mit anderen Medikamenten verwendet werden.
Glucophage 850 mg gehört zu einer Klasse von Arzneimitteln, die als Antidiabetika bezeichnet werden.
Es ist nicht bekannt, ob Glucophage bei Kindern unter 10 Jahren sicher und wirksam ist.
Welche Nebenwirkungen kann Glucophage haben?
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Glucophage sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Glucophage. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
LAKTATAZIDOSE
Postmarketing-Fälle von Metformin-assoziierter Laktatazidose führten zu Tod, Hypothermie, Hypotonie und resistenten Bradyarrhythmien. Der Beginn einer mit Metform assoziierten Laktatazidose ist oft subtil und wird nur von unspezifischen Symptomen wie Unwohlsein, Myalgien, Atemnot, Somnolenz und Bauchschmerzen begleitet. Metforminassoziierte Laktatazidose war gekennzeichnet durch erhöhte Laktatspiegel im Blut (> 5 mmol/Liter), Anionenlückenazidose (ohne Anzeichen von Ketonurie oder Ketonämie), ein erhöhtes Laktat/Pyruvat-Verhältnis; und Metformin-Plasmaspiegel im Allgemeinen > 5 mcg/ml [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Zu den Risikofaktoren für Metformin-assoziierte Laktatazidose gehören Nierenfunktionsstörung, gleichzeitige Anwendung bestimmter Medikamente (z. B. Carboanhydrasehemmer wie Topiramat), Alter ab 65 Jahren, Durchführung einer radiologischen Untersuchung mit Kontrastmittel, Operation und andere Eingriffe, hypoxische Zustände (z , akute kongestive Herzinsuffizienz), übermäßiger Alkoholkonsum und Leberfunktionsstörung.
Schritte zur Verringerung des Risikos einer Metformin-assoziierten Laktatazidose und zur Behandlung dieser Hochrisikogruppen werden bereitgestellt [siehe DOSIERUNG UND ANWENDUNG, GEGENANZEIGEN, WARNHINWEISE UND VORSICHTSMASSNAHMEN].
Bei Verdacht auf Metformin-assoziierte Laktatazidose ist GLUCOPHAGE oder GLUCOPHAGE XR sofort abzusetzen und allgemeine unterstützende Maßnahmen im Krankenhaus einzuleiten. Eine unverzügliche Hämodialyse wird empfohlen [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
GLUCOPHAGE/GLUCOPHAGE 500 mg XR enthalten den antihyperglykämischen Wirkstoff Metformin, ein Biguanid, in Form von Monohydrochlorid. Der chemische Name von Metforminhydrochlorid ist N,N-Dimethylimidodicarbonimiddiamid-Hydrochlorid. Die Strukturformel ist wie folgt:
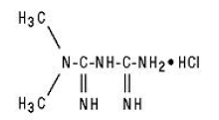
Metforminhydrochlorid ist eine weiße bis cremefarbene kristalline Verbindung mit der Summenformel C4H11N5 • HCl und einem Molekulargewicht von 165,63. Es ist frei löslich in Wasser und praktisch unlöslich in Aceton, Ether und Chloroform. Der pKa-Wert von Metformin beträgt 12,4. Der pH-Wert einer 1%igen wässrigen Lösung von Metforminhydrochlorid beträgt 6,68.
GLUCOPHAGE-Tabletten enthalten 500 mg, 850 mg oder 1000 mg Metforminhydrochlorid, was 389,93 mg, 662,88 mg bzw. 779,86 mg Metforminbase entspricht. Jede Tablette enthält die Hilfsstoffe Povidon und Magnesiumstearat. Darüber hinaus enthält der Überzug der 500-mg- und 850-mg-Tabletten Hypromellose und der Überzug der 1000-mg-Tablette Hypromellose und Polyethylenglykol.
GLUCOPHAGE 500 mg XR enthält 500 mg oder 750 mg Metforminhydrochlorid, was 389,93 mg bzw. 584,90 mg Metforminbase entspricht.
GLUCOPHAGE XR 500 mg Tabletten enthalten die Hilfsstoffe Hypromellose, mikrokristalline Cellulose, Natriumcarboxymethylcellulose und Magnesiumstearat.
GLUCOPHAGE 850 mg XR 750 mg Tabletten enthalten die Hilfsstoffe Hypromellose, Natriumcarboxymethylcellulose, Magnesiumstearat und rotes Eisenoxidpigment.
INDIKATIONEN
GLUCOPHAGE 850 mg ist als Ergänzung zu Diät und Bewegung indiziert, um die glykämische Kontrolle bei Erwachsenen und pädiatrischen Patienten ab 10 Jahren mit Typ-2-Diabetes mellitus zu verbessern.
GLUCOPHAGE XR ist als Ergänzung zu Diät und Bewegung indiziert, um die glykämische Kontrolle bei Erwachsenen mit Typ-2-Diabetes mellitus zu verbessern.
DOSIERUNG UND ANWENDUNG
Dosierung für Erwachsene
Glucophage
Glucophage XR
Pädiatrische Dosierung für Glucophage
Empfehlungen zur Anwendung bei eingeschränkter Nierenfunktion
Einstellung für jodhaltige Kontrastmittelverfahren
Absetzen von GLUCOPHAGE/GLUCOPHAGE XR zum Zeitpunkt oder vor einem jodhaltigen Kontrastmittelverfahren bei Patienten mit einer eGFR zwischen 30 und 60 ml/min/1,73 m2; bei Patienten mit Lebererkrankungen, Alkoholismus oder Herzinsuffizienz in der Vorgeschichte; oder bei Patienten, denen ein intraarterielles jodhaltiges Kontrastmittel verabreicht wird. Bewerten Sie die eGFR 48 Stunden nach dem bildgebenden Verfahren erneut; Starten Sie GLUCOPHAGE/GLUCOPHAGE XR erneut, wenn die Nierenfunktion stabil ist.
WIE GELIEFERT
Darreichungsformen und Stärken
GLUCOPHAGE 850 mg ist erhältlich als:
GLUCOPHAGE XR ist erhältlich als:
Lagerung und Handhabung
Lagerung
Bei 20°–25°C (68°–77°F) lagern; Ausflüge erlaubt bis 15°–30°C (59°–86°F). [Siehe USP Kontrollierte Raumtemperatur.]
In lichtbeständige Behälter füllen.
Vertrieb durch: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Überarbeitet: Mai 2018.
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen werden auch an anderer Stelle in der Kennzeichnung besprochen:
Klinische Studienerfahrung
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Glucophage
In einer klinischen Studie in den USA mit GLUCOPHAGE 850 mg bei Patienten mit Typ-2-Diabetes mellitus erhielten insgesamt 141 Patienten GLUCOPHAGE 1000 mg bis zu 2550 mg pro Tag. Die Nebenwirkungen, die bei mehr als 5 % der mit GLUCOPHAGE 500 mg behandelten Patienten berichtet wurden und die häufiger auftraten als bei den mit Placebo behandelten Patienten, sind in Tabelle 1 aufgeführt.
Durchfall führte bei 6 % der Patienten zum Absetzen von GLUCOPHAGE 500 mg. Zusätzlich wurden die folgenden Nebenwirkungen bei ≥ 1 % bis ≤ 5 % der mit GLUCOPHAGE behandelten Patienten berichtet und wurden häufiger unter GLUCOPHAGE als unter Placebo berichtet: anormaler Stuhlgang, Hypoglykämie, Myalgie, Benommenheit, Dyspnoe, Nagelveränderungen, Hautausschlag, vermehrtes Schwitzen, Geschmack Brustbeschwerden, Schüttelfrost, Grippesyndrom, Hitzewallungen, Herzklopfen.
In 29-wöchigen klinischen Studien mit GLUCOPHAGE 500 mg wurde bei etwa 7 % der Patienten eine Abnahme der zuvor normalen Vitamin-B12-Serumspiegel auf subnormale Werte beobachtet.
Pädiatrische Patienten
In klinischen Studien mit GLUCOPHAGE bei pädiatrischen Patienten mit Diabetes mellitus Typ 2 war das Nebenwirkungsprofil ähnlich wie bei Erwachsenen.
Glucopage XR
In placebokontrollierten Studien wurde 781 Patienten GLUCOPHAGE 1000 mg XR verabreicht. Die Nebenwirkungen, die bei mehr als 5 % der mit GLUCOPHAGE 850 mg XR behandelten Patienten berichtet wurden und die bei mit GLUCOPHAGE XR behandelten Patienten häufiger auftraten als bei den mit Placebo behandelten Patienten, sind in Tabelle 2 aufgeführt.
Durchfall führte bei 0,6 % der Patienten zum Absetzen von GLUCOPHAGE XR. Darüber hinaus wurden die folgenden Nebenwirkungen bei ≥ 1,0 % bis ≤ 5,0 % der GLUCOPHAGE XR-Patienten berichtet und wurden häufiger unter GLUCOPHAGE XR als unter Placebo berichtet: Bauchschmerzen, Verstopfung, aufgeblähter Bauch, Dyspepsie/Sodbrennen, Blähungen, Schwindel, Kopfschmerzen, oberer Bereich Atemwegsinfektion, Geschmacksstörung.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von Metformin nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Cholestatische, hepatozelluläre und gemischte hepatozelluläre Leberschäden wurden bei Anwendung von Metformin nach Markteinführung berichtet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Tabelle 3 zeigt klinisch signifikante Arzneimittelwechselwirkungen mit GLUCOPHAGE/GLUCOPHAGE XR.
WARNUNGEN
Eingeschlossen als Teil der "VORSICHTSMASSNAHMEN" Abschnitt
VORSICHTSMASSNAHMEN
Laktatazidose
Nach der Markteinführung gab es Fälle von Metformin-assoziierter Laktatazidose, einschließlich tödlicher Fälle. Diese Fälle hatten einen subtilen Beginn und wurden von unspezifischen Symptomen wie Unwohlsein, Myalgien, Bauchschmerzen, Atemnot oder erhöhter Somnolenz begleitet; Bei schwerer Azidose sind jedoch Hypotonie und resistente Bradyarrhythmien aufgetreten. Metforminassoziierte Laktatazidose war gekennzeichnet durch erhöhte Blutlaktatkonzentrationen (> 5 mmol/l), Anionenlückenazidose (ohne Anzeichen von Ketonurie oder Ketonämie) und ein erhöhtes Laktat:Pyruvat-Verhältnis; Metformin-Plasmaspiegel waren im Allgemeinen > 5 mcg/ml. Metformin verringert die Aufnahme von Laktat in die Leber und erhöht den Laktatspiegel im Blut, was das Risiko einer Laktatazidose erhöhen kann, insbesondere bei Risikopatienten.
Wenn eine Metformin-assoziierte Laktatazidose vermutet wird, sollten umgehend allgemeine unterstützende Maßnahmen in einem Krankenhaus eingeleitet werden, zusammen mit dem sofortigen Absetzen von GLUCOPHAGE/GLUCOPHAGE 500 mg XR. Bei mit GLUCOPHAGE/GLUCOPHAGE XR behandelten Patienten mit einer Diagnose oder starkem Verdacht auf Laktatazidose wird eine sofortige Hämodialyse empfohlen, um die Azidose zu korrigieren und angesammeltes Metformin zu entfernen (Metforminhydrochlorid ist mit einer Clearance von bis zu 170 ml/min unter guten hämodynamischen Bedingungen dialysierbar). Die Hämodialyse hat oft zu einer Umkehrung der Symptome und Genesung geführt.
Klären Sie die Patienten und ihre Familien über die Symptome einer Laktatazidose auf und weisen Sie sie an, GLUCOPHAGE/GLUCOPHAGE 1000 mg XR abzusetzen, wenn diese Symptome auftreten, und melden Sie diese Symptome ihrem medizinischen Betreuer.
Für jeden der bekannten und möglichen Risikofaktoren für eine Metformin-assoziierte Laktatazidose werden nachstehend Empfehlungen zur Verringerung des Risikos und zur Behandlung einer Metformin-assoziierten Laktatazidose gegeben:
Das Risiko einer Metformin-Akkumulation und einer Metformin-assoziierten Laktatazidose steigt mit dem Schweregrad der Nierenfunktionsstörung, da Metformin im Wesentlichen über die Nieren ausgeschieden wird. Zu den klinischen Empfehlungen, die auf der Nierenfunktion des Patienten basieren, gehören [siehe DOSIERUNG UND ANWENDUNG , KLINISCHE PHARMAKOLOGIE ]:
Vitamin B12-Mangel
In 29-wöchigen klinischen Studien mit GLUCOPHAGE 1000 mg wurde bei etwa 7 % der Patienten eine Abnahme der zuvor normalen Vitamin-B12-Serumspiegel auf subnormale Werte beobachtet. Eine solche Abnahme, möglicherweise aufgrund einer Störung der B12-Absorption aus dem B12-Intrinsic-Faktor-Komplex, kann mit Anämie einhergehen, scheint aber nach Absetzen von GLUCOPHAGE oder einer Vitamin-B12-Ergänzung schnell reversibel zu sein. Bestimmte Personen (Personen mit unzureichender Aufnahme oder Absorption von Vitamin B12 oder Kalzium) scheinen für die Entwicklung subnormaler Vitamin B12-Spiegel prädisponiert zu sein. Messen Sie hämatologische Parameter jährlich und Vitamin B12 in 2- bis 3-Jahres-Intervallen bei Patienten, die GLUCOPHAGE/GLUCOPHAGE 500 mg XR erhalten, und behandeln Sie alle Anomalien [siehe NEBENWIRKUNGEN ].
Hypoglykämie bei gleichzeitiger Anwendung mit Insulin und Insulin
Sekretagogen
Insulin und Insulinsekretagoga (z. B. Sulfonylharnstoff) sind dafür bekannt, Hypoglykämie zu verursachen. GLUCOPHAGE/GLUCOPHAGE XR kann das Risiko einer Hypoglykämie erhöhen, wenn es mit Insulin und/oder einem Insulinsekretagogikum kombiniert wird. Daher kann eine niedrigere Dosis von Insulin oder Insulinsekretagoga erforderlich sein, um das Risiko einer Hypoglykämie zu minimieren, wenn es in Kombination mit GLUCOPHAGE/GLUCOPHAGE XR angewendet wird [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Makrovaskuläre Ergebnisse
Es wurden keine klinischen Studien durchgeführt, die schlüssige Beweise für eine Verringerung des makrovaskulären Risikos mit GLUCOPHAGE/GLUCOPHAGE 850 mg XR erbrachten.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( INFORMATIONEN ZUM PATIENTEN ).
Laktatazidose
Erklären Sie die Risiken einer Laktatazidose, ihre Symptome und Bedingungen, die für ihre Entwicklung prädisponieren. Weisen Sie die Patienten an, GLUCOPHAGE/GLUCOPHAGE XR sofort abzusetzen und unverzüglich ihren Arzt zu benachrichtigen, wenn unerklärliche Hyperventilation, Myalgien, Unwohlsein, ungewöhnliche Schläfrigkeit oder andere unspezifische Symptome auftreten. Raten Sie die Patienten gegen übermäßigen Alkoholkonsum und informieren Sie die Patienten über die Bedeutung regelmäßiger Tests der Nierenfunktion während der Behandlung mit GLUCOPHAGE/GLUCOPHAGE XR. Weisen Sie die Patienten an, ihren Arzt vor jedem chirurgischen oder radiologischen Eingriff darüber zu informieren, dass sie GLUCOPHAGE/GLUCOPHAGE 500 mg XR einnehmen, da ein vorübergehendes Absetzen erforderlich sein kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hypoglykämie
Informieren Sie die Patienten darüber, dass eine Hypoglykämie auftreten kann, wenn GLUCOPHAGE/GLUCOPHAGE XR zusammen mit oralen Sulfonylharnstoffen und Insulin verabreicht wird. Erklären Sie Patienten, die eine Begleittherapie erhalten, die Risiken einer Hypoglykämie, ihre Symptome und Behandlung sowie die Bedingungen, die für ihre Entwicklung prädisponieren [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Vitamin B12-Mangel
Informieren Sie die Patienten über die Bedeutung regelmäßiger hämatologischer Parameter während der Behandlung mit GLUCOPHAGE/GLUCOPHAGE XR [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Frauen im fortpflanzungsfähigen Alter
Informieren Sie Frauen darüber, dass die Behandlung mit GLUCOPHAGE/GLUCOPHAGE XR bei manchen prämenopausalen anovulatorischen Frauen zu einem Eisprung führen kann, was zu einer ungewollten Schwangerschaft führen kann [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Informationen zur Verabreichung von Glucophage XR
Informieren Sie die Patienten darüber, dass GLUCOPHAGE 500 mg XR als Ganzes geschluckt und nicht zerkleinert, geschnitten oder gekaut werden muss und dass die inaktiven Bestandteile gelegentlich als weiche Masse, die der ursprünglichen Tablette ähneln kann, mit dem Stuhl ausgeschieden werden können.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Langzeitstudien zur Kanzerogenität wurden an Ratten (Dosierungsdauer 104 Wochen) und Mäusen (Dosierungsdauer 91 Wochen) mit Dosen bis einschließlich 900 mg/kg/Tag bzw. 1500 mg/kg/Tag durchgeführt. Diese Dosen sind beide ungefähr das Dreifache der maximal empfohlenen Tagesdosis von 2550 mg beim Menschen, basierend auf Vergleichen der Körperoberfläche. Weder bei männlichen noch bei weiblichen Mäusen wurden Hinweise auf Karzinogenität mit Metformin gefunden. Ebenso wurde mit Metformin bei männlichen Ratten kein tumorerzeugendes Potenzial beobachtet. Bei weiblichen Ratten, die mit 900 mg/kg/Tag behandelt wurden, traten jedoch vermehrt gutartige stromale Uteruspolypen auf.
In folgenden In-vitro-Tests ergaben sich keine Hinweise auf ein mutagenes Potenzial von Metformin: Ames-Test (S. typhimurium), Genmutationstest (Maus-Lymphomzellen) oder Chromosomenaberrationstest (humane Lymphozyten). Die Ergebnisse im In-vivo-Maus-Mikrokerntest waren ebenfalls negativ.
Die Fertilität männlicher oder weiblicher Ratten wurde durch Metformin nicht beeinflusst, wenn es in Dosen von bis zu 600 mg/kg/Tag verabreicht wurde, was ungefähr dem Zweifachen der maximal empfohlenen Tagesdosis von 2550 mg beim Menschen entspricht, basierend auf Vergleichen der Körperoberfläche.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Begrenzte Daten mit GLUCOPHAGE/GLUCOPHAGE XR bei Schwangeren reichen nicht aus, um ein arzneimittelbedingtes Risiko für schwere Geburtsfehler oder Fehlgeburten zu bestimmen. Veröffentlichte Studien zur Anwendung von Metformin während der Schwangerschaft haben keinen eindeutigen Zusammenhang zwischen Metformin und dem Risiko schwerer Geburtsfehler oder Fehlgeburten berichtet [siehe Daten ]. Es bestehen Risiken für Mutter und Fötus im Zusammenhang mit schlecht eingestelltem Diabetes mellitus in der Schwangerschaft [siehe Klinische Überlegungen ].
Es wurden keine nachteiligen Auswirkungen auf die Entwicklung beobachtet, wenn Metformin trächtigen Sprague-Dawley-Ratten und -Kaninchen während der Organogenese in Dosen bis zum 2- bzw. 5-Fachen einer klinischen Dosis von 2550 mg, bezogen auf die Körperoberfläche, verabreicht wurde [siehe Daten ].
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler beträgt 6–10 % bei Frauen mit prägestationsdiabetes mellitus und einem HbA1C >7 und liegt Berichten zufolge sogar bei 20–25% bei Frauen mit einem HbA1C >10. Das geschätzte Hintergrundrisiko einer Fehlgeburt für die angegebene Population ist unbekannt. In der US-Allgemeinbevölkerung beträgt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes maternales und/oder embryo/fetales Risiko
Ein schlecht eingestellter Diabetes mellitus in der Schwangerschaft erhöht das mütterliche Risiko für diabetische Ketoazidose, Präeklampsie, spontane Fehlgeburten, Frühgeburten, Totgeburten und Geburtskomplikationen. Ein schlecht eingestellter Diabetes mellitus erhöht das fötale Risiko für schwere Geburtsfehler, Totgeburten und Makrosomie-bedingte Morbidität.
Daten
Menschliche Daten
Veröffentlichte Daten aus Post-Marketing-Studien haben keinen klaren Zusammenhang mit Metformin und schwerwiegenden Geburtsfehlern, Fehlgeburten oder unerwünschten mütterlichen oder fötalen Folgen gemeldet, wenn Metformin während der Schwangerschaft angewendet wurde. Diese Studien können jedoch aufgrund methodischer Einschränkungen, einschließlich kleiner Stichprobengröße und inkonsistenter Vergleichsgruppen, nicht definitiv das Fehlen eines Metformin-assoziierten Risikos belegen.
Tierdaten
Metforminhydrochlorid hatte keinen nachteiligen Einfluss auf die Entwicklungsergebnisse, wenn es trächtigen Ratten und Kaninchen in Dosen von bis zu 600 mg/kg/Tag verabreicht wurde. Dies entspricht einer Exposition von etwa dem 2- bzw. 5-fachen einer klinischen Dosis von 2550 mg, basierend auf Vergleichen der Körperoberfläche von Ratten bzw. Kaninchen. Die Bestimmung der fötalen Konzentrationen zeigte eine partielle Plazentabarriere gegenüber Metformin.
Stillzeit
Zusammenfassung der Risiken
Begrenzte veröffentlichte Studien berichten, dass Metformin in der Muttermilch vorhanden ist [siehe Daten ]. Es liegen jedoch keine ausreichenden Informationen vor, um die Auswirkungen von Metformin auf den gestillten Säugling zu bestimmen, und es liegen keine Informationen zu den Auswirkungen von Metformin auf die Milchproduktion vor. Daher sollten die entwicklungsbezogenen und gesundheitlichen Vorteile des Stillens zusammen mit dem klinischen Bedarf der Mutter an GLUCOPHAGE/GLUCOPHAGE 500 mg XR und allen möglichen nachteiligen Auswirkungen auf das gestillte Kind durch GLUCOPHAGE/GLUCOPHAGE 850 mg XR oder durch den zugrunde liegenden Zustand der Mutter berücksichtigt werden.
Daten
Veröffentlichte klinische Laktationsstudien berichten, dass Metformin in der Muttermilch vorhanden ist, was zu Säuglingsdosen von etwa 0,11 % bis 1 % der gewichtsangepassten Dosis der Mutter und einem Milch/Plasma-Verhältnis zwischen 0,13 und 1 führte. Die Studien waren jedoch nicht darauf ausgelegt das Risiko der Anwendung von Metformin während der Stillzeit aufgrund der geringen Stichprobengröße und der begrenzten Daten zu unerwünschten Ereignissen, die bei Säuglingen gesammelt wurden, definitiv nachweisen.
Weibchen und Männchen mit reproduktivem Potenzial
Besprechen Sie die Möglichkeit einer ungewollten Schwangerschaft mit prämenopausalen Frauen, da die Therapie mit GLUCOPHAGE/GLUCOPHAGE XR bei manchen anovulatorischen Frauen zu einem Eisprung führen kann.
Pädiatrische Verwendung
Glucophage
Die Sicherheit und Wirksamkeit von GLUCOPHAGE zur Behandlung von Typ-2-Diabetes mellitus wurde bei pädiatrischen Patienten im Alter von 10 bis 16 Jahren nachgewiesen. Sicherheit und Wirksamkeit von GLUCOPHAGE wurden bei pädiatrischen Patienten unter 10 Jahren nicht nachgewiesen.
Die Anwendung von GLUCOPHAGE 850 mg bei pädiatrischen Patienten im Alter von 10 bis 16 Jahren zur Behandlung von Typ-2-Diabetes mellitus wird gestützt durch Nachweise aus angemessenen und gut kontrollierten Studien zu GLUCOPHAGE bei Erwachsenen mit zusätzlichen Daten aus einer kontrollierten klinischen Studie bei pädiatrischen Patienten im Alter von 10 bis 16 Jahren alt mit Typ-2-Diabetes mellitus, der eine ähnliche Reaktion bei der glykämischen Kontrolle wie bei Erwachsenen zeigte [siehe Klinische Studien ]. In dieser Studie waren die Nebenwirkungen ähnlich denen, die bei Erwachsenen beschrieben wurden. Eine maximale Tagesdosis von 2000 mg GLUCOPHAGE 1000 mg wird empfohlen. [Sehen DOSIERUNG UND ANWENDUNG .]
Glucophage 1000 mg XR
Sicherheit und Wirksamkeit von GLUCOPHAGE XR bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Kontrollierte klinische Studien mit GLUCOPHAGE/GLUCOPHAGE XR schlossen keine ausreichende Anzahl älterer Patienten ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie und des höheren Risikos widerzuspiegeln der Laktatazidose. Überprüfen Sie die Nierenfunktion häufiger bei älteren Patienten [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Nierenfunktionsstörung
Metformin wird im Wesentlichen über die Nieren ausgeschieden, und das Risiko einer Metformin-Akkumulation und einer Laktatazidose steigt mit dem Grad der Nierenfunktionsstörung. GLUCOPHAGE/GLUCOPHAGE 850 mg XR ist kontraindiziert bei schwerer Nierenfunktionsstörung, Patienten mit einer geschätzten glomerulären Filtrationsrate (eGFR) unter 30 ml/min/1,73 m2 [siehe DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN , und KLINISCHE PHARMAKOLOGIE ].
Leberfunktionsstörung
Die Anwendung von Metformin bei Patienten mit eingeschränkter Leberfunktion wurde mit einigen Fällen von Laktatazidose in Verbindung gebracht. GLUCOPHAGE/GLUCOPHAGE 500 mg XR wird bei Patienten mit eingeschränkter Leberfunktion nicht empfohlen. [sehen WARNUNGEN UND VORSICHTSMASSNAHMEN ].
ÜBERDOSIS
Eine Überdosierung von Metforminhydrochlorid ist aufgetreten, einschließlich der Einnahme von Mengen von mehr als 50 Gramm. Hypoglykämie wurde in etwa 10 % der Fälle berichtet, es wurde jedoch kein kausaler Zusammenhang mit Metformin festgestellt. Laktatazidose wurde in etwa 32 % der Fälle von Metformin-Überdosierung berichtet [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Metformin ist unter guten hämodynamischen Bedingungen mit einer Clearance von bis zu 170 ml/min dialysierbar. Daher kann eine Hämodialyse nützlich sein, um bei Patienten, bei denen eine Metformin-Überdosierung vermutet wird, angesammelte Medikamente zu entfernen.
KONTRAINDIKATIONEN
GLUCOPHAGE 1000 mg und GLUCOPHAGE 850 mg XR sind kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Metformin ist ein Antihyperglykämikum, das die Glukosetoleranz bei Patienten mit Typ-2-Diabetes mellitus verbessert, indem es sowohl die basale als auch die postprandiale Plasmaglukose senkt. Metformin verringert die hepatische Glukoseproduktion, verringert die intestinale Glukoseabsorption und verbessert die Insulinsensitivität, indem es die periphere Glukoseaufnahme und -verwertung erhöht. Unter Metformintherapie bleibt die Insulinsekretion unverändert, während die Nüchterninsulinspiegel und die ganztägige Plasmainsulinreaktion abnehmen können.
Pharmakokinetik
Absorption
Die absolute Bioverfügbarkeit einer GLUCOPHAGE 500-mg-Tablette, die unter nüchternen Bedingungen verabreicht wird, beträgt ungefähr 50 % bis 60 %. Studien mit oralen Einzeldosen von GLUCOPHAGE 500 bis 1500 mg und 850 bis 2550 mg weisen darauf hin, dass es bei steigenden Dosen an Dosisproportionalität mangelt, was eher auf eine verringerte Resorption als auf eine Veränderung der Ausscheidung zurückzuführen ist. Bei üblichen klinischen Dosen und Dosierungsschemata von GLUCOPHAGE werden Steady-State-Plasmakonzentrationen von Metformin innerhalb von 24 bis 48 Stunden erreicht und betragen im Allgemeinen
Nach einer oralen Einzeldosis von GLUCOPHAGE 500 mg XR wird Cmax mit einem Medianwert von 7 Stunden und einem Bereich von 4 bis 8 Stunden erreicht. Die maximalen Plasmaspiegel sind etwa 20 % niedriger im Vergleich zur gleichen Dosis von GLUCOPHAGE 1000 mg, das Ausmaß der Resorption (gemessen als AUC) ist jedoch vergleichbar mit dem von GLUCOPHAGE.
Im Steady State sind die AUC und Cmax für GLUCOPHAGE XR im Bereich von 500 bis 2000 mg bei einmal täglicher Gabe weniger als dosisproportional. Die maximalen Plasmaspiegel betragen etwa 0,6, 1,1, 1,4 und 1,8 µg/ml für 500, 1.000, 1.500 bzw. 2.000 mg einmal tägliche Dosen. Das Ausmaß der Metforminabsorption (gemessen als AUC) von GLUCOPHAGE 500 mg XR bei einer einmal täglichen Dosis von 2000 mg ist ähnlich der gleichen Tagesgesamtdosis, die als GLUCOPHAGE 850 mg Tabletten zweimal täglich 1000 mg verabreicht wird. Nach wiederholter Gabe von GLUCOPHAGE XR reicherte sich Metformin nicht im Plasma an.
Wirkung von Lebensmitteln:
Nahrung verringert das Ausmaß der Resorption und verzögert die Resorption von Metformin leicht, wie durch eine um etwa 40 % niedrigere mittlere maximale Plasmakonzentration (Cmax), eine um 25 % niedrigere Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) und eine 35-prozentige Minute Verlängerung der Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) nach Verabreichung einer einzelnen 850-mg-Tablette GLUCOPHAGE mit einer Mahlzeit im Vergleich zu derselben Tablettenstärke auf nüchternen Magen.
Obwohl das Ausmaß der Metformin-Resorption (gemessen als AUC) aus der GLUCOPHAGE XR-Tablette um etwa 50 % zunahm, wenn es zusammen mit Nahrung verabreicht wurde, hatte Nahrung keinen Einfluss auf Cmax und Tmax von Metformin. Sowohl fettreiche als auch fettarme Mahlzeiten hatten die gleiche Wirkung auf die Pharmakokinetik von GLUCOPHAGE XR.
Verteilung
Das scheinbare Verteilungsvolumen (V/F) von Metformin nach oraler Einzeldosis von GLUCOPHAGE 850 mg betrug im Durchschnitt 654 ± 358 l. Metformin wird vernachlässigbar an Plasmaproteine gebunden. Metformin verteilt sich in Erythrozyten, höchstwahrscheinlich als Funktion der Zeit.
Stoffwechsel
Studien mit intravenöser Einzeldosis bei gesunden Probanden zeigen, dass Metformin unverändert mit dem Urin ausgeschieden wird und weder einer hepatischen Metabolisierung (beim Menschen wurden keine Metaboliten identifiziert) noch einer biliären Ausscheidung unterliegt.
Beseitigung
Die renale Clearance (siehe Tabelle 4) ist etwa 3,5-mal größer als die Kreatinin-Clearance, was darauf hindeutet, dass die tubuläre Sekretion der Hauptweg der Metformin-Elimination ist. Nach oraler Gabe werden ca. 90 % des resorbierten Arzneimittels innerhalb der ersten 24 Stunden renal eliminiert, mit einer Eliminationshalbwertszeit aus dem Plasma von ca. 6,2 Stunden. Im Blut beträgt die Eliminationshalbwertszeit etwa 17,6 Stunden, was darauf hindeutet, dass die Erythrozytenmasse ein Verteilungskompartiment sein könnte.
Spezifische Populationen
Nierenfunktionsstörung
Bei Patienten mit eingeschränkter Nierenfunktion ist die Plasma- und Bluthalbwertszeit von Metformin verlängert und die renale Clearance verringert (siehe Tabelle 3) [Siehe DOSIERUNG UND ANWENDUNG , KONTRAINDIKATIONEN , WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Leberfunktionsstörung
Bei Patienten mit eingeschränkter Leberfunktion wurden keine pharmakokinetischen Studien zu Metformin durchgeführt [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Geriatrie
Begrenzte Daten aus kontrollierten pharmakokinetischen Studien mit GLUCOPHAGE 1000 mg bei gesunden älteren Probanden deuten darauf hin, dass die Gesamtplasmaclearance von Metformin im Vergleich zu gesunden jungen Probanden verringert, die Halbwertszeit verlängert und Cmax erhöht ist. Es scheint, dass die Veränderung der Pharmakokinetik von Metformin mit zunehmendem Alter hauptsächlich auf eine Veränderung der Nierenfunktion zurückzuführen ist (siehe Tabelle 4). [Sehen WARNUNGEN UND VORSICHTSMASSNAHMEN und Verwendung in bestimmten Bevölkerungsgruppen ].
Pädiatrie
Nach Einnahme einer einzelnen oralen GLUCOPHAGE 500-mg-Tablette mit einer Mahlzeit unterschied sich das geometrische Mittel der Cmax und AUC von Metformin um weniger als 5 % zwischen pädiatrischen Patienten mit Typ-2-Diabetes (12-16 Jahre) und gesunden Erwachsenen (20-16 Jahre) gleichen Geschlechts und Gewichts. 45 Jahre alt), alle mit normaler Nierenfunktion.
Geschlecht
Die pharmakokinetischen Parameter von Metformin unterschieden sich nicht signifikant zwischen gesunden Probanden und Patienten mit Typ-2-Diabetes mellitus, wenn sie nach Geschlecht analysiert wurden (Männer = 19, Frauen = 16).
Wettrennen
Es wurden keine Studien zu den pharmakokinetischen Parametern von Metformin je nach ethnischer Zugehörigkeit durchgeführt.
Wechselwirkungen mit anderen Medikamenten
In-vivo-Bewertung von Arzneimittelwechselwirkungen
Klinische Studien
Glucophage
Klinische Studien für Erwachsene
Es wurde eine doppelblinde, placebokontrollierte, multizentrische klinische Studie in den USA durchgeführt, an der adipöse Patienten mit Typ-2-Diabetes mellitus teilnahmen, deren Hyperglykämie mit einer Diät allein nicht ausreichend kontrolliert werden konnte (Baseline-Nüchtern-Plasmaglukose [FPG] von etwa 240 mg/dl). Die Patienten wurden 29 Wochen lang mit GLUCOPHAGE (bis zu 2550 mg/Tag) oder Placebo behandelt. Die Ergebnisse sind in Tabelle 7 dargestellt.
Das mittlere Ausgangskörpergewicht betrug 201 lbs bzw. 206 lbs in den Armen mit GLUCOPHAGE 850 mg bzw. Placebo. Die mittlere Veränderung des Körpergewichts vom Ausgangswert bis zur 29. Woche betrug -1,4 lbs bzw. -2,4 lbs in den Armen mit GLUCOPHAGE 1000 mg bzw. Placebo. Eine 29-wöchige, doppelblinde, placebokontrollierte Studie mit GLUCOPHAGE und Glyburid, allein und in Kombination , wurde bei adipösen Patienten mit Typ-2-Diabetes mellitus durchgeführt, die unter maximalen Dosen von Glyburid (FPG-Ausgangswert von etwa 250 mg/dl) keine angemessene Blutzuckerkontrolle erreicht hatten. Patienten, die in den Kombinationsarm randomisiert wurden, begannen die Therapie mit GLUCOPHAGE 500 mg und Glyburid 20 mg. Am Ende jeder Woche der ersten 4 Wochen der Studie wurde bei diesen Patienten die Dosierung von GLUCOPHAGE 500 mg um 500 mg erhöht, wenn sie den Nüchtern-Plasmaglukosezielwert nicht erreicht hatten. Nach Woche 4 wurden solche Dosisanpassungen monatlich vorgenommen, obwohl kein Patient GLUCOPHAGE 2500 mg überschreiten durfte. Patienten im Arm mit nur GLUCOPHAGE (Metformin plus Placebo) setzten Glyburid ab und befolgten dasselbe Titrationsschema. Patienten im Glyburid-Arm setzten die gleiche Glyburid-Dosis fort. Am Ende der Studie nahmen ungefähr 70 % der Patienten in der Kombinationsgruppe GLUCOPHAGE 2000 mg/Glyburid 20 mg oder GLUCOPHAGE 2500 mg/Glyburid 20 mg ein. Die Ergebnisse sind in Tabelle 8 dargestellt.
Das mittlere Ausgangskörpergewicht betrug 202 lbs, 203 lbs und 204 lbs in den GLUCOPHAGE/Glyburid-, Glyburid- bzw. GLUCOPHAGE 500 mg-Armen. Die durchschnittliche Veränderung des Körpergewichts vom Ausgangswert bis Woche 29 betrug 0,9 lbs, -0,7 lbs und -8,4 lbs in den GLUCOPHAGE/Glyburid-, Glyburid- bzw. GLUCOPHAGE 850 mg-Armen.
Pädiatrische klinische Studien
Eine doppelblinde, placebokontrollierte Studie bei pädiatrischen Patienten im Alter von 10 bis 16 Jahren mit Typ-2-Diabetes mellitus (durchschnittlicher FPG 182,2 mg/dl), Behandlung mit GLUCOPHAGE (bis zu 2000 mg/Tag) für bis zu 16 Wochen (durchschnittliche Dauer Behandlungsdauer 11 Wochen) durchgeführt. Die Ergebnisse sind in Tabelle 9 dargestellt.
Das mittlere Ausgangskörpergewicht betrug 205 lbs und 189 lbs in den Armen mit GLUCOPHAGE 850 mg bzw. Placebo. Die mittlere Veränderung des Körpergewichts vom Ausgangswert bis Woche 16 betrug -3,3 lbs bzw. -2,0 lbs im GLUCOPHAGE 500 mg- bzw. Placebo-Arm.
Glucophage XR
Eine 24-wöchige, doppelblinde, placebokontrollierte Studie mit GLUCOPHAGE 1000 mg XR, einmal täglich mit dem Abendessen eingenommen, wurde bei Patienten mit Typ-2-Diabetes mellitus durchgeführt, die es nicht geschafft hatten, ihren Blutzucker durch Diät und Bewegung unter Kontrolle zu bringen. Patienten, die an der Studie teilnahmen, hatten einen mittleren HbA1c-Ausgangswert von 8,0 % und einen mittleren NPG-Ausgangswert von 176 mg/dL. Die Behandlungsdosis wurde auf 1500 mg einmal täglich erhöht, wenn der HbA1c in Woche 12 ≥ 7,0 %, aber
Eine 16-wöchige, doppelblinde, placebokontrollierte Dosis-Wirkungs-Studie mit GLUCOPHAGE 500 mg XR, eingenommen einmal täglich zum Abendessen oder zweimal täglich zu den Mahlzeiten, wurde bei Patienten mit Typ-2-Diabetes mellitus durchgeführt, die keine glykämischen Werte erreichten Kontrolle durch Ernährung und Bewegung. Die Ergebnisse sind in Tabelle 10 gezeigt.
Das mittlere Ausgangskörpergewicht betrug 193 lbs, 192 lbs, 188 lbs, 196 lbs, 193 lbs und 194 lbs in den Armen mit GLUCOPHAGE XR 500 mg, 1000 mg, 1500 mg und 2000 mg einmal täglich, 1000 mg zweimal täglich bzw. Placebo . Die mittlere Veränderung des Körpergewichts vom Ausgangswert bis Woche 16 betrug jeweils -1,3 lbs, -1,3 lbs, -0,7 lbs, -1,5 lbs, -2,2 lbs und -1,8 lbs.
Eine 24-wöchige, doppelblinde, randomisierte Studie mit GLUCOPHAGE XR, eingenommen einmal täglich mit dem Abendessen, und GLUCOPHAGE 500 mg, eingenommen zweimal täglich (mit Frühstück und Abendessen), wurde bei Patienten mit Typ-2-Diabetes mellitus durchgeführt mit GLUCOPHAGE 500 mg zweimal täglich für mindestens 8 Wochen vor Studieneintritt behandelt. Die Ergebnisse sind in Tabelle 11 gezeigt.
Das mittlere Ausgangskörpergewicht betrug 210 lbs, 203 lbs und 193 lbs in den Armen mit GLUCOPHAGE 500 mg zweimal täglich bzw. GLUCOPHAGE XR 1000 mg und 1500 mg einmal täglich. Die mittlere Veränderung des Körpergewichts vom Ausgangswert bis Woche 24 betrug 0,9 lbs, 1,1 lbs bzw. 0,9 lbs.
INFORMATIONEN ZUM PATIENTEN
GLUCOPHAGE® [gloo-ko-fahzh] (Metforminhydrochlorid) Tabletten
und
GLUCOPHAGE® XR [gloo-ko-fahzh XR] (Metforminhydrochlorid) Retardtabletten
Lesen Sie die Patienteninformationen, die mit GLUCOPHAGE und GLUCOPHAGE 1000 mg XR geliefert werden, bevor Sie mit der Einnahme beginnen und jedes Mal, wenn Sie eine Nachfüllung erhalten. Möglicherweise gibt es neue Informationen. Diese Packungsbeilage ersetzt nicht das Gespräch mit Ihrem medizinischen Betreuer über Ihren Gesundheitszustand oder Ihre Behandlung.
Was sind die wichtigsten Informationen, die ich über GLUCOPHAGE 1000 mg und GLUCOPHAGE 500 mg XR wissen sollte?
Schwerwiegende Nebenwirkungen können bei Personen auftreten, die GLUCOPHAGE oder GLUCOPHAGE 1000 mg XR einnehmen, einschließlich:
Laktatazidose. Metforminhydrochlorid, das Arzneimittel in GLUCOPHAGE 500 mg und GLUCOPHAGE XR, kann eine seltene, aber schwerwiegende Nebenwirkung namens Laktatazidose (Ansammlung von Milchsäure im Blut) verursachen, die zum Tod führen kann. Laktatazidose ist ein medizinischer Notfall und muss in einem Krankenhaus behandelt werden.
Beenden Sie die Einnahme von GLUCOPHAGE oder GLUCOPHAGE 500 mg XR und wenden Sie sich sofort an Ihren Arzt, wenn Sie eines der folgenden Symptome einer Laktatazidose bemerken:
Sie haben ein höheres Risiko, eine Laktatazidose zu bekommen, wenn Sie:
Was sind GLUCOPHAGE und GLUCOPHAGE 1000 mg XR?
GLUCOPHAGE 850mg und GLUCOPHAGE 1000mg XR haben den gleichen Wirkstoff. GLUCOPHAGE XR wirkt jedoch länger in Ihrem Körper. Beide Arzneimittel helfen auf verschiedene Weise, Ihren Blutzucker zu kontrollieren. Dazu gehört, Ihrem Körper zu helfen, besser auf das Insulin zu reagieren, das er auf natürliche Weise produziert, die Zuckermenge zu verringern, die Ihre Leber produziert, und die Zuckermenge zu verringern, die Ihr Darm absorbiert. GLUCOPHAGE 1000 mg und GLUCOPHAGE 850 mg XR bewirken nicht, dass Ihr Körper mehr Insulin produziert.
Wer sollte GLUCOPHAGE oder GLUCOPHAGE 850 mg XR nicht einnehmen?
Einige Erkrankungen erhöhen Ihr Risiko, eine Laktatazidose zu bekommen, oder verursachen andere Probleme, wenn Sie eines dieser Arzneimittel einnehmen. Die meisten der unten aufgeführten Erkrankungen können Ihre Wahrscheinlichkeit erhöhen, eine Laktatazidose zu bekommen.
Nehmen Sie GLUCOPHAGE 1000 mg oder GLUCOPHAGE 500 mg XR nicht ein, wenn Sie:
Was sollte ich meinem Arzt vor der Einnahme von GLUCOPHAGE oder GLUCOPHAGE 1000 mg XR mitteilen?
Informieren Sie vor der Einnahme von GLUCOPHAGE 500 mg oder GLUCOPHAGE XR Ihren Arzt, wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Arzneimittel, Vitamine und Kräuterergänzungen. Informieren Sie sich über die Medikamente, die Sie einnehmen. Führen Sie eine Liste davon, um sie Ihrem Arzt und Apotheker zu zeigen, wenn Sie ein neues Arzneimittel erhalten.
Kann GLUCOPHAGE oder GLUCOPHAGE 500 mg XR bei Kindern angewendet werden?
GLUCOPHAGE 1000 mg senkt nachweislich den Blutzuckerspiegel bei Kindern (im Alter von 10-16 Jahren) mit Typ-2-Diabetes. GLUCOPHAGE 1000 mg wurde bei Kindern unter 10 Jahren nicht untersucht. GLUCOPHAGE 500 mg wurde nicht in Kombination mit anderen oralen blutzuckerregulierenden Arzneimitteln oder Insulin bei Kindern untersucht. Wenn Sie Fragen zur Anwendung von GLUCOPHAGE 1000 mg bei Kindern haben, sprechen Sie mit Ihrem Arzt oder einem anderen Gesundheitsdienstleister.
GLUCOPHAGE XR wurde bei Kindern nicht untersucht.
Wie sollte ich GLUCOPHAGE oder GLUCOPHAGE XR einnehmen?
Was sollte ich während der Einnahme von GLUCOPHAGE oder GLUCOPHAGE 1000 mg XR vermeiden?
Trinken Sie während der Einnahme von GLUCOPHAGE oder GLUCOPHAGE XR nicht viele alkoholische Getränke. Das bedeutet, dass Sie nicht für kurze Zeit Alkoholexzesse und nicht regelmäßig viel Alkohol trinken sollten. Alkohol kann das Risiko einer Laktatazidose erhöhen.
Was sind die Nebenwirkungen von GLUCOPHAGE und GLUCOPHAGE XR?
Rufen Sie sofort Ihren Arzt an, wenn Sie eines der folgenden Symptome haben, die Anzeichen einer Laktatazidose sein könnten:
Die meisten Menschen, die eine Laktatazidose mit Metformin hatten, haben andere Dinge, die in Kombination mit Metformin zur Laktatazidose geführt haben. Informieren Sie Ihren Arzt, wenn Sie eine der folgenden Beschwerden haben, da Sie unter GLUCOPHAGE 850 mg oder GLUCOPHAGE 500 mg XR ein höheres Risiko haben, eine Laktatazidose zu bekommen, wenn Sie:
Häufige Nebenwirkungen von GLUCOPHAGE 500 mg und GLUCOPHAGE 1000 mg XR sind Durchfall, Übelkeit und Magenverstimmung. Diese Nebenwirkungen klingen im Allgemeinen ab, nachdem Sie das Arzneimittel eine Zeit lang eingenommen haben. Die Einnahme Ihres Arzneimittels zu den Mahlzeiten kann helfen, diese Nebenwirkungen zu reduzieren. Informieren Sie Ihren Arzt, wenn die Nebenwirkungen Sie sehr belasten, länger als ein paar Wochen anhalten, wiederkommen, nachdem sie abgeklungen sind, oder später mit der Therapie beginnen. Möglicherweise benötigen Sie eine niedrigere Dosis oder müssen die Einnahme des Arzneimittels für kurze Zeit oder endgültig abbrechen.
Etwa 3 von 100 Personen, die GLUCOPHAGE oder GLUCOPHAGE 1000 mg XR einnehmen, haben zu Beginn der Einnahme des Arzneimittels einen unangenehmen metallischen Geschmack. Es dauert nur kurze Zeit.
GLUCOPHAGE 850 mg und GLUCOPHAGE 500 mg XR allein verursachen selten eine Hypoglykämie (niedriger Blutzucker). Hypoglykämie kann jedoch auftreten, wenn Sie nicht genug essen, Alkohol trinken oder andere Arzneimittel zur Senkung des Blutzuckerspiegels einnehmen.
Wie soll ich GLUCOPHAGE 500 mg und GLUCOPHAGE XR aufbewahren?
Lagern Sie GLUCOPHAGE und GLUCOPHAGE 850 mg XR bei 20 °C bis 25 °C (68 °F bis 77 °F).
Bewahren Sie GLUCOPHAGE 850 mg und GLUCOPHAGE 500 mg XR sowie alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur Anwendung von GLUCOPHAGE 850 mg und GLUCOPHAGE 850 mg XR
Wenn Sie Fragen oder Probleme haben, sprechen Sie mit Ihrem Arzt oder einem anderen Gesundheitsdienstleister. Sie können Ihren Arzt oder Apotheker nach Informationen über GLUCOPHAGE 850 mg und GLUCOPHAGE 500 mg XR fragen, die für Angehörige der Gesundheitsberufe bestimmt sind. Arzneimittel werden manchmal zu anderen als den in der Packungsbeilage aufgeführten Zwecken verschrieben. Verwenden Sie GLUCOPHAGE 1000 mg oder GLUCOPHAGE 1000 mg XR nicht für einen Zustand, für den es nicht verschrieben wurde. Teilen Sie Ihr Arzneimittel nicht mit anderen Personen.
Was sind die Inhaltsstoffe von GLUCOPHAGE und GLUCOPHAGE 500 mg XR?
Wirkstoffe von GLUCOPHAGE: Metforminhydrochlorid.
Inaktive Inhaltsstoffe in jeder GLUCOPHAGE-Tablette: Povidon und Magnesiumstearat. Darüber hinaus enthält der Überzug der 500-mg- und 850-mg-Tabletten Hypromellose und der Überzug der 1000-mg-Tablette Hypromellose und Polyethylenglycol.
Wirkstoffe von GLUCOPHAGE 1000 mg XR: Metforminhydrochlorid.
Inaktive Inhaltsstoffe in jeder Tablette GLUCOPHAGE 1000 mg XR 500 mg: Natriumcarboxymethylcellulose, Hypromellose, mikrokristalline Cellulose und Magnesiumstearat.
Inaktive Bestandteile in jeder Tablette GLUCOPHAGE XR 750 mg: Natriumcarboxymethylcellulose, Hypromellose und Magnesiumstearat.
Was ist Typ-2-Diabetes?
Typ-2-Diabetes ist eine Erkrankung, bei der Ihr Körper nicht genug Insulin produziert und das von Ihrem Körper produzierte Insulin nicht so gut wirkt, wie es sollte. Ihr Körper kann auch zu viel Zucker produzieren. Wenn dies geschieht, baut sich Zucker (Glukose) im Blut auf. Dies kann zu ernsthaften medizinischen Problemen führen.
Das Hauptziel der Behandlung von Diabetes ist es, Ihren Blutzucker auf ein normales Niveau zu senken.
Hoher Blutzucker kann durch Ernährung und Bewegung sowie bei Bedarf durch bestimmte Medikamente gesenkt werden.
Sprechen Sie mit Ihrem medizinischen Betreuer darüber, wie Sie niedrigen Blutzucker (Hypoglykämie), hohen Blutzucker (Hyperglykämie) und Probleme, die Sie aufgrund Ihres Diabetes haben, verhindern, erkennen und behandeln können.