Cartia XT 180mg Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Cartia und wie wird es angewendet?
Cartia ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Brustschmerzen (Angina pectoris), Bluthochdruck (Hypertonie), paroxysmaler supraventrikulärer Tachykardie und Vorhofflimmern (Flattern). Cartia kann allein oder mit anderen Medikamenten verwendet werden.
Cartia gehört zu einer Klasse von Medikamenten namens Antidysrhythmika, IV; Kalziumkanalblocker; Calciumkanalblocker, Nicht-Dihydropyridin.
Welche Nebenwirkungen kann Cartia haben?
Cartia kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Cartia sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cartia. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
Diltiazemhydrochlorid ist ein Hemmer des zellulären Einstroms von Calciumionen (langsamer Kanalblocker oder Calciumantagonist). Chemisch gesehen ist Diltiazemhydrochlorid 1,5-Benzothiazepin-4(5H)on,3-(acetyloxy)-5-[2-(dimethylamino)ethyl]-2,3-dihydro-2-(4-methoxyphenyl)-monohydrochlorid ,(+)-cis-. Die chemische Struktur ist:
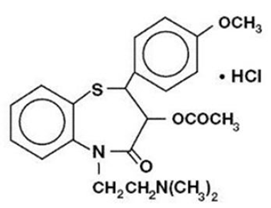
Diltiazemhydrochlorid ist ein weißes bis cremefarbenes kristallines Pulver mit bitterem Geschmack. Es ist in Wasser, Methanol und Chloroform löslich. Es hat ein Molekulargewicht von 450,98. Diltiazem-Hydrochlorid-Retardkapsel (Einmal-Tages-Dosierung) ist als einmal täglich retardierte Kapsel formuliert, die 120 mg, 180 mg, 240 mg oder 300 mg Diltiazem-Hydrochlorid enthält.
Darüber hinaus enthält jede Kapsel die folgenden inaktiven Bestandteile: Acetyltributylcitrat, Ammoniummethacrylat-Copolymer-NF, D & C Rot Nr. 28, D & C Gelb Nr. 10, D & C Gelb Nr. 10 Aluminiumlack, Ethylcellulose, FD & C Blau Nr. 1 Aluminiumlack, FD & C Blau Nr. 2 Aluminiumlack, FD & C Rot Nr. 40, FD & C Rot Nr. 40 Aluminiumlack, Gelatine-NF, Magnesiumstearat, Methacrylsäure-Copolymer-NF, Propylenglykol, Polysorbat 80-NF, Stärke , Saccharose, Talk USP und Titandioxid. Die 180-mg- und 240-mg-Kapseln enthalten gelbes Eisenoxid. Darüber hinaus enthält die 240-mg-Kapsel auch schwarzes Eisenoxid und rotes Eisenoxid.
Zur oralen Verabreichung.
Dieses Medikament erfüllt USP Drug Release 9.
INDIKATIONEN
Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) sind angezeigt zur Behandlung von Bluthochdruck. Es kann allein oder in Kombination mit anderen blutdrucksenkenden Medikamenten verwendet werden.
Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) ist für die Behandlung von chronisch stabiler Angina und Angina aufgrund von Spasmen der Koronararterien indiziert.
DOSIERUNG UND ANWENDUNG
Patienten, die mit Diltiazem allein oder in Kombination mit anderen Medikamenten behandelt werden, können auf Diltiazemhydrochlorid-Retardkapseln USP (einmal täglich dosiert) in der nächstliegenden äquivalenten Gesamttagesdosis umgestellt werden. Bei einigen Patienten können höhere Dosen von Diltiazemhydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) erforderlich sein. Die Patienten sollten engmaschig überwacht werden. Eine anschließende Titration auf höhere oder niedrigere Dosen kann erforderlich sein und sollte eingeleitet werden, wenn dies klinisch gerechtfertigt ist. Es liegen begrenzte allgemeine klinische Erfahrungen mit Dosen über 360 mg vor, aber Dosen bis 540 mg wurden in klinischen Studien untersucht. Die Inzidenz von Nebenwirkungen nimmt mit zunehmender Dosis zu, wobei AV-Block ersten Grades, Schwindel und Sinusbradykardie das stärkste Verhältnis zur Dosis aufweisen.
Hypertonie
Die Dosierung muss durch Titration an die individuellen Bedürfnisse des Patienten angepasst werden. Bei Anwendung als Monotherapie beträgt eine angemessene Anfangsdosis 180 bis 240 mg einmal täglich, obwohl einige Patienten auf niedrigere Dosen ansprechen können. Die maximale antihypertensive Wirkung wird normalerweise nach 14 Tagen chronischer Therapie beobachtet; Daher sollten Dosisanpassungen entsprechend geplant werden. Der übliche Dosierungsbereich, der in klinischen Studien untersucht wurde, war 240 bis 360 mg einmal täglich. Einzelne Patienten können auf höhere Dosen von bis zu 480 mg einmal täglich ansprechen.
Angina
Die Dosierungen zur Behandlung von Angina pectoris sollten an die Bedürfnisse jedes Patienten angepasst werden, beginnend mit einer Dosis von 120 oder 180 mg einmal täglich. Einzelne Patienten können auf höhere Dosen von bis zu 480 mg einmal täglich ansprechen. Bei Bedarf kann die Titration über einen Zeitraum von 7 bis 14 Tagen durchgeführt werden.
Diltiazem-Hydrochlorid-Kapseln mit verlängerter Freisetzung USP (einmal tägliche Dosierung)
Gleichzeitige Anwendung mit anderen kardiovaskulären Mitteln
WIE GELIEFERT
HINWEIS: DAS PRODUKT KANN EINEN GERUCH HABEN.
Lagerbedingungen
Bei 20° bis 25°C (68° bis 77°F) lagern [Siehe USP kontrollierte Raumtemperatur ].
Vermeiden Sie übermäßige Feuchtigkeit.
In einem dichten, lichtbeständigen Behälter gemäß USP abgeben.
Hergestellt von: Actavis Laboratories FL, Inc., Fort Lauderdale, FL 33314 USA. Vertrieb durch: Actavis Pharma, Inc., Parsippany, NJ 07054 USA. Überarbeitet: Dezember 2014
NEBENWIRKUNGEN
Schwerwiegende Nebenwirkungen sind in den bisher durchgeführten Studien selten aufgetreten, aber es sollte beachtet werden, dass Patienten mit eingeschränkter Ventrikelfunktion und kardialer Erregungsleitungsstörung in der Regel von diesen Studien ausgeschlossen wurden.
Die folgende Tabelle zeigt die häufigsten Nebenwirkungen, die in Placebo-kontrollierten Angina- und Hypertonie-Studien bei Patienten berichtet wurden, die Diltiazemhydrochlorid-Kapseln mit verlängerter Freisetzung (einmalige Dosierung) bis zu 360 mg erhielten, wobei die Raten bei Placebo-Patienten zum Vergleich gezeigt wurden.
Diltiazem-Hydrochlorid-Kapsel mit verlängerter Freisetzung (einmal täglich) Placebo-kontrollierte Angina- und Hypertonie-Studien kombiniert
In klinischen Studien mit Diltiazem-Hydrochlorid-Retardkapseln (Einmal-Tages-Dosierung), Diltiazem-Hydrochlorid-Tabletten und Diltiazem-Hydrochlorid-Retardkapseln mit über 3200 Patienten waren die häufigsten Ereignisse (d. h. mehr als 1 %) Ödeme (4,6 %). , Kopfschmerzen (4,6 %), Schwindel (3,5 %), Asthenie (2,6 %), AV-Block ersten Grades (2,4 %), Bradykardie (1,7 %), Flush (1,4 %), Übelkeit (1,4 %) und Hautausschlag ( 1,2 %).
Darüber hinaus wurden die folgenden Ereignisse selten (weniger als 1 %) in Angina- oder Hypertonie-Studien berichtet:
Herz-Kreislauf: Angina pectoris, Arrhythmie, AV-Block (2. oder 3. Grades), Schenkelblock, dekompensierte Herzinsuffizienz, EKG-Anomalien, Hypotonie, Palpitationen, Synkope, Tachykardie, ventrikuläre Extrasystolen.
Nervöses System: Abnorme Träume, Amnesie, Depression, Gangstörungen, Halluzinationen, Schlaflosigkeit, Nervosität, Parästhesien, Persönlichkeitsveränderung, Somnolenz, Tinnitus, Zittern.
Magen-Darm: Anorexie, Verstopfung, Durchfall, Mundtrockenheit, Geschmacksstörung, Dyspepsie, leichte Erhöhungen von SGOT, SGPT, LDH und alkalischer Phosphatase (vgl WARNUNGEN , Akute Leberschädigung ), Durst, Erbrechen, Gewichtszunahme.
Dermatologisch: Petechien, Lichtempfindlichkeit, Juckreiz, Urtikaria.
Sonstiges: Amblyopie, CPK-Anstieg, Dyspnoe, Epistaxis, Augenreizung, Hyperglykämie, Hyperurikämie, Impotenz, Muskelkrämpfe, verstopfte Nase, Nykturie, osteoartikuläre Schmerzen, Polyurie, sexuelle Schwierigkeiten.
Die folgenden Postmarketing-Ereignisse wurden selten bei Patienten berichtet, die Diltiazem erhielten: akute generalisierte exanthematische Pustulose, allergische Reaktionen, Alopezie, Angioödem (einschließlich fazialer oder periorbitaler Ödeme), Asystolie, Erythema multiforme (einschließlich Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse), exfoliative Dermatitis , extrapyramidale Symptome, Gingivahyperplasie, hämolytische Anämie, verlängerte Blutungszeit, Leukopenie, Lichtempfindlichkeit (einschließlich lichenoider Keratose und Hyperpigmentierung an sonnenexponierten Hautbereichen), Purpura, Retinopathie, Myopathie und Thrombozytopenie. Außerdem wurden bei diesen Patienten Ereignisse wie Myokardinfarkt beobachtet, die nicht ohne weiteres vom natürlichen Krankheitsverlauf zu unterscheiden sind. Es wurde über eine Reihe gut dokumentierter Fälle von generalisiertem Hautausschlag berichtet, von denen einige als leukozytoklastische Vaskulitis charakterisiert wurden. Eine definitive Ursache-Wirkungs-Beziehung zwischen diesen Ereignissen und der Diltiazem-Therapie muss jedoch noch etabliert werden.
Um VERMUTLICHE NEBENWIRKUNGEN zu melden, kontaktieren Sie Actavis unter 1-800-272-5525 oder die FDA unter 1-800-FDA-1088 oder www.fda.gov/medwatch.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Aufgrund des Potenzials für additive Wirkungen sind bei Patienten, die Diltiazem gleichzeitig mit anderen Wirkstoffen erhalten, die bekanntermaßen die kardiale Kontraktilität und/oder Erregungsleitung beeinflussen, Vorsicht und sorgfältige Titration geboten (siehe WARNUNGEN ). Pharmakologische Studien weisen darauf hin, dass es bei der gleichzeitigen Anwendung von Betablockern oder Digitalis mit Diltiazem zu additiven Wirkungen bei der Verlängerung der AV-Überleitung kommen kann (vgl WARNUNGEN ).
Wie bei allen Arzneimitteln ist bei der Behandlung von Patienten mit mehreren Arzneimitteln Vorsicht geboten. Diltiazem ist sowohl ein Substrat als auch ein Inhibitor des Cytochrom-P-450-3A4-Enzymsystems. Andere Arzneimittel, die spezifische Substrate, Inhibitoren oder Induktoren dieses Enzymsystems sind, können einen signifikanten Einfluss auf die Wirksamkeit und das Nebenwirkungsprofil von Diltiazem haben. Patienten, die andere Arzneimittel einnehmen, die Substrate von CYP450 3A4 sind, insbesondere Patienten mit eingeschränkter Nieren- und/oder Leberfunktion, benötigen möglicherweise eine Dosisanpassung, wenn sie mit der gleichzeitigen Anwendung von Diltiazem beginnen oder aufhören, um optimale therapeutische Blutspiegel aufrechtzuerhalten.
Anästhetika
Die Unterdrückung der Herzkontraktilität, -leitfähigkeit und -automatik sowie die mit Anästhetika verbundene Gefäßerweiterung können durch Kalziumkanalblocker potenziert werden. Bei gleichzeitiger Anwendung sollten Anästhetika und Calciumblocker sorgfältig titriert werden.
Benzodiazepine
Studien zeigten, dass Diltiazem im Vergleich zu Placebo die AUC von Midazolam und Triazolam um das 3- bis 4-Fache und die Cmax um das 2-Fache erhöhte. Die Eliminationshalbwertszeit von Midazolam und Triazolam verlängerte sich ebenfalls (1,5- bis 2,5-fach) während der gleichzeitigen Anwendung mit Diltiazem. Diese pharmakokinetischen Wirkungen, die während der gleichzeitigen Anwendung von Diltiazem beobachtet wurden, können zu verstärkten klinischen Wirkungen (z. B. verlängerte Sedierung) sowohl von Midazolam als auch von Triazolam führen.
Betablocker
Kontrollierte und unkontrollierte Studien aus dem Inland deuten darauf hin, dass die gleichzeitige Anwendung von Diltiazem und Betablockern in der Regel gut vertragen wird, aber die verfügbaren Daten reichen nicht aus, um die Auswirkungen einer gleichzeitigen Behandlung bei Patienten mit linksventrikulärer Dysfunktion oder kardialer Erregungsleitungsstörung vorherzusagen.
Die gleichzeitige Verabreichung von Diltiazemhydrochlorid und Propranolol an fünf gesunde Probanden führte bei allen Probanden zu erhöhten Propranololspiegeln und die Bioverfügbarkeit von Propranolol wurde um etwa 50 % erhöht. In vitro scheint Propranolol durch Diltiazem von seinen Bindungsstellen verdrängt zu werden. Wenn eine Kombinationstherapie zusammen mit Propranolol begonnen oder abgesetzt wird, kann eine Anpassung der Propranolol-Dosis gerechtfertigt sein (siehe WARNUNGEN ).
Buspiron
Bei neun gesunden Probanden erhöhte Diltiazem die mittlere Buspiron-AUC signifikant um das 5,5-Fache und die Cmax um das 4,1-Fache im Vergleich zu Placebo. T½ und Tmax von Buspiron wurden durch Diltiazem nicht signifikant beeinflusst. Verstärkte Wirkungen und erhöhte Toxizität von Buspiron können bei gleichzeitiger Verabreichung mit Diltiazem möglich sein. Nachfolgende Dosisanpassungen können während der gleichzeitigen Anwendung erforderlich sein und sollten auf der Grundlage einer klinischen Beurteilung erfolgen.
Carbamazepin
Es wurde berichtet, dass die gleichzeitige Verabreichung von Diltiazem mit Carbamazepin zu erhöhten Serumspiegeln von Carbamazepin (40 % bis 72 % Anstieg) führt, was in einigen Fällen zu Toxizität führt. Patienten, die diese Arzneimittel gleichzeitig erhalten, sollten auf mögliche Arzneimittelwechselwirkungen überwacht werden.
Cimetidin
Eine Studie mit sechs gesunden Probanden hat einen signifikanten Anstieg der maximalen Diltiazem-Plasmaspiegel (58 %) und der Fläche unter der Kurve (53 %) nach einer 1-wöchigen Cimetidin-Behandlung mit 1200 mg pro Tag und einer Einzeldosis von gezeigt Diltiazem 60 mg. Ranitidin erzeugte kleinere, nicht signifikante Anstiege. Die Wirkung kann durch Cimetidins bekannte Hemmung von Cytochrom P-450 in der Leber, dem Enzymsystem, das für den First-Pass-Metabolismus von Diltiazem verantwortlich ist, vermittelt werden. Patienten, die derzeit eine Diltiazem-Therapie erhalten, sollten sorgfältig auf eine Veränderung der pharmakologischen Wirkung überwacht werden, wenn sie eine Therapie mit Cimetidin beginnen oder beenden. Eine Anpassung der Diltiazem-Dosis kann gerechtfertigt sein.
Clonidin
Im Zusammenhang mit der gleichzeitigen Anwendung von Clonidin und Diltiazem wurde über eine Sinusbradykardie berichtet, die zu einem Krankenhausaufenthalt und dem Einsetzen eines Schrittmachers führte. Überwachen Sie die Herzfrequenz bei Patienten, die gleichzeitig Diltiazem und Clonidin erhalten.
Cyclosporin
In Studien mit Nieren- und Herztransplantationspatienten wurde eine pharmakokinetische Wechselwirkung zwischen Diltiazem und Ciclosporin beobachtet. Bei Empfängern von Nieren- und Herztransplantaten war eine Reduktion der Ciclosporin-Dosis im Bereich von 15 % bis 48 % erforderlich, um Cyclosporin-Talkonzentrationen aufrechtzuerhalten, die denen vor der Zugabe von Diltiazem ähnlich waren. Wenn diese Wirkstoffe gleichzeitig verabreicht werden sollen, sollten die Ciclosporin-Konzentrationen überwacht werden, insbesondere wenn die Diltiazem-Therapie begonnen, angepasst oder beendet wird.
Die Wirkung von Ciclosporin auf die Plasmakonzentration von Diltiazem wurde nicht untersucht.
Digitalis
Die Verabreichung von Diltiazem zusammen mit Digoxin bei 24 gesunden männlichen Probanden erhöhte die Digoxin-Plasmakonzentrationen um etwa 20 %. Ein anderer Forscher fand bei 12 Patienten mit koronarer Herzkrankheit keinen Anstieg der Digoxinspiegel. Da es widersprüchliche Ergebnisse bezüglich der Wirkung von Digoxin-Spiegeln gibt, wird empfohlen, die Digoxin-Spiegel bei Beginn, Anpassung und Absetzen einer Diltiazem-Therapie zu überwachen, um eine mögliche Über- oder Unterdigitalisierung zu vermeiden (siehe WARNUNGEN ).
Chinidin
Diltiazem erhöht signifikant die AUC(0-→) von Chinidin um 51 %, T½ um 36 % und senkt seine orale CL um 33 %. Eine Überwachung auf Nebenwirkungen von Chinidin kann gerechtfertigt sein und die Dosis entsprechend angepasst werden.
Rifampin
Die gleichzeitige Verabreichung von Rifampin mit Diltiazem senkte die Diltiazem-Plasmakonzentrationen auf nicht nachweisbare Werte. Die gleichzeitige Anwendung von Diltiazem mit Rifampin oder anderen bekannten CYP3A4-Induktoren sollte nach Möglichkeit vermieden und eine alternative Therapie in Betracht gezogen werden.
Statine
Diltiazem ist ein Inhibitor von CYP3A4 und erhöht nachweislich die AUC einiger Statine signifikant. Das Risiko einer Myopathie und Rhabdomyolyse mit Statinen, die durch CYP3A4 metabolisiert werden, kann bei gleichzeitiger Anwendung von Diltiazem erhöht sein. Wenn möglich, verwenden Sie ein nicht durch CYP3A4 metabolisiertes Statin zusammen mit Diltiazem; andernfalls sollten sowohl für Diltiazem als auch für das Statin Dosisanpassungen in Betracht gezogen werden, zusammen mit einer engmaschigen Überwachung auf Anzeichen und Symptome von Nebenwirkungen im Zusammenhang mit Statinen.
In einer Crossover-Studie mit gesunden Probanden (N=10) führte die gleichzeitige Gabe einer Einzeldosis von 20 mg Simvastatin am Ende einer 14-tägigen Behandlung mit Diltiazem SR von 120 mg BID zu einem 5-fachen Anstieg der mittleren AUC von Simvastatin im Vergleich zu Simvastatin allein. Patienten mit einer erhöhten durchschnittlichen Steady-State-Exposition von Diltiazem zeigten eine stärkere Zunahme der Simvastatin-Exposition. Computerbasierte Simulationen zeigten, dass bei einer Tagesdosis von 480 mg Diltiazem ein 8- bis 9-facher mittlerer Anstieg der AUC von Simvastatin zu erwarten ist. Wenn die gleichzeitige Verabreichung von Simvastatin mit Diltiazem erforderlich ist, begrenzen Sie die tägliche Dosis von Simvastatin auf 10 mg und Diltiazem auf 240 mg.
In einer randomisierten, offenen 4-Wege-Crossover-Studie mit zehn Probanden führte die gleichzeitige Gabe von Diltiazem (120 mg zweimal täglich Diltiazem SR über 2 Wochen) mit einer Einzeldosis von 20 mg Lovastatin zu einem 3- bis 4-fachen Anstieg des Mittelwerts Lovastatin-AUC und im Vergleich zu Lovastatin allein. In derselben Studie gab es keine signifikante Veränderung der AUC von 20 mg Pravastatin als Einzeldosis und während der gleichzeitigen Anwendung von Diltiazem. Die Diltiazem-Plasmaspiegel wurden durch Lovastatin oder Pravastatin nicht signifikant beeinflusst.
WARNUNGEN
Herzleitung
Diltiazem verlängert die Refraktärzeiten des AV-Knotens, ohne die Erholungszeit des Sinusknotens signifikant zu verlängern, außer bei Patienten mit Sick-Sinus-Syndrom. Dieser Effekt kann selten zu ungewöhnlich langsamer Herzfrequenz (insbesondere bei Patienten mit Sick-Sinus-Syndrom) oder einem AV-Block zweiten oder dritten Grades führen (13 von 3290 Patienten oder 0,40 %). Die gleichzeitige Anwendung von Diltiazem mit Betablockern oder Digitalis kann zu additiven Wirkungen auf die Erregungsleitung des Herzens führen. Ein Patient mit Prinzmetal-Angina entwickelte Perioden von Asystolie (2 bis 5 Sekunden) nach einer Einzeldosis von 60 mg Diltiazem (vgl NEBENWIRKUNGEN ).
Kongestive Herzinsuffizienz
Obwohl Diltiazem in isolierten tierischen Gewebepräparaten eine negativ inotrope Wirkung hat, haben hämodynamische Studien an Menschen mit normaler Ventrikelfunktion weder eine Verringerung des Herzindex noch konsistente negative Auswirkungen auf die Kontraktilität (dp/dt) gezeigt. Eine Akutstudie mit oralem Diltiazem bei Patienten mit eingeschränkter Ventrikelfunktion (Ejektionsfraktion 24 % ± 6 %) zeigte eine Verbesserung der Indizes der Ventrikelfunktion ohne signifikante Abnahme der kontraktilen Funktion (dp/dt). Bei Patienten mit vorbestehender Beeinträchtigung der Ventrikelfunktion wurde über eine Verschlechterung der dekompensierten Herzinsuffizienz berichtet. Die Erfahrung mit der Anwendung von Diltiazemhydrochlorid in Kombination mit Betablockern bei Patienten mit eingeschränkter Ventrikelfunktion ist begrenzt. Bei der Verwendung dieser Kombination ist Vorsicht geboten.
Hypotonie
Blutdrucksenkungen im Zusammenhang mit einer Diltiazem-Therapie können gelegentlich zu einer symptomatischen Hypotonie führen.
Akute Leberschädigung
Leichte Erhöhungen der Transaminasen mit und ohne gleichzeitige Erhöhung der alkalischen Phosphatase und des Bilirubins wurden in klinischen Studien beobachtet. Solche Erhöhungen waren in der Regel vorübergehend und bildeten sich selbst bei fortgesetzter Behandlung mit Diltiazem häufig zurück. In seltenen Fällen wurden signifikante Erhöhungen von Enzymen wie alkalischer Phosphatase, LDH, SGOT, SGPT und anderen Phänomenen festgestellt, die mit einer akuten Leberschädigung vereinbar sind. Diese Reaktionen traten tendenziell früh nach Therapiebeginn auf (1 bis 8 Wochen) und waren nach Absetzen der medikamentösen Therapie reversibel. Die Verwandtschaft zu Diltiazem ist in manchen Fällen ungewiss, in manchen aber wahrscheinlich (vgl VORSICHTSMASSNAHMEN ).
VORSICHTSMASSNAHMEN
Allgemein
Diltiazemhydrochlorid wird weitgehend von der Leber metabolisiert und über die Nieren und die Galle ausgeschieden. Wie bei jedem Arzneimittel, das über einen längeren Zeitraum verabreicht wird, sollten die Laborparameter der Nieren- und Leberfunktion in regelmäßigen Abständen überwacht werden. Das Medikament sollte bei Patienten mit eingeschränkter Nieren- oder Leberfunktion mit Vorsicht angewendet werden. In subakuten und chronischen Studien an Hunden und Ratten, die darauf ausgelegt waren, Toxizität hervorzurufen, wurden hohe Dosen von Diltiazem mit Leberschäden in Verbindung gebracht. In speziellen subakuten Leberstudien waren orale Dosen von 125 mg/kg und höher bei Ratten mit histologischen Veränderungen in der Leber verbunden, die nach Absetzen des Arzneimittels reversibel waren. Bei Hunden waren Dosen von 20 mg/kg auch mit Leberveränderungen verbunden; Diese Veränderungen waren jedoch bei fortgesetzter Dosierung reversibel.
Dermatologische Ereignisse (vgl NEBENWIRKUNGEN kann vorübergehend sein und trotz fortgesetzter Anwendung von Diltiazem verschwinden. Selten wurde jedoch auch über Hautausschläge berichtet, die zu einem Erythema multiforme und/oder einer exfoliativen Dermatitis fortschreiten. Sollte eine dermatologische Reaktion bestehen bleiben, sollte das Medikament abgesetzt werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Eine 24-monatige Studie an Ratten mit oralen Dosierungen von bis zu 100 mg/kg/Tag und eine 21-monatige Studie an Mäusen mit oralen Dosierungen von bis zu 30 mg/kg/Tag ergab keine Hinweise auf Karzinogenität. Es gab auch keine mutagene Reaktion in vitro oder in vivo in Säugerzelltests oder in vitro in Bakterien. In einer Studie, die an männlichen und weiblichen Ratten bei oralen Dosierungen von bis zu 100 mg/kg/Tag durchgeführt wurde, wurden keine Hinweise auf eine Beeinträchtigung der Fertilität beobachtet.
Schwangerschaft
Kategorie C. Reproduktionsstudien wurden an Mäusen, Ratten und Kaninchen durchgeführt. Die Verabreichung von Dosen im Bereich von fünf- bis zehnmal höher (auf mg/kg-Basis) als die täglich empfohlene therapeutische Dosis hat zu embryonaler und fötaler Letalität geführt. In einigen Studien wurde berichtet, dass diese Dosen Skelettanomalien verursachen. In den perinatalen/postnatalen Studien gab es eine erhöhte Inzidenz von Totgeburten bei Dosen, die dem 20-Fachen der Humandosis oder höher entsprachen.
Es gibt keine gut kontrollierten Studien bei schwangeren Frauen; Wenden Sie Diltiazem daher bei schwangeren Frauen nur dann an, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter
Diltiazem wird in die Muttermilch ausgeschieden. Ein Bericht weist darauf hin, dass die Konzentrationen in der Muttermilch sich den Serumspiegeln annähern können. Wenn die Anwendung von Diltiazem als notwendig erachtet wird, sollte eine alternative Methode der Säuglingsernährung eingeführt werden.
Pädiatrische Verwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Geriatrische Verwendung
Klinische Studien zu Diltiazem schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Die oralen LD50-Werte bei Mäusen und Ratten reichen von 415 bis 740 mg/kg bzw. von 560 bis 810 mg/kg. Die intravenösen LD50-Werte bei diesen Spezies betrugen 60 bzw. 38 mg/kg. Die orale LD50 bei Hunden liegt vermutlich über 50 mg/kg, während bei Affen bei 360 mg/kg eine Letalität beobachtet wurde.
Die toxische Dosis beim Menschen ist nicht bekannt. Aufgrund des umfangreichen Metabolismus können die Blutspiegel nach einer Standarddosis von Diltiazem um mehr als das Zehnfache schwanken, was die Nützlichkeit der Blutspiegel in Fällen von Überdosierung einschränkt.
Es liegen Berichte über eine Überdosierung von Diltiazem in Mengen von
Zu den nach einer Diltiazem-Überdosierung beobachteten Ereignissen gehörten Bradykardie, Hypotonie, Herzblock und Herzinsuffizienz. In den meisten Berichten über Überdosierung wurde eine unterstützende medizinische Maßnahme und/oder medikamentöse Behandlung beschrieben. Bradykardie sprach häufig positiv auf Atropin an, ebenso wie Herzblock, obwohl Herzschrittmacher auch häufig zur Behandlung von Herzblock verwendet wurde. Flüssigkeiten und Vasopressoren wurden verwendet, um den Blutdruck aufrechtzuerhalten, und bei Herzinsuffizienz wurden Inotropika verabreicht. Darüber hinaus erhielten einige Patienten eine Behandlung mit Beatmungsunterstützung, Magenspülung, Aktivkohle und/oder intravenösem Kalzium.
Die Wirksamkeit der intravenösen Verabreichung von Calcium zur Aufhebung der pharmakologischen Wirkungen einer Diltiazem-Überdosierung war widersprüchlich. In einigen wenigen gemeldeten Fällen reagierte eine Überdosierung mit Calciumkanalblockern in Verbindung mit Hypotonie und Bradykardie, die anfänglich auf Atropin nicht ansprach, besser auf Atropin, nachdem die Patienten intravenös Calcium erhalten hatten. In einigen Fällen wurde Calcium intravenös verabreicht (1 g Calciumchlorid oder 3 g Calciumgluconat) über 5 Minuten und bei Bedarf alle 10 bis 20 Minuten wiederholt. Calciumgluconat wurde auch als kontinuierliche Infusion mit einer Rate von 2 g pro Stunde über 10 Stunden verabreicht. Kalziuminfusionen für 24 Stunden oder länger können erforderlich sein. Die Patienten sollten auf Anzeichen einer Hyperkalzämie überwacht werden.
Im Falle einer Überdosierung oder eines übertriebenen Ansprechens sollten zusätzlich zur gastrointestinalen Dekontamination geeignete unterstützende Maßnahmen ergriffen werden. Diltiazem scheint nicht durch Peritoneal- oder Hämodialyse entfernt zu werden. Begrenzte Daten deuten darauf hin, dass eine Plasmapherese oder Aktivkohle-Hämoperfusion die Elimination von Diltiazem nach einer Überdosierung beschleunigen kann. Basierend auf den bekannten pharmakologischen Wirkungen von Diltiazem und/oder berichteten klinischen Erfahrungen können die folgenden Maßnahmen in Betracht gezogen werden:
Bradykardie: Atropin verabreichen (0,6 bis 1 mg). Wenn keine Reaktion auf die Vagusblockade erfolgt, Isoproterenol vorsichtig verabreichen.
Hochgradiger AV-Block: Behandlung wie oben für Bradykardie. Ein fixierter hochgradiger AV-Block sollte mit Herzschrittmachern behandelt werden.
Herzversagen: Verabreichen Sie inotrope Mittel (Isoproterenol, Dopamin oder Dobutamin) und Diuretika.
Hypotonie: Vasopressoren (z. B. Dopamin oder Noradrenalin).
Die tatsächliche Behandlung und Dosierung sollte von der Schwere der klinischen Situation und dem Urteilsvermögen und der Erfahrung des behandelnden Arztes abhängen.
KONTRAINDIKATIONEN
Diltiazem ist kontraindiziert bei (1) Patienten mit Sick-Sinus-Syndrom, außer in Gegenwart eines funktionierenden ventrikulären Schrittmachers, (2) Patienten mit AV-Block zweiten oder dritten Grades, außer in Gegenwart eines funktionierenden ventrikulären Schrittmachers, (3) Patienten mit Hypotonie (weniger als 90 mm Hg systolisch), (4) Patienten, die eine Überempfindlichkeit gegenüber dem Medikament gezeigt haben, und (5) Patienten mit akutem Myokardinfarkt und Lungenstauung, dokumentiert durch Röntgenaufnahmen bei der Aufnahme.
KLINISCHE PHARMAKOLOGIE
Es wird angenommen, dass die therapeutische Wirkung von Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) mit seiner Fähigkeit zusammenhängt, den zellulären Einstrom von Calciumionen während der Membrandepolarisation der glatten Herz- und Gefäßmuskulatur zu hemmen.
Wirkmechanismen
Hypertonie
Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) entfaltet seine antihypertensive Wirkung hauptsächlich durch Entspannung der glatten Gefäßmuskulatur und der daraus resultierenden Abnahme des peripheren Gefäßwiderstands. Das Ausmaß der Blutdrucksenkung hängt mit dem Grad der Hypertonie zusammen; so erleben Hypertoniker eine antihypertensive Wirkung, während bei Normotonikern nur eine geringe Blutdrucksenkung eintritt.
Angina
Es wurde gezeigt, dass Diltiazem-Hydrochlorid-Kapseln mit verlängerter Wirkstofffreisetzung USP (Einmal-Tages-Dosierung) zu einer Erhöhung der Belastungstoleranz führt, wahrscheinlich aufgrund seiner Fähigkeit, den myokardialen Sauerstoffbedarf zu reduzieren. Dies wird durch eine Verringerung der Herzfrequenz und des systemischen Blutdrucks bei submaximaler und maximaler Arbeitsbelastung erreicht. Es wurde gezeigt, dass Diltiazem ein potenter Dilatator der Koronararterien ist, sowohl epikardial als auch subendokardial. Spontane und ergonovininduzierte Koronararterienspasmen werden durch Diltiazem gehemmt.
In Tiermodellen stört Diltiazem den langsamen (depolarisierenden) Strom in erregbarem Gewebe. Es verursacht eine Erregungs-Kontraktions-Entkopplung in verschiedenen myokardialen Geweben ohne Änderungen in der Konfiguration des Aktionspotentials. Diltiazem bewirkt eine Relaxation der glatten Muskulatur der Koronargefäße und eine Dilatation sowohl der großen als auch der kleinen Koronararterien bei Arzneistoffspiegeln, die wenig oder keine negative inotrope Wirkung hervorrufen. Die resultierende Zunahme des koronaren Blutflusses (epikardial und subendokardial) tritt in ischämischen und nicht-ischämischen Modellen auf und wird von einer dosisabhängigen Abnahme des systemischen Blutdrucks und einer Abnahme des peripheren Widerstands begleitet.
Hämodynamische und elektrophysiologische Wirkungen
Wie andere Calciumkanalantagonisten verringert Diltiazem die sinuatriale und atrioventrikuläre Überleitung in isolierten Geweben und hat in isolierten Präparaten eine negativ inotrope Wirkung. Beim intakten Tier ist bei höheren Dosen eine Verlängerung des AH-Intervalls zu sehen.
Beim Menschen beugt Diltiazem spontanen und durch Ergonomie hervorgerufenen Spasmen der Koronararterien vor. Es verursacht eine Abnahme des peripheren Gefäßwiderstands und einen mäßigen Abfall des Blutdrucks bei normotensiven Personen und reduziert in Belastungstoleranzstudien bei Patienten mit ischämischer Herzkrankheit das Herzfrequenz-Blutdruck-Produkt für jede gegebene Arbeitsbelastung. Bisherige Studien, vor allem bei Patienten mit guter Ventrikelfunktion, haben keine Hinweise auf eine negativ inotrope Wirkung ergeben; Herzzeitvolumen, Ejektionsfraktion und linksventrikulärer enddiastolischer Druck wurden nicht beeinflusst. Solche Daten haben keinen prädiktiven Wert in Bezug auf Wirkungen bei Patienten mit schlechter Ventrikelfunktion, und bei Patienten mit vorbestehender Beeinträchtigung der Ventrikelfunktion wurde über vermehrte Herzinsuffizienz berichtet. Bisher liegen nur wenige Daten zur Wechselwirkung von Diltiazem und Betablockern bei Patienten mit eingeschränkter Ventrikelfunktion vor. Die Ruheherzfrequenz wird normalerweise durch Diltiazem leicht reduziert.
Bei Patienten mit Bluthochdruck erzeugt Diltiazemhydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) sowohl im Liegen als auch im Stehen blutdrucksenkende Wirkungen. In einer doppelblinden, parallelen Dosis-Wirkungs-Studie mit Dosen im Bereich von 90 bis 540 mg einmal täglich senkte Diltiazemhydrochlorid-Retardkapsel (Einmal-Tages-Dosierung) den diastolischen Blutdruck im Liegen auf eine offensichtlich lineare Weise über den gesamten Zeitraum Dosisbereich untersucht. Die Veränderungen des diastolischen Blutdrucks, gemessen am Talwert, für Placebo, 90 mg, 180 mg, 360 mg und 540 mg betrugen -2,9, -4,5, -6,1, -9,5 bzw. -10,5 mmHg. Posturale Hypotonie wird selten bemerkt, wenn man plötzlich eine aufrechte Position einnimmt. Mit den chronischen blutdrucksenkenden Wirkungen ist keine Reflextachykardie verbunden. Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) verringert den Gefäßwiderstand, erhöht das Herzzeitvolumen (durch Erhöhung des Schlagvolumens); und erzeugt eine leichte Abnahme oder keine Änderung der Herzfrequenz. Bei dynamischer Belastung wird ein Anstieg des diastolischen Drucks gehemmt, während der maximal erreichbare systolische Druck normalerweise reduziert wird. Eine chronische Therapie mit Diltiazemhydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) führt zu keiner Veränderung oder einem Anstieg der Plasma-Katecholamine. Es wurde keine erhöhte Aktivität der Renin-Angiotensin-Aldosteron-Achse beobachtet. Diltiazem-Hydrochlorid-Retardkapseln USP (Einmal-Tages-Dosierung) reduzieren die renalen und peripheren Wirkungen von Angiotensin II. Hypertensive Tiermodelle sprechen auf Diltiazem mit einer Senkung des Blutdrucks und einer erhöhten Urinausscheidung und Natriurese an, ohne dass sich das Natrium/Kalium-Verhältnis im Urin ändert.
In einer doppelblinden, parallelen Dosis-Wirkungs-Studie mit Dosen von 60 mg bis 480 mg einmal täglich verlängerte Diltiazemhydrochlorid-Retardkapsel (Einmal-Tages-Dosierung) die Zeit bis zum Ende des Trainings linear über die gesamte Dosis Bereich untersucht. Die Verbesserung der Zeit bis zur Beendigung der Belastung unter Verwendung eines Bruce-Belastungsprotokolls, gemessen am Tiefpunkt, für Placebo, 60 mg, 120 mg, 240 mg, 360 mg und 480 mg betrug 29, 40, 56, 51, 69 und 68 Sekunden , beziehungsweise. Als die Dosen von Diltiazemhydrochlorid-Retardkapseln (Einmal-Tages-Dosierung) erhöht wurden, nahm die Gesamthäufigkeit von Angina ab. Diltiazemhydrochlorid-Retardkapsel (einmal täglich), 180 mg einmal täglich, oder Placebo wurde in einer doppelblinden Studie an Patienten verabreicht, die gleichzeitig mit langwirksamen Nitraten und/oder Betablockern behandelt wurden. Es wurde eine signifikante Verlängerung der Zeit bis zur Beendigung der Belastung und eine signifikante Abnahme der Gesamthäufigkeit von Angina pectoris beobachtet. In dieser Studie war die Gesamthäufigkeit von unerwünschten Ereignissen in der Behandlungsgruppe mit Diltiazemhydrochlorid-Retardkapseln (einmal tägliche Dosierung) dieselbe wie in der Placebogruppe.
Intravenöses Diltiazem in Dosen von 20 mg verlängert die AH-Überleitungszeit und die funktionellen und effektiven Refraktärzeiten des AV-Knotens um etwa 20 %. In einer Studie mit oralen Einzeldosen von 300 mg Diltiazemhydrochlorid bei sechs gesunden Probanden betrug die durchschnittliche maximale PR-Verlängerung 14 % ohne Fälle von AV-Block höheren Grades als 1. Grad. Die Diltiazem-assoziierte Verlängerung des AH-Intervalls ist bei Patienten mit Herzblock ersten Grades nicht stärker ausgeprägt. Bei Patienten mit Sick-Sinus-Syndrom verlängert Diltiazem die Dauer des Sinuszyklus signifikant (in einigen Fällen um bis zu 50 %).
Die chronische orale Verabreichung von Diltiazemhydrochlorid an Patienten in Dosen von bis zu 540 mg/Tag hat zu einer geringfügigen Verlängerung des PR-Intervalls und gelegentlich zu einer abnormalen Verlängerung geführt (siehe WARNUNGEN ).
Pharmakokinetik und Stoffwechsel
Diltiazem wird aus dem Gastrointestinaltrakt gut resorbiert und unterliegt einem umfangreichen First-Pass-Effekt, was eine absolute Bioverfügbarkeit (im Vergleich zur intravenösen Verabreichung) von etwa 40 % ergibt. Diltiazem unterliegt einem intensiven Metabolismus, bei dem nur 2 % bis 4 % des unveränderten Arzneimittels im Urin erscheinen. Arzneimittel, die hepatische mikrosomale Enzyme induzieren oder hemmen, können die Disposition von Diltiazem verändern.
Die Messung der Gesamtradioaktivität nach kurzer intravenöser Verabreichung bei gesunden Freiwilligen lässt auf das Vorhandensein anderer nicht identifizierter Metaboliten schließen, die höhere Konzentrationen erreichen als die von Diltiazem und langsamer ausgeschieden werden; Die Halbwertszeit der Gesamtradioaktivität beträgt etwa 20 Stunden im Vergleich zu 2 bis 5 Stunden bei Diltiazem.
In-vitro-Bindungsstudien zeigen, dass Diltiazem zu 70 % bis 80 % an Plasmaproteine gebunden ist. Kompetitive In-vitro-Ligandenbindungsstudien haben auch gezeigt, dass die Diltiazem-Bindung durch therapeutische Konzentrationen von Digoxin, Hydrochlorothiazid, Phenylbutazon, Propranolol, Salicylsäure oder Warfarin nicht verändert wird. Die Plasmaeliminationshalbwertszeit nach einmaliger oder mehrfacher Verabreichung des Arzneimittels beträgt etwa 3,0 bis 4,5 Stunden. Desacetyl-Diltiazem ist auch im Plasma in Konzentrationen von 10 % bis 20 % des Ausgangsarzneimittels vorhanden und ist als koronarer Vasodilatator 25 % bis 50 % so wirksam wie Diltiazem. Therapeutische Mindestkonzentrationen von Diltiazem im Plasma scheinen im Bereich von 50 bis 200 ng/ml zu liegen. Es gibt eine Abweichung von der Linearität, wenn die Dosisstärken erhöht werden; die Halbwertszeit wird mit der Dosis leicht erhöht. Eine Studie, in der Patienten mit normaler Leberfunktion mit Patienten mit Zirrhose verglichen wurden, ergab eine Verlängerung der Halbwertszeit und eine Erhöhung der Bioverfügbarkeit um 69 % bei Patienten mit eingeschränkter Leberfunktion. Eine einzelne Studie an neun Patienten mit stark eingeschränkter Nierenfunktion zeigte keinen Unterschied im pharmakokinetischen Profil von Diltiazem im Vergleich zu Patienten mit normaler Nierenfunktion.
Diltiazem-Hydrochlorid-Kapseln mit verlängerter Wirkstofffreisetzung (Einmal-Tages-Dosierung)
Im Vergleich zu einer Behandlung mit Diltiazem-Tabletten im Steady-State werden mehr als 95 % des Wirkstoffs aus der Formulierung mit Diltiazem-Hydrochlorid-Retardkapseln (Einmal-Tages-Dosierung) resorbiert. Eine Einzeldosis von 360 mg der Kapsel führt zu nachweisbaren Plasmaspiegeln innerhalb von 2 Stunden und zu Spitzenplasmaspiegeln zwischen 10 und 14 Stunden; Die Resorption erfolgt während des gesamten Dosierungsintervalls. Bei gleichzeitiger Einnahme von Diltiazemhydrochlorid-Retardkapseln (Einmal-Tages-Dosierung) mit einem fettreichen Frühstück wurde das Ausmaß der Resorption von Diltiazem nicht beeinflusst. Ein Dose Dumping findet nicht statt. Die scheinbare Eliminationshalbwertszeit nach Einzel- oder Mehrfachgabe beträgt 5 bis 8 Stunden. Eine Abweichung von der Linearität ähnlich der bei Diltiazem-Tabletten und Diltiazem-Hydrochlorid-Kapseln (zweimal täglich) wird beobachtet. Wenn die Dosis von Diltiazemhydrochlorid-Retardkapseln (Einmal-Tages-Dosierung) von einer Tagesdosis von 120 mg auf 240 mg erhöht wird, erhöht sich die Fläche unter der Kurve um das 2,7-fache. Wenn die Dosis von 240 mg auf 360 mg erhöht wird, erhöht sich die Fläche unter der Kurve um das 1,6-fache.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN und VORSICHTSMASSNAHMEN Abschnitte.