Lanoxin 0.25mg Digoxin Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Lanoxin und wie wird es angewendet?
Lanoxin 0,25 mg ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Vorhofflimmern und Herzinsuffizienz. Lanoxin 0,25 mg kann allein oder mit anderen Medikamenten verwendet werden.
Lanoxin gehört zu einer Klasse von Medikamenten namens Antidysrhythmika, V, Inotropika.
Was sind die möglichen Nebenwirkungen von Lanoxin 0,25 mg?
Lanoxin kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Lanoxin sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Lanoxin. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
BEZEICHNUNG
LANOXIN (Digoxin) ist eines der Herz- (oder Digitalis-) Glykoside, eine eng verwandte Gruppe von Arzneimitteln, die gemeinsame spezifische Wirkungen auf das Myokard haben. Diese Medikamente kommen in einer Reihe von Pflanzen vor. Digoxin wird aus den Blättern von Digitalis lanata gewonnen. Der Begriff „Digitalis“ wird verwendet, um die gesamte Gruppe der Glykoside zu bezeichnen. Die Glykoside bestehen aus 2 Teilen: einem Zucker und einem Cardenolid (daher „Glykoside“).
Digoxin wird chemisch als (3β,5β,12β)-3-[(O-2,6-Didesoxy-β-D-ribo-hexopyranosyl-(1→4)-O-2,6-didesoxy-β-D) beschrieben -ribo-Hexopyranosyl-(1→4)-2,6-didesoxy-β-D-ribohexopyranosyl)oxy]-12,14-dihydroxy-card-20(22)-enolid. Seine Summenformel ist C41H64O14, sein Molekulargewicht ist 780,95 und seine Strukturformel ist:
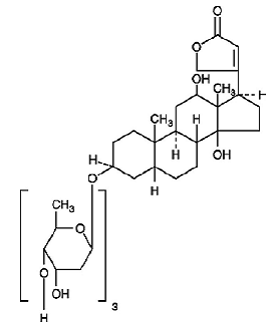
Digoxin liegt als geruchlose weiße Kristalle vor, die unter Zersetzung über 230 °C schmelzen. Das Medikament ist in Wasser und Äther praktisch unlöslich; leicht löslich in verdünntem (50 %) Alkohol und in Chloroform; und frei löslich in Pyridin.
LANOXIN 0,25 mg Injektion und Injektion Kinder sind sterile Lösungen von Digoxin zur intravenösen oder intramuskulären Injektion. Das Vehikel enthält 40 % Propylenglykol und 10 % Alkohol. Die Injektion wird mit 0,17 % dibasischem Natriumphosphat und 0,08 % wasserfreier Citronensäure auf einen pH-Wert von 6,8–7,2 gepuffert. Jede 2-ml-Ampulle LANOXIN 0,25 mg zur Injektion enthält 500 µg (0,5 mg) Digoxin (250 µg [0,25 mg] pro ml). Eine Verdünnung ist nicht erforderlich. Jede 1-ml-Ampulle LANOXIN 0,25 mg Injektion Kinder enthält 100 µg (0,1 mg) Digoxin. Eine Verdünnung ist nicht erforderlich.
INDIKATIONEN
Herzinsuffizienz bei Erwachsenen
LANOXIN 0,25 mg ist angezeigt zur Behandlung von leichter bis mittelschwerer Herzinsuffizienz bei Erwachsenen. LANOXIN erhöht die linksventrikuläre Ejektionsfraktion und verbessert die Symptome der Herzinsuffizienz, was sich in einer verbesserten körperlichen Leistungsfähigkeit und weniger Krankenhauseinweisungen und Notfallversorgung im Zusammenhang mit Herzinsuffizienz zeigt, während es keinen Einfluss auf die Sterblichkeit hat. Wenn möglich, sollte LANOXIN 0,25 mg in Kombination mit einem Diuretikum und einem Angiotensin-Converting-Enzym (ACE)-Hemmer angewendet werden.
Herzinsuffizienz bei pädiatrischen Patienten
LANOXIN erhöht die myokardiale Kontraktilität bei pädiatrischen Patienten mit Herzinsuffizienz.
Vorhofflimmern bei Erwachsenen
LANOXIN ist angezeigt zur Kontrolle der ventrikulären Ansprechrate bei erwachsenen Patienten mit chronischem Vorhofflimmern.
DOSIERUNG UND ANWENDUNG
Wichtige Dosierungs- und Verabreichungsinformationen
Bei der Auswahl eines Dosierungsschemas für LANOXIN 0,25 mg ist es wichtig, Faktoren zu berücksichtigen, die die Digoxin-Blutspiegel beeinflussen (z. B. Körpergewicht, Alter, Nierenfunktion, begleitende Arzneimittel), da die toxischen Digoxinspiegel nur geringfügig höher sind als die therapeutischen Spiegel. Die Dosierung kann entweder mit einer Aufsättigungsdosis gefolgt von einer Erhaltungsdosis eingeleitet werden, wenn eine schnelle Titration gewünscht wird, oder mit einer Erhaltungsdosis ohne Aufsättigungsdosis eingeleitet werden.
Die parenterale Verabreichung von Digoxin sollte nur verwendet werden, wenn eine schnelle Digitalisierung dringend erforderlich ist oder wenn das Medikament nicht oral eingenommen werden kann. Die intramuskuläre Injektion kann zu starken Schmerzen an der Injektionsstelle führen, daher wird die intravenöse Verabreichung bevorzugt. Wenn das Arzneimittel intramuskulär verabreicht werden muss, sollte es tief in den Muskel injiziert und anschließend massiert werden. Bei Erwachsenen sollten nicht mehr als 500 Mikrogramm LANOXIN 0,25 mg zur Injektion an einer einzigen Stelle injiziert werden. Bei pädiatrischen Patienten sollten nicht mehr als 200 µg LANOXIN 0,25 mg Injection Pediatric an einer einzigen Injektionsstelle injiziert werden.
Verabreichen Sie die Dosis über einen Zeitraum von 5 Minuten oder länger und vermeiden Sie eine Bolusgabe, um eine systemische und koronare Vasokonstriktion zu verhindern. Das Mischen von LANOXIN 0,25 mg zur Injektion und Injektion für Kinder mit anderen Arzneimitteln im selben Behältnis oder die gleichzeitige Verabreichung über denselben intravenösen Zugang wird nicht empfohlen.
LANOXIN 0,25 mg zur Injektion und Injektion für Kinder kann unverdünnt oder mit einem 4-fachen oder höheren Volumen an sterilem Wasser zur Injektion, 0,9 % Natriumchlorid-Injektion oder 5 % Dextrose-Injektion verdünnt verabreicht werden. Die Verwendung von weniger als dem 4-fachen Volumen an Verdünnungsmittel könnte zu einer Ausfällung des Digoxins führen. Die sofortige Anwendung des verdünnten Produkts wird empfohlen.
Wenn Tuberkulinspritzen zum Abmessen sehr kleiner Dosen verwendet werden, spülen Sie nicht mit der parenteralen Lösung, nachdem der Inhalt in einen Gefäßverweilkatheter ausgestoßen wurde, um eine Überdosierung von Digoxin zu vermeiden.
Erwägen Sie eine Unterbrechung oder Reduzierung der LANOXIN-Dosis vor der elektrischen Kardioversion [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Laden des Dosierungsschemas bei Erwachsenen und pädiatrischen Patienten
Erhaltungsdosierung bei Erwachsenen und Kindern über 10 Jahren
Die Erhaltungsdosis basiert auf dem mageren Körpergewicht, der Nierenfunktion, dem Alter und den Begleitprodukten [siehe KLINISCHE PHARMAKOLOGIE ].
Die empfohlenen Anfangserhaltungsdosen für Erwachsene und pädiatrische Patienten über 10 Jahre mit normaler Nierenfunktion sind in Tabelle 2 angegeben. Die Dosen können je nach klinischem Ansprechen, Wirkstoffspiegel im Serum und Toxizität alle 2 Wochen erhöht werden.
Tabelle 3 zeigt die empfohlene Erhaltungsdosis (einmal täglich) für Erwachsene und Kinder über 10 Jahre (einmal täglich zu verabreichen) entsprechend dem mageren Körpergewicht und der Nierenfunktion. Die Dosierungen basieren auf Studien an erwachsenen Patienten mit Herzinsuffizienz. Alternativ kann die Erhaltungsdosis anhand der folgenden Formel geschätzt werden (maximale Körperspeicher, die jeden Tag durch Ausscheidung verloren gehen):
Gesamterhaltungsdosis = Ladedosis (d. h. maximale Körperspeicherung) x % täglicher Verlust/100 (% täglicher Verlust = 14 + Kreatinin-Clearance/5)
Reduzieren Sie die LANOXIN-Dosis bei Patienten, deren Magergewicht aufgrund von Fettleibigkeit oder Ödemen einen ungewöhnlich geringen Bruchteil ihrer Gesamtkörpermasse ausmacht.
Erhaltungsdosierung bei pädiatrischen Patienten unter 10 Jahren
Die Anfangserhaltungsdosis bei Herzinsuffizienz bei pädiatrischen Patienten unter 10 Jahren basiert auf magerem Körpergewicht, Nierenfunktion, Alter und begleitenden Arzneimitteln [siehe KLINISCHE PHARMAKOLOGIE ]. Die empfohlenen Anfangserhaltungsdosen für pädiatrische Patienten sind in Tabelle 4 angegeben. Diese Empfehlungen gehen von einer normalen Nierenfunktion aus.
Tabelle 5 zeigt die durchschnittliche tägliche Erhaltungsdosis für pädiatrische Patienten unter 10 Jahren (zweimal täglich zu verabreichen) mit Herzinsuffizienz, basierend auf Alter, magerem Körpergewicht und Nierenfunktion.
Überwachung zur Beurteilung von Sicherheit, Wirksamkeit und therapeutischen Blutspiegeln
Auf Anzeichen und Symptome von Digoxin-Toxizität und klinischem Ansprechen überwachen. Passen Sie die Dosis basierend auf Toxizität, Wirksamkeit und Blutspiegeln an.
Digoxinspiegel im Serum von weniger als 0,5 ng/ml wurden mit einer verminderten Wirksamkeit in Verbindung gebracht, während Spiegel über 2 ng/ml mit einer erhöhten Toxizität ohne erhöhten Nutzen in Verbindung gebracht wurden.
Interpretieren Sie die Serum-Digoxin-Konzentration im klinischen Gesamtkontext und verwenden Sie keine isolierte Messung der Serum-Digoxin-Konzentration als Grundlage für die Erhöhung oder Verringerung der LANOXIN-Dosis. Serum-Digoxin-Konzentrationen können durch endogene Digoxin-ähnliche Substanzen fälschlicherweise erhöht werden [vgl WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Wenn der Assay empfindlich auf diese Substanzen reagiert, erwägen Sie, vor Beginn der Behandlung mit LANOXIN einen Ausgangswert für Digoxin zu erhalten und die Werte nach der Behandlung um den angegebenen Ausgangswert zu korrigieren.
Serum-Digoxin-Konzentrationen unmittelbar vor der nächsten planmäßigen LANOXIN 0,25 mg-Dosis oder mindestens 6 Stunden nach der letzten Dosis erhalten. Die Digoxinkonzentration ist wahrscheinlich 10-25 % niedriger, wenn eine Probe direkt vor der nächsten Dosis (24 Stunden nach der Einnahme) genommen wird, verglichen mit einer Probenahme 8 Stunden nach der Einnahme (bei einmal täglicher Gabe). Es gibt jedoch nur geringfügige Unterschiede in den Digoxinkonzentrationen bei zweimal täglicher Dosierung, unabhängig davon, ob die Probenahme 8 oder 12 Stunden nach einer Dosis erfolgt.
Umstellung von intravenösem Digoxin auf orales Digoxin
Beim Wechsel von intravenösen zu oralen Digoxin-Formulierungen berücksichtigen Sie Unterschiede in der Bioverfügbarkeit bei der Berechnung der Erhaltungsdosierungen (siehe Tabelle 6).
WIE GELIEFERT
Darreichungsformen und Stärken
LANOXIN-Injektion: Ampullen mit 500 µg (0,5 mg) in 2 ml (250 µg [0,25 mg] pro 1 ml).
LANOXIN 0,25 mg Injektion Kinder: Ampullen mit 100 mcg (0,1 mg) in 1 ml.
Lagerung und Handhabung
LANOXIN (Digoxin) Injektion, 500 µg (0,5 mg) in 2 ml (250 µg [0,25 mg] pro ml); Schachtel mit 10 Ampullen ( NDC 70515 260 10)
LANOXIN (Digoxin) Injektion Kinder, 100 mcg (0,1 mg) in 1 ml; Schachtel mit 10 Ampullen ( NDC 70515 262 10)
Bei 25 °C (77 °F) lagern; Abweichungen bis 15 °C bis 30 °C (59 °F bis 86 °F) zulässig [siehe USP Controlled Room Temperature] und vor Licht schützen.
Hergestellt für: Covis Pharma, Zug, 6300 Schweiz. Überarbeitet im August 2018
NEBENWIRKUNGEN
Die folgenden Nebenwirkungen sind im Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“ des Etiketts ausführlicher aufgeführt:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Im Allgemeinen sind die Nebenwirkungen von LANOXIN 0,25 mg dosisabhängig und treten bei Dosen auf, die höher sind als zur Erzielung einer therapeutischen Wirkung erforderlich. Daher sind Nebenwirkungen weniger häufig, wenn LANOXIN 0,25 mg innerhalb des empfohlenen Dosisbereichs verwendet wird, innerhalb des therapeutischen Serumkonzentrationsbereichs gehalten wird und wenn sorgfältig auf gleichzeitige Medikationen und Erkrankungen geachtet wird.
In der DIG-Studie (einer Studie zur Untersuchung der Wirkung von Digoxin auf Mortalität und Morbidität bei Patienten mit Herzinsuffizienz) betrug die Inzidenz von Krankenhauseinweisungen wegen Verdachts auf Digoxin-Toxizität 2 % bei Patienten, die LANOXIN einnahmen, verglichen mit 0,9 % bei Patienten, die Placebo einnahmen [siehe Klinische Studien ].
Die Gesamthäufigkeit von Nebenwirkungen mit Digoxin wurde mit 5–20 % angegeben, wobei 15–20 % der Nebenwirkungen als schwerwiegend eingestuft wurden. Herztoxizität macht etwa die Hälfte, Magen-Darm-Störungen etwa ein Viertel und ZNS- und andere Toxizität etwa ein Viertel dieser unerwünschten Ereignisse aus.
Magen-Darm
Zusätzlich zu Übelkeit und Erbrechen wurde die Anwendung von Digoxin mit Bauchschmerzen, intestinaler Ischämie und hämorrhagischer Nekrose des Darms in Verbindung gebracht.
ZNS
Digoxin kann Kopfschmerzen, Schwäche, Schwindel, Apathie, Verwirrtheit und psychische Störungen (wie Angstzustände, Depressionen, Delirium und Halluzinationen) verursachen.
Sonstiges
Gynäkomastie wurde gelegentlich nach längerer Anwendung von Digoxin beobachtet. Selten wurden Thrombozytopenie und makulopapulöser Ausschlag sowie andere Hautreaktionen beobachtet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Digoxin hat eine enge therapeutische Breite, daher ist eine verstärkte Überwachung der Digoxinkonzentrationen im Serum und auf mögliche Anzeichen und Symptome einer klinischen Toxizität erforderlich, wenn Medikamente, die mit Digoxin interagieren können, begonnen, angepasst oder abgesetzt werden. Verschreibende Ärzte sollten die Verschreibungsinformationen aller Arzneimittel konsultieren, die zusammen mit Digoxin verschrieben werden, um Informationen zu möglichen Arzneimittelwechselwirkungen zu erhalten.
P-Glykoprotein (PGP) Induktoren/Inhibitoren
Digoxin ist ein Substrat von P-Glykoprotein auf der Ebene der Darmabsorption, des renalen Tubulusabschnitts und der Gallen-Darm-Sekretion. Daher haben Arzneimittel, die P-Glykoprotein induzieren/inhibieren, das Potenzial, die Pharmakokinetik von Digoxin zu verändern.
Pharmakokinetische Arzneimittelwechselwirkungen
Pharmakokinetische Wechselwirkungen wurden hauptsächlich bei gleichzeitiger oraler Gabe von Digoxin beobachtet und berichtet. Es gibt nur sehr wenige Studien, die die Arzneimittelwechselwirkung untersucht haben, wenn Digoxin intravenös verabreicht wird. Das Ausmaß der Veränderung der Digoxin-Exposition bei intravenöser Verabreichung ist im Allgemeinen geringer als bei oraler Verabreichung. Die folgende Tabelle enthält verfügbare Interaktionsdaten unter Verwendung von Digoxin IV-Formulierung (NA bedeutet nicht verfügbar).
Potenziell signifikante pharmakodynamische Arzneimittelwechselwirkungen
Aufgrund der beträchtlichen Variabilität der pharmakodynamischen Wechselwirkungen sollte die Dosierung von Digoxin individualisiert werden, wenn Patienten diese Medikamente gleichzeitig erhalten.
Arzneimittel-/Labortest-Wechselwirkungen
Körpereigene Substanzen unbekannter Zusammensetzung (Digoxin-ähnliche immunreaktive Substanzen [DLIS]) können Standard-Radioimmunoassays für Digoxin stören. Die Interferenz führt meistens dazu, dass die Ergebnisse falsch positiv oder falsch erhöht sind, aber manchmal führt sie dazu, dass die Ergebnisse falsch reduziert werden. Einige Assays unterliegen diesen Mängeln stärker als andere. Es stehen mehrere LC/MS/MS-Methoden zur Verfügung, die möglicherweise weniger anfällig für DLIS-Interferenzen sind. DLIS sind bei bis zu der Hälfte aller Neugeborenen vorhanden und bei unterschiedlichen Prozentsätzen von schwangeren Frauen, Patienten mit hypertropher Kardiomyopathie, Patienten mit Nieren- oder Leberfunktionsstörung und anderen Patienten, die aus irgendeinem Grund volumenexpandiert sind. Die gemessenen DLIS-Spiegel (als Digoxin-Äquivalente) sind normalerweise niedrig (0,2–0,4 ng/ml), aber manchmal erreichen sie Werte, die als therapeutisch oder sogar toxisch angesehen würden.

In einigen Assays können Spironolacton, Canrenon und Kaliumcanrenoat bei Konzentrationen von bis zu 0,5 ng/ml fälschlicherweise als Digoxin erkannt werden. Einige Substanzen der traditionellen chinesischen und ayurvedischen Medizin wie Chan Su, Sibirischer Ginseng, Asiatischer Ginseng, Ashwagandha oder Dashen können ähnliche Störungen verursachen.
Spironolacton und DLIS sind viel stärker proteingebunden als Digoxin. Infolgedessen werden Assays der Konzentrationen von freiem Digoxin in proteinfreiem Ultrafiltrat (die tendenziell etwa 25 % niedriger sind als die Gesamtkonzentrationen, was mit dem üblichen Ausmaß der Proteinbindung übereinstimmt) durch Spironolacton oder DLIS weniger beeinflusst. Es sollte beachtet werden, dass die Ultrafiltration nicht alle Interferenzprobleme mit Alternativmedizin löst. Die Verwendung einer LC/MS/MS-Methode kann aufgrund der guten Ergebnisse, die sie liefert, insbesondere in Bezug auf Spezifität und Quantisierungsgrenze, die bessere Option sein.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Kammerflimmern bei Patienten mit akzessorischem AV-Weg (Wolff-Parkinson-White-Syndrom)
Patienten mit Wolff-Parkinson-White-Syndrom, die Vorhofflimmern entwickeln, haben ein hohes Risiko für Kammerflimmern. Die Behandlung dieser Patienten mit Digoxin führt zu einer stärkeren Verlangsamung der Überleitung im atrioventrikulären Knoten als in den akzessorischen Bahnen, und die Risiken einer schnellen ventrikulären Reaktion, die zu Kammerflimmern führt, werden dadurch erhöht.
Sinusbradykardie und sinuatrialer Block
LANOXIN kann insbesondere bei Patienten mit vorbestehender Sinusknotenerkrankung eine schwere Sinusbradykardie oder einen sinuatrialen Block und bei Patienten mit vorbestehendem unvollständigem AV-Block einen fortgeschrittenen oder vollständigen Herzblock verursachen. Erwägen Sie vor der Behandlung mit Digoxin das Einsetzen eines Herzschrittmachers.
Digoxin-Toxizität
Anzeichen und Symptome einer Digoxin-Toxizität sind Anorexie, Übelkeit, Erbrechen, Sehstörungen und Herzrhythmusstörungen [Herzblock ersten Grades, zweiten Grades (Wenckebach) oder dritten Grades (einschließlich Asystolie); atriale Tachykardie mit Block; AV-Dissoziation; beschleunigter junktionaler (Knoten-) Rhythmus; unifokale oder multiforme ventrikuläre vorzeitige Kontraktionen (insbesondere Bigeminie oder Trigeminus); ventrikuläre Tachykardie; und Kammerflimmern]. Toxizität wird normalerweise mit Digoxinspiegeln von mehr als 2 ng/ml in Verbindung gebracht, obwohl Symptome auch bei niedrigeren Spiegeln auftreten können. Niedriges Körpergewicht, fortgeschrittenes Alter oder eingeschränkte Nierenfunktion, Hypokaliämie, Hyperkalzämie oder Hypomagnesiämie können für eine Digoxin-Toxizität prädisponieren. Bestimmen Sie die Digoxinspiegel im Serum bei Patienten mit Anzeichen oder Symptomen einer Digoxintherapie und unterbrechen Sie die Dosis oder passen Sie die Dosis an, falls erforderlich [siehe NEBENWIRKUNGEN und ÜBERDOSIERUNG ]. Beurteilen Sie regelmäßig die Serumelektrolyte und die Nierenfunktion.
Die früheste und häufigste Manifestation einer Digoxin-Toxizität bei Säuglingen und Kindern ist das Auftreten von Herzrhythmusstörungen, einschließlich Sinusbradykardie. Bei Kindern kann die Anwendung von Digoxin zu Arrhythmien führen. Am häufigsten sind Leitungsstörungen oder supraventrikuläre Tachyarrhythmien, wie atriale Tachykardie (mit oder ohne Block) und junktionale (nodale) Tachykardie. Ventrikuläre Arrhythmien sind seltener. Sinusbradykardie kann ein Zeichen für eine bevorstehende Digoxin-Intoxikation sein, insbesondere bei Säuglingen, selbst wenn kein Herzblock ersten Grades vorliegt. Jede Arrhythmie oder Veränderung der Erregungsleitung des Herzens, die bei einem Kind auftritt, das Digoxin einnimmt, sollte zunächst als Folge einer Digoxin-Intoxikation angenommen werden.
Angesichts der Tatsache, dass erwachsene Patienten mit Herzinsuffizienz einige Symptome mit Digoxin-Toxizität gemeinsam haben, kann es schwierig sein, Digoxin-Toxizität von Herzinsuffizienz zu unterscheiden. Eine falsche Identifizierung ihrer Ätiologie kann den Arzt dazu veranlassen, die LANOXIN-Dosierung fortzusetzen oder zu erhöhen, wenn die Dosierung eigentlich ausgesetzt werden sollte. Wenn die Ätiologie dieser Anzeichen und Symptome nicht klar ist, messen Sie die Digoxinspiegel im Serum.
Risiko ventrikulärer Arrhythmien während der elektrischen Kardioversion
Es kann wünschenswert sein, die Dosis von LANOXIN für 1-2 Tage vor der elektrischen Kardioversion von Vorhofflimmern zu reduzieren oder abzusetzen, um die Induktion ventrikulärer Arrhythmien zu vermeiden, aber Ärzte müssen die Folgen einer Verstärkung der ventrikulären Reaktion berücksichtigen, wenn Digoxin verringert oder abgesetzt wird. Bei Verdacht auf Digitalistoxizität sollte eine elektive Kardioversion hinausgezögert werden. Wenn es nicht ratsam ist, die Kardioversion zu verzögern, sollte die niedrigstmögliche Energiestufe gewählt werden, um das Provozieren von ventrikulären Arrhythmien zu vermeiden.
Risiko einer Ischämie bei Patienten mit akutem Myokardinfarkt
LANOXIN 0,25 mg wird bei Patienten mit akutem Myokardinfarkt nicht empfohlen, da Digoxin den myokardialen Sauerstoffbedarf erhöhen und zu Ischämie führen kann.
Vasokonstriktion bei Patienten mit Myokarditis
LANOXIN 0,25 mg kann eine Vasokonstriktion auslösen und die Produktion entzündungsfördernder Zytokine fördern; Vermeiden Sie daher die Anwendung bei Patienten mit Myokarditis.
Vermindertes Herzzeitvolumen bei Patienten mit erhaltener linksventrikulärer systolischer Funktion
Bei Patienten mit Herzinsuffizienz in Verbindung mit einer erhaltenen linksventrikulären Ejektionsfraktion kann es bei der Anwendung von LANOXIN zu einer verringerten Herzleistung kommen. Solche Störungen umfassen restriktive Kardiomyopathie, konstriktive Perikarditis, Amyloid-Herzkrankheit und akutes Cor pulmonale. Bei Patienten mit idiopathischer hypertropher Subaortenstenose kann es aufgrund der inotropen Wirkung von Digoxin zu einer Verschlechterung der Ausflussobstruktion kommen. Patienten mit amyloider Herzkrankheit können bei therapeutischen Konzentrationen aufgrund einer erhöhten Bindung von Digoxin an extrazelluläre Amyloidfibrillen anfälliger für Digoxin-Toxizität sein.
LANOXIN 0,25 mg sollte bei diesen Patienten im Allgemeinen vermieden werden, obwohl es zur Kontrolle der ventrikulären Frequenz in der Untergruppe von Patienten mit Vorhofflimmern verwendet wurde.
Reduzierte Wirksamkeit bei Patienten mit Hypokalzämie
Hypokalzämie kann die Wirkung von Digoxin beim Menschen zunichte machen; daher kann Digoxin unwirksam sein, bis das Serumkalzium wieder normal ist. Diese Wechselwirkungen hängen mit der Tatsache zusammen, dass Digoxin die Kontraktilität und Erregbarkeit des Herzens ähnlich wie Calcium beeinflusst.
Veränderte Reaktion bei Schilddrüsenerkrankungen und hypermetabolischen Zuständen
Hypothyreose kann den Bedarf an Digoxin verringern.
Herzinsuffizienz und/oder atriale Arrhythmien, die aus hypermetabolischen oder hyperdynamischen Zuständen (z. B. Hyperthyreose, Hypoxie oder arteriovenöser Shunt) resultieren, werden am besten behandelt, indem die zugrunde liegende Erkrankung behandelt wird. Atriale Arrhythmien, die mit hypermetabolischen Zuständen einhergehen, sind besonders resistent gegen eine Digoxin-Behandlung. Patienten mit Beri Beri-Herzkrankheit sprechen möglicherweise nicht ausreichend auf Digoxin an, wenn der zugrunde liegende Thiaminmangel nicht gleichzeitig behandelt wird.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Digoxin zeigte in In-vitro-Studien (Ames-Test und Maus-Lymphom) kein genotoxisches Potenzial. Es liegen weder Daten zum karzinogenen Potenzial von Digoxin vor, noch wurden Studien zur Bewertung seines Potenzials zur Beeinträchtigung der Fruchtbarkeit durchgeführt.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie C
LANOXIN 0,25 mg sollte einer schwangeren Frau nur verabreicht werden, wenn dies eindeutig erforderlich ist. Es ist auch nicht bekannt, ob Digoxin bei Verabreichung an eine schwangere Frau den Fötus schädigen oder die Fortpflanzungsfähigkeit beeinträchtigen kann. Reproduktionsstudien an Tieren wurden mit Digoxin nicht durchgeführt.
Arbeit und Lieferung
Es liegen nicht genügend Daten aus klinischen Studien vor, um die Sicherheit und Wirksamkeit von Digoxin während der Wehen und der Geburt zu bestimmen.
Stillende Mutter
Studien haben gezeigt, dass sich Digoxin in der Muttermilch verteilt und dass das Konzentrationsverhältnis von Milch zu Serum etwa 0,6–0,9 beträgt. Die geschätzte Digoxin-Exposition eines Säuglings während des Stillens liegt jedoch weit unter der üblichen Säuglingserhaltungsdosis. Daher sollte diese Menge keine pharmakologische Wirkung auf den Säugling haben.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von LANOXIN bei der Kontrolle der Kammerfrequenz bei Kindern mit Vorhofflimmern wurde nicht nachgewiesen.
Die Sicherheit und Wirksamkeit von LANOXIN bei der Behandlung von Herzinsuffizienz bei Kindern wurde nicht in angemessenen und gut kontrollierten Studien nachgewiesen. In der veröffentlichten Literatur über Kinder mit Herzinsuffizienz verschiedener Ätiologien (z. B. Ventrikelseptumdefekt, Anthrazyklin-Toxizität, offener Ductus arteriosus) wurde die Behandlung mit Digoxin jedoch mit Verbesserungen der hämodynamischen Parameter und der klinischen Anzeichen und Symptome in Verbindung gebracht.
Neugeborene zeigen eine beträchtliche Variabilität in ihrer Toleranz gegenüber Digoxin. Früh- und Unreifgeborene reagieren besonders empfindlich auf die Wirkung von Digoxin, und die Dosierung des Medikaments muss nicht nur reduziert, sondern ihrem Reifegrad entsprechend individualisiert werden.
Geriatrische Verwendung
Die Mehrzahl der mit Digoxin gewonnenen klinischen Erfahrungen wurde bei älteren Patienten gemacht. Diese Erfahrung hat keine Unterschiede im Ansprechen oder bei Nebenwirkungen zwischen älteren und jüngeren Patienten festgestellt. Es ist jedoch bekannt, dass dieses Medikament im Wesentlichen über die Nieren ausgeschieden wird, und das Risiko toxischer Reaktionen auf dieses Medikament kann bei Patienten mit eingeschränkter Nierenfunktion größer sein. Da ältere Patienten eher eine eingeschränkte Nierenfunktion haben, sollte die Dosis sorgfältig ausgewählt werden, die auf der Nierenfunktion basieren sollte, und es kann sinnvoll sein, die Nierenfunktion zu überwachen [siehe DOSIERUNG UND ANWENDUNG ].
Nierenfunktionsstörung
Die Clearance von Digoxin kann primär mit der Nierenfunktion korreliert werden, wie durch die Kreatinin-Clearance angezeigt wird. Die Tabellen 3 und 5 geben die üblichen täglichen Erhaltungsdosisanforderungen für Digoxin basierend auf der Kreatinin-Clearance an [vgl DOSIERUNG UND ANWENDUNG ].
Digoxin wird hauptsächlich über die Nieren ausgeschieden; daher benötigen Patienten mit eingeschränkter Nierenfunktion geringere Digoxin-Erhaltungsdosen als üblich [vgl DOSIERUNG UND ANWENDUNG ]. Aufgrund der verlängerten Eliminationshalbwertszeit ist bei Patienten mit eingeschränkter Nierenfunktion ein längerer Zeitraum erforderlich, um eine anfängliche oder neue Steady-State-Serumkonzentration zu erreichen, als bei Patienten mit normaler Nierenfunktion. Wenn die Dosis von Digoxin nicht angemessen reduziert wird, besteht bei solchen Patienten ein hohes Toxizitätsrisiko, und die toxischen Wirkungen halten bei diesen Patienten länger an als bei Patienten mit normaler Nierenfunktion.
Leberfunktionsstörung
Plasmakonzentrationen von Digoxin bei Patienten mit akuter Hepatitis fallen im Allgemeinen in den Profilbereich einer Gruppe gesunder Probanden.
Malabsorption
Die Resorption von Digoxin ist bei einigen Malabsorptionszuständen wie chronischem Durchfall verringert.
ÜBERDOSIS
Anzeichen und Symptome bei Erwachsenen und Kindern
Die Anzeichen und Symptome der Toxizität ähneln im Allgemeinen den zuvor beschriebenen [siehe NEBENWIRKUNGEN ], kann aber häufiger und schwerer sein. Anzeichen und Symptome einer Digoxin-Toxizität werden bei Konzentrationen über 2 ng/ml häufiger. Bei der Entscheidung, ob die Symptome eines Patienten auf Digoxin zurückzuführen sind, sind jedoch der klinische Zustand zusammen mit den Serumelektrolytspiegeln und der Schilddrüsenfunktion wichtige Faktoren [siehe DOSIERUNG UND ANWENDUNG ].
Erwachsene
Die häufigsten Anzeichen und Symptome einer Digoxin-Toxizität sind Übelkeit, Erbrechen, Anorexie und Müdigkeit, die bei 30-70 % der Patienten mit Überdosierung auftreten. Extrem hohe Serumkonzentrationen führen insbesondere bei Patienten mit eingeschränkter Nierenfunktion zu einer Hyperkaliämie. Nahezu jede Art von Herzrhythmusstörungen wurde mit einer Überdosierung von Digoxin in Verbindung gebracht, und mehrere Rhythmusstörungen bei demselben Patienten sind häufig. Maximale kardiale Wirkungen treten 3-6 Stunden nach der Einnahme auf und können 24 Stunden oder länger anhalten. Arrhythmien, die als charakteristischer für eine Digoxin-Toxizität angesehen werden, sind ein neu aufgetretener Mobitz-Typ-1-AV-Block, beschleunigte junktionale Rhythmen, nicht-paroxysmale atriale Tachykardie mit AV-Block und bidirektionale ventrikuläre Tachykardie. Herzstillstand durch Asystolie oder Kammerflimmern ist in der Regel tödlich. Die Toxizität von Digoxin hängt von der Serumkonzentration ab. Wenn der Digoxin-Serumspiegel über 1,2 ng/ml ansteigt, besteht die Möglichkeit einer Zunahme von Nebenwirkungen. Darüber hinaus erhöhen niedrigere Kaliumspiegel das Risiko für Nebenwirkungen. Bei Erwachsenen mit Herzerkrankungen deuten klinische Beobachtungen darauf hin, dass eine Digoxin-Überdosis von 10-15 mg bei der Hälfte der Patienten zum Tod führt. Eine von einem Erwachsenen ohne Herzerkrankung eingenommene Dosis über 25 mg schien einheitlich tödlich zu sein, wenn kein Digoxin Immune Fab (DIGIBIND®, DIGIFAB®) verabreicht wurde.
Unter den extrakardialen Manifestationen sind gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Anorexie) sehr häufig (bis zu 80 % Inzidenz) und gehen den kardialen Manifestationen in den meisten Literaturberichten bei etwa der Hälfte der Patienten voraus. Neurologische Manifestationen (z. B. Schwindel, verschiedene ZNS-Störungen), Müdigkeit und Unwohlsein sind sehr häufig. Visuelle Manifestationen können auch auftreten, wobei Aberrationen im Farbsehen (Überwiegen von Gelbgrün) am häufigsten auftreten. Neurologische und visuelle Symptome können bestehen bleiben, nachdem andere Anzeichen einer Toxizität abgeklungen sind. Bei chronischer Toxizität können unspezifische extrakardiale Symptome wie Unwohlsein und Schwäche überwiegen.
Kinder
Bei pädiatrischen Patienten können während oder kurz nach der Gabe von Digoxin Anzeichen und Symptome einer Toxizität auftreten. Häufige nichtkardiale Wirkungen ähneln denen, die bei Erwachsenen beobachtet werden, obwohl Übelkeit und Erbrechen bei Säuglingen und kleinen pädiatrischen Patienten nicht häufig beobachtet werden. Andere berichtete Manifestationen einer Überdosierung sind Gewichtsverlust in höheren Altersgruppen, Gedeihstörungen bei Säuglingen, Bauchschmerzen, die durch Ischämie der Mesenterialarterie verursacht werden, Schläfrigkeit und Verhaltensstörungen, einschließlich psychotischer Episoden. Arrhythmien und Kombinationen von Arrhythmien, die bei erwachsenen Patienten auftreten, können auch bei pädiatrischen Patienten auftreten, obwohl Sinustachykardie, supraventrikuläre Tachykardie und schnelles Vorhofflimmern bei pädiatrischen Patienten weniger häufig beobachtet werden. Pädiatrische Patienten entwickeln eher AV-Überleitungsstörungen oder Sinusbradykardie. Jede Arrhythmie bei einem mit Digoxin behandelten Kind sollte als mit Digoxin in Zusammenhang stehend angesehen werden, bis nichts anderes ausgeschlossen werden kann. Bei pädiatrischen Patienten im Alter von 1-3 Jahren ohne Herzerkrankung deuten klinische Beobachtungen darauf hin, dass eine Digoxin-Überdosis von 6-10 mg bei der Hälfte der Patienten zum Tod führen würde. In derselben Population führte eine Dosis über 10 mg zum Tod, wenn kein Digoxin Immune Fab verabreicht wurde.
Behandlung
Chronische Überdosierung
Bei Verdacht auf Toxizität LANOXIN 0,25 mg absetzen und den Patienten an ein Herzüberwachungsgerät anschließen. Korrigieren Sie Faktoren wie Elektrolytanomalien, Schilddrüsenfunktionsstörungen und Begleitmedikationen [siehe DOSIERUNG UND ANWENDUNG ]. Korrigieren Sie die Hypokaliämie, indem Sie Kalium so verabreichen, dass das Serumkalium zwischen 4,0 und 5,5 mmol/l gehalten wird. Kalium wird normalerweise oral verabreicht, aber wenn die Korrektur der Arrhythmie dringend ist und die Kaliumkonzentration im Serum niedrig ist, kann Kalium intravenös verabreicht werden. Überwachen Sie das Elektrokardiogramm auf Anzeichen einer Kaliumtoxizität (z. B. Peaking von T-Wellen) und beobachten Sie die Auswirkungen auf die Arrhythmie. Vermeiden Sie Kaliumsalze bei Patienten mit Bradykardie oder Herzblock. Symptomatische Arrhythmien können mit Digoxin Immune Fab behandelt werden.
Akute Überdosierung
Patienten, die absichtlich oder versehentlich große Dosen Digoxin eingenommen haben, sollten unabhängig von der Zeit seit der Einnahme Aktivkohle oral oder über eine Magensonde erhalten, da Digoxin durch den enterohepatischen Kreislauf in den Darm rezirkuliert. Setzen Sie LANOXIN zusätzlich zur Herzüberwachung vorübergehend ab, bis die Nebenwirkung abgeklungen ist. Korrigieren Sie Faktoren, die zu den Nebenwirkungen beitragen können [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ]. Korrigieren Sie insbesondere Hypokaliämie und Hypomagnesiämie. Aufgrund seines großen extravaskulären Verteilungsvolumens wird Digoxin durch Dialyse nicht effektiv aus dem Körper entfernt. Lebensbedrohliche Arrhythmien (ventrikuläre Tachykardie, Kammerflimmern, hochgradiger AV-Block, Bradyarrhythmie, Sinusstillstand) oder Hyperkaliämie erfordern die Verabreichung von Digoxin Immune Fab. Es wurde gezeigt, dass Digoxin Immune Fab bei der Umkehrung von Anzeichen und Symptomen einer Digoxin-Toxizität zu 80-90 % wirksam ist. Bradykardie und Herzblock, die durch Digoxin verursacht werden, werden parasympathisch vermittelt und sprechen auf Atropin an. Es kann auch ein temporärer Herzschrittmacher verwendet werden. Ventrikuläre Arrhythmien können auf Lidocain oder Phenytoin ansprechen. Wenn eine große Menge Digoxin eingenommen wurde, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, kann aufgrund der Freisetzung von Kalium aus der Skelettmuskulatur eine Hyperkaliämie vorliegen. In diesem Fall ist eine Behandlung mit Digoxin Immune Fab angezeigt; eine anfängliche Behandlung mit Glukose und Insulin kann erforderlich sein, wenn die Hyperkaliämie lebensbedrohlich ist. Sobald die Nebenwirkung abgeklungen ist, kann die Therapie mit LANOXIN 0,25 mg nach einer sorgfältigen Neubewertung der Dosis wieder aufgenommen werden.
KONTRAINDIKATIONEN
LANOXIN ist kontraindiziert bei Patienten mit:
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Alle Wirkungen von Digoxin werden durch seine Wirkungen auf die Na-K-ATPase vermittelt. Dieses Enzym, die „Natriumpumpe“, ist für die Aufrechterhaltung des intrazellulären Milieus im ganzen Körper verantwortlich, indem es Natriumionen aus den Zellen und Kaliumionen in die Zellen befördert. Durch Hemmung der Na-K-ATPase, Digoxin
Die kardiologischen Folgen dieser direkten und indirekten Wirkungen sind eine Zunahme der Kraft und Geschwindigkeit der myokardialen systolischen Kontraktion (positiv inotrope Wirkung), eine Verlangsamung der Herzfrequenz (negativ chronotrope Wirkung), eine verringerte Leitungsgeschwindigkeit durch den AV-Knoten und eine Abnahme im Grad der Aktivierung des sympathischen Nervensystems und des Renin-Angiotensin-Systems (neurohormonelle Deaktivierungswirkung).
Pharmakodynamik
Die Zeiten bis zum Einsetzen der pharmakologischen Wirkung und bis zum Wirkungsmaximum von LANOXIN-Zubereitungen sind in Tabelle 7 gezeigt.
Hämodynamische Effekte
Die Kurz- und Langzeittherapie mit dem Medikament erhöht das Herzzeitvolumen und senkt den Lungenarteriendruck, den Lungenkapillarkeildruck und den systemischen Gefäßwiderstand bei Patienten mit Herzinsuffizienz. Diese hämodynamischen Effekte werden von einer Zunahme der linksventrikulären Ejektionsfraktion und einer Abnahme der endsystolischen und enddiastolischen Dimensionen begleitet.
EKG-Veränderungen
Die Anwendung therapeutischer Dosen von LANOXIN kann eine Verlängerung des PR-Intervalls und eine Senkung der ST-Strecke im Elektrokardiogramm verursachen. LANOXIN kann während Belastungstests falsch positive ST-T-Veränderungen im Elektrokardiogramm hervorrufen. Diese elektrophysiologischen Wirkungen sind kein Hinweis auf Toxizität. LANOXIN reduziert die Herzfrequenz während des Trainings nicht signifikant.
Pharmakokinetik
Hinweis: Die folgenden Daten stammen aus Studien, die an Erwachsenen durchgeführt wurden, sofern nicht anders angegeben.
Vergleiche der systemischen Verfügbarkeit und Äquivalentdosen für orale Zubereitungen von LANOXIN sind in Tabelle 6 gezeigt [vgl DOSIERUNG UND ANWENDUNG ].
Verteilung
Nach der Arzneimittelverabreichung wird eine 6–8-stündige Gewebeverteilungsphase beobachtet. Darauf folgt eine viel allmählichere Abnahme der Serumkonzentration des Arzneimittels, die von der Ausscheidung von Digoxin aus dem Körper abhängt. Die Peakhöhe und -steigung des frühen Abschnitts (Absorptions-/Verteilungsphasen) der Serumkonzentrations-Zeit-Kurve sind abhängig vom Verabreichungsweg und den Absorptionseigenschaften der Formulierung. Klinische Beweise deuten darauf hin, dass die frühen hohen Serumkonzentrationen nicht die Konzentration von Digoxin an seinem Wirkort widerspiegeln, sondern dass bei chronischer Anwendung die Steady-State-Serumkonzentrationen nach der Verteilung im Gleichgewicht mit den Gewebekonzentrationen stehen und mit pharmakologischen Wirkungen korrelieren. Bei einzelnen Patienten können diese Serumkonzentrationen nach der Verteilung nützlich sein, um therapeutische und toxische Wirkungen zu bewerten [siehe DOSIERUNG UND ANWENDUNG ].
Digoxin ist im Gewebe konzentriert und hat daher ein großes scheinbares Verteilungsvolumen (ungefähr 475-500 l). Digoxin passiert sowohl die Blut-Hirn-Schranke als auch die Plazenta. Bei der Geburt ist die Digoxinkonzentration im Serum des Neugeborenen ähnlich der Serumkonzentration der Mutter. Ungefähr 25 % des Digoxins im Plasma sind an Protein gebunden. Serum-Digoxin-Konzentrationen werden durch große Veränderungen im Fettgewebegewicht nicht signifikant verändert, so dass sein Verteilungsraum am besten mit dem mageren (dh idealen) Körpergewicht korreliert, nicht mit dem Gesamtkörpergewicht.
Stoffwechsel
Nur ein kleiner Prozentsatz (13 %) einer Dosis Digoxin wird bei gesunden Probanden metabolisiert. Die Metaboliten im Urin, zu denen Dihydrodigoxin, Digoxigenin-Bisdigitoxosid und ihre Glucuronid- und Sulfat-Konjugate gehören, sind von Natur aus polar, und es wird postuliert, dass sie durch Hydrolyse, Oxidation und Konjugation gebildet werden. Der Metabolismus von Digoxin ist nicht vom Cytochrom-P-450-System abhängig, und es ist nicht bekannt, dass Digoxin das Cytochrom-P-450-System induziert oder hemmt.
Ausscheidung
Die Elimination von Digoxin folgt einer Kinetik erster Ordnung (d. h. die zu jedem Zeitpunkt ausgeschiedene Digoxinmenge ist proportional zum Gesamtkörpergehalt). Nach intravenöser Verabreichung an gesunde Probanden werden 50-70 % einer Digoxin-Dosis unverändert im Urin ausgeschieden. Die renale Ausscheidung von Digoxin ist proportional zur Kreatinin-Clearance und weitgehend unabhängig vom Urinfluss. Bei gesunden Probanden mit normaler Nierenfunktion hat Digoxin eine Halbwertszeit von 1,5-2 Tagen. Die Halbwertszeit bei anurischen Patienten ist auf 3,5-5 Tage verlängert. Digoxin wird durch Dialyse, Austauschtransfusion oder während eines kardiopulmonalen Bypasses nicht effektiv aus dem Körper entfernt, da der größte Teil des Arzneimittels an extravaskuläres Gewebe gebunden ist.
Besondere Populationen
Geriatrie
Aufgrund der altersbedingten Verschlechterung der Nierenfunktion ist zu erwarten, dass ältere Patienten Digoxin langsamer eliminieren als jüngere Patienten. Ältere Patienten können aufgrund des altersbedingten Verlustes an fettfreier Muskelmasse auch ein geringeres Verteilungsvolumen von Digoxin aufweisen. Daher sollte die Dosierung von Digoxin bei älteren Patienten sorgfältig ausgewählt und überwacht werden [vgl Verwendung in bestimmten Bevölkerungsgruppen ].
Geschlecht
In einer Studie mit 184 Patienten war die Clearance von Digoxin bei weiblichen Patienten um 12 % niedriger als bei männlichen Patienten. Dieser Unterschied ist wahrscheinlich klinisch nicht von Bedeutung.
Leberfunktionsstörung
Da nur ein kleiner Prozentsatz (ca. 13 %) einer Digoxindosis verstoffwechselt wird, ist nicht zu erwarten, dass eine Leberfunktionsstörung die Pharmakokinetik von Digoxin signifikant verändert. In einer kleinen Studie fielen die Plasma-Digoxin-Konzentrationsprofile bei Patienten mit akuter Hepatitis im Allgemeinen in den Bereich der Profile bei einer Gruppe gesunder Probanden. Für Patienten mit eingeschränkter Leberfunktion wird keine Dosisanpassung empfohlen; jedoch sollten die Digoxinkonzentrationen im Serum gegebenenfalls verwendet werden, um die Dosierung bei diesen Patienten zu unterstützen.
Nierenfunktionsstörung
Da die Digoxin-Clearance mit der Kreatinin-Clearance korreliert, weisen Patienten mit eingeschränkter Nierenfunktion im Allgemeinen verlängerte Digoxin-Eliminationshalbwertszeiten und eine höhere Digoxin-Exposition auf. Titrieren Sie daher bei diesen Patienten vorsichtig, basierend auf dem klinischen Ansprechen und ggf. basierend auf der Überwachung der Digoxinkonzentrationen im Serum.
Wettrennen
Die Auswirkung von Rassenunterschieden auf die Pharmakokinetik von Digoxin wurde nicht formell untersucht. Da Digoxin hauptsächlich als unveränderter Wirkstoff über die Nieren ausgeschieden wird und es keine wesentlichen Unterschiede in der Kreatinin-Clearance zwischen den Rassen gibt, sind pharmakokinetische Unterschiede aufgrund der Rasse nicht zu erwarten.
Klinische Studien
Chronische Herzinsuffizienz
In zwei 12-wöchige, doppelblinde, placebokontrollierte Studien wurden 178 (RADIANCE-Studie) und 88 (PROVED-Studie) erwachsene Patienten mit Herzinsuffizienz der NYHA-Klassen II oder III aufgenommen, die zuvor mit oralem Digoxin, einem Diuretikum und einem ACE-Hemmer (RADIANCE nur) und randomisierten Placebo oder Behandlung mit LANOXIN-Tabletten. Beide Studien zeigten eine bessere Bewahrung der körperlichen Leistungsfähigkeit bei Patienten, die randomisiert LANOXIN erhielten. Die fortgesetzte Behandlung mit LANOXIN verringerte das Risiko einer Verschlechterung der Herzinsuffizienz, wie durch Herzinsuffizienz-bedingte Krankenhauseinweisungen und Notfallversorgung und die Notwendigkeit einer begleitenden Herzinsuffizienztherapie belegt wurde.
DIG-Studie mit LANOXIN 0,25 mg bei Patienten mit Herzinsuffizienz
Die Hauptstudie der Digitalis Investigation Group (DIG) war eine 37-wöchige, multizentrische, randomisierte, doppelblinde Mortalitätsstudie zum Vergleich von Digoxin mit Placebo bei 6800 erwachsenen Patienten mit Herzinsuffizienz und einer linksventrikulären Ejektionsfraktion kleiner oder gleich 0,45. Bei der Randomisierung waren 67 % NYHA-Klasse I oder II, 71 % hatten eine Herzinsuffizienz ischämischer Ätiologie, 44 % hatten Digoxin erhalten und die meisten erhielten gleichzeitig einen ACE-Hemmer (94 %) und Diuretika (82 %). Wie in den oben beschriebenen kleineren Studien wurden Patienten, die unverblindet Digoxin erhalten hatten, vor der Randomisierung von dieser Behandlung ausgeschlossen. Die Randomisierung zu Digoxin war erneut mit einer signifikanten Verringerung der Inzidenz von Krankenhauseinweisungen verbunden, unabhängig davon, ob sie als Anzahl der Krankenhauseinweisungen wegen Herzinsuffizienz (relatives Risiko 75 %), als Risiko für mindestens eine solche Krankenhauseinweisung während der Studie (RR 72 %) oder bewertet wurden Anzahl der Krankenhauseinweisungen aus jeglichem Grund (RR 94 %). Andererseits hatte die Randomisierung zu Digoxin keine offensichtliche Auswirkung auf die Sterblichkeit (RR 99 %, mit Konfidenzgrenzen von 91–107 %).
Chronisches Vorhofflimmern
Digoxin wurde auch als Mittel zur Kontrolle der ventrikulären Reaktion auf chronisches Vorhofflimmern bei Erwachsenen untersucht. Digoxin reduzierte die Ruheherzfrequenz, nicht aber die Herzfrequenz während des Trainings.
In 3 verschiedenen randomisierten, doppelblinden Studien, an denen insgesamt 315 erwachsene Patienten teilnahmen, wurde Digoxin hinsichtlich der Umwandlung von kürzlich aufgetretenem Vorhofflimmern in einen Sinusrhythmus mit Placebo verglichen. Die Umwandlung war in der Digoxin- und der Placebo-Gruppe gleich wahrscheinlich und gleich schnell. In einer randomisierten Studie mit 120 Patienten, in der Digoxin, Sotalol und Amiodaron verglichen wurden, hatten Patienten, die randomisiert Digoxin erhielten, die niedrigste Inzidenz einer Konversion zum Sinusrhythmus und die am wenigsten zufriedenstellende Frequenzkontrolle, wenn keine Konversion auftrat.
In mindestens einer Studie wurde Digoxin als Mittel zur Verzögerung der Reversion zu Vorhofflimmern bei erwachsenen Patienten mit häufigem Wiederauftreten dieser Arrhythmie untersucht. Dies war eine randomisierte, doppelblinde Crossover-Studie mit 43 Patienten. Digoxin verlängerte die mittlere Zeit zwischen symptomatischen wiederkehrenden Episoden um 54 %, hatte jedoch keine Auswirkung auf die Häufigkeit von Flimmerepisoden, die während der kontinuierlichen elektrokardiographischen Überwachung beobachtet wurden.