Nimotop 30mg Nimodipine Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Nimotop 30 mg und wie wird es angewendet?
Nimotop ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von Aneurysmen (Subarachnoidalblutung). Nimotop kann allein oder mit anderen Medikamenten verwendet werden.
Nimotop gehört zu einer Klasse von Arzneimitteln, die Kalziumkanalblocker genannt werden; Neurologika, Sonstiges; Kalziumkanalblocker, Dihydrophyridin.
Es ist nicht bekannt, ob Nimotop 30 mg bei Kindern sicher und wirksam ist.
Welche Nebenwirkungen kann Nimotop haben?
Nimotop kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigsten Nebenwirkungen von Nimotop gehören:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Nimotop. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
NIMOTOP (Nimodipin) NICHT INTRAVENÖS ODER AUF ANDEREN PARENTERALEN WEGEN VERABREICHEN. WENN DER INHALT VON NIMOTOP (Nimodipin) KAPSELN PARENTERAL INJIZIERT WURDE, IST ES ZU TODESFÄLLEN UND SCHWEREN, LEBENSBEDROHLICHEN EREIGNISSEN GEKOMMEN (siehe WARNHINWEISE und DOSIERUNG UND VERABREICHUNG).
BEZEICHNUNG
Nimotop® (Nimodipin) gehört zur Klasse der pharmakologischen Wirkstoffe, die als Calciumkanalblocker bekannt sind. Nimodipin ist Isopropyl-2-methoxyethyl-1,4-dihydro-2,6-dimethyl-4-(m-nitrophenyl)-3,5-pyridindicarboxylat. Es hat ein Molekulargewicht von 418,5 und eine Summenformel von C21H26N2O7. Die Strukturformel lautet:
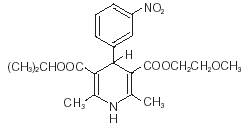
Nimodipin ist eine gelbe kristalline Substanz, praktisch unlöslich in Wasser.
NIMOTOP® (Nimodipin)-Kapseln sind als Weichgelatinekapseln zur oralen Verabreichung formuliert. Jede mit Flüssigkeit gefüllte Kapsel enthält 30 mg Nimodipin in einem Vehikel aus Glycerin, Pfefferminzöl, gereinigtem Wasser und Polyethylenglykol 400. Die Weichgelatinekapselhülle enthält Gelatine, Glycerin, gereinigtes Wasser und Titandioxid.
INDIKATIONEN
Nimotop® (Nimodipin) ist indiziert zur Verbesserung des neurologischen Outcomes durch Reduzierung der Inzidenz und Schwere ischämischer Defizite bei Patienten mit Subarachnoidalblutung aus rupturierten intrakraniellen Beerenaneurysmen, unabhängig von ihrem neurologischen Zustand nach dem Iktus (dh Hunt- und Hess-Grad IV).
DOSIERUNG UND ANWENDUNG
VERabreichen Sie NIMOTOP (Nimodipin) KAPSELN NICHT INTRAVENÖS ODER AUF ANDERE PARENTERALE ART (siehe WARNHINWEISE). Wenn Nimotop (Nimodipin) versehentlich intravenös verabreicht wird, kann eine klinisch signifikante Hypotonie eine kardiovaskuläre Unterstützung mit blutdrucksenkenden Mitteln erfordern. Spezifische Behandlungen für eine Calciumkanalblocker-Überdosierung sollten ebenfalls unverzüglich gegeben werden.
Nimotop (Nimodipin) wird oral in Form von elfenbeinfarbenen 30-mg-Weichgelatinekapseln bei Subarachnoidalblutung verabreicht.
Die orale Dosis beträgt 60 mg (zwei 30-mg-Kapseln) alle 4 Stunden an 21 aufeinanderfolgenden Tagen, vorzugsweise nicht weniger als eine Stunde vor oder zwei Stunden nach den Mahlzeiten. Die orale Therapie mit Nimotop® (Nimodipin) sollte innerhalb von 96 Stunden nach der Subarachnoidalblutung beginnen.
Wenn die Kapsel nicht geschluckt werden kann, z. B. zum Zeitpunkt der Operation, oder wenn der Patient bewusstlos ist, sollte mit einer 18-Gauge-Nadel ein Loch in beide Enden der Kapsel gemacht und der Inhalt der Kapsel in eine Spritze extrahiert werden. Eine parenterale Spritze kann verwendet werden, um die Flüssigkeit aus der Kapsel zu extrahieren, aber die Flüssigkeit sollte immer in eine Spritze überführt werden, die keine Nadel aufnehmen kann und die für die orale Verabreichung oder über eine naso-gastrische Sonde oder PEG ausgelegt ist. Um Verabreichungsfehler zu minimieren, wird empfohlen, die für die Verabreichung verwendete Spritze mit „Nicht für IV-Verwendung“ zu kennzeichnen. Der Inhalt sollte dann in die Magensonde in situnaso des Patienten entleert und mit 30 ml normaler Kochsalzlösung (0,9 %) durch die Sonde gespült werden. Die Wirksamkeit und Sicherheit dieser Verabreichungsmethode wurde in klinischen Studien nicht nachgewiesen.
Patienten mit Leberzirrhose haben eine wesentlich verringerte Clearance und eine ungefähr verdoppelte Cmax. Die Dosierung sollte auf 30 mg alle 4 Stunden reduziert werden, wobei der Blutdruck und die Herzfrequenz engmaschig überwacht werden sollten.
WIE GELIEFERT
Jede elfenbeinfarbene Weichgelatinekapsel NIMOTOP® (Nimodipin) ist mit dem Wort Nimotop 30 mg bedruckt und enthält 30 mg Nimodipin. Die 30-mg-Kapseln sind in Folienbeuteln zur Abgabe von Einzeldosen verpackt und werden in Kartons mit 100 Kapseln geliefert. Das Produkt ist auch in kindersicheren Einzeldosis-Sicherheitspack-Folienbeuteln mit 30 Kapseln pro Karton erhältlich. Die Kapseln sollten in der Originalfolienverpackung des Herstellers bei 25°C (77°F) gelagert werden, Abweichungen bis 15-30°C (59-86°F) sind zulässig [Siehe USP kontrollierte Raumtemperatur.]
Kapseln sollten vor Licht und Frost geschützt werden.
Vertrieben von: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Hergestellt von: Catalent Pharma Solutions St. Petersburg, FL 33716. FDA-Revisionsdatum: 20.01.2006
NEBENWIRKUNGEN
Unerwünschte Erfahrungen wurden von 92 von 823 Patienten mit Subarachnoidalblutung (11,2 %) berichtet, denen Nimodipin verabreicht wurde. Die am häufigsten berichtete Nebenwirkung war niedriger Blutdruck bei 4,4 % dieser Patienten. Neunundzwanzig von 479 (6,1 %) mit Placebo behandelten Patienten berichteten auch über Nebenwirkungen. Die Ereignisse, die mit einer Häufigkeit von mehr als 1 % gemeldet wurden, werden unten nach Dosis angezeigt.
DOSE q4h Anzahl der Patienten (%) Nimodipin
Es wurden keine anderen Nebenwirkungen von Patienten berichtet, die 0,35 mg/kg alle 4 Stunden, 30 mg alle 4 Stunden oder 120 mg alle 4 Stunden erhielten. Unerwünschte Erfahrungen mit einer Inzidenzrate von weniger als 1 % in der 60 mg q4h-Dosisgruppe waren: Hepatitis; Juckreiz; Magen-Darm-Blutung; Thrombozytopenie; Anämie; Herzklopfen; Erbrechen; Spülung; Diaphorese; Keuchen; Phenytoin-Toxizität; Benommenheit; Schwindel; Rebound-Vasospasmus; Gelbsucht; Hypertonie; Hämatom.
Nebenwirkungen mit einer Inzidenzrate von weniger als 1 % in der 90 mg q4h-Dosisgruppe waren: Juckreiz, gastrointestinale Blutung; Thrombozytopenie; neurologische Verschlechterung; Erbrechen; Diaphorese; kongestive Herzinsuffizienz; Hyponatriämie; abnehmende Blutplättchenzahl; disseminierte intravasale Koagulopathie; tiefe Venenthrombose.
Wie aus der Tabelle ersichtlich ist, umfassten Nebenwirkungen, die im Zusammenhang mit der Anwendung von Nimodipin aufgrund einer erhöhten Inzidenz bei höherer Dosis oder einer höheren Rate im Vergleich zur Placebo-Kontrolle auftreten, niedrigeren Blutdruck, Ödeme und Kopfschmerzen, die bekannte pharmakologische Wirkungen von Calciumkanalblockern sind. Es muss jedoch beachtet werden, dass SAB häufig von Bewusstseinsveränderungen begleitet wird, die zu einer Unterberichterstattung über unerwünschte Erfahrungen führen. Patienten, die Nimodipin in klinischen Studien für andere Indikationen erhielten, berichteten über Hitzegefühl (2,1 %), Kopfschmerzen (4,1 %) und Flüssigkeitsretention (0,3 %), typische Reaktionen auf Calciumkanalblocker. Als Kalziumkanalblocker kann Nimodipin möglicherweise Herzinsuffizienz bei anfälligen Patienten verschlimmern oder die AV-Überleitung stören, aber diese Ereignisse wurden nicht beobachtet.
Es wurden keine klinisch signifikanten Wirkungen auf hämatologische Faktoren, die Nieren- oder Leberfunktion oder den Kohlenhydratstoffwechsel mit oralem Nimodipin kausal in Verbindung gebracht. Einzelfälle von erhöhten Serumglukosespiegeln (0,8 %), erhöhten LDH-Spiegeln (0,4 %), verringerten Thrombozytenzahlen (0,3 %), erhöhten alkalischen Phosphatasespiegeln (0,2 %) und erhöhten SGPT-Spiegeln (0,2 %) wurden außerhalb des Nüchternzustands berichtet selten.

Drogenmissbrauch und -abhängigkeit
Es wurden keine Fälle von Drogenmissbrauch oder -abhängigkeit mit Nimotop® (Nimodipin) gemeldet.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Es ist möglich, dass die kardiovaskuläre Wirkung anderer Calciumkanalblocker durch die Zugabe von Nimotop® (Nimodipin) verstärkt werden könnte.
In Europa wurde beobachtet, dass Nimotop® (Nimodipin) gelegentlich die Wirkung von Antihypertonika verstärkt, die gleichzeitig von Patienten mit Bluthochdruck eingenommen wurden; dieses Phänomen wurde in nordamerikanischen klinischen Studien nicht beobachtet.
Eine Studie an acht gesunden Probanden hat nach einer einwöchigen Behandlung mit 1.000 mg/Tag Cimetidin und 90 mg/Tag Nimodipin eine 50%ige Erhöhung der mittleren maximalen Nimodipin-Plasmakonzentrationen und eine 90%ige Erhöhung der mittleren Fläche unter der Kurve gezeigt . Dieser Effekt kann durch die bekannte Hemmung des hepatischen Cytochrom P-450 durch Cimetidin vermittelt werden, was den First-Pass-Metabolismus von Nimodipin verringern könnte.
WARNUNGEN
TOD DURCH UNBEABSICHTIGTE INTRAVENÖSE VERABREICHUNG: NIMOTOP (Nimodipin) NICHT INTRAVENÖS ODER AUF ANDERE PARENTERALE VERABREICHUNG VERabreichen. TODESFÄLLE UND SCHWERE, LEBENSBEDROHENDE UNERWÜNSCHTE EREIGNISSE, EINSCHLIESSLICH HERZSTILLSTAND, KARDIOVASKULÄRER ZUSAMMENSCHLAG, HYPOTENSION UND BRADYKARDIE, SIND AUFGETRETEN, WENN DER INHALT VON NIMOTOP (Nimodipin) KAPSELN PARENTERAL INJIZIERT WURDE (SIEHE DOSIERUNG UND ANWENDUNG).
VORSICHTSMASSNAHMEN
Allgemein: Blutdruck: Nimodipin hat die hämodynamischen Wirkungen, die von einem Kalziumkanalblocker erwartet werden, obwohl sie im Allgemeinen nicht ausgeprägt sind. Die intravenöse Verabreichung des Inhalts von Nimotop (Nimodipin)-Kapseln hat jedoch zu schwerwiegenden Nebenwirkungen geführt, einschließlich Tod, Herzstillstand, Kreislaufkollaps, Hypotonie und Bradykardie. Bei Patienten mit Subarachnoidalblutung, die in klinischen Studien Nimotop® (Nimodipin) erhielten, wurde bei etwa 5 % eine Blutdrucksenkung berichtet und etwa 1 % verließen die Studie deswegen (nicht alle konnten auf Nimodipin zurückgeführt werden). Dennoch sollte der Blutdruck während der Behandlung mit Nimotop® (Nimodipin) aufgrund seiner bekannten Pharmakologie und der bekannten Wirkungen von Calciumkanalblockern sorgfältig überwacht werden. (sehen WARNUNGEN und DOSIERUNG UND ANWENDUNG )
Lebererkrankung: Der Metabolismus von Nimotop® (Nimodipin) ist bei Patienten mit eingeschränkter Leberfunktion verringert. Bei solchen Patienten sollten Blutdruck und Pulsfrequenz engmaschig überwacht und eine niedrigere Dosis verabreicht werden (vgl DOSIERUNG UND ANWENDUNG ).
Bei Patienten, die mit Nimodipin behandelt wurden, wurde selten über intestinale Pseudoobstruktion und Ileus berichtet. Ein kausaler Zusammenhang wurde nicht hergestellt. Die Bedingung hat auf eine konservative Behandlung reagiert.
Wechselwirkungen im Labortest: Keine bekannt.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit: In einer zweijährigen Studie wurden bei Ratten, die eine Diät mit 1800 ppm Nimodipin (entsprechend 91 bis 121 mg/kg/Tag Nimodipin) erhielten, höhere Inzidenzen von Adenokarzinomen des Uterus und Leydig-Zell-Adenomen der Hoden beobachtet als bei Placebo-Kontrollen . Die Unterschiede waren jedoch statistisch nicht signifikant, und die höheren Raten lagen gut innerhalb des historischen Kontrollbereichs für diese Tumoren im Wistar-Stamm.
Nimodipin erwies sich in einer 91-wöchigen Studie an Mäusen als nicht karzinogen, aber die hohe Dosis von 1800 ppm Nimodipin im Futter (546 bis 774 mg/kg/Tag) verkürzte die Lebenserwartung der Tiere. Mutagenitätsstudien, einschließlich der Ames-, Mikronukleus- und Dominant-Letal-Tests, waren negativ. Nimodipin beeinträchtigte die Fertilität und die allgemeine Reproduktionsleistung männlicher und weiblicher Wistar-Ratten nach oraler Gabe von bis zu 30 mg/kg/Tag nicht, wenn es täglich über mehr als 10 Wochen bei den Männchen und 3 Wochen bei den Weibchen vor der Paarung und fortgesetzt verabreicht wurde bis Tag 7 der Schwangerschaft. Diese Dosis bei einer Ratte entspricht etwa dem Vierfachen der äquivalenten klinischen Dosis von 60 mg alle 4 Stunden bei einem 50 kg schweren Patienten.
Schwangerschaft: Trächtigkeitskategorie C. Nimodipin hat sich bei Himalaya-Kaninchen als fruchtschädigend erwiesen. Die Häufigkeit von Missbildungen und verkümmerten Föten war bei oralen Dosen von 1 und 10 mg/kg/Tag, die (per Schlundsonde) verabreicht wurden, vom 6. bis zum 18. Tag der Trächtigkeit erhöht, jedoch nicht bei 3,0 mg/kg/Tag in einer von zwei identischen Kaninchenstudien. In der zweiten Studie wurde bei 1,0 mg/kg/Tag, jedoch nicht bei höheren Dosen, eine erhöhte Inzidenz von verkümmerten Föten beobachtet. Nimodipin war embryotoxisch und verursachte bei Long-Evans-Ratten in einer Dosis von 100 mg/kg/Tag, die vom 6. bis zum 15. Tag der Trächtigkeit per Schlundsonde verabreicht wurde, eine Resorption und ein gehemmtes Wachstum der Föten. In zwei anderen Studien an Ratten waren Nimodipin-Dosen von 30 mg/kg/Tag, die ab dem 16. Tag der Trächtigkeit per Schlundsonde verabreicht wurden und bis zur Tötung (Tag 20 der Trächtigkeit oder Tag 21 nach der Geburt) fortgesetzt wurden, mit einer höheren Inzidenz von Skelettvariationen, verkümmerten Föten und Feten verbunden Totgeburten, aber keine Fehlbildungen. Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen, um die Wirkung auf menschliche Föten direkt zu beurteilen. Nimodipin sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mutter: Es wurde gezeigt, dass Nimodipin und/oder seine Metaboliten in Rattenmilch in viel höheren Konzentrationen als im mütterlichen Plasma vorkommen. Es ist nicht bekannt, ob das Arzneimittel in die Muttermilch übergeht. Da viele Medikamente in die Muttermilch übergehen, wird stillenden Müttern geraten, ihre Babys während der Einnahme des Medikaments nicht zu stillen.
Pädiatrische Verwendung: Sicherheit und Wirksamkeit bei Kindern wurden nicht nachgewiesen.
Geriatrische Verwendung: Klinische Studien zu Nimodipin schlossen keine ausreichende Anzahl von Probanden ab 65 Jahren ein, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere berichtete klinische Erfahrungen haben keine Unterschiede im Ansprechen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosierung bei älteren Patienten vorsichtig sein, da eine verminderte Leber-, Nieren- oder Herzfunktion sowie Begleiterkrankungen oder andere medikamentöse Therapien häufiger auftreten.
ÜBERDOSIS
Es liegen keine Berichte über eine Überdosierung bei oraler Verabreichung von Nimotop® (Nimodipin) vor. Es ist zu erwarten, dass die Symptome einer Überdosierung mit kardiovaskulären Wirkungen wie übermäßiger peripherer Vasodilatation mit ausgeprägter systemischer Hypotonie zusammenhängen. Eine klinisch signifikante Hypotonie aufgrund einer Überdosierung von Nimotop® (Nimodipin) kann eine aktive kardiovaskuläre Unterstützung mit blutdrucksenkenden Mitteln erfordern. Spezifische Behandlungen für eine Calciumkanalblocker-Überdosierung sollten ebenfalls unverzüglich gegeben werden. Da Nimotop® (Nimodipin) stark proteingebunden ist, ist eine Dialyse wahrscheinlich nicht sinnvoll.
KONTRAINDIKATIONEN
Keine bekannt.
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus: Nimodipin ist ein Kalziumkanalblocker. Die kontraktilen Prozesse glatter Muskelzellen sind abhängig von Calciumionen, die während der Depolarisation als langsame ionische Transmembranströme in diese Zellen eintreten. Nimodipin hemmt den Calciumionentransfer in diese Zellen und hemmt somit die Kontraktionen der glatten Gefäßmuskulatur. In Tierversuchen hatte Nimodipin eine größere Wirkung auf Hirnarterien als auf Arterien anderswo im Körper, möglicherweise weil es stark lipophil ist und es ihm ermöglicht, die Blut-Hirn-Schranke zu überwinden; Nimodipin-Konzentrationen von bis zu 12,5 ng/ml wurden in der Zerebrospinalflüssigkeit von mit Nimodipin behandelten Patienten mit Subarachnoidalblutung (SAH) nachgewiesen. Der genaue Wirkungsmechanismus von Nimodipin beim Menschen ist unbekannt. Obwohl die unten beschriebenen klinischen Studien eine günstige Wirkung von Nimodipin auf die Schwere von neurologischen Defiziten zeigen, die durch zerebralen Vasospasmus nach SAH verursacht werden, gibt es keinen arteriographischen Beweis dafür, dass das Medikament den Spasmus dieser Arterien entweder verhindert oder lindert. Es ist jedoch nicht bekannt, ob die verwendete arteriographische Methode angemessen war, um eine klinisch bedeutsame Wirkung, falls vorhanden, auf Vasospasmus nachzuweisen.
Pharmakokinetik und Metabolismus: Beim Menschen wird Nimodipin nach oraler Verabreichung schnell resorbiert, und Spitzenkonzentrationen werden im Allgemeinen innerhalb einer Stunde erreicht. Die terminale Eliminationshalbwertszeit beträgt ungefähr 8 bis 9 Stunden, aber frühere Eliminationsraten sind viel schneller und entsprechen einer Halbwertszeit von 1 bis 2 Stunden; eine Konsequenz ist die Notwendigkeit einer häufigen (alle 4 Stunden) Dosierung. Es gab keine Anzeichen einer Akkumulation, wenn Nimodipin sieben Tage lang dreimal täglich gegeben wurde. Nimodipin ist zu über 95 % an Plasmaproteine gebunden. Die Bindung war über den Bereich von 10 ng/ml bis 10 ug/ml konzentrationsunabhängig. Nimodipin wird fast ausschließlich in Form von Metaboliten ausgeschieden und weniger als 1 % wird als unveränderter Wirkstoff im Urin wiedergefunden. Es wurden zahlreiche Metaboliten identifiziert, die alle entweder inaktiv oder erheblich weniger aktiv als die Ausgangsverbindung sind. Aufgrund eines hohen First-Pass-Metabolismus beträgt die Bioverfügbarkeit von Nimodipin nach oraler Gabe durchschnittlich 13 %. Die Bioverfügbarkeit ist bei Patienten mit Leberzirrhose signifikant erhöht, wobei Cmax etwa doppelt so hoch ist wie bei Normalpersonen, was eine Dosissenkung bei dieser Patientengruppe erforderlich macht (siehe DOSIERUNG UND ANWENDUNG ). In einer Studie mit 24 gesunden männlichen Probanden führte die Verabreichung von Nimodipin-Kapseln nach einem Standardfrühstück zu einer um 68 % niedrigeren maximalen Plasmakonzentration und einer um 38 % niedrigeren Bioverfügbarkeit im Vergleich zur Einnahme im nüchternen Zustand.
In einer einzelnen Parallelgruppenstudie mit 24 älteren Probanden (im Alter von 59-79 Jahren) und 24 jüngeren Probanden (im Alter von 22-40) waren die beobachteten AUC und Cmax von Nimodipin bei der älteren Population etwa 2-mal höher als in der jüngeren Studie Probanden nach oraler Gabe (gegeben als Einzeldosis von 30 mg und Dosierung bis zum Steady-State mit 30 mg dreimal täglich für 6 Tage). Das klinische Ansprechen auf diese altersbedingten pharmakokinetischen Unterschiede wurde jedoch nicht als signifikant erachtet. (Sehen VORSICHTSMASSNAHMEN : Geriatrische Verwendung.)
Klinische Versuche: In 4 randomisierten, doppelblinden, placebokontrollierten Studien hat sich gezeigt, dass Nimodipin die Schwere neurologischer Defizite infolge von Vasospasmen bei Patienten mit kürzlich erlittener Subarachnoidalblutung (SAB) verringert. Die Studien verwendeten Dosen im Bereich von 20-30 mg bis 90 mg alle 4 Stunden, wobei das Medikament in 3 Studien 21 Tage lang und in der anderen mindestens 18 Tage lang verabreicht wurde. Drei der vier Studien begleiteten die Patienten 3-6 Monate lang. Drei der Studien untersuchten relativ gut Patienten, wobei alle oder die meisten Patienten in Hunt- und Hess-Graden I - III (im Wesentlichen frei von fokalen Defiziten nach der anfänglichen Blutung) waren, die vierte untersuchte viel kränkere Patienten, Hunt- und Hess-Grade III - V. Zwei Studien , ein US-amerikanisches, ein französisches, waren im Design ähnlich, wobei relativ unbeeinträchtigte SAH-Patienten randomisiert Nimodipin oder Placebo erhielten. In jedem Fall wurde beurteilt, ob ein sich spät entwickelndes Defizit auf Krämpfe oder andere Ursachen zurückzuführen war, und die Defizite wurden bewertet. Beide Studien zeigten signifikant weniger schwere Defizite aufgrund von Spasmen in der Nimodipin-Gruppe; die zweite (französische) Studie zeigte weniger krampfbedingte Defizite aller Schweregrade. Auf Defizite, die nicht mit Krämpfen in Zusammenhang stehen, wurde keine Wirkung beobachtet.
Eine dritte, große Studie wurde im Vereinigten Königreich mit SAH-Patienten aller Schweregrade durchgeführt (aber 89 % waren in den Graden I-III). Nimodipin wurde alle 4 Stunden mit 60 mg dosiert. Die Ergebnisse wurden nicht als krampfbedingt definiert oder nicht, aber es gab eine signifikante Verringerung der Gesamtrate von Infarkten und schwerwiegend beeinträchtigenden neurologischen Ergebnissen nach 3 Monaten:
An einer kanadischen Studie nahmen viel kränkere Patienten (Grade III-V von Hunt und Hess) teil, die eine hohe Rate an Todesfällen und Behinderungen aufwiesen und eine Dosis von 90 mg alle 4 Stunden verwendeten, aber ansonsten den ersten beiden Studien ähnlich waren. Die Analyse von verzögerten ischämischen Defiziten, von denen viele aus Spasmen resultieren, zeigte eine signifikante Verringerung der mit Spasmen verbundenen Defizite. Unter den analysierten Patienten (72 Nimodipin, 82 Placebo) gab es die folgenden Ergebnisse.
Als die Daten der kanadischen und der britischen Studie kombiniert wurden, betrug der Behandlungsunterschied in Bezug auf die Erfolgsrate (dh gute Genesung) auf der Glasgow Outcome Scale 25,3 % (Nimodipin) gegenüber 10,9 % (Placebo) für Grad IV oder V nach Hunt und Hess. Die folgende Tabelle zeigt, dass Nimodipin tendenziell die gute Genesung von SAH-Patienten mit schlechtem neurologischem Status nach dem Iktus verbessert, während die Zahl der Patienten mit schwerer Behinderung und das vegetative Überleben verringert werden.
Eine Dosisfindungsstudie, in der 30-, 60- und 90-mg-Dosen verglichen wurden, ergab eine allgemein niedrige Rate von krampfbedingten neurologischen Defiziten, aber keine Dosis-Wirkungs-Beziehung.
INFORMATIONEN ZUM PATIENTEN
Keine Informationen bereitgestellt. Bitte wende dich an die WARNUNGEN und VORSICHTSMASSNAHMEN Abschnitte.