Cordarone 100mg, 50mg Amiodarone Verwendung, Nebenwirkungen, Stärke und Dosierung. Preis in Online-Apotheke. Generika medikamente rezeptfrei.
Was ist Cordarone 100 mg und wie wird es angewendet?
Cordarone 100 mg i.v. ist ein verschreibungspflichtiges Arzneimittel zur Behandlung der Symptome von unregelmäßigem Herzrhythmus (ventrikuläre Arrhythmien).
Welche Nebenwirkungen kann Cordarone 100 mg haben?
Cordarone 100 mg kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Suchen Sie sofort medizinische Hilfe auf, wenn Sie eines der oben aufgeführten Symptome haben.
Die häufigsten Nebenwirkungen von Cordarone 100 mg IV sind:
Teilen Sie dem Arzt mit, wenn Sie eine Nebenwirkung haben, die Sie stört oder die nicht abklingt.
Dies sind nicht alle möglichen Nebenwirkungen von Cordarone. Für weitere Informationen fragen Sie Ihren Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
WARNUNG
LUNGEN-, LEBER- UND HERZTOXIZITÄT
CORDARONE 100 mg ist nur für die Anwendung bei Patienten mit den angegebenen lebensbedrohlichen Arrhythmien bestimmt, da seine Anwendung mit erheblicher Toxizität einhergeht [siehe INDIKATIONEN UND ANWENDUNG].
CORDARONE kann eine pulmonale Toxizität (Überempfindlichkeits-Pneumonitis oder interstitielle/alveoläre Pneumonitis) verursachen, die bei einigen Patientenserien zu einer klinisch manifesten Erkrankung mit Raten von bis zu 17 % geführt hat. Die pulmonale Toxizität war in etwa 10 % der Fälle tödlich. Lassen Sie zu Beginn der Behandlung mit CORDARONE 100 mg eine Ausgangs-Röntgenaufnahme des Brustkorbs und Lungenfunktionstests, einschließlich der Diffusionskapazität, durchführen. Wiederholen Sie die Anamnese, körperliche Untersuchung und Röntgenaufnahme des Brustkorbs alle 3 bis 6 Monate [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
CORDARONE kann eine Lebertoxizität verursachen, die tödlich sein kann. Holen Sie die Ausgangswerte und periodischen Lebertransaminasen ein und setzen Sie die Dosis ab oder reduzieren Sie sie, wenn der Anstieg das Dreifache des Normalwerts übersteigt oder sich bei einem Patienten mit erhöhtem Ausgangswert verdoppelt. Setzen Sie CORDARONE ab, wenn bei dem Patienten Anzeichen oder Symptome einer klinischen Leberschädigung auftreten [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
CORDARONE kann Arrhythmien verschlimmern. Beginnen Sie mit CORDARONE 50 mg in einer klinischen Umgebung, in der kontinuierliche Elektrokardiogramme und Herzwiederbelebung verfügbar sind [siehe WARNHINWEISE UND VORSICHTSMASSNAHMEN].
BEZEICHNUNG
CORDARONE (Amiodaron-HCl) ist ein Antiarrhythmikum, das zur oralen Verabreichung als rosafarbene Tabletten mit Bruchrille mit 200 mg Amiodaronhydrochlorid erhältlich ist. Die vorhandenen inaktiven Inhaltsstoffe sind kolloidales Siliciumdioxid, Laktose, Magnesiumstearat, Povidon, Stärke und FD&C Red 40. CORDARONE ist ein Benzofuranderivat: 2-Butyl-3-benzofuranyl 4-[2-(diethylamino)-ethoxy]- 3, 5-Diiodphenylketonhydrochlorid.
Die Strukturformel lautet wie folgt:
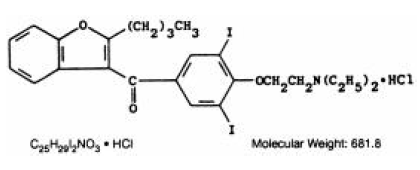
Amiodaron-HCl ist ein weißes bis cremefarbenes kristallines Pulver. Es ist leicht löslich in Wasser, löslich in Alkohol und frei löslich in Chloroform. Es enthält 37,3 Gewichtsprozent Jod.
INDIKATIONEN
CORDARONE ist indiziert zur Behandlung von dokumentiertem, lebensbedrohlichem rezidivierendem Kammerflimmern und lebensbedrohlicher rezidivierender hämodynamisch instabiler Tachykardie bei Erwachsenen, die auf adäquate Dosen anderer verfügbarer Antiarrhythmika nicht angesprochen haben oder wenn alternative Wirkstoffe nicht vertragen werden.
DOSIERUNG UND ANWENDUNG
Die Dosierung muss basierend auf der Schwere der Arrhythmie und dem Ansprechen individualisiert werden. Verwenden Sie die niedrigste wirksame Dosis. Holen Sie eine Grundlinien-Thorax-Röntgenaufnahme, Lungenfunktionstests, Schilddrüsenfunktionstests und Leber-Aminotransferasen ein. Korrigieren Sie Hypokaliämie, Hypomagnesiämie und Hypokalzämie vor Beginn der Behandlung
Empfohlene Dosierung
Beginnen Sie die Behandlung mit einer Aufsättigungsdosis von 800 bis 1600 mg/Tag, bis ein anfängliches therapeutisches Ansprechen eintritt (normalerweise 1 bis 3 Wochen). Sobald eine ausreichende Arrhythmiekontrolle erreicht ist oder wenn Nebenwirkungen auftreten, reduzieren Sie die Dosis von CORDARONE 50 mg auf 600 bis 800 mg/Tag für einen Monat und dann auf die Erhaltungsdosis, normalerweise 400 mg/Tag.
Verwaltung
CORDARONE konsequent zu den Mahlzeiten verabreichen [vgl KLINISCHE PHARMAKOLOGIE ]. Die Verabreichung von CORDARONE in geteilten Dosen zu den Mahlzeiten wird für Tagesgesamtdosen von 1000 mg oder mehr empfohlen oder wenn eine gastrointestinale Unverträglichkeit auftritt.
WIE GELIEFERT
Darreichungsformen und Stärken
200-mg-Tabletten: runde, konvexe, rosafarbene Tabletten mit einem erhabenen „C“ und der Prägung „200“ auf einer Seite, mit Bruchkerbe und der Prägung „WYETH“ und „4188“ auf der Rückseite.
Lagerung und Handhabung
CORDARONE® (Amiodaron HCl) Tabletten sind in Flaschen mit 60 Tabletten wie folgt erhältlich:
200mg , NDC 0008-4188-04, runde, konvexe, rosafarbene Tabletten mit einem erhabenen „C“ und der Prägung „200“ auf einer Seite, mit Bruchkerbe und der Prägung „WYETH“ und „4188“ auf der Rückseite.
Dicht verschlossen halten.
Bei kontrollierter Raumtemperatur von 20° bis 25°C (68° bis 77°F) lagern.
Vor Licht schützen.
In einen lichtbeständigen, dichten Behälter füllen.
Hergestellt von Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, Frankreich. Vertrieb durch: Wyeth Pharmaceuticals Inc., eine Tochtergesellschaft von Pfizer Inc., Philadelphia, PA 19101. Überarbeitet: Okt. 2018
NEBENWIRKUNGEN
Die folgenden schwerwiegenden Nebenwirkungen werden in anderen Abschnitten der Verschreibungsinformationen ausführlicher beschrieben:
Erfahrung mit klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien zu einem Medikament beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien zu einem anderen Medikament verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Bei der üblichen Erhaltungsdosis (400 mg/Tag) und darüber verursacht CORDARONE 100 mg bei etwa drei Viertel aller Patienten Nebenwirkungen, die bei 7 bis 18 % zum Absetzen führen.
In Umfragen unter fast 5.000 Patienten, die in offenen Studien in den USA behandelt wurden, und in veröffentlichten Berichten über die Behandlung mit CORDARONE waren die Nebenwirkungen, die am häufigsten ein Absetzen von CORDARONE erforderten, Lungeninfiltrate oder -fibrose, paroxysmale ventrikuläre Tachykardie, dekompensierte Herzinsuffizienz und Erhöhung der Leberenzymwerte. Andere Symptome, die seltener zu Abbrüchen führten, waren Sehstörungen, Lichtempfindlichkeit, blaue Hautverfärbung, Hyperthyreose und Hypothyreose.
Die folgenden Nebenwirkungsraten basieren auf einer retrospektiven Studie mit 241 Patienten, die 2 bis 1.515 Tage behandelt wurden (Mittelwert 441,3 Tage):
Schilddrüse
Häufig: Hypothyreose, Hyperthyreose.
Herz-Kreislauf
Häufig: Herzinsuffizienz, Herzrhythmusstörungen, SA-Knoten-Dysfunktion.
Magen-Darm
Sehr häufig: Übelkeit, Erbrechen.
Häufig: Verstopfung, Anorexie, Bauchschmerzen.
Dermatologisch
Häufig: Sonnendermatitis/Lichtempfindlichkeit.
Neurologische
Häufig: Unwohlsein und Müdigkeit, Zittern/abnorme unwillkürliche Bewegungen, Koordinationsmangel, abnormer Gang/Ataxie, Schwindel, Parästhesien, verminderte Libido, Schlaflosigkeit, Kopfschmerzen, Schlafstörungen.
Ophthalmisch
Häufig: Sehstörungen.
Leber
Häufig: Anomale Leberfunktionstests, unspezifische Lebererkrankungen.
Atmung
Häufig: Lungenentzündung oder Fibrose.
Sonstiges
Häufig: Hitzewallungen, Geschmacks- und Geruchsstörungen, Ödeme, Speichelfluss, Gerinnungsstörungen.
Gelegentlich: Blaue Hautverfärbung, Hautausschlag, spontane Ekchymose, Alopezie, Hypotonie und kardiale Erregungsleitungsstörungen.
Postmarketing-Erfahrung
Die folgenden Nebenwirkungen wurden während der Anwendung von CORDARONE nach der Zulassung festgestellt. Da diese Reaktionen freiwillig aus einer Population unbekannter Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
Hämatologisch hämolytische Anämie, aplastische Anämie, Panzytopenie, Neutropenie, Thrombozytopenie, Agranulozytose, Granulom.
Immun : anaphylaktische/anaphylaktoide Reaktion (einschließlich Schock), Angioödem.
Neurologische : Pseudotumor cerebri, Parkinson-Symptome wie Akinese und Bradykinesie (manchmal reversibel nach Absetzen der Therapie), demyelinisierende Polyneuropathie.
Psychiatrisch : Halluzination, Verwirrtheitszustand, Orientierungslosigkeit, Delirium.
Herz : Hypotonie (manchmal tödlich), Sinusstillstand.
Atmung : eosinophile Pneumonie, akutes Atemnotsyndrom in der postoperativen Umgebung, Bronchospasmus, Bronchiolitis obliterans organisierende Pneumonie, pulmonale alveoläre Blutung, Pleuraerguss, Pleuritis.
Magen-Darm : Pankreatitis, akute Pankreatitis.
Leber : Hepatitis, cholestatische Hepatitis, Zirrhose.
Erkrankungen der Haut und des Unterhautgewebes Urtikaria, toxische epidermale Nekrolyse (manchmal tödlich), Erythema multiforme, Stevens-Johnson-Syndrom, exfoliative Dermatitis, bullöse Dermatitis, Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Ekzem, Juckreiz, Hautkrebs, Lupus-ähnliches Syndrom.
Bewegungsapparat : Myopathie, Muskelschwäche, Rhabdomyolyse.
Nieren : Nierenfunktionsstörung, Niereninsuffizienz, akutes Nierenversagen.
Fortpflanzung : Nebenhodenentzündung, Impotenz.
Körper als Ganzes : Fieber, Mundtrockenheit.
Endokrin und metabolisch : Schilddrüsenknoten/Schilddrüsenkrebs, Syndrom der inadäquaten Sekretion des antidiuretischen Hormons (SIADH).
Gefäß : Vaskulitis.
WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN
Aufgrund der langen Halbwertszeit von Amiodaron ist zu erwarten, dass Arzneimittelwechselwirkungen Wochen bis Monate nach Absetzen von Amiodaron bestehen bleiben.
Arzneimittelwechselwirkungen mit Amiodaron sind in Tabelle 1 unten beschrieben.
WARNUNGEN
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Sektion.
VORSICHTSMASSNAHMEN
Persistenz von Nebenwirkungen
Aufgrund der langen Halbwertszeit von Amiodaron (15 bis 142 Tage) und seines aktiven Metaboliten Desethylamiodaron (14 bis 75 Tage) können Nebenwirkungen und Arzneimittelwechselwirkungen mehrere Wochen nach Absetzen von Amiodaron anhalten [siehe KLINISCHE PHARMAKOLOGIE ].
Lungentoxizität
CORDARONE kann ein klinisches Syndrom von Husten und fortschreitender Dyspnoe verursachen, begleitet von funktionellen, radiologischen, Gallium-Scan- und pathologischen Daten, die mit einer pulmonalen Toxizität übereinstimmen. Lungentoxizität als Folge von CORDARONE kann entweder aus indirekter oder direkter Toxizität resultieren, wie sie durch Überempfindlichkeitspneumonitis (einschließlich eosinophiler Pneumonie) bzw. interstitielle/alveoläre Pneumonitis dargestellt wird. Es wurde berichtet, dass Lungentoxizitätsraten bis zu 17 % betragen und in etwa 10 % der Fälle tödlich sind. Lassen Sie zu Beginn der Therapie mit CORDARONE 50 mg eine Ausgangs-Röntgenaufnahme des Brustkorbs und Lungenfunktionstests, einschließlich der Diffusionskapazität, durchführen. Wiederholen Sie die Anamnese, körperliche Untersuchung und Röntgenaufnahme des Brustkorbs alle 3 bis 6 Monate oder wenn Symptome auftreten. Erwägen Sie eine alternative antiarrhythmische Therapie, wenn beim Patienten Anzeichen oder Symptome einer pulmonalen Toxizität auftreten. Prednison 40–60 mg/Tag, ausgeschlichen über mehrere Wochen, kann bei der Behandlung von pulmonaler Toxizität hilfreich sein.
Atemnotsyndrom bei Erwachsenen (ARDS)
Postoperativ wurde über das Auftreten von ARDS bei Patienten berichtet, die eine CORDARONE-Therapie erhielten und sich entweder einem kardialen oder einem nicht kardialen chirurgischen Eingriff unterzogen hatten. Obwohl die Patienten in der Regel gut auf eine kräftige Atemtherapie ansprechen, war der Ausgang in seltenen Fällen tödlich.
Leberschädigung
Asymptomatische Erhöhungen der Leberenzymwerte werden häufig beobachtet, aber CORDARONE 100 mg kann lebensbedrohliche Leberschäden verursachen. Die Histologie ähnelt der einer alkoholischen Hepatitis oder Zirrhose. Erhalten Sie Basislinien- und periodische Lebertransaminasen. Wenn die Transaminasen das Dreifache des Normalwerts überschreiten oder sich bei einem Patienten mit erhöhtem Ausgangswert verdoppeln, brechen Sie die Behandlung mit CORDARONE 100 mg ab oder reduzieren Sie die Dosis, führen Sie Folgeuntersuchungen durch und behandeln Sie entsprechend.
Verschlimmerte Arrhythmie
CORDARONE 100 mg kann die vorliegende Arrhythmie bei etwa 2 bis 5 % der Patienten verschlimmern oder neues Kammerflimmern, unaufhörliche ventrikuläre Tachykardie, erhöhten Widerstand gegen Kardioversion und polymorphe ventrikuläre Tachykardie in Verbindung mit QTc-Verlängerung (Torsade de Pointes [TdP]) verursachen.
Korrigieren Sie Hypokaliämie, Hypomagnesiämie und Hypokalzämie vor Beginn der Behandlung mit CORDARONE, da diese Erkrankungen das Ausmaß der QTc-Verlängerung übertreiben und das Potenzial für TdP erhöhen können. Achten Sie besonders auf das Elektrolyt- und Säure-Basen-Gleichgewicht bei Patienten, die an schwerem oder anhaltendem Durchfall leiden oder Arzneimittel erhalten, die den Elektrolytspiegel beeinflussen, wie Diuretika, Abführmittel, systemische Kortikosteroide oder Amphotericin B.
Sehbehinderung und Sehverlust
Optikusneuropathie und Optikusneuritis
Bei mit Amiodaron behandelten Patienten wurde über Fälle von Optikusneuropathie und Optikusneuritis berichtet, die in der Regel zu einer Sehbehinderung und manchmal zu dauerhafter Erblindung führten und jederzeit während der Therapie auftreten können. Wenn Symptome einer Sehbehinderung auftreten, wie z. B. Veränderungen der Sehschärfe und Abnahme des peripheren Sehens, erwägen Sie das Absetzen von CORDARONE 100 mg und überweisen Sie umgehend zu einer augenärztlichen Untersuchung. Während der Anwendung von CORDARONE wird eine regelmäßige augenärztliche Untersuchung, einschließlich Funduskopie und Spaltlampenuntersuchung, empfohlen [siehe NEBENWIRKUNGEN ].
Mikroablagerungen auf der Hornhaut
Mikroablagerungen auf der Hornhaut treten bei der Mehrzahl der mit CORDARONE behandelten Erwachsenen auf. Sie sind in der Regel nur durch Spaltlampenuntersuchung erkennbar, führen aber bei bis zu 10 % der Patienten zu Symptomen wie Lichthöfen oder verschwommenem Sehen. Mikroablagerungen auf der Hornhaut sind nach Dosisreduktion oder Beendigung der Behandlung reversibel. Asymptomatische Mikroablagerungen allein sind kein Grund, die Dosis zu reduzieren oder die Behandlung abzubrechen [vgl NEBENWIRKUNGEN ].
Schilddrüsenanomalien
CORDARONE 50 mg hemmt die periphere Umwandlung von Thyroxin (T4) in Triiodthyronin (T3) und kann bei klinisch euthyreoten Patienten zu erhöhten Thyroxinspiegeln, erniedrigten T3-Spiegeln und erhöhten Spiegeln von inaktivem reversem T3 (rT3) führen. CORDARONE 50 mg kann entweder Hypothyreose (berichtet bei bis zu 10 % der Patienten) oder Hyperthyreose (tritt bei etwa 2 % der Patienten auf) verursachen. Überwachen Sie die Schilddrüsenfunktion vor der Behandlung und regelmäßig danach, insbesondere bei älteren Patienten und bei allen Patienten mit Schilddrüsenknoten, Kropf oder anderen Schilddrüsenfunktionsstörungen in der Vorgeschichte.
Eine Hyperthyreose kann einen Arrhythmie-Durchbruch auslösen. Wenn irgendwelche neuen Anzeichen einer Arrhythmie auftreten, sollte die Möglichkeit einer Hyperthyreose in Betracht gezogen werden. Antithyreostatika, β-adrenerge Blocker, vorübergehende Kortikosteroidtherapie können notwendig sein, um die Symptome einer Hyperthyreose zu behandeln. Die Wirkung von Thyreostatika kann bei Amiodaron-induzierter Thyreotoxikose aufgrund erheblicher Mengen vorgeformter Schilddrüsenhormone, die in der Drüse gespeichert sind, verzögert sein. Die Therapie mit radioaktivem Jod ist aufgrund der geringen Aufnahme von Radiojod im Zusammenhang mit einer Amiodaron-induzierten Hyperthyreose kontraindiziert. Auf eine CORDARONE-induzierte Hyperthyreose kann eine vorübergehende Hypothyreose folgen.
Eine Hypothyreose kann primär oder nach dem Abklingen einer vorangegangenen Amiodaron-induzierten Hyperthyreose auftreten. Im Zusammenhang mit einer Amiodaron-Therapie wurde über schwere Hypothyreose und Myxödem-Koma, manchmal mit tödlichem Ausgang, berichtet. Bei einigen mit Amiodaron behandelten Patienten mit klinischer Hypothyreose können die Indexwerte für freies Thyroxin normal sein. Behandeln Sie Hypothyreose, indem Sie die Dosis von CORDARONE und die Schilddrüsenhormon-Supplementierung reduzieren oder absetzen.
Bradykardie
CORDARONE verursacht bei 2 bis 4 % der Patienten eine symptomatische Bradykardie oder einen Sinusarrest mit Unterdrückung von Fluchtherden. Das Risiko wird durch elektrolytische Störungen oder die gleichzeitige Anwendung von Antiarrhythmika oder negativen Chronotropen erhöht [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ]. Bradykardie kann einen Herzschrittmacher zur Frequenzkontrolle erfordern.
Postmarketing-Fälle von symptomatischer Bradykardie, von denen einige das Einsetzen eines Schrittmachers erforderten, und mindestens einer mit tödlichem Ausgang, wurden berichtet, als Ledipasvir/Sofosbuvir oder Sofosbuvir mit Simeprevir bei Patienten mit Amiodaron begonnen wurden. Bradykardie trat im Allgemeinen innerhalb von Stunden bis Tagen auf, trat aber in einigen Fällen bis zu 2 Wochen nach Beginn der antiviralen Behandlung auf. Die Bradykardie klang im Allgemeinen nach Absetzen der antiviralen Behandlung ab. Der Mechanismus für diesen Effekt ist unbekannt. Überwachen Sie die Herzfrequenz bei Patienten, die Amiodaron einnehmen oder kürzlich abgesetzt haben, wenn Sie eine antivirale Behandlung beginnen [siehe WECHSELWIRKUNGEN MIT ANDEREN MEDIKAMENTEN ].
Implantierbare Herzgeräte
Bei Patienten mit implantierten Defibrillatoren oder Herzschrittmachern kann die chronische Verabreichung von Antiarrhythmika die Stimulations- oder Defibrillationsschwellen beeinflussen. Daher sollten zu Beginn und während der Behandlung mit Amiodaron die Stimulations- und Defibrillationsschwellen beurteilt werden.
Fötale Toxizität
CORDARONE kann den Fötus schädigen, wenn es einer schwangeren Frau verabreicht wird. Eine fetale Exposition kann das Potenzial für Auswirkungen auf das Herz, die Schilddrüse, die neurologische Entwicklung, das Nervensystem und das Wachstum bei Neugeborenen erhöhen [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Periphere Neuropathie
Die chronische Verabreichung von CORDARONE kann zu einer peripheren Neuropathie führen, die möglicherweise nicht abklingt, wenn CORDARONE abgesetzt wird.
Lichtempfindlichkeit und Hautverfärbung
CORDARONE induziert bei etwa 10 % der Patienten eine Photosensibilisierung; ein gewisser Schutz kann durch Sonnenschutzcremes oder Schutzkleidung geboten werden. Bei Langzeitbehandlung kann es zu einer blaugrauen Verfärbung der exponierten Haut kommen. Das Risiko kann bei Patienten mit hellem Teint oder bei Patienten mit übermäßiger Sonneneinstrahlung erhöht sein. Nach Absetzen des Arzneimittels kann es zu einer gewissen Umkehrung der Verfärbung kommen.
Chirurgie
Flüchtige Anästhetika
Patienten, die mit CORDARONE 100 mg behandelt werden, können empfindlicher auf die myokardial dämpfenden und erregungsleitenden Wirkungen von halogenierten Inhalationsanästhetika reagieren.
Informationen zur Patientenberatung
Weisen Sie den Patienten an, die von der FDA zugelassene Patientenkennzeichnung ( Leitfaden für Medikamente ).
Informieren Sie schwangere Frauen über das potenzielle Risiko für einen Fötus. Raten Sie Frauen im gebärfähigen Alter, ihren verschreibenden Arzt über eine bekannte oder vermutete Schwangerschaft zu informieren [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Weisen Sie Frauen darauf hin, dass das Stillen während der Behandlung mit CORDARONE nicht empfohlen wird [siehe Verwendung in bestimmten Bevölkerungsgruppen ].
Empfehlen Sie den Patienten, Grapefruitsaft und Johanniskraut zu vermeiden.
Weisen Sie die Patienten an, einen Arzt aufzusuchen, wenn bei ihnen Anzeichen und Symptome einer pulmonalen Toxizität, Verschlechterung der Arrhythmie, Bradykardie, Sehbehinderung oder Hypo- und Hyperthyreose auftreten.
Das Etikett dieses Produkts wurde möglicherweise aktualisiert. Vollständige Verschreibungsinformationen finden Sie unter www.pfizer.com.
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Amiodaron-HCl war mit einem statistisch signifikanten, dosisabhängigen Anstieg der Inzidenz von Schilddrüsentumoren (follikuläres Adenom und/oder Karzinom) bei Ratten verbunden. Die Inzidenz von Schilddrüsentumoren war bei der niedrigsten getesteten Dosis, dh 5 mg/kg/Tag (etwa das 0,08-fache der maximal empfohlenen Erhaltungsdosis beim Menschen*), größer als bei der Kontrolle.
Mutagenitätsstudien (Ames-, Mikronukleus- und lysogene Tests) mit CORDARONE waren negativ.
In einer Studie, in der männlichen und weiblichen Ratten Amiodaron-HCl verabreicht wurde, die 9 Wochen vor der Verpaarung begann, wurde bei einer Dosis von 90 mg/kg/Tag (ungefähr das 1,4-fache der maximal empfohlenen Erhaltungsdosis*) eine verringerte Fertilität beobachtet.
*600 mg bei einem 60 kg schweren Patienten (Dosis im Vergleich zur Körperoberfläche)
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Zusammenfassung der Risiken
Verfügbare Daten aus Postmarketing-Berichten und veröffentlichten Fallserien weisen darauf hin, dass die Anwendung von Amiodaron bei schwangeren Frauen das Risiko für fetale Nebenwirkungen erhöhen kann, einschließlich neonataler Hypo- und Hyperthyreose, neonataler Bradykardie, neurologischen Entwicklungsstörungen, Frühgeburt und fötaler Wachstumsbeschränkung. Amiodaron und sein Metabolit Desethylamiodaron (DEA) passieren die Plazenta. Unbehandelte zugrunde liegende Arrhythmien, einschließlich ventrikulärer Arrhythmien, während der Schwangerschaft stellen ein Risiko für Mutter und Fötus dar (vgl Klinische Überlegungen ). In Tierversuchen führte die Verabreichung von Amiodaron an Kaninchen, Ratten und Mäuse während der Organogenese zu embryofetaler Toxizität bei Dosen unterhalb der maximal empfohlenen Erhaltungsdosis beim Menschen (vgl Daten ). Informieren Sie schwangere Frauen über das potenzielle Risiko für einen Fötus.
Das geschätzte Hintergrundrisiko schwerer Geburtsfehler und Fehlgeburten für die angegebene Population ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Verlust oder andere unerwünschte Folgen. In der US-Allgemeinbevölkerung liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2–4 % bzw. 15–20 %.
Klinische Überlegungen
Krankheitsbedingtes mütterliches und/oder embryo-/fetales Risiko
Die Inzidenz ventrikulärer Tachykardien ist erhöht und kann während der Schwangerschaft symptomatischer sein. Ventrikuläre Arrhythmien treten am häufigsten bei schwangeren Frauen mit zugrundeliegender Kardiomyopathie, angeborener Herzerkrankung, Herzklappenerkrankung oder Mitralklappenprolaps auf. Die meisten Tachykardie-Episoden werden durch ektopische Schläge ausgelöst, und das Auftreten von Arrhythmie-Episoden kann daher während der Schwangerschaft aufgrund der erhöhten Neigung zu ektopischer Aktivität zunehmen. Durchbrucharrhythmien können auch während der Schwangerschaft auftreten, da die therapeutischen Behandlungsspiegel aufgrund des erhöhten Verteilungsvolumens und des erhöhten Arzneimittelstoffwechsels, die dem schwangeren Zustand innewohnen, möglicherweise schwierig aufrechtzuerhalten sind.
Fetale/neonatale Nebenwirkungen
Es wurde gezeigt, dass Amiodaron und sein Metabolit die Plazenta passieren. Unerwünschte Wirkungen auf den Fötus im Zusammenhang mit der Anwendung von mütterlichem Amiodaron während der Schwangerschaft können neonatale Bradykardie, QT-Verlängerung und periodische ventrikuläre Extrasystolen, neonatale Hypothyreose (mit oder ohne Struma), die vor der Geburt oder beim Neugeborenen festgestellt und sogar nach einigen Tagen der Exposition berichtet wird, neonatale Hyperthyroxinämie, neurologische Entwicklungsstörungen unabhängig von der Schilddrüsenfunktion, einschließlich Sprachverzögerung und Schwierigkeiten mit der geschriebenen Sprache und dem Rechnen, verzögerte motorische Entwicklung und Ataxie, Rucknystagmus mit synchroner Kopfneigung, fetale Wachstumsbeschränkung und Frühgeburt. Überwachen Sie das Neugeborene auf Anzeichen und Symptome einer Schilddrüsenerkrankung und Herzrhythmusstörungen.
Arbeit und Lieferung
Das Risiko von Arrhythmien kann während der Wehen und der Geburt zunehmen. Mit CORDARONE behandelte Patientinnen sollten während der Wehen und der Entbindung kontinuierlich überwacht werden [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Daten
Tierdaten
Bei trächtigen Ratten und Kaninchen während der Zeit der Organogenese hatte Amiodaron-HCl in Dosen von 25 mg/kg/Tag (etwa das 0,4- bzw. 0,9-fache der maximal empfohlenen Erhaltungsdosis*) keine nachteiligen Auswirkungen auf den Fötus. Bei Kaninchen verursachten 75 mg/kg/Tag (etwa das 2,7-fache der maximal empfohlenen Erhaltungsdosis beim Menschen*) bei mehr als 90 % der Tiere Aborte. Bei der Ratte waren Dosen von 50 mg/kg/Tag oder mehr mit einer leichten Verschiebung der Hoden und einer erhöhten Inzidenz unvollständiger Ossifikation einiger Schädel- und Zehenknochen verbunden; bei 100 mg/kg/Tag oder mehr war das fötale Körpergewicht reduziert; bei 200 mg/kg/Tag gab es eine erhöhte Inzidenz fötaler Resorption. (Diese Dosen bei Ratten entsprechen etwa dem 0,8-, 1,6- und 3,2-fachen der maximal empfohlenen Erhaltungsdosis beim Menschen*) Bei einer Dosis von 5 mg/kg/Tag wurden auch bei einem von zwei Mäusestämmen nachteilige Wirkungen auf das fötale Wachstum und Überleben festgestellt ( etwa das 0,04-fache der maximal empfohlenen Erhaltungsdosis für den Menschen*).
*600 mg bei einem 60 kg schweren Patienten (Dosen im Vergleich zur Körperoberfläche)
Stillzeit
Zusammenfassung der Risiken
Amiodaron und einer seiner Hauptmetaboliten, DEA, sind in der Muttermilch mit zwischen 3,5 % und 45 % der mütterlichen gewichtsangepassten Amiodaron-Dosierung vorhanden. Es gibt Fälle von Hypothyreose und Bradykardie bei gestillten Säuglingen, obwohl unklar ist, ob diese Wirkungen auf die Amiodaron-Exposition in der Muttermilch zurückzuführen sind. Stillen wird während der Behandlung mit CORDARONE nicht empfohlen [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Weibchen und Männchen mit reproduktivem Potenzial
Unfruchtbarkeit
Basierend auf Fertilitätsstudien an Tieren kann CORDARONE die weibliche und männliche Fertilität verringern. Es ist nicht bekannt, ob dieser Effekt reversibel ist. [sehen Nichtklinische Toxikologie ].
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von CORDARONE bei pädiatrischen Patienten wurde nicht nachgewiesen.
Geriatrische Verwendung
Normale Probanden über 65 Jahre zeigen niedrigere Clearances und eine längere Arzneimittelhalbwertszeit als jüngere Probanden [vgl KLINISCHE PHARMAKOLOGIE ]. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, um die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion und einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerzuspiegeln.
ÜBERDOSIS
Es gab Fälle, einige davon mit tödlichem Ausgang, einer Überdosierung von CORDARONE 50 mg.
Überwachen Sie den Herzrhythmus und den Blutdruck des Patienten, und wenn eine Bradykardie folgt, kann ein β-adrenerger Agonist oder ein Schrittmacher verwendet werden. Behandeln Sie Hypotonie mit unzureichender Gewebedurchblutung mit positiv inotropen und vasopressorischen Mitteln. Weder CORDARONE 50 mg noch sein Metabolit sind dialysierbar.
KONTRAINDIKATIONEN
KLINISCHE PHARMAKOLOGIE
Wirkmechanismus
Amiodaron gilt als Antiarrhythmikum der Klasse III, besitzt jedoch elektrophysiologische Eigenschaften aller vier Vaughan-Williams-Klassen. Wie Klasse-I-Medikamente blockiert Amiodaron Natriumkanäle bei schnellen Stimulationsfrequenzen, und wie Klasse-II-Medikamente übt Amiodaron eine nicht-kompetitive antisympathische Wirkung aus. Eine seiner Hauptwirkungen bei längerer Verabreichung ist die Verlängerung des Herzaktionspotentials, eine Klasse-III-Wirkung. Die negative chronotrope Wirkung von Amiodaron in Lymphknotengewebe ist ähnlich der Wirkung von Klasse-IV-Medikamenten. Zusätzlich zur Blockierung der Natriumkanäle blockiert Amiodaron die myokardialen Kaliumkanäle, was zur Verlangsamung der Erregungsleitung und Verlängerung der Refraktärzeit beiträgt. Die antisympathische Wirkung und die Blockierung von Calcium- und Kaliumkanälen sind verantwortlich für die negativen dromotropen Wirkungen auf den Sinusknoten und für die Verlangsamung der Reizleitung und Verlängerung der Refraktärzeit im atrioventrikulären (AV) Knoten. Seine gefäßerweiternde Wirkung kann die kardiale Arbeitsbelastung und folglich den myokardialen Sauerstoffverbrauch verringern.
CORDARONE verlängert die Dauer des Aktionspotentials aller Herzfasern bei minimaler Reduzierung von dV/dt (maximale Aufwärtshubgeschwindigkeit des Aktionspotentials). Die Refraktärzeit ist in allen Herzgeweben verlängert. CORDARONE erhöht die kardiale Refraktärzeit, ohne das Ruhemembranpotential zu beeinflussen, außer in automatischen Zellen, wo die Steigung des Präpotentials verringert ist, was im Allgemeinen die Automatizität verringert. Diese elektrophysiologischen Wirkungen spiegeln sich in einer verringerten Sinusrate von 15 bis 20 %, verlängerten PR- und QT-Intervallen von etwa 10 %, der Entwicklung von U-Wellen und Veränderungen der T-Wellen-Kontur wider. Diese Veränderungen sollten kein Absetzen von CORDARONE 50 mg erfordern, da sie ein Beweis für seine pharmakologische Wirkung sind, obwohl CORDARONE eine ausgeprägte Sinusbradykardie oder einen Sinusstillstand und einen Herzblock verursachen kann [siehe WARNUNGEN UND VORSICHTSMASSNAHMEN ].
Hämodynamik
In Tierversuchen und nach intravenöser Verabreichung beim Menschen entspannt CORDARONE 100 mg die glatte Gefäßmuskulatur, reduziert den peripheren Gefäßwiderstand (Nachlast) und erhöht leicht den Herzindex. Nach oraler Gabe führt CORDARONE 100 mg jedoch zu keiner signifikanten Veränderung der linksventrikulären Ejektionsfraktion (LVEF), selbst bei Patienten mit depressiver LVEF. Nach akuter intravenöser Gabe beim Menschen kann CORDARONE 100 mg eine leicht negativ inotrope Wirkung haben.
Pharmakodynamik
Es gibt keine gut etablierte Beziehung zwischen Plasmakonzentration und Wirksamkeit, aber es scheint, dass Konzentrationen weit unter 1 mg/l oft unwirksam sind und dass Konzentrationen über 2,5 mg/l im Allgemeinen nicht erforderlich sind. Plasmakonzentrationsmessungen können verwendet werden, um Patienten zu identifizieren, deren Spiegel ungewöhnlich niedrig sind und die von einer Dosiserhöhung profitieren könnten, oder ungewöhnlich hoch sind und bei denen eine Dosisreduktion in der Hoffnung auf Minimierung von Nebenwirkungen erforderlich sein könnte.
Auswirkungen auf anormale Rhythmen werden nicht vor 2 bis 3 Tagen beobachtet und benötigen normalerweise 1 bis 3 Wochen, selbst wenn eine Aufsättigungsdosis verwendet wird. Es kann noch über längere Zeiträume zu einer anhaltenden Wirkungssteigerung kommen. Es gibt Hinweise darauf, dass die Wirkungszeit kürzer ist, wenn ein Aufsättigungsdosis-Schema angewendet wird.
Entsprechend der langsamen Eliminationsrate bleiben antiarrhythmische Wirkungen Wochen oder Monate nach Absetzen von CORDARONE 50 mg bestehen, aber der Zeitpunkt des Wiederauftretens ist variabel und unvorhersehbar. Wenn das Medikament nach dem Wiederauftreten der Arrhythmie wieder aufgenommen wird, stellt sich die Kontrolle im Allgemeinen im Vergleich zur anfänglichen Reaktion relativ schnell ein, vermutlich weil die Gewebevorräte nicht vollständig erschöpft waren.
Pharmakokinetik
Absorption
Nach oraler Verabreichung beim Menschen wird CORDARONE langsam und unterschiedlich resorbiert. Die Bioverfügbarkeit von CORDARONE beträgt etwa 50 %. Maximale Plasmakonzentrationen werden 3 bis 7 Stunden nach einer Einzeldosis erreicht. Die Plasmakonzentrationen bei einer chronischen Dosierung von 100 bis 600 mg/Tag sind ungefähr dosisproportional, mit einem mittleren Anstieg von 0,5 mg/l pro 100 mg/Tag. Diese Mittel beinhalten jedoch eine beträchtliche individuelle Variabilität.
Nahrung erhöht die Geschwindigkeit und das Ausmaß der Absorption von CORDARONE. Die Auswirkungen von Nahrungsmitteln auf die Bioverfügbarkeit von CORDARONE wurden an 30 gesunden Probanden untersucht, die unmittelbar nach dem Verzehr einer fettreichen Mahlzeit und nach nächtlichem Fasten eine Einzeldosis von 600 mg erhielten. Die Fläche unter der Plasmakonzentrations-Zeit-Kurve (AUC) und die maximale Plasmakonzentration (Cmax) von Amiodaron stiegen in Gegenwart von Nahrung um das 2,3-fache (Bereich 1,7 bis 3,6) bzw. 3,8-fache (Bereich 2,7 bis 4,4). Nahrung erhöhte auch die Resorptionsrate von Amiodaron und verringerte die Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) um 37 %. Die mittlere AUC und mittlere Cmax des Hauptmetaboliten von Amiodaron, DEA, erhöhten sich um 55 % (Bereich 58 bis 101 %) bzw. 32 % (Bereich 4 bis 84 %), aber es gab keine Veränderung der Tmax in Gegenwart von Lebensmittel.
Verteilung
CORDARONE ist stark proteingebunden (ca. 96 %). CORDARONE hat ein sehr großes, aber variables Verteilungsvolumen, im Durchschnitt etwa 60 l/kg, aufgrund einer ausgedehnten Anreicherung an verschiedenen Stellen, insbesondere im Fettgewebe und in stark durchbluteten Organen wie Leber, Lunge und Milz.
Ein Hauptmetabolit von CORDARONE 50 mg, DEA, wurde beim Menschen identifiziert; es reichert sich in noch stärkerem Maße in fast allen Geweben an. Es liegen keine Daten zur Aktivität von DEA beim Menschen vor, aber bei Tieren hat es signifikante elektrophysiologische und antiarrhythmische Wirkungen, die im Allgemeinen denen von Amiodaron selbst ähneln. Die genaue Rolle und der Beitrag von DEA zur antiarrhythmischen Aktivität von oralem Amiodaron sind nicht sicher. Die Entwicklung maximaler ventrikulärer Klasse-III-Effekte nach oraler CORDARONE 100 mg-Gabe beim Menschen korreliert enger mit der DEA-Akkumulation über die Zeit als mit der Amiodaron-Akkumulation.
Beseitigung
Nach Verabreichung einer Einzeldosis an 12 gesunde Probanden zeigte CORDARONE eine Multikompartiment-Pharmakokinetik mit einer mittleren scheinbaren terminalen Plasma-Eliminationshalbwertszeit von 58 Tagen (Bereich 15 bis 142 Tage) für Amiodaron und 36 Tagen (Bereich 14 bis 75 Tage) für den Wirkstoff Metabolit (DEA). Bei Patienten hat sich gezeigt, dass CORDARONE 100 mg nach Absetzen einer chronischen oralen Therapie eine biphasische Elimination mit einer anfänglichen 50 %igen Verringerung der Plasmaspiegel nach 2,5 bis 10 Tagen aufweist. Eine viel langsamere terminale Plasmaeliminationsphase zeigt eine Halbwertszeit der Muttersubstanz im Bereich von 26 bis 107 Tagen, mit einem Mittelwert von etwa 53 Tagen und den meisten Patienten im Bereich von 40 bis 55 Tagen. Ohne eine Aufsättigungsphase würden Steady-State-Plasmakonzentrationen bei konstanter oraler Dosierung daher zwischen 130 und 535 Tagen erreicht werden, mit einem Durchschnitt von 265 Tagen. Für den Metaboliten betrug die mittlere Plasmaeliminationshalbwertszeit etwa 61 Tage. Diese Daten spiegeln wahrscheinlich eine anfängliche Elimination des Arzneimittels aus gut durchblutetem Gewebe (die 2,5- bis 10-tägige Halbwertszeitphase) wider, gefolgt von einer Endphase, die eine extrem langsame Elimination aus schlecht durchbluteten Gewebekompartimenten wie Fett darstellt.
Die beträchtliche interindividuelle Variation in beiden Eliminationsphasen sowie die Ungewissheit darüber, welches Kompartiment für die Arzneimittelwirkung entscheidend ist, erfordert Aufmerksamkeit für individuelle Reaktionen, sobald die Arrhythmiekontrolle mit Initialdosen erreicht ist, da die korrekte Erhaltungsdosis teilweise bestimmt wird, durch die Eliminationsraten. Individualisieren Sie die Erhaltungsdosen von CORDARONE [siehe DOSIERUNG UND ANWENDUNG ].
Stoffwechsel
Amiodaron wird durch die Enzymgruppe Cytochrom P450 (CYP), insbesondere CYP3A und CYP2C8, zu DEA metabolisiert. Das CYP3A-Isoenzym ist sowohl in der Leber als auch im Darm vorhanden. In vitro zeigen Amiodaron und DEA ein Potenzial zur Hemmung von CYP2C9, CYP2C19, CYP2D6, CYP3A, CYP2A6, CYP2B6 und CYP2C8. Amiodaron und DEA haben auch das Potenzial, einige Transporter wie P-Glykoprotein und Transporter für organische Kationen (OCT2) zu hemmen.
Ausscheidung
Amiodaron wird hauptsächlich durch Leberstoffwechsel und biliäre Ausscheidung eliminiert, und es gibt eine vernachlässigbare Ausscheidung von Amiodaron oder DEA im Urin. Weder Amiodaron noch DEA sind dialysierbar.
Spezifische Populationen
Wirkung des Alters
Normale Probanden über 65 Jahre zeigen niedrigere Clearance (etwa 100 ml/h/kg) als jüngere Probanden (etwa 150 ml/h/kg) und einen Anstieg von t½ von etwa 20 auf 47 Tage.
Nierenfunktionsstörung
Eine eingeschränkte Nierenfunktion hat keinen Einfluss auf die Pharmakokinetik von Amiodaron oder DEA.
Leberfunktionsstörung
Nach einer Einzeldosis von intravenösem Amiodaron bei Zirrhosepatienten werden signifikant niedrigere Cmax- und durchschnittliche Konzentrationswerte für DEA beobachtet, aber die mittleren Amiodaronspiegel sind unverändert.
Herzerkrankung
Bei Patienten mit schwerer linksventrikulärer Dysfunktion ist die Pharmakokinetik von Amiodaron nicht signifikant verändert, aber die terminale Eliminations-t½ von DEA ist verlängert.
Obwohl keine Dosisanpassung für Patienten mit Nieren-, Leber- oder Herzanomalien während der chronischen Behandlung mit oralem Amiodaron definiert wurde, ist eine engmaschige klinische Überwachung bei älteren Patienten und Patienten mit schwerer linksventrikulärer Dysfunktion ratsam.
Wechselwirkungen mit anderen Medikamenten
Auswirkungen anderer Wirkstoffe auf Amiodaron
Grapefruitsaft: Gesunden Probanden verabreichter Grapefruitsaft erhöhte die AUC von Amiodaron um 50 % und die Cmax um 84 % und senkte die DEA auf nicht quantifizierbare Konzentrationen.
Cimetidin hemmt CYP3A und kann den Amiodaronspiegel im Serum erhöhen.
Cholestyramin reduziert den enterohepatischen Kreislauf von Amiodaron und erhöht dadurch seine Elimination. Dies führt zu verringerten Serumspiegeln und Halbwertszeiten von Amiodaron.
Auswirkungen von Amiodaron auf Wirkstoffe
CYP3A-Substrate
Die gleichzeitige Einnahme von Amiodaron mit Chinidin erhöht die Chinidin-Serumkonzentration nach zwei Tagen um 33 %. Die gleichzeitige Einnahme von Amiodaron mit Procainamid für weniger als sieben Tage erhöht die Plasmakonzentrationen von Procainamid und N-Acetylprocainamid um 55 % bzw. 33 %.
Loratadin, ein nicht sedierendes Antihistaminikum, wird hauptsächlich durch CYP3A metabolisiert und sein Metabolismus kann durch Amiodaron gehemmt werden.
Der Metabolismus von Lidocain kann durch Amiodaron gehemmt werden.
Cyclophosphamid ist ein Prodrug, das durch CYP450 einschließlich CYP3A zu einem aktiven Metaboliten metabolisiert wird. Der Metabolismus von Cyclophosphamid kann durch Amiodaron gehemmt werden.
Clopidogrel, ein inaktives Thienopyridin-Prodrug, wird in der Leber durch CYP3A zu einem aktiven Metaboliten metabolisiert. Es wurde über eine mögliche Wechselwirkung zwischen Clopidogrel und Amiodaron berichtet, die zu einer unwirksamen Hemmung der Thrombozytenaggregation führt.
Makrolid/Ketolid-Antibiotika
Amiodaron kann den Metabolismus von Makrolid-/Ketolid-Antibiotika (außer Azithromycin) und systemischen Azol-Antimykotika hemmen.
P-Glycoprotein-Substrate
Amiodaron, das gleichzeitig mit Digoxin eingenommen wird, erhöht die Digoxinkonzentration im Serum nach einem Tag um 70 %.
Dabigatranetexilat kann bei gleichzeitiger Einnahme mit oralem Amiodaron zu einer erhöhten Serumkonzentration von Dabigatran führen.
Dextromethorphan ist ein Substrat sowohl für CYP2D6 als auch für CYP3A. Amiodaron hemmt CYP2D6. Eine chronische (> 2 Wochen) orale Amiodaron-Gabe beeinträchtigt den Metabolismus von Dextromethorphan und kann zu erhöhten Serumkonzentrationen führen.
INFORMATIONEN ZUM PATIENTEN
CORDARONE® (KOR-DU-RON) (Amiodaron) Tabletten
Was sind die wichtigsten Informationen, die ich über CORDARONE 50 mg wissen sollte?
CORDARONE kann schwerwiegende Nebenwirkungen verursachen, die zum Tod führen können, einschließlich:
Rufen Sie Ihren Arzt an oder holen Sie sich sofort medizinische Hilfe, wenn Sie während der Behandlung mit CORDARONE eines der folgenden Symptome haben:
Die Behandlung mit CORDARONE sollte in einem Krankenhaus begonnen werden, damit Ihr Gesundheitszustand sorgfältig überwacht werden kann.
CORDARONE sollte nur zur Behandlung von Personen angewendet werden, bei denen lebensbedrohliche Herzrhythmusstörungen, sogenannte ventrikuläre Arrhythmien, diagnostiziert wurden, wenn andere Behandlungen nicht gewirkt haben oder Sie diese nicht vertragen.
CORDARONE 50 mg kann andere schwerwiegende Nebenwirkungen hervorrufen. Siehe „Was sind die möglichen Nebenwirkungen von CORDARONE 100 mg?“ Wenn Sie während der Behandlung schwerwiegende Nebenwirkungen bekommen, müssen Sie CORDARONE möglicherweise absetzen, Ihre Dosis ändern oder sich medizinisch behandeln lassen. Sprechen Sie mit Ihrem Arzt, bevor Sie die Einnahme von CORDARONE beenden.
Sie können nach dem Absetzen von CORDARONE immer noch Nebenwirkungen haben, da das Arzneimittel noch Monate nach Beendigung der Behandlung in Ihrem Körper verbleibt.
Sie sollten vor und während der Behandlung mit CORDARONE 100 mg regelmäßige Kontrolluntersuchungen, Blutuntersuchungen und Röntgenaufnahmen des Brustkorbs durchführen lassen, um auf schwerwiegende Nebenwirkungen zu prüfen. Vor Beginn der Behandlung mit CORDARONE sollten Sie auch Lungenfunktionstests durchführen lassen.
Was ist CORDARONE?
CORDARONE ist ein verschreibungspflichtiges Arzneimittel zur Behandlung von Patienten, bei denen lebensbedrohliche Herzrhythmusstörungen, sogenannte ventrikuläre Arrhythmien, diagnostiziert wurden, wenn andere Behandlungen nicht gewirkt haben oder Sie diese nicht vertragen. Es ist nicht bekannt, ob CORDARONE bei Kindern sicher und wirksam ist.
Wer sollte CORDARONE 100mg nicht einnehmen?
Nehmen Sie Cordarone 100 mg nicht ein, wenn Sie:
Informieren Sie vor der Einnahme von CORDARONE 100 mg Ihren Arzt über alle Ihre Erkrankungen, auch wenn Sie:
Informieren Sie Ihren Arzt über alle Arzneimittel, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Arzneimittel, Vitamine und pflanzlicher Nahrungsergänzungsmittel. CORDARONE 50 mg und bestimmte andere Arzneimittel können sich gegenseitig beeinflussen und schwerwiegende Nebenwirkungen hervorrufen. Sie können Ihren Apotheker nach einer Liste von Arzneimitteln fragen, die mit CORDARONE interagieren.
Wie sollte ich CORDARONE einnehmen?
Was sollte ich während der Einnahme von CORDARONE vermeiden?
Welche Nebenwirkungen kann CORDARONE haben?
CORADARON kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
Zu den häufigsten Nebenwirkungen von CORDARONE gehören:
CORDARONE 50 mg kann die Fruchtbarkeit bei Männern und Frauen beeinträchtigen. Es ist nicht bekannt, ob die Wirkungen reversibel sind. Sprechen Sie mit Ihrem Arzt, wenn Sie Bedenken hinsichtlich der Fruchtbarkeit haben.
Dies sind nicht alle möglichen Nebenwirkungen von CORDARONE. Weitere Informationen erhalten Sie von Ihrem Arzt oder Apotheker.
Rufen Sie Ihren Arzt für medizinischen Rat zu Nebenwirkungen an. Sie können Nebenwirkungen der FDA unter 1-800-FDA-1088 melden.
Wie ist CORDARONE aufzubewahren?
Bewahren Sie CORDARONE 50 mg und alle Arzneimittel außerhalb der Reichweite von Kindern auf.
Allgemeine Informationen zur sicheren und wirksamen Anwendung von CORDARONE
Medikamente werden manchmal für andere als die in einem Medikationsleitfaden aufgeführten Zwecke verschrieben. Verwenden Sie CORDARONE nicht für einen Zustand, für den es nicht verschrieben wurde. Geben Sie CORDARONE nicht an andere Personen weiter, selbst wenn diese die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Apotheker oder Gesundheitsdienstleister nach Informationen über CORDARONE fragen, die für medizinisches Fachpersonal geschrieben sind.
Welche Inhaltsstoffe enthält CORDARONE 100mg?
Wirkstoff: Amiodaron HCl
Inaktive Zutaten: kolloidales Siliciumdioxid, Lactose, Magnesiumstearat, Povidon, Stärke und FD&C Red 40.
Dieser Medikationsleitfaden wurde von der US Food and Drug Administration genehmigt.